扩展功能
文章信息
- 郭玉华, 舒雪纯, 张影波, 官玲亮, 于福来, 元超
- GUO Yu-Hua, SHU Xue-Chun, ZHANG Ying-Bo, GUAN Ling-Liang, YU Fu-Lai, YUAN Chao
- 基于超高效液相色谱-电喷雾-质谱、天然产物词典和活性筛选的艾纳香内生真菌次生代谢产物
- Screening of bioactive secondary metabolites of endophytes associated with Blumea balsamifera (L.) DC. by UPLC-QTof-MS, DNP and bio-assay
- 微生物学通报, 2020, 47(2): 552-561
- Microbiology China, 2020, 47(2): 552-561
- DOI: 10.13344/j.microbiol.china.190493
-
文章历史
- 收稿日期: 2019-06-11
- 接受日期: 2019-10-09
- 网络首发日期: 2019-11-06
2. 中国热带农业科学院海口试验站 海南 海口 570102;
3. 海南大学林学院 海南 海口 570228
2. Haikou Experimental Station, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 570102, China;
3. College of Forestry, Hainan University, Haikou, Hainan 570228, China
天然产物仍然是新药发现的重要源泉,1980-2010年间,天然产物及其衍生物占到新研发抗菌药物的74%和抗肿瘤药物的59%[1]。已报道的自然界中的化合物达到24.6万种,且仍以每年4 000种的速度增长[2],这导致出现了一个不可回避的关键问题:重复分离(reisolation)。重复分离导致大量时间和经费的浪费,因此,科学家们做了很多尝试“去重复”(dereplication),并取得较好效果。如,El-Elimat等[3]2013年结合活性筛选、超高效液相色谱-高分辨质谱(ultra performance liquid chromatography-high resolution mass spectrum,UPLC-HRMS)、MS、UV,以及ACD/Intellixtract Analysis自建数据库可排除50%以上重复研究的真菌次生代谢产物,大大节约了研究成本。Krug等[4]2008年在研究粘细菌过程中采用超高效液相色谱-高分辨电喷雾质谱(UPLC-high resolution electrospray ionization mass spectroscopy,UPLC- HRESIMS)结合主成分分析(principal component analysis,PCA)的方法从粘细菌Myxococcus stipitatus中发现了一种目前数据库中无记载的已知生物碱类化合物Phenalamide A。Laatsch[5] 2008年构建的Antibase数据库涵盖了95%以上已报道的天然产物质谱信息,可为基于UPLC-MS的去重复发现新化合物提供强有力支撑。Nielsen等[6] 2011年对719种微生物天然产物分别在正负离子模式下的各种加和峰进行了分析,发现正离子模式可以离子化其中93%的化合物,其中56.1%的化合物可通过各级离子特征信息进行确证。Floros等[7] 2016年采用分子网络(molecular networking)方法从来自1 000多种海洋微生物的4 000多份提取物样品中筛选出来自同一菌株的两个未报道的化合物Maridric acids A、B。目前全球抗生素耐药性导致每年死亡人数达70万,如不采取有效行动,预计2050年这一数字将上升至1 000万[8]。1981-2014年全球范围内共有112个小分子化合物被批准为新的抗生素,其中包括11个未经结构修饰的微生物天然产物(9.8%)和71个微生物天然产物衍生物(63.4%)[9],显然微生物天然产物在新型抗生素的研发中起着重要作用。
艾纳香[B. balsamifera (L.) DC.]又名大风艾、冰片艾,为菊科艾纳香属植物,始载于公元741年(唐开元二十九年)陈藏器编著的《本草拾遗》[10],作为传统黎药可用于妇女产后沐浴,以防止妇科疾病的发生[11],现代药理研究显示艾纳香提取物具有很好的抗菌活性[12]。为了从传统抗菌药用植物内生真菌中快速寻找到新型抗菌先导化合物,我们对特色黎药植物艾纳香的内生真菌进行了分离和鉴定,并对内生真菌发酵产物进行抗细菌活性筛选、DNP数据库检索及UPLC-MS分析,以期寻找活性次生代谢产物。
1 材料与方法 1.1 材料 1.1.1 供试植物和菌株艾纳香[B. balsamifera (L.) DC.] 2018年12月份采自农业农村部儋州热带药用植物种质资源圃,经中国热带农业科学院热带作物品种资源研究所王祝年研究员鉴定为艾纳香本品。
供试细菌菌株:大肠埃希菌(Escherichia coli ATCC 25922)、金黄色葡萄球菌(Staphylococcus aureus ATCC 6538)、枯草芽孢杆菌(Bacillus subtilis ATCC 9372)和铜绿假单胞菌(Pseudomonas aeruginosa ATCC 27853)均由青岛大学药学院李刚老师惠赠。
1.1.2 培养基自制水琼脂培养基(g/L):琼脂15.0,链霉素0.1;自制PDA培养基(g/L):马铃薯200.0,葡萄糖20.0,琼脂15.0;大米培养基(g/L):大米60.0;MHB (Mueller-Hinton agar)培养基和LB培养基购自青岛海博生物科技有限公司。
1.1.3 主要试剂和仪器乙酸乙酯、二氯甲烷、甲醇、乙醇,天津市富宇精细化工有限公司。数控超声波清洗器,昆山市超声仪器有限公司;超高效液相飞行时间高分辨质谱联用系统,Waters公司;旋转蒸发仪,BUCHI公司。
1.2 方法 1.2.1 植物内生真菌分离方法艾纳香内生真菌的分离采用水琼脂法[13],将采集的新鲜叶片用水龙头冲洗表面尘土,超净台上用70%乙醇灭菌1 min,然后放入1.3 mol/L的次氯酸钠溶液中3 min,最后用70%乙醇浸泡30 min,无菌水冲洗干净,切成1 cm2左右方块,贴在添加有抗生素的自制水琼脂平板培养基中,2周后挑出叶片边缘长出的菌丝接种到PDA培养基。
1.2.2 菌株的分子鉴定培养1周左右的菌株经液氮研磨后采用CTAB法[14]提取基因组DNA作为模板,PCR扩增ITS-rDNA片段,所用引物为ITS1 (5′-TCCGTAG GTGAACCTGCGG-3′)和ITS4 (5′-TCCTCCGCTTA TTGATATGC-3′)。PCR反应体系(30 μL):DNA模板1 µL,ITS1和ITS4引物(10 μmol/L)各3 µL,dNTPs (2.5 mmol/L) 2 µL,10×Buffer 3 µL,Taq酶(5 U/μL) 0.2 µL,ddH2O 17.8 µL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 10 min,12 ℃保存。将PCR产物送武汉华大基因公司进行ITS-rDNA测序。测序结果返回后,首先使用MEGA X[15]软件去除重复测序序列和杂合序列,将均匀整齐的序列提交至真菌分子鉴定数据库UNITE (https://unite.ut.ee),以E值≤E-10和Bits-score≥1 000为鉴定指标确定真菌的种属地位[16]。
1.2.3 次生代谢产物提取物的制备将菌株接种于PDA平板培养基上,25 ℃培养10 d。无菌条件下将带菌培养基切块,接种于制备好的大米培养基中,共30瓶,室温下静置培养40 d后,加入乙酸乙酯终止发酵,40 kHz超声提取3次,每次30 min,合并滤液,减压浓缩至干,获得粗提物。
1.2.4 单体化合物的分离将目标菌株的发酵提取物用甲醇溶解,经硅胶柱层析,采用二氯甲烷/甲醇梯度洗脱(100/0,99/1,…,0/100,体积比),依次获得7个馏分:Fr1 (100/0),Fr2 (99/1),Fr3 (98/2),Fr4 (95/5),Fr5 (90/10),Fr6 (50/50),Fr7 (0/100),其中Fr2部分静置后析出大量方形结晶,进一步用砂芯抽滤装置滤出后得单体化合物。
1.2.5 液质联用分析条件液相条件:采用Waters ACQUITY UPLC系统配置二元泵系统和自动进样器模块。色谱柱:BEH C18色谱柱(100 mm×2.1 mm,i.d, 1.7 μm);流动相:A:水(含0.1%甲酸),B:乙腈(含0.1%甲酸);柱温:45 ℃;样品室温度:4 ℃;流速:0.45 mL/min;进样体积:5 μL;流动相流动梯度见表 1。
| No. | Duration (min) | A (%) | B (%) | Curve |
| 1 | 0.0 | 99.0 | 1.0 | |
| 2 | 4.0 | 90.0 | 10.0 | 6 |
| 3 | 6.0 | 88.0 | 12.0 | 6 |
| 4 | 11.0 | 80.0 | 20.0 | 6 |
| 5 | 13.0 | 65.0 | 35.0 | 6 |
| 6 | 17.0 | 55.0 | 45.0 | 6 |
| 7 | 20.0 | 0.0 | 100.0 | 6 |
| 8 | 24.0 | 0.0 | 100.0 | 6 |
| 10 | 27.0 | 99.0 | 1.0 | 1 |
质谱条件:Waters SYNAPT G2 HDMS系统,氮气作为质谱离子源的雾化、锥孔气;电喷雾电离正离子模式;毛细管电压:3.0 kV;锥孔电压:40 V;萃取锥孔电压:3 V;离子源温度:100 ℃;脱溶剂气温度:450 ℃;反向锥孔气流:50 L/h;脱溶剂气流速:800 L/h;碰撞气流速:0.5 mL/min;扫描时间:0.5 s;扫描时间间隔:0.02 s;质荷比范围:50-1 200 m/z;数据采集形式:Centroid;灵敏性:Normal;动态范围:Extended;锁定质量数:m/z 556.277 1。
1.2.6 提取物抗细菌活性筛选粗提物的抗细菌实验采用滤纸片法[17],将供试细菌分别用LB培养基37 ℃振荡培养过夜,转速90 r/min,取200 µL加入到无菌MHA平板培养基上,获得带菌培养基。将待测提取物分别用甲醇配置成2 µg/µL的浓度,各取20 µL滴加到直径6 mm的无菌滤纸片上,挥发干溶剂,平贴到带菌平板培养基上,37 ℃培养24 h,测量抑菌圈直径,链霉素(1 µg/片)为阳性对照,所有实验重复3次。
1.2.7 单体化合物的抗菌活性评价单体化合物的抗菌活性实验采用96孔板倍比稀释法[18]。分别将供试细菌接种到LB培养基中37 ℃振荡过夜。经血细胞计数板调整菌悬液浓度约1×108 CFU/mL,用MHB培养基稀释100倍至106 CFU/mL作为供试菌悬液。测定时除了第一个孔加入菌悬液体积为200 µL外,其余每孔均为100 µL,用DMSO溶解各供试样品,采用倍比稀释法依次加入各孔,保证各孔DMSO均低于5 µL,最终样品浓度范围为128-8 µg/mL,置37 ℃恒温培养箱中培养24 h,酶标仪读取吸光度值,计算最低抑菌浓度(minimum inhibitory concentration,MIC),链霉素为阳性对照,5 µL的DMSO加入到100 µL菌液中为阴性对照,所有实验重复3次。
2 结果与分析 2.1 菌株鉴定经ITS序列测定和UNITE真菌分子鉴定数据库比对,鉴定11株植物内生真菌为:Alternaria alternate,Phomopsis sp.,Colletotrichum gloeosporioides,Corynespora cassiicola,Diaporthe sp.,Hypoxylon investiens,Hypoxylon monticulosum,Cladosporium iridis,Muscodor sp.,Daldinia sp.,Colletotrichum cliviae。
2.2 粗提物的抗菌活性11株艾纳香植物内生真菌的发酵产物对4种细菌的抑制活性结果显示,内生真菌Diaporthe sp.和Phomopsis sp.的发酵产物对金黄色葡萄球菌、枯草芽孢杆菌和铜绿假单胞菌具有较好的抑制活性,尤其是Diaporthe sp.发酵产物抑菌活性最强,然而所有内生真菌发酵产物对大肠埃希菌活性均无抑制作用(表 2)。
| 内生真菌 Endophytic fungi |
供试细菌Four bacteria | |||
| S. aureus | B. subtilis | P. aeruginosa | E. coli | |
| Alternaria alternate | - | - | - | - |
| Phomopsis sp. | 10.0 | 7.0 | 9.0 | - |
| Colletotrichum gloeosporioides | 9.0 | - | 7.0 | - |
| Corynespora cassiicola | 10.0 | - | 7.0 | - |
| Diaporthe sp. | 12.0 | 10.5 | 11.0 | - |
| Hypoxylon investiens | - | - | - | - |
| Hypoxylon monticulosum | 9.0 | - | 7.5 | - |
| Cladosporium iridis | 8.5 | - | - | - |
| Muscodor sp. | - | - | - | - |
| Daldinia sp. | 7.0 | - | - | - |
| Colletotrichum cliviae | - | - | - | - |
| 阳性对照药(链霉素) Positive control (streptomycin) |
14.0 | 12.0 | 14.0 | 14.0 |
| 注:-:无抑菌活性.提取物浓度:40 µg/片;阳性药:1 µg/片. Note: -: No inhibitory effects against bacteria. Dose of extract: 40 µg/disc; Positive control: 1 µg/disc. |
||||
对两株活性较强的内生真菌进行DNP光盘数据库检索,发现共报道Phomopsis sp.次生代谢产物289个,Diaporthe sp. 57种次生代谢产物结构。进一步的分析显示,两个菌株存在共有的次生代谢产物化学结构类型主要为Dicerandrol聚酮类化合物以及细胞松弛素类结构(图 1),且该两类化合物结构新颖、活性广泛[19-20]。
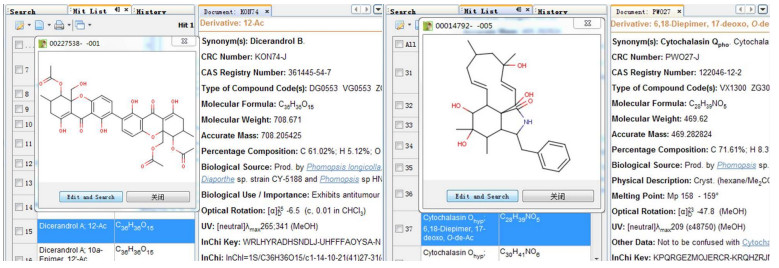
|
| 图 1 菌株Diaporthe sp.和Phomopsis sp.在DNP数据库中检索到的结构信息 Figure 1 Structural information of Diaporthe sp. and Phomopsis sp. screened in DNP database |
|
|
为进一步比较两株菌的差异,选出目标菌株进行化学成分研究,对两株菌发酵产物分别进行了UPLC-QTof-MS分析,通过对其总离子流图比较发现,整体相似度较大,如在tR为5.76 min左右均出现m/z为434.270 6的离子峰,在tR为7.12 min左右均出现m/z为416.259 8的离子峰,同时在tR为9.88、10.86、12.17 min三处均出现相同离子峰,其m/z分别为667.202 5、709.211 4、659.438 7 (图 2)。
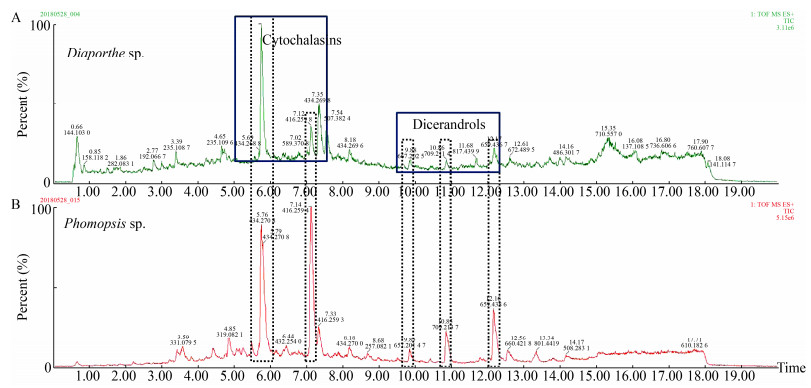
|
| 图 2 菌株Diaporthe sp. (A)和Phomopsis sp. (B)的UPLC-QTof-MS总离子流图 Figure 2 Base peak ion (BPI) chromatogram of extracts of Diaporthe sp. (A) and Phomopsis sp. (B) in positive ion mode by UPLC-QTof-MS 注:虚线框:可能的共有成分;实线框:推测的两种结构类型化合物. Note: Dotted line: Possible same ingredient; Full line: Putative two skeletons. |
|
|
进一步分析发现,Diaporthe sp.成分较为丰富,共出现7个明显的离子峰,通过对其中6个峰的质谱图分析(图 3),结合之前DNP数据库的分析以及氮素规则,发现Diaporthe sp.的ESI+总离子流图中的前3个峰的m/z (434.271 6,416.259 8,434.269 8)均为偶数,推测其可能为含一个氮原子的细胞松弛素类化合物,后面的3处共有峰(tR:9.88、10.86、12.17 min) m/z均为奇数,推测其可能为Dicerandrol类结构。基于此,决定对Diaporthe sp.的次级代谢产物进行进一步研究。
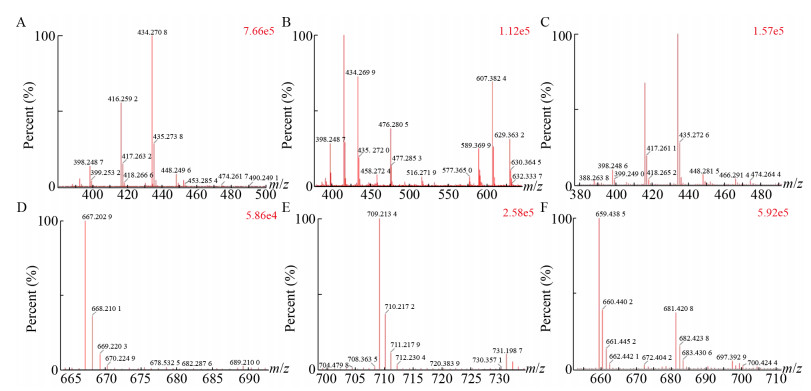
|
| 图 3 两种结构类型化合物的MS图 Figure 3 MS fragmentation of two distinctive structures 注:A-C表示3个不同质荷比的Cytochlasins (A:434.271 6;B:416.259 8;C:434.269 8)的MS图;D-F表示3个不同质荷比的Dicerandrols (D:667.202 9;E:709.213 4;F:659.438 5)的MS图. Note: A-C represent MS spectra of three Cytochlasins with different m/z (A: 434.271 6; B: 416.259 8; C: 434.269 8); D-F represent MS spectra of three Dicerandrols with different m/z (D: 667.202 9; E: 709.213 4; F: 659.438 5). |
|
|
通过对获得的单体化合物UPLC-QTof-MS与Diaporthe sp.粗提物的图谱比对,显示该化合物为粗提物中的第2个峰(tR=7.12 min),进一步的单晶衍射获得该化合物绝对构型,显示其为一种细胞松弛素类化合物。同时,通过对单体化合物的质谱裂解途径进行推测,其裂解规律与其单晶衍射结构完全相符,最终确定化合物的结构为Cytochalasin H (图 4、5)。
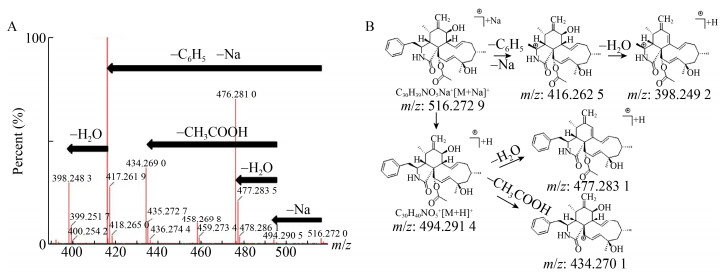
|
| 图 4 正离子模式下Cytochalasin H的MS图(A)和推测的Cytochalasin H裂解途径(B) Figure 4 Positive MS spectrum of Cytochalasin H (A) and putative fragmentation pathway of Cytochalasin H (B) |
|
|

|
| 图 5 Cytochalasin H (A)与Diaporthe sp. (B)的总离子流图和Cytochalasin H化学结构(C)及Cytochalasin H单晶衍射(D) Figure 5 BPI chromatogram of Cytochalasin H (A) and Diaporthe sp. (B), chemical structure of Cytochalasin H (C), and single-crystal X-ray diffraction of Cytochalasin H (D) |
|
|
抗菌活性结果显示,该化合物对枯草芽孢杆菌表现较好的抑制活性,MIC为32 µg/mL。对金黄色葡萄球菌和铜绿假单胞菌表现较弱抑制活性,MIC为64 µg/mL,对大肠埃希菌无抑制活性(MIC>128 µg/mL),链霉素为阳性对照(MIC为1-5 µg/mL)。
3 讨论与结论自弗莱明最早发现青霉素[21]以来,20世纪40-80年代是抗生素发现的黄金时期,一系列不同结构类型抗生素被发现和应用于临床,如β-内酰胺类、氨基糖苷类、四环素类和大环内酯类等[22]。然而,随着人们获取环境微生物手段的不断更新,新发现抗生素的进度反而缓慢。据统计,20世纪90年代以后,只有3种新型抗生素被发现[23],最主要的原因是已知化合物的大量重复分离,导致人力和研究经费的浪费。尽管很多科研人员在去重复方面做了大量探索,然而各种方法大多具有一定适用范围,如UPLC-MS-PCA通常适用于同属或同种但不同采集地的菌株代谢产物差异性分析,且仅适用于少量样本分析。UPLC-MS结合Antibase数据库,需要有较强的质谱裂解原理做基础以及对数据库的依赖,而很多数据库都是收费的,有的专用数据库是自建的,仅限本实验室使用,且数据库样本需要长期积累[24]。UPLC-MS结合分子网络是近几年发展起来的一种比较好的快速去重复技术[25],2019年以来,已有多篇基于该技术的天然产物化学方面的文章发表在American Chemical Society (ACS)相关杂志上[26-28],其在大样本数量(>1 000)的样品分析中具有很好的优势,主要是根据化合物质谱碎片信息进行结构聚类,可快速找到已知和未知结构类型化合物,现在国内关于该技术的相关研究报道不多。本研究采用生物活性、DNP数据库以及UPLC-QTof-MS分析相结合的方法寻找抗菌先导化合物,其优势是可以快速而简便地筛选和发现活性菌株,并预测其中主要化学成分的结构类型,然而本方法也存在一定不足,如其仅在样本数量相对较少(通常50株以内)且次生代谢产物为非新骨架化合物情况下效果较好,原因是DNP检索和UPLC-QTof-MS分析主要依靠人为逐个检索和分析,大样本数量的分析使用该方法则会耗时漫长,同时很多新骨架化合物并未被收录到DNP数据库,导致该方法对新骨架化合物预测困难。另外,由于很多菌株化学成分未被研究过,DNP数据库中也检索不到相应的次生代谢产物结构信息,使得该数据库的使用受到一定限制。当然,本研究方法在新骨架化合物的寻找方面并非完全无能为力,如果使用DNP数据库检索不到某一菌株相应的次生代谢产物结构信息,以及UPLC-QTof-MS图谱中出现独特裂解规律的碎片信息等情况,则说明该菌株极有可能产生新骨架化合物,值得进一步跟踪研究其化学成分。另外,在研究过程中借助本方法也可以快速去除一些被大量研究过的无效菌株,大大节约研究成本。
随着抗生素的大量滥用,各种耐药菌株ESKAPE (E. faecium,S. aureus,ESBL-producing E. coli and Klebsiella species,A. baumannii,P. aeruginosa,Enterobacter species)不断出现,急需从各种环境微生物中快速发现活性先导化合物。为了从药用植物内生真菌中寻找抗菌药源分子,我们对海南传统黎族抗菌药用植物艾纳香的叶片进行了系统内生真菌分离,并在次生代谢产物方面进行了探索。目前有关艾纳香内生真菌的研究相对较少,唐青等[29]2017年对贵州多地艾纳香内生真菌多样性方面进行了系统研究,共分离得到152株内生真菌,分属于11个属。这提示我们药用植物艾纳香中蕴藏着丰富的内生真菌资源,然而该研究并未进行活性筛选或次生代谢产物方面研究。元超等[30-31]2019年分别对两株艾纳香内生真菌次生代谢产物进行了研究,发现了一系列结构类型多样、活性广泛的化合物,显示艾纳香内生真菌是寻找活性先导化合物的一大类重要的真菌资源,值得深入研究。本研究首次采用生物活性筛选结合DNP数据库以及UPLC-QTof-MS的策略对艾纳香内生真菌资源进行探索,获得了一株目标菌株Diaporthe sp.和一个抗菌活性化合物Cytochalasin H。尽管本研究筛选到了活性成分,然而是个已知化合物,提示我们的研究策略可能存在一定的不足,因此在后续研究中,应该在此方法的基础上重点发挥UPLC-QTof-MS的分析功能,筛查化合物的重要碎片信息,为新化合物的发现提供有力支撑。
| [1] |
Hou YP, Braun DR, Michel CR, et al. Microbial strain prioritization using metabolomics tools for the discovery of natural products[J]. Analytical Chemistry, 2012, 84(10): 4277-4283. DOI:10.1021/ac202623g |
| [2] |
Dictionary of Natural Products 28.1[EB/OL]. London, Britain: Taylor & Francis Group, 2019. http://dnp.chemnetbase.com/faces/chemical/ChemicalSearch.xhtml
|
| [3] |
El-Elimat T, Figueroa M, Ehrmann BM, et al. High-resolution MS, MS/MS, and UV database of fungal secondary metabolites as a dereplication protocol for bioactive natural products[J]. Journal of Natural Products, 2013, 76(9): 1709-1716. DOI:10.1021/np4004307 |
| [4] |
Krug D, Zurek G, Schneider B, et al. Efficient mining of myxobacterial metabolite profiles enabled by liquid chromatography-electrospray ionisation-time-of-flight mass spectrometry and compound-based principal component analysis[J]. Analytica Chimica Acta, 2008, 624(1): 97-106. DOI:10.1016/j.aca.2008.06.036 |
| [5] |
Laatsch H. AntiBase 2011[EB/OL]. Weinheim, Germany: Wiley-VCH. 2011. http://wwwuser.gwdg.de/~hlaatsc/antibase.htm
|
| [6] |
Nielsen KF, Månsson M, Rank C, et al. Dereplication of microbial natural products by LC-DAD-TOFMS[J]. Journal of Natural Products, 2011, 74(11): 2338-2348. DOI:10.1021/np200254t |
| [7] |
Floros DJ, Jensen PR, Dorrestein PC, et al. A metabolomics guided exploration of marine natural product chemical space[J]. Metabolomics, 2016, 12(9): 145. DOI:10.1007/s11306-016-1087-5 |
| [8] |
O'Neill J. Tackling drug-resistant infections globally: final report and recommendations[EB/OL]. London: HM Government and the Wellcome Trust, 2016. https://www.linkedin.com/pulse/tackling-drug-resistant-infections-globally-report-pooja-bheda
|
| [9] |
Newman DJ, Cragg GM. Natural products as sources of new drugs from 1981 to 2014[J]. Journal of Natural Products, 2016, 79(3): 629-661. DOI:10.1021/acs.jnatprod.5b01055 |
| [10] |
Guan LL, Xia QF, Pang YX, et al. Analysis of metabolic pathway of terpenoids in Blumea balsamifera[J]. China Journal of Chinese Materia Medica, 2016, 41(9): 1585-1591. (in Chinese) 官玲亮, 夏奇峰, 庞玉新, 等. 艾纳香萜类物质生物合成途径分析[J]. 中国中药杂志, 2016, 41(9): 1585-1591. |
| [11] |
de Boer HJ, Cotingting C. Medicinal plants for women's healthcare in Southeast Asia: a meta-analysis of their traditional use, chemical constituents, and pharmacology[J]. Journal of Ethnopharmacology, 2014, 151(2): 747-767. DOI:10.1016/j.jep.2013.11.030 |
| [12] |
Pang YX, Wang D, Fan ZW, et al. Blumea balsamifera — a phytochemical and pharmacological review[J]. Molecules, 2014, 19(7): 9453-9477. DOI:10.3390/molecules19079453 |
| [13] |
Kusari S, Lamshöft M, Zühlke S, et al. An endophytic fungus from Hypericum perforatum that produces hypericin[J]. Journal of Natural Products, 2008, 71(2): 159-162. DOI:10.1021/np070669k |
| [14] |
Song B, Zhu XF, Xu BQ, et al. Identification of Kolra fragrant pear calyx-end black spot pathogen and its sequence analysis of ITS, GPD and EF-1α[J]. Acta Horticulturae Sinica, 2016, 43(2): 329-336. (in Chinese) 宋博, 朱晓锋, 徐兵强, 等. 库尔勒香梨果萼黑斑病病原鉴定及其ITS、GPD和EF-1α序列分析[J]. 园艺学报, 2016, 43(2): 329-336. |
| [15] |
Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J]. Molecular Biology and Evolution, 1987, 4(4): 406-425. |
| [16] |
Nilsson RH, Larsson KH, Taylor AFS, et al. The UNITE database for molecular identification of fungi: handling dark taxa and parallel taxonomic classifications[J]. Nucleic Acids Research, 2019, 47(D1): D259-D264. DOI:10.1093/nar/gky1022 |
| [17] |
Du XN, Gao YH, Zhang Y, et al. Diversity and antibacterial activities of fungi associated with the South China Sea sponge[J]. Mycosystema, 2019, 38(1): 64-73. (in Chinese) 杜晓娜, 高渊皓, 张雁, 等. 一株南海指海绵共附生真菌多样性及其抗菌活性[J]. 菌物学报, 2019, 38(1): 64-73. |
| [18] |
Zhang DH, Noviendri D, Nursid M, et al. 12, 13- dihydroxyfumitremorgin C, fumitremorgin C, and brevianamide F, antibacterial diketopiperazine alkaloids from the marine-derived fungus Pseudallescheria sp.[J]. Natural Product Sciences, 2007, 13(3): 251-254. |
| [19] |
Wagenaar MM, Clardy J. Dicerandrols, new antibiotic and cytotoxic dimers produced by the fungus Phomopsis longicolla isolated from an endangered mint[J]. Journal of Natural Products, 2001, 64(8): 1006-1009. DOI:10.1021/np010020u |
| [20] |
Chen CM, Zhu HC, Li XN, et al. Armochaeglobines A and B, two new indole-based alkaloids from the arthropod-derived fungus Chaetomium globosum[J]. Organic Letters, 2015, 17(3): 644-647. DOI:10.1021/ol503666b |
| [21] |
Fleming A. On the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. influenzae[J]. British Journal of Experimental Pathology, 1929, 10(3): 226-236. |
| [22] |
Clatworthy AE, Pierson E, Hung DT. Targeting virulence: a new paradigm for antimicrobial therapy[J]. Nature Chemical Biology, 2007, 3(9): 541-548. DOI:10.1038/nchembio.2007.24 |
| [23] |
Wright GD. Antibiotics: a new hope[J]. Chemistry & Biology, 2012, 19(1): 3-10. |
| [24] |
Liu XY, Ashforth E, Ren B, et al. Bioprospecting microbial natural product libraries from the marine environment for drug discovery[J]. The Journal of Antibiotics, 2010, 63(8): 415-422. DOI:10.1038/ja.2010.56 |
| [25] |
Koyama N, Tomoda H. MS network-based screening for new antibiotics discovery[J]. The Journal of Antibiotics, 2019, 72(1): 54-56. DOI:10.1038/s41429-018-0109-0 |
| [26] |
Hou XM, Li YY, Shi YW, et al. Integrating molecular networking and 1H NMR to target the isolation of chrysogeamides from a library of marine-derived Penicillium fungi[J]. The Journal of Organic Chemistry, 2019, 84(3): 1228-1237. DOI:10.1021/acs.joc.8b02614 |
| [27] |
Woo S, Kang KB, Kim J, et al. Molecular networking reveals the chemical diversity of Selaginellin derivatives, natural phosphodiesterase-4 inhibitors from Selaginella tamariscina[J]. Journal of Natural Products, 2019, 82(7): 1820-1830. DOI:10.1021/acs.jnatprod.9b00049 |
| [28] |
Mudalungu CM, von Törne WJ, Voigt K, et al. Noursamycins, chlorinated cyclohexapeptides identified from molecular networking of Streptomyces noursei NTR-SR4[J]. Journal of Natural Products, 2019, 82(6): 1478-1486. DOI:10.1021/acs.jnatprod.8b00967 |
| [29] |
Tang Q, Zhou SX, Lei BX, et al. Diversity of endophytic fungi from Blumea balsamifera in Southwest Guizhou[J]. Mycosystema, 2017, 36(11): 1498-1503. (in Chinese) 唐青, 周思旋, 雷帮星, 等. 贵州西南部艾纳香内生真菌多样性研究[J]. 菌物学报, 2017, 36(11): 1498-1503. |
| [30] |
Yuan C, Li G, Zhang YB, et al. Secondary metabolites of an endophytic fungus Diaporthe sp. derived from Blumea balsamifera (L.) DC.[J]. Acta Microbiologica Sinica, 2019, 59(4): 753-761. (in Chinese) 元超, 李刚, 张影波, 等. 艾纳香内生真菌Diaporthe sp.次生代谢产物[J]. 微生物学报, 2019, 59(4): 753-761. |
| [31] |
Yuan C, Guo YH, Zhang YB, et al. Secondary metabolites from Corynespora cassiicola J9, an endophytic fungus associated with Blumea balsamifera (L.) DC.[J]. Acta Pharmaceutica Sinica, 2019, 54(5): 892-896. (in Chinese) 元超, 郭玉华, 张影波, 等. 艾纳香内生真菌Corynespora cassiicola J9次生代谢产物研究[J]. 药学学报, 2019, 54(5): 892-896. |
 2020, Vol. 47
2020, Vol. 47




