扩展功能
文章信息
- 曾喻兵, 周雪珂, 江朝源, 彭珂楠, 杨泽晓, 朱玲, 徐志文
- ZENG Yu-Bing, ZHOU Xue-Ke, JIANG Chao-Yuan, PENG Ke-Nan, YANG Ze-Xiao, ZHU Ling, XU Zhi-Wen
- 竹鼠源致病性大肠杆菌分离鉴定与耐药情况分析
- Isolation, identification and drug resistance analysis of pathogenic Escherichia coli from bamboo rat
- 微生物学通报, 2020, 47(2): 512-521
- Microbiology China, 2020, 47(2): 512-521
- DOI: 10.13344/j.microbiol.china.190301
-
文章历史
- 收稿日期: 2019-04-10
- 接受日期: 2019-09-02
- 网络首发日期: 2019-09-19
2. 动物疫病与人类健康四川省重点实验室 四川 成都 611130;
3. 四川大学生命科学学院 四川 成都 610065
2. Key Laboratory of Animal Disease and Human Health of Sichuan Province, Chengdu, Sichuan 611130, China;
3. College of Life Sciences, Sichuan University, Chengdu, Sichuan 610065, China
竹鼠(bamboo rat)又称竹根猪、竹根鼠、芒狸、冬毛老鼠等,属草食性动物,因喜爱采食竹子而得名[1]。竹鼠营养丰富、毛皮柔软,具有较高的经济效益。近年竹鼠养殖业备受关注,人工饲养竹鼠逐渐规模化。目前竹鼠养殖主要分布在华中、华南、西南等地区,四川养殖业也逐渐兴起[2]。竹鼠喜阴冷、畏光,对环境的突然变化感知灵敏,人工养殖技术的限制导致疾病不断发生,尤其是细菌性疾病对养殖业造成了严重的威胁[3]。大肠杆菌(Escherichia coli)是存在于人和动物体内的条件致病菌,致病性大肠杆菌导致的动物疾病死亡率高,是养殖业的一大杀手[4]。随着养殖业中抗生素的不合理使用情况加剧,大肠杆菌多重耐药菌层出不穷,耐药谱显著增宽,给人类健康和养殖业带来巨大的威胁[5]。
2019年1月初,四川省绵阳市某竹鼠养殖场出现竹鼠弥散死亡,全场80%竹鼠发病,死亡率30%,包括成年、幼年竹鼠,症状表现为精神沉郁,口角及牙龈出血,关节肿胀并伴随跛行,剖检见肺脏点状出血,肝脏肿胀有坏死灶,淋巴结肿胀。本实验通过常规细菌分离鉴定和形态学观察,结合16S rRNA基因测序分析鉴定该病原菌,并进行病理组织学观察,对病原菌耐药性和耐药基因进行检测。
1 材料与方法 1.1 样本来源样本来自四川省绵阳市某竹鼠养殖场,该养殖场竹鼠出现弥散性死亡。
1.2 主要试剂和仪器及培养基犊牛血清、DL2000 DNA Marker、2×Taq PCR Master Mix、pMD19-T载体、Solution Ι,宝生物工程(大连)有限公司;细菌DNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒,Tiangen公司;引物均由生工生物工程(上海)股份有限公司合成;大肠杆菌DH5α感受态细胞为本实验室保存;成年大鼠购自成都达硕实验动物有限公司。PCR仪、Gel DocTM EZ imager凝胶成像系统,Bio-Rad公司;电热恒温培养箱,上海齐欣科学仪器有限公司;电泳仪,北京市六一仪器厂;正置显微镜DM500、石蜡切片机,Leica公司。胰蛋白胨大豆琼脂培养基(TSA)、胰蛋白胨大豆肉汤培养基(TSB)、麦康凯培养基、普通琼脂培养基,瑞进特公司。
1.3 细菌分离将送检患病竹鼠采用前腔静脉放血法处死并解剖,无菌条件下采取肺脏、肝脏、脾脏及肾脏,采用划线法接种于TSA培养基,置于37 ℃恒温培养18-24 h。观察菌落形态,挑取优势单菌落进行革兰氏染色,通过染色镜检对细菌进行初步判断。挑取可疑菌落分别接种于麦康凯培养基和TSA培养基上纯化,37 ℃恒温培养,观察菌落的生长形态。
1.4 生理生化试验挑取纯化培养的单菌落分别接种于生化管中,根据颜色的变化,参照《伯杰细菌鉴定手册》[6]判定实验结果。
1.5 16S rRNA基因扩增及遗传进化分析将分离得到的细菌用细菌DNA提取试剂盒提取基因组DNA作为模板,用16S rRNA通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-G GTTACCTGTTACGACTT-3′)进行PCR扩增,预期扩增长度1 465 bp。PCR反应体系(30 µL):上、下游引物(10 µmol/L)各0.5 µL,细菌基因组DNA (208 ng/µL) 2 µL,2×Taq PCR Master Mix 15 µL,ddH2O 12 µL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃ 7 min。
PCR扩增产物用1%琼脂糖凝胶进行电泳检测,利用凝胶回收试剂盒对目的条带进行回收纯化,产物与pMD19-T载体连接6 h,连接产物转入大肠杆菌DH5α感受态细胞中,用蓝白斑筛选阳性克隆后送至成都擎科梓熙生物技术有限公司测序。测序结果在GenBank中与相关核苷酸序列进行BLAST比对。采用MEGA 6.0软件中的Neighbor-Joining法建立其系统发育树,采用DNAStar 7.1进行同源性分析。
1.6 病理组织学观察将肺脏、肝脏、肾脏及脾脏固定于10%甲醛溶液后,送至成都里来生物科技有限公司采用常规石蜡切片法处理,切片进行HE染色、显微镜观察并拍照。
1.7 动物致病性试验挑取纯化的单菌落接种于TSB培养基,37 ℃、150 r/min振荡培养过夜,4 000 r/min离心5 min收集菌体,用无菌生理盐水悬浮菌体,选取4只SPF级大鼠,随机分为A、B两组,每组2只,按0.2 mL/只(6×108 CFU/mL)剂量腹腔注射A组大鼠为实验组,B组注射等量生理盐水为对照组;接种后观察大鼠精神状态,观察并记录;剖检死亡大鼠,无菌条件下采集肺脏、肝脏、肾脏和脾脏,对肺脏和肝脏进行细菌分离并进行16S rRNA基因测序;对采集的肺脏、肝脏、肾脏和脾脏器官用10%甲醛溶液固定,送至成都里来生物科技有限公司采用常规石蜡切片法处理,切片进行HE染色、显微镜观察并拍照[7]。
1.8 药敏试验药敏试验参考国家临床实验室标准委员会(National Committee for Clinical Laboratory Standards,NCCLS)[8]推荐的Kirby-Bauer法,选择20种对革兰氏阴性菌有效的常见药物进行药敏试验,测量抑菌圈直径,依据该标准进行结果判定。
1.9 耐药基因检测根据文献[9]合成引物检测大肠杆菌相关耐药基因,包括大肠杆菌ESBLs耐药基因TEM、SHV、OXA,磺胺类耐药基因sul Ⅰ、sul Ⅱ,氨基糖苷类耐药基因aac(3)-Ⅱ、aph(3′)-Ⅱ,氯霉素类耐药基因cmlA、floR,四环素类耐药基因tetA、tetB,喹诺酮类耐药基因qnrB。引物序列由生工生物工程(上海)股份有限公司合成,引物序列见表 1。
| 基因种类 Gene type |
耐药基因及登录号 Drug resistance gene and accession number |
引物序列 Primers sequence (5′→3′) |
目标条带 Product size (bp) |
退火温度 Annealing temperature (℃) |
| β-内酰胺类 Beta-lactamines |
TEM (FJ668751) | ACATTTCCGTGTCGCCCTTATTCCC | 118 | 62 |
| ACCCACTCGTGCACCCAACTG | ||||
| SHV (FJ668798) | GCGACAACGTCACCCGCCTT | 132 | 60 | |
| TTGCGAACGGGCGCTCAGAC | ||||
| OXA (GQ896560) | ACAGAAGCATGGCTCGAAAGT | 190 | 57 | |
| TTGCTGTGAATCCTGCACCA | ||||
| 磺胺类 Sulfonamides |
sul Ⅰ (AM295981) | TCGGACAGGGCGTCTAAG | 925 | 57 |
| GGGTATCGGAGCGTTTGC | ||||
| sul Ⅱ (FJ705354) | TGCCATCCCTGGTCAGAGTGCAG | 179 | 64 | |
| GCAGTCAATGGGCGCAAGCTGT | ||||
| 氨基糖苷类 Aminoglycosides |
aac(3)-Ⅱ (X13543) | GGCGACTTCACCGTTTCT | 412 | 56 |
| GGACCGATCACCCTACGAG | ||||
| aph(3’)-Ⅱ (NC009656) | CGTATTTCGTCTCGCTCAG | 232 | 56 | |
| GATTCCGACTCGTCCAAC | ||||
| 氯霉素类 Chloramphenicols |
cmlA (AJ487033) | GGGTGGCGGGCTATCTTT | 467 | 56 |
| GCGACACCAATACCCACTAG | ||||
| floR (DQ206638) | GAACACGACGCCCGCTAT | 601 | 56 | |
| TTCCGCTTGGCCTATGAG | ||||
| 四环素类 Tetracyclines |
tetA (X75761) | TTGGCATTCTGCATTCACTCG | 344 | 57 |
| CCACCCGTTCCACGTTGTT | ||||
| tetB (V00611) | TTCACCGCATAGTCCCTT | 388 | 52 | |
| TGCAATAAATCCGAGCAG | ||||
| 喹诺酮类 Quinolones |
qnrB (NC010943) | CTATGATCGTGAAAGCCAGAAAGG | 427 | 55 |
| CCGAATATCTAAGTCACCCAACTCC |
经过12 h培养之后,涂抹肝脏的平板长出较纯的可疑菌落,在TSA培养基上呈圆形光滑的灰白色菌落,麦康凯培养基上长出粉红色菌落,革兰氏染色镜检可见一种革兰氏阴性菌,中等大小,两端钝圆。
2.2 生化试验结果生化试验结果(表 2)表明,该分离菌与《伯杰细菌鉴定手册》中的大肠杆菌生化特性相符。
| 生化试验项目 Biochemical tests |
结果 Results |
| 葡萄糖Glucose | + |
| 乳糖Lactose | + |
| 果糖Fructose | + |
| 木糖Xylose | + |
| 麦芽糖Maltose | + |
| 山梨醇Sorbitol | + |
| 甘露醇Mannitol | - |
| 尿素Urea | - |
| 甲基红Methyl red | + |
| H 2S | - |
| V-P | - |
| 硝酸盐Nitrate | - |
| 注:+:阳性;-:阴性. Note: +: Positive; -: Negative. |
|
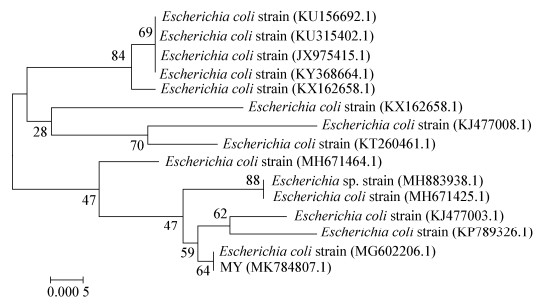
将16S rRNA基因扩增产物经1%琼脂糖凝胶电泳检测,目的条带与预期(1 465 bp)相符(图 1)。序列比对结果表明,该菌株16S rRNA基因序列与GenBank中大肠杆菌参考株的相似性达99%。将该大肠杆菌命名为MY,用MEGA 6.0软件和MegAlign软件对鉴定菌株的16S rRNA基因序列与参考菌株(表 3)构建遗传进化树并进行同源性分析,结果表明MY与MG602206.1处于同一支(图 2),与MG602206.1相似性最高,为99.3% (图 3)。

|
| 图 1 16S rRNA基因的PCR扩增结果 Figure 1 The PCR amplication of 16S rRNA gene 注:M:DL2000分子量标准;MY:分离菌;+:阳性对照;-:阴性对照. Note: M: DL2000 DNA Marker; MY: Isolated bacteria; +: Positive control; -: Negative control. |
|
|
| 登录号Accession No. | 菌种Strains | 地区Area |
| KT260461.1 | Escherichia coli strain RCB249 | 蝙蝠粪(印度) Bat guano (India) |
| KF918342.1 | Escherichia coli strain Sw1 | 猪粪便(韩国) Pig feces (South Korea) |
| MF893145.1 | Escherichia coli strain PUJA-1 | 水(印度) Water sample (India) |
| JX975415.1 | Escherichia coli strain XJ133-127-1NF1 | 牛肺(新疆) Calf (Xinjiang) |
| KU156692.1 | Escherichia coli strain Gut07 | 人类粪便(厦门) Human faeces (Xiamen) |
| KU315402.1 | Escherichia coli strain Ls1 | 鸡粪(河南) Chicken manure (Henan) |
| KX162658.1 | Escherichia coli strain TYN 130606 | 仔猪粪便(四川) Piglet diarrhea feces (Sichuan) |
| KJ477008.1 | Escherichia coli strain E326-1 | 即食食品(广东) Ready to eat foods (Guangdong) |
| MH883938.1 | Escherichia sp. strain GR25 | 桑树内生菌(重庆) Bacteria endophyte of mulberry (Chongqing) |
| KY368664.1 | Escherichia coli strain W-1 | 鱼(甘肃) Fish (Gansu) |
| KJ477003.1 | Escherichia coli strain E119-1 | 牛肉(广东) Beef (Guangdong) |
| MG602206.1 | Escherichia coli strain EC1704-2 | 鸡(广东) Chicken (Guangdong) |
| MH671425.1 | Escherichia coli strain 44 | 仔猪(江苏) Piglets (Jiangsu) |
| KP789326.1 | Escherichia coli strain 13A | 粪便(美国) Feces (USA) |
|
| 图 2 分离菌株基于16S rRNA基因序列的进化树 Figure 2 Phylogenetic analysis tree based on 16S rRNA gene sequence 注:标尺为序列差异的分支长度;节点处的数字为Bootstrap值;括号内的数字为GenBank序列号. Note: Bar: Nucleotide divergence; Numbers at the branch points: Bootstrap values; Numbers in parenthesis: GenBank accession number. |
|
|

|
| 图 3 分离菌株与部分大肠杆菌16S rRNA基因核酸序列相似性比对 Figure 3 Nucleotide similarity for isolates and partial Escherichia coli |
|
|

|
| 图 4 竹鼠组织切片 Figure 4 Bamboo rat tissue sections 注:A:肝脏肝细胞空泡变性(绿色箭头),肝细胞坏死区域(红色箭头),胆管上皮细胞坏死脱落(黄色箭头);标尺:50 μm. B:脾脏未见明显病变;标尺:100 μm. C:肺脏出血(黄色箭头)淋巴细胞浸润(红色箭头);标尺:100 μm. D:肾脏肾小球基底膜明显增厚(黄色箭头)肾小管上皮细胞变性脱落(绿色箭头)肾小管上皮细胞由柱状变为扁平(红色箭头);标尺:100 μm. Note: A: Liver, Hepatocyte vacuolar degeneration (green arrow), Hepatocyte necrosis area (red arrow), Biliary epithelial cell necrosis (yellow arrow)(scale: 50 μm); B: Spleen (scale: 100 μm); C: Lung, Intrapulmonary hemorrhage (yellow arrow), Lymphocyte infiltration (yellow arrow)(scale: 100 μm); D: Kidney, Glomerular basement membrane thickening (yellow arrow), Renal tubular epithelial cells degeneration (green arrow), Renal tubular epithelial cells change from columnar to flat (red arrow)(scale: 100 μm). |
|
|
肝脏:肝脏被膜完整,肝细胞分叶不明显,肝索排列紊乱;肝细胞形态较为正常,大量肝细胞广泛性空泡变性,可见变性细胞胞浆淡染,其内出现大小不等微小空泡,胞核悬于中央或偏于一侧;门管区周围肝细胞呈片状坏死,可见坏死细胞结构模糊,胞质粉染,胞核固缩、碎裂或溶解;肝窦内可见少量分叶核的中性粒细胞浸润,未见明显扩张淤血;门管区小叶间动脉、静脉及胆管结构较清晰,周围炎细胞浸润,胆管上皮细胞坏死脱落,可见胆管结构不完整,胆管上皮细胞胞核固缩、碎裂,管腔内可见残存细胞碎片;其他未见明显病理变化。
脾脏:脾脏被膜完整,红髓和白髓分界较清晰;白髓区生发中心明显,未见明显淋巴细胞变性坏死;红髓区脾血窦未见明显扩张、淤血,少量中性粒细胞浸润;其他未见明显病理变化。
肺脏:肺组织外膜完整,肺脏各级支气管分支结构较为正常,支气管纤毛上皮排列整齐,少量上皮细胞脱落;肺泡细胞结构较为正常,未见明显变性坏死;肺泡内广泛性出血,可见肺泡间质及腔内有较多红细胞渗出;间质内可见少量或淋巴细胞浸润;其他未见明显病理变化。
肾脏:肾脏组织被膜完整,皮质和髓质分界较为清晰,肾小球结构较完整,基底膜明显增厚;较多肾小管上皮细胞空泡变性,可见变性细胞胞质内含较多空泡,胞核固缩,部分细胞脱落,部分肾小管明显扩张,上皮细胞由柱状变为扁平,偶见蛋白样物质渗出;间质内未见明显的炎细胞浸润和纤维组织增生;其他未见明显病理变化。
2.5 动物致病性试验将分离菌株经腹腔注射大鼠后,A组大鼠精神沉郁,食欲减退嗜睡,呼吸急促并呈现出腹式呼吸,在24 h内A组大鼠均死亡,对照组B组大鼠无明显异常。剖检A组大鼠,可见大鼠肺脏有淤血或出血点,肝脏肿胀充血,腹腔内部有胶冻状物质。从大鼠肺脏和肝脏分离出与攻毒菌株MY相同特征的大肠杆菌,且其16S rRNA基因测序结果与攻毒菌株MY一致。对死亡大鼠进行病理组织学观察可见肝脏肝细胞空泡变性,变性肝细胞胞浆内出现大小不等的微小空泡,胞核悬于中央或偏于一侧,门管区小叶间动脉、静脉及胆管炎细胞浸润;脾脏边缘区细胞增多;肺脏肺泡上皮细胞空泡变性,肺泡萎陷,肺泡隔增厚,炎细胞浸润;肾脏肾小管上皮细胞空泡变性,胞核固缩,少量肾小管内可见蛋白管型(图 5)。

|
| 图 5 大鼠组织切片 Figure 5 Rat tissue sections 注:A:肝脏肝细胞空泡变性(绿色箭头),门管区周围少量淋巴细胞浸润(黄色箭头);标尺:50 μm. B:脾脏边缘区细胞增多(红色箭头);标尺:50 μm. C:肺脏肺泡上皮细胞空泡变性(绿色箭头)淋巴细胞浸润(红色箭头);标尺:50 μm. D:肾脏蛋白管型(绿色箭头)肾小管上皮细胞空泡变性(黄色箭头);标尺:50 μm. Note: A: Liver, Hepatocyte vacuolar degeneration (green arrow), lymphocyte infiltrates around the portal area (yellow arrow)(scale: 50 μm); B: Spleen, Increased cells in the marginal zone (red arrow)(scale: 50 μm); C: Lung, Alveolar epithelial vacuolar degeneration (green arrow), Lymphocytes infiltration (red arrow)(scale: 50 μm); D: Kidney, protein case (green arrow), Renal tubular epithelial cell vacuolar degeneration (yellow arrow)(scale: 50 μm). |
|
|
对分离菌株进行药敏试验,结果如表 4所示,分离菌对丁胺卡那霉素、庆大霉素、大观霉素、氨苄西林、头孢他啶、头孢吡肟、头孢噻肟、多粘菌素B、四环素、多西环素等10种药物高度敏感;对阿莫西林、链霉素、头孢曲松等3种药物中介;对左氧氟沙星、诺氟沙星、恩诺沙星、新霉素、红霉素、氟苯尼考、复方新诺明等7种药物耐药。
| 抗生素类别 Antibiotic category |
药物名称 Drug names |
抑菌圈直径 Diametre of the inhibition zone (mm) |
结果 Result |
| 喹诺酮类 Quinolones |
左氧氟沙星LVX | 8 | R |
| 诺氟沙星NOR | 6 | R | |
| 恩诺沙星ENR | 6 | R | |
| 氨基糖苷类 Aminoglycosides |
新霉素NEO | 8 | R |
| 丁胺卡那AMK | 19 | S | |
| 庆大霉素GEN | 15 | S | |
| 链霉素STR | 12 | I | |
| 大观霉素STP | 18 | S | |
| β-内酰胺类 β-lactamines |
头孢曲松CRO | 21 | I |
| 氨苄西林AMP | 17 | S | |
| β-内酰胺类 Beta-lactamines |
阿莫西林AXS | 14 | I |
| 头孢他啶CAZ | 17 | S | |
| 头孢吡肟FEP | 26 | S | |
| 头孢噻肟CTX | 23 | S | |
| 大环内酯类 Macrolides |
红霉素ERY | 7 | R |
| 氯霉素类 Chloramphenicol |
氟苯尼考FFC | 8 | R |
| 磺胺类 Sulfonamides |
复方新诺明SXT | 6 | R |
| 多肽类 Polypeptide antibiotics |
多粘菌素B POL | 14 | S |
| 四环素类 Tetracyclines |
四环素TCY | 18 | S |
| 多西环DP | 19 | S | |
| 注:S:敏感;I:中介;R:耐药. Note: S: Sensitive; I: Intermediary; R: Resistance. |
|||
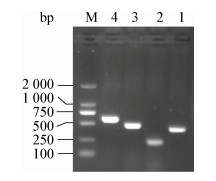
分离菌株PCR扩增产物经琼脂糖凝胶电泳鉴定,结果显示,氨基糖苷类耐药基因[aac(3)-Ⅱ、aph(3′)-Ⅱ]和氯霉素类耐药基因(cmlA、floR)电泳检测结果片段大小与目标条带相符(图 6)。
|
| 图 6 耐药基因PCR扩增结果 Figure 6 PCR amplification of drug-resistant genes Note: 1: aac(3)-Ⅱ; 2: aph(3′)-Ⅱ; 3: cmlA; 4: floR; M: DL2000 DNA Marker. |
|
|
本实验从竹鼠肝脏分离出一株细菌,动物致病性试验导致大鼠死亡,表明该菌是导致竹鼠死亡的致病菌;通过对分离菌株形态学观察和16S rRNA基因遗传进化分析,确定该分离菌为大肠杆菌,与MG602206.1处于同一支,且相似性高达99.3%;竹鼠组织切片可见肺脏组织、肝脏组织和肾脏组织病变损伤严重;动物试验大鼠病理组织切片可见与竹鼠相似的病理变化,但病理损伤与竹鼠相比较轻,这可能与物种差异有关;药敏试验显示该株大肠杆菌对左氧氟沙星、诺氟沙星、恩诺沙星、新霉素、红霉素、氟苯尼考、复方新诺明等7种抗生素耐药;耐药基因检测结果显示,aac(3)-Ⅱ、aph(3′)-Ⅱ、cmlA、floR为该菌株携带的耐药基因。
大肠杆菌是竹鼠细菌性疾病的主要病原[3, 10-12]。将分离的大肠杆菌16S rRNA基因序列与不同来源的菌株进行对比分析,发现该菌与广东省鸡源大肠杆菌(MG602206.1)处于同一分支,相似性最高,可能是由于现阶段畜禽饲养不够规范,存在畜禽混养情况导致。氧氟沙星、诺氟沙星、复方新诺明均为养殖全程禁用药,该菌株出现对此3种药物的耐药,说明在养殖业中可能仍然存在违规使用禁用药物的情况,导致多重耐药菌株的出现。
该株大肠杆菌的氨基糖苷类耐药基因及耐药情况的检测结果显示,该分离株携带aac(3)-Ⅱ、aph(3′)-Ⅱ耐药基因,且对丁胺卡那霉素、庆大霉素、大观霉素高度敏感。氨基糖苷类药物的耐药机制是以细菌3种修饰酶的产生为主,包括氨基糖苷类磷酸转移酶(aminoglycoside phosphotransferase,APH)、氨基糖苷类乙酰转移酶(aminoglycoside acetyltransferases,AAC)和氨基糖苷类腺苷转移酶(aminoglycoside nucleotidyltransferases,ANT)[9]。细菌对庆大霉素和丁胺卡那霉素耐药是通过甲基化酶(Rmt酶)修饰核糖体,使细菌对4, 6-二取代的2-脱氧链霉胺(2-DOS)氨基糖苷类抗生素具有耐药性[13];ANT和APH可使大观霉素失活[14];汤景元等[14]的研究结果显示,aph(3′)-Ⅱ耐药基因和抗菌药物丁胺卡那霉素相关,但陈伟[9]的研究结果显示两者的相关性较低。本实验中该分离菌株携带aph(3′)-Ⅱ耐药基因却对丁胺卡那霉素高度敏感,两者相关性较低,与陈伟[9]的研究结果一致;携带aph(3′)-Ⅱ却对大观霉素高度敏感。综上所述,目前细菌氨基糖苷类耐药基因与其耐药表型存在差异。研究证实cmlA介导的氯霉素耐药基因属于质粒介导型的,细菌携带cmlA与其是否对氟苯尼考耐药没有必然的联系[9]。floR基因主要参与细菌耐氟苯尼考机制[15]。该分离菌株携带cmlA、floR基因,与耐药表型相符。携带floR基因的质粒可以通过接合或转化在相同和不同物种或属的细菌中传播,从而传播抗性[16]。本实验从竹鼠分离的大肠杆菌携带氯霉素耐药基因,可能是质粒介导的耐药基因传递,不仅给畜禽养殖带来巨大的损失,也严重威胁人类健康。
竹鼠大肠杆菌病是竹鼠的常发病,常诱发其他疾病导致混合感染,因此防治较难。研究表明竹鼠源大肠杆菌与其他不同物种来源大肠杆菌的耐药性不同,所以不能沿用诊治猪源、鸡源大肠杆菌病的用药思路选择药物[17]。药敏试验表明本实验分离的大肠杆菌对丁胺卡那霉素、庆大霉素、大观霉素、氨苄西林、头孢他啶、头孢吡肟、头孢噻肟、多粘菌素、四环素、多西环素等10种药物高度敏感,建议竹鼠养殖者在治疗竹鼠大肠杆菌病时选择庆大霉素和丁胺卡那霉素等价格低廉、效果好的药物。本实验结果阐述了竹鼠源大肠杆菌目前的耐药情况,给竹鼠养殖业中大肠杆菌病的防治提供案例支撑,也为养殖业敲响警钟,提示要合理使用抗菌药物,减少发生其他条件致病性疾病混合感染的几率,避免因混合感染造成巨大的经济损失。
| [1] |
Tang HB, Chen FL, Rao GB, et al. Isolation and identification of Citrobacter freundii from the diseased bamboo rats and analysis of the pathogenicity of the isolate[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(5): 922-929. (in Chinese) 唐海波, 陈凤莲, 饶桂波, 等. 竹鼠源弗氏柠檬酸杆菌的分离鉴定及致病性分析[J]. 畜牧兽医学报, 2017, 48(5): 922-929. |
| [2] |
Liu KJ, Wan HF, Zhang WM, et al. Present situation, prospect and development countermeasure of bamboo rat breeding[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine, 2017, 33(4): 180-183. (in Chinese) 刘克俊, 万火福, 张文明, 等. 竹鼠养殖业现状、前景及发展对策[J]. 广西畜牧兽医, 2017, 33(4): 180-183. |
| [3] |
Wu P. Pathogeny characteristics analysis and prevention- treatment research of bamboo rat colibacillosis[D]. Ya'an: Master's Thesis of Sichuan Agricultural University, 2013 (in Chinese) 吴鹏.竹鼠大肠杆菌病的病原特性及其综合防治研究[D].雅安: 四川农业大学硕士学位论文, 2013 |
| [4] |
Wang JW. Insights into prevalence of antimicrobial resistance and resistance genes in Escherichia coli isolates from swine[D]. Changchun: Master's Thesis of Jilin Agricultural University, 2015 (in Chinese) 王基伟.猪源大肠杆菌分离鉴定及耐药性研究[D].长春: 吉林农业大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10193-1015963718.htm |
| [5] |
Yue S. Detection of Escherichia coli resistance genes and virulence genes and analysis of drug resistance in beef cattle in parts of Heilongjiang[D]. Daqing: Master's Thesis of Heilongjiang Bayi Agricultural University, 2017 (in Chinese) 岳山.黑龙江部分地区肉牛大肠杆菌耐药基因与毒力基因检测及耐药性分析[D].大庆: 黑龙江八一农垦大学硕士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10223-1017153377.htm |
| [6] |
Buchanan RE, Gibbons NE. Bergeyʼs Bacterial Identification Manual[M]. Institute of Microbiology, Chinese Academy of Sciences, trans. 8th ed. Beijing: Science Press, 1984: 385-389 (in Chinese) 布坎南RE, 吉本斯NE.伯杰细菌鉴定手册[M].中国科学院微生物研究所《伯杰细菌鉴定手册》, 译. 8版.北京: 科学出版社, 1984: 385-389 |
| [7] |
Yin XH, Zeng YB, Zhao J, et al. Isolation and identification of pathogenic Escherichia coli and Bacillus cereus[J]. Microbiology China, 2019, 46(4): 811-818. (in Chinese) 殷鑫欢, 曾喻兵, 赵军, 等. 致病性大肠杆菌和蜡样芽胞杆菌的分离鉴定[J]. 微生物学通报, 2019, 46(4): 811-818. |
| [8] |
Ma Y, Li JY, Jin SH. American Clinical Laboratory Standards Institute recommends susceptibility testing (2005 revised edition) methods and criteria[J]. National Medical Journal of China, 2005, 85(17): 1182-1184. (in Chinese) 马越, 李景云, 金少鸿. 美国临床实验室标准委员会推荐药敏试验操作方法和判断标准(2005年修订版)[J]. 中华医学杂志, 2005, 85(17): 1182-1184. |
| [9] |
Chen W. Detection and correlation analysis of resistance and HPI virulence genes in Escherichia coli from animals[D]. Hefei: Master's Thesis of Anhui Agricultural University, 2013 (in Chinese) 陈伟.动物源大肠杆菌耐药基因与HPI毒力基因的检测及相关性分析[D].合肥: 安徽农业大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10364-1014147713.htm |
| [10] |
Luo SM, Huang GZ, Su WZ, et al. Diagnosis and treatment of a disease caused by mixed infection of Escherichia coli and Arthrinium saccharicola in bamboo rats[J]. Agricultural Science & Technology, 2015, 16(12): 2842-2844. (in Chinese) 罗世民, 黄光中, 苏五珍, 等. 竹鼠大肠杆菌病与霉菌病混感的诊治[J]. 农业科学与技术, 2015, 16(12): 2842-2844. |
| [11] |
Zeng YG, Deng ZB. Studies on isolation and identification of Escherichia coli in bamboo rat[J]. Progress in Veterinary Medicine, 2002, 23(3): 94-95. (in Chinese) 曾元根, 邓治邦. 中华竹鼠大肠杆菌病诊断与防制[J]. 动物医学进展, 2002, 23(3): 94-95. |
| [12] |
Wang SQ, He DS. Diagnosis and treatment of bamboo edema caused by O141 Escherichia coli[J]. Heilongjiang Animal Science and Veterinary Medicine, 2011(14): 121-122. (in Chinese) 王书全, 何得肆. O141型大肠杆菌引起竹鼠水肿病的诊治[J]. 黑龙江畜牧兽医, 2011(14): 121-122. |
| [13] |
Zhong AL, Tian M, Liu YQ, et al. Research progress of resistance mechanism of aminoglycoside antibiotics[J]. Chinese Journal of Antibiotics, 2019, 44(4): 401-405. (in Chinese) 钟艾玲, 田敏, 刘艳全, 等. 氨基糖苷类抗生素的耐药机制研究进展[J]. 中国抗生素杂志, 2019, 44(4): 401-405. |
| [14] |
Tang JY, Wang HN, Zhang PJ, et al. Phenotypic and aminoglycosides genotypic antimicrobial resistance characterization of Escherichia coli isolated from 95 pig farms[J]. Acta Veterinaria et Zootechnica Sinica, 2008, 39(4): 472-477. (in Chinese) 汤景元, 王红宁, 张鹏举, 等. 95个猪场大肠杆菌耐药表型及氨基糖苷类药物耐药基因型调查[J]. 畜牧兽医学报, 2008, 39(4): 472-477. |
| [15] |
Chen HM, Cheng LF, Deng H, et al. Analysis of antimicrobial resistance and distribution of the floR gene in Pasteurella multocida isolated from poultry[J]. Animal Husbandry & Veterinary Medicine, 2019, 51(3): 93-96. (in Chinese) 陈红梅, 程龙飞, 邓辉, 等. 禽源多杀性巴氏杆菌耐药性分析及氟苯尼考耐药基因floR分布[J]. 畜牧与兽医, 2019, 51(3): 93-96. |
| [16] |
Lu JW, Zhang JF, Xu L, et al. Spread of the florfenicol resistance floR gene among clinical Klebsiella pneumoniae isolates in China[J]. Antimicrobial Resistance & Infection Control, 2018, 7(1): 127. |
| [17] |
Gong DC, Shi XN. Isolation, identification and drug sensitivity test of E. coli in bamboo rat[J]. Heilongjiang Animal Science and Veterinary Medicine, 2011(2): 75-76. (in Chinese) 龚大春, 史小娜. 竹鼠大肠杆菌的分离鉴定与药敏试验[J]. 黑龙江畜牧兽医, 2011(2): 75-76. |
 2020, Vol. 47
2020, Vol. 47




