扩展功能
文章信息
- 古丽尼沙·沙依木, 张志东, 杨波, 章世奎, 唐琦勇, 宋素琴, 朱静, 郭春苗, 顾美英
- Gulinisha·Shayimu, ZHANG Zhi-Dong, YANG Bo, ZHANG Shi-Kui, TANG Qi-Yong, SONG Su-Qin, ZHU Jing, GUO Chun-Miao, GU Mei-Ying
- 不同品种苹果树内生细菌群落多样性及功能
- Endophytic bacterial community diversity and function in apple trees of different varieties
- 微生物学通报, 2020, 47(2): 500-511
- Microbiology China, 2020, 47(2): 500-511
- DOI: 10.13344/j.microbiol.china.190494
-
文章历史
- 收稿日期: 2019-06-12
- 接受日期: 2019-10-08
- 网络首发日期: 2019-11-04
2. 新疆农业科学院园艺作物研究所 新疆 乌鲁木齐 830091;
3. 新疆农业科学院轮台国家果树资源圃 新疆 轮台 841600
2. Research Institute of Horticulture Crops, Xinjiang Academy of Agricultural Sciences, Urumqi, Xinjiang 830091, China;
3. Agriculture National Fruit Tree Germplasm Repository, Xinjiang Academy of Agricultural Sciences, Luntai, Xinjiang 841600, China
植物内生菌(endophyte)是指那些在其生活史的一定阶段或全部阶段生活于健康植物各种组织和器官内部以及细胞间隙,不引起宿主植物发生明显病害的一类微生物[1-2],在不同健康植物的根、茎、叶及果实中均广泛分布,种类繁多,具有促进植物生长、提高植物抗逆性和降低植物病虫害发生等生理生态功能,对调节宿主体内微生态平衡以及促进宿主植物健康生长均发挥重要作用[3-6]。
研究表明,植物内生细菌的种群组成随物种基因型及不同部位、生长地和环境条件不同而不同[7-9]。寄主根据其自身发育和功能性状对内生菌产生影响。研究表明,耐旱小米基因型根中产IAA (indole acetic acid)的内生细菌比例较高,ACC (1-aminocyclopropane-1-carboxylicacid)脱氨酶产生菌比例较低,而不耐旱小米基因型根中则相反[10]。不同地区2个非转基因和1个转基因品种大白菜根内生菌多样性也存在差异,其优势菌群分别为低(G+C)mol%革兰氏阳性菌(48.3%)、变形杆菌(50.2%)和高(G+C)mol%革兰氏阳性菌(38.2%),且从转基因品种中分离的内生菌对病原菌拮抗作用最强[11]。易感条锈病和抗条锈病小麦品种内生细菌数量差异显著,抗病品种多于感病品种;与茎叶相比,根中内生菌数量更为丰富[12]。吴燕燕等[13]采用高通量测序技术分析表明,桑树茎内具有丰富的内生细菌资源,抗性品种的内生细菌多样性高于易感品种。Hameed等[14]对4个水稻品种内生细菌研究表明,水稻的内生菌种类繁多,在组织中的分布受寄主基因型、土壤因子和营养胁迫的影响。但也有研究表明,不同基因型水稻种子内生细菌群落无明显差异,但丰度分布有明显差异,尤其是优势内生菌属[15]。陈百文等[16]研究发现不同茶树品种间内生细菌数量有一定差异,但未达到显著性水平。
新疆处于各大生物区系交汇的过渡地带,得天独厚的光热土资源孕育了丰富的果树资源,是多种果树的起源中心或次生起源中心之一[17]。从地理分界线来讲,新疆位于天山以东,由于光照充足、昼夜温差大、降水较少、病虫害较轻,是苹果的适宜栽培区,种质资源也较为丰富[18],其苹果外观品质和内在品质均佳。分布于伊犁河谷两侧天山中的野苹果,已被列为我国具有国际意义的生物多样性优先保护物种和中国濒危二级重点保护植物。而吉尔吉斯斯坦位于天山以西,地貌多样,拥有极其丰富的生物多样性,作为一些栽培水果的起源中心具有世界性的重要地位,有许多与驯化水果植物有关的野生物种,包括野苹果、梨、杏、开心果、巴旦木等[19],虽然发展瓜果种植业历史悠久,但水果种植面积不大,且主要生产苹果[20]。本研究利用Illumina MiSeq高通量测序技术,对新疆农业科学院轮台果树资源圃收集的新疆和吉尔吉斯斯坦不同品种的苹果树内生细菌种群多样性特征及差异进行分析,为揭示不同品种苹果树内生细菌功能菌株的挖掘和利用提供依据。
1 材料与方法 1.1 采样地点新疆本地和吉尔吉斯斯坦不同品种苹果树(表 1)栽植于新疆农业科学院轮台国家果树资源圃,以新疆本地野苹果为砧木。轮台县隶属于新疆巴音郭楞蒙古族自治州,地处天山南麓,塔里木盆地北缘,地势较平缓。地理位置坐标是83°38′E−85°25′E,41°05′N−42°32′N。属于暖温带大陆性干旱气候,光热资源丰富,年平均气温为10.6 ℃,年平均太阳总辐射量577.6 kJ/cm2,年日照2 783 h,年平均降水量52 mm,年蒸发量2 072 mm,无霜期188 d左右[21]。苹果树肥、水、修剪等管理采用常规措施。
| 样品 Sample |
苹果品种名称 Apple varieties |
原产地 Original places |
| A | 野苹果Malus sieversii M. | 新疆本地Xinjiang |
| B | 卡拉阿尔玛Kalaaerma | 新疆本地Xinjiang |
| C | 秋富Qiufu | 新疆本地Xinjiang |
| D | 沙依拉姆Shayilamu | 新疆本地Xinjiang |
| E | 吉国3号Kyrgyzstan Ⅲ | 吉尔吉斯斯坦Kyrgyzstan |
| F | 库尔贝Courbet | 吉尔吉斯斯坦Kyrgyzstan |
| G | 吉国7号Kyrgyzstan Ⅶ | 吉尔吉斯斯坦Kyrgyzstan |
| H | 阔日耶Kuoriejės | 吉尔吉斯斯坦Kyrgyzstan |
ZR-96 Bacterial DNA Kit,Zymo research公司;SanPrep柱式PCR产物纯化试剂盒,生工生物工程(上海)股份有限公司;引物合成、2×Taq Mix,北京鼎国生物技术有限公司。MiSeq高通量测序技术平台,北京诺禾致源生物信息科技有限公司;Mastercycler梯度PCR仪,Eppendorf公司;WD-9413B凝胶成像系统,北京六一生物科技有限公司。
1.3 样品采集及表面消毒于2017年9月采集资源圃内不同品种、外观健康的苹果树(表 1)枝条和叶片,放入无菌样品袋中4 ℃环境下保存,于48 h内进行表面消毒处理。具体参考刘晓静等[22]的方法,将枝条和叶片称取相同重量后,自来水流水冲洗10 min,无菌纸吸干水分,75%无水乙醇处理4 min,经无菌水洗涤后,用3% H2O2浸泡3 min,再用无菌水冲洗3−4次,最后一遍无菌水洗涤液经涂板检测无菌后,无菌条件下进行内生细菌DNA的提取。
1.4 基因组DNA的提取及扩增测序对消毒后的枝条和叶片加入液氮充分研磨后取适量转入灭菌EP管中,使用DNA提取试剂盒并参照说明书进行总DNA的提取。采用琼脂糖凝胶电泳检测所提取DNA的纯度和浓度后送北京诺禾致源生物信息科技有限公司进行高通量测序。
通过Illumina MiSeq平台,测序靶标DNA为16S rRNA基因V3−V4可变区,利用16S rRNA基因通用引物799F (5′-AACMGGATTAGATACCC KG-3′)和1193R (5′-ACGTCATCCCCACCTTCC-3′)进行PCR扩增。PCR反应体系和反应条件参考牛世全等[23]和刘晓静等[22]的方法,扩增PCR产物经琼脂糖电泳检测阳性后,进行高通量测序和分析。
1.5 数据处理、内生细菌群落多样性分析及功能预测测序结束后,对原始序列进行数据拆分、PE Reads拼接、Tags过滤和Tags去嵌合体序列后得到最终的有效序列。然后基于有效数据进行操作分类单元(operational taxonomic unit,OTU)聚类和物种分类分析,并将OTU和物种注释结合,去除注释为叶绿体、线粒体及非细菌界的OTU,从而得到每个样品的OTU和分类谱系的基本分析结果。再对OTU进行丰度、多样性指数等分析,同时对物种注释在各个分类水平上进行群落结构的统计分析。使用FAPROTAX软件对不同品种苹果树内生细菌群体进行功能预测。
2 结果与分析 2.1 不同品种苹果树内生细菌OTU及其多样性分析8个品种苹果树产生的原始序列质控后获得V3−V4区有效序列总数分别为61 487−71 583条,按照97%相似性,分别聚成24−92个OTU (表 2)。基于OTU数及相对丰度,对不同品种苹果树内生细菌进行多样性分析,结果表明不同品种苹果树内生细菌多样性指数存在一定的差异,Shannon指数和Simpson指数分别在0.729−1.177和0.265−0.457之间,大小为C > B > A > F > E > H > D > G。总体而言,新疆本地品种的苹果树内生细菌多样性高于吉尔吉斯斯坦品种。
| 样品 Sample |
有效序列数 Number of valid sequences |
OTU数 Number of OTUs |
Shannon指数 Shannon index |
辛普森指数 Simpson index |
覆盖率 Coverage (%) |
| A | 71 065 | 75 | 1.069 | 0.445 | 99.9 |
| B | 71 141 | 92 | 1.095 | 0.456 | 99.9 |
| C | 63 744 | 51 | 1.177 | 0.457 | 99.9 |
| D | 69 013 | 69 | 0.811 | 0.273 | 99.9 |
| E | 71 583 | 32 | 0.908 | 0.391 | 99.9 |
| F | 61 487 | 27 | 0.951 | 0.401 | 99.9 |
| G | 66 614 | 24 | 0.729 | 0.265 | 99.9 |
| H | 61 851 | 31 | 0.908 | 0.368 | 99.9 |
| 注:A:野苹果;B:卡拉阿尔玛;C:秋富;D:沙依拉姆;E:吉国3号;F:库尔贝;G:吉国7号;H:阔日耶.下同. Note:A: Malus sieversii M.; B: Kalaaerma; C: Qiufu; D: Shayilamu; E: Kyrgyzstan Ⅲ; F:Courbet; G: Kyrgyzstan Ⅶ; H: Kuoriejės. The same below. | |||||
种群归类显示8个品种苹果树所得OTU序列分属18个细菌门及22个可归类细菌纲。在目及以下分类阶层,已归类的OTU总计分布于37个细菌目45个细菌科49个细菌属。不同品种苹果树中测得的各级细菌分类阶层总数也明显不同(表 3),新疆本地品种苹果树的内生细菌种类要高于吉尔吉斯斯坦苹果品种。
| Sample | Phylum | Class | Order | Family | Genus |
| A | 10 | 22 | 38 | 53 | 56 |
| B | 13 | 29 | 42 | 56 | 69 |
| C | 11 | 20 | 30 | 37 | 41 |
| D | 7 | 18 | 31 | 44 | 49 |
| E | 6 | 12 | 15 | 19 | 19 |
| F | 5 | 9 | 12 | 14 | 14 |
| G | 3 | 6 | 11 | 14 | 15 |
| H | 6 | 13 | 19 | 21 | 21 |
维恩图直观展示样本中共有和独有的OTU的数目,可反映出样品间OTU数目组成的相似性及重叠情况,从图 1可见8个品种苹果树中内生菌共有的OTU数目仅1个,为放线菌门的节杆菌属(Arthrobacter)。不同品种苹果树独有的内生细菌群体种群组成存在较大差异。新疆本地品种的苹果树内生细菌特有OTU数目较多,其中新疆野苹果独有的OTU数目有6个,包括放线菌门(Actinobacteria)的红杆菌属(Rubrobacter) (1.21%)、糖多孢菌属(Saccharopolyspora) (0.81%)、异常球菌-栖热菌门(Deinococcus-Thermus)的Truepera属(0.81%)和变形菌门(Proteobacteria) (3.23%)、厌氧绳菌纲(Anaerolineae) (1.21%)的未知属。卡拉阿尔玛品种独有的OTU数目最多,有31个,以变形菌门(Proteobacteria) (13个)和拟杆菌门(Bacteroidetes) (9个)为主,主要菌属为冷蛇菌属(Psychroserpens) (1.93%)、红杆菌属(Rubrobacter) (1.10%)、棘杆菌属(Sphingorhabdus) (1.65%)、砂藻属(Arenicella) (1.10%)、藏红花色纤细杆菌属(Croceitalea) (1.10%)和变形菌门(Proteobacteria) (2.48%)、螺旋体菌门(Saccharibacteria) (2.48%)、拟杆菌门(Bacteroidetes) (2.20%)、螺旋体菌门(Saccharibacteria) (1.10%)的未知属等,说明较其他品种有更多具有偏好性的细菌种群。秋富品种独有的OTU数目有19个,以变形菌门(Proteobacteria) (6个)、放线菌门(Actinobacteria) (5个)和拟杆菌门(Bacteroidetes) (3个)为主,但占比均小于1.00%。沙依拉姆品种独有的OTU数目有7个,以变形菌门(Proteobacteria) (2个)和放线菌门(Actinobacteria) (2个)为主,但占比均小于1.00%。而吉尔吉斯斯坦引进的4个品种特有OTU数目较少。吉国3号品种独有的OTU数目有1个,为变形菌门(Proteobacteria) (0.91%)门的未知属,吉国7号品种独有的OTU数目也为1个,为厚壁菌门(Firmicutes)的嗜盐杆菌属(Halobacillus) (3.57%),其余两个品种没有独有的OTU数目。
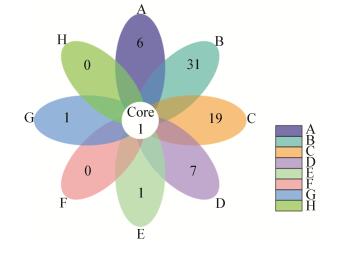
|
| 图 1 不同品种苹果树内生细菌群落OTU分布韦恩图 Figure 1 Venn diagram of OTUs distribution of endophytic bacterial community detected in apple trees of different varieties |
|
|
所测8个样品中占优势的可归类细菌群落(OTU至少在1种苹果中丰度≥1%)共分布11个门(图 2),包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、螺旋体菌门(Saccharibacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、蓝菌门(Cyanobacteria)、浮霉菌门(Planctomycetes)、热微菌门(Thermomicrobia)、芽单胞菌门(Gemmatimonadetes)。其中,变形菌门和放线菌门为主要优势细菌门,OTU总计覆盖了8个品种苹果树的61.16%−97.08%,说明苹果树内生细菌群体门水平上的组成相似,但丰度占比不同。
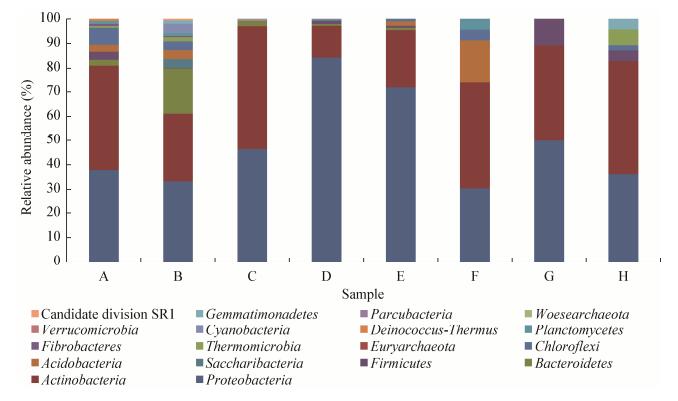
|
| 图 2 不同品种苹果树内生细菌群落优势细菌门组成 Figure 2 Dominant bacterial phyla detected from endophytic bacterial community in apple trees of different varieties |
|
|
按照至少在1种苹果中丰度≥1%,可归类微生物群落OTU共归于α-变形杆菌纲(Alphaproteobacteria)、β-变形杆菌纲(Betaproteobacteria)、γ-变形杆菌纲(Gammaproteobacteria)、δ-变形杆菌纲(Deltaproteobacteria)、腈基降解菌纲(Nitriliruptoria)、酸微菌纲(Acidimicrobiia)、红杆菌纲(Rubrobacteria)、嗜热油菌纲(Thermoleophilia)、黄杆菌纲(Flavobacteriia)、鞘脂杆菌纲(Sphingobacteriia)、蓝藻菌纲(Cytophagia)、芽孢杆菌纲(Bacilli)、Ardenticatenia纲、厌氧绳菌纲(Anaerolineae)、浮霉菌纲(Planctomycetacia)和Phycisphaerae纲16个优势细菌纲。归于这16个细菌纲的OTU覆盖了8个品种苹果树样品的39.14%−88.83%,各优势细菌纲数目、组成及其丰度随不同苹果品种而异(图 3)。新疆品种中以α-变形杆菌纲(Alphaproteobacteria)、β-变形杆菌纲(Betaproteobacteria)、γ-变形杆菌纲(Gammaproteobacteria)、黄杆菌纲(Flavobacteriia)、腈基降解菌纲(Nitriliruptoria)和酸微菌纲(Acidimicrobiia)为主,吉尔吉斯斯坦的品种中以α-变形杆菌纲(Alphaproteobacteria)、β-变形杆菌纲(Betaproteobacteria)、γ-变形杆菌纲(Gammaproteobacteria)为主;其中厌氧绳菌纲(Anaerolineae)为新疆野苹果中独有,黄杆菌纲(Flavobacteriia)仅在新疆品种中有分布,鞘脂杆菌纲(Sphingobacteriia)分布在新疆卡拉阿尔玛和秋富中,Ardenticatenia纲分布在新疆的野苹果和卡拉阿尔玛中,浮霉菌纲(Planctomycetacia)分布在新疆的野苹果、卡拉阿尔玛和沙依拉姆中,Phycisphaerae纲分布在新疆沙依拉姆和吉尔吉斯斯坦库尔贝中。

|
| 图 3 不同品种苹果树内生细菌群落优势细菌纲组成 Figure 3 Dominant bacterial classes detected from endophytic bacterial community in apple trees of different varieties |
|
|
按照至少在1种苹果中丰度≥1%,可归类微生物群落OTU分属于马赛菌属(Massilia)、节杆菌属(Arthrobacter)、假单胞菌属(Pseudomonas)、尤泽比氏菌属(Euzebya)、假动球菌属(Pseudokineococcus)、鞘脂单胞菌属(Sphingomonas)、盐单胞菌属(Halomonas)、动性球菌属(Planococcus)、芽孢杆菌属(Bacillus)、红色杆菌属(Rubrobacter)、长孢菌属(Longispora)等28个优势细菌属(图 4)。研究表明,优势细菌属数目、组成及其丰度随苹果品种的不同而有所差异。其中,马赛菌属(Massilia)和节杆菌属(Arthrobacter)的总丰度最高,除马赛菌属(Massilia)在吉国7号这个品种中未检测到外,这两个属在其他品种中均在1.29%−17.86%之间;马赛菌属(Massilia)丰度较高的是新疆的秋富和沙依拉姆、吉尔吉斯斯坦的吉国3号,节杆菌属(Arthrobacter)丰度较高的是吉尔吉斯斯坦的库贝尔、阔日耶和吉国7号。假单胞菌属(Pseudomjierjisisonas)在吉尔吉斯斯坦的3个品种中有较高分布,而新疆的品种中未被检出;水杆菌属(Aquibacter)在新疆的品种中有较高分布,而吉尔吉斯斯坦的品种中未被检出。短小杆菌属(Curtobacterium)、错玫杆菌属(Falsirhodobacter)、鲁杰氏菌属(Ruegeria)、贫养杆菌属(Modestobacter)、传播杆菌属(Patulibacter)等13属仅在新疆品种中有所检出,但丰度均较低。由此可以看出,新疆本地品种苹果树内生细菌的多样性较丰富,吉尔吉斯斯坦的苹果树内生菌种类虽然没有新疆本地的苹果树种类多,但也存在一些特有属。此外,这8个品种苹果树内生细菌还存在大量未能在属水平归类的OTU序列,其范围在13.74%−69.60%之间,说明可能还存在大量的未知属。
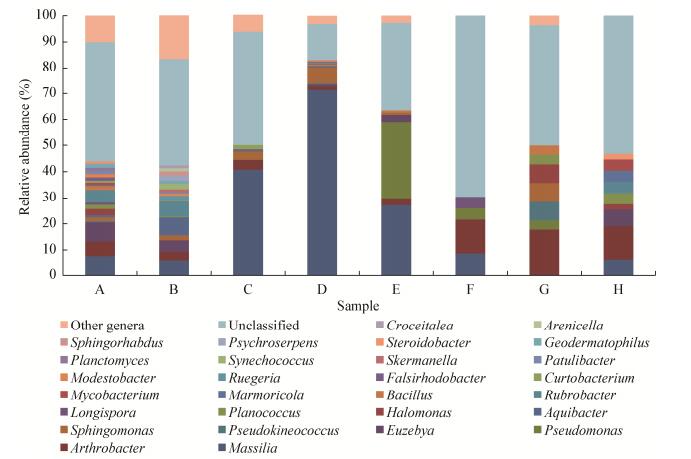
|
| 图 4 不同品种苹果树内生细菌群落优势细菌属组成 Figure 4 Dominant bacterial genera detected from endophytic bacterial community in apple trees of different varieties |
|
|
主成分分析(principal component analysis,PCA)表明(图 5),主成分分析1 (PC1)和主成分分析2 (PC2)的样品差异性贡献率分别达到35.60%和22.96%,合计为58.56%,是差异的主要来源。新疆本地的4个品种苹果树内生细菌群落多样性差异较大,4个象限都有分布;而吉尔吉斯斯坦的4个品种间内生细菌群落多样性差异较小,大体分布于第三象限,其菌群种类相似程度高。

|
| 图 5 不同品种苹果树内生细菌群落PCA图 Figure 5 The PCA analysis of endophytic bacterial community in apple trees of different varieties |
|
|
使用FAPROTAX数据库对微生物群落进行功能预测,在一定程度上反映微生物群落功能。经分析,共获得18项主要功能分组,其丰度随苹果品种的不同而异,新疆本地品种微生物群落的功能信息多于吉尔吉斯斯坦苹果品种(图 6),排在前5的分别是化能异养(chemoheterotrophy)、需氧化能异养(aerobic chemoheterotrophy)、尿素分解功能(ureolysis)、砷酸盐解毒功能(arsenate detoxification)和异化砷还原功能(dissimilatory arsenate reduction)。其中吉尔吉斯斯坦的苹果品种中砷酸盐解毒功能(1.92%−11.11%)和异化砷还原功能(1.92%−11.11%)丰度较高,而新疆本地品种中则尿素分解功能(4.07%−64.08%)丰度较高。此外,预测结果中也出现了丰度较高的具有石油烃降解(0.1%−4.17%)等益生功能信息,新疆品种中还含有具有纤维素分解(0.29%−0.37%)、木聚糖分解(0.29%−0.37%)等益生功能信息。
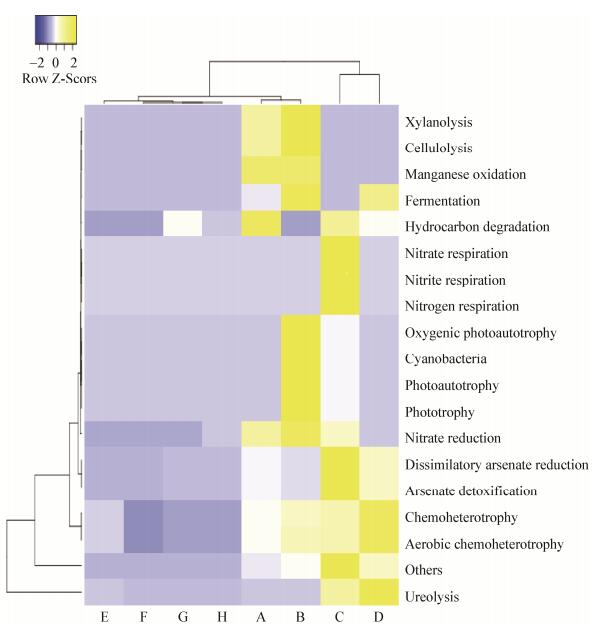
|
| 图 6 功能基因预测聚类热图 Figure 6 Clustering heatmap of function gene prediction |
|
|
植物内生菌广泛存在于植物各组织和器官中,表现出丰富的群落多样性,对植物的生长和健康有很重要的作用[24]。目前对内生菌多样性的研究方法很多,高通量测序是其中比较重要的方法[25]。16S rRNA基因测序中最优引物对的选择是微生物多样性分析中的关键问题,引物位置的不同,16S rRNA基因的PCR扩增会有很大的种群偏倚性。许多细菌的16S rRNA基因引物不仅会扩增目标区域,还会扩增线粒体和叶绿体等非目标区域。本研究利用高通量测序技术,对不同品种苹果内生细菌多样性进行分析。表 2中每个样本有效测序序列数都在6万条以上,而OTU数目都小于100,有的只有20多,这个结果与所用的V3−V4区的引物有关。研究表明V3−V4区引物在各分类层级鉴定的准确性高,适用性比较广,但也存在植物叶绿体和线粒体的干扰[26]。扩增V5−V7高变区能够高效地扩增目标区域,消除叶绿体和线粒体的潜在污染[27],但内生细菌种类多样性信息分析的准确性不如V3−V4区。因此选择合适的引物对植物内生菌多样性进行分析还需要做更多的工作。
内生菌的群落多样性不仅取决于宿主植物本身和内生菌种类,还与地理位置、温度变化、光照、雨水、空气湿度等环境因素密切相关,表现出一定的宿主专化性和地域专化性[14]。本研究调查了8个不同品种苹果树内生细菌多样性特征,结果发现新疆本地品种内生细菌多样性和种类均高于吉尔吉斯斯坦品种。主成分分析表明,新疆本地品种间群落结构组成和多样性差异较大,而吉尔吉斯斯坦各品种间群落结构组成和多样性特征相似,但与新疆品种间有较大差异。由此可以看出苹果树内生细菌的种群分布与宿主的基因型关系密切,同时也受周围环境的影响。不同品种和砧木苹果内生菌的高通量测序结果显示具有相似谱系的苹果样品具有相似的微生物群[28]。不同桑树品种内生菌菌体对宿主的选择偏好性可能与宿主自身的生理结构、营养代谢途径以及其分泌的次生代谢产物有关[13]。宋庭宁等的研究发现相同植物不同地点的内生细菌群落(无论是叶,还是根)种类无明显差异,但存在菌落数量上的差异[29]。对新疆本地和吉尔吉斯斯坦不同品种苹果树内生细菌群落需更进一步的进行多引物、多位点免培养分析,以全面揭示不同品种苹果树内生细菌群落多样性特征及其生态分布规律。
目前苹果树内生细菌群体的多样性研究较多,但对不同品种苹果树内生菌群落多样性的分析比较还较少[28]。本研究对来自新疆本地和吉尔吉斯斯坦不同品种苹果树内生菌多样性进行调查分析显示,8个测试苹果树内生细菌中共有的OTU数仅1个,这与研究的品种越多,共有的OTU数目可能就会越少有关。变形菌门和放线菌门为主要优势内生细菌菌群,覆盖了8个苹果品种内生细菌的61.16%−97.08%,说明苹果树内生细菌群体门水平上的组成相似。属级水平上的优势种群分析显示,苹果树内生菌群落种类较多,且新疆本地品种的苹果树内生细菌的多样性较吉尔吉斯斯坦丰富。归于马赛菌属和节杆菌属的总丰度最高,几乎在这8个品种中都有分布,其丰度分别在6.06%−71.37%、1.29%−17.86%之间。研究表明,马赛菌属不仅能够合成多种次级代谢产物和酶,而且具有溶磷、降解菲和耐受重金属等多种功能[20-32]。节杆菌属细菌具有很强的环境适应性和抗逆性,具有高效降解环境中的有机污染物和吸附重金属的能力,被用于污染水体和土壤等的生物修复研究与应用[33-35]。在吉尔吉斯斯坦苹果树中有较高分布的假单胞菌属是常见的具有防治植物病害和促进植物生长的生防菌[36]。在多个苹果树内生菌中检测到的优势种属还包括尤泽比氏菌属、鞘脂单胞菌属、盐单胞菌属、动性球菌属、长孢菌属、红色杆菌属、芽孢杆菌属等具有一定促生抗逆或和降解环境有毒有害物质相关的有益功能性状的微生物类群[37-43]。微生物群落功能预测也显示新疆本地品种微生物群落的功能信息多于吉尔吉斯斯坦苹果品种,但本研究基因功能类型还较少,很多功能仍不清楚,还需要进行深入研究。
此外,这8个品种苹果内生菌还存在大量未能在属水平归类的OTU序列,其范围在13.74%−69.60%之间,说明可能还存在大量未知属。由此可以看出不同品种苹果树内生细菌群体种群组成存在较大差异,且潜在分类信息也给新的微生物资源挖掘和功能分析提供线索,值得进一步研究。后续研究将在本研究基础上通过改良菌株培养基成分及培养方法等手段,尽可能多的分离出这些苹果品种内生细菌菌株,对其具有的拮抗、促生、降解有害物质等功能进行评价,筛选在生物防治和环境治理等方面具有较大应用潜力的微生物菌株。
| [1] |
Zhang Y, Yu XX, Zhang WJ, et al. Interactions between endophytes and plants: beneficial effect of endophytes to ameliorate biotic and abiotic stresses in plants[J]. Journal of Plant Biology, 2019, 62(1): 1-13. |
| [2] |
Wang ZW, Ji YL, Chen YG. Studies and biological significances of plant endophytes[J]. Microbiology China, 2015, 42(2): 349-363. (in Chinese) 王志伟, 纪燕玲, 陈永敢. 植物内生菌研究及其科学意义[J]. 微生物学通报, 2015, 42(2): 349-363. |
| [3] |
Emami S, Alikhani HA, Pourbabaei AA, et al. Effect of rhizospheric and endophytic bacteria with multiple plant growth promoting traits on wheat growth[J]. Environmental Science and Pollution Research, 2019, 26(19): 19804-19813. DOI:10.1007/s11356-019-05284-x |
| [4] |
Hazarika DJ, Goswami G, Gautom T, et al. Lipopeptide mediated biocontrol activity of endophytic Bacillus subtilis against fungal phytopathogens[J]. BMC Microbiology, 2019, 19: 71. DOI:10.1186/s12866-019-1440-8 |
| [5] |
Zhu YL. Isolation and identification of Ammodendron bifolium endophytic bacteria and the action mechanism of selected isolates-induced seed germination and their effects on host osmotic-stress tolerance[J]. Archives of Microbiology, 2019, 201(4): 431-442. DOI:10.1007/s00203-018-1582-3 |
| [6] |
Pandey PK, Samanta R, Yadav RNS. Inside the plant: addressing bacterial endophytes in biotic stress alleviation[J]. Archives of Microbiology, 2019, 201(4): 415-429. DOI:10.1007/s00203-019-01642-y |
| [7] |
Jia T, Oberhofer M, Shymanovich T, et al. Effects of hybrid and non-hybrid Epichloë endophytes and their associated host genotypes on the response of a native grass to varying environments[J]. Microbial Ecology, 2016, 72(1): 185-196. DOI:10.1007/s00248-016-0743-7 |
| [8] |
Walitang DI, Kim CG, Kim K, et al. The influence of host genotype and salt stress on the seed endophytic community of salt-sensitive and salt-tolerant rice cultivars[J]. BMC Plant Biology, 2018, 18: 51. DOI:10.1186/s12870-018-1261-1 |
| [9] |
Banik A, Mukhopadhaya SK, Dangar TK. Characterization of N2-fixing plant growth promoting endophytic and epiphytic bacterial community of Indian cultivated and wild rice (Oryza spp.) genotypes[J]. Planta, 2016, 243(3): 789-812. |
| [10] |
Manjunatha BS, Paul S, Aggarwal C, et al. Diversity and tissue preference of osmotolerant bacterial endophytes associated with pearl millet genotypes having differential drought susceptibilities[J]. Microbial Ecology, 2019, 77(3): 676-688. DOI:10.1007/s00248-018-1257-2 |
| [11] |
Haque MA, Yun HD, Cho KM. Diversity of indigenous endophytic bacteria associated with the roots of Chinese cabbage (Brassica campestris L.) cultivars and their antagonism towards pathogens[J]. Journal of Microbiology, 2016, 54(5): 353-363. DOI:10.1007/s12275-016-5641-7 |
| [12] |
Kiani T, Khan SA, Noureen N, et al. Isolation and characterization of culturable endophytic bacterial community of stripe rust-resistant and stripe rust-susceptible Pakistani wheat cultivars[J]. International Microbiology, 2019, 22(2): 191-201. DOI:10.1007/s10123-018-00039-z |
| [13] |
Wu YY, Xu WF, Luo Q, et al. An Illumina-based analysis of the diversity of endophytic bacteria from different mulberry genotypes[J]. Newsletter of Sericultural Science, 2018, 38(3): 1-10. (in Chinese) 吴燕燕, 徐伟芳, 罗琴, 等. Illumina MiSeq高通量测序分析不同品种桑树内生细菌多样性[J]. 蚕学通讯, 2018, 38(3): 1-10. DOI:10.3969/j.issn.1006-0561.2018.03.001 |
| [14] |
Hameed A, Yeh MW, Hsieh YT, et al. Diversity and functional characterization of bacterial endophytes dwelling in various rice (Oryza sativa L.) tissues, and their seed-borne dissemination into rhizosphere under gnotobiotic P-stress[J]. Plant and Soil, 2015, 394(1/2): 177-197. |
| [15] |
Zhang J, Zhang CW, Yang J, et al. Insights into endophytic bacterial community structures of seeds among various Oryza sativa L. rice genotypes[J]. Journal of Plant Growth Regulation, 2019, 38(1): 93-102. DOI:10.1007/s00344-018-9812-0 |
| [16] |
Chen BW, Zheng XY, Ye NX, et al. A preliminary study on the distribution of endophytic bacteria in tea plants[J]. Tea in Fujian, 2008, 30(1): 27-29. (in Chinese) 陈百文, 郑晓彦, 叶乃兴, 等. 茶树内生细菌的分布规律初探[J]. 福建茶叶, 2008, 30(1): 27-29. DOI:10.3969/j.issn.1005-2291.2008.01.011 |
| [17] |
Hou B, Xu Z. The origin center of the world cultivated deciduous fruit trees-wild fruit forest in Yili valley, Tianshan mountain, Xinjiang[J]. Arid Zone Research, 2004, 21(4): 406. (in Chinese) 侯博, 许正. 世界栽培落叶果树起源中心——新疆天山伊犁谷地野果林[J]. 干旱区研究, 2004, 21(4): 406. |
| [18] |
Zhang SK, Liao K, Xu L, et al. The characteristics comparison of 14 local apple varieties in Xinjiang[J]. Xinjiang Agricultural Sciences, 2015, 52(8): 1412-1417. (in Chinese) 章世奎, 廖康, 徐乐, 等. 14个新疆地方苹果品种特性比较[J]. 新疆农业科学, 2015, 52(8): 1412-1417. |
| [19] |
Li YN. An investigation and studies on the origin and evolution of Malus domestica Borkh. in the world[J]. Acta Horticulturae Sinica, 1999, 26(4): 213-220. (in Chinese) 李育农. 苹果起源演化的考察研究[J]. 园艺学报, 1999, 26(4): 213-220. DOI:10.3321/j.issn:0513-353X.1999.04.002 |
| [20] |
Zhang J, Ma HL. Analysis of fruit production and import in five central Asian countries[J]. Russian Central Asian & East European Market, 2013(1): 39-44. (in Chinese) 张姣, 马惠兰. 中亚五国水果生产与进口状况分析[J]. 俄罗斯中亚东欧市场, 2013(1): 39-44. DOI:10.3969/j.issn.1671-8453.2013.01.005 |
| [21] |
Ablah N, Du RQ, Zhang SK, et al. Introduction performance of the 3 sweet cherry varieties in southern Xinjiang, China[J]. Tianjin Agricultural Sciences, 2017, 23(2): 95-100. (in Chinese) 阿布来克·尼牙孜, 杜润清, 章世奎, 等. 3个甜樱桃品种在南疆地区的引种表现[J]. 天津农业科学, 2017, 23(2): 95-100. DOI:10.3969/j.issn.1006-6500.2017.02.023 |
| [22] |
Liu XJ, Zhu J, Chu M, et al. Changes in carbon metabolism characteristics and community composition of endophytic bacteria in postharvest Kuqa-grown apricot[J]. Food Science, 2018, 39(22): 141-146. (in Chinese) 刘晓静, 朱静, 楚敏, 等. 库车小白杏采后内生细菌群落代谢特征及结构组成的变化[J]. 食品科学, 2018, 39(22): 141-146. DOI:10.7506/spkx1002-6630-201822022 |
| [23] |
Niu SQ, Long Y, Li HY, et al. Microbial diversity in saline alkali soil from Hexi Corridor analyzed by Illumina MiSeq high-throughput sequencing system[J]. Microbiology China, 2017, 44(9): 2067-2078. (in Chinese) 牛世全, 龙洋, 李海云, 等. 应用Illumina MiSeq高通量测序技术分析河西走廊地区盐碱土壤微生物多样性[J]. 微生物学通报, 2017, 44(9): 2067-2078. |
| [24] |
Guerrero-Zúñiga AL, López-López E, Rodríguez-Tovar AV, et al. Functional diversity of plant endophytes and their role in assisted phytoremediation[A]//Bharagava RN, Saxena G. Bioremediation of Industrial Waste for Environmental Safety: Volume Ⅱ: Biological Agents and Methods for Industrial Waste Management[M]. Singapore: Springer, 2020: 237-255
|
| [25] |
Tamošiūnė I, Andriūnaitė E, Stanys V, et al. Exploring diversity of bacterial endophyte communities using advanced sequencing technology[A]//Kumar V, Prasad R, Kumar M, et al. Microbiome in Plant Health and Disease: Challenges and Opportunities[M]. Singapore: Springer, 2019: 447-481
|
| [26] |
Castelino M, Eyre S, Moat J, et al. Optimisation of methods for bacterial skin microbiome investigation: primer selection and comparison of the 454 versus MiSeq platform[J]. BMC Microbiology, 2017, 17: 23. DOI:10.1186/s12866-017-0927-4 |
| [27] |
Wang F, Men X, Zhang G, et al. Assessment of 16S rRNA gene primers for studying bacterial community structure and function of aging flue-cured tobaccos[J]. AMB Express, 2018, 8: 182. DOI:10.1186/s13568-018-0713-1 |
| [28] |
Liu J, Abdelfattah A, Norelli J, et al. Apple endophytic microbiota of different rootstock/scion combinations suggests a genotype-specific influence[J]. Microbiome, 2018, 6: 18. DOI:10.1186/s40168-018-0403-x |
| [29] |
Song TN, Hong ZG, Cao X, et al. Analysis of andophytic bacteria diversity in six medicinal plants[J]. Journal of Green Science and Technology, 2019(1): 1-4, 8. (in Chinese) 宋庭宁, 洪宗国, 曹夕, 等. 6种药用植物的2个组织的内生细菌多样性初步分析[J]. 绿色科技, 2019(1): 1-4, 8. |
| [30] |
Lee H, Kim DU, Park S, et al. Massilia chloroacetimidivorans sp. nov., a chloroacetamide herbicide-degrading bacterium isolated from soil[J]. Antonie van Leeuwenhoek, 2017, 110(6): 751-758. DOI:10.1007/s10482-017-0845-3 |
| [31] |
Miao Y, Johnson NW, Heck K, et al. Microbial responses to combined oxidation and catalysis treatment of 1, 4-dioxane and co-contaminants in groundwater and soil[J]. Frontiers of Environmental Science & Engineering, 2018, 12(5): 2. |
| [32] |
Yang ED, Cui DX, Wang WY. Research progress on the genus Massilia[J]. Microbiology China, 2019, 46(6): 1537-1548. (in Chinese) 杨恩东, 崔丹曦, 汪维云. 马赛菌属细菌研究进展[J]. 微生物学通报, 2019, 46(6): 1537-1548. |
| [33] |
Qin S, Feng WW, Zhang YJ, et al. Diversity of bacterial microbiota of coastal halophyte Limonium sinense and amelioration of salinity stress damage by symbiotic plant growth-promoting actinobacterium Glutamicibacter halophytocola KLBMP 5180[J]. Applied and Environmental Microbiology, 2018, 84(19): e01533-18. |
| [34] |
Singh D, Geat N, Rajawat MVS, et al. Prospecting endophytes from different Fe or Zn accumulating wheat genotypes for their influence as inoculants on plant growth, yield, and micronutrient content[J]. Annals of Microbiology, 2018, 68(12): 815-833. DOI:10.1007/s13213-018-1388-1 |
| [35] |
Guo XH, Xie CY, Wang LJ, et al. Biodegradation of persistent environmental pollutants by Arthrobacter sp.[J]. Environmental Science and Pollution Research, 2019, 26(9): 8429-8443. DOI:10.1007/s11356-019-04358-0 |
| [36] |
Nassal D, Spohn M, Eltlbany N, et al. Effects of phosphorus-mobilizing bacteria on tomato growth and soil microbial activity[J]. Plant and Soil, 2018, 427(1/2): 17-37. |
| [37] |
Valliappan K, Sun W, Li ZY. Marine actinobacteria associated with marine organisms and their potentials in producing pharmaceutical natural products[J]. Applied Microbiology and Biotechnology, 2014, 98(17): 7365-7377. DOI:10.1007/s00253-014-5954-6 |
| [38] |
Pham NT, Meier-Dinkel A, Höltken AM, et al. Endophytic bacterial communities in in vitro shoot cultures derived from embryonic tissue of hybrid walnut (Juglans ×intermedia)[J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2017, 130(1): 153-165. DOI:10.1007/s11240-017-1211-x |
| [39] |
Monzón GC, Nisenbaum M, Seitz MKH, et al. New findings on aromatic compounds' degradation and their metabolic pathways, the biosurfactant production and motility of the halophilic bacterium Halomonas sp. KHS3[J]. Current Microbiology, 2018, 75(8): 1108-1118. DOI:10.1007/s00284-018-1497-x |
| [40] |
Jung JH, Joe MH, Kim DH, et al. Complete genome sequence of Planococcus sp. PAMC21323 isolated from Antarctica and its metabolic potential to detoxify pollutants[J]. Standards in Genomic Sciences, 2018, 13: 31. DOI:10.1186/s40793-018-0334-y |
| [41] |
Piao CY. Isolation and identification of Longispora urticae sp. nov. and study on secondary metabolite[D]. Harbin: Master's Thesis of Northeast Agricultural University, 2018 (in Chinese) 朴晨宇.放线菌新种Longispora urticae的分离鉴定及次级代谢产物研究[D].哈尔滨: 东北农业大学硕士学位论文, 2018 http://cdmd.cnki.com.cn/Article/CDMD-10224-1018134677.htm |
| [42] |
Gao J, Feng Y, Huang L, et al. Studies on the biological constituents of marine actinomycetes Rubrobacter radiotolerans[J]. Chinese Journal of Marine Drugs, 2016, 35(2): 13-17. (in Chinese) 高捷, 冯瑜, 黄磊, 等. 海洋放线菌Rubrobacter radiotolerans的活性成分研究[J]. 中国海洋药物, 2016, 35(2): 13-17. |
| [43] |
Etesami H, Alikhani HA. Bacillus species as the most promising bacterial biocontrol agents in rhizosphere and endorhiza of plants grown in rotation with each other[J]. European Journal of Plant Pathology, 2018, 150(2): 497-506. DOI:10.1007/s10658-017-1276-8 |
 2020, Vol. 47
2020, Vol. 47




