扩展功能
文章信息
- 周凯强, 李志洪, 覃书漫, 巫新月, 汤千千, 王紫莹, 陈安均, 张志清, 申光辉
- ZHOU Kai-Qiang, LI Zhi-Hong, QIN Shu-Man, WU Xin-Yue, TANG Qian-Qian, WANG Zi-Ying, CHEN An-Jun, ZHANG Zhi-Qing, SHEN Guang-Hui
- 余甘子采后软腐病拮抗菌的筛选、鉴定及其防效
- Identification and biocontrol effect of antagonistic Streptomyces against postharvest Penicillium fruit rot of Phyllanthus emblica L.
- 微生物学通报, 2020, 47(2): 459-468
- Microbiology China, 2020, 47(2): 459-468
- DOI: 10.13344/j.microbiol.china.190359
-
文章历史
- 收稿日期: 2019-04-22
- 接受日期: 2019-05-27
- 网络首发日期: 2019-06-10
余甘子又名牛甘果、油甘果,鲜果酸脆微涩,回味甘甜,作为药食两用的食品资源富含维生素C、氨基酸及超氧化物歧化酶、多酚等成分[1],具有清热凉血,生津止咳,抗氧化抗癌和免疫调节等功效[2],具有良好的加工开发前景。余甘子采收技术落后,采后耐贮性差,在贮藏、运输、加工过程中易受青霉等病原菌侵染而发生腐败变质[3],造成严重的损耗和经济损失。本课题组前期从余甘子腐烂果实中分离并鉴定出一株优势软腐病菌Penicillium choerospondiatis DQ23,该菌致腐能力强,可通过产果胶酶、蛋白酶、纤维素酶等破坏果实细胞壁而迅速导致腐烂现象[3]。青霉是果蔬采后较为普遍的病菌之一,长期以来主要使用化学抑霉剂进行防治,存在残留大,食用安全风险高,极易导致抗药性等弊端。因此,寻找绿色、安全、有效的防控措施对降低余甘子采后贮藏腐损率,保证产品加工安全,减少经济损失具有重要意义。
放线菌种类繁多,代谢功能各异,能产生种类丰富的次级代谢产物,是农业生物防治的重要微生物资源,已经证实其在果蔬防病促生、抗线虫等方面作用明显,在替代化学抑菌剂,减少化学残留和生态环境污染,提高果蔬采后贮藏及食用安全性方面具有较强应用潜力[4-5]。国内外学者已分离获得了对柑橘青霉病菌[6]、番茄灰霉病菌[6]、梨灰霉病菌[7]、香蕉炭疽病菌[8]、草莓灰霉病菌[9]等果蔬采后致腐菌具有较强抑菌活性和良好防治效果的多种放线菌株。目前,拮抗放线菌资源在余甘子果实采后防腐保鲜领域的研究和应用较少,特别是对余甘子采后青霉软腐病害的防治研究鲜见报道。
本研究以余甘子采后软腐病青霉菌为供试菌,筛选具有较强拮抗作用和应用潜力的放线菌菌株,结合菌株形态、生理生化特性和16S rRNA基因序列分析等方法对其进行鉴定,并考察无菌发酵液对余甘子的防腐保鲜效果及对果实贮藏品质的影响,为余甘子采后软腐病菌的生物控制提供依据。
1 材料与方法 1.1 材料余甘子采自福建漳州地区,品种为“粉甘”,挑选无病虫害,色泽均匀,果面整洁,大小接近且无损伤的果实用于实验;拮抗菌株分离土壤为余甘子根系土壤;余甘子软腐病菌P. choerospondiatis DQ23保存于本课题组实验室。
1.2 培养基高氏一号培养基[10]、马铃薯葡萄糖培养基(PDA)[10]、葡萄糖天门冬素培养基[10]、葡萄糖酵母膏琼脂培养基[10]、察氏琼脂培养基[10]、淀粉铵琼脂培养基[10]、燕麦琼脂培养基[11]、淀粉琼脂培养基[11]。
1.3 主要试剂和仪器细菌基因组DNA提取试剂盒、SanPrep柱式DNA凝胶回收试剂盒,成都擎科梓熙生物技术有限公司。电子天平,德国赛多利斯公司;超净工作台,苏净集团苏州安泰空气技术有限公司;智能生化培养箱,上海三发科学仪器有限公司;高速冷冻离心机,赛默飞公司;超纯水系统,MilliPore公司;恒温培养振荡器,上海智城分析仪器制造有限公司;水果糖度计,广州市普析通仪器有限公司;梯度PCR仪和凝胶成像仪,伯乐生命医学产品有限公司。
1.4 方法 1.4.1 拮抗放线菌分离纯化采用平板稀释分离法从土壤样品中分离放线菌。土样用无菌水梯度稀释至10−3、10−4、10−5稀释梯度[11],吸取0.2 mL稀释样品涂布于高氏一号培养基(含80 mg/L重铬酸钾)平板上,28 ℃倒置培养3−5 d。挑取菌落形态不同的放线菌单菌落,使用高氏一号培养基划线纯化3次,纯化菌株接种于高氏一号斜面28 ℃培养5 d,4 ℃保存。
1.4.2 拮抗放线菌初筛采用琼脂块法初筛具有拮抗效果的放线菌菌株。将待筛菌株涂布于高氏一号平板培养基,28 ℃培养7 d后,用无菌打孔器制备直径7.0 mm的含菌琼脂块。将软腐病菌涂布于PDA平板培养基,待筛放线菌琼脂块带菌丝面向上均匀放置于平板培养基中,28 ℃培养3 d,用十字交叉法测量并记录抑菌圈大小,每株待筛放线菌重复3次。
1.4.3 拮抗放线菌复筛(1) 无菌发酵液制备:根据初筛实验结果,选取初筛具有明显拮抗效果的放线菌菌株,接种于高氏一号液体培养基(装液量50 mL/150 mL)中,28 ℃、150 r/min振荡培养7 d,发酵液4 ℃、10 000 r/min离心15 min,上清液经0.45 μm微孔滤膜过滤2次,获得无菌发酵液。
(2) 无菌发酵液抑菌活性测定:采用生长速率法[12],将无菌发酵液与冷却至约55 ℃的PDA培养基按体积比1:4混合均匀后倒平板,获得无菌发酵液体积分数为20%的PDA培养基。将软腐病菌点接于制备好的含20%发酵液PDA培养基平板中央,以相同营养浓度的PDA平板为对照,28 ℃培养3 d后测量各平板上青霉菌落直径。抑菌率(%)= (对照菌落直径−处理菌落直径)/对照菌落直径×100。
1.4.4 拮抗放线菌菌株的鉴定放线菌株的形态特征观察及生理生化特性鉴定参照《链霉菌鉴定手册》[13]方法进行,并与《放线菌的分类和鉴定》[14]中相关菌株特征进行比较。16S rRNA基因序列分析鉴定:采用细菌基因组提取试剂盒提取菌株基因组DNA。采用通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-TACGGCTACCTTGTTACGACTT-3′)进行菌株16S rRNA基因PCR扩增。PCR反应体系(25 μL):2×Taq PCR MasterMix 12.5 μL,引物(10 μmol/L)各1.0 μL,Template DNA 1.0 μL,超纯水补平至25 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 15 min。反应结束后取5 μL反应液用1%琼脂糖凝胶电泳检测,并用SanPrep柱式DNA凝胶回收试剂盒回收目的条带,送交成都擎科伟业生物技术有限公司纯化并测序。利用美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中BLAST程序对所测序列进行比对分析,选择GenBank中与之相似性较高菌种的模式菌株16S rRNA基因序列,利用ClustalX 1.8软件对其进行多重比对,分析菌株SC-15与参比菌株之间的序列相似度,并通过MEGA 5.1软件,选择Kimura 2-parameter模型,构建菌株Neighbor-Joining (N-J)系统发育树[15],并进行Bootstrap分析检验,重复1 000次,并以50%为阈值。
1.4.5 放线菌发酵液对余甘子软腐病的防治效果及对果实品质的影响按1.4.3方法制备无菌发酵液,用无菌生理盐水稀释至体积分数分别为25%、50%、75%、100%的无菌发酵稀释液备用。选择果实大小一致、果面光洁完整的余甘子,随机分成6组,其中4组分别用体积分数25%、50%、75%、100%的无菌发酵液浸果处理1 min,用生理盐水浸果处理作为空白对照组,同时800倍多菌灵稀释液进行浸果处理1 min作为阳性对照组。各组处理果实室温晾干,装入一次性包装盒,每盒10个果实,PE保鲜膜覆盖好,于25±1 ℃,相对湿度90%−95%条件下贮藏。每处理组重复30盒,其中15盒用于观察统计果实腐烂情况,另外15盒中每隔24 h随机选取1盒测定其他指标。
1.4.6 果实腐烂率和腐烂指数测定各处理组每隔24 h观察果实腐烂情况,将余甘子果实腐烂率按照腐烂面积占果面比例大小划分为5级:0级,无腐烂;1级,腐烂面积≤10%;2级,腐烂面积10%−30%;3级,腐烂面积30%−50%;4级,腐烂面积 > 50%。
腐烂率(%)=发病果数/总果数×100;
腐烂指数(%)=∑(腐烂级别×该级别果数)/最高级×总果数×100。
1.4.7 余甘子果实品质指标测定余甘子果实称重后,添加2倍质量的蒸馏水,加入石英砂用研钵进行研磨,待研磨充分后取2.0 mL加入离心管中,10 000 r/min离心5 min,取上清液用水果糖度计测定可溶性固形物。取各组处理余甘子,加入10倍质量蒸馏水,充分研磨后4 000 r/min离心10 min,取10 mL上清液,采用NaOH溶液滴定法测定可滴定酸(以柠檬酸计)。
1.5 数据处理采用Origin 9.0软件进行各处理组数据结果的平均值、标准偏差及方差分析(analysis of variance,ANOVA),采用Duncan’s新复极差法进行不同处理组结果差异显著性分析[16]。
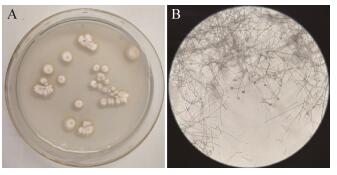
2 结果与分析 2.1 拮抗放线菌株的分离和筛选采用稀释平板涂布法共分离并纯化获得了68株放线菌菌株。采用琼脂块法初筛获得10株对P. choerospondiatis DQ23有明显拮抗活性的放线菌菌株,其中8株放线菌的抑菌圈直径大于14 mm (表 1)。菌株SC-15琼脂块的抑菌作用最强,抑菌圈直径达到18.70 mm,且抑菌圈最清楚(图 1A)。采用生长速率法对8株较强抑菌活性菌株进行复筛。由表 1可见,各菌株发酵液对P. choerospondiatis DQ23均有不同程度的抑菌活性,其中添加体积分数20%的SC-15无菌发酵液的抑菌率最高,为87.8%。SC-1、SC-8、SC-20菌株琼脂块的抑菌作用较强,但复筛结果中其发酵液的抑菌活性较弱,可能与其抑菌活性代谢产物的合成需要更多氧气有关。
| 菌株 Strain |
抑菌圈直径 Inhibition zone diameter (mm) |
抑菌圈清晰度 Inhibition zone clarity |
抑菌率 Inhibition rate (%) |
| SC-1 | 17.25±0.22b | −− | 31.3±1.06f |
| SC-5 | 18.60±0.05a | + | 84.1±0.25b |
| SC-6 | 14.20±0.10f | ++ | 78.3±0.55d |
| SC-7 | 14.75±0.17d | + | 34.1±0.83e |
| SC-8 | 16.50±0.13c | ++ | 19.6±0.63h |
| SC-12 | 15.75±0.18d | + | 80.9±0.96c |
| SC-15 | 18.70±0.06a | +++ | 87.8±0.37a |
| SC-20 | 17.30±0.19b | + | 23.3±0.92g |
| 注:表中同列数据后不同小写字母表示在P < 0.05水平差异显著. +++:特别清晰;++:清晰;+:较清晰;−:较模糊;−−:模糊. Note: Different lowercase letters in the same column indicate significant differences at P < 0.05 level. +++: Particularly clear; ++: Clear; +: Clearer; −: More fuzzy; −−: Blur. | |||

|
| 图 1 菌株SC-15对P. choerospondiatis DQ23的抑制效果 Figure 1 Inhibition effect of strain SC-15 against P. choerospondiatis DQ23 注:A:菌株SC-15琼脂块的抑制效果;B:含20%无菌发酵液的PDA培养基上DQ23菌落;C:PDA培养基上DQ23菌落. Note: A: Inhibition effect of strain SC-15 agar disk on P. choerospondiatis DQ23; B: Colony on PDA added with 20% cell-free fermentation broth; C: Colony on PDA medium. |
|
|
SC-15在高氏一号培养基中生长快速,呈现扁平状,气生菌丝丰富,由白色转灰粉色;基内菌丝由白色转乳脂色至浅褐色,可溶性色素为浅褐色(图 2A)。SC-15在显微形态下丝直,柔曲,孢子长圆形或柱形,表面光滑(图 2B)。菌株SC-15的生理生化特性见表 2。
|
| 图 2 拮抗放线菌SC-15菌落培养特征和气生菌丝 Figure 2 The colony and aerial mycelia characteristic of antagonistic actinomycetes strain SC-15 注:A:高氏一号培养基上菌落特征; B:气生菌丝(400×). Note: A: Colony characteristics on Gauze's agar; B: Aerial hyphae (400×). |
|
|
| 测定项目 Items |
结果 Result |
| 纤维素利用 Cellulase |
+ |
| 牛奶固化胨化 Milk coagulation |
− |
| 淀粉水解 Amyloylsis |
+ |
| 产硫化氢 Hydrogen sulfide |
+ |
| 明胶液化 Gelatin liquefaction |
+ |
| 过氧化氢酶 Catalase |
+ |
| 葡萄糖 Glucose |
+ |
| 蔗糖 Sucrose |
− |
| α-乳糖 α-lactose |
− |
| D-木糖 D-xylose |
− |
| D-麦芽糖 D-maltose |
+ |
| D-果糖 D-fructose |
+ |
| 注:+:阳性;−:阴性. Note: +: Positive; −: Negative. | |
从培养4 d的SC-15新鲜菌体中提取基因组DNA,采用通用引物(27F和1492R)进行PCR扩增,琼脂糖凝胶电泳检测PCR产物。结果表明,菌株16S rRNA基因片段长度1 357 bp,GenBank登录号MK951694。经NCBI数据库BLAST工具比对分析发现,菌株SC-15的16S rRNA基因序列与维及尼链霉菌Streptomyces virginia NBRC 3729 (GenBank登录号NR_112496)和肉桂地链霉菌Streptomyces cinnafoliaNBRC 15873 (GenBank登录号NR_041194)相似度达到99%以上。
选取13株相似度较高的链霉菌属不同种模式菌株的16S rRNA基因序列与SC-15构建系统发育树,结果显示菌株SC-15与肉桂地链霉菌和维及尼链霉菌2种不同链霉菌的模式聚在同一分支(图 3),说明这2种链霉菌在进化过程中关系密切,但利用16S rRNA基因序列分析不能将菌株SC-15鉴定到种。因此,结合菌株培养特征(表 3)、生理生化特性(表 2)与《链霉菌鉴定手册》中这2个种的特征描述进行比较,发现菌株SC-15在葡萄糖天门冬素培养基上无气生菌丝,基内菌丝呈浅褐色;在高氏一号培养基培养7 d后气生菌丝呈灰粉色;不利用蔗糖和木糖。这些与肉桂地链霉菌不符,而维及尼链霉菌其他菌落特征和生理生化特性与菌株SC-15相符,因此初步鉴定菌株SC-15为维及尼链霉菌(Streptomyces virginia)。

|
| 图 3 菌株SC-15基于16S rRNA基因序列构建的系统发育树 Figure 3 Phylogenetic tree of strain SC-15 based on 16S rRNA gene sequence 注:分支处数值表示Bootstrap值;括号内数字表示序列GenBank登录号;标尺为进化距离. Note: Numbers at branch nodes present bootstrap value; The GenBank accession number of aligned sequences are shown in the brackers; Bar: Nucleotide divergence. |
|
|
| 培养基 Medium |
气生菌丝 Aerial hyphae |
基内菌丝 Substrate mycelium |
可溶性色素 Soluble pigment |
生长状况 Growth status |
| 高氏一号琼脂Gauze’s agar | 灰粉色Gray pink | 浅褐色Light brown | 浅褐色Light brown | +++ |
| 葡萄糖天门冬素Glucose aspartate | 无None | 浅褐色Light brown | 无None | ++ |
| 葡萄糖酵母膏琼脂Glucose yeast agar | 无None | 褐色Brown | 无None | +++ |
| 察氏琼脂Czapek’ medium | 灰白色Grayish white | 乳脂色Cream color | 无None | +++ |
| 淀粉铵琼脂Ammonium starch agar | 白色White | 褐色Brown | 浅褐色Light brown | + |
| 燕麦琼脂Oatmeal agar | 薰衣草色Lavender | 金褐色Golden brown | 淡黄色Light yellow | +++ |
| 淀粉琼脂Starch agar | 粉色Pink | 无色None | 淡黄色Light yellow | +++ |
| 注:+++:生长迅速;++:生长较快;+:生长较慢. Note: +++: Grows faster; ++: Grows fast; +: Grows slower. | ||||
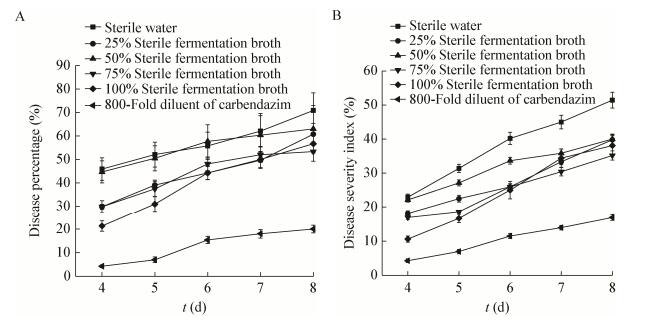
在25 ℃贮藏第1−3天,各处理余甘子果实均未见明显的软腐现象,果实硬度、色泽无明显变化。由图 4A可知,25 ℃贮藏第4−8天过程中,各处理组余甘子的腐烂率均呈现上升趋势,无菌水(阴性)对照组第8天腐烂率已经达到70.86%。贮藏第4−8天,不同体积分数的菌株SC-15无菌发酵液浸果处理余甘子果实腐烂率均低于无菌水处理对照组,但防效均不及800倍多菌灵处理组(其腐烂率为4.28%−20.0%)。贮藏至第8天,75%无菌发酵液处理效果最好,果实腐烂率为53.3%,较无菌水(阴性)对照组降低24.7%。
|
| 图 4 菌株SC-15无菌发酵液对余甘子腐烂率(A)和腐烂指数(B)的影响 Figure 4 Effect of strain SC-15 sterile fermentation broth on disease percentage (A) and disease severity index (B) of P. emblica |
|
|
由图 4B可见,在25 ℃贮藏过程中,各组余甘子的腐烂指数均呈现上升趋势,阴性对照组第8天腐烂指数已经达到51.4%。贮藏期第4−8天,不同体积分数菌株SC-15无菌发酵液处理余甘子果实腐烂指数均低于无菌水(阴性)对照组,其中75%无菌发酵液效果最好(效果见图 5),贮藏至第8天果实腐烂指数为35.2%,较无菌水(阴性)对照组降低31.6%。

|
| 图 5 菌株SC-15无菌发酵液对余甘子软腐病的防治效果 Figure 5 Control effect of strain SC-15 sterile fermentation broth on soft rot of P. emblica 注:A−C:分别为第4、5、6天无菌水处理果实;D–F:分别为第4、5、6天75%体积分数发酵液浸果处理果实. Note: A−C: Fruits treated in sterile water on days 4, 5 and 6 respectively; D–F: Fruits treated by 75% cell-free fermentation broth on days 4, 5 and 6 respectively. |
|
|
青霉菌侵染果实后,会利用可溶性营养物质进行繁殖生长,导致果实品质降低。由图 6A可知,在25 ℃贮藏条件下,不同处理果实的可溶性固形物含量均呈先上升后下降的趋势。贮藏前期,随着青霉菌的侵染,通过分泌细胞壁水解酶类,导致果肉细胞内容物泄露,固形物含量增加;而在贮藏后期,病原菌不断繁殖代谢,消耗果实中各种可溶性营养物质,造成固形物含量的快速降低。无菌水(阴性)处理对照组果实的可溶性固形物下降的时间最早,在贮藏第6天迅速下降至7%以下,至第8天时仅为4.9%。发酵液及多菌灵处理果实可溶性固形物含量的下降开始时间较晚,表明发酵液处理可延缓青霉侵染导致的果实固形物水解降低,其中75%无菌发酵液处理组优于其他体积分数发酵液处理组,贮藏至第8天果实可溶性固形物为4.8%。

|
| 图 6 SC-15无菌发酵液对余甘子可溶性固形物(A)和可滴定酸(B)的影响 Figure 6 Effect of SC-15 cell-free fermentation broth on soluble solids (A) and titratable acid (B) of P. emblica L. stored at 25 ℃ |
|
|
余甘子果实呈高酸性,一般pH值在3.0以下,富含各种有机酸,可滴定酸含量也是评价果实品质的重要指标。由图 6B可以看出,在25 ℃贮藏条件下,各处理组果实的可滴定酸含量均呈持续下降趋势,无菌水(阴性)对照组可滴定酸含量降低最快,第8天时较第4天下降了57%,而发酵液和多菌灵处理果实可滴定酸含量的降低速度较缓慢,表明发酵液处理也可延缓果实可滴定酸的减少速度。贮藏期第5−8天,不同体积分数无菌发酵液处理组的果实可滴定酸均高于无菌水处理对照组,其中75%无菌发酵液处理组贮藏至第8天时,可滴定酸含量为6.25 mg/g,较无菌水(阴性)对照组高26.7%。
3 讨论与结论由青霉菌侵染引起的果实腐烂是一种危害较大,较为普遍的一种果蔬采后病害。余甘子采后贮藏过程易受到青霉P. choerospondiatis DQ23的侵染而快速软腐霉变,丧失其商品价值,同时存在产生真菌毒素等影响食用安全性的次生代谢产物。目前生产中仍然过度依赖抑霉类化学杀菌剂,长期使用不仅会造成农残污染,危害鲜果和加工产品的质量安全,甚至会诱导致腐病菌产生抗药性,使化学药剂防效大大降低。放线菌种类和数量多,次生代谢能力强,产物丰富,抑菌作用机制多样,易保存培养,绝大多数无致病性,环境兼容性强,在农业生产病害防治领域应用潜力巨大。近年来,果蔬采后病害拮抗放线菌的筛选和应用逐渐成为寻找高效、绿色、安全新防控手段的重要途径。范延辉等通过纯培养法从黄河三角洲贝壳堤岛贝沙沉积物中分离获得菌株BK绛红北里孢菌,对冬枣轮纹病菌丝生长抑制率达72.30%,发酵液对离体冬枣果实轮纹病防效可达73.72%,与50%多菌灵的防效相当[17];朱海云等筛选获得了一株肉桂地链霉菌M109,其对猕猴桃细菌性溃疡病的防效可达72.1%−84.6%[18];赵娟等筛选获得了一株唐德链霉菌XJ93,其对草莓灰霉病菌的抑菌圈直径为20.67 mm[19]。目前国内外已有不少有关柑橘等水果青霉病害拮抗放线菌的相关研究报道[20-23],但鲜见关于余甘子果实贮藏软腐病菌P. choerospondiatis拮抗放线菌的筛选报道。本实验从余甘子果树根际土壤分离获得了多株对余甘子果实软腐病菌P. choerospondiatis DQ23具有良好拮抗作用的放线菌,其中菌株SC-15拮抗活性最强,20%无菌发酵液对青霉菌丝生长的抑制率高达87.7%,具有较强的应用潜力。
依据菌落形态特征、生理生化特性,结合16S rRNA基因序列分析,初步将菌株SC-15鉴定为维及尼链霉菌(S. virginiae)。维及尼链霉菌主要产生维吉尼亚霉素(virginiamycin)抗生素,已经作为一种动物专用饲料添加剂使用,具有不易产生抗药性的优势[24]。孙莉等[25]分离获得了一株S. virginiae X54,其对黄瓜疫霉菌具有良好的拮抗作用,5倍稀释发酵液的抑菌率可达70%以上。目前关于维吉尼链霉菌对P. choerospondiatis引起的余甘子果实软腐病的防治鲜有报道。本研究获得的拮抗放线菌SC-15发酵液具有一定的应用价值,虽然防效不及化学类杀菌剂,但作为具有应用潜力的生防菌株,具有环境污染小、不易产生抗性的优势。此外,该菌株在食品安全、人类健康和环境影响等方面的安全性有待进一步研究评价。
本实验采用刺伤接种结合浸果处理法,考察了不同体积分数的菌株SC-15无菌发酵液的应用效果,发现不同体积分数的发酵液均对余甘子软腐病的发生有一定的防治效果,但防效与800倍多菌灵液还存在一定差距。不同体积分数发酵液处理中,75%发酵液浸果处理的防腐保鲜效果最好,发酵液原液处理的效果稍差,可能是由于经过滤法除菌获得的发酵液中残留有菌体代谢的其他酶类并未灭活,加快了果实细胞壁的降解破坏,导致防效不佳。本研究仅对该拮抗放线菌防效进行初步评价,所使用的发酵培养基及发酵条件并未经过筛选和优化。因此,还需要进一步探讨无菌发酵液的处理和应用方式,以及对发酵培养条件进一步优化[26-27],以提高实际应用效果,控制发酵生产成本。
| [1] |
Liu YZ, Li HX, Xu LJ, et al. Modern research overview and application prospect analysis on Phyllanthus emblica both as diet and medicine[J]. Chinese Traditional and Herbal Drugs, 2013, 44(12): 1700-1706. (in Chinese) 刘延泽, 李海霞, 许利嘉, 等. 药食兼用余甘子的现代研究概述及应用前景分析[J]. 中草药, 2013, 44(12): 1700-1706. |
| [2] |
Kumar A, Singh B, Singh K. Functional characterization of flavanone 3-hydroxylase gene from Phyllanthus emblica (L.)[J]. Journal of Plant Biochemistry and Biotechnology, 2015, 24(4): 453-460. DOI:10.1007/s13562-014-0296-0 |
| [3] |
Wu Y, Zhou ZJ, Qin XY, et al. Identification of the pathogen causing fruit rot of postharvest Phyllanthus emblica and its cell wall degrading enzyme activity[J]. Microbiology China, 2019, 46(4): 760-769. (in Chinese) 吴月, 周志杰, 覃小艳, 等. 余甘子采后软腐病菌的分离鉴定及其细胞壁水解酶活性[J]. 微生物学通报, 2019, 46(4): 760-769. |
| [4] |
Ara I. Antagonism of actinomycete against Pestalotiopsis mangiferae, causal agent of mango brown rot in post harvest storage[J]. African Journal of Microbiology Research, 2012, 6(8): 1782-1789. |
| [5] |
Zhang QM, Yong DJ, Zhang Y, et al. Streptomyces rochei A-1 induces resistance and defense-related responses against Botryosphaeria dothidea in apple fruit during storage[J]. Postharvest Biology and Technology, 2016, 115: 30-37. DOI:10.1016/j.postharvbio.2015.12.013 |
| [6] |
Li QL. Identification, biocontrol potential and mode of action of Streptomyces sp. JK-1[D]. Wuhan: Doctoral Dissertation of Huazhong Agricultural University, 2011 (in Chinese) 李其利.链霉菌JK-1的鉴定及其防病潜能和防病机制的研究[D].武汉: 华中农业大学博士学位论文, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10504-1011405141.htm |
| [7] |
Sun PP, Jia XH, Cui JC, et al. Selection, identification and characterization of actinomyces L-30 for the biocontrol of pear gray mold[J]. Acta Horticulturae Sinica, 2016, 43(12): 2335-2346. (in Chinese) 孙平平, 贾晓辉, 崔建潮, 等. 梨灰霉病拮抗放线菌L-30的筛选、鉴定及作用机制研究[J]. 园艺学报, 2016, 43(12): 2335-2346. |
| [8] |
Zhang YF, Gu LS, Liu ZQ, et al. Identification of a biocontrol actinomycete strain CY-14 and the effect of its fermentation broth on Colletotrichum musae[J]. Chinese Journal of Pesticide Science, 2018, 20(5): 634-642. (in Chinese) 张月凤, 辜柳霜, 柳志强, 等. 生防放线菌CY-14的鉴定及其发酵液对香蕉炭疽病的防治效果[J]. 农药学学报, 2018, 20(5): 634-642. |
| [9] |
Shen GH, Zhang ZQ, Qin W, et al. Identification of antagonistic actinomyces strain against Botrytis cinerea and effect of its fermentation filtrate on preservation quality of strawberry[J]. Food Science, 2015, 36(21): 185-190. (in Chinese) 申光辉, 张志清, 秦文, 等. 灰霉病菌拮抗放线菌的筛选鉴定及对草莓的防腐保鲜效果[J]. 食品科学, 2015, 36(21): 185-190. DOI:10.7506/spkx1002-6630-201521035 |
| [10] |
Li PQ, Feng BZ, Li XX, et al. Screening and identification of antagonistic actinomycete LA-5 against Botrytis cinerea[J]. Chinese Journal of Applied Ecology, 2018, 29(12): 4172-4180. (in Chinese) 李培谦, 冯宝珍, 李新秀, 等. 番茄灰霉菌拮抗放线菌LA-5的筛选及鉴定[J]. 应用生态学报, 2018, 29(12): 4172-4180. |
| [11] |
Li W, Xiao XO, Li K, et al. Screening, identification and fermentation optimization of an antagonistic actinomycete strain XL-6 against Ralstonia solanacearum[J]. Microbiology China, 2018, 45(2): 357-367. (in Chinese) 李威, 肖熙鸥, 李可, 等. 茄子青枯病拮抗放线菌XL-6的筛选、鉴定及发酵条件优化[J]. 微生物学通报, 2018, 45(2): 357-367. |
| [12] |
He HW, Chen B, Han LR, et al. Screening and antagonistic activity of actinomycetes against Fusarium oxysporum f. sp. lycopersici[J]. Journal of Hebei Agricultural University, 2018, 41(4): 29-33. (in Chinese) 贺宏伟, 陈彬, 韩立荣, 等. 番茄枯萎病菌拮抗放线菌的筛选及其抑菌活性研究[J]. 河北农业大学学报, 2018, 41(4): 29-33. |
| [13] |
Actinomycetes Classification Group, Institute of Microbiology, Chinese Academy of Sciences. Streptomyces Identification Handbook[M]. Beijing: Science Press, 1975: 13-16, 160. (in Chinese) 中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M]. 北京: 科学出版社, 1975: 13-16, 160. |
| [14] |
Yan XC. The Classification and Identification of Actinomycetes[M]. Beijing: Science Press, 1992: 438, 966. (in Chinese) 阎逊初. 放线菌的分类和鉴定[M]. 北京: 科学出版社, 1992: 438, 966. |
| [15] |
Jiao JH, Huang DY, Wu WQ, et al. Identification and optimization of fermentation medium of antagonistic actinomycete 30702 against yam anthracnose[J]. Chinese Journal of Tropical Crops, 2016, 37(4): 775-783. (in Chinese) 焦敬华, 黄东益, 吴文嫱, 等. 山药炭疽病菌拮抗放线菌30702菌株的初步鉴定及发酵培养基优化[J]. 热带作物学报, 2016, 37(4): 775-783. DOI:10.3969/j.issn.1000-2561.2016.04.020 |
| [16] |
Errakhi R, Lebrihi A, Barakate M. In vitro and in vivo antagonism of actinomycetes isolated from Moroccan rhizospherical soils against Sclerotium rolfsii: a causal agent of root rot on sugar beet (Beta vulgaris L.)[J]. Journal of Applied Microbiology, 2009, 107(2): 672-681. DOI:10.1111/j.1365-2672.2009.04232.x |
| [17] |
Fan YH, Wang J. Screening, identification, and inhibitory effect of antagonistic actinomycetes against Macrophoma kuwatsukai causing winter jujube ring grain disease[J]. Biotechnology Bulletin, 2017, 33(7): 114-119. (in Chinese) 范延辉, 王君. 冬枣轮纹病菌拮抗放线菌的筛选、鉴定及其抑制效果[J]. 生物技术通报, 2017, 33(7): 114-119. |
| [18] |
Zhu HY, Ma Y, Ke Y, et al. Screening, identification and controlling effects of biocontrol strain against Chinese gooseberry or Kiwi fruit bacterial canker[J]. Journal of Microbiology, 2016, 36(5): 90-96. (in Chinese) 朱海云, 马瑜, 柯杨, 等. 猕猴桃细菌性溃疡病生防菌的筛选、鉴定及其防效初探[J]. 微生物学杂志, 2016, 36(5): 90-96. |
| [19] |
Zhao J, Jia WG, Liu WC, et al. Screening of antagonistic actinomycete against strawberry grey mould and activity determination of its fermentation broth[J]. Northern Horticulture, 2018, 42(4): 59-65. (in Chinese) 赵娟, 贾卫国, 刘伟成, 等. 草莓灰霉病菌拮抗放线菌的筛选及活性测定[J]. 北方园艺, 2018, 42(4): 59-65. |
| [20] |
Lu LM, Du DC, Cheng BP, et al. Isolation and identification of marine actinomyces A3202 and its control efficacy against postharvest citrus diseases[J]. Acta Phytophylacica Sinica, 2014, 41(3): 327-334. (in Chinese) 鹿连明, 杜丹超, 程保平, 等. 海洋放线菌A3202的分离鉴定及其对柑橘采后病害的防效[J]. 植物保护学报, 2014, 41(3): 327-334. |
| [21] |
Peng WF, Wu ZM, Chen W, et al. Isolation and identification of Streptomyces triostinicus C2 antagonizing on a variety of plant pathogenic fungi[J]. Biotechnology Bulletin, 2016, 32(7): 106-111. (in Chinese) 彭卫福, 吴志明, 陈未, 等. 拮抗多种植物病原真菌Streptomyces triostinicus C2的分离与鉴定[J]. 生物技术通报, 2016, 32(7): 106-111. |
| [22] |
Wu ZM, Lu CJ, Zhang SW, et al. Inhibitory activities of metabolite produced by Streptomyces sp. N2 and its efficacy on fruit storage[J]. Southwest China Journal of Agricultural Sciences, 2018, 31(7): 1393-1398. (in Chinese) 吴志明, 鹿承建, 章帅文, 等. 新型Streptomyces sp. N2代谢粗提物的抑菌活性及其水果保鲜初探[J]. 西南农业学报, 2018, 31(7): 1393-1398. |
| [23] |
Maldonado MC, Orosco CE, Gordillo MA, et al. In vivo and in vitro antagonism of Streptomyces sp. RO3 against Penicillium digitatum and Geotrichum candidum[J]. African Journal of Microbiology Research, 2010, 4(22): 2451-2456. |
| [24] |
Tong QQ. High-throughput screening and genome shuffling of Streptomyces virginiae for improved virginiamycin production[D]. Hefei: Doctoral Dissertation of University of Science and Technology of China, 2018 (in Chinese) 仝倩倩.高通量筛选及基因组重排选育维吉尼亚霉素高产菌[D].合肥: 中国科学技术大学博士学位论文, 2018 http://cdmd.cnki.com.cn/Article/CDMD-10358-1018098405.htm |
| [25] |
Sun L, Yi TY, Su ZP, et al. Screening and identification of bio-control agents against Phytophthora melonis[J]. China Vegetables, 2015(6): 23-27. (in Chinese) 孙莉, 易图永, 粟智平, 等. 黄瓜疫霉菌生防菌的筛选及鉴定[J]. 中国蔬菜, 2015(6): 23-27. DOI:10.3969/j.issn.1000-6346.2015.06.008 |
| [26] |
Sylla J, Alsanius BW, Krüger E, et al. Control of Botrytis cinerea in strawberries by biological control agents applied as single or combined treatments[J]. European Journal of Plant Pathology, 2015, 143(3): 461-471. DOI:10.1007/s10658-015-0698-4 |
| [27] |
Yan JF, Zhao BX, Liu Q, et al. Optimization of Streptomyces combination ST-2 fermentation conditions and control effect on cucumber Fusarium wilt[J]. Chinese Journal of Biological Control, 2016, 32(4): 531-538. (in Chinese) 闫建芳, 赵柏霞, 刘秋, 等. 链霉菌组合ST-2发酵条件优化及对黄瓜枯萎病的防治效果[J]. 中国生物防治学报, 2016, 32(4): 531-538. |
 2020, Vol. 47
2020, Vol. 47




