扩展功能
文章信息
- 李宁杰, 兰琪, 陈中维, 刘洁, 吴磊, 王敦球, 张浩, 黄小霞, 潘莉, 陈一聪, 覃业维
- LI Ning-Jie, LAN Qi, CHEN Zhong-Wei, LIU Jie, WU Lei, WANG Dun-Qiu, ZHANG Hao, HUANG Xiao-Xia, PAN Li, CHEN Yi-Cong, QIN Ye-Wei
- 黄孢原毛平革菌BKMF-1767产絮凝剂PCF-1767的絮凝特性及其机理解析
- Flocculation characteristics and mechanism of flocculant PCF-1767 produced by Phanerochaete chrysosporium BKMF-1767
- 微生物学通报, 2020, 47(2): 431-439
- Microbiology China, 2020, 47(2): 431-439
- DOI: 10.13344/j.microbiol.china.190375
-
文章历史
- 收稿日期: 2019-04-28
- 接受日期: 2019-09-03
- 网络首发日期: 2019-10-10
2. 桂林理工大学广西环境污染控制理论与技术重点实验室 广西 桂林 541004
2. Guangxi Key Laboratory of Environmental Pollution Control Theory and Technology, Guilin University of Technology, Guilin, Guangxi 541004, China
在污水处理中,絮凝剂是重要的药剂。传统絮凝剂如聚合氯化铝(poly aluminum chloride,PAC)和聚丙烯酰胺(polyacrylamide,PAM)已被广泛应用,然而在这些絮凝剂的使用过程中会产生铝离子等重金属离子的残留或者生成丙烯酰胺单体,这些物质均会对生态环境和人体健康造成严重的危害[1]。微生物絮凝剂(microbial flocculants,MBF)是一类由微生物代谢产生的具有絮凝活性的天然有机高分子物质,主要成分有糖蛋白、多糖、蛋白质、DNA等,有些微生物菌体自身也可作为微生物絮凝剂[2],由于微生物絮凝剂具有安全、高效、无毒、可生物降解、无二次污染等特点而使其在水处理中显示出更多优势[3]。絮凝剂的有效絮凝浓度直接影响微生物絮凝剂的生产成本,目前报道的微生物絮凝剂的有效絮凝浓度范围为0.1–90 mg/L[4]。我们仍然需要继续寻找一些更高效、有效絮凝浓度更小的微生物絮凝剂。
微生物絮凝剂往往是混合物,对其中的絮凝活性组分及其絮凝机理进行深入探讨对微生物絮凝剂在实际工程中的应用具有重要意义[5]。研究微生物絮凝剂的絮凝活性及其有效成分,最大程度保证数据的准确性是前提。目前微生物絮凝剂的研究多是使用混合的培养液进行培养[6],而培养液中多含有Fe3+、Ca2+、Mg2+等离子,这些无机离子本身就具有一定的絮凝活性[7]{顾美英, 2014 #1;姜彬慧, 2014 #13},这会对其中的有效絮凝成分的作用分析产生干扰,因此本实验使用3 500 Da透析袋透析培养液得到纯化的絮凝剂,使实验结果更加准确。
购买自中国典型培养物保藏中心的黄孢原毛平革菌BKMF-1767,经初步实验发现其产物具有较高的絮凝活性。黄孢原毛平革菌是白腐真菌中最具代表性的一种[8],目前关于黄孢原毛平革菌的研究多在对污染物的降解[9]、重金属的吸附去除方面[10],对其产物的具体絮凝特性及机理的研究未见详细报道。本文研究黄孢原毛平革菌BKMF-1767的胞外多糖的絮凝活性及其絮凝特性,对多糖的结构和分子量进行分析,探究其絮凝机理。
1 材料与方法 1.1 主要试剂和仪器碘甲烷、三氟乙酸,山东西亚化学工业有限公司;三氯甲烷、硫酸、无水氯化钙等,西陇科学股份有限公司;超细高岭土(≤2.5 μm)、葡萄糖,上海麦克林生化科技有限公司。
气相色谱质谱联用仪,PerkinElmer公司;冷冻真空干燥器,北京博医康实验仪器有限公司;紫外可见光分光光度计,上海元析仪器有限公司;Zeta电位仪,马尔文帕纳科公司;恒温立式培养箱,上海天呈实验仪器制造有限公司。
1.2 菌种的培养实验所用菌种购买自中国典型培养物保藏中心的黄孢原毛平革菌(Phanerochaete chrysosporium) BKMF-1767 (CCTCC AF96007)。培养采用微量元素液体培养基(g/L):KH2PO4 2.000,CaCl2 0.100,MgSO4 0.500,FeSO4·7H2O 0.115,MnSO4·H2O 0.112,ZnSO4·7H2O 0.089,CuSO4·5H2O 0.050,维生素B1 0.001,酒石酸铵0.206,葡萄糖10.000。以上药品溶解于pH 4.5的酒石酸缓冲液。
0.12 MPa灭菌后的微量元素培养液,接种孢子悬液。悬液中孢子浓度数量级为106个/mL[11]。接种后的三角烧瓶置于30 ℃、180 r/min进行培养。
1.3 絮凝剂的提取通过高速离心机分离菌球和培养液(常温,4 000 r/min,5 min),培养液装入3 500 Da的透析袋中用去离子水透析5 d,每天换水5次,透析后的溶液在4 ℃、10 000 r/min下离心20 min,取上清液作为絮凝剂,将其命名为Phanerochaete chrysosporium flocculant-1767 (PCF-1767)。
絮凝剂溶液中多糖、蛋白质含量分别用蒽酮-硫酸法和考马斯亮蓝法进行测定。
1.4 絮凝实验在六联搅拌混凝器上进行高岭土(2.5 μm)絮凝实验,在250 mL的烧杯中配制最终体积为200 mL的絮凝实验体系,加入PCF-1767后400 r/min快速搅拌1 min,40 r/min慢速搅拌3 min,静置10 min后取上清液在波长为550 nm下测定吸光值,实验中使用CaCl2作为助凝剂,不加絮凝剂的实验体系作为对照组,设置3组平行。絮凝效率计算公式为:
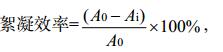
|
其中,A0表示对照组上清液的OD550,Ai表示加入培养液絮凝之后上清液的OD550值。
分别研究培养时间、絮凝剂浓度、pH、Ca2+浓度、高岭土浓度和温度对絮凝效率的影响,以及对絮凝剂的热稳定性进行研究。
培养时间范围:分别取培养5–12 d的培养液进行絮凝剂提取。絮凝体系中PCF-1767 (多糖)浓度为1 mg/L,高岭土浓度为3 g/L,CaCl2浓度为7.5 mmol/L,自然pH。
絮凝剂浓度范围:培养7 d后提取得到的絮凝剂(以下简称7 d絮凝剂),浓度为0.6–2 mg/L,高岭土浓度3 g/L,CaCl2浓度为7.5 mmol/L,自然pH。
pH范围:用HCl溶液或NaOH溶液将高岭土溶液的初始pH值调整至1.0–12.0,7 d絮凝剂浓度1 mg/L,高岭土浓度3 g/L,CaCl2浓度为7.5 mmol/L。
CaCl2浓度范围:CaCl2初始浓度为0–9 mmol/L,7 d絮凝剂浓度1 mg/L,高岭土浓度3 g/L,自然pH。
高岭土浓度范围:高岭土溶液初始浓度为1–6 g/L,7 d絮凝剂浓度1 mg/L,CaCl2浓度为7.5 mmol/L,自然pH。
温度范围:温度为30–90 ℃的高岭土溶液,浓度为3 g/L,7 d絮凝剂浓度1 mg/L,CaCl2浓度为7.5 mmol/L,自然pH。
热稳定性:将7 d絮凝剂分别在20−100 ℃水浴中加热3 h,恢复常温后再测定其絮凝活性。
1.5 GC-MS分析絮凝剂经冷冻真空干燥3 d得多糖冻干样,采用李波等[12]研究中的方法,取10 mg多糖,经水解、还原、乙酰化处理进行多糖中单糖种类的分析;同样另取10 mg多糖,先后经甲基化、水解、还原、乙酰化处理进行多糖中单糖苷连接方式的分析。
GC-MS条件[13]:气相色谱质谱联用仪,色谱柱为Elite-5MS石英毛细柱(30 m×0.25 mm);载气为氦气,流速1 mL/min;进样口温度为250 ℃,进样量1 μL,分流比20:1;柱箱起始温度140 ℃,以8 ℃/min升至250 ℃,保留15 min。色谱与质谱接口温度为250 ℃,EI离子源,电子轰击能量70 eV,扫描质量范围为40–550 amu,延迟时间设置为5 min。
1.6 分子量测定分子量采用凝胶渗透色谱与多角度激光光散射仪测定(委托北京市理化分析测试中心测定)。
1.7 絮凝机理分析 1.7.1 Zeta电位测定利用Zeta电位仪测定高岭土溶液的Zeta电位,样品制备好后立即测定。
1.7.2 絮体形态观察高岭土与絮凝剂混合均匀,用玻璃棒蘸取到载玻片上,盖上盖玻片后放到显微镜40倍下观察絮体形态,并拍摄照片。
2 结果与讨论 2.1 培养液中多糖含量的变化经测定,黄孢原毛平革菌BKMF-1767各时段得到的絮凝剂溶液中蛋白质含量极少甚至测不出,多糖为其中主要成分,可认为该絮凝剂为多糖类物质。培养过程中糖含量变化如图 1所示,在5–12 d培养时间内,培养液中总糖含量一直在降低,表明菌体一直在进行增长繁殖;随着培养的进行,12 d时的多糖含量可达到约350 mg/L。胞外多糖的累积,一方面可能是由于菌体正常生长代谢分泌累积,另一方面可能是由于菌体细胞裂解,导致胞内多糖的释放增多。
|
| 图 1 培养液中多糖及总糖含量随培养时间的变化 Figure 1 Changes of polysaccharide and total sugar contents in culture medium with culture time 注:A:多糖浓度随培养时间变化;B:总糖浓度随培养时间变化. Note: A: Changes of polysaccharide concentration with culture time; B: Changes of total sugar concentration with culture time. |
|
|
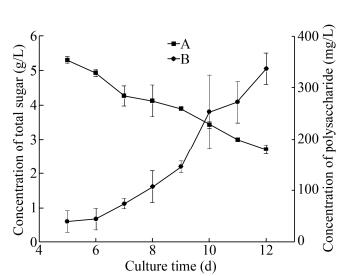
如图 2A所示,除第5天的产生的絮凝剂絮凝活性较低,第6天后提取的絮凝剂絮凝效率相差都不大,均在70%以上。第9天提取的絮凝剂絮凝效率最高,达到84.1%。在本实验中,胞外多糖的使用量非常小,只要0.75 mg/L就可以达到80%以上的絮凝效率,相比Ugbenyen等[14]研究的一种Cobetia属菌和芽孢杆菌联合培养产生的絮凝剂用量0.2–1.0 mg/mL要小得多,放射杆菌和球形芽孢杆菌混合培养的生物絮凝剂的最佳剂量为12 mg/L[15],丝状支原体生物絮凝剂的最佳剂量为3.5 mg/L[16],而当PCF-1767使用量超过1.35 mg/L时,絮凝效率开始出现明显下降(图 2B)。由于多糖分子表面带有较多负电基团,负电基团之间相互作用使得整个体系中的胶体维持稳定的状态而长时间无法下沉[17]。结合胞外多糖的产量,可见菌体培养后期产生的胞外多糖是一种高效的微生物絮凝剂。
|
| 图 2 PCF-1767与絮凝效率的关系 Figure 2 The relationship between PCF-1767 and flocculation efficiency 注:A:不同培养时间产生的PCF-1767;B:不同浓度的PCF-1767. Note: A: PCF-1767 of different culture time; B: PCF-1767 of different concentrations. |
|
|
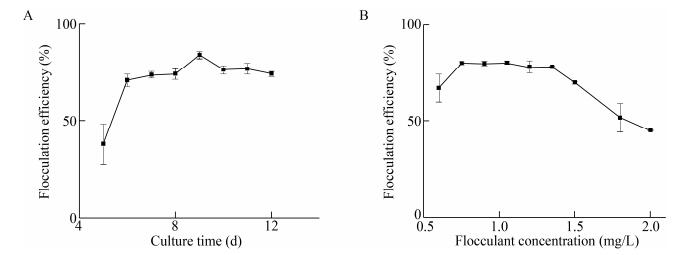
如图 3所示,PCF-1767的絮凝效率会受环境因素(pH、高岭土浓度、水体温度)不同程度的影响。黄曲霉产絮凝剂的pH稳定范围为3.0–7.0[18],菲律宾红杆菌分泌的生物絮凝剂的最佳pH范围为7.0–9.0[19]。如图 3A所示,PCF-1767适宜初始pH范围在3.0–9.0,且絮凝后相较于初始pH变化不大,絮凝剂的pH适宜范围与Ugbenyen等[14]研究的絮凝剂相似,即在酸性和弱碱性条件下絮凝效率都较好,且絮凝剂自身的pH稳定,表明其应用具有广泛性。

|
| 图 3 絮凝条件对PCF-1767絮凝效率的影响 Figure 3 The effect of flocculation conditions on the flocculation efficiency of PCF-1767 注:A:絮凝体系初始pH值;B:初始Ca2+浓度;C:高岭土初始浓度;D:温度. Note: A: Initial pH value of flocculation system; B: Initial Ca2+ concentration; C: Initial concentration of kaolin; D: Temperature. |
|
|
如图 3B所示,实验中发现若不添加助凝剂CaCl2,PCF-1767的絮凝效果不明显。这与大部分微生物絮凝剂的情况一样,都需要添加助凝剂来达到絮凝效果[20]。朱哲等[21]认为,Ca2+可通过与胞外聚合物中的负电官能团架桥来促进污泥絮体的形成并维持絮体结构的稳定性。初始浓度为2–9 mmol/L的Ca2+对絮凝剂的效率影响不大,而当Ca2+初始浓度低于2 mmol/L时絮凝效率开始下降,说明助凝剂Ca2+的初始浓度至少应为2 mmol/L。
对于初始浓度为3–6 g/L的高岭土溶液,PCF-1767均具有较高的絮凝活性(图 3C),如图 3D所示,絮凝体系的温度会影响PCF-1767的絮凝效率。在30–50 ℃范围内,絮凝效率较高,当温度高于50 ℃时,絮凝效率开始急剧降低,说明高温会抑制PCF-1767的絮凝活性。
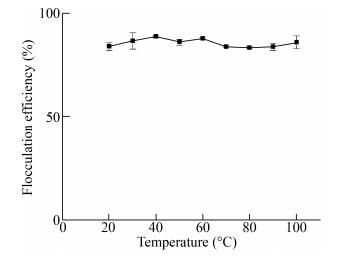
经不同温度水浴甚至沸水浴处理的PCF-1767溶液冷却后仍表现出良好的絮凝活性(图 4)。这可能是因为高温下多糖的结构发生改变,待冷却后多糖能够恢复其絮凝活性结构[18],说明PCF-1767具有良好的热稳定性,不易失活,方便保存。这也进一步证明了PCF-1767的活性成分是多糖,而不是蛋白质。
|
| 图 4 PCF-1767絮凝剂的热稳定性 Figure 4 Thermal stability of PCF-1767 flocculant |
|
|
絮凝剂的结构会影响絮凝效率的表达,通过GC-MS分析发现第5–12天多糖样品组成以葡萄糖为主(图 5),如表 1所示,糖链的骨架结构均主要是由葡萄糖以→4)Glup(1→的方式连接,培养6、7 d时多糖中有极少部分阿拉伯糖,以Arap(1→、或→3)Arap(1→的方式连接(表 1)。以上结果表明不同时期PCF-1767中多糖一级结构的差异较小。

|
| 图 5 絮凝剂PCF-1767衍生化总离子图 Figure 5 Total ion map of flocculant PCF-1767 derivatization |
|
|
| PCF-1767的提取时间 Extraction time of PCF-1767 (d) |
甲基化糖醇 Methylated alditol |
连接类型 Connection type |
| 5−12 | 2, 3, 6-tri-O-methyl-D-glucitol | →4)Glup(1→ |
| 6 | 2, 3, 5-tri-O-methyl-L-arabinitol | Arap(1→ |
| 2, 5-di-O-methyl-L-arabinitol | →3)Arap(1→ | |
| 7 | 2, 5-di-O-methyl- L-arabinitol | →3)Arap(1→ |
表 2对多糖的分子量分析表明,该絮凝剂是一种高分子量的多糖,通过测定不同时期产生的多糖分子量发现,黄孢原毛平革菌产生的多糖分子量随培养时间的延长而增大,这很可能是图 2A中絮凝效率升高的原因。本实验主要采取第7天的多糖进行研究,其重均分子量为1.499×106 Da,高于大多数已报道[18, 22-23]的絮凝剂,这可能也是本絮凝剂低量高效的原因。如Aljuboori等[18]利用黄曲霉生产的杂多糖分子量为2.574×104 Da,Li等[22]发现的地衣菌X-14分泌胞外絮凝剂分子量约为6.89×104 Da,奇异变形杆菌TJ-1分泌的一种酸性絮凝剂分子量为1.2×105 Da[23];PCF-1767与沙雷菌生产的生物絮凝剂[24]分子量相近(约1.8×106),但使用浓度低于其所使用的1−10 mg/L,海洋甲藻胞外多糖KG03[25] (分子量约为1.87×106)与PCF-1767使用浓度相近,为0.5−1.0 mg/L,耐受温度要高于PCF-1767,但仅限在酸性条件下使用。
| PCF-1767的提取时间 Extraction time of PCF-1767 (d) |
重均分子量 MW (Da) |
数均分子量 MN (Da) |
分子量分散度 MW/MN |
| 4 | 9.897×105 | 8.571×105 | 1.155 |
| 5.110×104 | 3.898×104 | 1.311 | |
| 7 | 1.499×106 | 1.238×106 | 1.211 |
| 8 | 1.689×106 | 1.276×106 | 1.323 |
| 16 | 2.126×106 | 1.824×106 | 1.165 |
如表 3所示,高岭土颗粒表面带负电,加入CaCl2溶液后Zeta电位略有上升,这表明Ca2+的加入中和了高岭土表面部分负电荷。加入絮凝剂PCF-1767后体系中的Zeta电位基本没有变化,且絮凝剂本身呈负电性,说明该絮凝剂的主要作用机理不是通过电荷中和实现的[26]。
| 样品 Sample |
Zeta电位 Zeta potential (mV) |
| Kaolin solution | −23.4 |
| Kaolin solution+CaCl2 | −18.5 |
| Kaolin solution+CaCl2+PCF-1767 | −15.6 |
| PCF-1767 | −7.5 |
通过显微镜观察显示,高岭土悬液中高岭土颗粒为分散均匀细小颗粒(图 6A)。加入CaCl2溶液后,溶液中颗粒尺寸稍有变化但不大(图 6B)。加入PCF-1767后,溶液中形成较大的絮体(图 6C),这进一步证实了PCF-1767对于水中的细小颗粒的絮凝作用。郭育涛等[27]认为,高岭土颗粒可以吸附在多糖长分子链上,吸附在链上的颗粒可以同时被其他多糖分子链吸附,从而形成具有较好沉降能力的三维絮体,在沉降过程中絮体相互压缩和卷扫形成更大更密实的絮体,从而更有利于高岭土的沉降。结合Zeta电位的现象,说明絮凝的机理主要通过吸附架桥和卷扫作用完成对颗粒物的絮凝。

|
| 图 6 絮凝高岭土显微镜图像 Figure 6 Microscopic images of flocculated kaolin 注:A:高岭土悬液;B:高岭土悬液加CaCl2溶液;C:高岭土悬液加CaCl2溶液和絮凝剂PCF-1767. Note: A: Kaolin suspension; B: Kaolin suspension plus CaCl2 solution; C: Kaolin suspension plus CaCl2 solution and flocculant PCF-1767. |
|
|
(1) PCF-1767为多糖型微生物絮凝剂,菌体培养6–12 d后得到的胞外多糖均可产生较好的絮凝效果。
(2) PCF-1767最佳投加浓度仅为0.75–1.35 mg/L;其絮凝效率会受pH、浊度、温度的影响,助凝剂钙离子浓度至少应为2 mmol/L,且PCF-1767的热稳定性很好。
(3) 不同时期PCF-1767中多糖的一级结构差别小,主要由葡萄糖组成,糖链的骨架结构主要是葡萄糖以→4)Glup(1→方式连接。多糖分子量随培养时间的延长而增大,这可能是造成絮凝效率增大的原因。
(4) Zeta电位变化情况和絮体图像分析说明PCF-1767的絮凝机理主要为吸附架桥和卷扫作用。
(5) PCF-1767安全无毒,与多数已报道的微生物絮凝剂相比,其分子量较高,使用量较小,pH适用范围更广。
| [1] |
Suryani, Ambarsari L, Artika IM, et al. Characterization of bioflocculant producing-bacteria isolated from tapioca waste water[J]. HAYATI Journal of Biosciences, 2011, 18(4): 193-196. DOI:10.4308/hjb.18.4.193 |
| [2] |
Li LX, Liu WM, Ma F. Research advances in compound bioflocculant[J]. CIESC Journal, 2018, 69(10): 4139-4147. (in Chinese) 李立欣, 刘婉萌, 马放. 复合型微生物絮凝剂研究进展[J]. 化工学报, 2018, 69(10): 4139-4147. |
| [3] |
Feng DL, Xu SH. Characterization of bioflocculant MBF3-3 produced by an isolated Bacillus sp.[J]. World Journal of Microbiology and Biotechnology, 2008, 24(9): 1627-162. DOI:10.1007/s11274-008-9654-1 |
| [4] |
Salehizadeh H, Yan N. Recent advances in extracellular biopolymer flocculants[J]. Biotechnology Advances, 2014, 32(8): 1506-1522. DOI:10.1016/j.biotechadv.2014.10.004 |
| [5] |
Agunbiade M, Pohl C, Ashafa O. Bioflocculant production from Streptomyces platensis and its potential for river and waste water treatment[J]. Brazilian Journal of Microbiology, 2018, 49(4): 731-741. DOI:10.1016/j.bjm.2017.02.013 |
| [6] |
Jiang BH, Li RN, Li FD, et al. Optimization of fermentation conditions and composition analysis of polysaccharide- based bioflocculant produced by Paenibacillus sp. A9[J]. Research of Environmental Sciences, 2014, 27(5): 547-553. (in Chinese) 姜彬慧, 李若男, 李凤达, 等. 类芽孢杆菌产絮凝多糖发酵条件优化及成分分析[J]. 环境科学研究, 2014, 27(5): 547-553. |
| [7] |
Gu MY, Zhu J, Song SQ, et al. Identification and functional properties of a novel flocculant producing bacterium[J]. Chinese Journal of Environmental Engineering, 2014, 8(3): 1208-1214. (in Chinese) 顾美英, 朱静, 宋素琴, 等. 一株产微生物絮凝剂新菌种的鉴定及功能特性[J]. 环境工程学报, 2014, 8(3): 1208-1214. |
| [8] |
Huang DL, Zeng GM, Huang GH, et al. Application of white-rot fungi in composting lead-contaminated waste[J]. Environmental Science, 2006, 27(1): 175-180. (in Chinese) 黄丹莲, 曾光明, 黄国和, 等. 接种白腐真菌堆肥处理含Pb垃圾[J]. 环境科学, 2006, 27(1): 175-180. |
| [9] |
Qing C, Shang C, Zhou YH, et al. Study on the biodegradation of tetracycline wastewater by Phanerochaete chrysosporium[J]. Environmental Pollution and Control, 2018, 40(9): 1023-1026, 1067. (in Chinese) 卿纯, 尚翠, 周亦航, 等. 黄孢原毛平革菌对四环素废水的降解研究[J]. 环境污染与防治, 2018, 40(9): 1023-1026, 1067. |
| [10] |
Yin ZW, Dong YH, Zhang SY, et al. Adsorption mechanism of Cr(VI) from aqueous solution by Phanerochaete chrysosporium mycelial pellets[J]. Environmental Engineering, 2018, 36(8): 74-78. (in Chinese) 尹志文, 董怡华, 张盛宇, 等. 黄孢原毛平革菌菌丝球吸附水中Cr(Ⅵ)的去除机理[J]. 环境工程, 2018, 36(8): 74-78. |
| [11] |
Li NJ, Zeng GM, Huang DL, et al. Response of extracellular carboxylic and thiol ligands (oxalate, thiol compounds) to Pb2+ stress in Phanerochaete chrysosporium[J]. Environmental Science and Pollution Research, 2015, 22(16): 12655-12663. DOI:10.1007/s11356-015-4429-3 |
| [12] |
Li B, Lu F. Method and analysis of methylation of polysaccharides[J]. Natural Product Research and Development, 2012, 24(1): 79-83. (in Chinese) 李波, 芦菲. 多糖的甲基化方法及图谱解析[J]. 天然产物研究与开发, 2012, 24(1): 79-83. DOI:10.3969/j.issn.1001-6880.2012.01.018 |
| [13] |
He JZ, Shao P, Meng XH, et al. Analysis of structural characteristics of polysaccharide from Ganoderma lucidum[J]. Chinese Journal of Analytical Chemistry, 2010, 38(3): 372-376. (in Chinese) 何晋浙, 邵平, 孟祥河, 等. 灵芝多糖的结构特征分析[J]. 分析化学, 2010, 38(3): 372-376. |
| [14] |
Ugbenyen AM, Okoh AI. Characteristics of a bioflocculant produced by a consortium of Cobetia and Bacillus species and its application in the treatment of wastewaters[J]. Water SA, 2014, 40(1): 139-144. |
| [15] |
Wang LL, Ma F, Qu YY, et al. Characterization of a compound bioflocculant produced by mixed culture of Rhizobium radiobacter F2 and Bacillus sphaeicus F6[J]. World Journal of Microbiology and Biotechnology, 2011, 27(11): 2559-2565. DOI:10.1007/s11274-011-0726-2 |
| [16] |
Zaki SA, Elkady MF, Farag S, et al. Characterization and flocculation properties of a carbohydrate bioflocculant from a newly isolated Bacillus velezensis 40B[J]. Journal of Environmental Biology, 2013, 34(1): 51-58. |
| [17] |
Liu WJ, Wang K, Li BZ, et al. Production and characterization of an intracellular bioflocculant by Chryseobacterium daeguense W6 cultured in low nutrition medium[J]. Bioresource Technology, 2010, 101(3): 1044-1048. DOI:10.1016/j.biortech.2009.08.108 |
| [18] |
Aljuboori AHR, Idris A, Abdullah N, et al. Production and characterization of a bioflocculant produced by Aspergillus flavus[J]. Bioresource Technology, 2013, 127: 489-493. DOI:10.1016/j.biortech.2012.09.016 |
| [19] |
Gao Q, Zhu XH, Mu J, et al. Using Ruditapes philippinarum conglutination mud to produce bioflocculant and its applications in wastewater treatment[J]. Bioresource Technology, 2009, 100(21): 4996-5001. DOI:10.1016/j.biortech.2009.05.035 |
| [20] |
Li O, Lu C, Liu A, et al. Optimization and characterization of polysaccharide-based bioflocculant produced by Paenibacillus elgii B69 and its application in wastewater treatment[J]. Bioresource Technology, 2013, 134: 87-93. DOI:10.1016/j.biortech.2013.02.013 |
| [21] |
Zhu Z, Li T, Wang DS, et al. Role of Ca(Ⅱ) in bioflocculation of activated sludge[J]. Chinese Journal of Environmental Engineering, 2009, 3(4): 612-616. (in Chinese) 朱哲, 李涛, 王东升, 等. Ca(Ⅱ)在活性污泥生物絮凝中的作用研究[J]. 环境工程学报, 2009, 3(4): 612-616. |
| [22] |
Li Z, Zhong S, Lei HY, et al. Production of a novel bioflocculant by Bacillus licheniformis X14 and its application to low temperature drinking water treatment[J]. Bioresource Technology, 2009, 100(14): 3650-3656. DOI:10.1016/j.biortech.2009.02.029 |
| [23] |
Xia SQ, Zhang ZQ, Wang XJ, et al. Production and characterization of a bioflocculant by Proteus mirabilis TJ-1[J]. Bioresource Technology, 2008, 99(14): 6520-6527. DOI:10.1016/j.biortech.2007.11.031 |
| [24] |
Liang SK, Song DD. Characteristics of a extracellular bioflocculant from a Serratia plumuthica isolate[J]. Advanced Materials Research, 2009, 79-82: 223-226. DOI:10.4028/www.scientific.net/AMR.79-82.223 |
| [25] |
Yim JH, Kim SJ, Ahn SH, et al. Characterization of a novel bioflocculant, p-KG03, from a marine dinoflagellate, Gyrodinium impudicum KG03[J]. Bioresource Technology, 2007, 98(2): 361-367. DOI:10.1016/j.biortech.2005.12.021 |
| [26] |
Wang SG, Li J, Gao BY, et al. Study on efficient bioflocculant by a Klebsiella mobilis[J]. Environmental Chemistry, 2005, 24(2): 171-174. (in Chinese) 王曙光, 李剑, 高宝玉, 等. 产气肠杆菌(KLE-1)絮凝特性的研究[J]. 环境化学, 2005, 24(2): 171-174. DOI:10.3321/j.issn:0254-6108.2005.02.013 |
| [27] |
Guo YT, Qi LZ, Nie HY, et al. Application of cationic microbial Klebsiella flocculant CMBF-NⅢ2 in sewage treatment[J]. Environmental Chemistry, 2019, 38(3): 607-614. (in Chinese) 郭育涛, 齐亮子, 聂红云, 等. 阳离子化克雷伯氏菌絮凝剂CMBF-NⅢ2在生活污水中的应用[J]. 环境化学, 2019, 38(3): 607-614. |
 2020, Vol. 47
2020, Vol. 47




