扩展功能
文章信息
- 李婷, 张威, 吴明辉, 刘光琇, 陈拓, 李师翁
- LI Ting, ZHANG Wei, WU Ming-Hui, LIU Guang-Xiu, CHEN Tuo, LI Shi-Weng
- 荒漠土壤中两株抗氧化细菌的抗氧化生理生化特征
- Physiological and biochemical characteristics of two antioxidant bacteria in desert soil
- 微生物学通报, 2020, 47(2): 379-389
- Microbiology China, 2020, 47(2): 379-389
- DOI: 10.13344/j.microbiol.china.190418
-
文章历史
- 收稿日期: 2019-05-12
- 接受日期: 2019-07-29
- 网络首发日期: 2019-09-16
2. 云南大学生态学与环境学院 云南 昆明 650000;
3. 甘肃省极端环境微生物资源与工程重点实验室 甘肃 兰州 730000;
4. 中国科学院大学 北京 100049;
5. 兰州交通大学环境与市政工程学院 甘肃 兰州 730000
2. School of Ecology and Environmental Science, Yunnan University, Kunming, Yunnan 650000, China;
3. Key Laboratory of Extreme Environmental Microbial Resources and Engineering, Gansu Province, Lanzhou, Gansu 730000, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China;
5. School of Environmental and Municipal Engineering, Lanzhou Jiaotong University, Lanzhou, Gansu 730000, China
微生物在恶劣环境中容易受到氧化损伤,损伤主要集中在细胞内脂、蛋白质和DNA,可导致细胞功能丧失而无法维持细胞正常代谢繁衍甚至死亡。强电离辐射、干旱、高温、高盐碱环境中产生的活性氧(reactive oxygen species,ROS)包括羟自由基(HO·)、超氧自由基(O2–)[1],能够直接造成细胞氧化损伤。活性氧可以作用于细胞膜上的多元不饱和脂肪酸,造成脂质过氧化从而破坏细胞流动性[2];引起蛋白质有害修饰,包括氨基酸中硫酰基氧化、与醛类反应;还可导致DNA的单键或双键断裂[3]。同时,这些反应产生了有毒害物质,进一步损害细胞。
荒漠特殊的环境条件极易造就强氧化环境,对生存其中的微生物产生氧化损伤。荒漠分布广泛,其面积约为陆地面积的1/3,土壤盐碱化严重、强紫外辐射、水分含量极低。这些环境因子将荒漠中微生物置于强氧化条件下。尤其在紫外辐射下,有研究表明几乎80%的细胞损伤属于氧化损伤[4]。同样地,也有研究表明在干旱和盐碱土壤中发现了大量抗氧化基因,从而说明这样的环境中生物更易受到氧化胁迫[5-6]。
荒漠土壤细菌是荒漠生态系统中重要的群落组成,适应这一极端环境的微生物很可能具有特殊的生态适应机制及高效的抗氧化活性物质。目前微生物抗氧化研究多集中于食品微生物、肠道微生物,荒漠中对抗氧化特征与机理的研究多以植物为对象,荒漠土壤微生物抗氧化相关研究还较少。本文以荒漠土壤细菌为研究对象,用过氧化氢筛选得到2株具有强抗氧化能力的细菌,并对抗氧化菌株的抗氧化生理生化特征,包括氧化环境下抗氧化细菌生长情况、细胞受损程度、抗氧化酶活性、清除自由基能力展开研究。为恢复荒漠地区生物多样性、开发微生物抗氧化资源提供科学依据和技术基础。
1 材料与方法 1.1 材料 1.1.1 菌株及培养基从荒漠土壤样品中分离培养得到11株长势相同且生长良好的细菌,其中菌株AX6和菌株AX19分离自中国柴达木盆地,菌株sptzw03、sptzw12、sptzw15、sptzw24、sptzw42分离自中国腾格里沙漠,菌株KD3分离自北美洲死亡谷沙漠Badwater盆地,菌株KD4和菌株KD5分离自南极的Lake Vida,菌株KD6分离自南美洲的阿塔卡马沙漠。其中南极Lake Vida的样品由美国沙漠研究所Henry Sun教授提供,其余菌株由本实验室分离得到。
大肠杆菌对氧化物质的耐受性较低[7],以Escherichia coli JM109为阴性对照,购自Solarbio公司,菌株编号C1310;耐辐射球菌Deinococcus radiodurans为阳性对照,它是存在于沙漠中具有超高抗辐射、抗氧化能力的菌株[7-8],购自中国微生物菌种保藏管理委员会普通微生物中心(China General Microbiological Culture Collection Center,CGMCC),菌株编号1.3828。
LB培养基(g/L):蛋白胨10.00,酵母提取物5.00,NaCl 10.00,琼脂20.00 (固体培养基)。R2A培养基(g/L):酵母提取物0.50,䏡蛋白胨0.50,酪蛋白氨基酸0.50,葡萄糖0.50,可溶性淀粉0.50,丙酮酸盐0.30,磷酸二氢钾0.30,七水合硫酸镁0.05,琼脂15 (固体培养基),用磷酸氢二钾和磷酸二氢钾调pH为7.4。
1.1.2 主要试剂和仪器过氧化氢、无水乙醇、硫酸亚铁、EDTA二钠、邻苯三酚,天津市百世化工有限公司;DPPH,Aldrich公司;番红花T,上海埃彼化学试剂有限公司;细胞裂解液、PMSF,北京雷根生物技术有限公司。电泳槽,北京君意东方电泳设备有限公司;梯度PCR仪,东胜创新生物科技有限公司;电热恒温培养箱、恒温振荡培养箱,上海一恒科技有限公司;涡旋混合器,江苏东鹏仪器制造有限公司;紫外可见分光光度计,莱伯泰科仪器股份有限公司;凝胶成像系统,Alpha Innotech公司;滤膜,Merck Millipore有限公司。
1.2 采样方法每个采样区域随机选择3个采样点,在无人为破坏的沙丘采集表层土样(2–5 cm),放入无菌采样袋,在–20 ℃条件下保存。
1.3 抗氧化细菌筛选 1.3.1 菌株活化甘油冻存的菌株用接种针蘸取菌液,在LB固体培养基中划线。置于30 ℃恒温培养箱培养48–72 h。挑取形态、颜色和大小不一的菌落反复划线,直至得到单一菌落。
1.3.2 抗氧化细菌筛选初次筛选过氧化氢浓度为0、0.01、0.02、0.03、0.04、0.05、0.06 mmol/L;二次筛选过氧化氢浓度为0、0.02、0.04、0.06、0.08、0.10、0.12 mmol/L;3次筛选过氧化氢浓度为0、0.5、1.0、1.5、2.0、2.5、3.0 mmol/L。1 mL菌液加入1 mL过氧化氢稀释液,对照组加入1 mL去离子水,充分混匀后静置处理30 min,用PBS缓冲溶液冲洗3次,制成不同倍数菌液稀释液涂布计数,每个处理组作3个平行实验。根据存活率筛选出具有抗氧化活性的细菌。
1.4 细菌抗氧化生理生化特征 1.4.1 抗氧化菌株生长曲线测定过氧化氢用0.22 μm滤膜灭菌后加入灭菌冷却的LB培养基,制成浓度为0、0.5、1.0、1.5、2.0、2.5 mmol/L的过氧化氢LB液体培养基,接入10% (体积比)的接种菌液,放入28 ℃恒温摇床培养箱中200 r/min培养,每2-3 h测定菌液的OD600,直至生长到达衰落阶段。每个浓度设置3个平行,每次以培养基调零。以时间为横坐标,OD600为纵坐标作生长曲线。
1.4.2 抗氧化菌株氧化处理菌株接种于R2A液体培养基中,28 ℃、200 r/min培养48 h,培养至菌液OD600为1时,分装至50 mL锥形瓶,以不同浓度的过氧化氢处理,浓度梯度为0、1.5、3.0 mmol/L,处理时间为4 h。每组处理作3个平行实验。
1.4.3 抗氧化菌株丙二醛含量以及SOD、CAT、GSH-Px活性测定丙二醛(malondialdehyde,MDA)具有CH2(CHO)2结构,是一种生物体脂质氧化后的产物,它的产生标志着氧化应激反应的发生。细菌细胞膜在过氧化氢条件下氧化生成丙二醛的多少,可用于表征细菌膜损伤程度[9],其含量测定使用TBA法[10]。细菌超氧化物歧化酶(superoxide dismutase,SOD)活性测定采用邻苯三酚自氧化法[11]等;过氧化氢酶(catalase,CAT)活性测定采用分光光度法,通过过氧化氢吸光度变化值来表征,测定步骤改自Nakayama等[12];谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性测定采用比色法,使用Leagene公司试剂盒。
1.4.4 羟自由基清除能力测定羟自由基清除能力测定方法[13]:反应终体积1 mL,其中含150 mmol/L磷酸钠盐缓冲液(pH 7.4),114 μmol/L番红花T,1.0 mmol/L硫酸亚铁,3% (质量体积比) H2O2以及不同处理后菌液样品,空白组以蒸馏水代替样品,对照组以蒸馏水代替样品和硫酸亚铁。在37 ℃恒温水浴30 min后用0.3 mol/L的EDTA二钠终止反应,测520 nm处吸光值。
羟自由基清除率计算式为:

|
(1) |
式中,Ab为空白组吸光度,Ac为对照组吸光度,As样品为样品组吸光度。
1.4.5 超氧阴离子自由基清除能力测定超氧阴离子自由基清除能力测定方法改自Wang等[14],pH 8.2的0.05 mol/L的Tris-HCl缓冲液0.6 mL,样品0.2 mL于各试管中,对照组用蒸馏水代替。于25 ℃水浴锅中保温10 min,加入同样预温的30 mmol/L邻苯三酚盐酸液40 μL,混匀后精确反应4 min,用0.1 mL浓盐酸终止反应,测320 nm处吸光度,以等体积的Tris-HCl缓冲液作为空白组。
超氧阴离子自由基清除率计算公式如下:
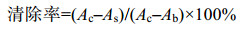
|
(2) |
式中,Ab为空白组吸光度,Ac为对照组吸光度,As样品为样品组吸光度。
1.4.6 DPPH清除能力测定DPPH清除能力的测定方法改自Lee等[15],500 μL样品与500 μL的0.4 mmol/L DPPH乙醇,空白组以等体积无水乙醇代替DPPH溶液,对照组以等体积蒸馏水代替样品溶液,混匀后在室温下避光反应30 min,并在6 000 r/min离心10 min,取上清液,以等体积蒸馏水和无水乙醇混合液调零,于517 nm测定吸光度。
DPPH自由基清除率计算公式为:

|
(3) |
式中,Ab为空白组吸光度,Ac为对照组吸光度,As样品为样品组吸光度。
1.5 数据分析数据用R 3.5.1进行分析方差分析,采用Excel和SPSS 16.0作图。系统发育树由软件MEGA 7.0作图。
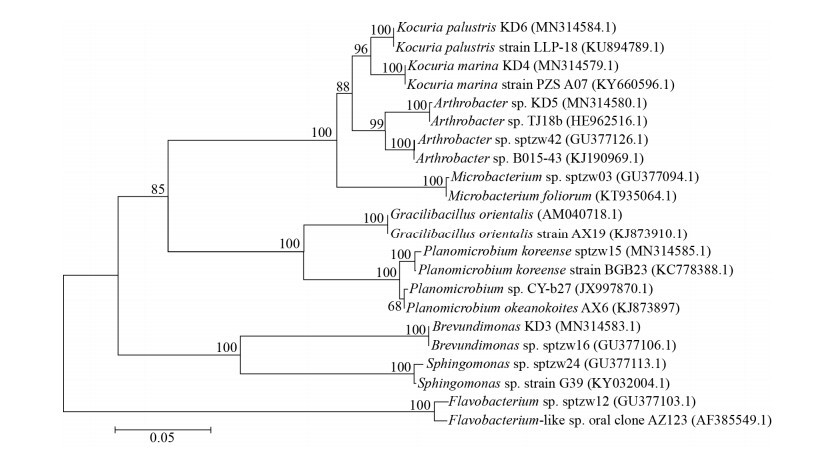
2 结果与分析 2.1 荒漠土壤细菌基于16S rRNA基因的系统发育树分析用LB固体培养基对不同样品中分离出的菌株进行培养,筛选出长势良好的11株细菌,将它们进一步活化后进行16S rRNA基因扩增、测序,得到的序列在Contig软件中拼接后上传至美国国家生物技术信息中心(NCBI)的核酸数据库BLAST进行比对,构建系统发育树(图 1)。在门水平上,11株菌隶属于4个常见的土壤微生物菌群[16],其中菌株sptzw03、sptzw42、KD4、KD5、KD6属于放线菌门(Actinobacteria),菌株sptzw12属于拟杆菌门(Bacteroidetes),菌株sptzw15、AX6、AX19属于厚壁菌门(Firmicutes),菌株sptzw24、KD3属于变形菌门(Proteobacteria)。从属水平看,分属于微杆菌属(Microbacterium)、节杆菌属(Arthrobacter)、考克氏菌属(Kocuria)、黄杆菌属(Flavobacterium)、动性微菌属(Planomicrobium)、糖球菌属(Gracilibacillus)、鞘脂单胞菌属(Sphingomonas)和短波单胞菌属(Brevundimonas)。
|
| 图 1 菌株基于16S rRNA基因序列的系统发育树 Figure 1 Phylogenetic tree based on 16S rRNA gene sequences of the strains 注:括号内数字:菌株的GenBank序列号;分支处数字:Bootstrap支持率;标尺:5%差异的分支长度. Note: Numbers in brackets: GenBank accession numbers of the strain; Numbers in branch points: Percentages supported by bootstrap; Bar: 5% nucleotide divergence. |
|
|
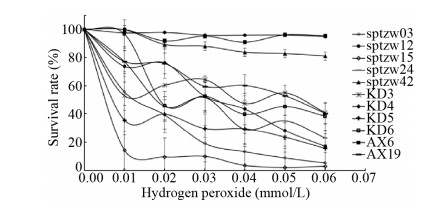
图 2为11株细菌在不同浓度过氧化氢处理后的存活率曲线,控制过氧化氢浓度为0、0.01、0.02、0.03、0.04、0.05、0.06 mmol/L浓度梯度,菌株KD4 (Kocuria)、AX6 (Planomicrobium)、sptzw42 (Arthrobacter)三株菌在0.06 mmol/L过氧化氢处理后存活率依然保持在80%以上,分别为94.75%、95.34%和80.99%。其余菌株存活率在0.06 mmol/L时均低于50%,初步筛选出在氧化处理后具有较高存活率的3株细菌AX6、sptzw42、KD4。
|
| 图 2 过氧化氢处理下荒漠土壤细菌存活率曲线 Figure 2 Survival curve of bacteria in desert soils treated with hydrogen peroxide stress |
|
|
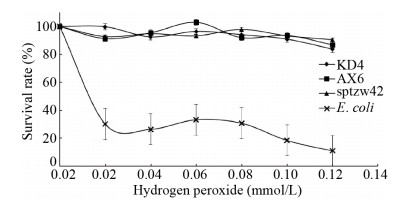
增加过氧化氢浓度进一步对菌株AX6、sptzw42、KD4进行复筛,并加入大肠杆菌作为阴性对照,存活率曲线如图 3所示。在过氧化氢浓度升高之后,菌株AX6、sptzw42、KD4在各个浓度均保持较高的存活率。
|
| 图 3 过氧化氢处理下菌株KD4、AX6、sptzw42存活率曲线 Figure 3 Survival curve of strains KD4, AX6, sptzw42 treated with hydrogen peroxide |
|
|
在高浓度过氧化氢条件下,加入耐辐射球菌作为阳性对照,存活率曲线如图 4所示。菌株AX6、KD4存活率下降趋势与耐辐射球菌存活曲线类似、较为平缓,在浓度为2 mmol/L处存活率分别保持在60.00%和80.81%。sptzw42存活率在0.5 mmol/L处明显下降,在3 mmol/L处存活率低至8.96%。随着过氧化氢浓度的持续升高,菌株AX6、KD4的存活率明显高于其他菌株。
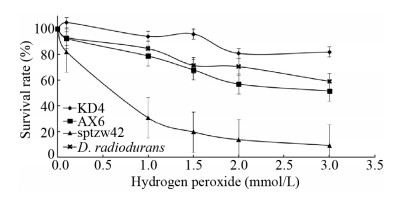
|
| 图 4 较高浓度过氧化氢处理下菌株KD4、AX6、sptzw42存活率 Figure 4 Survival curves of strains KD4, AX6, sptzw42 treated with higher concentration hydrogen peroxide |
|
|
抗氧化菌株AX6、KD4在不同浓度过氧化氢处理下的生长曲线如图 5、图 6所示。随着过氧化氢浓度的升高,菌株AX6、KD4适应期增加,在过氧化氢为1.5 mmol/L时生长浓度最高,OD600分别为2.66和10.71。菌株生长曲线测定表明,菌株AX6和KD4在过氧化氢浓度高于1.5 mmol/L时,菌株的适应期长,对数期生长速率低,稳定期的菌液浓度也低。因此确定1.5 mmol/L的过氧化氢浓度是AX6和KD4的最优耐受氧化浓度。

|
| 图 5 不同浓度过氧化氢条件下菌株AX6生长曲线 Figure 5 Growth curve of strain AX6 in different concentrations hydrogen peroxide |
|
|

|
| 图 6 不同浓度过氧化氢条件下菌株KD4生长曲线 Figure 6 Growth curve of strain KD4 in different concentrations hydrogen peroxide |
|
|
不同浓度过氧化氢处理下,抗氧化菌株丙二醛含量如图 7A所示。用1.5 mmol/L浓度过氧化氢处理后,菌株AX6的丙二醛含量显著上升(P < 0.05),但是其含量显著低于阴性对照大肠杆菌(P < 0.05),KD4则无显著上升趋势。相比于普通细菌,菌株AX6、KD4在氧化环境中受到氧化损害的程度更小。用3 mmol/L浓度过氧化氢处理之后,菌株KD4的丙二醛含量显著低于大肠杆菌(P < 0.05),说明菌株KD4在高浓度过氧化氢条件下细胞受损程度较低。
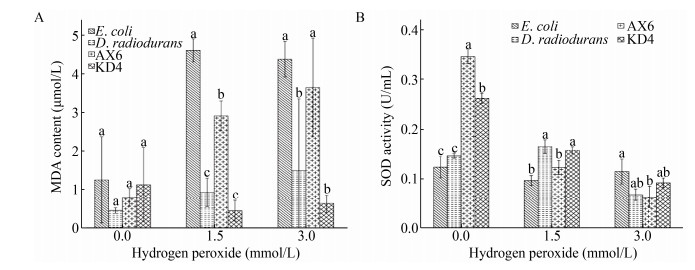
|
| 图 7 不同浓度过氧化氢处理菌株丙二醛含量(A)以及超氧化物歧化酶活性(B) Figure 7 Level of malondialdehyde (A) and activity of superoxide dismutase (B) of strains treated with different concentrations hydrogen peroxide 注:不同的小写字母表示处理之间在统计学上差异显著(P < 0.05).下同. Note: The different lowercases represent statistically significant difference (P < 0.05). The same below. |
|
|
不同浓度过氧化氢处理下抗氧化菌株SOD活性如图 7B所示。随着过氧化氢浓度增加菌株AX6与KD4的SOD活性显著下降(P < 0.05),SOD活性呈现低过氧化氢浓度时最高,高过氧化氢浓度时最低的变化趋势,且与对照菌株相比无显著差异。表明在过氧化氢为主要氧化物质的环境中,抗氧化菌株AX6、KD4的SOD抗氧化作用并未启动。
不同浓度过氧化氢处理下抗氧化菌株CAT活性如图 8A所示。1.5 mmol/L过氧化氢处理后,菌株AX6、KD4的CAT活性显著降低(P < 0.05);3 mmol/L过氧化氢处理后,菌株KD4酶活性显著升高(P < 0.05)。表明在受到较高浓度过氧化氢胁迫时菌株KD4通过CAT抗氧化作用来抵抗氧化胁迫,而菌株AX6的CAT抗氧化作用不明显。

|
| 图 8 不同浓度过氧化氢处理菌株过氧化氢酶(A)以及谷胱甘肽过氧化物酶活性(B) Figure 8 Activity of catalase (A) and glutathione peroxidase (B) of strains treated with different concentrations hydrogen peroxide |
|
|
不同浓度过氧化氢处理下抗氧化菌株GSH-Px活性如图 8B所示。1.5 mmol/L过氧化氢处理后,菌株AX6的谷胱甘肽过氧化物酶活性显著升高达108.33 U/mL (P < 0.05),3 mmol/L过氧化氢处理后,菌株AX6的酶活性显著高于耐辐射球菌(P < 0.05);而菌株KD4的酶活性没有显著变化。表明菌株AX6在受到过氧化氢胁迫时主要依靠谷胱甘肽过氧化物酶来抵抗氧化胁迫,而KD4则没有这样的特征。
虽然SOD是生物体中分布广泛的抗氧化酶,但在过氧化氢胁迫下,两株抗氧化细菌并没有利用SOD进行抗氧化。一方面,SOD是将超氧化物转化为过氧化氢,过氧化氢为主的氧化环境抑制了SOD产生过氧化氢的过程,导致SOD活性下降[17]。另一方面,过多的SOD会与CAT结合,导致细胞清除过氧化氢的能力下降[18],因而细胞主动抑制SOD的活性升高。两株菌可能分别通过上调CAT与GSH-Px合成相关酶清除过氧化氢,从而表现出抗氧化特性。
2.5 抗氧化菌株清除各氧化物质能力荒漠土壤中存在大量的羟自由基和超氧阴离子自由基。荒漠中强烈的紫外辐射激发大气中的原子产生超氧阴离子自由基,氧与水反应生成羟自由基[19]。羟自由基和超氧阴离子自由基具有较强的氧化性,可引起高氧中毒和细胞损伤[20]。另外,在实验室中通常用DPPH自由基清除率判定物质抗氧化能力。因此测定了羟自由基、超氧阴离子自由基和DPPH的清除率来表征抗氧化菌株的抗氧化生理生化特征。
不同浓度过氧化氢处理后抗氧化菌株的超氧阴离子自由基清除率如图 9A所示。1.5 mmol/L浓度过氧化氢处理后的菌株AX6和KD4对超氧阴离子自由基清除率均显著上升(P < 0.05)分别达到18.33%和13.54%。表明低过氧化氢诱导可以提高菌株AX6和菌株KD4的超氧阴离子自由基清除能力。
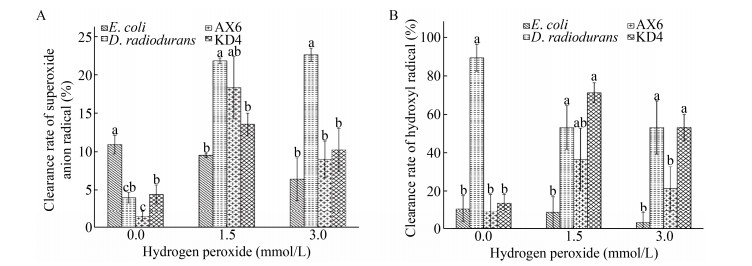
|
| 图 9 不同浓度过氧化氢处理菌株超氧阴离子自由基(A)以及羟自由基清除率(B) Figure 9 Clearance rate of superoxide anion radical (A) and hydroxyl radical (B) of strains treated with different concentrations hydrogen peroxide |
|
|
不同浓度过氧化氢处理后抗氧化菌株的羟自由基清除率如图 9B所示。在1.5 mmol/L浓度过氧化氢处理时,菌株KD4的羟自由基清除能力显著增加(P < 0.05),最高清除率为71.21%,在3 mmol/L过氧化氢处理后清除率与阳性对照耐辐射球菌无显著差异。说明在低的过氧化氢诱导下菌株KD4对羟基自由基的清除能力会被激发。
不同浓度过氧化氢处理后抗氧化菌株的DPPH清除率如图 10所示。菌株AX6的DPPH清除能力显著高于阴性对照大肠杆菌(P < 0.05),且在3 mmol/L的过氧化氢处理后清除能力与阳性对照耐辐射球菌无显著差异。说明抗氧化菌株AX6具有良好的DPPH清除能力,在过氧化氢胁迫下清除能力并未受到影响。
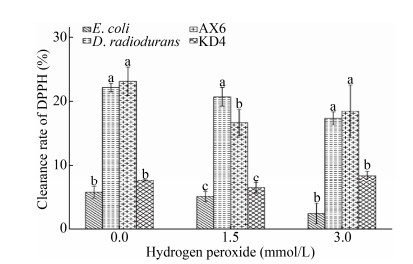
|
| 图 10 不同浓度过氧化氢处理菌株DPPH清除率 Figure 10 Clearance rate of DPPH of strains treated with different concentrations hydrogen peroxide |
|
|
菌株AX6具有良好的DPPH清除能力,Boujida等[21]分离出来的抗氧化嗜盐菌同样具有较好的DPPH清除能力,说明在较小的氧化胁迫下其对超氧阴离子自由基清除能力能够被激发,相比之下菌株KD4只是在羟自由基清除方面有较为突出的能力,在低浓度过氧化氢环境中这种能力被激发。
3 讨论与结论荒漠中的年平均太阳辐射可达到334 W/m2,这种程度的太阳辐射不仅直接对生物造成光损伤[22],还会形成一个高氧化强度的环境。为了避免自身结构功能以及繁殖受到影响,荒漠土壤微生物体内外会产生一系列抗氧化过程相关反应。不同的荒漠土壤微生物中发生的抗氧化过程不尽相同,不同的生理生化特征包括细胞膜损伤、抗氧化酶活性和活性氧清除能力,从而表现出抗氧化能力的差异性。
3.1 抗氧化细菌的筛选短时的氧化处理下,菌株的存活率可以表征菌株的氧化应激反应强度[23]。从荒漠土壤中培养得到的细菌氧化耐受能力差异明显,在较高的过氧化氢浓度中筛选出高存活率菌株海床动性微菌AX6 (Planomicrobium okeanokoites AX6)和海洋考克氏菌KD4 (Kocuria marina KD4)具有强的氧化应激反应,说明这两个菌株的抗氧化能力强。海床动性微菌曾在波斯湾海水、中国福建东海岸带的沉积物、中国1号冰川以及内蒙古地质公园的土壤中被分离得到,研究表明它具有耐低温、耐盐特性,因此能在不同环境中广泛分布[24-28]。同样地,有研究表明海洋考克氏菌具有耐碱、耐盐特性,它曾在特罗坦湾、印度的科瓦兰盐场中被分离出来[29-31],其具有适应荒漠氧化环境的能力或许与这些抗逆特性有关。
3.2 抗氧化细菌的酶活性以及自由基清除能力抗氧化菌株要维持自身在氧化环境中正常生命活动,一方面要防止自身细胞结构受到损伤,另一方面对外界和体内的活性氧进行清除[32]。本研究证实在氧化条件下,2株抗氧化细菌受到的细胞氧化损伤低于普通土壤菌株,并通过不同种类抗氧化酶以及活性氧清除能力来抵抗氧化胁迫。
菌株KD4和AX6的主要抗氧化过程分别依靠CAT和GSH-Px分解过氧化氢。值得注意的是,绝大部分革兰氏阳性菌不能自主合成GSH-Px抗氧化过程反应中所需底物谷胱甘肽,现有报道中只有2种革兰氏阳性菌具有这种能力[33],菌株AX6表现出较高活性的GSH-Px,可以进一步探明GSH-Px在革兰氏阳性菌中的作用过程,补充完善细菌抗氧化系统的作用机理。
其次,菌株AX6在清除超氧阴离子自由基和DPPH时表现出良好的能力,而菌株KD4在清除羟自由基时表现出突出的能力。菌株AX6与KD4在过氧化氢氧化胁迫下表现出的突出抗氧化酶活性以及自由基清除能力帮助细菌清除了体内外的活性氧,保护菌株不受损伤。但两株菌表现出来的生理特征不尽相同,说明了抗氧化过程的多样性。
3.3 展望某些细菌在具有抗干旱能力、抗辐射能力和抗盐碱能力的同时具备抗氧化能力,使它们具备这些抗性的进化适应机制一直是研究热点,因此对其生态适应机制的研究具有重要生态学意义。本研究对荒漠土壤中抗氧化细菌的生理生化特征做研究,发现不同的细菌其抗氧化特征不尽相同,且这些抗氧化菌株存在其他抗性。单从细胞层面挖掘不同逆境中抗氧化机制的多样性以及不同抗性机制之间的联系是远远不够的,这方面工作需要从分子层面展开研究。
此外,抗氧化制剂在医药、健康、食品和工业都广泛应用并且消费量逐年增加,由于合成抗氧化剂的毒性问题,开发利用天然抗氧化剂已成为近年来抗氧化剂研发的新热点。现有的天然抗氧化剂主要来源于植物,较传统的植物提取而言,微生物发酵提取抗氧化剂有着诸多优势,但目前关于微生物源性抗氧化剂的研究很少。本研究中的抗氧化菌株具有较高的抗氧化酶活性,因此从极端干旱环境生存的微生物中寻找天然的抗氧化活性物质或抗氧化酶是一种新的并且可行的途径。在分子生物技术创新和成本下降的条件下,通过不断挖掘荒漠微生物抗氧化基因资源,荒漠环境抗氧化微生物资源开发将得到新的机遇。
| [1] |
Gutteridge JMC, Halliwell B. Free radicals and antioxidants in the year 2000: a historical look to the future[J]. Annals of the New York Academy of Sciences, 2000, 899(1): 136-147. |
| [2] |
Cabiscol E, Tamarit J, Ros J. Oxidative stress in bacteria and protein damage by reactive oxygen species[J]. International Microbiology: the Official Journal of the Spanish Society for Microbiology, 2000, 3(1): 3-8. |
| [3] |
Thapa G, Sadhukhan A, Panda SK, et al. Molecular mechanistic model of plant heavy metal tolerance[J]. Biometals, 2012, 25(3): 489-505. DOI:10.1007/s10534-012-9541-y |
| [4] |
Riley PA. Free radicals in biology: oxidative stress and the effects of ionizing radiation[J]. International Journal of Radiation Biology, 1994, 65(1): 27-33. DOI:10.1080/09553009414550041 |
| [5] |
Zhang TG, Li QL, Diao ZH, et al. Effects of salt and drought stresses on antioxidant system and RbohC and RbohF genes expression in Brassica campestris[J]. Chinese Journal of Applied Ecology, 2019, 30(3): 969-978. (in Chinese) 张腾国, 李巧丽, 刁志宏, 等. 盐及干旱胁迫对油菜抗氧化系统和RbohC、RbohF基因表达的影响[J]. 应用生态学报, 2019, 30(3): 969-978. |
| [6] |
Pandit AS, Joshi MN, Bhargava P, et al. A snapshot of microbial communities from the Kutch: one of the largest salt deserts in the World[J]. Extremophiles, 2015, 19(5): 973-987. DOI:10.1007/s00792-015-0772-z |
| [7] |
Paulino-Lima IG, Azua-Bustos A, Vicuña R, et al. Isolation of UVC-tolerant bacteria from the hyperarid Atacama Desert, Chile[J]. Microbial Ecology, 2013, 65(2): 325-335. DOI:10.1007/s00248-012-0121-z |
| [8] |
Lim S, Jung JH, Blanchard L, et al. Conservation and diversity of radiation and oxidative stress resistance mechanisms in Deinococcus species[J]. FEMS Microbiology Reviews, 2019, 43(1): 19-52. DOI:10.1093/femsre/fuy037 |
| [9] |
Tsikas D. Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples: analytical and biological challenges[J]. Analytical Biochemistry, 2017, 524: 13-30. DOI:10.1016/j.ab.2016.10.021 |
| [10] |
Bao L, Hong LY, Lou DL. Dynamic observation of superoxide dismutase and malondialdehyde in toxic bacterial dysentery[J]. Clinical Medicine, 1996, 16(2): 36-37. (in Chinese) 包玲, 洪莲云, 楼德理. 中毒性细菌性痢疾超氧化物歧化酶及丙二醛的动态观察[J]. 临床医学, 1996, 16(2): 36-37. |
| [11] |
Chen LL, Zhang W, Wang ZX, et al. Determination of superoxide dismutase activity in methanobactin-copper complexes by pyrogallol autoxidation[J]. Journal of Food Safety and Quality, 2017, 8(9): 3438-3444. (in Chinese) 陈林林, 张伟, 王振兴, 等. 邻苯三酚自氧化法测定甲烷氧化菌素-铜配合物的超氧化物歧化酶活性[J]. 食品安全质量检测学报, 2017, 8(9): 3438-3444. DOI:10.3969/j.issn.2095-0381.2017.09.027 |
| [12] |
Nakayama M, Nakajima-Kambe T, Katayama H, et al. High catalase production by Rhizobium radiobacter strain 2-1[J]. Journal of Bioscience and Bioengineering, 2008, 106(6): 554-558. DOI:10.1263/jbb.106.554 |
| [13] |
Das D, Goyal A. Antioxidant activity and γ-aminobutyric acid (GABA) producing ability of probiotic Lactobacillus plantarum DM5 isolated from Marcha of Sikkim[J]. LWT - Food Science and Technology, 2015, 61(1): 263-268. DOI:10.1016/j.lwt.2014.11.013 |
| [14] |
Wang YC, Yu RC, Chou CC. Antioxidative activities of soymilk fermented with lactic acid bacteria and bifidobacteria[J]. Food Microbiology, 2006, 23(2): 128-135. DOI:10.1016/j.fm.2005.01.020 |
| [15] |
Lee BJ, Kim JS, Kang YM, et al. Antioxidant activity and γ-aminobutyric acid (GABA) content in sea tangle fermented by Lactobacillus brevis BJ20 isolated from traditional fermented foods[J]. Food Chemistry, 2010, 122(1): 271-276. DOI:10.1016/j.foodchem.2010.02.071 |
| [16] |
Makhalanyane TP, Valverde A, Gunnigle E, et al. Microbial ecology of hot desert edaphic systems[J]. FEMS Microbiology Reviews, 2015, 39(2): 203-221. DOI:10.1093/femsre/fuu011 |
| [17] |
Macmillan-Crow LA, Crow JP. Does more MnSOD mean more hydrogen peroxide?[J]. Anti-Cancer Agents in Medicinal Chemistry, 2011, 11(2): 178-180. DOI:10.2174/187152011795255939 |
| [18] |
Mao GD, Thomas PD, Lopaschuk GD, et al. Superoxide dismutase (SOD)-catalase conjugates. Role of hydrogen peroxide and the Fenton reaction in SOD toxicity[J]. The Journal of Biological Chemistry, 1993, 268(1): 416-420. |
| [19] |
Georgiou CD, Sun HJ, McKay CP, et al. Evidence for photochemical production of reactive oxygen species in desert soils[J]. Nature Communications, 2015, 6: 7100. DOI:10.1038/ncomms8100 |
| [20] |
Nimse SB, Pal D. Free radicals, natural antioxidants, and their reaction mechanisms[J]. RSC Advances, 2015, 5(35): 27986-28006. DOI:10.1039/C4RA13315C |
| [21] |
Boujida N, Palau M, Charfi S, et al. Isolation and characterization of halophilic bacteria producing exopolymers with emulsifying and antioxidant activities[J]. Biocatalysis and Agricultural Biotechnology, 2018, 16: 631-637. DOI:10.1016/j.bcab.2018.10.015 |
| [22] |
McKay CP, Friedmann EI, Gómez-Silva B, et al. Temperature and moisture conditions for life in the extreme arid region of the Atacama Desert: four years of observations including the El Niño of 1997-1998[J]. Astrobiology, 2003, 3(2): 393-406. DOI:10.1089/153110703769016460 |
| [23] |
Zhang N, Jiang JC, Yang J, et al. Study on the relationship between survival rate and total antioxidant capacity (T-AOC) of microbe implanted by N+ ion[J]. Journal of Radiation Research and Radiation Processing, 2012, 30(5): 316-320. (in Chinese) 张宁, 蒋剑春, 杨静, 等. 离子注入微生物存活率与总抗氧化能力(T-AOC)的关系[J]. 辐射研究与辐射工艺学报, 2012, 30(5): 316-320. |
| [24] |
Akbari E, Beheshti-Maal K, Nayeri H. Production and optimization of alkaline lipase by a novel psychrotolerant and halotolerant strain Planomicrobium okeanokoites ABN-IAUF-2 isolated from Persian gulf[J]. International Journal of Medical Research & Health Sciences, 2016, 5(4): 139-148. |
| [25] |
Luo XN, Zhang JL, Li D, et al. Planomicrobium soli sp. nov., isolated from soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(8): 2700-2705. |
| [26] |
Zhang DC, Liu HC, Xin YH, et al. Planomicrobium glaciei sp. nov., a psychrotolerant bacterium isolated from a glacier[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(6): 1387-1390. DOI:10.1099/ijs.0.002592-0 |
| [27] |
Dai X, Wang YN, Wang BJ, et al. Planomicrobium chinense sp. nov., isolated from coastal sediment, and transfer of Planococcus psychrophilus and Planococcus alkanoclasticus to Planomicrobium as Planomicrobium psychrophilum comb. nov. and Planomicrobium alkanoclasticum comb. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(2): 699-702. DOI:10.1099/ijs.0.63340-0 |
| [28] |
Ramezani M, Nikou MM, Pourmohyadini M, et al. Planomicrobium iranicum sp. nov., a novel slightly halophilic bacterium isolated from a hypersaline wetland[J]. International Journal of Systematic and Evolutionary Microbiology, 2019, 69(5): 1433-1437. DOI:10.1099/ijsem.0.003332 |
| [29] |
Kim SB, Nedashkovskaya OI, Mikhailov VV, et al. Kocuria marina sp. nov., a novel actinobacterium isolated from marine sediment[J]. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(5): 1617-1620. DOI:10.1099/ijs.0.02742-0 |
| [30] |
Sarafin Y, Donio MBS, Velmurugan S, et al. Kocuria marina BS-15 a biosurfactant producing halophilic bacteria isolated from solar salt works in India[J]. Saudi Journal of Biological Sciences, 2014, 21(6): 511-519. DOI:10.1016/j.sjbs.2014.01.001 |
| [31] |
Horiuchi A, Kubota N, Hidaka E, et al. Notable alkaline tolerance of Kocuria marina isolate from blood of a pediatric patient with continuous intravenous epoprostenol therapy[J]. Journal of Infection and Chemotherapy, 2015, 21(9): 680-686. DOI:10.1016/j.jiac.2015.06.004 |
| [32] |
Wu TT, Huang Q, Wang XL, et al. Mechanistic investigation on ROS resistance of phosphorothioated DNA[J]. Scientific Reports, 2017, 7: 42823. DOI:10.1038/srep42823 |
| [33] |
Fu RY, Chen J, Li Y. The function of glutathione/glutathione peroxidase system in the oxidative stress resistance systems of microbial cells[J]. Chinese Journal of Biotechnology, 2007, 23(5): 770-775. (in Chinese) 付瑞燕, 陈坚, 李寅. 谷胱甘肽/谷胱甘肽过氧化物酶系统在微生物细胞抗氧胁迫系统中的作用[J]. 生物工程学报, 2007, 23(5): 770-775. DOI:10.3321/j.issn:1000-3061.2007.05.002 |
 2020, Vol. 47
2020, Vol. 47




