扩展功能
文章信息
- 牟丹, 周家喜, 张鑫, 张晓敏, 张庆明, 邹晓
- MOU Dan, ZHOU Jia-Xi, ZHANG Xin, ZHANG Xiao-Min, ZHANG Qing-Ming, ZOU Xiao
- 烟叶陈化过程可培养微生物的生态功能
- Ecological function of culturable microorganisms during tobacco leaf aging
- 微生物学通报, 2020, 47(2): 362-369
- Microbiology China, 2020, 47(2): 362-369
- DOI: 10.13344/j.microbiol.china.190425
-
文章历史
- 收稿日期: 2019-05-15
- 接受日期: 2019-07-12
- 网络首发日期: 2019-08-27
2. 上海烟草集团有限责任公司 上海 200082;
3. 贵州中烟工业有限责任公司 贵州 贵阳 550001
2. Shanghai Tobacco Group Co. Ltd., Shanghai 200082, China;
3. China Tobacco Guizhou Idustrial Co. Ltd., Guiyang, Guizhou 550001, China
烟叶采摘烘烤后会带有青杂气和刺激性气味,香吃味不足,口味不佳,不适合用于卷烟加工。在烟草工业中,需对新烤烟叶陈化处理以改善烟叶品质。烟叶陈化是环境、化学、酶及微生物等共同作用的过程,其中微生物因子作用贯穿始终[1]。在烟叶陈化的过程中微生物的代谢活动可消耗烟叶中的蛋白质、纤维素及淀粉等[2];同时也将烟叶中大分子物质分解为紫罗兰酮、大马酮、糠醛等小分子香味物质[3-4]。烟叶的陈化过程也是一个生态降解过程[5],主要的生物驱动力是微生物,不同陈化阶段的微生物具有不同的生态功能。研究显示微生物种类和丰度与烟叶成分的降解、积累有关,如芽孢杆菌和小球菌能降低烟叶中蛋白质及烟碱的含量[6];酵母菌可有效阻止烟叶中亚硝酸盐和亚硝胺的积累[7];假单胞菌对尼古丁有较强降解能力[8];巨大芽孢杆菌可促进类胡萝卜素类、萜烯类和苯丙氨酸类等致香物质的积累等[9]。也有研究显示,在烟叶陈化中添加真菌菌剂可促进烟叶中化学成分的协调[10-11]和内含物质的转化[12]。因此,研究陈化过程中微生物群落及功能类群的变化对烟叶陈化技术的改进及微生物资源的丰富与利用具有重要意义。
本研究对不同陈化阶段的烟叶微生物进行分离培养,采用rDNA条形码技术进行物种鉴定,分析烟叶表面可培养微生物群落动态变化,分别对细菌和真菌进行功能注释,并结合主要化学成分相关性分析,以期揭示三者之间的作用关系,加深对烟叶陈化机制的理解。
1 材料与方法 1.1 烟叶样品采集存于贵阳库、坛厂库、茅台库3个储烟仓库中9个不同等级的、分别陈化0、3、6、9、12、15、18、21、24个月的烟叶,共243个烟叶样品,用于菌种分离鉴定。
1.2 培养基牛肉膏蛋白胨培养基(g/L):牛肉膏3.0,蛋白胨10.0,NaCl 5.0,琼脂18.0,pH 7.2-7.4。马丁氏培养基(g/L):KH2PO4 1.0,MgSO4·7H2O 0.5,蛋白胨5.0,葡萄糖10.0,琼脂18.0,1%孟加拉红水溶液3.3 mL,pH自然。PDA培养基(g/L):土豆200.0,葡萄糖20.0,琼脂18.0,pH自然。以上培养基均在0.1 MPa灭菌30 min。
1.3 主要试剂和仪器植物基因组DNA提取试剂盒、细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司。PCR仪,杭州柏恒科技有限公司;光学显微镜,重庆奥特光学仪器有限公司。
1.4 方法 1.4.1 烟叶表面可培养微生物的分离称取10 g烟叶样品,切碎后加入到90 mL的磷酸缓冲液(pH 7.0)中摇匀,24 ℃、120 r/min培养30 min得到微生物原菌液。吸取1 mL原菌液至9 mL无菌水中进行稀释。分别吸取1 mL已稀释至10-2-10-7浓度的菌液加入到无菌培养皿中,10-4-10-6浓度加入到马丁氏培养基,10-5-10-7浓度加入到牛肉膏蛋白胨培养基,24 ℃培养5 d。分别统计可培养细菌、真菌的菌落数量及种类,以菌落数×稀释倍数给出每类微生物的数量及种类。
1.4.2 优势菌株DNA的提取、鉴定挑取单菌落纯化培养,刮取菌丝,用细菌和植物DNA基因组提取试剂盒提取烟叶细菌和真菌DNA。PCR反应体系(25 μL):ITS1 (10 μmol/L) 1 μL,ITS4 (10 μmol/L) 1 μL,2×Master Mix (green) 21 μL,模板DNA 2 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃ 5 min。扩增产物送昆明擎科生物有限公司测序。真菌引物ITS1 (5′-TCCGTAGGTGAAC CTGCGG-3′)和ITS4 (5′-TCCTCCGCTTATTGATA TGC-3′),细菌引物27F (5′-AGAGTTTGATCCTG GCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGA CTT-3′)。
1.4.3 化合物检测有机碳采用高温外热重铬酸钾氧化容量法;全氮经H2SO4-H2O2消煮后采用半微量凯氏法;全磷经H2SO4-H2O2消煮后采用钼黄比色法;全钾经H2SO4-H2O2消煮后采用火焰分光光度法[13]。
1.4.4 数据处理扩增序列经手工校对后,细菌参照RDP (http://rdp.cme.msu.edu)和NCBI (https://blast.ncbi.nlm.nih.gov)数据库[14],真菌参照BOLD (http://www.boldsystems.org)和NCBI数据库[15]进行物种鉴定。结合不同陈化阶段的优势微生物及关键微生物类群变化,利用SPSS 22.0数据统计软件对微生物群落与主要化学变化进行相关性分析。利用FAPROTAX (http://www.zoology.ubc.ca/louca/FAPROTAX/lib/php/index.php?section=Home)数据库对细菌功能进行注释;利用FUNGuild (http://funguild.org)数据库预测真菌群落的生态功能[16],置信水平选用可能(probable)和很可能(highly probable)。
2 结果与分析 2.1 烟叶可培养微生物群落组成通过传统分离培养,从烟叶中共筛选得到189株细菌菌株和229株真菌菌株。经分子鉴定,细菌共归属于4门8纲14目25科38属,真菌包括2门4纲9目19科26属。其中芽孢杆菌属(Bacillus)和沙雷氏菌属(Serratia)为细菌优势属,分别占细菌总菌株数的27.51%、12.17% (图 1A);同时还有葡萄球菌属(Staphylococcus) (7.94%)、苍白杆菌属(Ochrobactrum) (7.41%)、寡养单胞菌属(Stenotrophomonas) (6.35%)和不动杆菌属(Acinetobacter) (4.23%)等占较大比例。真菌群落中曲霉属(Aspergillus)和青霉属(Penicillium)优势显著,分别占真菌总菌株数的33.77%、30.26%,为优势种群(图 1B);其次是枝孢属(Cladosporium),占7.89%。另外,真菌群落中栓菌属(Trametes) (4.82%)、篮状菌属(Talaromyces) (3.51%)、齿耙菌属(Irpex) (3.07%)也较为丰富。
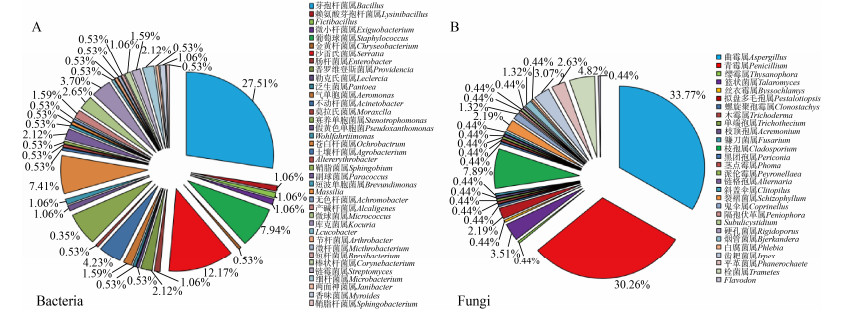
|
| 图 1 烟叶表面可培养细菌(A)和真菌(B)群落结构 Figure 1 Community structure of culturable bacteria (A) and fungi (B) on tobacco leaf surface |
|
|
研究发现,烟叶表面可培养微生物群落结构随着陈化时间的增加而不断变化。随烟叶陈化时间的延长,烟叶表面可培养微生物群落结构由复杂变简单,优势微生物比例先减少后增加(图 2)。陈化前期微生物菌群较丰富,细菌主要为芽孢杆菌属、沙雷氏菌属和苍白杆菌属等;真菌主要是曲霉属和青霉属等。随陈化时间延长,许多优势菌群逐渐减少或消失,陈化到18个月时,细菌主要有芽孢杆菌属、葡萄球菌属和Fictibacillus,真菌主要包括曲霉属、青霉属和枝孢属。到21个月时,15-18个月时间段内检测不到的菌群又会大量出现,如副球菌属(Paracoccus)、假黄色单胞菌属(Pseudoxanthomonas)、库克菌属(Kocuria)、链格孢属(Alternaria)等。
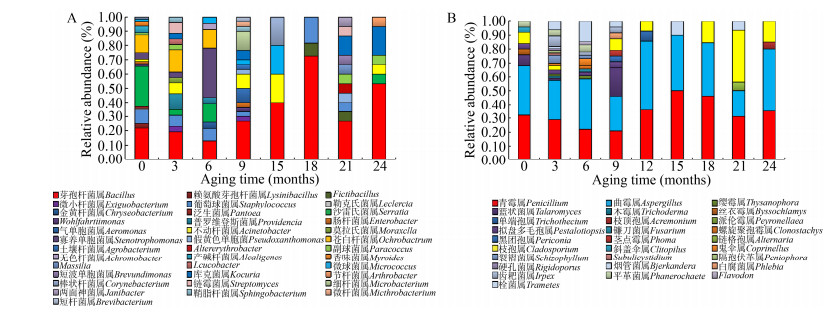
|
| 图 2 可培养微生物群落动态 Figure 2 Dynamics of culturable microbial communities |
|
|
根据物种分类结果,通过FAPROTAX数据库对烟叶可培养细菌进行功能注释,除未鉴定类群外,细菌获得63种功能分组,相对丰度较高的15种细菌功能分组如图 3A所示。陈化开始时,烟叶中存在丰富的化能异养(chemoheterotrophy)、硝酸盐还原(nitrate reduction)、动物寄生虫或共生体(animal parasites or symbionts)、人体病原菌(human pathogens all)等类群;随着陈化时间的延长,优势功能类群比例降低,15个月时最低,主要为化能异养类群(chemoheterotrophy和Aerobic chemoheterotrophy);到陈化后期,主要的优势功能分组为化能异养(chemoheterotrophy)、硝酸盐还原(nitrate reduction)和其他功能类群。基于FUNGuild数据库分析,除未鉴定类群,烟叶可培养真菌包括9个生态功能群(图 3B)。整个陈化过程主要以植物病原(plant pathogen)、木腐菌(wood saprotroph)、植物病原-木腐菌(plant pathogen-wood saprotroph)和未定义腐生菌(undefined saprotroph)类群为主;除此还存在少量的动物病原-植物病原-木腐菌(animal pathogen- plant pathogen-wood saprotroph)、粪生菌-植物腐生菌-木腐菌(dung saprotroph-plant saprotroph-wood saprotroph)和内生菌群(endophyte)。陈化3个月和24个月时分别仅一个OTU被认定为内生-植物病原(endophyte-plant pathogen)和真菌寄生菌(fungal parasite)。

|
| 图 3 烟叶可培养细菌(A)和真菌(B)生态功能群变化 Figure 3 Changes in ecological function groups of culturable bacteria (A) and fungi (B) in tobacco leaves |
|
|
由表 1和表 2可知,有机碳与细菌中Altererythrobacter、微球菌属(Micrococcus)、短波单胞菌属(Brevundimonas)、两面神菌属(Janibacter)呈显著正相关关系,相关系数为0.825;与真菌中链格孢属(Alternaria)呈显著正相关关系,相关系数为0.824。全氮与苍白杆菌属呈显著负相关关系,相关系数为-0.757;与拟盘多毛孢属(Pestalotiopsis)呈显著正相关,相关系数0.836;与平革菌属(Phanerochaete)显著负相关,相关系数-0.695。全磷与葡萄球菌属、苍白杆菌属呈显著正相关关系,相关系数分别为0.734、0.804;与曲霉属、拟盘多毛孢属、平革菌属显著正相关,相关系数分别为0.779、0.800、0.805。全钾与Fictibacillus呈显著正相关,相关系数0.795;与曲霉属、拟盘多毛孢属呈显著正相关关系,相关系数为0.679、0.753。随着陈化时间的延长,烟叶主要化学成分在不断变化,微生物群落也在不断改变,两者之间联系密切。
| 细菌群落Bacterial community | 有机碳Organic carbon | 全氮Nitrogen | 全磷Phospharus | 全钾Potassium | |
| 芽孢杆菌属Bacillus | -0.388 | -0.239 | 0.352 | -0.141 | |
| 赖氨酸芽孢杆菌属Lysinibacillus | -0.446 | -0.530 | 0.447 | -0.594 | |
| Fictibacillus | 0.532 | 0.560 | -0.293 | 0.795* | |
| 微小杆菌属Exiguobacterium | -0.599 | -0.560 | 0.293 | -0.682 | |
| 葡萄球菌属Staphylococcus | -0.412 | -0.619 | 0.734* | -0.317 | |
| 金黄杆菌属Chryseobacterium | -0.019 | -0.204 | 0.447 | -0.173 | |
| 沙雷氏菌属Serratia | -0.277 | -0.495 | 0.543 | -0.321 | |
| Wohlfahrtiimonas | -0.452 | -0.498 | 0.293 | -0.425 | |
| 普罗维登斯菌属Providencia | -0.449 | -0.593 | 0.592 | -0.646 | |
| 肠杆菌属Enterobacter | -0.452 | -0.498 | 0.293 | -0.425 | |
| 气单胞菌属Aeromonas | -0.338 | -0.204 | -0.064 | -0.299 | |
| 不动杆菌属Acinetobacter | -0.595 | -0.485 | 0.085 | -0.681 | |
| 寡养单胞菌属Stenotrophomonas | -0.170 | -0.438 | 0.671 | -0.344 | |
| 假黄色单胞菌Pseudoxanthomonas | 0.372 | 0.187 | -0.293 | 0.088 | |
| 苍白杆菌属Ochrobactrum | -0.465 | -0.757* | 0.804* | -0.594 | |
| Altererythrobacter | 0.825* | 0.448 | -0.319 | 0.415 | |
| 副球菌属Paracoccus | 0.228 | 0.000 | 0.169 | -0.209 | |
| 产碱杆菌属Alcaligenes | -0.254 | -0.448 | 0.447 | -0.257 | |
| Massilia | 0.825* | 0.448 | -0.319 | 0.415 | |
| 微球菌属Micrococcus | -0.311 | -0.485 | 0.169 | -0.375 | |
| 短波单胞菌属Brevundimonas | 0.825* | 0.448 | -0.319 | 0.415 | |
| 库克菌属Kocuria | 0.351 | 0.458 | -0.378 | 0.000 | |
| 链霉菌属Streptomyces | -0.032 | -0.291 | 0.273 | -0.367 | |
| 细杆菌属Microbacterium | -0.338 | -0.204 | -0.064 | -0.299 | |
| 两面神菌属Janibacter | 0.825* | 0.448 | -0.319 | 0.415 | |
| 鞘脂杆菌属Sphingobacterium | -0.599 | -0.560 | 0.293 | -0.682 | |
| 注:*:在0.05水平显著相关;**:在0.01水平极显著相关,下同.
Note: *: Significant correlation at 0.05 level; **: Highly significant correlation at 0.01 level. The same below. | |||||
| 真菌群落Fungal community | 有机碳Organic carbon | 全氮Nitrogen | 全磷Phospharus | 全钾Potassium |
| 青霉属Penicillium | -0.429 | -0.578 | 0.650 | -0.563 |
| 曲霉属Aspergillus | -0.501 | -0.631 | 0.779* | 0.679* |
| 缨霉属Thysanophora | 0.012 | -0.188 | 0.450 | -0.129 |
| 篮状菌属Talaromyces | -0.454 | -0.454 | 0.211 | -0.431 |
| 木霉属Trichoderma | -0.399 | -0.509 | 0.450 | -0.528 |
| 单端孢属Trichothecium | -0.242 | -0.107 | -0.056 | -0.288 |
| 枝顶孢属Acremonium | 0.242 | 0.536 | -0.309 | 0.151 |
| 派伦霉属Peyronellaea | -0.399 | -0.509 | 0.450 | -0.528 |
| 拟盘多毛孢属Pestalotiopsis | -0.595 | 0.836** | 0.800** | 0.753* |
| 镰刀菌属Fusarium | 0.012 | -0.188 | 0.450 | -0.129 |
| 螺旋聚孢霉属Clonostachys | 0.012 | -0.188 | 0.450 | -0.129 |
| 黑团孢属Periconia | -0.295 | -0.188 | -0.056 | -0.248 |
| 茎点霉属Phoma | -0.295 | -0.188 | -0.056 | -0.248 |
| 链格孢属Alternaria | 0.824** | 0.456 | -0.309 | 0.430 |
| 枝孢属Cladosporium | 0.634 | 0.476 | -0.234 | 0.377 |
| 斜盖伞属Clitopilus | -0.215 | -0.429 | 0.450 | -0.209 |
| 鬼伞属Coprinellus | -0.177 | -0.417 | 0.636 | -0.370 |
| 裂褶菌属Schizophyllum | -0.396 | -0.556 | 0.563 | -0.560 |
| Subulicystidium | -0.399 | -0.509 | 0.450 | -0.528 |
| 隔孢伏革属Peniophora | -0.399 | -0.509 | 0.450 | -0.528 |
| 烟管菌属Bjerkandera | 0.393 | 0.054 | -0.281 | 0.062 |
| 白腐菌属Phlebia | -0.295 | -0.188 | -0.056 | -0.248 |
| 齿耙菌属Irpex | -0.463 | -0.593 | 0.537 | -0.613 |
| 平革菌属Phanerochaete | -0.414 | -0.695* | 0.805** | -0.611 |
| Flavodon | 0.012 | -0.188 | 0.450 | -0.129 |
| 栓菌属Trametes | -0.273 | -0.502 | 0.666 | -0.470 |
微生物参与了烟叶陈化的整个进程,并在其中扮演着不可替代的角色。本研究发现,陈化过程不同陈化时期烟叶表面可培养细菌种类繁多,有厚壁菌门、变形菌门、拟杆菌门和放线菌门,其中变形菌门为主要优势菌门。张成省等[17]、浦绍占等[18]、伍雪莹等[19]分离鉴定烟叶表面主要优势菌属为芽孢杆菌属、假单胞菌属、葡萄球菌属和肠杆菌属(Enterobacter)等,与本研究结果相似,但发现肠杆菌属细菌较少,而沙雷氏菌占有较大比例,这可能是由于不同产地的烟叶微生物群落组成不一致。研究结果表明,随陈化时间的延长,烟叶可培养优势微生物类群比例逐渐降低,由此可推断在烟叶陈化过程中微生物作用主要发生于15-18个月之前。进一步分析发现,陈化后期细菌种类和数量显著高于真菌,表明陈化前期为细菌和真菌共同作用,而后期主要是细菌作用。
微生物功能群与其群落结构的动态变化息息相关,丰富的群落组成对应着丰富的生态功能。本研究通过FAPROTAX数据库功能注释发现,细菌功能较为丰富,其中化能异养菌群占比很大,在属水平上主要为芽孢杆菌属、库克菌属、不动杆菌属等,高比例的化能异养菌有助于烟叶中有机质的降解;还注释到较高比例的硝酸盐和亚硝酸盐还原类群,在属水平上主要为芽孢杆菌属、气单胞菌属(Aeromonas)、肠杆菌属等,表明细菌在烟叶硝酸盐及亚硝酸盐的去除中发挥重要作用;除此之外,还有丰富的人体病原、动物寄生或共生菌、植物病原类群等,表明细菌通过多种途径获益于自身并作用于烟叶。通过FUNGuild注释发现存在大量的腐生菌及动植物病原,表明真菌主要通过破坏烟叶死的宿主细胞或损伤烟叶宿主细胞来获取营养,还通过少量的内生菌与宿主细胞交换资源以获得营养,促进了烟叶有机物质的逐级降解。
微生物群落变化与主要化学成分变化密切相关。与化学成分呈显著相关的苍白杆菌属、拟盘多毛孢属、平革菌属均只出现在陈化前6个月或9个月;除此,与化学成分显著相关的几类微生物Altererythrobacter、微球菌属、短波单胞菌属、两面神菌属、Fictibacillus、链格孢属均在陈化后期出现,表明化学成分的变化推动着微生物群落结构组成的改变。叶建斌等[20]研究推测原烟进入陈化阶段后,部分微生物不适应新的自然陈化条件而失活或消失。由此推测可能是由于陈化前期达不到部分微生物存活的条件,但当烟叶化学成分含量达到一定条件后微生物可重新存活并繁殖,这也可以解释陈化21个月时微生物类群为何大幅增加。
陈化过程中主要化学成分的变化影响了微生物群落的组成,微生物功能群通过结构变化推动烟叶陈化进程,两两之间相辅相成。近年来,部分微生物在烟叶陈化技术中得到了很好的利用[3, 8, 11],但大多微生物的功能还未被人们开发利用。因此开发更多烟叶微生物资源,了解其生态功能,对烟叶陈化具有重要指导意义。此外,烟叶表面可培养微生物在生物防治方面具有应用潜力。如枯草芽孢杆菌(Bacillus subtilis)对植物病原真菌具有较好的防治作用[21]。单宏英[22]从陈化烟叶表面分离得到的芽孢杆菌属(Bacillus) BC79菌株对烟草灰霉病原菌菌丝生长和孢子萌发有明显的抑制作用,可用于烟草灰霉病的生物防治。由此可见,烟叶附生的微生物资源不仅可应用于烟叶陈化,还具有其他重要的生态学功能。
| [1] |
Zhao MQ, Chen HH. Relationship between the decomposition and translation of chemical components and the quality formation during tobacco aging precedure[J]. Journal of Anhui Agricultural Sciences, 2006, 34(14): 3394-3397. (in Chinese) 赵铭钦, 陈红华. 烟叶陈化过程中化学成分的分解转化与品质形成的关系[J]. 安徽农业科学, 2006, 34(14): 3394-3397. DOI:10.3969/j.issn.0517-6611.2006.14.081 |
| [2] |
Yu HX, Wang Y, Ma YK, et al. Diversity of microorganism in fermented tobacco leaves and application status[J]. Journal of Hebei Agricultural Sciences, 2009, 13(10): 59-60, 70. (in Chinese) 于会喜, 王毅, 马永凯, 等. 发酵烟叶表面微生物的多样性及其应用现状[J]. 河北农业科学, 2009, 13(10): 59-60, 70. DOI:10.3969/j.issn.1088-1631.2009.10.024 |
| [3] |
Zhou J, Li XM, Xu CK, et al. Improvement on smoking quality of tobacco scraps with microorganism strain Yu-1[J]. Tobacco Science & Technology, 2002(6): 3-5. (in Chinese) 周瑾, 李雪梅, 许传坤, 等. 利用微生物发酵改良烤烟碎片品质的研究[J]. 烟草科技, 2002(6): 3-5. DOI:10.3969/j.issn.1002-0861.2002.06.001 |
| [4] |
Jia BL, Wei T, Huang S, et al. Isolation and identification of an α-carotenes-degradating strain and optimization of its fermentation conditions[J]. Food and Fermentation Industries, 2015, 41(1): 34-39. (in Chinese) 贾蓓蕾, 魏涛, 黄申, 等. α-胡萝卜素降解产香菌株的分离、鉴定及发酵条件优化[J]. 食品与发酵工业, 2015, 41(1): 34-39. |
| [5] |
Zhou JX, Yu LF, Zhang J, et al. Study on the characteristics of bacterial community succession in tobacco aging[J]. Acta Ecologica Sinica, 2018, 38(21): 7739-7748. (in Chinese) 周家喜, 喻理飞, 张健, 等. 烟叶陈化过程细菌群落演替特征[J]. 生态学报, 2018, 38(21): 7739-7748. |
| [6] |
Tamayo AI, Cancho FG. Microbiology of the fermentation of Spanish tobacco[J]. International Congress of Microbiology, 1953, 6: 48-50. |
| [7] |
Vigliotta G, Di Giacomo M, Carata E. Nitrite metabolism in Debaryomyces hansenii TOB-Y7, a yeast strain involved in tobacco fermentation[J]. Applied Microbiology and Biotechnology, 2007, 75(3): 633-645. DOI:10.1007/s00253-007-0867-2 |
| [8] |
Chen CM, Li XM, Yang JK, et al. Isolation of nicotine-degrading bacterium Pseudomonas sp. Nic22, and its potential application in tobacco processing[J]. International Biodeterioration & Biodegradation, 2008, 62(3): 226-231. |
| [9] |
Zhao MQ, Liu Y, Li FF, et al. Identification of dominant and fragrance-enhancing microorganisms of tobacco leaves during ripening[J]. Acta Microbiologica Sinica, 2009, 49(5): 624-630. (in Chinese) 赵铭钦, 刘云, 李芳芳, 等. 陈化烤烟叶面优势菌的筛选鉴定与其增香效应[J]. 微生物学报, 2009, 49(5): 624-630. DOI:10.3321/j.issn:0001-6209.2009.05.012 |
| [10] |
Xu J, Zhang XG, Zhang TY, et al. Improving tobacco quality by epiphyte agents[J]. Journal of Southwest Agricultural University (Natural Science), 2005, 27(2): 163-168, 172. (in Chinese) 徐洁, 张修国, 张天宇, 等. 微生物真菌菌剂对烟叶品质的影响[J]. 西南农业大学学报:自然科学版, 2005, 27(2): 163-168, 172. |
| [11] |
Zheng XG, Zhang XG, Zhang TY, et al. Improving tobacco quality by fungal leavens[J]. Microbiology China, 2003, 30(6): 10-13. (in Chinese) 郑小嘎, 张修国, 张天宇, 等. 真菌菌剂改善烟叶品质的初步研究[J]. 微生物学通报, 2003, 30(6): 10-13. DOI:10.3969/j.issn.0253-2654.2003.06.003 |
| [12] |
Li N, Zeng DL, Dai Y, et al. Isolation and identification on cultivable microorganisms from cigar leaf surface[J]. Journal of Anhui Agricultural Sciences, 2009, 37(25): 11857-11858. (in Chinese) 李宁, 曾代龙, 戴亚, 等. 雪茄烟叶叶面可培养微生物分离鉴定[J]. 安徽农业科学, 2009, 37(25): 11857-11858. DOI:10.3969/j.issn.0517-6611.2009.25.009 |
| [13] |
Zhou JX, Yu LF, Zhang XM, et al. Analysis of fungal community composition on the stored tobacco surfaces[J]. Mycosystema, 2018, 37(4): 434-443. (in Chinese) 周家喜, 喻理飞, 张晓敏, 等. 仓储烟叶表面真菌群落组成分析[J]. 菌物学报, 2018, 37(4): 434-443. |
| [14] |
Wang Q, Garrity GM, Tiedje JM, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [15] |
Ratnasingham S, Hebert PDN. BOLD: the barcode of life data system (http://www.barcodinglife.org)[J]. Molecular Ecology Notes, 2007, 7(3): 355-364
|
| [16] |
Nguyen NH, Song ZW, Bates ST, et al. FUNGuild: an open annotation tool for parsing fungal community datasets by ecological guild[J]. Fungal Ecology, 2016, 20: 241-248. DOI:10.1016/j.funeco.2015.06.006 |
| [17] |
Zhang CS, Lin JS, Kong FY, et al. Research on phyllosphere microflora in stored flue-cured tobacco strips in Shandong province[J]. Acta Tabacaria Sinica, 2010, 16(4): 58-62, 66. (in Chinese) 张成省, 林建胜, 孔凡玉, 等. 山东仓储片烟表面微生物区系研究[J]. 中国烟草学报, 2010, 16(4): 58-62, 66. DOI:10.3969/j.issn.1004-5708.2010.04.012 |
| [18] |
Pu SZ, Ma YK, Liu M, et al. Diversity of culturable bateria on the surface of naturally aged tobacco leaves in Yuxi region[J]. Chinese Journal of Microecology, 2016, 28(8): 920-925. (in Chinese) 浦绍占, 马永凯, 刘敏, 等. 玉溪地区自然陈化烟叶表面可培养细菌多样性研究[J]. 中国微生态学杂志, 2016, 28(8): 920-925. |
| [19] |
Wu XY, Liang SL, Han SY, et al. Diversity and phylogenetic analysis of bacterial communities on flue-cured tobacco leaves at different aged phases[J]. Guangdong Agricultural Sciences, 2014, 41(18): 28-33, 38. (in Chinese) 伍雪莹, 梁书利, 韩双艳, 等. 不同陈化期烤烟叶表细菌的多样性及发育分析[J]. 广东农业科学, 2014, 41(18): 28-33, 38. DOI:10.3969/j.issn.1004-874X.2014.18.009 |
| [20] |
Ye JB, Yan J, Liu XZ, et al. Study on change of bacteria populations of raw tobacco leaves before and after redrying[J]. Journal of Henan Agricultural Sciences, 2017, 46(1): 154-159. (in Chinese) 叶建斌, 闫记, 刘向真, 等. 原烟复烤前后细菌种群变化研究[J]. 河南农业科学, 2017, 46(1): 154-159. |
| [21] |
Yu XM, Ai CX, Xin L, et al. The siderophore-producing bacterium, Bacillus subtilis CAS15, has a biocontrol effect on Fusarium wilt and promotes the growth of pepper[J]. European Journal of Soil Biology, 2011, 47(2): 138-145. DOI:10.1016/j.ejsobi.2010.11.001 |
| [22] |
Shan HY. Studies on screening, identification and application of beneficial microorganisms isolated from aging tobacco surfaces[D]. Yangling: Master's Thesis of Northwest A & F University, 2012 (in Chinese) 单宏英.陈化烟叶表面有益微生物的分离筛选、鉴定及应用研究[D].杨凌: 西北农林科技大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/article/cdmd-10712-1012436640.htm |
 2020, Vol. 47
2020, Vol. 47




