扩展功能
文章信息
- 黄亦馨, 李晓, 赵津莹, 李锋, 宋浩, 骆健美
- HUANG Yi-Xin, LI Xiao, ZHAO Jin-Ying, LI Feng, SONG Hao, LUO Jian-Mei
- 一株耐盐产电菌Shewanella algae E-1的分离及其产电特性分析
- Isolation and characterization of a salt-tolerant exoelectrogenic strain Shewanella algae E-1
- 微生物学通报, 2020, 47(2): 351-361
- Microbiology China, 2020, 47(2): 351-361
- DOI: 10.13344/j.microbiol.china.190288
-
文章历史
- 收稿日期: 2019-04-06
- 接受日期: 2019-08-06
- 网络首发日期: 2019-10-17
2. 南开大学 分子微生物学与技术教育部重点实验室 天津 300110;
3. 系统生物工程教育部重点实验室 天津大学化工学院 天津 300071
2. Ministry of Education Key Laboratory of Molecular Microbiology and Technology, Nankai University, Tianjin 300110, China;
3. Key Laboratory of Systems Bioengineering (MOE), School of Chemical Engineering and Technology, Tianjin University, Tianjin 300071, China
微生物燃料电池(microbial fuel cells,MFCs)是利用微生物的催化作用氧化有机物(包括废水中的污染物)直接将化学能转化成电能的新型装置。由于具有废水处理和产生电能的双重作用,它在清洁能源生产、废水资源化处理、生物传感器开发及环境生物修复等领域表现出巨大的应用前景[1-4]。
产电微生物是微生物燃料电池系统的核心组成,其电化学活性由于菌种产生电子和传递电子的机制不同而表现出明显的差异[5]。目前已发现的产电微生物主要集中在变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)[6]。变形菌门主要包括假单胞菌属(Pseudomonas)[7]、希瓦氏菌属(Shewanella)[8]、克雷伯氏菌属(Klebsiella)[9]、地杆菌属(Geobacter)[10]、苍白杆菌属(Ochrobactrum)[11]、红育菌属(Rhodoferax)[12]、嗜酸菌属(Acidiphilium)[13]、气单胞菌属(Aeromonas)[14]、柠檬酸杆菌属(Citrobacter)[15]、弧形杆菌属(Arcobacter)[16]和脱硫弧菌属(Desulfovibrio)[17]等,厚壁菌门主要包括芽孢杆菌属(Bacillus)[18]和梭菌属(Clostridium)[19]等。
目前大部分产电微生物的来源为污水处理厂的活性污泥、沉积物、土壤和生物垃圾等。其中,天津科技大学的骆健美课题组以天津泰达污水处理厂污泥浓缩间的污泥为接种物接种并运行微生物燃料电池,从富集的阳极生物膜上先后分离得到一株Tolumonas osonensis P2-A-1和一株嗜根考克氏菌(Kocuria rhizophila) P2-A-5,该工作是这两个种内微生物产电性能的首次报道[20-21]。此外,彭月等从接种污水处理厂活性污泥的单室空气阳极生物膜上分离到一株克雷伯氏菌(Klebsiella sp.) Z6,该菌株以柠檬酸钠为底物时表现出较强的电化学活性[22]。2016年,姜允斌等[23]从阔叶林森林土壤中分离得到一株厌氧的生孢梭菌(Clostridium sporogenes) SE6,该菌可产生孢子,对环境因素的变化有很强的耐受能力,接种微生物燃料电池后发现它可通过细胞色素直接将电子传递至阳极,产生电能[23]。2015年,刘盛萍等以生物垃圾为底物,污水处理厂活性污泥为接种物构建双室MFCs,运行至稳定期后从阳极碳纤维布上分离得到的一株产电菌Nitratireductor sp. WJ5-4,该菌株可以利用较高固含量的生物垃圾产电,在生物垃圾处理方面表现出很好的应用价值[24]。近年来,研究者分别从近海的淤泥样品[25]和海域的潮间带表面沉积物[26]中分离和筛选来源于海洋的产电微生物,菌株的鉴定结果均为希瓦氏菌。但研究者很少对菌株在盐条件下的产电特性展开进一步分析。基于此,本文以取自南海的海水为接种液启动并运行阳极液中含有不同盐浓度的微生物燃料电池,从富集的阳极生物膜上分离得到了一株纯种微生物菌株E-1。分析菌株E-1在有无盐压力下的产电特性,并通过形态学观察、Biolog分析和16S rRNA基因序列比对鉴定其种属信息。研究成果有利于丰富耐盐产电微生物的多样性,为微生物燃料电池在海水资源化处理方面的应用提供新的实验材料。
1 材料与方法 1.1 材料 1.1.1 微生物分离和培养所用的培养基液体培养采用LB培养基,固体培养则采用加入2%琼脂的LB培养基。培养基pH调至7.0-7.2,1×105 Pa灭菌20 min。菌株鉴定培养基采用BUA+B培养平板,BUA培养基,Biolog公司。BUA+B培养基:51.7 g BUA加950 mL蒸馏水,无氧氮气吹洗,轻微煮沸,搅拌以溶解琼脂和其他组分,冷却后调pH为7.2±0.1,1×105 Pa灭菌15 min,盖紧瓶盖,防止氧气进入。在无氧的氮气保护下,冷却至40–45 ℃,加50 mL新鲜的脱纤羊血,摇匀;厌氧环境中倒平板。
1.1.2 阳极液(g/L)NH4Cl 0.31,KCl 0.13,Na2HPO4 4.576,NaH2PO4 2.452,pH调节为7.5,之后加入1 g/L的葡萄糖作为碳源,0.7×105 Pa灭菌30 min。
1.1.3 主要试剂和仪器Easy PureTM Genomic DNA Kit,北京全式金生物技术公司。电化学工作站,上海辰华仪器有限公司;直流多阻值电阻箱,天水长城电工仪器有限责任公司;普通光学显微镜,Olympus公司;扫描电子显微镜,Leo公司;自动微生物鉴定系统,Biolog公司。
1.2 产电微生物的富集与分离取自南海的海水经过简单的沉淀处理后接种于MFCs的阳极室,分别在阳极液含有0%和6.6% NaCl的两种条件下连续运行,待负载电阻两端的电压逐渐稳定后记录电压值用于表征电化学性质。菌株E-1和其他的分离株均分离自接种海水且在盐浓度下运行并达到稳定的单室空气阴极MFCs的阳极生物膜。具体步骤如下:在无菌操作台上用接种针刮取阳极生物膜若干,重悬于4 mL 0.9%的生理盐水制备成均匀的菌悬液,将其进行梯度稀释后涂布于分离的LB固体培养基上,37 ℃恒温条件下培养2 d,根据菌落形态、颜色、大小、表面和边缘特征,挑取特征差异明显的菌落,分别接种于LB液体培养基中再次富集培养,如此反复传代5-6次,得到纯培养的菌株。
1.3 微生物燃料电池的构建、启动和运行采用空气阴极单室型MFCs反应器,具体构建过程参考文献[20]。
将LB固体培养基上的菌体E-1接种一环到装有50 mL的LB液体培养基的250 mL三角瓶中,37 ℃、200 r/min振荡培养24 h,取菌液6 000×g离心10 min后收集菌体并用0.9%的生理盐水洗涤3次。将菌体分别重悬于含有不同NaCl浓度(0%和6.6%)的阳极液中(以1 g/L葡萄糖作为底物),使其初始OD600为1.0,然后接种到MFCs反应器中。反应器分别与外电阻(无特殊说明时外电阻均固定在1 000 Ω)和数据采集装置连接好,在37±1 ℃恒温条件下运行,运行过程中定期更换接种液。待出现连续两个稳定电压时即认为启动成功。当监测的输出电压低于50 mV时,开始更换阳极液。当获得稳定可重复的输出电压后,按照文献[20]的方法进行电流密度(I)和功率密度(P)等相关电化学参数的测定。
1.4 菌株在盐压力下的生长特性分析将培养过夜的菌液分别转接到含有0%、2%、4%、6.6% NaCl的50 mL LB液体培养基中,并将其初始OD600值调为一致。37 ℃、200 r/min振荡培养,不同时间取样测定OD600并绘制生长曲线。
1.5 菌株的形态观察分离纯化后得到的分离株在LB固体培养基上37 ℃恒温培养24-48 h,对单菌落的形态、颜色、透明度、大小、光滑、凸起、边缘整齐等特征进行观察和记录,并分别进行革兰氏染色。采用扫描电子显微镜观察菌体形态,电镜样品的预处理方法如下:菌株于LB液体培养基中37 ℃、200 r/min振荡培养12 h,培养液6 000×g离心3 min,倒掉上清,将沉淀物用PBS缓冲液悬浮,6 000×g离心5 min,重复上述步骤5次。将最后一步的沉淀悬浮后,过夜浸泡在含有2.5%戊二醛的PBS缓冲液中。第二天继续用PBS缓冲液洗5次,除掉残余的戊二醛。最后将处理完成的菌液按最适稀释比例取少量于5×5 mm的盖玻片上风干,拿到电镜室喷金,进行形态观察。
1.6 Biolog分析按照革兰氏阴性菌Biolog鉴定参数选择合适的培养条件[27]。参考文献[28]进行Biolog分析,具体方法为:将单菌落接种到BUA+B培养平板上,37 ℃培养24 h,用无菌牙签挑取少量新鲜菌落制成菌悬液,与标准菌悬液进行对照,误差范围小于±2,用八道移液枪进行Biolog GN II微孔板接种,每孔接种菌悬液150 μL,加盖30 ℃培养24 h后,打开微孔板盖,将微孔板放入自动微生物鉴定系统的结果自动读数仪中,显色结果与Biolog数据库进行比对分析。
Biolog鉴定结果有3个重要的参数需要考虑:可能性Probability (PROB),相似性Similarity (SIM)和位距Distance (DIST)。DIST和SIM是最重要的2个值,DIST值表示测试结果与数据库相应数据条的位距,SIM值表示测试结果与数据库相应数据条的相似程度。当DIST < 5.0,SIM > 0.75为良好的匹配;SIM值越接近于1,检定结果的可靠性越高[29]。
1.7 16S rRNA基因序列分析和系统发育树的构建采用Easy PureTM Genomic DNA Kit进行基因组总DNA的提取,具体步骤按照试剂盒的说明书操作。以提取的总DNA为模板,采用通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)对16S rRNA基因序列进行PCR扩增。PCR反应条件和反应体系参考文献[21]。PCR扩增产物经试剂盒纯化,用1%琼脂糖凝胶电泳检测合格后委托金唯智测序公司进行测序。测序结果提交NCBI (National Center of Biotechnology Information) GenBank用BLAST进行相似性检索和同源性比对。利用MEGA 7.0软件,采用基于Kimura 2-parameter模型的邻接法(neighbor-joining method)构建系统发育树,进化树分支稳定性用Bootstrap分析,重复1 000次。
2 结果与分析 2.1 产电微生物的富集和分离将海水接种于单室空气阴极MFCs的阳极室,分别在阳极液(以1 g/L葡萄糖为底物)含有0%和6.6% NaCl的两种条件下连续运行待系统进入稳定,此时,阳极膜上出现了肉眼可见的生物膜。由图 1可知,在无外源添加盐压力的条件下,系统在运行125 h后达到稳定,稳定电压约425 mV。在外源添加6.6% NaCl的条件下,系统在运行60 h后达到稳定,稳定电压约350 mV。这些结果表明,海水中含有一定数量的产电微生物,尤其是存在着一些耐盐产电微生物。因此,后续从接种海水且在盐浓度下运行且达到稳定的阳极生物膜上分离和筛选耐盐产电微生物。
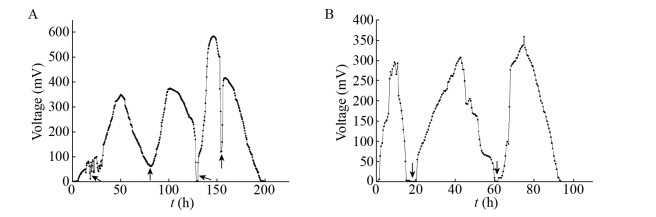
|
| 图 1 以海水为接种液的电压变化曲线图 Figure 1 The voltage output of seawater inoculation solution 注:A:以无外源添加NaCl的海水为接种液的电压变化曲线图;B:以外源添加6.6% NaCl的海水为接种液的电压变化曲线图. Note: A: The voltage change output of inoculation solution was taken as seawater without NaCl added externally; B: The voltage change output of inoculation solution was obtained by using seawater with 6.6% NaCl. |
|
|
根据菌落形态、颜色、大小、表面和边缘特征,挑取特征差异明显的9个菌株(表 1)分别接种电池,最终筛选到一株产电性能较好的分离株E-1。如图 2所示,在无外源添加盐压力的条件下,E-1接种MFCs后运行415 h后达到稳定,稳定电压约为554 mV,功率密度在电流密度为192.14 mA/m2时最大,达到51.69 mW/m2。
| 菌株编号 Strain No. |
菌体形态 Bacteria morphology |
菌落颜色 The color of the colony |
菌落大小 Size of the colony |
菌落表面 Surface of the colony |
边缘形态 Edge shape |
| E-1 | 短杆状Short rod | 浅棕黄色Light yellow | 直径2 mm 2 mm in diameter |
光滑Smooth | 边缘透明光滑,呈油脂状 The edges are transparent and smooth with an oily appearance |
| E-2 | 短杆状Short rod | 橘黄色Orange | 直径2 mm 2 mm in diameter |
光滑Smooth | 边缘整齐规则 Edge regularity |
| E-3 | 短杆状Short rod | 乳白色Milky white | 直径2 mm 2 mm in diameter |
光滑Smooth | 边缘整齐光滑 Edge regularity |
| E-4 | 短杆状Short rod | 橘黄色Orange | 直径2 mm 2 mm in diameter |
光滑Smooth | 边缘整齐规则 Edge regularity |
| E-5 | 圆球状Globular | 乳白色Milky white | 直径2 mm 2 mm in diameter |
光滑Smooth | 边缘整齐规则 Edge regularity |
| E-6 | 弧状Arc | 浅黄色Light yellow | 直径3 mm 3 mm in diameter |
光滑Smooth | 边缘整齐规则 Edge regularity |
| E-7 | 长杆状Long rod | 黄色Yellow | 直径2 mm 2 mm in diameter |
光滑Smooth | 边缘整齐规则 Edge regularity |
| E-8 | 短杆状Short rod | 乳白色Milky white | 直径3 mm 3 mm in diameter |
光滑Smooth | 边缘整齐规则 Edge regularity |
| E-9 | 短杆状Short rod | 浅橘色Shallow orange | 直径2 mm 2 mm in diameter |
光滑Smooth | 边缘整齐规则 Edge regularity |
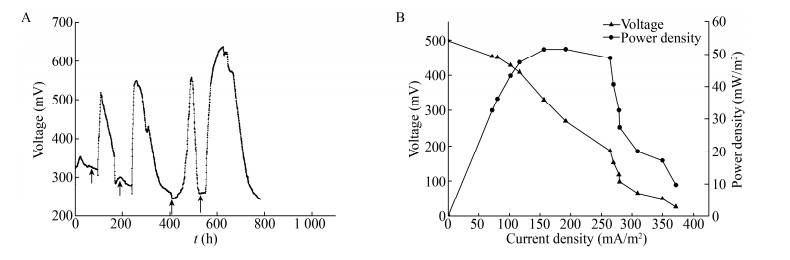
|
| 图 2 菌株E-1在无外源添加盐压力的条件下的产电性能 Figure 2 The electrogenic performance of strain E-1 without salt pressure Note: A: The voltage output; B: The polarization and power density curves. |
|
|
由图 3可知,在外源添加盐浓度6.6%的条件下,E-1接种MFCs运行98 h后达到稳定,稳定电压约为384 mV,其功率密度在电流密度为79.54 mA/m2时最大,达到26.56 mW/m2。比较图 2和图 3的结果可知,与无压力条件相比,NaCl添加后的系统达到稳定的时间缩短了76.4%,系统内阻增大了48.6%,产生的电压和功率密度分别下降了30.7%和48.6% (表 2)。推测E-1在盐浓度下良好的产电性能与其耐盐能力有关,为此测定了菌株在不同盐浓度下的生长曲线。由图 4可知,在NaCl浓度为0%的条件下,菌株的延滞期为0-2.5 h,对数期为2.5-16 h,培养21 h后OD600值达到最大,为1.66。随着NaCl浓度的增加,菌株的延滞期明显延长,达到稳定后的OD600值随之下降。当NaCl浓度为6.6%时,菌株的延滞期为0-6 h,对数期为6-23 h,培养25 h后OD600值达到最大,为1.53。
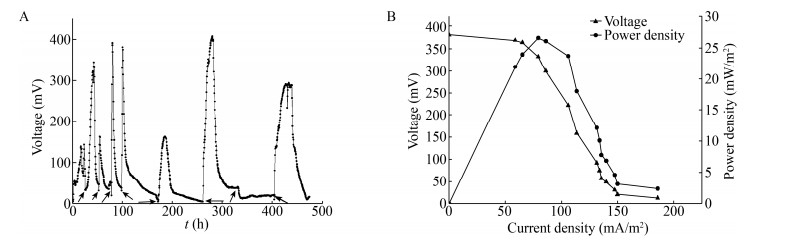
|
| 图 3 菌株E-1在外源添加盐压力6.6%的条件下的产电性能 Figure 3 The electrogenic performance of strain E-1 under exogenous salt pressure of 6.6% Note: A: The voltage output; B: The polarization and power density curves. |
|
|
| 电池运行条件 Battery condition |
稳定时间 Stabilization time (h) |
电压 Voltage (mV) |
系统内阻 The system internal resistance (Ω) |
功率密度 Power density (mW/m2) |
| 无外源添加NaCl No salt addition |
415 | 554 | 1 468.9 | 51.69 |
| 外源添加6.6% NaCl With addition of 6.6% NaCl |
98 | 384 | 2 859.1 | 26.56 |

|
| 图 4 菌株E-1在不同盐浓度下的生长曲线 Figure 4 Growth curves of strain E-1 at different salt concentrations |
|
|
E-1在LB固体培养基上培养后的单菌落形态呈圆形,为浅棕黄色,直径2 mm,边缘整齐,表面透明光滑,呈油脂状,分泌某种褐色物质使培养基呈现浅棕黄色(图 5A和5B);其革兰氏染色的结果为阴性(图 5C);菌体呈短杆状,长度约2.5 μm,宽度约0.5 μm (图 5D)。

|
| 图 5 菌株E-1的形态观察 Figure 5 The morphological observation of strain E-1 Note: A, B: The single colony morphology; C: The gram staining result; D: The scanning electron microscope image. |
|
|
由表 3可知,SIM值=0.94 > 0.75;DIS值= 0.89 < 5.0;PROB为100%。系统得到的3个重要参数比较理想,与数据库匹配良好,SIM值越接近1.00,说明鉴定结果的可靠性更高。在物种栏显示出一个最佳匹配名称:Shewanella algae,其他9种在名称栏里列出作为参考。菌种鉴定出阳性反应33种,阴性反应50种,边界反应12种。阳性反应表示目标菌株与数据库的匹配程度 > 80%,阴性反应表示样品菌与数据库匹配程度 < 20%,边界反应多于15个为鉴定结果不好,实验中为12。各种数据指标都表明鉴定结果准确,和数据库有很好的匹配,初步鉴定菌株E-1为海藻希瓦氏菌(Shewanella algae)。
| 物种Species | 可能性PROB (%) | 相似性SIM | 位距DIST | 类型Type |
| Shewanella algae | 100 | 0.94 | 0.89 | GN-NENT |
| Shewanella putrefaciens | 0 | 0.00 | 5.02 | GN-NENT |
| Myroides odoratimimus | 0 | 0.00 | 8.49 | GN-NENT |
| Psychrobacter phenylpyruvicus | 0 | 0.00 | 10.72 | GN-NENT |
| Pseudomonas alcaligenes | 0 | 0.00 | 11.82 | GN-NENT |
| Bordetella bronchiseptica | 0 | 0.00 | 11.86 | GN-NENT |
| Myroides odoratus | 0 | 0.00 | 12.04 | GN-NENT |
| Weeksella virosa | 0 | 0.00 | 12.12 | GN-NENT |
| Aquaspirillum diapar | 0 | 0.00 | 12.85 | GN-NENT |
| Bordetella hinzii | 0 | 0.00 | 12.89 | GN-NENT |
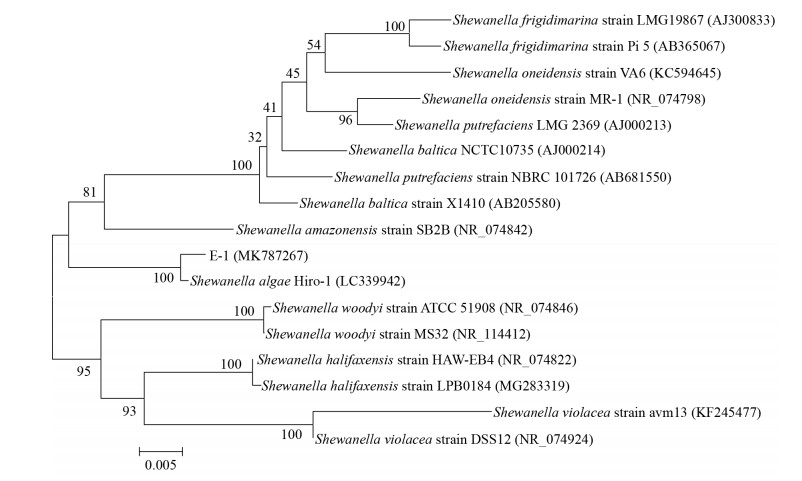
PCR扩增获得的菌株E-1的16S rRNA基因片段大小为1 450 bp (图 6),将序列提交至NCBI。BLAST结果显示,菌株E-1的16S rRNA基因序列与已知菌株Shewanella algae Hiro-1具有100%的相似性,以邻接(neighbor-joining)法构建系统发育树,从构建的系统发育树(图 7)可知,菌株E-1的16S rRNA基因与Shewanella algae Hiro-1处在系统发育树的同一分支,亲缘关系最为接近。综合上述形态学观察、Biolog分析和16S rRNA基因序列结果,将分离株E-1鉴定为Shewanella algae (GenBank登录号为MK787267)。
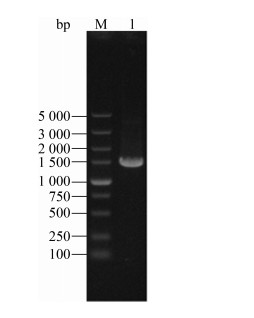
|
| 图 6 菌株E-1的16S rRNA基因PCR产物琼脂糖凝胶电泳分析 Figure 6 Agarose gel electrophoresis analysis of 16S rRNA gene PCR product of strain E-1 Note: M: DNA Marker; 1: 16S rRNA PCR product of strain E-1. |
|
|
|
| 图 7 菌株E-1基于16S rRNA基因构建的系统发育树 Figure 7 16S rRNA gene phylogenetic tree of strain E-1 注:括号中的序号表示菌株的GenBank登录号;各分支点显示的数字代表通过1 000次重复运算得到的置信值. Note: The serial number in brackets denotes the GenBank accession number of the strain; Bootstrap values (expressed as percentages of 1 000 replications) are shown at branch points. |
|
|
根据代谢微平板对照相应碳源,将该菌株分别涂布到含有不同碳源的基本无机盐固体培养基上,观察菌株是否生长分析其对碳源的利用程度。通过观察可知菌株能够利用乳酸、乙酸、琥珀酰胺酸、L-丙氨酸、尿苷等碳源,但不能利用L-阿拉伯糖、麦芽糖、蔗糖和甘油等碳源。此外,菌株在不同温度和pH条件下的生长情况表明,适宜生长的温度范围为25-40 ℃,pH范围为5.0-10.0。
3 讨论与结论本文以海水为接种液启动并运行阳极液中含有不同盐浓度的微生物燃料电池,从富集的阳极生物膜上分离得到一株纯培养的微生物菌株E-1。该菌株接种于不添加NaCl的微生物燃料电池中产生的最大输出电压和功率密度分别为554 mV和51.69 mW/m2。2013年,彭月等[22]将克雷伯氏菌Z6接种到单室空气阴极MFC中可产生的最大输出电压和最大功率密度分别为310 mV和14.35 mW/m2。2016年,姜允斌等[23]将分离的一株土壤产电菌Clostridium sporogenes SE6接种到MFCs中,其产生的稳定电压和最大功率密度分别为118 mV和44 mW/m2。相比于这些已报道的产电微生物,菌株E-1显示出较强的电化学活性。更值得注意的是,菌株E-1在外源添加盐浓度6.6%的微生物燃料电池中产生的稳定电压和最大功率密度分别达到384 mV和26.56 mW/m2,目前关于耐盐产电微生物的报道较少且菌株的产电水平仍停留在较低水平。2010年,Huang等[30]从沿海海洋沉积物中分离得到了一株可以在盐浓度1%-8%生长并产电的Shewanella marisflavi EP1菌,该菌株在6% NaCl下达到最大输出电压219 mV和最大功率密度9.6 mW/m2。同年,王彪等[31]利用石墨电极对来源于深海的产电菌Shewanella sp. DS1在NaCl浓度为1%-7%条件下的产电性能进行了分析,菌株的最佳盐度为3%,在该条件下产生的最大输出电压为202 mV,最大功率密度为17.21 mW/m2。2016年,李鹏等[32]从浙江省舟山海域潮间带中筛选出一株产电菌Shewanella sp. m2,对菌株的培养条件进行系统优化后该菌株在NaCl浓度为1.035%下产生的最大输出电压为115 mV。与这些结果相比较,菌株E-1这种在盐胁迫下表现出的良好电化学活性,使得其在海水资源化处理方面表现出巨大的应用潜力和优势。
此外,研究者发现内阻是限制产电性能的主要因素[33],而盐度则会构成内阻的主要限制因素[30],电压会随着NaCl浓度的增大先升高后降低。这可能是因为在合适的盐度范围内,溶液离子强度的提高可以显著降低总内阻,有利于提高产电性能,但盐浓度太高时,会对产电菌的代谢活性产生胁迫作用,进而降低其电化学活性。李尔炀等研究发现假单胞菌在含有5% NaCl浓度的条件下,延滞期由原来的24 h增长至35 h左右,稳定期达到的最大OD600值由1.6下降到0.35左右[34]。在本论文中,菌株E-1的最适盐浓度为6.6%,延滞期由原来的2.5 h增长至6 h左右,稳定期达到的最大OD600值由1.66下降到1.53左右。与上述工作相比,菌株E-1对盐具有较强的耐受性,在盐压力下生长状态良好,这也可能是其在含盐条件下表现出良好产电性能的重要原因。
通过综合形态学观察、Biolog分析和16S rRNA基因序列结果,分离株E-1被鉴定为海藻希瓦氏菌(Shewanella algae)。海藻希瓦氏菌最早于1985年由Kotaki等从红藻表面分离出来,当时被命名为OK-1;海藻希瓦氏菌OK-1是革兰氏阴性菌,杆状,有极生鞭毛,氧化酶反应阳性,不产气,根据这些特征Kotaki等将其归入假单胞菌属[35]。1990年,Simidu分析了OK-1的(G+C)mol%含量和16S rRNA基因碱基序列特点后发现OK-1与希瓦氏菌属有较近的亲缘关系,但因OK-1与腐败希瓦氏菌(Shewanella putrefaciens)的碱基序列间仍存在显著差异,所以将OK-1定义为一种新的希瓦氏菌,即海藻希瓦氏菌(Shewanella alga)[36],在1997年正式更名为Shewanella algae。目前,关于海藻希瓦氏菌的应用大多集中在发酵生产河豚毒素以及抑制对金属材料的腐蚀性能方面[37-38]。本论文是首次对Shewanella algae种内微生物的产电性能及其在微生物燃料电池中应用的报道,成果丰富了耐盐产电微生物的种类,并为后续利用微生物燃料电池技术进行海水资源化处理提供了新的研究思路和新的实验材料。
| [1] |
Logan BE. Exoelectrogenic bacteria that power microbial fuel cells[J]. Nature Reviews Microbiology, 2009, 7(5): 375-381. DOI:10.1038/nrmicro2113 |
| [2] |
Chang IS, Moon H, Jang JK, et al. Improvement of a microbial fuel cell performance as a BOD sensor using respiratory inhibitors[J]. Biosensors and Bioelectronics, 2005, 20(9): 1856-1859. DOI:10.1016/j.bios.2004.06.003 |
| [3] |
Logan BE, Hamelers B, Rozendal R, et al. Microbial fuel cells: methodology and technology[J]. Environmental Science & Technology, 2006, 40(17): 5181-5192. |
| [4] |
Lovley DR. Microbial fuel cells: novel microbial physiologies and engineering approaches[J]. Current Opinion in Biotechnology, 2006, 17(3): 327-332. DOI:10.1016/j.copbio.2006.04.006 |
| [5] |
Bond DR, Holmes DE, Tender LM, et al. Electrode-reducing microorganisms that harvest energy from marine sediments[J]. Science, 2002, 295(5554): 483-485. DOI:10.1126/science.1066771 |
| [6] |
Li Y, Sun YM, Kong XY, et al. Progress in research of electrigens in microbial fuel cell[J]. Microbiology China, 2009, 36(9): 1404-1409. (in Chinese) 李颖, 孙永明, 孔晓英, 等. 微生物燃料电池中产电微生物的研究进展[J]. 微生物学通报, 2009, 36(9): 1404-1409. |
| [7] |
Jayapriya J, Ramamurthy V. Use of non-native phenazines to improve the performance of Pseudomonas aeruginosa MTCC 2474 catalysed fuel cells[J]. Bioresource Technology, 2012, 124: 23-28. DOI:10.1016/j.biortech.2012.08.034 |
| [8] |
Ringeisen BR, Henderson E, Wu PK, et al. Correction to high power density from a miniature microbial fuel cell using Shewanella oneidensis DSP10[J]. Environmental Science & Technology, 2006, 40(8): 2629-2634. |
| [9] |
Xia X, Cao XX, Liang P, et al. Electricity generation from glucose by a Klebsiella sp. in microbial fuel cells[J]. Applied Microbiology and Biotechnology, 2010, 87(1): 383-390. DOI:10.1007/s00253-010-2604-5 |
| [10] |
Bond DR, Lovley DR. Electricity production by Geobacter sulfurreducens attached to electrodes[J]. Applied and Environmental Microbiology, 2003, 69(3): 1548-1555. DOI:10.1128/AEM.69.3.1548-1555.2003 |
| [11] |
Zuo Y, Xing DF, Regan JM, et al. Isolation of the exoelectrogenic bacterium Ochrobactrum anthropi YZ-1 by using a U-tube microbial fuel cell[J]. Applied and Environmental Microbiology, 2008, 74(10): 3130-3137. DOI:10.1128/AEM.02732-07 |
| [12] |
Chaudhuri SK, Lovley DR. Electricity generation by direct oxidation of glucose in mediatorless microbial fuel cells[J]. Nature Biotechnology, 2003, 21(10): 1229-1232. DOI:10.1038/nbt867 |
| [13] |
Borole AP, O'Neill H, Tsouris C, et al. A microbial fuel cell operating at low pH using the acidophile Acidiphilium cryptum[J]. Biotechnology Letters, 2008, 30(8): 1367-1372. DOI:10.1007/s10529-008-9700-y |
| [14] |
Chopra AK, Xu XJ, Ribardo D, et al. The cytotoxic enterotoxin of Aeromonas hydrophila induces proinflammatory cytokine production and activates arachidonic acid metabolism in macrophages[J]. Infection and Immunity, 2000, 68(5): 2808-2818. DOI:10.1128/IAI.68.5.2808-2818.2000 |
| [15] |
Xu S, Liu H. New exoelectrogen Citrobacter sp. SX-1 isolated from a microbial fuel cell[J]. Journal of Applied Microbiology, 2011, 111(5): 1108-1115. DOI:10.1111/j.1365-2672.2011.05129.x |
| [16] |
Fedorovich V, Knighton MC, Pagaling E, et al. Novel electrochemically active bacterium phylogenetically related to Arcobacter butzleri, isolated from a microbial fuel cell[J]. Applied and Environmental Microbiology, 2009, 75(23): 7326-7334. DOI:10.1128/AEM.01345-09 |
| [17] |
Cooney MJ, Roschi E, Marison IW, et al. Physiologic studies with the sulfate-reducing bacterium Desulfovibrio desulfuricans: evaluation for use in a biofuel cell[J]. Enzyme and Microbial Technology, 1996, 18(5): 358-365. DOI:10.1016/0141-0229(95)00132-8 |
| [18] |
Nimje VR, Chen CY, Chen CC, et al. Corrigendum to "Stable and high energy generation by a strain of Bacillus subtilis in a microbial fuel cell"[Journal of Power Sources 190 (2) (2009) 258-263][J]. Journal of Power Sources, 2010, 195(16): 5427-5428. DOI:10.1016/j.jpowsour.2010.02.001 |
| [19] |
Park HS, Kim BH, Kim HS, et al. A novel electrochemically active and Fe(Ⅲ)-reducing bacterium phylogenetically related to Clostridium butyricum isolated from a microbial fuel cell[J]. Anaerobe, 2001, 7(6): 297-306. DOI:10.1006/anae.2001.0399 |
| [20] |
Li M, Liang X, Luo JM, et al. Isolation of an exoelectrogen Kocuria rhizophila from the anodic biofilm and optimization of its power generation[J]. Acta Scientiae Circumstantiae, 2015, 35(10): 3078-3087. (in Chinese) 李明, 梁湘, 骆健美, 等. 一株产电菌嗜根考克氏菌(Kocuria rhizophila)的分离及其产电性能优化[J]. 环境科学学报, 2015, 35(10): 3078-3087. |
| [21] |
Luo JM, Yang J, He HH, et al. A new electrochemically active bacterium phylogenetically related to Tolumonas osonensis and power performance in MFCs[J]. Bioresource Technology, 2013, 139: 141-148. DOI:10.1016/j.biortech.2013.04.031 |
| [22] |
Peng Y, Zhu NW, Nie HY. Isolation of an electrogen Klebsiella sp. Z6 from anodic biofilm and its electricity-generating characteristics[J]. Acta Scientiae Circumstantiae, 2013, 33(4): 1035-1042. (in Chinese) 彭月, 朱能武, 聂红燕. 一株克雷伯氏菌(Klebsiella sp.)Z6的分离及其产电特性研究[J]. 环境科学学报, 2013, 33(4): 1035-1042. |
| [23] |
Jiang YB, Deng H, Huang XQ, et al. Characterization of a novel electrogenic Clostridium sporogenes isolated from forest soil[J]. Acta Microbiologica Sinica, 2016, 56(5): 846-855. (in Chinese) 姜允斌, 邓欢, 黄新琦, 等. 一株土壤产电菌Clostridium sporogenes的分离及其产电性能[J]. 微生物学报, 2016, 56(5): 846-855. |
| [24] |
Liu SP, Wu J, Wu K, et al. Isolation and characterization of an electricity-producing strain Nitratireductor sp. WJ5-4[J]. Microbiology China, 2015, 42(4): 665-673. (in Chinese) 刘盛萍, 吴晶, 吴克, 等. 一株产电菌Nitratireductor sp. WJ5-4的筛选及产电分析[J]. 微生物学通报, 2015, 42(4): 665-673. |
| [25] |
Huang JX. Isolation of current producing bacteria and application in microbial fuel cells[D]. Hefei: Doctoral Dissertation of University of Science and Technology of China, 2009 (in Chinese) 黄杰勋.产电微生物菌种的筛选及其在微生物燃料电池中的应用研究[D].合肥: 中国科学技术大学博士学位论文, 2009 |
| [26] |
Wang B, Huang JX, Zhang XB, et al. Isolation and characterization of an electricity-producing strain Shewanella sp. S2 from marine[J]. Microbiology China, 2010, 37(3): 342-348. (in Chinese) 王彪, 黄杰勋, 章晓波, 等. 一株海洋产电菌Shewanella sp. S2的筛选和产电分析[J]. 微生物学通报, 2010, 37(3): 342-348. |
| [27] |
Li Y, Sheng H, Zhao RH. Utilization of Biolog microbes identification system in the identification of microbial species[J]. Liquor-Making Science & Technology, 2005(7): 84-85. (in Chinese) 李运, 盛慧, 赵荣华. Biolog微生物鉴定系统在菌种鉴定中的应用[J]. 酿酒科技, 2005(7): 84-85. DOI:10.3969/j.issn.1001-9286.2005.07.022 |
| [28] |
Liu J. Identification of an anaerobic fermentation strain Biolog and effects of different carbon sources on hydrogen production[J]. Environmental Study and Monitoring, 2008, 21(1): 11-13. (in Chinese) 刘婧. 一株厌氧发酵菌Biolog鉴定及利用不同碳源对产氢的影响[J]. 环境研究与监测, 2008, 21(1): 11-13. |
| [29] |
Cheng C, Yang M, Li JX, et al. Biolog microbial identification system—study on the operating regulation of bacteria identification[J]. Food and Fermentation Industries, 2006, 32(5): 50-54. (in Chinese) 程池, 杨梅, 李金霞, 等. Biolog微生物自动分析系统——细菌鉴定操作规程的研究[J]. 食品与发酵工业, 2006, 32(5): 50-54. DOI:10.3321/j.issn:0253-990X.2006.05.013 |
| [30] |
Huang JX, Sun BL, Zhang XB. Electricity generation at high ionic strength in microbial fuel cell by a newly isolated Shewanella marisflavi EP1[J]. Applied Microbiology and Biotechnology, 2010, 85(4): 1141-1149. DOI:10.1007/s00253-009-2259-2 |
| [31] |
Wang B, Chen XH, Xu FC, et al. Influence of substrate and salinity on electricity production by deep-sea strain Shewanella sp. DS1[A]//Power and Energy Engineering Conference 2010[C]. Wuhan: Wuhan University, 2010: 259-262 (in Chinese) 王彪, 陈新华, 徐方成, 等.碳源和盐度对深海产电菌Shewanella sp. DS1产电能力影响[A]//2010年电力与能源工程学术会议[C].武汉: 武汉大学, 2010: 259-262 |
| [32] |
Li P, Liao Z, Miao ZL, et al. Screening and identification of one strain of marine electrogenic bacteria and optimization of electrogenic conditions[J]. Journal of Zhejiang Agricultural Sciences, 2016, 57(9): 1536-1542. (in Chinese) 李鹏, 廖智, 苗增良, 等. 1株海洋产电细菌的筛选鉴定及产电条件的优化[J]. 浙江农业科学, 2016, 57(9): 1536-1542. |
| [33] |
Manohar AK, Bretschger O, Nealson KH, et al. The use of electrochemical impedance spectroscopy (EIS) in the evaluation of the electrochemical properties of a microbial fuel cell[J]. Bioelectrochemistry, 2008, 72(2): 149-154. DOI:10.1016/j.bioelechem.2008.01.004 |
| [34] |
Li EY, Cheng JH, Shi LW, et al. Research on salt-tolerant bacteria[J]. Journal of Jiangsu Institute of Petrochemical Technology, 2001, 13(4): 4-6. (in Chinese) 李尔炀, 程洁红, 史乐文, 等. 耐盐菌的研究[J]. 江苏石油化工学院学报, 2001, 13(4): 4-6. DOI:10.3969/j.issn.2095-0411.2001.04.002 |
| [35] |
Kotaki Y, Oshima Y, Yasumoto Y. Bacterial transformation of paralytic shellfish toxins in coral reef crabs and a marine snail[J]. Nippon Suisan Gakkaishi, 1985, 51(6): 1009-1013. DOI:10.2331/suisan.51.1009 |
| [36] |
Simidu U, Kita-Tsukamoto K, Yasumoto T, et al. Taxonomy of four marine bacterial strains that produce tetrodotoxin[J]. International Journal of Systematic Bacteriology, 1990, 40(4): 331-336. DOI:10.1099/00207713-40-4-331 |
| [37] |
Zhang J, Song XX, Luan X, et al. Effects of Shewanella algae on corrosion of Zn-Al-Cd anode[J]. Acta Metallurgica Sinica, 2012, 48(12): 1495-1502. (in Chinese) 张杰, 宋秀霞, 栾鑫, 等. 海藻希瓦氏菌对Zn-Al-Cd牺牲阳极的腐蚀性能影响[J]. 金属学报, 2012, 48(12): 1495-1502. |
| [38] |
Wu SJ. Preliminary research on tetrodotoxin production of Shewanella alga[D]. Qingdao: Master's Thesis of Ocean University of China, 2005 (in Chinese) 吴韶菊.海藻希瓦氏菌(Shewanella alga)产河豚毒素(tetrodotoxin)初步研究[D].青岛: 中国海洋大学硕士学位论文, 2005 http://cdmd.cnki.com.cn/Article/CDMD-10423-2005139710.htm |
 2020, Vol. 47
2020, Vol. 47




