扩展功能
文章信息
- 杨宗政, 许文帅, 吴志国, 曹井国, 武莉娅, 王春虎, 赵晓宇
- YANG Zong-Zheng, XU Wen-Shuai, WU Zhi-Guo, CAO Jing-Guo, WU Li-Ya, WANG Chun-Hu, ZHAO Xiao-Yu
- 微生物固定化及其在环境污染治理中的应用研究进展
- Microbial immobilization in environmental pollution treatment: a review
- 微生物学通报, 2020, 47(12): 4278-4292
- Microbiology China, 2020, 47(12): 4278-4292
- DOI: 10.13344/j.microbiol.china.191018
-
文章历史
- 收稿日期: 2019-12-08
- 接受日期: 2020-06-17
- 网络首发日期: 2020-09-08
2. 天津科技大学海洋与环境学院 天津 300457;
3. 天津市卤水化工与资源生态化利用重点实验室 天津 300457
2. College of Marine and Environmental Sciences, Tianjin University of Science & Technology, Tianjin 300457, China;
3. Tianjin Key Laboratory of Brine Chemical Engineering and Resource Eco-utilization, Tianjin 300457, China
自从1959年人类首次利用树脂吸附大肠杆菌完成细胞固定化以来,微生物固定化技术发展迅速,在固定化酶[1]、工业发酵[2]等领域,常将酶或者细胞[3]固定在载体中,并应用于生物反应器[4]中,以便获取相应的生物反应产品。随着环境问题日益严峻,20世纪70年代后期,研究者开始尝试将微生物固定化技术应用于环境污染治理领域,并体现出了优势和良好的应用前景。
研究者常使用各种物理化学手段将微生物固定在载体上,以期获得更高的生物活性和生物处理效果。相对于常规的生物法,微生物固定化技术具有成本低、效果好、可重复利用、利于固液分离等优点,在实际应用中更具有优势。本文将重点概述其在环境污染治理领域的应用特点,并通过典型应用阐释固定化技术应用的规律,以期为其今后在环境保护领域中的应用提供参考。
1 微生物固定化概述 1.1 微生物固定化方法在环保领域中,较为常用的微生物固定化方法有吸附法、包埋法和交联法,这些方法各有特点,所使用的载体也不同,从表 1中可以看到一些多孔性的载体常被用作吸附固定化的载体,特别是一些矿物类载体能兼有天然环保等特点,比较适合直接用于环境修复中,而不会带来二次污染问题;包埋法通常采用聚乙烯醇(polyvinyl alcohol,PVA)、海藻酸盐(sodium alginate,SA)等高分子材料作为载体,这种材质能够耐生物降解,适合长期保存和反复利用。此外,近几年还涌现出了一些新型的固定化方法,如无载体固定法和复合固定法等。
| Immobilization methods | Strain or flora | Sources of strain or flora | Carrier | The function of immobilized microorganism (medium) | Type of reactor | Literature | |
| Adsorption method | Bacteria | Sphingomonas sp. Y2 | Activated sludge | Functionalized Fe3O4 nanoparticle | Degradation of nonylphenol polyethoxylates (Water) | ND | [5] |
| Mycobacteria gilvum | Contaminated soil | Biochar prepared from rice straw, sludge and pig manure | Degradation of PAHs (Soil) | ND | [6] | ||
| Flora | Microbial community in activated sludge | Activated sludge from anoxic tank | Inert polyurethane (PU) foam and biodegradable polymer polycaprolactone (PCL) | Removal of nitrogen (Water) | Moving bed biofilm reactor (MBBR) | [7] | |
| Pseudomonas putida, Pseudomonas stutzeri | Soil contaminated by coke oven wastewater | Activated charcoal, saw dust and fly ash | Treatment of coke-oven effluent (Complex pollutant containing phenol and cyanide) (Water) | ND | [8] | ||
| Pseudomonas sp. SDR4, Mortierellaalpina sp. JDR7 | Surface of freezing thawed soil contaminated by PAHs | Corncob, peanut shell, vermiculite and peat soil | Degradation of polycyclic aromatic hydrocarbons at lowtemperature (Soil) | ND | [9] | ||
| Candidatus kuenenia, Candidatus brocadia, Nitrosomonas etc. | ND | Hydrophobic polypropylene (PP) | Removal of nitrogen (Water) | Continuous stirred tank reactor (CSTR) | [10] | ||
| Petroleum-degrading consortium | Soil contaminated by petroleum | Corncob biochar and straw biochar | Degradation of Petroleum (Soil) | ND | [11] | ||
| Thiobacillus thioparus | Activated sludge from sewage treatment plant | Wood chips and granular activated carbon (GAC) | Removal of H2S and NH3 (Air) | Biofilter system | [12] | ||
| Fungus | Phanerochaetc chrysosporium | ND | Sunflower plate and sunflower straw | Decolorization of wastewater contaminated by acid blackATT (Water) | ND | [13] | |
| Entrapment method | Bacteria | Pseudomonas sp. a3 | Activated sludge in wastewater treatment system | PVA and SA | Degradation of nitrobenzene, phenol, aniline and otheraromatics (Water) | ND | [14] |
| Ralstonia metallidurans CH34 | Deposits in zinc factory | SA | Degradation of phenols in heavy metal environment (Water) | ND | [15] | ||
| Bacillus sp. M3 | Soil Contaminated by petroleum | Polyurethane foam, PVA and SA | Degradation of benzene (Water) | Packed bed bioreactor (PBBR) | [16] | ||
| Flora | Pseudomonas, Bacillus, Escherichia coli etc. | Activated sludge from a local municipal wastewater treatment plant | PVA and SA | Treatment of petroleum wastewater (Water) | Specially designed spouted bed bioreactor (SBBR) | [17] | |
| VOCs-degrading microflora | Activated sludge from painting wastewater treatmentfacilities | SA | Degradation of toluene and ethyl acetate (Air) | Biotrickling filter tower | [18] | ||
| Fungus | Penicillium simplicissimum | ND | Fe3O4 magnetic particles and SA | Treatment of Cd2+ and phenol Simultaneously(Water) | ND | [19] | |
| Symbiotic bacteria and algae | Activated sludge, Chlorella vulgaris | Activated sludge in sewage treatment plant | SA | Removal of ammonia nitrogen and TP (Water) | Fluidized bed reactor | [20] | |
| Chlorella pyrenoidosa Chick, Photosynthetic bacteria | ND | SA | Removal of ammonia nitrogen, phosphate, nitrite, etc.(Water) | ND | [21] | ||
| Algae | Chlorella sp. MM3 | ND | SA | Degradation of pyrene (Soil) | ND | [22] | |
| Chlamydomonas reinhardtii, Anabaena variabilis | ND | SA | Removal of Cd2+ (Water) | ND | [23] | ||
| Freezing and thawing method | Bacteria | Achromobacter sp. | ND | PVA and SA | Degradation of quinoline (Water) | ND | [24] |
| Flora | Anammox flora | Activated sludge from an aerated bioreactor in a domesticwastewater treatment plant | PVA | Removal of nitrogen (Water) | Fixed bed bioreactor (FBBR) | [25] | |
| Autotrophic sulfur oxidizers | Municipal wastewater treatment plant | PVA and SA | Removal of hydrogen sulfide (Air) | Biofilter | [26] | ||
| Self-immobilization method | Flora | Acinetobacter calcoaceticus JH-9, Aspergillus niger Y3 | Activated sludge in chemical wastewater treatment plant | Without carrier | Degradation of aniline at low temperature (Water) | ND | [27] |
| Symbiotic bacteria and algae | Pseudomonas putida, Chlorella vulgaris | Municipal wastewater treatment plant | Without carrier | Removal of ammonia nitrogen, phosphate (Water) | ND | [28] | |
| Multi-technology for microbial immobilization method | Fungus | Candidasp. | Activated sludge from a pharmaceutical plant | SA and nanoscale SiO2 | Degradation of phenol in high salt condition (Water) | ND | [29] |
| Bacteria | Pseudomonas citronellolis DK-3 | Activated sludge from pesticide factory | SA and Fe3O4 nanoparticles | Degradation of acifluorfen (Water) | Sequencing batch reactor (SBR) | [30] | |
| High efficient nitrogen removing bacterium | Activated sludge from aquaculture wastewater treatmentplant | SA and chitosan | Treatment of biogas slurry (Water) | ND | [31] | ||
| Flora | Sulfate reducing bacteria flora | Sludge from sulfate reduction bioreactor | PVA, activated carbon and calcium carbonate | Removal of sulfate (Water) | ND | [32] | |
| Pseudomonas stutzeri ADH1, Enterobacter sp. AOZ1, Bacillus subtilisBSK9 | Activated sludge or environmental sewage | SA, PVA, diatomite, agar and bamboo charcoal powder | Treatment of polluted river water with low C/N ratio(Water) | ND | [33] | ||
| Bacillus sp. W1, Bacillus sp. W2, Microbacterium sp. Y2 | Sediment or soil contaminated by Cr6+ | SA and biochar | Treatment of wastewater with pyrene and Cr6+(Water) | ND | [34] | ||
| 注:ND:未注明. Note: ND: Unspecified. |
|||||||
无载体固定法往往利用微生物自身聚集成团的特性,在无载体的条件下即可聚集成团,达到自固定化的目的,絮团形成了适宜微生物生存的微环境,对微生物的代谢活动更加有利。但是,无载体固定化法所使用的微生物多具有可自絮凝成颗粒状或能够成膜的特性,具有一定局限性,并不能适用于大部分微生物,为此,一些研究者将目的功能微生物与具有这些特性的微生物混合,利用具有絮凝或成膜特性的微生物包裹目的微生物,形成多种微生物的共生体系并能够完成相应的功能。菌藻固定化技术即为这种方法的代表,此法使固定化后微生物密度显著提高,藻类还能提升废水处理系统脱氮除磷的能力。在此体系中,微生物可以产生赤霉素、吲哚-3-乙酸等植物激素,促进藻类的生长,藻类充当微生物的载体,也促进了微生物的生长[35]。
复合固定法是联合使用多种固定化方法对微生物进行固定,在获得较高的固定化强度的同时保留更高的微生物活性,提高固定化微生物的整体性能。从表 1可以看出,复合固定法往往以聚乙烯醇或者海藻酸钠作为基础载体,再添加具有一定功能的添加物。此外,也有添加凝聚剂使微生物聚集后再进行包埋的报道[36],还有研究者利用微生物分泌的胞外聚合物来加强微生物与载体的固定效果[37]。
1.2 微生物固定化载体在微生物固定化技术中,载体材料为微生物提供了稳定的生存和增殖环境,同时,载体的传质传氧特性也与微生物的生长息息相关。除了传统载体外,现在还开发出具有更多特殊功能的载体,表 1列举了一些例子,如可生物降解多聚物载体[7]、缓释碳源载体[33]和磁性载体[17]等,这些新型载体的出现为固定化技术提供了更多的可能。微生物固定化技术中,单一无机、有机材料往往存在较大的局限性,不能满足实际处理过程中复杂的环境条件需求,因此,研究者对多种有机或无机载体进行组成上的调控,使各种载体材料能够优势互补。复合载体往往在复合固定法中使用。其中,使用聚乙烯醇和海藻酸钠进行复配[14, 38]就是典型的复合载体使用案例,复合载体能提高其机械强度、成球性和重复利用性,相比于海藻酸钠固定化颗粒[8]有了明显改善,具备了进一步应用于反应器中进行大规模处理废水的能力。
近些年来,壳聚糖、磁性材料与纳米材料成为固定化载体材料的研究热点,被用作复合载体的添加物,提高了相关性能或赋予了固定化微生物新的功能(表 1)。壳聚糖上存在氨基及羟基,方便对其进行改性,这一特性使研究者可以根据不同的需求制作特种的壳聚糖衍生物作为固定化材料。
磁性材料可使载体获得磁性特征,从而可以通过电磁场控制其载体特性和运动方式,有利于反应器中的搅拌与回收,节省人工操作,在实际应用过程中易实现大规模连续化生产应用。在PVA-SA体系中加入Fe3O4磁性颗粒,制成的颗粒表面有丰富的小孔,能为微生物提供丰富的增殖空间并提升了载体传质性能;此外,颗粒还具有超顺磁性,在外加磁场下具有靶向性[39]。
纳米材料是具有高比表面积和高表面能的材料,相对于普通材料具有更强的吸附能力,能够吸附更多的微生物并为其提供足够的增殖空间,同时也能在局部提高污染物浓度便于微生物的降解。此外,纳米材料还能降低质子传递限制,影响细胞膜的通透性,进而对微生物的代谢及生理反应产生影响,因此,添加纳米材料能够大幅提高微生物降解效率及稳定性[30]。但是,有研究表明纳米颗粒能通过吸附或者静电作用与微生物细胞膜发生反应,可能对细胞造成损伤[40]。
此外,表 1还列举了一些其他在实际应用过程中的载体材料,从中可以看出,植物残体及其转化物(如生物质炭)是一种应用较多的固定化材料,此类材料除了可以满足微生物固定化的基本需求外,还能做到资源再利用,达到以废治废的目的,具有较好的实际应用价值。
1.3 微生物的筛选微生物固定化技术中,微生物作为处理污染物的主体,对处理效果起到关键作用。如表 1所示,可供固定化技术使用的微生物资源繁多,主要有细菌、真菌和藻类。研究者常常在一定压力下对微生物进行筛选,并应用于固定化技术中。比如针对实际工业污水中污染物复杂的特点,利用富集驯化法从废水处理系统的活性污泥中筛选出广谱高效降解菌[14];利用颗粒吸附态多环芳烃(polycyclic aromatic hydrocarbons,PAHs)作为筛选底物,从土壤中筛选PAHs高效降解菌[41];从深海中筛选出高效石油降解菌[42],用于解决海水乃至深海中石油污染的问题。
2 微生物固定化技术在环境污染治理领域的典型应用 2.1 在水污染处理领域的应用环境中自然水体污染多源于工农业污水及生活污水的排放,污水中往往存在着重金属、高盐、高化学需氧量(chemical oxygen demand,COD)和高氨氮等情况,在使用生物处理时对于微生物具有较大的抑制作用。使用微生物固定化技术能够使微生物在水体环境中形成较高的微生物密度,载体为微生物提供了适宜定殖生存的微环境,使得微生物对各种污染物的抗逆能力大大提升,从而提高整个系统负荷和处理效能。在污水的大规模处理时,常常将固定化微生物与各种生物反应器联用,如表 1所示,既提高了处理效率,也解决了一些活性污泥工艺产泥量大的问题[43]。
在诸多水环境污染问题中,水体富营养化一直以来就是一个困扰人类的问题,大量含氮磷等营养源的工业污水被排放到环境中,不断富集造成了一系列的环境生态问题。针对这个重要环境问题,有大量使用固定化微生物技术去除水体中氮的研究报道[44-46]。然而在诸多除氮生物技术中,利用厌氧氨氧化技术除氮成为近二十年来的一个热点,厌氧氨氧化是一种高效、高性价比、环境友好、低好氧不需额外碳源、低污泥产出的除氮生物方法[47-48],发展至今已经有很多国家大规模成功使用的案例[49]。厌氧氨氧化技术在发展过程中与固定化技术应用紧密结合,主要表现在微生物筛选和固定化载体的不断研究和进步上。
2.1.1 厌氧氨氧化菌株的筛选和培养在厌氧氨氧化反应中,厌氧氨氧化菌株(anaerobic ammonia-oxidizing bacteria,AnAOB)与产生亚硝酸盐的好氧氨氧化菌(aerobic ammonia-oxidizing bacteria,AOB)或氨氧化古菌(ammonia-oxidizing archaea,AOA)菌株要共存[50],就需要AnAOB对氧具有一定的耐受性;由于废水中有可能含盐,因此耐盐性也是要考虑的要素[51];另外就是AnAOB的聚集成膜能力,当菌株具有高度疏水的细胞表面时,才能够较多地附着胞外聚合物(extracellular polymeric substances,EPS)[52],这一能力对于菌株在实际应用与固定化技术结合时至关重要。从大量报道的文献分析,AnAOB菌种Candidatus Brocadia sinica在工程应用中经常能被检测到[53],而且表现出较好的环境适应能力,且Candidatus Brocadia sinica具有较快的比生长速率[54],这对于厌氧微生物在短时间内的大量增殖生长非常重要。除此之外,待处理污水中的有机质种类和浓度及环境温度对于菌株的定向筛选和应用都有较大影响[51]。
AnAOB目前还没有得到纯培养菌株,而且在不同的环境中,其中的AnAOB菌株所占丰度不同,占支配地位的AnAOB菌株类型也会发生转换[51]。针对AnAOB菌株难以得到适合的纯培养菌株的问题,有研究者通过PVA-SA包埋固定化起始接种物的方法来进行菌株纯化,在较短时间内可达到95.0%以上的纯度,当在PVA-SA培养完成后连同载体可以直接投入到反应器中作为接种物,该方法快捷方便,可以在较短时间内完成AnAOB菌株的纯化和富集培养过程[54]。
2.1.2 载体的选择和应用从厌氧氨氧化技术的起步到目前大规模应用,载体的选择和改进从未停止过。在利用厌氧氨氧化除氮过程中,AOB/AOA和AnAOB能够协作完成在低碳氮比废水中氮源的高效脱除[50]。创造合适的微生物生存环境,使厌氧和好氧菌能够处于各自合适的生态位上是保证厌氧氨氧化过程得以高效进行的关键。为此,在最初阶段,有研究者采用两个分离的反应器来分别实现好氧和厌氧反应过程[55],虽然能够避免两类细菌对于亚硝酸根的底物竞争,较好实现厌氧氨氧化过程,但是过程复杂,成本和操作费用较高。也有研究者[56]尝试了生物污泥颗粒法在同一反应器中来完成厌氧氨氧化过程,使AOB/AOA在污泥颗粒外部生长,而AnAOB在颗粒内部定殖,两类菌在同一污泥颗粒上共存。但是,这种方法也存在着污泥颗粒机械强度不高、容易塌陷而造成结构破坏、不利于长期运行等问题。基于以上问题,通过微生物固定化技术,使菌株在多孔高强度的载体上固定化定殖就很好地解决了这个问题。
在固定化技术用于厌氧氨氧化反应的整个过程中,大量的研究围绕这一主题展开,其中既有使用包埋法进行的微生物固定化方法,也有使用吸附附着方式的固定化。包埋法使用PVA-SA作为载体的居多,其能够对特定种类、数量和比例的微生物进行固定化,包埋后能够在培养中保持生物量不至于流失,但是操作复杂、成本较高、包埋载体传质性能较差。因此,目前更多的厌氧氨氧化反应系统中使用颗粒载体进行吸附固定化。
吸附载体在载体材质方面,不同类型也各有利弊,比如一些普通聚合凝胶的作用与活性污泥颗粒作用类似,能够提供微生物需要的微环境,但机械强度不够[57],多孔沸石提供了较大的比表面积,机械强度也较高,但是孔径太小不利于传质[58],综合衡量比较若干种载体,从载体材质类型来说有机高分子聚合物载体在机械强度、传质传氧、载体表面特性等方面都比较有利于微生物定殖生长[59],而其中聚氨酯泡沫(polyurethane foam,PUF)是被广泛采用的一种。此外,载体的尺寸对于微生物生长和高效发挥作用也有很重要的影响。比如,对于较小尺寸的载体具有较高的氧气透过性,只利于好氧微生物生长定殖,而较大尺寸的载体则不利于传质和载体内核的厌氧氨氧化细菌的生存。因此,载体大小存在一个最适条件,能够使好氧和厌氧微生物正好都在载体上找到各自稳定的生存空间,发挥各自的作用来共同完成厌氧氨氧化过程进行废水中氮的脱除。在载体形状方面,载体也有各种类型,比如常见的球形颗粒状、立方体状等。Liu等[10]将厌氧氨氧化菌固定在用疏水性聚丙烯树脂制成的中空圆筒状载体上,并在全混合厌氧反应器(continuous stirred tank reactor,CSTR)中培养,由于载体存在形体扩散阻力,因此载体内部形成氧气浓度梯度,使微生物在载体表面及内部形成了不同的生物膜,增强了厌氧和好氧菌的共生作用,是目前利用厌氧氨氧化除氮效率比较高的反应系统之一。
载体在反应器中除了作为微生物定殖的构筑物使用,还有着其他一些辅助功能,比如可以作为微生物的碳源或电子供体使用。因此,有研究者尝试使用可生物降解的多聚物颗粒作为载体[7],虽然通过比较发现整体的TOC和氮的去除效果不如不可降解的PU颗粒,原因可能是载体表面负载微生物量较少,但是可生物降解聚合物的优势在于,能够为脱氮过程提供缓释的碳源底物且不存在过量的问题。为了使载体能够负载更多生物量且具有更好的生物多样性,载体材料也可以通过改性得到进一步的提升。比如对载体进行亲水阳离子的改性,改性后的材料可以提高吸附呈电负性菌体的附着性,从而进一步提高载体负载[60]。
在反应器应用方面,传统的序批式反应器(sequencing batch reactor,SBR)的应用相对普遍,后来随着厌氧氨氧化技术的成熟和固定化载体材料性能的不断改进,膜生物反应器(membrane bioreactor,MBR)得到了快速发展和应用,是目前研究的热点[61]。从以上厌氧氨氧化技术与微生物固定化技术耦合发展的过程来分析,高效微生物的不断筛选分离和培养技术的进步,同时伴随着固定化载体新材料的不断涌现和挖掘,两者的紧密结合促进了高效除氮技术的发展和大规模的应用,是固定化微生物技术在水环境生物处理中的典型应用。
2.2 在土壤污染治理领域的应用随着我国工农业的快速发展,土壤环境污染问题近几十年来愈发严重,很多污染物不断进入土壤中产生累积。多环芳烃、石油相关产品、农药、氯酚和重金属都是众所周知的具有高风险的土壤污染物。土壤污染的治理变得越来越迫切和具有挑战性。利用微生物来进行土壤污染治理的方法被广泛关注并取得了一些成果,但是也存在着微生物定殖差、处理效率低和不能彻底修复污染土壤等诸多问题[62]。
从污染介质角度来说,土壤是非流体介质,区别于水或空气,不利于微生物与污染物的接触以及传质过程;而且土壤环境中存在各种颗粒状矿物质、有机质、水分、空气、大量土著微生物和土壤动植物等,其环境十分复杂。因此,利用微生物进行生物强化处理难度大。微生物固定化技术的优势在于能够创建一个适合微生物生存和发挥作用的微环境,将目的微生物与土壤环境隔离开来,屏蔽与土著微生物之间的恶性竞争,减少环境因素对功能微生物的影响,极大地提高目的微生物的存活能力和污染处理效果。此外,固定载体本身还具有其他功能特点,以利于固定化微生物发挥对土壤的处理效能,如可提供微生物分解利用的碳源能源和电子供体,本身具有较强吸附性能,有的还具有改良土壤等功能[6]。Xu等[63]使用花生壳作为载体固定化微生物处理石油污染土壤,花生壳在进入土壤后使得土壤容重降低,增大了孔隙率和氧气扩散能力,提高了水、氧、营养物质和碳氢化合物的传质速率;同时,花生壳在分解时可以给微生物提供纤维素、半纤维素和木质素等有机物,有利于微生物的生长。
另外,由于污染物进入土壤后会与土壤颗粒产生牢固的吸附作用,而且随着时间延长和周围物理化学条件改变吸附结合作用会发生变化,存在着污染物的生物有效性问题。因此,要彻底去除土壤中的污染物,提高污染物的生物有效性是必须要考虑的问题。很多研究者在通过固定化微生物技术提高污染物的生物有效性途径方面做出了很多有益的探索。主要有以下几个方面:
2.2.1 微生物的分离和筛选通过在土壤污染环境中直接筛选高效的功能菌株是最直接有效的方法,如表 1中所示案例。筛选出的菌株一方面具有高效降解酶系,更重要的是具有提高土壤中污染物的生物有效性的能力。为了得到在土壤环境中高效降解吸附态污染物的菌株,应该采取吸附态底物筛选的这种加筛选压力的方法。有研究者[41]使用颗粒吸附态PAHs筛选微生物,比在水溶PAHs底物条件下筛选的微生物具有更好地降解吸附态PAHs的性能。分析菌株特点发现该类菌株具有表面疏水性较强的特点,利于附着于污染物表面进行降解,从而大大提高了吸附态污染物的生物有效性[64]。
微生物疏水的表面也有利于胞外聚合物EPS的富集,进而形成生物膜,生物膜除了具有保护微生物,形成稳定高效的微生物群落和完成一些传质传氧、基因水平转移等生理功能外[65-66]。有报道称生物膜对有机污染物也具有溶出效应[67],是土壤中的污染物向微生物传递的中间介质和纽带,微生物能够利用生物膜的作用对土壤界面吸附态的污染物进行有效降解。
微生物的成膜能力除了EPS的分泌和附着外,还有生物表面活性剂生成的促进作用[68]。生物表面活性剂有利于菌体与载体间形成共价键,同时也有助于保持生物膜活性,帮助菌体在污染环境中存活。比如鼠李糖酯是由假单胞菌分泌的一种重要的生物表面活性剂,不但有利于菌体吸附于载体表面[69],还可以用在多环芳烃去除等方面[67]。
2.2.2 固定化载体的选用功能微生物要发挥作用一定要有与之适配的载体依托,也就是既要利于微生物定殖,同时载体自身也应具有直接或间接提高土壤污染物生物有效性的特点。
一些载体具有直接提高土壤污染物生物有效性的特点,比如固定化载体可以把污染物吸附到载体周围,增加污染物与微生物接触概率,而载体材料对污染物的吸附作用决定着吸附态污染物的生物有效性,是影响固定化微生物对土壤污染处理效果的重要因素。植物残体是经常用于微生物固定化的一种天然、廉价的载体[21]。植物残体等天然有机质对疏水性有机物(如多环芳烃等)的吸附主要以分配作用为主,脂肪碳和芳香碳是其吸附的主要组分[70]。但是,这只限于在水中能完成吸附作用。当用在土壤中时,土壤颗粒中的有机质对污染物同样具有吸附能力,此时土壤中污染物并不会向载体靠近。相比于天然的生物质载体,经过热裂解而成的生物质炭具有的吸附性提高了10-1 000倍,因此在土壤中具有较强的吸附污染物能力,之后可以通过微生物降解吸附态污染物来达到去除的目的。近些年来,对生物质炭在土壤污染治理方面的研究成为一个热点,表 1中就列举了多个利用生物质炭作为固定化载体的应用案例。生物质炭具有比表面积大、吸附能力强、孔隙度好、自身性能稳定的优点,还能够参与土壤中的碳储存与循环,这些特点使生物质炭在土壤原位修复领域获得了得天独厚的优势。Xiong等[6]利用生物炭吸附固定降解菌,使其对菲、荧蒽、芘的降解效率分别提高了15.3%、52.1%、42.5%,他们发现PAHs降解效果的提高并非是因为微生物细胞量的增加,而是由于吸附剂协助PAHs向细胞传质而促进了降解效率。因此,载体的强吸附作用能够提高污染物在土壤中的生物有效性。但是吸附作用也有可能伴随着负面的效应,即固定化载体由于有吸附增浓作用,使得周围污染物浓度过高而毒害微生物,导致负面的效果[71]。
固定化载体间接提高污染物在土壤中生物有效性的方法在于,载体从材质本身物理化学性质等方面来促进微生物发挥作用,提高生物有效性。有些载体的物化性质能够刺激微生物大量分泌EPS利于微生物的成膜[72]。不同性质载体表面差异会造成EPS等微生物分泌物性质上的差异,从而导致附着和负载情况不同,疏水性的载体表面如同菌体表面疏水一样能有利于菌体成膜和附着;细菌表面一般呈电负性,因此更倾向于吸附于带有正电荷的载体表面,载体表面的改性可实现带正电[73]。还有些载体能够刺激微生物降解酶类的分泌和表达,也能间接实现对土壤中污染物最大程度的高效降解[74]。
2.2.3 其他因素和方法改变土壤中污染物的生物有效性还可以通过辅助性添加一些外来物质,如添加表面活性剂吐温-80等。这些物质有可能对微生物具有毒性,而固定化载体则可以有效保护用于土壤修复的微生物生存。另外,还可以通过与植物的联合进行污染土壤的修复。王传花[34]利用水蜈蚣与生物炭固定化菌群联合修复Cr-芘复合污染土壤,发现两者具有协同效应,该联合作用对Cr和芘的去除率分别为80.0%和63.6%。也可以通过与其他土壤修复方式的联用来实现土壤中污染物的去除,比如可以通过将土壤进行淋洗处理后,对淋洗液进行固定化微生物的降解处理,从而也实现了土壤中污染物的最大限度去除[75]。
2.3 在空气污染处理领域的应用目前,我国空气污染主要由烟煤型污染、机动车尾气污染及其他污染复合构成[76],导致了一些地区酸雨、雾霾等严重环境问题。使用普通的生物法进行处理过程中,存在生物密度较低、所需空间大和处理过程中pH值、污染物负荷等工艺条件难以调控及微生物活性低等缺点[26, 77]。20世纪90年代以来,人们开始利用微生物固定化技术来弥补普通生物法的不足之处。Kim等[26]使用PVA及SA包埋混合微生物处理H2S气体,当污染物负荷从低浓度逐步提高至高浓度时,固定态微生物能够在较短的时间内恢复稳定,结果表明,固定化微生物技术成功弥补了生物滤池工艺对工艺条件波动敏感的缺点。此外,固定化微生物在甲醛废气[78]、VOCs[79]、NH3[77]等气体污染物处理方面都有报道。
空气污染与水污染同属于流体介质,但与水污染不同的是,在气体污染处理中污染物需先从气相进入液相中,然后才能被固定在载体上的微生物利用(也有研究者认为污染物在通过气相到达生物膜表面后,被直接吸附在生物膜表面后被微生物利用[80]),这一过程涉及到气液传质并会对降解效果产生很大的影响。在气液传质过程中,填料材质、压降、pH等因素都会对传质效率产生影响,导致反应器对各项条件的改变十分敏感,在最适的传质条件下,微生物可能受到抑制。微生物固定化技术提高了微生物的抗逆能力,使其在较为严苛的条件下,仍能保持优于游离态的活性,使反应器效率得到大幅度提升。
如表 1所示,在气体污染治理领域,微生物固定化技术常与生物滴滤塔、生物过滤床等反应器联用,与水处理领域固定床反应器相比,处理废气的固定床反应器气速与气量都更大,对载体材料的冲刷更严重,若载体材料强度不足,易在气液冲刷下坍塌。因此,固定化载体常使用机械强度较高的刚性载体。此外,为了保证传质效率,还要求其利于气液循环。有研究表明,树脂、硅藻土、陶瓷等载体材料在保证机械强度的同时,还有助于反应器内的气液循环[81]。在实际应用中,微生物降解气体污染物会产生大量降解产物,在长时间运行过程中,一些降解产物大量积累,会堵塞载体中的孔隙结构,进而影响整个反应体系。Kim等[12]使用二级生物滤池处理H2S及NH3,其中一个装填木屑作为填料,另一个以活性炭颗粒为填料,接种活性污泥及排硫硫杆菌在填料上进行固定,结果表示2个反应器都具有99.0%的去除率,但是随着硫单质及硫酸铵的积累,反应器的去除率出现大幅度下降。
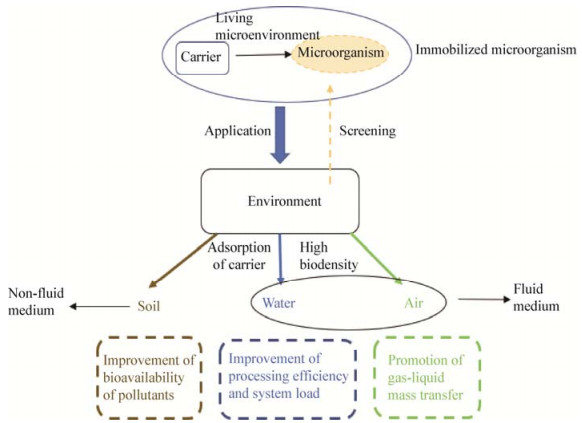
3 结论与展望微生物固定化技术在水、土、气等环境污染治理领域应用广泛,不但提高了功能微生物在环境中的定殖存活能力,也极大地强化了生物处理效果,是目前重要的生物处理手段之一。本文综述内容可由图 1表示,在微生物选取上,大量适合在特定环境下满足污染物去除要求的微生物资源,通过富集驯化和定向筛选的方法被分离鉴定出来。用于固定化的微生物资源应使用具有筛选压力的方式得到,比如通过吸附态污染物筛选的菌株有利于在土壤中提高土壤吸附态污染物的生物有效性,从而有利于完成土壤中污染物的去除;在水、土、气各领域污染处理中,生物膜都起到了保护微生物、传递污染物等关键作用,因此应尽量筛选成膜能力较强的功能菌株进行固定化应用。载体选用上,应从载体材质、性状或尺寸等诸多因素考虑,并且在不同介质条件下应用,不同的载体有着各自的特点和作用。在水、空气污染处理中应用的载体应具备较好的机械强度,以应对流体剪切力和气液负荷比较大的情况;在土壤环境中,则要着重考虑污染物在土壤中的生物有效性,也就是载体要能够提高土壤中吸附态污染物的去除效果。随着材料技术的不断进步,很多新型固定化材料被开发出来,多种材料复合搭配不同固定化方法以提高固定化微生物的各项性能(如吸附性能、机械强度、传质性能、生物相容性等)成为研究主流。但是,微生物固定化技术目前还存在的诸多问题,可以考虑从以下几方面进行进一步研究:
|
| 图 1 微生物固定化技术在不同环境介质中的应用特点 Figure 1 Application characteristics of microbial immobilization technology in different environmental media |
|
|
(1) 在生物资源方面,很多重要的微生物资源还没有得到纯培养物,这样就妨碍了对于微生物本身生理生化特性以及在固定化应用方面的进一步研究,比如厌氧氨氧化细菌;在活性污泥等原始菌群固定化研究基础上,还需进一步关注该如何人为复配高效菌群并进行固定化,从而实现对环境污染的长效处理效果。
(2) 在固定化载体方面,开发适合不同微生物需求、具有更好的传质和传氧性能的载体或固定化方法,从而进一步提高固定化微生物的负载量和生物处理效果;可生物降解的高分子聚合材料在固定化微生物的应用中表现出了很好的应用潜力,可以进一步开发用于多种污染介质中的可生物降解的载体,也可以考虑把可生物降解载体与其他材质的载体进行复配,从而实现作用互补的效果。
(3) 在土壤的生物修复中,应从生物和固定化角度进一步研究提高土壤中污染物生物有效性的机制;研究不同性质和不同老化时间的污染土壤中污染物的生物有效性,以及通过生物质炭等作为固定化载体所进行的生物修复效果,从而为完善和开发新的高效土壤修复方法奠定基础。
| [1] |
Lin CP, Xu KL, Zheng RC, et al. Immobilization of amidase into a magnetic hierarchically porous metal-organic framework for efficient biocatalysis[J]. Chemical Communications, 2019, 55(40): 5697-5700. |
| [2] |
Yu L, O'Sullivan DJ. Immobilization of whole cells of Lactococcus lactis containing high levels of a hyperthermostable β-galactosidase enzyme in chitosan beads for efficient galacto-oligosaccharide production[J]. Journal of Dairy Science, 2018, 101(4): 2974-2983. |
| [3] |
Gungormusler-Yilmaz M, Cicek N, Levin DB, et al. Cell immobilization for microbial production of 1, 3-propanediol[J]. Critical Reviews in Biotechnology, 2016, 36(3): 482-494. |
| [4] |
Yan QY, Li LL, Cong FD, et al. Catalyzed synthesis of hexyl acetate in immobilized lipase bioreactor[J]. Science and Technology of Food Industry, 2015, 36(9): 171-174, 183. (in Chinese) 闫倩云, 李玲玲, 丛方地, 等. 固定化脂肪酶生物反应器催化合成乙酸正己酯[J]. 食品工业科技, 2015, 36(9): 171-174, 183. |
| [5] |
Bai NL, Wang S, Sun PF, et al. Degradation of nonylphenol polyethoxylates by functionalized Fe3O4 nanoparticle-immobilized Sphingomonas sp. Y2[J]. Science of the Total Environment, 2018, 615: 462-468. |
| [6] |
Xiong BJ, Zhang YC, Hou YW, et al. Enhanced biodegradation of PAHs in historically contaminated soil by M. gilvum inoculated biochar[J]. Chemosphere, 2017, 182: 316-324. |
| [7] |
Chu LB, Wang JL. Comparison of polyurethane foam and biodegradable polymer as carriers in moving bed biofilm reactor for treating wastewater with a low C/N ratio[J]. Chemosphere, 2011, 83(1): 63-68. |
| [8] |
Singh U, Arora NK, Sachan P. Simultaneous biodegradation of phenol and cyanide present in coke-oven effluent using immobilized Pseudomonas putida and Pseudomonas stutzeri[J]. Brazilian Journal of Microbiology, 2018, 49(1): 38-44. |
| [9] |
Gong CJ, Su D, Wang X, et al. Impacts of cold-resistant mixed strains immobilized by different carrier materials on remediation of PAHs polluted soils[J]. Chinese Journal of Ecology, 2018, 37(12): 3713-3720. (in Chinese) 巩春娟, 苏丹, 王鑫, 等. 不同载体材料固定化耐低温混合菌修复PAHs污染土壤[J]. 生态学杂志, 2018, 37(12): 3713-3720. |
| [10] |
Liu Y, Niu QG, Wang SP, et al. Upgrading of the symbiosis of Nitrosomanas and anammox bacteria in a novel single-stage partial nitritation-anammox system: nitrogen removal potential and microbial characterization[J]. Bioresource Technology, 2017, 244: 463-472. |
| [11] |
Ren HY, Ma LL, Wang B, et al. Efficient degradation of petroleum pollutant by immobilized bacteria based on biochar material[J]. Chinese Journal of Environmental Engineering, 2017, 11(11): 6177-6183. (in Chinese) 任宏洋, 马伶俐, 王兵, 等. 生物炭基固定化菌剂对石油类污染物的高效降解[J]. 环境工程学报, 2017, 11(11): 6177-6183. |
| [12] |
Kim HS, Kim YJ, Chung JS, et al. Long-term operation of a biofilter for simultaneous removal of H2S and NH3[J]. Journal of the Air & Waste Management Association, 2002, 52(12): 1389-1398. |
| [13] |
Ning LQ, Zhang J, Wu ZG, et al. Research on the decolorization of acidic black ATT by immobilized Phanerochaete chrysosporium[J]. Industrial Water Treatment, 2017, 37(8): 57-61. (in Chinese) 宁立群, 张洁, 吴志国, 等. 固定化白腐菌对酸性黑ATT脱色的研究[J]. 工业水处理, 2017, 37(8): 57-61. |
| [14] |
Wu ZG, Liu YL, Liu HM, et al. Characterization of the nitrobenzene-degrading strain Pseudomonas sp. a3 and use of its immobilized cells in the treatment of mixed aromatics wastewater[J]. World Journal of Microbiology & Biotechnology, 2012, 28(8): 2679-2687. |
| [15] |
Wu ZG, Wang YM, Xing ZH, et al. Study on degrading phenol by immobilized Ralstonia metallidurans CH34[J]. Microbiology China, 2005, 32(4): 31-36. (in Chinese) 吴志国, 王艳敏, 邢志华, 等. 固定化Ralstonia metallidurans CH34降解苯酚的研究[J]. 微生物学通报, 2005, 32(4): 31-36. |
| [16] |
Kureel MK, Geed SR, Giri BS, et al. Biodegradation and kinetic study of benzene in bioreactor packed with PUF and alginate beads and immobilized with Bacillus sp. M3[J]. Bioresource Technology, 2017, 242: 92-100. |
| [17] |
Ismail ZZ, Khudhair HA. Biotreatment of real petroleum wastewater using non-acclimated immobilized mixed cells in spouted bed bioreactor[J]. Biochemical Engineering Journal, 2018, 131: 17-23. |
| [18] |
Chen XS, Ji WB, Chen SR, et al. Experimental study on treating organic gases by the dominant bacterial strains[J]. Energy Environmental Protection, 2009, 23(4): 15-18. (in Chinese) 陈雪松, 季文标, 陈水荣, 等. 固定化优势菌种处理有机废气的试验研究[J]. 能源环境保护, 2009, 23(4): 15-18. |
| [19] |
Xie H, Xu WH, Tan XF, et al. Study on adsorption of Cd2+ and phenol from aqueous solution with Penicillium simplicissimum fixed on magnetic particles[J]. Technology of Water Treatment, 2016, 42(2): 56-58, 62. (in Chinese) 谢浩, 徐卫华, 谭小飞, 等. 磁性粒子固定简青霉吸附处理Cd2+-苯酚复合污染废水的研究[J]. 水处理技术, 2016, 42(2): 56-58, 62. |
| [20] |
Yan Q, Gao X, Peng XY. Advanced treatment of effluent from a wastewater treatment plant by embedded immobilized bacteria and algae system[J]. Chinese Journal of Environmental Engineering, 2012, 6(10): 3629-3634. (in Chinese) 严清, 高旭, 彭绪亚. 固定化菌藻系统对污水处理厂出水的深度处理[J]. 环境工程学报, 2012, 6(10): 3629-3634. |
| [21] |
Liu E, Liu XG, Wang XD, et al. Study on efficiency of purifying the aquacultural waste water with immobilized alga-bacteria system and immobilization conditions optimization[J]. Journal of Shanghai Ocean University, 2017, 26(3): 422-431. (in Chinese) 刘娥, 刘兴国, 王小冬, 等. 固定化藻菌净化水产养殖废水效果及固定化条件优选研究[J]. 上海海洋大学学报, 2017, 26(3): 422-431. |
| [22] |
Subashchandrabose SR, Logeshwaran P, Venkateswarlu K, et al. Pyrene degradation by Chlorella sp. MM3 in liquid medium and soil slurry: possible role of dihydrolipoamide acetyltransferase in pyrene biodegradation[J]. Algal Research, 2017, 23: 223-232. |
| [23] |
Kondo K, Hirayama K, Matsumoto M. Adsorption of metal ions from aqueous solution onto microalga entrapped into ca-alginate gel bead[J]. Desalination and Water Treatment, 2013, 51(22/24): 4675-4683. |
| [24] |
Xie QQ, Liu YJ, Liu Y, et al. Properties characterization of PVA-SA living cell immobilization carrier and its biodegradation property of quinoline[J]. Technology of Water Treatment, 2018, 44(3): 49-51, 57. (in Chinese) 谢琪琪, 刘永军, 刘羽, 等. PVA-SA活细胞固定化载体性能表征及喹啉生物降解特性[J]. 水处理技术, 2018, 44(3): 49-51, 57. |
| [25] |
Choi M, Chaudhary R, Lee M, et al. Enhanced selective enrichment of partial nitritation and anammox bacteria in a novel two-stage continuous flow system using flat-type poly (vinylalcohol) cryogel films[J]. Bioresource Technology, 2020, 300: 122546. |
| [26] |
Kim JH, Rene ER, Park HS. Biological oxidation of hydrogen sulfide under steady and transient state conditions in an immobilized cell biofilter[J]. Bioresource Technology, 2008, 99(3): 583-588. |
| [27] |
Shan D, Ma F, Zhang S, et al. Characteristic and immobilized mycelial pellets method of aniline-degradation bacteria at low temperature[J]. Journal of Beijing University of Technology, 2008, 34(6): 636-641. (in Chinese) 山丹, 马放, 张斯, 等. 低温苯胺降解菌固定化菌丝球方法与特性[J]. 北京工业大学学报, 2008, 34(6): 636-641. |
| [28] |
Shen Y, Gao JQ, Li LS. Municipal wastewater treatment via co-immobilized microalgal-bacterial symbiosis: microorganism growth and nutrients removal[J]. Bioresource Technology, 2017, 243: 905-913. |
| [29] |
Jiang Y, Yang K, Deng T, et al. Immobilization of halophilic yeast for effective removal of phenol in hypersaline conditions[J]. Water Science and Technology, 2018, 77(3): 706-713. |
| [30] |
Chen DK, Cai TM, Chen LW, et al. Biodegradation of acifluorfen using joint immobilized cells of sodium alginate and Fe3O4 nanoparticles[J]. Chinese Journal of Environmental Engineering, 2017, 11(6): 3907-3913. (in Chinese) 陈道康, 蔡天明, 陈立伟, 等. 海藻酸钠与纳米Fe3O4联合固定化菌对三氟羧草醚的降解[J]. 环境工程学报, 2017, 11(6): 3907-3913. |
| [31] |
Chen C, Guo JY, Zhou MJ, et al. Removal of ammonium from aqueous solution by microorganism cells immobilized into chitosan-sodium alginate beads[J]. China Environmental Science, 2019, 39(7): 2812-2821. (in Chinese) 陈诚, 郭俊元, 周明杰, 等. 壳聚糖-海藻酸钠固定化菌小球处理猪场沼液[J]. 中国环境科学, 2019, 39(7): 2812-2821. |
| [32] |
Meng C, Yang H, Wang SL, et al. Embedding immobilization of sulfate-reducing bacteria and the microbial community analysis[J]. Chinese Journal of Environmental Engineering, 2019, 13(8): 1995-2003. (in Chinese) 孟琛, 杨宏, 王少伦, 等. 硫酸盐还原菌包埋固定化及微生物群落分析[J]. 环境工程学报, 2019, 13(8): 1995-2003. |
| [33] |
Yan QY, Liu Y, Wang X, et al. Research on co-denitrification performance of slow-release organic carbon source and water purification bacteria-embedded solid capsules[J]. Acta Agriculturae Zhejiangensis, 2017, 29(24): 651-659. (in Chinese) 闫秋月, 柳永, 王新, 等. 缓释碳源与净水菌胶囊组合脱氮净水性能研究[J]. 浙江农业学报, 2017, 29(4): 651-659. |
| [34] |
Wang CH. Remediation of pyrene-chromium co-contaminated soils by joint application of immobilized consortium and Kyllinga brecifolia rottb[D]. Shanghai: Doctoral Dissertation of Shanghai University, 2016 (in Chinese) 王传花.固定化菌群联合水蜈蚣修复芘-铬复合污染土壤实验研究[D].上海: 上海大学博士学位论文, 2016 |
| [35] |
Egamberdieva D, Jabborova D, Hashem A. Pseudomonas induces salinity tolerance in cotton (Gossypium hirsutum) and resistance to Fusarium root rot through the modulation of indole-3-acetic acid[J]. Saudi Journal of Biological Sciences, 2015, 22(6): 773-779. |
| [36] |
Yang YL, Xue R, Wu GQ. Immobilized PSB for treatment of sulfite paper making wastewater[J]. China Environmental Science, 2001, 21(4): 351-354. (in Chinese) 杨云龙, 薛嵘, 吴国庆. 固定化PSB处理亚硫酸钠造纸废水[J]. 中国环境科学, 2001, 21(4): 35l-354. |
| [37] |
Lin M, Liu YH, Chen WW, et al. Use of bacteria-immobilized cotton fibers to absorb and degrade crude oil[J]. International Biodeterioration and Biodegradation, 2014, 88: 8-12. |
| [38] |
Liu JH, Ren JW, Xu RD, et al. Biodegradation of partially hydrolyzed polyacrylamide by immobilized bacteria isolated from HPAM-containing wastewater[J]. Environmental Progress & Sustainable Energy, 2016, 35(5): 1344-1352. |
| [39] |
Wang YJ, Fu WQ, Xue P. Degradation of trace oil in water using magnetic immobilized microorganism[J]. Chemical Engineering, 2017, 45(9): 7-12. (in Chinese) 王永军, 付文强, 薛屏. 利用磁性固定化微生物降解水中微量油[J]. 化学工程, 2017, 45(9): 7-12. |
| [40] |
Thill A, Zeyons O, Spalla O, et al. Cytotoxicity of CeO2 nanoparticles for Escherichia coli physico-chemical insight of the cytotoxicity mechanism[J]. Environmental Science & Technology, 2006, 40(19): 6151-6156. |
| [41] |
Vacca DJ, Bleam WF, Hickey WJ. Isolation of soil bacteria adapted to degrade humic acid-sorbed phenanthrene[J]. Applied and Environmental Microbiology, 2005, 71(7): 3797-3805. |
| [42] |
Kumar AG, Rajan NN, Kirubagaran R, et al. Biodegradation of crude oil using self-immobilized hydrocarbonoclastic deep sea bacterial consortium[J]. Marine Pollution Bulletin, 2019, 146: 741-750. |
| [43] |
Wang RC, Cheng X, Zeng X. Mechanisms and applications of bacterial-algal symbiotic systems for pollutant removal from wastewater[J]. Acta Scientiae Circumstantiae, 2018, 38(1): 13-22. (in Chinese) 王荣昌, 程霞, 曾旭. 污水处理中菌藻共生系统去除污染物机理及其应用进展[J]. 环境科学学报, 2018, 38(1): 13-22. |
| [44] |
Third KA, Burnett N, Cord-Ruwisch R. Simultaneous nitrification and denitrification using stored substrate (PHB) as the electron donor in an SBR[J]. Biotechnology and Bioengineering, 2003, 83(6): 706-720. |
| [45] |
Zhuang HD, Liu B, Hong W, et al. Pilot study on coal chemical of high nitrogenous wastewater using immobilized enhanced A/O process[J]. Technology of Water Treatment, 2011, 37(12): 75-77. (in Chinese) 庄会栋, 刘勃, 洪卫, 等. 固定化微生物增强A/O工艺处理煤化工高氨氮废水的中试研究[J]. 水处理技术, 2011, 37(12): 75-77. |
| [46] |
Gan YL, Zhao QL, Ye ZF. Denitrification performance and microbial diversity of immobilized bacterial consortium treating nitrate micro-polluted water[J]. Bioresource Technology, 2019, 281: 351-358. |
| [47] |
Mulder A, van de Graaf AA, Robertson LA, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor[J]. FEMS Microbiology Ecology, 1995, 16(3): 177-183. |
| [48] |
Kartal B, Maalcke WJ, de Almeida NM, et al. Molecular mechanism of anaerobic ammonium oxidation[J]. Nature, 2011, 479(7371): 127-130. |
| [49] |
Ni SQ, Zhang J. Anaerobic ammonium oxidation: from laboratory to full-scale application[J]. Biomed Research International, 2013, 2013: 469360. |
| [50] |
Straka LL, Meinhardt KA, Bollmann A, et al. Affinity informs environmental cooperation between ammonia-oxidizing archaea (AOA) and anaerobic ammonia-oxidizing (anammox) bacteria[J]. The ISME Journal, 2019, 13(8): 1997-2004. |
| [51] |
Zhang L, Okabe S. Ecological niche differentiation among anammox bacteria[J]. Water Research, 2020, 171: 115468. |
| [52] |
Ali M, Shaw DR, Zhang L, et al. Aggregation ability of three phylogenetically distant anammox bacterial species[J]. Water Research, 2018, 143: 10-18. |
| [53] |
Sonthiphand P, Hall MW, Neufeld JD. Biogeography of anaerobic ammonia-oxidizing (anammox) bacteria[J]. Frontiers in Microbiology, 2014, 5: 399. |
| [54] |
Zhang L, Okabe S. Rapid cultivation of free-living planktonic anammox cells[J]. Water Research, 2017, 127: 204-210. |
| [55] |
Huang P, Mukherji ST, Wu S, et al. Fate of 17β-estradiol as a model estrogen in source separated urine during integrated chemical P recovery and treatment using partial nitritation-anammox process[J]. Water Research, 2016, 103: 500-509. |
| [56] |
Vázquez-Padín J, Mosquera-Corral A, Campos JL, et al. Microbial community distribution and activity dynamics of granular biomass in a canon reactor[J]. Water Research, 2010, 44(15): 4359-4370. |
| [57] |
Prasomsri T, Jiao WQ, Weng SZ, et al. Mesostructured zeolites: bridging the gap between zeolites and MCM-41[J]. Chemical Communications, 2015, 51(43): 8900-8911. |
| [58] |
Mehlhorn D, Valiullin R, Kärger J, et al. Exploring mass transfer in mesoporous zeolites by NMR diffusometry[J]. Materials, 2012, 5(4): 699-720. |
| [59] |
Le HT, Jantarat N, Khanitchaidecha W, et al. Utilization of waste materials for microbial carrier in wastewater treatment[J]. BioMed Research International, 2016, 2016: 6957358. |
| [60] |
Chu LB, Wang JL, Quan F, et al. Modification of polyurethane foam carriers and application in a moving bed biofilm reactor[J]. Process Biochemistry, 2014, 49(11): 1979-1982. |
| [61] |
Kumwimba MN, Lotti T, Şenel E, et al. Anammox-based processes: how far have we come and what work remains? A review by bibliometric analysis[J]. Chemosphere, 2020, 238: 124627. |
| [62] |
Sharma S. Bioremediation: features, strategies and applications[J]. Asian Journal of Pharmacy and Life Science, 2012, 2(2): 202-213. |
| [63] |
Xu YH, Lu M. Bioremediation of crude oil-contaminated soil: comparison of different biostimulation and bioaugmentation treatments[J]. Journal of Hazardous Materials, 2010, 183(1/3): 395-401. |
| [64] |
Bastiaens L, Springael D, Wattiau P, et al. Isolation of adherent polycyclic aromatic hydrocarbon (PAH)-degrading bacteria using PAH-sorbing carriers[J]. Applied and Environmental Microbiology, 2000, 66(5): 1834-1843. |
| [65] |
Sheng GP, Yu HQ, Li XY. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: a review[J]. Biotechnology Advances, 2010, 28(6): 882-894. |
| [66] |
Zhang XQ, Bishop PL. Biodegradability of biofilm extracellular polymeric substances[J]. Chemosphere, 2003, 50(1): 63-69. |
| [67] |
An CJ, Huang GH, Wei J, et al. Effect of short-chain organic acids on the enhanced desorption of phenanthrene by rhamnolipid biosurfactant in soil-water environment[J]. Water Research, 2011, 45(17): 5501-5510. |
| [68] |
Ibacache-Quiroga C, Ojeda J, Espinoza-Vergara G, et al. The hydrocarbon-degrading marine bacterium Cobetia sp. strain MM1IDA2H-1 produces a biosurfactant that interferes with quorum sensing of fish pathogens by signal hijacking[J]. Microbial Biotechnology, 2013, 6(4): 394-405. |
| [69] |
Zhong H, Jiang YB, Zeng GM, et al. Effect of low-concentration rhamnolipid on adsorption of Pseudomonas aeruginosa ATCC 9027 on hydrophilic and hydrophobic surfaces[J]. Journal of Hazardous Materials, 2015, 285: 383-388. |
| [70] |
Chefetz B, Xing BS. Relative role of aliphatic and aromatic moieties as sorption domains for organic compounds: a review[J]. Environmental Science & Technology, 2009, 43(6): 1680-1688. |
| [71] |
Yang MY, Zhang H, Ni JZ, et al. Effect of cadmium on pyrene biodegradation in solution and soil using free and immobilized Escherichia sp. on biochar[J]. Applied Soil Ecology, 2020, 150: 103472. |
| [72] |
Xiong FZ, Zhao XX, Liao YH, et al. Effects of surface properties on biofilm formation and the related applications[J]. Microbiology China, 2018, 45(1): 155-165. (in Chinese) 熊富忠, 赵小希, 廖胤皓, 等. 材料表面特征对生物膜形成的影响及其应用[J]. 微生物学通报, 2018, 45(1): 155-165. |
| [73] |
Chen YP, Zhang P, Guo JS, et al. Functional groups characteristics of EPS in biofilm growing on different carriers[J]. Chemosphere, 2013, 92(6): 633-638. |
| [74] |
Li QY, Lu H, Yin YX, et al. Synergic effect of adsorption and biodegradation enhance cyanide removal by immobilized Alcaligenes sp. strain DN25[J]. Journal of Hazardous Materials, 2019, 364: 367-375. |
| [75] |
Xu XY, Zhou H, Chen X, et al. Biodegradation potential of polycyclic aromatic hydrocarbons by immobilized Klebsiella sp. in soil washing effluent[J]. Chemosphere, 2019, 223: 140-147. |
| [76] |
Yu GY. Japan's air pollution policy and its enlightenment to China[J]. Times Finance, 2019(9): 221-222, 229. (in Chinese) 喻高莹. 日本大气污染政策及对我国的启示[J]. 时代金融, 2019(9): 221-222, 229. |
| [77] |
Kim JH, Rene ER, Park HS. Performance of an immobilized cell biofilter for ammonia removal from contaminated air stream[J]. Chemosphere, 2007, 68(2): 274-280. |
| [78] |
Qi ZH, Zhang XH, Zhang SH. Impact factors analysis of removing formaldehyde in indoor air by a microorganisms bioreactor[J]. Environmental Science and Technology, 2015, 38(5): 109-113, 138. (in Chinese) 齐枝花, 张晓虎, 张胜华. 微生物反应器处理空气甲醛的影响因素分析[J]. 环境科学与技术, 2015, 38(5): 109-113, 138. |
| [79] |
Parvatiyar MG, Govind R, Bishop DF. Biodegradation of toluene in a membrane biofilter[J]. Journal of Membrane Science, 1996, 119(1): 17-24. |
| [80] |
Sun XX, Sun PS, Wang J. Application on the technology of purifying organic waste gases in low concentration by using biological method[J]. Journal of Kunming University of Science and Technology (Science and Technology), 2004, 29(5): 115-119. (in Chinese) 孙学习, 孙珮石, 王洁. 生物法净化低浓度有机废气技术研究应用进展[J]. 昆明理工大学学报:理工版, 2004, 29(5): 115-119. |
| [81] |
Wan SG, Li GY, Zu L, et al. Purification of waste gas containing high concentration trimethylamine in biotrickling filter inoculated with B350 mixed microorganisms[J]. Bioresource Technology, 2011, 102(12): 6757-6760. |
 2020, Vol. 47
2020, Vol. 47