扩展功能
文章信息
- 杨盼, 翟亚萍, 赵祥, 王绍明, 刘红玲, 张霞
- YANG Pan, ZHAI Ya-Ping, ZHAO Xiang, WANG Shao-Ming, LIU Hong-Ling, ZHANG Xia
- 丛枝菌根真菌和根瘤菌互作对苜蓿根际土壤细菌群落结构的影响及PICRUSt功能预测分析
- ffect of interaction between arbuscular mycorrhizal fungi and Rhizobium on Medicago sativa rhizosphere soil bacterial community structure and PICRUSt functional prediction
- 微生物学通报, 2020, 47(11): 3868-3879
- Microbiology China, 2020, 47(11): 3868-3879
- DOI: 10.13344/j.microbiol.china.190978
-
文章历史
- 收稿日期: 2019-11-24
- 接受日期: 2020-01-28
- 网络首发日期: 2020-02-24
2. 成都师范学院 四川 成都 611130
2. Chengdu Normal University, Chengdu, Sichuan 611130, China
苜蓿(Medicago sativa)为多年生豆科牧草,具有产量高、适应性强、抗旱耐盐碱、家畜适口性好等特点,被称为“牧草之王”[1]。丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是通过与寄主植物形成“菌根”结构,从而与寄主植物建立共生关系的有益微生物[2],AM真菌和植物共生可以使AM真菌的根外菌丝逐渐向周围伸展,显著扩大了根系的吸收面积与结构[3],从而提高植物根系对土壤中所需理化物质的吸收。根瘤菌是革兰氏阴性细菌,在土壤中广泛分布,通过侵染豆科植物根部与该植物共生形成根瘤结构,从而增加植物根部对氮素的吸收[4]。目前,有研究发现豆科作物接种AMF和根瘤菌具有协同促进作用[5],而且研究发现,无论单接种AM真菌、根瘤菌或二者混合接种,均可以促进植物养分吸收、提高抗逆性(如抗病性)[6-8]、改良土壤结构[9]、提高难溶性养分的溶解度等,从而对苜蓿产量提高有显著促进作用。
土壤微生物对植被的生长发育及产量有重要影响,是植物和土壤连接的媒介,其中数量最大、分布最广的就是细菌。细菌对于土壤的氮磷循环、养分吸收等过程,以及对土壤生态系统的稳定、土壤肥力的保存具有至关重要的作用[10]。接种AM真菌和根瘤菌后必然会对苜蓿土壤微生物群落组成与结构产生一定的影响,因此,研究接种AM真菌和根瘤菌后土壤细菌的群落结构和多样性,对于阐明接种AM真菌和根瘤菌后对植物促进作用的机理具有重要意义。
随着测序技术的发展,具有高通量、高准确度和低成本优势的高通量测序技术已广泛应用于根际微生物的研究中,现已成为研究环境微生物多样性及群落结构差异的重要手段[11-14]。相比于传统的测序技术,高通量测序技术可以更为真实全面地反映微生物群落组成的多样性。本研究通过高通量测序技术研究不同接种处理组土壤微生物的群落组成和多样性,以期了解接种AM真菌和根瘤菌影响了哪些关键菌群,及其在苜蓿生长过程中发挥的作用,并结合PICRUSt预测分析不同接种处理土壤微生物功能的变化,从而为接种AM真菌和根瘤菌促进植株养分吸收、提高抗逆性、促进苜蓿产量提高等提供微生物方面的科学依据。
1 材料与方法 1.1 材料供试紫花苜蓿种子,产地新疆自治区石河子市。挑选大小一致、饱满的种子,经质量分数为10%的H2O2浸泡10 min后用无菌水冲洗5遍,将苜蓿种子浸泡在少量无菌水中催芽过夜。
供试AM真菌:摩西球囊霉(Glomus mosseae,G.m)和根内球囊霉(Glomus intraradices,G.i)由青岛农业大学菌根生物技术研究所刘润进教授提供。根瘤菌选用苜蓿中华根瘤菌(Sinorhizobium meliloti),由石河子大学农学院提供。
以土壤׃沙׃蛭石按5׃3׃2的体积比混匀的混合土壤作为供试土壤。分别将土壤、沙、蛭石经1×105 Pa高压灭菌2 h,自然冷却后再次灭菌2 h。盆栽容器为17×11×15 cm (盆口直径×盆底直径×高)规格的塑料盆,盆经过0.2%高锰酸钾浸泡过夜,用无菌水冲洗风干备用。
主要试剂和仪器:Phusion® High-Fidelity PCR Master Mix with GC Buffer,New England Biolabs公司;Gene JET™ Gel Extraction Kit,Thermo Scientific公司;Ion Plus Fragment Library Kit 48 rxns,Thermo Fisher公司。Ion S5TMXL仪器,Thermo Fisher公司;智能光照培养箱,浙江托普云农科技股份有限公司。
1.2 试验方法 1.2.1 室内幼苗培养实验设置6个接种处理组:(1)单独接种摩西球囊霉(G.m);(2)单独接种根内球囊霉(G.i);(3)单独接种根瘤菌(K);(4)双接种摩西球囊霉和根瘤菌(G.m-K);(5)双接种根内球囊霉和根瘤菌(G.i-K);(6)不接种(CK)。
挑选已经发芽的种子进行播种,每盆装入4 kg混合灭菌土。接种方法为:AM真菌接种与播种同步进行,以含有AM真菌孢子、菌丝以及寄主植物根段的混合物土壤作为接种菌剂,均匀撒于种子下约2 cm处,每盆穴播苜蓿种子20粒,菌剂20 g,不接种和单独接种根瘤菌处理则添加等量灭活菌剂;根瘤菌接种前需对根瘤菌进行活化和培养,配制成菌悬液(根瘤菌数约109 CFU/mL),在间苗后采用注射器进行根灌接种,接种量为8 mL,不接种和单接种AM真菌则注射8 mL无菌水;AM真菌与根瘤菌双接种时,先进行AM真菌接种以及播种覆土,待间苗后进行根瘤菌接种,方法同根瘤菌的单接种,每种处理5组重复,待幼苗生长7 d后间苗,每盆留下10株长势一致且粗壮的幼苗。盆栽前期50 d内使用智能光照培养箱进行培养,培养箱设置为白天28 ℃ 16 h,光照强度为最大光强的80%,夜晚(黑暗) 23 ℃ 8 h。盆栽后期50−60 d转移到室内培养,室内培养条件为白天25−33 ℃,夜晚20−25 ℃。
1.2.2 室外幼苗的移栽2018年5月4日于新疆石河子市147团苜蓿大田采集距地面5−30 cm的土壤,取部分土壤自然风干后检测土壤性质,土壤概况为pH 7.9、含水率8.35%、全氮0.57 g/kg、全磷0.31 g/kg、全钾30.89 g/kg、碱解氮32.47 mg/kg、有效磷26.23 mg/kg、速效钾496.96 mg/kg、有机质29.22 g/kg。将带回实验室的剩余土壤分装后经1×105 Pa高压灭菌2 h,自然冷却备用。苜蓿幼苗移栽后在石河子大学试验地培养(86°05′72″E,44°30′29″N,404 m),该区气候较为干燥,年降雨量约125−208 mm,年平均气温7.2 ℃,属典型大陆性干旱气候。幼苗移栽前将70×70×70 cm (长×宽×高)的定制玻璃缸埋入土壤中50 cm深,以保持缸内与缸外土壤温度一致,用酒精擦拭玻璃缸内侧除菌,将灭菌土壤倒入玻璃缸中,每个玻璃缸内装入60×70×70 cm灭菌土,试验设置6组处理。
2018年6月28日,对室内培养60 d的紫花苜蓿进行接种效应分析,确保苜蓿根系被AM真菌或根瘤菌侵染后,将室内培养的紫花苜蓿移栽至室外缸内,每个玻璃缸内移栽30株长势一致的苜蓿,行距12 cm,移栽工作在1 d内完成。室外生长期间,初次浇水要浇透土壤,接下来每2周浇灌一次,采用均匀洒水的方式在每个缸中浇入等量无菌水6 L。
1.2.3 样品的采集于2018年9月30日在石河子大学试验地分别采集6个处理组CK、G.m、G.i、K、G.m-K、G.i-K根际(记为CKTR、GMR、GIR、KR、GMKR、GIKR)及非根际土壤(记为CKTB、GMB、GIB、KB、GMKB、GIKB)。采集根际土样时,采用“抖根法”,首先将植物根部上结合松散的土壤抖掉,再拿小刷子刷下根部0−4 mm范围内的土壤作为根际土壤,在采集根际土旁选取没有苜蓿生长的地方采集同等深度的土壤作为非根际土壤。土壤采集后放入冰盒带回实验室,保存于−80 ℃冰箱备用。
1.2.4 细菌16S rRNA基因高通量测序试验采用CTAB法提取各组土壤基因组DNA,并通过琼脂糖凝胶电泳检测DNA的浓度和纯度。分别将每组样品提取的DNA放入不同的离心管,并用无菌水稀释至1 ng/μl。以稀释后的DNA为模板,对16S rRNA基因的V3−V4区片段进行PCR扩增,扩增过程使用带有Barcode的特异引物515F (5′-GTGCCAGCMGCCGCGGTAA-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)。PCR反应体系:2×Phusion Master Mix 15 µL,515F、806R (2 µmol/L)各3 µL,基因组DNA (1 ng/µL) 7 µL,ddH2O 2 µL。PCR反应条件:98 ℃ 1 min;98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min;4 ℃保存。将扩增产物通过琼脂糖凝胶回收、纯化洗脱后用琼脂糖电泳进行检测。将PCR产物使用ThermoFisher的Ion S5TM XL平台进行高通量测序。完成测序后,将测定的序列剪切优化后以97%的序列一致性将序列聚类为操作分类单元(operational taxonomic units,OTU)。根据OTU聚类,统计分析其各个分类水平上的群落结构和组成,并使用PICRUSt软件进行基因功能预测,根据功能分类丰度,绘制功能丰度热图。
2 结果与分析 2.1 细菌群落结构分析对12组36个土壤样品进行16S rRNA基因高通量测序,得到了2 880 072个Raw reads,经序列过滤和去除嵌合体序列,最后得到的优质序列共2 720 025条,平均长度为418.42 bp。以97%的相似度划分,得到3 849个OTU。12组土壤样品的细菌覆盖率为99.5%−99.6%,说明取样合理,所测结果能够较为真实地反映不同处理组紫花苜蓿土壤中的细菌群落。
36个苜蓿土壤样品的3 849个OTU分属于50门59纲132目249科595属398种。由图 1可知,在不同处理组中,相对丰度较高的细菌门分别为Proteobacteria (52.81%−81.46%)、Bacteroidetes(7.83%−19.68%)、Actinobacteria (2.21%−16.4%)、Firmicutes (1.22%−7.31%)、Gemmatimonadetes (2.01%−5.43%)、Acidobacteria (0.61%−2.14%)、Verrucomicrobia (0.40%−1.02%)、unidentified_ Bacteria (0.12%−0.90%)、Fusobacteria (0.01%− 3.93%)和Berkelbacteria (0.02%−1.06%)。在门水平上,Proteobacteria占绝对优势。
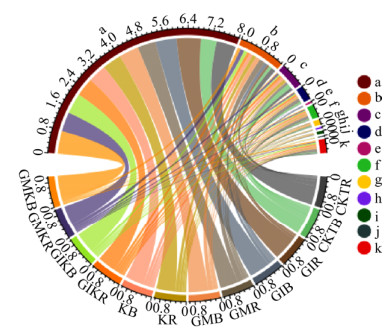
|
| 图 1 不同接种处理下苜蓿土壤细菌门水平的相对丰度弦图 Figure 1 Relative abundance chord diagram of soil bacterial at division level under different inoculation treatments 注:a:变形菌门;b:拟杆菌门;c:放线菌门;d:厚壁菌门;e:梭杆菌门;f:芽单胞菌门;g:酸杆菌门;h:unidentified_Bacteria;i:疣微菌门;j:Berkelbacteria;k:稀有细菌类群. Note: a: Proteobacteria; b: Bacteroidetes; c: Actinobacteria; d: Firmicutes; e: Fusobacteria; f: Gemmatimonadetes; g: Acidobacteria; h: unidentified_Bacteria; i: Verrucomicrobia; j: Berkelbacteria; k: Others. |
|
|
研究共检测到细菌59纲,丰度较高的纲分别为Gammaproteobacteria (39.2%−69.19%)、Bacteroidia (7.5%−19.53%)、Alphaproteobacteria (7.17%− 16.74%)、Bacilli (0.85%−6.72%)、Acidimicrobiia (0.69%−3.63%)、Clostridia (0.31%−2.73%)和Fusobacteriia (0.02%−3.92%)。由图 2可以得知,Gammaproteobacteria是在纲水平占绝对优势的细菌类群,隶属于变形菌门。相较于不接种组,Gammaproteobacteria丰度在GIR和GMKR处理组中分别增加了42.93%和10.79%,在GIKR处理组降低了1.97%。Bacteroidia丰度在GMR处理组中增加了25.8%,而且除了KR处理组,Alphaproteobacteria在其他接种处理组均显著降低(P < 0.05)。
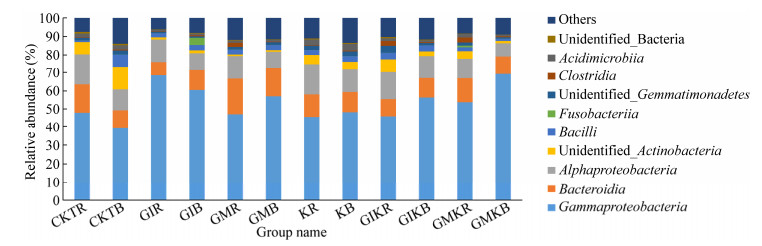
|
| 图 2 不同接种处理下苜蓿土壤纲水平细菌菌群组成 Figure 2 Relative abundance chord diagram of soil bacterial at class level under different inoculation treatments 注:Unidentified:分类地位不明确的细菌类群;Others:稀有细菌类群. Note: Unidentified: Bacterial sequences that were not identified into anyone in databases; Others: Rare groups. |
|
|
试验通过高通量测序在6个不同处理组共检测到595属,其中优势细菌属(丰度 > 1%)为Stenotrophomonas、Lysobacter、Pontibacter、Bacillus、Sphingomonas、Rheinheimera及Cellvibrio,其中Stenotrophomonas为占绝对优势的菌属。为了研究不同接种处理组在属水平的组成差异,绘制了各属的相对丰度热图(图 3)。
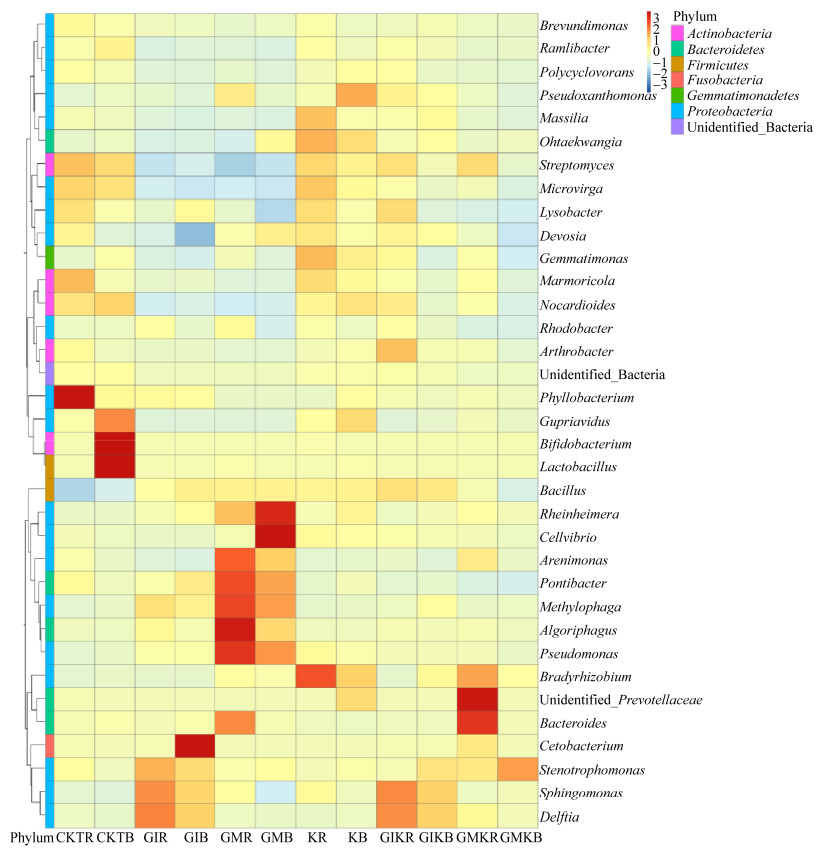
|
| 图 3 不同接种处理下苜蓿土壤细菌属水平丰度热图 Figure 3 Abundance heat map of bacterial at genus level under different inoculation treatments |
|
|
由图 3可知,CKTR处理组中丰度较大的属有Phyllobacterium、Brevundimonas及Marmoricola,CKTB处理组中Bifidobacterium和Lactobacillus丰度较高,GIR处理组中丰度较大的属有Stenotrophomonas、Sphingomonas及Delftia,而且Sphingomonas和Delftia两属在GIB、GIKR、GIKB处理组中丰度也较大,但在其他组细菌群落中显著降低甚至消失;在GIB处理组中丰度较大的属有Cetobacterium,GMR处理组中丰度较大的属有Algoriphagus、Pseudomonas、Pontibacter、Arenimonas及Methylophage,GMB处理组中丰度较大的属有Rheinheimera和Cellvibrio,KR处理组中Massilia、Gemmatimonas及Bradyrhizobium丰度较大,KB处理组中Pseudomonas丰度较大,GIKR处理组中Arthrobacter、unidentified_ Lachnospiraceae及Faecalibacterium丰度较大,GIKB处理组中Pedobacter丰度较大,GMKR处理组中unidentified_Prevotellaceae和Bacteroide丰度较大,GMKB处理组中Stenotrophomonas丰度较大。
2.3 细菌功能预测为了了解不同处理组苜蓿土壤根际、非根际细菌的功能,采用PICRUSt软件进行了细菌功能预测。该软件基于Greengene数据库构建细菌域全谱系的基因功能图谱,随后将菌群组成“映射”到数据库中,进行菌群代谢功能预测。在一级功能层中,除未分类功能组外,共有6类生物功能代谢通路,分别为:organismal systems、metabolism、genetic information processing、environmental information processing、cellular processes、human diseases (图 4)。其中最主要的功能为metabolism和genetic information processing和environmental information processing,在不同处理组中它们的平均占比分别为48.68%、20.43%及15.23%。在基因二级功能层预测分析中发现其由氨基酸代谢、碳水化合物代谢、外源物质降解及代谢、膜转运、转录、复制和修复、能量代谢、传染病、细胞生长和死亡、传染病等35个子功能组成(图 4)。在所有处理组中占比较高的子功能(占比 > 5%)主要为膜转运、碳水化合物代谢、氨基酸代谢及翻译。相较于不接种组,氨基酸代谢在GIR、GMR、GIKR和GMKR处理组分别降低了1.98%、1.65%、0.75%和1.66%,在KR处理组提高了1.71%;碳水化合物代谢在GIR和GMR处理组分别降低了3.77%和0.12%,在KR、GIKR和GMKR处理组分别升高了2.8%、0.25%和4.42%。相较于不接种组,GIR处理组中微生物群落外源物质降解及代谢、转运、细胞运动性、传染病、膜转运、细胞过程和信号转导等功能明显增强,在GMR和GMKR处理组中微生物群落复制和修复、碳水化合物代谢、核苷酸代谢、翻译等功能明显增强,在KR处理组中脂质代谢、氨基酸代谢、萜类和聚酮类化合物代谢、能量代谢等功能增强。
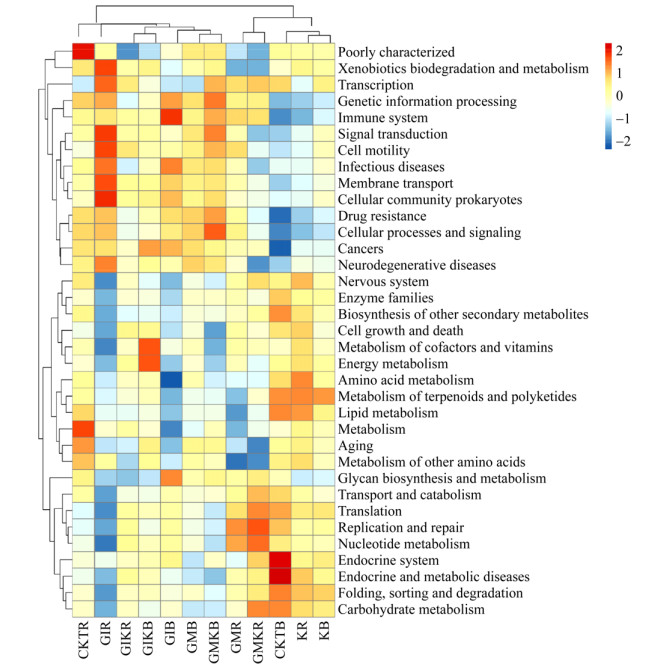
|
| 图 4 不同接种处理下苜蓿土壤细菌功能多样性热图 Figure 4 Heat map of bacterial functional diversity in alfalfa soil under different inoculation treatments |
|
|
本研究通过高通量测序分析了不同接种处理下苜蓿根际和非根际土壤细菌群落结构组成,在门水平上,Proteobacteria、Bacteroidetes、Actinobacteria、Firmicutes及Gemmatimonadetes在不同处理组中丰度相对较高(> 3%),而且Proteobacteria为各个接种处理组中占绝对优势的细菌类群(图 1)。目前发现大多数植物的内生菌门均以Proteobacteria为主,如黑枸杞[15]、Zostera japonica[16]、香蕉[17]和玉米[18]等。变形菌门是细菌中最大的一门,属于革兰氏阴性菌,有研究推测变形菌门在各种植物根际微生物区系中占优势可能是因为其在各种植物根际生长速度较快[19]。本研究中,Proteobacteria下的Gammaproteobacteria是最优势菌纲,Gammaproteobacteria中具有许多促生长细菌(plant growth promoting Rhizobacteria,PGPR),可以释放植物激素[20]以及抵抗土壤病原菌[21];相较于对照组,GIR与GMKR处理组中Gammaproteobacteria的丰度分别增加了42.93%和10.79%,GIKR处理组中Gammaproteobacteria的丰度则降低了1.97% (P < 0.05),推测单独接种根内球囊霉、双接种摩西球囊霉和根瘤菌可提高苜蓿根际有益菌的丰度,而双接种根内球囊霉和根瘤菌可能对土壤有益菌的丰度增加有一定的抑制作用。另外,相较于对照组,Proteobacteria下的另一菌纲Alphaproteobacteria的丰度在GIR、GMR、GIKR和GMKR处理组中显著降低,在KR处理组无明显变化。Alphaproteobacteria中含有大量能与植物共生的其他固氮细菌[22],说明接种的根瘤菌可能与其他固氮菌具有协同促进作用,而接种AM真菌后可能由于植株分泌物的改变或微生物间的竞争拮抗作用,使得AM真菌对其他固氮菌具有抑制作用。另外,采样时间在9月底,早晚温差大可能会造成很多微生物死亡,推测接种根瘤菌可能会提高其他固氮菌的耐低温能力。本研究中,Bacteroidetes是仅次于Proteobacteria的优势菌群,Bacteroidia是本研究中隶属于Bacteroidetes的第二大菌纲,Bacteroidia与植物氮、磷、蛋白质的代谢以及纤维素的降解和提高植物抗逆性等方面具有重要作用。Wang等[23]研究结果表明,施用微生物菌剂可以促进土壤根际中Bacteroidia和Actinobacteria等有益菌丰度的增加。本实验与其研究结果一致,在本研究中,相较于不接种组,Bacteroidia在GMR处理组中增加了25.8%,Actinobacteria在KR处理组增加了1.87%,Firmicutes在GIR、GMR、KR、GIKR和GMKR处理组中分别增加了1.1、3.0、1.5、4.2和3.1倍。有研究发现,Actinobacteria、Firmicutes可以产生抗生素,并对土壤病原菌有一定的拮抗作用[24],推测接种AM真菌和根瘤菌可提高苜蓿植株的氮、磷循环,以及提高苜蓿植株的抗病能力,并且就抗病能力来说,双接种处理组可能高于单接种处理组。
此外,土壤细菌类群组成较为复杂,本研究中发现在属水平上不同处理组间菌群的丰度差异较大。相较于对照组,在GIR处理组中丰度较大的属有Stenotrophomonas、Sphingomonas及Delftia,且Sphingomonas和Delftia两属细菌在GIB、GIKR、GIKB处理组中丰度也较大,而在其他处理组中显著降低(P < 0.05);在GMR处理组中丰度较大的细菌属有Algoriphagus、Pseudomonas、Pontibacter、Arenimonas及Methylophage;在KR处理组中Massilia、Gemmatimonas及Bradyrhizobium丰度较大;在GIKR处理组中Arthrobacter和Faecalibacterium丰度较大;在GMKR处理组中Bacteroide丰度较大。在不同处理组中,寡养单孢菌属(Stenotrophomonas)为已分类最优势属。相较于不接种组,寡养单孢菌属(Stenotrophomonas)在GIR处理组中增加了45.6%,在GIKR处理组中则降低了19.2%。目前,已有研究表明,寡养单孢菌属(Stenotrophomonas)和鞘氨醇单胞菌属(Sphingomonas)为有机化合物降解菌,具有分泌过氧化氢酶的能力,是可以提高植物抗逆性的土壤益生菌[25]。Delftia具有抑制多种致病菌的作用[26];芽孢杆菌属(Gemmatimonas)、假单孢菌属(Pseudomonas)和Massilia可以通过生成和释放生长素和赤霉素等植物激素促进植物生长,而且芽孢杆菌属(Gemmatimonas)和假单孢菌属(Pseudomonas)可以通过固氮、溶磷等促进对养分的吸收,进而改善根系构型,减少肥料的施用[27-29],Massilia[30]则对疫霉菌(Phytophthora)有体外拮抗作用,可提高植物的抗病性。Pontibacter属细菌具有耐盐、耐碱、耐旱等作用,可显著提高土壤的抗逆性[31]。有研究发现,Bradyrhizobium[32]和节杆菌属(Arthrobacter)[33]与土壤的氮元素循环密切相关,且Bradyrhizobium、Arthrobacter均属于固氮菌,具有结瘤固氮作用;拟杆菌属(Bacteroide)和糖代谢、氮代谢、脂化酶等密切有关,对于氮和磷表现良好的适应性[34]。本研究中,相较于不接种组,单接种根瘤菌中的特有属Massilia、Gemmatimonas和Bradyrhizobium促进了苜蓿根际结瘤固氮的能力,单接种根内球囊霉与摩西球囊霉中特有属Stenotrophomonas、Delftia和Pseudomonas等提高了苜蓿根际土壤磷素循环、植物激素的释放以及对病原菌的抵御能力,对提高植物的抗病、抗逆性以及提高植物的产量、减少肥料的施用有极其重要的作用。
3.2 细菌群落功能预测分析PICRUSt软件是最新兴起的细菌群落功能预测的平台,较多应用于土壤细菌群落功能预测[35]。为探明不同处理组中苜蓿根际和非根际土壤细菌的功能,本研究将MiSeq高通量测序结果进行PICRUSt功能预测分析。结果表明,不同处理组中苜蓿根际和非根际土壤细菌共涉及代谢、遗传信息处理、环境信息处理等6个代谢通路,分属于35个子功能,表现出功能上的丰富性。在本研究中,不同接种处理组中的主要功能基因均为代谢相关功能,其所占比例最大,说明代谢在苜蓿生长过程起着极其重要的作用,这与前人的研究结果一致,前人研究表明,土壤微生物通过代谢活动促进植物生长、提高作物产量,例如链霉菌、芽孢杆菌、假单胞菌等通过代谢产生抗生素、抑菌蛋白及促进植物生长激素等,从而达到控制病原菌以及促进植物生长的作用,并且固氮、溶磷等作用也是通过代谢而促进根系对氮、磷养分的吸收[36-39]。此外,在本研究中与代谢相关的二级功能层中氨基酸代谢、碳水化合物代谢占比较高,研究表明,氨基酸代谢主要通过脱氨作用、转氨作用、联合脱氨或脱羧作用分解成α-酮酸、胺类及二氧化碳,氨基酸代谢与植株氮素的循环息息相关[40]。在本研究中,相较于不接种组,氨基酸代谢在GIR、GMR、GIKR和GMKR处理组分别降低了1.98%、1.65%、0.75%和1.66%,在KR处理组提高了1.71%,进一步证明了接种根瘤菌可能促进植物氮素循环,而接种AM真菌可能对于氮循环有一定的抑制作用。另外有研究表明,碳水化合物代谢与植物体内氮、磷密切相关,氮、磷循环的增加可促进植株碳水化合物的代谢[41]。在本研究中,碳水化合物代谢在GIR和GMR处理组分别降低了3.77%和0.12%,在KR、GIKR和GMKR处理组分别升高了2.8%、0.25%和4.42%。GIKR和GMKR处理组碳水化合物代谢相比于GIR和GMR处理组显著提高,推测相比于单接种AM真菌,双接种AM真菌和根瘤菌更有益于植株的氮、磷循环。
综上所述,相较于不接种,不同接种处理会分别促进不同有益菌的增加,从而对苜蓿养分吸收、抗逆性的增加有一定的抑制作用,例如接种中华根瘤菌增加了苜蓿根际Alphaproteobacteria等促进氮循环的细菌丰度,接种根内球囊霉和摩西球囊霉分别增加了苜蓿根际Gammaproteobacteria和Bacteroidia等对磷循环有促进作用的有益菌的丰度。另外,PICRUSt功能预测表明,代谢为苜蓿生长过程中最主要的功能,接种根瘤菌可通过增加氨基酸代谢而有利于植株氮素循环,而接种AM真菌可能对于氮循环有一定的抑制作用,并且相比于单接种AM真菌,双接种AM真菌和根瘤菌处理组碳水化合物代谢更强,从而更有益于植株的氮、磷循环。
| [1] |
Liu YN, Shi YH, Yan XB, et al. Effect of alfalfa hay substituting for part of the concentrate, on the production of cows and economic profit[J]. Acta Prataculturae Sinica, 2013, 22(6): 190-197. (in Chinese) 刘艳娜, 史莹华, 严学兵, 等. 苜蓿青干草替代部分精料对奶牛生产性能及经济效益的影响[J]. 草业学报, 2013, 22(6): 190-197. |
| [2] |
Smith SE, Read DJ. Mycorrhizal symbiosis[J]. Quarterly Review of Biology, 2008, 3(3): 273-281. |
| [3] |
Smith FA, Grace EJ, Smith SE. More than a carbon economy: nutrient trade and ecological sustainability in facultative arbuscular mycorrhizal symbioses[J]. New Phytologist, 2009, 182(2): 347-358. DOI:10.1111/j.1469-8137.2008.02753.x |
| [4] |
Chakraborty U, Purkayastha RP. Role of rhizobitoxine in protecting soybean roots from Macrophomina phaseolina infection[J]. Canadian Journal of Microbiology, 1984, 30(3): 285-289. DOI:10.1139/m84-043 |
| [5] |
Zhuang Q, Zhao XJ, Song FQ. Amorpha fruticosa arbuscular mycorrhizal (AM) root exudates induced nodulation factors of rhizobia and their interactions[J]. Journal of Northwest Forestry University, 2018, 33(3): 164-168. (in Chinese) 庄倩, 赵晓娟, 宋福强. 紫穗槐丛枝菌根(AM)根系分泌物诱导根瘤菌结瘤因子及作用研究[J]. 西北林学院学报, 2018, 33(3): 164-168. |
| [6] |
Rabie GH. Induction of fungal disease resistance in Vicia faba by dual inoculation with Rhizobium leguminosarum and vesicular-arbuscular mycorrhizal fungi[J]. Mycopathologia, 1998, 141(3): 159-166. DOI:10.1023/A:1006937821777 |
| [7] |
Ruiz-Lozano JM, Collados C, Barea JM, et al. Arbuscular mycorrhizal symbiosis can alleviate drought-induced nodule senescence in soybean plants[J]. New Phytologist, 2001, 151(2): 493-502. DOI:10.1046/j.0028-646x.2001.00196.x |
| [8] |
Vivas A, Vörös I, Biró B, et al. Symbiotic efficiency of autochthonous arbuscular mycorrhizal fungus (G. mosseae) and Brevibacillus sp. isolated from cadmium polluted soil under increasing cadmium levels[J]. Environmental Pollution, 2003, 126(2): 179-189. DOI:10.1016/S0269-7491(03)00195-7 |
| [9] |
Ye JS, Li T, Hu YJ, et al. Influences of AM fungi on plant growth and water-stable soil aggregates under drought stresses[J]. Acta Ecologica Sinica, 2013, 33(4): 1080-1090. (in Chinese) 叶佳舒, 李涛, 胡亚军, 等. 干旱条件下AM真菌对植物生长和土壤水稳定性团聚体的影响[J]. 生态学报, 2013, 33(4): 1080-1090. |
| [10] |
Burns KN, Kluepfel DA, Strauss SL, et al. Vineyard soil bacterial diversity and composition revealed by 16S rRNA genes: differentiation by geographic features[J]. Soil Biology and Biochemistry, 2015, 91: 232-247. DOI:10.1016/j.soilbio.2015.09.002 |
| [11] |
Lu H, Zhao H, Sheng YY, et al. Soil prokaryotic community characteristics in two alpine meadow types based on high-throughput sequencing techniques[J]. Acta Ecologica Sinica, 2018, 38(22): 8080-8087. (in Chinese) 卢慧, 赵珩, 盛玉钰, 等. 基于高通量测序的两种高寒草甸土壤原核生物群落特征研究[J]. 生态学报, 2018, 38(22): 8080-8087. |
| [12] |
Liu KH, Ding XW, Zhang B, et al. High-throughput sequencing to reveal fungal diversity in hot springs of Rehai at Tengchong in Yunnan[J]. Acta Microbiologica Sinica, 2017, 57(9): 1314-1322. (in Chinese) 刘开辉, 丁小维, 张波, 等. 高通量测序分析云南腾冲热海热泉真菌多样性[J]. 微生物学报, 2017, 57(9): 1314-1322. |
| [13] |
Li YK, Sun YF, Lei YH, et al. Fungal community diversity in rhizosphere soil of Lycium barbarum L. based on high-throughput sequencing[J]. Acta Microbiologica Sinica, 2017, 57(7): 1049-1059. (in Chinese) 李越鲲, 孙燕飞, 雷勇辉, 等. 枸杞根际土壤真菌群落多样性的高通量测序[J]. 微生物学报, 2017, 57(7): 1049-1059. |
| [14] |
Zhang GQ, Zhao P, Dong YX, et al. Effects of a novel fertilizer synergist on fungi diversity from potato rhizosphere soil[J]. Microbiology China, 2017, 44(11): 2644-2651. (in Chinese) 张国青, 赵盼, 董彦旭, 等. 高通量测序分析环保肥料增效剂对马铃薯根际土壤真菌多样性变化影响[J]. 微生物学通报, 2017, 44(11): 2644-2651. |
| [15] |
Li Y, He XM, Yang XD, et al. The microbial community diversity of the rhizosphere and bulk soils of Lycium ruthenicum in different habitats[J]. Acta Ecologica Sinica, 2018, 38(17): 5983-5995. (in Chinese) 李岩, 何学敏, 杨晓东, 等. 不同生境黑果枸杞根际与非根际土壤微生物群落多样性[J]. 生态学报, 2018, 38(17): 5983-5995. |
| [16] |
Liu PY, Zhang HK, Chen L, et al. Rhizosphere microbial community structure and function of Zostera japonica in the distribution area of seagrass beds in the Yellow Sea and Bohai Sea[J]. Acta Microbiologica Sinica, 2019, 59(8): 1484-1499. (in Chinese) 刘鹏远, 张海坤, 陈琳, 等. 黄渤海海草分布区日本鳗草根际微生物群落结构特征及其功能分析[J]. 微生物学报, 2019, 59(8): 1484-1499. |
| [17] |
Wang MY, Hou SZ, Dong T, et al. Effects of banana pseudostem biochar on bacterial abundance and community structure in rhizosphere soil[J]. Acta Microbiologica Sinica, 2019, 59(7): 1363-1372. (in Chinese) 王明元, 侯式贞, 董涛, 等. 香蕉假茎生物炭对根际土壤细菌丰度和群落结构的影响[J]. 微生物学报, 2019, 59(7): 1363-1372. |
| [18] |
Liu QC. Analyzing composition of bacterial community and screening of biocontrol bacteria strains in maize rhizosphere[D]. Beijing: Master's Thesis of Chinese Academy of Agricultural Sciences, 2018 (in Chinese) 刘泉成.玉米根际微生物群落特征分析及生防菌筛选[D].北京: 中国农业科学院硕士学位论文, 2018 |
| [19] |
Du YX, Xie BM, Cai HS, et al. Structural and functional diversity of rhizosphere microbial community of nine plant species in the Daqing saline-alkali soil region[J]. Acta Ecologica Sinica, 2016, 36(3): 740-747. (in Chinese) 杜滢鑫, 谢宝明, 蔡洪生, 等. 大庆盐碱地九种植物根际土壤微生物群落结构及功能多样性[J]. 生态学报, 2016, 36(3): 740-747. |
| [20] |
Palaniyandi SA, Damodharan K, Yang SH, et al. Streptomyces sp. strain PGPA39 alleviates salt stress and promotes growth of 'Micro Tom' tomato plants[J]. Journal of Applied Microbiology, 2014, 117(3): 766-773. DOI:10.1111/jam.12563 |
| [21] |
Jošić D, Ćirić A, Soković M, et al. Antifungal activities of indigenous plant growth promoting Pseudomonas spp. from alfalfa and clover rhizosphere[J]. Frontiers in Life Science, 2015, 8(2): 131-138. DOI:10.1080/21553769.2014.998776 |
| [22] |
Dedysh SN, Ricke P, Liesack W. NifH and NifD phylogenies: an evolutionary basis for understanding nitrogen fixation capabilities of methanotrophic bacteria[J]. Microbiology, 2004, 150(5): 1301-1313. DOI:10.1099/mic.0.26585-0 |
| [23] |
Wang M, Li SS, Chen SB, et al. Manipulation of the rhizosphere bacterial community by biofertilizers is associated with mitigation of cadmium phytotoxicity[J]. Science of the Total Environment, 2019, 649: 413-421. DOI:10.1016/j.scitotenv.2018.08.174 |
| [24] |
Xiong W, Zhao QY, Zhao J, et al. Different continuous cropping spans significantly affect microbial community membership and structure in a vanilla-grown soil as revealed by deep pyrosequencing[J]. Microbial Ecology, 2015, 70(1): 209-218. DOI:10.1007/s00248-014-0516-0 |
| [25] |
Chen DM, Ke WH, Chen LL, et al. Diversity of bacterial community in rhizosphere soils under effects of continuously planting burley tobacco[J]. Chinese Journal of Applied Ecology, 2010, 21(7): 1751-1758. (in Chinese) 陈冬梅, 柯文辉, 陈兰兰, 等. 连作对白肋烟根际土壤细菌群落多样性的影响[J]. 应用生态学报, 2010, 21(7): 1751-1758. |
| [26] |
Liang XJ, Guo DH, Liu YZ, et al. Identification of a Delftia sp. NF83-1 and its antagonistic performance[A]// Proceedings of 2014 Annual Meeting of Chinese Society of Plant Protection[C]. Xiamen: Chinese Society for Plant Protection, 2014 (in Chinese) 梁雪杰, 郭殿豪, 刘邮洲, 等.一株戴尔福特菌Delftia sp. NF83-1的鉴定及其拮抗性能评价[A]//2014年中国植物保护学会学术年会论文集[C].厦门: 中国植物保护学会, 2014 |
| [27] |
Chen WL, Li J, Zhu HH, et al. A review of the regulation of plant root system architecture by rhizosphere microorganisms[J]. Acta Ecologica Sinica, 2016, 36(17): 5285-5297. (in Chinese) 陈伟立, 李娟, 朱红惠, 等. 根际微生物调控植物根系构型研究进展[J]. 生态学报, 2016, 36(17): 5285-5297. |
| [28] |
Zhou WJ, Lü DG, Qin SJ. Research progress in interaction between plant and rhizosphere microorganism[J]. Journal of Jilin Agricultural University, 2016, 38(3): 253-260. (in Chinese) 周文杰, 吕德国, 秦嗣军. 植物与根际微生物相互作用关系研究进展[J]. 吉林农业大学学报, 2016, 38(3): 253-260. |
| [29] |
Nosheen A, Bano A, Ullah F, et al. Effect of plant growth promoting rhizobacteria on root morphology of Safflower (Carthamus tinctorius L.)[J]. African Journal of Biotechnology, 2011, 10(59): 12639-12649. |
| [30] |
Ofek M, Hadar Y, Minz D. Ecology of root colonizing Massilia (Oxalobacteraceae)[J]. PLoS One, 2012, 7(7): e40117. DOI:10.1371/journal.pone.0040117 |
| [31] |
Dai WK, Fang CX. Trans-omics study of two desert bacteria Pontibacter korlensis and Pontibacter akesuensis[A]// Proceedings of the 16th National Symposium on Environmental Microbiology[C]. Lanzhou: Chinese society of Microbiology, 2013: 38-39 (in Chinese) 戴文魁, 方呈祥.两株沙漠细菌Pontibacter korlensis和Pontibacter akesuensis的trans-omics研究[A]//第十六次全国环境微生物学学术研讨会论文集[C].兰州: 中国微生物学会, 2013: 38-39 |
| [32] |
Wu WX. Studies on the autotoxic substances of tobacco and the effects of autotoxic substances on the rhizospheric microbiology[D]. Fuzhou: Master's Thesis of Fujian Agriculture and Forestry University, 2010 (in Chinese) 吴文祥.烟草自毒物质及其对根际土壤微生物影响的研究[D].福州: 福建农林大学硕士学位论文, 2010 |
| [33] |
Jiang Y, Zhou JG, Zou YP, et al. Isolation and primary identification of a new nitrogng-fixation Arthrobacter strain[J]. Journal of Central China Normal University (Natural Sciences), 2004, 38(2): 210-214. (in Chinese) 江月, 周建刚, 邹煜平, 等. 一种有固氮能力的节杆菌菌株的分离和初步鉴定[J]. 华中师范大学学报:自然科学版, 2004, 38(2): 210-214. |
| [34] |
Tang J, Xu XR, Shang CY, et al. Association of bacterial diversity in city area of Nanming river with environmental factors[J]. Acta Microbiologica Sinica, 2015, 55(8): 1050-1059. (in Chinese) 唐婧, 徐小蓉, 商传禹, 等. 南明河城区河段细菌多样性与环境因子的关系[J]. 微生物学报, 2015, 55(8): 1050-1059. |
| [35] |
Song TJ, Yang JS, Zhou J, et al. Analysis of composition and difference of soil bacteria functional genes of in different Corydalis yanhusuo producing areas based on Miseq sequencing technology[J]. Journal of Zhejiang Chinese Medical University, 2018, 42(3): 178-186. (in Chinese) 宋腾蛟, 杨蒋舜, 周静, 等. 基于MiSeq测序技术分析不同元胡产区土壤细菌功能基因组成与差异[J]. 浙江中医药大学学报, 2018, 42(3): 178-186. |
| [36] |
Song M, Yun HY, Kim YH. Antagonistic Bacillus species as a biological control of ginseng root rot caused by Fusarium cf. incarnatum[J]. Journal of Ginseng Research, 2014, 38(2): 136-145. DOI:10.1016/j.jgr.2013.11.016 |
| [37] |
Ma L. Isolation of antagonistic bacterium strains against pathogen casuing black scurf of potato and the acting mechanism[D]. Lanzhou: Master's Thesis of Gansu Agricultural University, 2016 (in Chinese) 马龙.马铃薯黑痣病生防细菌的筛选鉴定及其生防作用机理研究[D].兰州: 甘肃农业大学硕士学位论文, 2016 |
| [38] |
Wang QL, Zhang DZ, Wang JF, et al. Effects of plant growth-promoting bacterial on the growth of maize and the IAA secrete ability detection[J]. Journal of Yunnan Agricultural University, 2015, 30(4): 494-498. (in Chinese) 汪钱龙, 张德智, 王菊芬, 等. 不同植物促生细菌对玉米生长的影响及其生长素分泌能力研究[J]. 云南农业大学学报, 2015, 30(4): 494-498. |
| [39] |
Rahman MS, Quadir QF, Rahman A, et al. Screening and characterization of phosphorus solubilizing bacteria and their effect on rice seedlings[J]. Research in Agriculture Livestock and Fisheries, 2014, 1(1): 27-35. |
| [40] |
Hu JW, Zhu RG, Wang HB, et al. Free amino acids in pine needles response to environment nitrogen[J]. Biological Chemical Engineering, 2017, 3(3): 5-8. (in Chinese) 胡居吾, 朱仁果, 王慧宾, 等. 松针中游离氨基酸代谢对环境氮的响应[J]. 生物化工, 2017, 3(3): 5-8. |
| [41] |
Gao ML. Study on the effects of phosphorus on tomato yield and quality[D]. Harbin: Master's Thesis of Northeast Agricultural University, 2003 (in Chinese) 高美玲.磷对番茄产量和品质影响的研究[D].哈尔滨: 东北农业大学硕士学位论文, 2003 |
 2020, Vol. 47
2020, Vol. 47