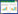扩展功能
文章信息
- 吴楠, 尹本丰, 张静, 陶冶, 张元明
- WU Nan, YIN Ben-Feng, ZHANG Jing, TAO Ye, ZHANG Yuan-Ming
- 不同积雪覆盖期荒漠齿肋赤藓结皮层丛枝菌根真菌多样性变化
- Variation of arbuscular mycorrhizal fungi (AMF) biological diversity in the mosses crust layer of desert during snow cover season
- 微生物学通报, 2020, 47(11): 3843-3855
- Microbiology China, 2020, 47(11): 3843-3855
- DOI: 10.13344/j.microbiol.china.200284
-
文章历史
- 收稿日期: 2020-03-24
- 接受日期: 2020-08-24
- 网络首发日期: 2020-09-15
2. 中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点实验室 新疆 乌鲁木齐 830011
2. State Key Laboratory of Desert and Oasis Ecology, Xinjiang Institute of Ecology and Geography, Chinese Academy of Sciences, Urumqi, Xinjiang 830011, China
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)多样性及其生态功能越来越受到国际菌根学和生态学界的关注,越来越多的创新成果打破了传统观念,比如:AMF-植物共生营养交换新理论模型的创建,发现脂肪酸才是宿主植物光合作用碳源的主要传递形式,被植物的转运蛋白转运给菌根真菌[1];而共生体之间的资源交换并不对称,食草昆虫蚜虫的侵染减少了植物碳对AMF的分配,尽管真菌P向植物的转移保持不变[2];AMF介导的凋落物降解机制方面,发现AMF不仅可以与根系形成共生关系,而且可以定殖于落叶中,通过与其他微生物相互作用分解植物落叶、转运分解后的矿质营养至宿主植物体内[3]。特别是一些高盐、缺水、养分匮乏的特殊生境中,AMF、解磷细菌等根际微生物之间的跨界互作成为研究热点[4-5],陆续发现AMF菌丝分泌物中的果糖可作为信号激发解磷细菌活化植酸[6];AMF孢子关联细菌可辅助AMF共同提升植物耐盐性[7]等。
荒漠生态系统中对豆科植物、短命植物等特色荒漠维管植物与AMF共生关系的研究已广泛开展[8-10],但对以荒漠苔藓为代表的非维管植物与AMF的共生关系仍知之甚少,这与苔藓植物在荒漠地气界面承担的重要生态功能并不相称。藓类植物由于缺乏草本植物所拥有的有效传输系统维管束,以往认为其养分来源主要来自于大气沉降和淋融,其根系为仅具有支撑和固定作用的假根。但越来越多的研究证明,土壤基质仍然是藓类植物矿质营养的重要来源[11]。存在于荒漠结皮层的AMF被认为在养分匮乏和水分亏缺的荒漠生态系统中扮演着重要角色[12]。研究表明,荒漠地表的苔藓结皮中蕴藏着极为丰富、尚未充分开发的AMF资源。鄂尔多斯沙地真藓(Bryum argenteum Hedw.)、盐土藓[Pterygoneurum subsessible (Brid.) Jur.]等常见荒漠苔藓中分离的AMF多达27种,其中球囊霉属(Glomus)占19种,而且藓类植物茎和叶中能够观察到AMF的菌丝和泡囊,假根中可观察到菌丝[13]。基于Illumina MiSeq测序技术发现沙坡头地区地衣和藓类结皮中共有AMF属于4个目5个科6个属,其中,球囊霉属为优势种[14]。荒漠藓类结皮对草本植物种子库、种子萌发、植物生长等具有重要影响[15]。菌根真菌在生物土壤结皮与草本植物之间的养分转移通路主要发生在以蓝藻或者地衣为主的生物土壤结皮中[16],藓类植物生物量相对较大并具有养分吸收利用及拦截作用,藓类植物与草本植物之间的菌根真菌通路是否畅通以及养分流动方向如何还需要深入研究。
古尔班通古特沙漠位于欧亚大陆腹地的准噶尔盆地,与国内其他荒漠生态系统相比,该沙漠拥有丰富的冬季降雪,可在荒漠地表形成天然的覆膜,厚度达20−30 cm,维持100−150 d之久[17-18]。在全球气候变暖的背景下,有数据显示,新疆冬季降雪呈现显著的增加趋势[19-20]。季节性积雪深度、积雪的多寡以及积雪覆盖时长等都将发生较大的变化,不同积雪变化下的雪下光、温、水等环境因子的差异无疑将会对荒漠植物的多样性、群落结构与功能、荒漠植物-微生物共生关系产生复杂而深远的影响。然而,目前对于温带荒漠有积雪背景条件下的荒漠植物-微生物共生关系的研究非常有限,或侧重短命植物对冬季降水变化的响应[21-22],或侧重AMF对短命植物个体生长的影响[8]。已有研究显示,积雪覆盖及其融化会对荒漠浅土层的土壤物理环境(太阳辐射、土壤通透性、土壤含水量、养分动态)、土壤生物环境(土壤微生物活性、土壤酶活性、植物根系活力、种子库活力)产生综合影响[23]。积雪融水可为该沙漠草本植物春季的生长提供稳定、连续的土壤水分,保证了草本植物的生长发育[22]。对荒漠地气界面重要组分苔藓植物及其与之共生的微生物如何响应冬季积雪的变化知之甚少。由于夏季降雨后的持续高温会影响孢子体成熟,冬季适度的低温和有效的降水会有助于苔藓的光合作用和有性繁殖[24-25]。因此,冬季降雪期可能是成为古尔班通古特沙漠长期以来被忽视的苔藓重要繁育期。与草本层相比,荒漠苔藓分布集中于地表0−5 cm,与积雪的接触更为充分,受积雪覆盖润湿效应的影响更为明显。已有研究表明:不同降雪量处理的藓类结皮的净光合速率和呼吸速率均差异明显,增加降雪 > 正常降雪 > 无降雪[26]。真藓叶绿素a、叶绿素b等光合色素的含量也随降雪量的增加呈上升趋势[27]。齿肋赤藓也被证明能够通过生理调节来适应冬季降雪,可溶性蛋白含量表现为增加降雪 > 正常降雪 > 减少降雪处理,尤其是在融雪期间更为明显;而抗氧化酶活性和丙二醛含量则相反,随积雪减少反而增加[28]。然而,针对温带荒漠有积雪背景条件下苔藓结皮层中重要微生物类群AMF多样性的研究非常有限。
近年来,通过分子生物学方法鉴定AMF多样性的研究越来越多,在Davison于2015年发表于Science上的一篇有关全球AMF分子多样性的数据库基础上建立了中国AMF分子多样性的新数据库,反映了我国草地生态系统、森林生态系统均具有丰富的AMF分子水平上的多样性,但荒漠生态系统AMF分子多样性研究很少,并未在该数据库有所反映[29]。本文利用高通量测序技术揭示不同积雪覆盖期(降雪前、雪盖期、融雪期)齿肋赤藓结皮层中的AMF群落多样性变化,以期更全面地认识荒漠地气界面植物与微生物冬季积雪期双赢的重要生存策略,为中国AMF分子多样性数据库提供重要数据支撑。
1 材料与方法 1.1 研究区概况我国最大的固定和半固定沙漠古尔班通古特沙漠(44o11′−46o20′N,84o31′−90o00′E)位于天山北部准噶尔盆地中部,面积约4.88×104 km2,年平均蒸发量 > 2 000 mm,而年平均降水量 < 150 mm,沙漠腹地仅有70−100 mm,且主要集中于冬春季;年平均气温6−10 ℃,极端高温在40 ℃以上,≥10 ℃的年积温可达3 000−3 500 ℃,空气相对湿度平均50%−60%,5−8月通常 < 45%。影响沙丘地貌建造的营力主要为西风环流体系和蒙古高压风系,形成西北-东南向、高10−50 m长达10 km以上分布密集的大沙垄。主要为树枝状沙垄、蜂窝状沙丘及新月形沙丘和沙丘链等[30]。白梭梭(Haloxylon persicum)、梭梭(H. ammodendron)等小半乔木群落及尖喙牻牛儿苗(Erodium oxyrrhynchum)短命和类短命植物广泛分布[31],而且地表还发育有良好的生物结皮(包括藻结皮、地衣结皮和苔藓结皮等)[32]。
1.2 样方布设与样品采集在古尔班通古特沙漠腹地野外勘查的基础上,中国科学院新疆生态与地理研究所建立了准噶尔荒漠生态系统长期监测样地(45.24°N,87.60°E),用铁丝网设置围栏,以防止放牧和人为干扰。在5个相距50 m的自然降雪监测固定样地中于降雪前(2018年12月29日)、雪盖期(2019年1月28日)、融雪期(2019年3月18日)[28]分别随机选取2×2 m小样方,每个小样方内按照五点混合法用无菌离心管采集齿肋赤藓结皮样品,迅速放入4 ℃保温箱中带回中国科学院干旱区生物地理与生物资源重点实验室储存于−80 ℃冰箱备用。
1.3 主要试剂和仪器E.Z.N.A.® Soil DNA Kit,Omega公司;EasyTaq kit,北京全式金生物技术有限公司;TruSeq Nano DNA LT Library Prep Kit、MiSeq Reagent Kit V3 (600 cycles),Illumina公司;Agilent High Sensitivity DNA Kit,Agilent公司;Quant-iT PicoGreen dsDNA Assay Kit,Invitrogen公司。QuantiFluor荧光定量系统,Promega公司;MiSeq测序仪,Illumina公司。
1.4 DNA提取和PCR扩增样品从−80 ℃冰箱取出后过2 mm土筛,解冻后用灭菌去离子水轻柔搓洗收集菌丝并提取DNA。土壤总DNA用E.Z.N.A.® Soil DNA Kit提取。核酸蛋白定量仪检测DNA浓度,琼脂糖凝胶检测DNA完整性。DNA样品送往上海派森诺生物科技有限公司,利用Illumina Miseq测序平台完成测序,选择AMF特异引物,分别为AML1 (5′-ATCAACTTTCGATGGTAGGATAGA-3′)/ AML2 (5′-GAACCCAAACACTTTGGTTTC-3′)和NS31 (5′-TTGGAGGGCAAGTCTGGTGCC-3′)/ AM1 (5′-GTTTCCCGTAAGGCGCCGAA-3′)[33-34]。第1次PCR反应体系(25 μL):按照EasyTaq kit说明书,正、反向引物(10 μmol/L)各0.4 μL,模板1 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 1 min,72 ℃ 1 min,33个循环;72 ℃ 10 min。第2次PCR:分别以3个重复的第1次PCR产物按1:1 000用ddH2O稀释后作为模板,PCR反应体系与第1次相同,PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 45 s,72 ℃ 1 min,31个循环;72 ℃ 10 min[34]。采用TruSeq Nano DNA LT Library Prep Kit制备测序文库。上机测序前,需要先对文库在Agilent Bioanalyzer上进行质检,用High Sensitivity DNA Kit。采用Quant-iT PicoGreen dsDNA Assay Kit在QuantiFluor荧光定量系统上对文库进行定量,合格的文库浓度应在2 nmol/L以上。使用MiSeq测序仪进行2×300 bp的双端测序,相应试剂为MiSeq Reagent Kit V3 (600 cycles)。
1.5 生物信息学及统计学分析利用FLASH、QIIME对原始序列进行数据去杂和质控过滤,得到优化数据[35-36]。基于USEARCH软件对得到的高质量序列,按照97%的相似度进行操作分类单元(operational taxonomic units,OTU)的聚类[37],使用QIIME软件,调用UCLUST对97%相似水平的OTU代表序列进行分类学分析,比对数据库为Silva的真菌18S rRNA基因数据库[38]。将丰度值低于全体样本测序总量0.001%的OTU去除后用于后续分析[39]。基于OTU聚类和注释的结果,利用R语言工具绘制柱状图、Venn图及聚类分析热图,并对属水平的群落组成结构进行主成分分析(principal component analysis,PCA),以二维图像描述降雪前后样本间的自然分布特征。使用QIIME软件分别对每个样本计算Chao1丰富度估计指数、ACE丰富度估计指数、Shannon多样性指数及Simpson多样性指数,对Unweighted和Weighted的UniFrac距离矩阵分别进行UPGMA聚类分析,并使用R软件进行可视化。使用软件MEGAN将样本所含有OTU的丰度信息和分类学组成数据映射至NCBI Taxonomy所提供的微生物分类等级树[40]。使用Mothur软件计算丰度位于前50位的优势属之间的Spearman等级相关系数并构建关联网络,导入Cytoscape软件进行可视化[41]。其他数据分析用SPSS (v13.0)、Origin 8.0完成。所有高通量测序数据均已上传至https://submit.ncbi.nlm.nih.gov/,SRA登录号为PRJNA611906。
2 结果与分析 2.1 AMF群落OTU分析选用相似水平为97%的OTU样品表画出维恩图,结果表明(图 1):OTU总数和特有OTU数目均表现为降雪前 > 雪盖期 > 融雪期。雪盖前特有OTU比例(20.56%)达到融化期(10.20%)的2.02倍。不同雪被期共同包含的OTU数目为576个,占总OTU数目的19.52%。
|
| 图 1 AMF群落OTU维恩图 Figure 1 OTU venn figure of AMF communities within moss crusts |
|
|
齿肋赤藓结皮中AMF群落多样性指数如表 1所示,群落丰富度Chao1指数和ACE指数均表现为降雪前 > 雪盖期 > 融雪期,表明降雪减少了AMF群落丰富度。Shannon指数综合考虑了群落的丰富度和均匀度,而且对群落的丰富度以及稀有OTU更敏感,该指数表现为降雪前 > 融雪期 > 雪盖期,表明降雪减少了AMF群落尤其是稀有OTU丰富度。Simpson指数对均匀度和群落中的优势OTU更敏感,该指数没有显著变化,暗示AMF群落中的优势OTU多样性相对稳定。
| 项目 Item |
降雪前 Early winter |
雪盖期 Mid-winter |
融雪期 Snow melt |
| Simpson指数 Simpson index |
0.94 | 0.87 | 0.94 |
| Chao1指数 Chao1 index |
1 170.12 | 1 041 | 917.42 |
| ACE指数 ACE index |
946.21 | 841.62 | 712.74 |
| Shannon指数 Shannon index |
6.13 | 5.23 | 5.68 |
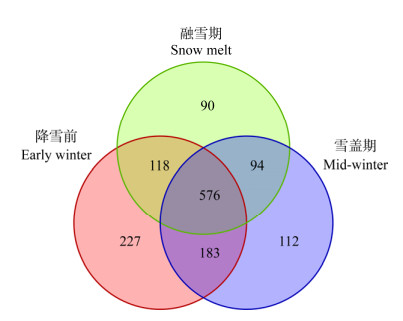
AMF群落组成分析结果表明,降雪前、雪盖期及融雪期检测到的OTU分属于球囊菌门(Glomeromycota)的5目9科11属。从门的水平看(图 2A),优势类群均为球囊菌门,表现为降雪前 < 雪盖期 < 融雪期,暗示融雪期水分补给助力齿肋赤藓结皮中AMF丰度提升了13.2%。目、科、属水平均发现降雪前、雪盖期、融雪期齿肋赤藓结皮层中AMF类群的类型没有显著差异,但是不同AMF类群降雪前后变化不一(图 2B−D)。从目的水平看(图 2B),球囊霉目在不同时期均超过50%,为绝对优势类群(Glomerales)且融雪期比例明显增加,由降雪前的55.2%提升到77.2%;类球囊霉目(Paraglomerales)则由降雪前的26.2%显著下降为13.0%;多样孢囊霉目(Diversisporales)和原囊霉目(Archaeosporales)则在降雪前后基本保持不变。从科水平看(图 2C),隶属于球囊霉目的近明球囊霉科(Claroideoglomeraceae),在不同时期均接近或超过50%,为绝对优势类群且融雪期比例明显增加,由降雪前的49.4%提升到75.3%;隶属于类球囊霉目的类球囊霉科(Paraglomeraceae)和隶属于球囊霉目的球囊霉科(Glomeraceae)则同时在融雪期较降雪前大幅降低,前者由11.0%降为1.6%,后者则由5.8%降为1.9%。属水平上的变化趋势与科水平近似(图 2D),绝对优势属(> 50%)近明球囊霉属(Claroideoglomus)融雪期比例大幅增加而类球囊霉属(Paraglomus)、球囊霉属则较降雪前比例下降。
|
| 图 2 门(A)、目(B)、科(C)和属(D)不同分类水平上AMF群落组成 Figure 2 AMF community composition at the phylum (A), order (B), family (C) and genus (D) level |
|
|
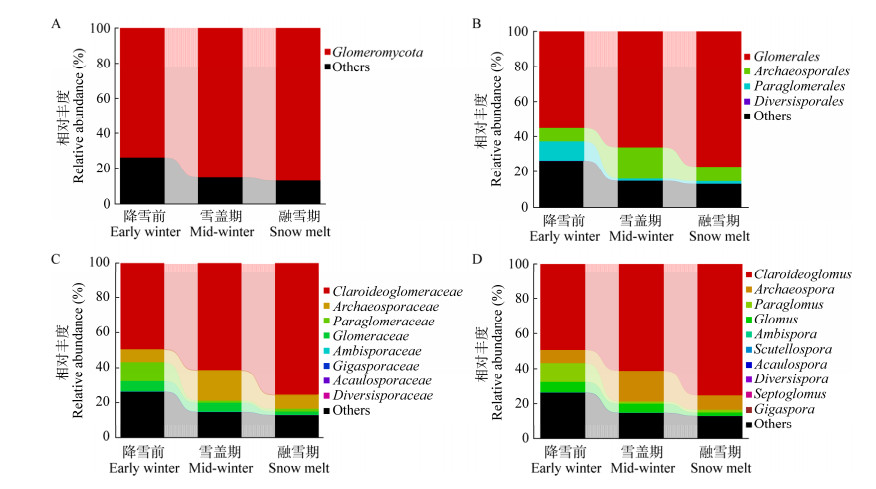
基于MEGAN的分类学组成信息可视化分析表明(图 3):将降雪前、雪盖期、融雪期所含有的OTU的丰度信息和分类学组成数据映射至NCBI Taxonomy所提供的微生物分类等级树,可在一套标准的分类等级系统中统一呈现所有样本在各分类水平的具体组成。每个分支节点的饼图表明该分类单元在各样本中的丰度高低,扇形面积越大,表明该分类单元在对应样本中的丰度越高。结果同样表明在不同分类单元,降雪前、雪盖期、融雪期齿肋赤藓结皮层中AMF类群的类型并未明显改变,但是不同AMF所占的比例在降雪前后有所调整。而且低丰度属的变化也能在图 3中清晰反映,如无梗囊霉属(Acaulospora)主要集中在降雪前采集的样品中,而多样孢囊霉属(Diversispora)主要集中在融雪期样品中。
|
| 图 3 物种进化及丰度信息图 Figure 3 Species evolution and abundance information map |
|
|
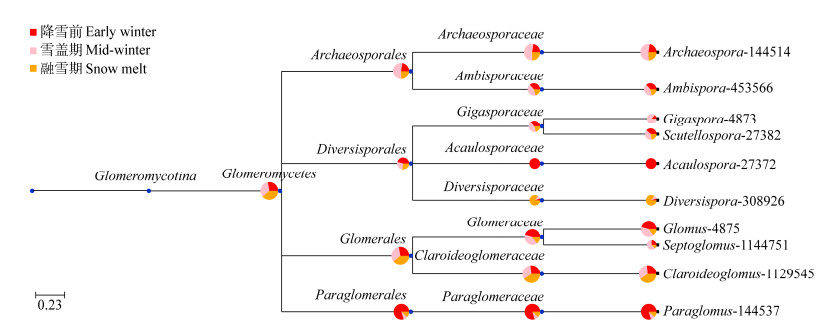
为进一步从复杂的群落数据中快速发现优势AMF类群,使用GraPhlAn这一最近涌现的可视化工具对样本总体在各分类水平的组成构建等级树,以不同颜色区分各分类单元,并通过节点大小反映它们的丰度分布。结果表明(图 4):目水平上节点大小表现为球囊霉目(Glomerales) > 原囊霉目 > 类球囊霉目(Paraglomerales) > 多样孢囊霉目,说明所有采集的样品中球囊霉目(Glomerales)为优势AMF类群;依据属水平节点大小可直观看出近明球囊霉属、原囊霉属(Archaeospora)、类球囊霉属和球囊霉属为优势类群。
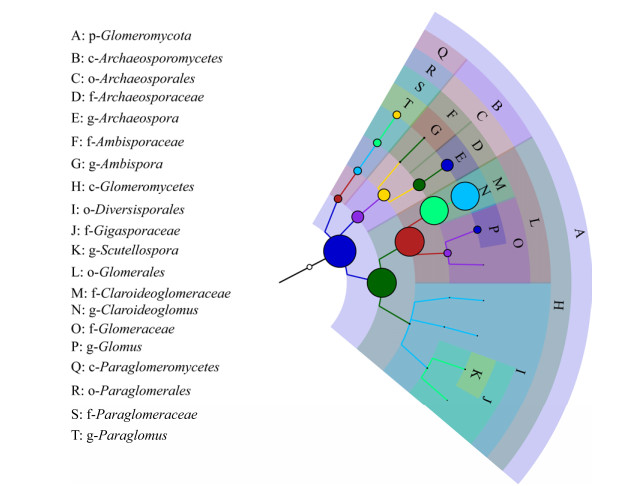
|
| 图 4 基于GraPhlAn的AMF群落总体分类等级树图 Figure 4 GraPhlAn-based tree of classification and rank of AMF community |
|
|
将各分类水平的群落组成数据根据分类单元的丰度分布或样本间的相似程度加以聚类,根据聚类结果对分类单元和样本分别排序,并以结合聚类分析的热图加以呈现(图 5),发现降雪前和融雪期AMF群落在种类上并无差异,但高丰度分类单元的类别由降雪前的5种集中为2种,可见降雪对苔藓结皮中的AMF类群有一定的选择性。从颜色梯度变化来看,融雪期呈增加趋势的为多样孢囊霉属和近明球囊霉属,无梗囊霉属和类球囊霉属等均下降。
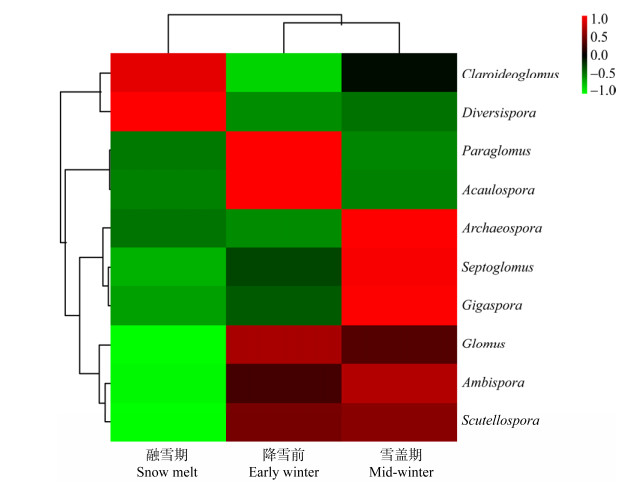
|
| 图 5 结合聚类分析的属水平群落组成热图 Figure 5 Heat map of AMF genus changes |
|
|
主成分分析结果表明PC1和PC2的累计贡献率可达100%。降雪前和融雪期的样品分别位于主成分1的正负端,表明主成分1能够区分两个时期的AMF群落属水平的结构特征说明降雪前后藓类结皮层AMF群落组成确实有显著的差异。
2.5 AMF群落β多样性优势属关联网络分析通过网络关联分析的方法进一步考察不同AMF群落成员之间的相互作用,寻找群落成员在不同生境下共同出现(co-occurrence)或彼此排斥(co-exclusion)的相互作用模式,从而推断不同AMF类群之间可能的相互“协作”或“竞争”关系。根据OTU或各分类单元在不同样本中的丰度分布,图 6反映出通过巨孢囊霉属(Gigaspora)、隔球囊霉属(Septoglomus)、双型囊霉属(Ambispora)、盾巨孢囊霉属(Scutellospora)节点的连接均最多且互为正相关,暗示低丰度属之间可能存在协作关系;而高丰度属近明球囊霉属和球囊霉属之间、类球囊霉属和原囊霉属之间均呈现负相关,暗示高丰度属之间可能存在竞争关系。
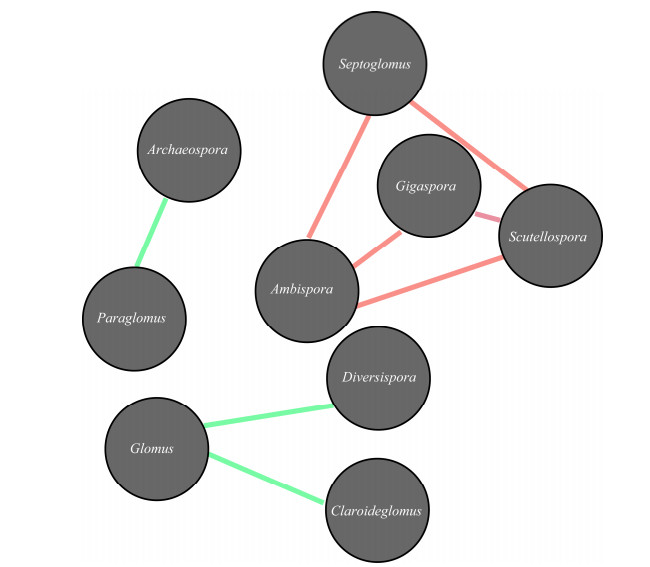
|
| 图 6 不同AMF属的关联网络图 Figure 6 Associated network diagram of different AMF genus 注:红线表明正相关,绿线表明负相关. Note: Red lines represent positive correlation. Green lines represent negative correlation. |
|
|
本研究中从属水平可以明显看出,古尔班通古特沙漠苔藓结皮层高丰度AMF类群与腾格里沙漠沙坡头地区藓类结皮有所不同,后者主要为球囊霉属,而前者高丰度属包括近明球囊霉属、类球囊霉属、球囊霉属和原囊霉属[14]。参考区域尺度上针对中国西北5个主要沙漠结皮中细菌多样性和群落结构差异进行的对比研究结果,结皮层中细菌多样性差异的主要影响因子不是区域降水量,而是土壤有机碳、总磷、结皮发育程度(厚度、盖度)和微地形等[42]。不同沙漠苔藓结皮层中AMF多样性的差异可能也与上述因子密切相关。本文主要针对降雪前和融雪期齿肋赤藓结皮层中AMF的多样性差异,从AMF自身对融雪期水热变化的适应性、宿主植物齿肋赤藓对不同类群AMF的选择性偏好、AMF与解磷细菌等根际微生物的潜在互作等方面予以探讨。
AMF多样性季节动态的研究表明冬季AMF多样性显著低于夏季[43],相对而言,优势AMF类群可能依靠其发达的菌丝系统并利用更广范围的资源以调节胞内环境,从而适应降雪前和融雪期土壤水热状态的转变。高纬度苔原地带,耐寒性真菌在10 ℃低温下仍能发挥矿化作用,促进土壤碳循环[44]。古尔班通古特沙漠中,降雪前初冬季节的土壤暴露于空气下,土壤温度呈现为一个剧烈的波动状态,一天中温差能够达到20 ℃。积雪就像是一个温度“调节器”,使表层土壤温度处于一个相对平衡的状态,并且这种调节作用随着积雪厚度的增加而增加[45-46]。森林生态系统中,积雪对真菌多样性的影响与积雪厚度和雪盖的不同形成时期有着密切的关系,随着雪被厚度的增加,菌根真菌多样性也将呈增大的趋势[47],可能主要与不同积雪厚度下土壤温度差异有关[48]。古尔班通古特沙漠3月份后气温与地温快速上升,积雪消融集中进入土壤。有研究表明,由于水的比热容大于土壤,土壤含水量的增加影响了土壤温度的提升,二者之间的耦合效应会严重削弱[49]。也有研究表明,高频率的水分补充能更好地提升表层土壤水分,可提高土著AMF侵染率,孢子密度和孢子直径都会增加[8]。融雪期气温与地温同步快速上升,反复的冻融循环一方面可能会造成低耐受性AMF类群的死亡,导致融雪期AMF多样性降低;另一方面可能通过其机械作用促使菌丝体分化,具竞争力的优势属近明球囊霉属比例呈现大幅增加(图 2)。除上述水热效应的影响外,由于AMF是好气性的,土壤含水量将直接影响土壤氧分压,进而影响AMF的生长发育[50]。因此,融雪期不同类群AMF对苔藓结皮层中氧分压的差别响应可能也会影响AMF多样性。
融雪期处于旺盛生长期的宿主植物齿肋齿藓,对AMF的偏好性可能导致不同类群AMF丰度变化趋势不一。古尔班通古特沙漠初春融雪后表层土壤体积含水量能够达到18%,接近土壤饱和含水量。作为变水植物,苔藓植物体内的含水量在融雪期快速增加,其光合作用等生理代谢活动迅速启动[28]。荒漠草本植物和乔灌木在生长时间上存在生态位分离现象,以满足不同生活型植物在生长期的水分和养分供应[51],而荒漠短命植物与藓类植物并不存在明显的生长期生态位分离现象,二者镶嵌分布,而且融雪期均处于快速生长发育期,因而存在不可避免的养分竞争。融雪期雪水中的氮输入可能会加剧土壤磷养分的相对不足[43],因此,该时期的齿肋赤藓会合成大量的碳与AMF交换生长所需的磷养分等。由于宿主植物可以区分互利共生的AMF伴侣[52],将植物碳从不向其寄主提供营养的共生体中截留,转而优先将碳分配给更“合作”的AMF[53]。融雪期齿肋赤藓可能会偏好性地与向其提供更紧缺的磷养分的近明球囊霉属AMF形成共生关系,这就导致有益AMF比例增加,进而导致AMF多样性的改变。
融雪期根际其他微生物多样性的变化也将间接影响AMF多样性变化。由于磷资源的匮乏及其在土壤中的难移动性,AMF-荒漠植物共生系统中,磷养分对于宿主植物的生长来说也是不容忽视的限制性资源[8]。庞大的AMF菌丝网络中存在大量的解磷细菌,它们可以通过分泌质子、有机酸、磷酸酶等方式增加土壤中难溶性无机磷和有机磷的溶解与矿化,将土壤中难溶性有机磷酸盐转化为能够直接被植物吸收利用的正磷酸根。AMF的种类、菌丝活性、菌丝数量等均会影响细菌在真菌菌丝表面的定殖,进而产生不同的联合生态效应[54]。不同种类的AMF要和不同种类的解磷细菌产生互作关系,才能获取到更多的磷资源[55];而且只有当土壤有效磷浓度合适时,细菌才能与AMF协同矿化、帮助宿主植物从土壤中吸收更多的磷养分[56]。已有研究表明,土壤无机磷水平与AMF的交互作用显著影响荒漠短命植物生长和养分分配,改变对群落的生物多样性和系统的净初级生产力,低磷有促进作用,高磷则抑制菌根作用[8]。因此,后续工作中还需针对融雪期解磷细菌多样性、土壤磷素含量等进行研究,为揭示AMF向齿肋赤藓的磷素运输机制提供数据支撑。
前期工作发现,PVC旋转阻断AMF菌丝网络后,荒漠短命植物尖喙牻牛儿苗(E. oxyrrhynchum)的叶片性状、株高、根长、地上和地下生物量均有所下降,其中减雪处理组下降显著[57]。生物因素(真菌菌丝网络)和物理因素(积雪)可能对藓类植物同样会产生类似的复合效应,进而改变融雪期荒漠苔藓及短命植物间养分的吸收与分配,后续工作中还可以深入对比两类荒漠植物在融雪期生态适应机制的相似性及差异性。要想深入认识AMF与荒漠植物在积雪背景下互作的内在机理,还需进行长期定位观测,尤其是AMF菌丝网络叠加积雪因素后对荒漠植物的影响是一个复杂多变的过程,而通常使用灭菌剂(苯菌灵)和PVC管转动等方式的灭菌处理在冬季积雪覆盖条件下实施起来非常困难,因此还需积极探索新方法来阐明荒漠植物-AMF-积雪的互作机理与调控途径。
致谢: 感谢中国科学院干旱区生物地理与生物资源重点实验室“干旱区植物生态适应与环境效应”团队在野外样地布设、样品采集中的帮助;感谢中国农业大学冯固教授团队在实验中的指导和帮助。| [1] |
Jiang YN, Wang WX, Xie QJ, et al. Plants transfer lipids to sustain colonization by mutualistic mycorrhizal and parasitic fungi[J]. Science, 2017, 356(6343): 1172-1175. DOI:10.1126/science.aam9970 |
| [2] |
Charters MD, Sait SM, Field KJ. Aphid herbivory drives asymmetry in carbon for nutrient exchange between plants and an arbuscular mycorrhizal fungus[J]. Current Biology, 2020, 30(10): 1801-1808.e5. DOI:10.1016/j.cub.2020.02.087 |
| [3] |
Bunn RA, Simpson DT, Bullington LS, et al. Revisiting the 'direct mineral cycling' hypothesis: arbuscular mycorrhizal fungi colonize leaf litter, but why?[J]. The ISME Journal, 2019, 13(8): 1891-1898. DOI:10.1038/s41396-019-0403-2 |
| [4] |
Durán P, Thiergart T, Garrido-Oter R, et al. Microbial interkingdom interactions in roots promote Arabidopsis survival[J]. Cell, 2018, 175(4): 973-983. DOI:10.1016/j.cell.2018.10.020 |
| [5] |
Shi N. Mechanism of inter-specific interactions among arbuscular mycorrhizal fungi and phosphate solubilizing bacteria to improve P uptake of maize[D]. Beijing: Doctoral Dissertation of China Agricultural University, 2016 (in Chinese) 石宁.丛枝菌根真菌种间及与解磷细菌间的生物互作促进玉米磷吸收的机制[D].北京: 中国农业大学博士学位论文, 2016 |
| [6] |
Zhang L, Feng G, Declerck S. Signal beyond nutrient, fructose, exuded by an arbuscular mycorrhizal fungus triggers phytate mineralization by a phosphate solubilizing bacterium[J]. The ISME Journal, 2018, 12(10): 2339-2351. DOI:10.1038/s41396-018-0171-4 |
| [7] |
Selvakumar G, Shagol CC, Kim K, et al. Spore associated bacteria regulates maize root K+/Na+ ion homeostasis to promote salinity tolerance during arbuscular mycorrhizal symbiosis[J]. BMC Plant Biology, 2018, 18(1): 109-122. DOI:10.1186/s12870-018-1317-2 |
| [8] |
Zhang CP. Effects of arbuscular mycorrhizal fungi, moisture and soil inorganic phosphorus on adaptation of ephemeral plants to desert environment[D]. Beijing: Doctoral Dissertation of University of Chinese Academy of Sciences, 2013 (in Chinese) 张翠萍. AM真菌、水分和土壤无机磷对短命植物适应荒漠极端环境的影响[D].北京: 中国科学院大学博士学位论文, 2013 |
| [9] |
He XL, Wang YY, Zhao LL, et al. Spatial distribution of arbuscular mycorrhizal fungi and dark septate endophytes in the rhizosphere of Artemisia sphaerocephala from Inner Mongolia desert[J]. Acta Ecologica Sinica, 2011, 31(3): 812-818. (in Chinese) 贺学礼, 王银银, 赵丽莉, 等. 荒漠沙蒿根围AM真菌和DSE的空间分布[J]. 生态学报, 2011, 31(3): 812-818. |
| [10] |
Shi ZY. Biodiversity and ecological effects of AM fungi on short-lived desert plants in early spring[D]. Beijing: Doctoral Dissertation of China Agricultural University, 2006 (in Chinese) 石兆勇.早春荒漠短命植物的共生AM真菌生物多样性及其生态效应研究[D].北京: 中国农业大学博士学位论文, 2006 |
| [11] |
Hawkins BJ, May E, Robbins S. Nitrate and ammonium uptake in 21 common species of moss from Vancouver Island, British Columbia[J]. Botany, 2018, 96(3): 201-208. DOI:10.1139/cjb-2017-0154 |
| [12] |
Hernández-Hernández RM, Roldán A, Caravaca F, et al. Arbuscular mycorrhizal fungal assemblages in biological crusts from a Neotropical savanna are not related to the dominant perennial Trachypogon[J]. Science of the Total Environment, 2017, 575: 1203-1210. DOI:10.1016/j.scitotenv.2016.09.190 |
| [13] |
Bao ML. The diversity and ecological distribution of AM fungi in desert biological soil crust[D]. Hohhot: Master's Thesis of Inner Mongolia University, 2009 (in Chinese) 包美丽.沙地生物结皮层AM真菌多样性及生态分布[D].呼和浩特: 内蒙古大学硕士学位论文, 2009 |
| [14] |
Qi JH, Liu YB, Li XR, et al. AMF diversity analysis of lichen and moss biocrusts in Shapotou region[J]. Acta Pedologica Sinica, 2020, 57(4): 986-994. (in Chinese) 漆婧华, 刘玉冰, 李新荣, 等. 沙坡头地区地衣和藓类结皮丛枝菌根真菌多样性研究[J]. 土壤学报, 2020, 57(4): 986-994. |
| [15] |
Peralta AML, Sánchez AM, Luzuriaga AL, et al. Factors driving species assemblage in Mediterranean soil seed banks: from the large to the fine scale[J]. Annals of Botany, 2016, 117(7): 1221-1228. DOI:10.1093/aob/mcw039 |
| [16] |
Aanderud ZT, Smart TB, Wu N, et al. Fungal loop transfer of nitrogen depends on biocrust constituents and nitrogen form[J]. Biogeosciences, 2018, 15(12): 3831-3840. DOI:10.5194/bg-15-3831-2018 |
| [17] |
Zhou HF, Li Y, Tang Y, et al. The characteristics of the snow-cover and snow melt water storage in Gurbantunggut Desert[J]. Arid Zone Research, 2009, 26(3): 312-317. (in Chinese) 周宏飞, 李彦, 汤英, 等. 古尔班通古特沙漠的积雪及雪融水储存特征[J]. 干旱区研究, 2009, 26(3): 312-317. |
| [18] |
Li Y, Gu JL, Zhang P, et al. Snow cover storage retrieval by remote sensing technology and variation analysis on the Junggar Basin[J]. Arid Land Geography, 2010, 33(4): 623-629. (in Chinese) 李杨, 顾建丽, 张璞, 等. 准噶尔盆地积雪储量的遥感反演及变化特征分析[J]. 干旱区地理, 2010, 33(4): 623-629. |
| [19] |
Wang QX, Zhang CL, Liu J, et al. The changing tendency on the depth and days of snow cover in Northern Xinjiang[J]. Advances in Climate Change Research, 2009, 5(1): 39-43. (in Chinese) 王秋香, 张春良, 刘静, 等. 北疆积雪深度和积雪日数的变化趋势[J]. 气候变化研究进展, 2009, 5(1): 39-43. |
| [20] |
Hu LQ, Li S, Liang FC. Analysis of the variation characteristics of snow covers in Xinjiang region during recent 50 years[J]. Journal of Glaciology and Geocryology, 2013, 35(4): 793-800. (in Chinese) 胡列群, 李帅, 梁凤超. 新疆区域近50a积雪变化特征分析[J]. 冰川冻土, 2013, 35(4): 793-800. |
| [21] |
Fan LL, Li Y, Tang LS, et al. Combined effects of snow depth and nitrogen addition on ephemeral growth at the southern edge of the Gurbantunggut Desert, China[J]. Journal of Arid Land, 2013, 5(4): 500-510. DOI:10.1007/s40333-013-0185-8 |
| [22] |
Fan LL, Tang LS, Wu LF, et al. The limited role of snow water in the growth and development of ephemeral plants in a cold desert[J]. Journal of Vegetation Science, 2014, 25(3): 681-690. DOI:10.1111/jvs.12121 |
| [23] |
Jefferies RL, Walker NA, Edwards KA, et al. Is the decline of soil microbial biomass in late winter coupled to changes in the physical state of cold soils?[J]. Soil Biology and Biochemistry, 2010, 42(2): 129-135. |
| [24] |
Stark LR. Widespread sporophyte abortion following summer rains in Mojave Desert populations of Grimmia orbicularis[J]. The Bryologist, 2001, 104(1): 115-125. DOI:10.1639/0007-2745(2001)104[0115:WSAFSR]2.0.CO;2 |
| [25] |
Benassi M, Stark LR, Brinda JC, et al. Plant size, sex expression and sexual reproduction along an elevation gradient in a desert moss[J]. The Bryologist, 2011, 114(2): 277-288. DOI:10.1639/0007-2745-114.2.277 |
| [26] |
Li G, Liu LC, Gao YH, et al. Effects of snow on photosynthesis and respiration of two kinds of biological soil crusts in Shapotou, Ningxia, China[J]. Journal of Desert Research, 2014, 34(4): 998-1006. (in Chinese) 李刚, 刘立超, 高艳红, 等. 降雪对生物土壤结皮光合及呼吸作用的影响[J]. 中国沙漠, 2014, 34(4): 998-1006. |
| [27] |
Xie M, Hui R, Liu LC, et al. Effects of snowfall on physiological and biochemical characteristics of Bryum argenteum distributed in desert moss crusts[J]. Acta Ecologica Sinica, 2017, 37(3): 915-921. (in Chinese) 谢敏, 回嵘, 刘立超, 等. 降雪对荒漠地区藓类结皮中真藓生理生化的影响[J]. 生态学报, 2017, 37(3): 915-921. |
| [28] |
Zhang J, Zhang YM. Ecophysiological responses of the biocrust moss Syntrichia caninervis to experimental snow cover manipulations in a temperate desert of central Asia[J]. Ecological Research, 2020, 35(1): 198-207. DOI:10.1111/1440-1703.12072 |
| [29] |
Wang YM, Fan JQ, Shi ZY. Molecular diversity of arbuscular mycorrhizal fungal in China[J]. Microbiology China, 2018, 45(11): 2399-2408. (in Chinese) 王永明, 范洁群, 石兆勇. 中国丛枝菌根真菌分子多样性[J]. 微生物学通报, 2018, 45(11): 2399-2408. |
| [30] |
Guo HX, Wang XQ, Gai SG, et al. Windblown sand movement on the top of semi-fixed longitudinal dune in the hinterland of Gurbantunggut Desert[J]. Arid Land Geography, 2010, 33(6): 954-961. (in Chinese) 郭洪旭, 王雪芹, 盖世广, 等. 古尔班通古特沙漠腹地半固定沙垄顶部风沙运动规律[J]. 干旱区地理, 2010, 33(6): 954-961. |
| [31] |
Zhang LY, Chen CD. On the general characteristics of plant diversity of Gurbantunggut sandy desert[J]. Acta Ecologica Sinica, 2002, 22(11): 1923-1932. (in Chinese) 张立运, 陈昌笃. 论古尔班通古特沙漠植物多样性的一般特点[J]. 生态学报, 2002, 22(11): 1923-1932. |
| [32] |
Zhang YM, Wang XQ. Summary on formation and developmental characteristics of biological soil crusts in desert areas[J]. Acta Ecologica Sinica, 2010, 30(16): 4484-4492. (in Chinese) 张元明, 王雪芹. 荒漠地表生物土壤结皮形成与演替特征概述[J]. 生态学报, 2010, 30(16): 4484-4492. |
| [33] |
Dumbrell AJ, Ashton PD, Aziz N, et al. Distinct seasonal assemblages of arbuscular mycorrhizal fungi revealed by massively parallel pyrosequencing[J]. New Phytologist, 2011, 190(3): 794-804. DOI:10.1111/j.1469-8137.2010.03636.x |
| [34] |
Zhou LS, Guo SX. Molecular diversity of arbuscular mycorrhizal fungi in wild and cultured Gynostemma pentaphyllum roots in Xishuangbanna, Southwest China[J]. Chinese Journal of Applied Ecology, 2013, 24(9): 2503-2510. (in Chinese) 周丽思, 郭顺星. 云南西双版纳野生与栽培绞股蓝根内丛枝菌根真菌的分子多样性[J]. 应用生态学报, 2013, 24(9): 2503-2510. |
| [35] |
Magoč T, Salzberg SL. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [36] |
Caporaso JG, Kuczynski J, Stombaugh J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [37] |
Edgar RC. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [38] |
Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41(D1): D590-D596. |
| [39] |
Bokulich NA, Subramanian S, Faith JJ, et al. Quality- filtering vastly improves diversity estimates from Illumina amplicon sequencing[J]. Nature Methods, 2013, 10(1): 57-59. DOI:10.1038/nmeth.2276 |
| [40] |
Huson DH, Mitra S, Ruscheweyh HJ, et al. Integrative analysis of environmental sequences using MEGAN4[J]. Genome Research, 2011, 21(9): 1552-1560. DOI:10.1101/gr.120618.111 |
| [41] |
Shannon P, Markiel A, Ozier O, et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J]. Genome Research, 2003, 13(11): 2498-2504. DOI:10.1101/gr.1239303 |
| [42] |
Su YG, Chen YW, Padilla FM, et al. The influence of biocrusts on the spatial pattern of soil bacterial communities: a case study at landscape and slope scales[J]. Soil Biology and Biochemistry, 2020, 142: 107721. DOI:10.1016/j.soilbio.2020.107721 |
| [43] |
Xiao D, Chen RX, Liu X, et al. Arbuscular mycorrhizal fungi abundance was sensitive to nitrogen addition but diversity was sensitive to phosphorus addition in karst ecosystems[J]. Biology and Fertility of Soils, 2019, 55(5): 457-469. DOI:10.1007/s00374-019-01362-x |
| [44] |
Leung G, Robson GD, Robinson CH. Characterisation of cold-tolerant fungi from a decomposing High Arctic moss[J]. Soil Biology and Biochemistry, 2011, 43(9): 1975-1979. DOI:10.1016/j.soilbio.2011.05.003 |
| [45] |
Lipson DA, Schadt CW, Schmidt SK. Changes in soil microbial community structure and function in an alpine dry meadow following spring snow melt[J]. Microbial Ecology, 2002, 43(3): 307-314. DOI:10.1007/s00248-001-1057-x |
| [46] |
Schmidt SK, Costello EK, Nemergut DR, et al. Biogeochemical consequences of rapid microbial turnover and seasonal succession in soil[J]. Ecology, 2007, 88(6): 1379-1385. DOI:10.1890/06-0164 |
| [47] |
Guo JC. Fungal genetic aspects of plateau alpine meadow soil affected by seasonal snow cover in the Northwestern Sichuan[D]. Ya'an: Master's Thesis of Sichuan Agricultural University, 2012 (in Chinese) 郭军成.季节性雪被对川西北亚高山草甸土壤真菌遗传特性的影响[D].雅安: 四川农业大学硕士学位论文, 2012 |
| [48] |
Dumbrell AJ, Nelson M, Helgason T, et al. Idiosyncrasy and overdominance in the structure of natural communities of arbuscular mycorrhizal fungi: is there a role for stochastic processes?[J]. Journal of Ecology, 2010, 98(2): 419-428. |
| [49] |
Fu Q, Hou RJ, Wang ZL, et al. Soil moisture thermal interaction effects under snow cover during freezing and thawing period[J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(15): 101-107. (in Chinese) 付强, 侯仁杰, 王子龙, 等. 冻融期积雪覆盖下土壤水热交互效应[J]. 农业工程学报, 2015, 31(15): 101-107. |
| [50] |
Augé RM. Water relations, drought and vesicular-arbuscular mycorrhizal symbiosis[J]. Mycorrhiza, 2001, 11(1): 3-42. DOI:10.1007/s005720100097 |
| [51] |
Huang G, Li CH, Li Y. Phenological responses to nitrogen and water addition are linked to plant growth patterns in a desert herbaceous community[J]. Ecology and Evolution, 2018, 8(10): 5139-5152. DOI:10.1002/ece3.4001 |
| [52] |
Bever JD, Richardson SC, Lawrence BM, et al. Preferential allocation to beneficial symbiont with spatial structure maintains mycorrhizal mutualism[J]. Ecology Letters, 2009, 12(1): 13-21. |
| [53] |
Kiers ET, Duhamel M, Beesetty Y, et al. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis[J]. Science, 2011, 333(6044): 880-882. DOI:10.1126/science.1208473 |
| [54] |
Taktek S, Trépanier M, Servin PM, et al. Trapping of phosphate solubilizing bacteria on hyphae of the arbuscular mycorrhizal fungus Rhizophagus irregularis DAOM 197198[J]. Soil Biology and Biochemistry, 2015, 90: 1-9. DOI:10.1016/j.soilbio.2015.07.016 |
| [55] |
Lendenmann M, Thonar C, Barnard RL, et al. Symbiont identity matters: carbon and phosphorus fluxes between Medicago truncatula and different arbuscular mycorrhizal fungi[J]. Mycorrhiza, 2011, 21(8): 689-702. DOI:10.1007/s00572-011-0371-5 |
| [56] |
Zhang L, Fan JQ, Ding XD, et al. Hyphosphere interactions between an arbuscular mycorrhizal fungus and a phosphate solubilizing bacterium promote phytate mineralization in soil[J]. Soil Biology and Biochemistry, 2014, 74: 177-183. DOI:10.1016/j.soilbio.2014.03.004 |
| [57] |
Wu N, Zhang J, Wang Y, et al. Effects of snow cover and arbuscular mycorrhizal fungi network on the seedling growth of Erodium oxyrrhynchum[J]. Arid Zone Research, 2018, 35(3): 624-632. (in Chinese) 吴楠, 张静, 王玥, 等. 积雪和丛枝菌根真菌网络对尖喙牻牛儿苗幼苗生长的影响[J]. 干旱研究, 2018, 35(3): 624-632. |
 2020, Vol. 47
2020, Vol. 47