扩展功能
文章信息
- 祁珊珊, 贺芙蓉, 汪晶晶, 李琴, 戴志聪, 杜道林
- QI Shan-Shan, HE Fu-Rong, WANG Jing-Jing, LI Qin, DAI Zhi-Cong, DU Dao-Lin
- 丛枝菌根真菌对入侵植物南美蟛蜞菊生长及竞争力的影响
- Effects of arbuscular mycorrhizal fungi on the growth and the competition of an invasive plant Wedelia trilobata
- 微生物学通报, 2020, 47(11): 3801-3810
- Microbiology China, 2020, 47(11): 3801-3810
- DOI: 10.13344/j.microbiol.china.200731
-
文章历史
- 收稿日期: 2020-07-16
- 接受日期: 2020-10-07
- 网络首发日期: 2020-10-12
2. 江苏大学环境与安全工程学院 江苏 镇江 212013
2. School of Environment and Safety Engineering, Jiangsu University, Zhenjiang, Jiangsu 212013, China
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是土壤微生物群落的重要功能组分,AMF能够促进植物的生长发育、抵抗环境胁迫并增强植物对病原物和植食动物的抗性[1-4]。同时,AMF也能增加植物对土壤养分的吸收[5]。植物对土壤养分中的大量元素需求很大,特别是氮、磷等养分。其中,磷元素虽然在土壤中的存储量大,但其容易与土壤中的阳离子结合形成难溶性磷酸盐[6]。因而土壤中约95%的磷元素不能被植物直接吸收利用[7],往往导致植物缺磷而影响生长。当植物与AMF形成共生体后,前者可以通过AMF的菌根网络扩大对土壤磷养分的吸收范围[8];AMF的定殖还可以通过刺激寄主植物根系分泌有机酸(如草酸和柠檬酸)[9]或者通过促进根系解磷细菌分泌相关酶(如磷酸酶)[10],从而促进土壤难溶性磷元素转化成植物可吸收利用的磷。还有研究表明,AMF在促进植物养分吸收的同时,对寄主植物的竞争力也有重要影响[11-12]。植物间通常会争夺有限的光、水和养分等资源以供自身生长发育繁殖所需。基于资源竞争理论(resource-competition theory),能更有效获取资源的物种其竞争力也更强[13]。
植物入侵(plant invasion)已经在全球范围内造成巨大的生态及经济损失。成功的入侵植物常常能够快速生长、高效获取资源,以及具有较强的种间竞争能力[14]。目前有一些研究表明,入侵植物也可以通过与AMF形成共生关系从而影响其生长发育。比如,Majewska等[15]对分布于中欧的37种非本土植物根部的AMF状况及其土壤营养条件进行了调查,发现其中高达35种(占94.59%)非本土植物均与AMF形成了紧密的关系,并且具有相当的丰度。我们的一项前期研究还表明,AMF也可以提高入侵植物的抗病能力[4]。但目前对于AMF能否真正增强入侵植物的竞争优势还不甚清楚。
南美蟛蜞菊[Wedelia trilobata (L.) A.S. Hitchc.]是菊科(Asteraceae)蟛蜞菊属(Wedelia)的多年生克隆草本植物,原产于南美洲热带地区。20世纪70年代,南美蟛蜞菊作为一种绿化地被植物被大规模引入中国华南地区[16],由于其生长快速,在野外迅速蔓延扩散,严重危害了华南地区的生物多样性与生态系统并造成巨大的经济损失[14]。目前,南美蟛蜞菊广泛分布于太平洋沿岸国家及诸多岛屿,被列为“世界百大外来入侵种”之一[17]。在中国华南地区,南美蟛蜞菊经常分布于废弃荒地、路边等土壤有效磷含量很低的地方,并且南美蟛蜞菊常会排挤本地植物而形成单优群落[18]。因此,为了研究入侵植物南美蟛蜞菊是否能与AMF形成良好的共生关系以及AMF能否促进南美蟛蜞菊在低磷养分中的生长或提高其种间竞争力等这些问题,本研究通过温室试验探究低磷环境中AMF对入侵植物南美蟛蜞菊生长及与本地植物竞争中的影响,以期为解释入侵植物在低磷等营养贫瘠环境中快速生长及扩散提供理论依据。
1 材料与方法 1.1 试验材料供试南美蟛蜞菊(W. trilobata)及同属本地植物蟛蜞菊(W. chinensis)均采自江苏大学环境与安全工程学院温室植物保育基地。试验选取含有2个茎节且长势一致的健康茎段。先使用次氯酸钠溶液(浓度为5%)对茎段进行表面消毒10 min,继而将茎段用无菌水清洗5遍后用于后续试验。
供试AMF为变形球囊霉(Glomus versiforme),购自北京农林科学院(菌株编号:ACCC30374),试验所用菌剂为自行扩繁[4]的含培养基质、菌丝、AMF孢子的混合物(每克菌剂约含23个孢子)。
圆形塑料花盆(9×6×7.5 cm)经酒精表面消毒后备用。
洗净、灭菌并烘干的河砂(直径 < 2 mm,无可利用营养)作盆栽基质。
1.2 主要试剂和仪器及培养基磷酸二氢钾、次氯酸钠,国药集团化学试剂有限公司。显微镜,Leica公司。Hoagland培养基的配制参考文献[19]。
1.3 试验设计温室盆栽试验设南美蟛蜞菊和蟛蜞菊接种和不接种AMF (2)×正常磷水平和低磷水平(2)×南美蟛蜞菊和蟛蜞菊的单种和混种(3)=12个处理,随机排列,重复6次。
1.4 接种、磷处理、种植与管理接种AMF的处理每盆施加6 g菌剂,将其与盆中的294 g处理过的河砂混匀(+AMF);不接种的则施加灭菌的6 g菌剂,将其与盆中的294 g处理过的河砂混匀(−AMF)。施加正常磷水平的处理(normal P)每盆添加含30.9 mg/L磷的1×Hoagland营养液;施加低磷水平的处理(low P)每盆添加含1.545 mg/L的低磷1×Hoagland营养液(除了磷,其他营养元素都一致)。种植方式为南美蟛蜞菊或蟛蜞菊单种(monoculture),每盆各种植2株同种植物;两种植物混种(mixture),即每盆分别种植一株南美蟛蜞菊和一株蟛蜞菊(表 1)。
| No. | AMF | 营养水平 Nutrient |
种植方式 Culture |
| 1 | 接种AMF菌剂 With AMF inoculation (+AMF) |
正常磷 Normal P |
Wt |
| 2 | Wc | ||
| 3 | Wt+Wc | ||
| 4 | 低磷 Low P |
Wt | |
| 5 | Wc | ||
| 6 | Wt+Wc | ||
| 7 | 不接种AMF菌剂 Without AMF inoculation (−AMF) |
正常磷 Normal P |
Wt |
| 8 | Wc | ||
| 9 | Wt+Wc | ||
| 10 | 低磷 Low P |
Wt | |
| 11 | Wc | ||
| 12 | Wt+Wc |
所有花盆随机摆放于温室中(温度为25 ℃,光周期为16 h/8 h)培养,每隔2周随机改变花盆的摆放位置。期间,每2 d用适量蒸馏水浇灌植株,每5 d相应补充一次各处理营养液。
1.5 测定指标与方法植株生长2个月后收获植株,测量植株的茎长、二级分枝数、叶片数、茎干重、叶干重、根长、根干重等,并计算比根长(根重量与根长的比值)及根冠比(根干重与地上干重的比值)。
1.5.1 菌根侵染率的测定依据Phillips等[20]描述的方法对植物根进行染色,并通过显微镜观测AMF侵染率。

|
采用相对竞争强度[21](relative competitive intensity,RCI)计算南美蟛蜞菊与蟛蜞菊二者之间的互相竞争强度:
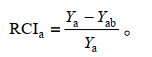
|
利用竞争平衡指数[22](competitive balance index,CB)衡量南美蟛蜞菊或蟛蜞菊二者竞争能力的大小:
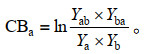
|
其中,上述公式中的Ya、Yb分别为物种a南美蟛蜞菊、物种b蟛蜞菊各自在种内竞争时的单株平均总生物量,Yab、Yba分别为在种间竞争时物种a或物种b的单株产量。对于相对竞争强度RCI,若RCIa=0,表示两物种之间没有竞争;若RCIa > 0,表示两物种之间的竞争抑制了a植物生长;若RCIa < 0表示两物种之间的竞争促进了a植物生长。对于竞争平衡指数CB,若CBa > 0,表示物种a的竞争能力强于物种b;若CBa=0,表示两物种a与物种b有相同的竞争能力;若CBa < 0,表示物种a的竞争能力弱于物种b。
1.6 数据统计分析使用SAS软件进行数据的统计分析,采用Duncan’s Multiple Range Test比较处理组间菌根侵染率的差异(显著性水平α=0.05);用三因素方差分析检验AMF、营养方式以及种植方式对南美蟛蜞菊及蟛蜞菊生长的影响,并用Duncan’s Multiple Range Test比较不同处理组之间的差异(显著性水平α=0.05);使用SigmaPlot 12.5软件进行绘图。
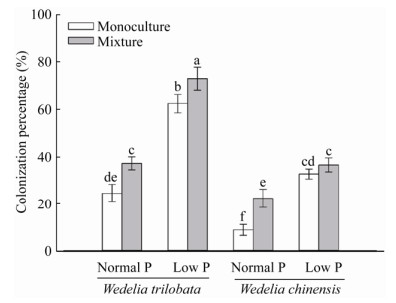
2 结果与分析 2.1 AMF对植物的侵染率变形球囊霉对两种植物均有侵染,但不论在何种磷水平,AMF对南美蟛蜞菊根系的侵染率显著高于其对蟛蜞菊根系的侵染,并且混种处理存在的种间竞争均显著提高了南美蟛蜞菊的AMF侵染率(图 1,F=37.64,p < 0.001)。而且在低磷处理下,南美蟛蜞菊(F=32.79,p < 0.001)与蟛蜞菊(F=18.03,p < 0.001)的AMF侵染率均明显高于正常磷处理下两种植物各自的AMF侵染率(图 1)。
|
| 图 1 南美蟛蜞菊及蟛蜞菊的菌根侵染率 Figure 1 The mycorrhizal colonization percentage of Wedelia trilobata and Wedelia chinensis 注:Monoculture:同种植物单独种植;Mixture:两种植物混合种植;Normal P:正常磷营养;Low P:低磷营养;数值为平均值±SE (n=6),不同字母表示在不同处理间存在显著差异(p < 0.05). Note: Monoculture: single plant species were grown; Mixture: two plant species were grown together; Normal P: normal phosphorus nutrient; Low P: low phosphorus nutrient; The results are mean±SE (n=6), bars followed by different letters are statistically significant at p < 0.05. |
|
|
总体上,不同的种植方式及磷营养条件两种处理对南美蟛蜞菊的地上生长均有显著影响;磷营养水平及AMF二者对南美蟛蜞菊的地上、地下部分的生长存在显著的交互影响;种植方式、磷营养水平及AMF三者对南美蟛蜞菊的茎长、茎干重及比根长存在显著的交互影响(表 2)。对蟛蜞菊而言,AMF侵染、种植方式及磷营养水平都分别显著影响其地上、地下部分的生长,而种植方式及磷营养水平二者对蟛蜞菊的生长有显著影响(表 3)。
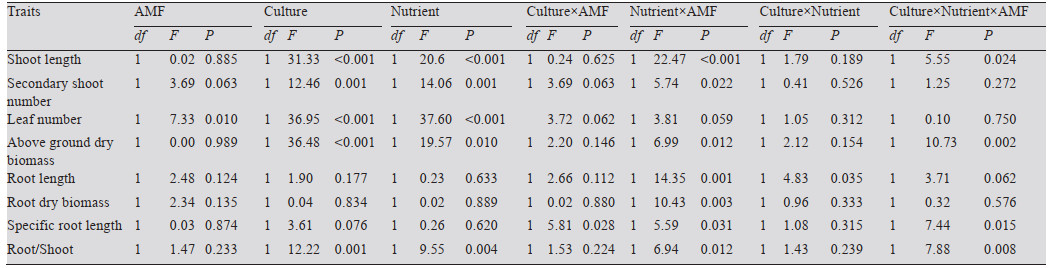
|

|
在正常磷营养及同种植物单种条件下,接种AMF显著促进南美蟛蜞菊二级分枝数量,但抑制蟛蜞菊的二级分枝数量(图 2A、B)及叶片的数量(图 2C、D);在低磷水平下,接种AMF后南美蟛蜞菊的茎长显著高于未接种AMF (图 2E),但接种AMF显著抑制蟛蜞菊的茎长(图 2F);当与本地植物竞争时,接种AMF的南美蟛蜞菊地上生物量显著高于未接种AMF (图 2G),而接种AMF反而显著抑制蟛蜞菊的地上生物量(图 2H)。
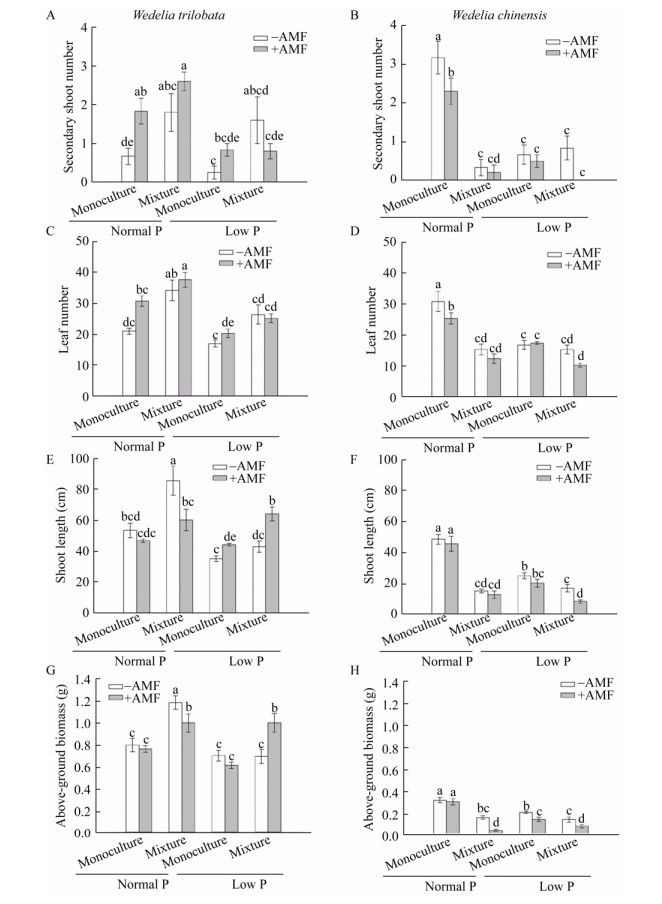
|
| 图 2 南美蟛蜞菊及蟛蜞菊的二级分枝数、叶片数、茎长及地上生物量 Figure 2 The secondary shoot number, leaf number, shoot length, and above-ground biomass of Wedelia trilobata and Wedelia chinensis 注:−AMF:未接种变形球囊霉;+AMF:接种变形球囊霉;Monoculture:同种植物单独种植;Mixture:两种植物混合种植;Normal P:正常磷营养;Low P:低磷营养;数值为平均值±SE,n=6,不同字母表示在不同处理间存在显著差异(p < 0.05). Note: −AMF: non-inoculation of Glomus versiforme; +AMF: inoculation of Glomus versiforme; Monoculture: Single plant species were grown; Mixture: Two plant species were grown together; Normal P: Normal phosphorus nutrient; Low P: Low phosphorus nutrient. The results are mean±SE (n=6), bars followed by different letters are statistically significant at p < 0.05. |
|
|
正常磷水平下,接种AMF抑制了南美蟛蜞菊的根长(图 3a)、地下生物量(图 3C)及根冠比(图 3G);在低磷水平下,接种AMF显著提高了单独种植南美蟛蜞菊的根长(图 3A)与根冠比(图 3G),与本地植物混种时,接种AMF会显著促进其比根长(图 3E);而接种AMF则显著抑制了蟛蜞菊的根长(图 3B)、地下生物量(图 3D)及根冠比(图 3H),但接种AMF显著促进了蟛蜞菊在正常营养下单独种植时的比根长(图 3F)。
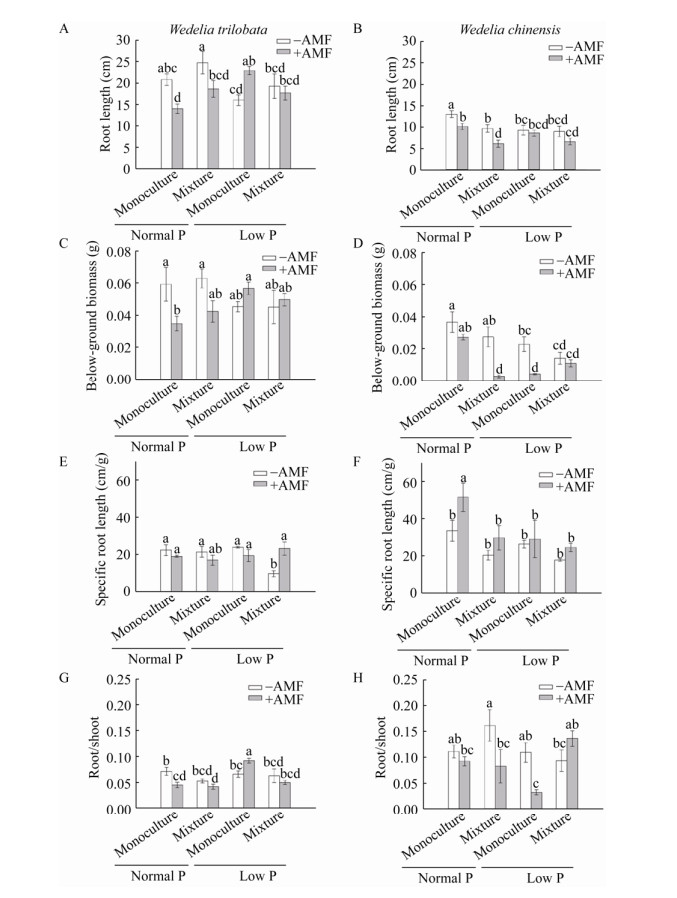
|
| 图 3 南美蟛蜞菊及蟛蜞菊的根长、根干重、比根长及根冠比 Figure 3 The root length, root dry biomass, specific root length and the ratio of root and shoot of Wedelia trilobata and Wedelia chinensis 注:−AMF:未接种变形球囊霉;+AMF:接种变形球囊霉;Monoculture:同种植物单独种植;Mixture:两种植物混合种植;Normal P:正常磷营养;Low P:低磷营养;数值为平均值±SE (n=6),不同字母表示在不同处理间存在显著差异(p < 0.05). Note: −AMF: Non-inoculation of Glomus versiforme; +AMF: Inoculation of Glomus versiforme; Monoculture: Single plant species were grown; Mixture: Two plant species were grown together; Normal P: Normal phosphorus nutrient; Low P: Low phosphorus nutrient. The results are mean±SE (n=6), bars followed by different letters are statistically significant at p < 0.05. |
|
|
南美蟛蜞菊地上部分的相对竞争强度(RCI)均 < 0,而蟛蜞菊地上部分的RCI值均 > 0 (图 4a),说明种间竞争促进了南美蟛蜞菊地上部分生长,却抑制了蟛蜞菊地上部分的生长。低磷处理减弱了竞争对南美蟛蜞菊地上部分的促进作用(RCI值趋向于0),AMF的侵染使得南美蟛蜞菊地上部分的RCI值恢复到正常磷条件下的水平(图 4A),说明AMF可以抵消低磷条件的胁迫,增强了南美蟛蜞菊地上部分的竞争力。AMF的侵染(特别是在正常磷水平下)则增加了蟛蜞菊地上部分的RCI值(图 4A),即AMF的侵染加大了蟛蜞菊地上部分受到的竞争胁迫。AMF的侵染并没有显著提高南美蟛蜞菊地下部分的相对竞争强度(图 4B)。
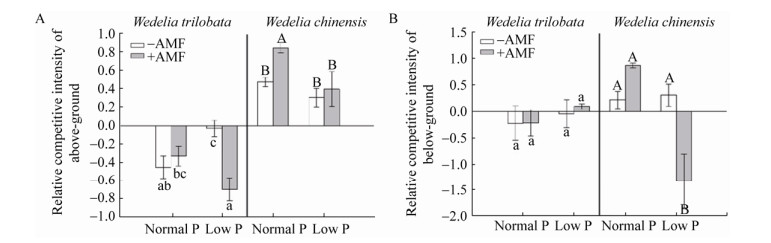
|
| 图 4 不同处理下南美蟛蜞菊和蟛蜞菊的地上部分(A)和地下部分(B)相对竞争强度 Figure 4 The relative competitive intensity of above-ground (A) and below-ground (B) in Wedelia trilobata and Wedelia chinensis 注:−AMF:未接种变形球囊霉;+AMF:接种变形球囊霉;Normal P:正常磷营养;Low P:低磷营养;数值为平均值±SE (n=6),不同字母表示在不同处理间存在显著差异(p < 0.05). Note: −AMF: Non-inoculation of Glomus versiforme; +AMF: Inoculation of Glomus versiforme; Normal P: Normal phosphorus nutrient; Low P: Low phosphorus nutrient. The results are mean±SE (n=6), bars followed by different letters are statistically significant at p < 0.05. |
|
|
与蟛蜞菊竞争生长时,南美蟛蜞菊的地上部分及地下部分的竞争平衡指数均为正值(图 5),说明南美蟛蜞菊的竞争能力强于蟛蜞菊。而且在低磷水平下,接种AMF处理显著提高了南美蟛蜞菊的地下竞争平衡指数(图 5)。

|
| 图 5 不同处理下南美蟛蜞菊地上部分及地下部分竞争平衡指数 Figure 5 The competitive balance (CB) of above-ground (A) and below-ground (B) in Wedelia trilobata 注:−AMF:未接种变形球囊霉;+AMF:接种变形球囊霉;Normal P:正常磷营养;Low P:低磷营养;数值为平均值±SE (n=6),不同字母表示在不同处理间存在显著差异(p < 0.05). Note: −AMF: Non-inoculation of Glomus versiforme; +AMF: Inoculation of Glomus versiforme; Normal P: Normal phosphorus nutrient; Low P: Low phosphorus nutrient. The results are mean±SE (n=6), bars followed by different letters are statistically significant at p < 0.05. |
|
|
目前,关于AMF是否对外来入侵植物的贡献大于对本地植物的贡献仍有争议。比如,Bunn等[23]表明本地植物和入侵植物对AMF侵染的响应并没有显著的差异。然而,众多研究均表明,AMF在外来植物的入侵中发挥了重要的作用,外来植物与AMF的互作往往可以促进其成功入侵[24-26]。本研究也表明变形球囊霉不仅能显著促进入侵植物南美蟛蜞菊在低磷水平下的生长,并且还提高了其对本地植物的竞争能力。
外来入侵植物南美蟛蜞菊在我国的分布地区常为废弃荒地,其土壤中有效磷含量往往很低[4]。因此,南美蟛蜞菊是否能高效利用土壤中的营养资源对其快速生长与扩散起着重要作用。研究表明,入侵植物的生长通常会受益于与AMF的互作[15]。比如,Majewska等[27]研究表明,AMF对两种入侵植物金光菊(Rudbeckia laciniata)和巨大一枝黄花(Solidago gigantea)的生长与营养吸收都有显著的促进作用。同时,与AMF互作还可以提高入侵植物的抗病能力[4]。本研究结果表明,在低磷条件下,与AMF互作显著促进了南美蟛蜞菊的茎长以及地上生物量,但对本地植物在低磷营养水平下的生长没有明显的影响(图 2)。茎的伸长和地上生物量对匍匐茎无性克隆生长具有极其重要的意义,而南美蟛蜞菊[14, 17]正是主要依赖于匍匐茎快速无性克隆繁殖进行种群的扩张,这意味着即使面对低磷环境胁迫,南美蟛蜞菊也可以通过同AMF的互作而保持向外扩张的态势。
另外有研究表明,在磷饥饿条件下,植物可通过赤霉素积累诱导菌根的侵染[28-29]。然而我们的一项前期研究则发现,南美蟛蜞菊内源赤霉素高于本地植物蟛蜞菊的内源赤霉素[14],由此我们推测,可能因为更高的赤霉素使得南美蟛蜞菊具有更高AMF侵染率,进而促进南美蟛蜞菊的生长并提高其竞争力。这主要是与互惠的AMF结合可以增加植物捕获PO43−的表面积[27, 30],从而提高植物对磷的吸收,促进植物生长。
AMF在营养吸收能力的增强及生长的促进上可以提高外来入侵植物的竞争能力[31],有利于其进一步扩张。比如,AMF的侵染对紫茎泽兰(Ageratina adenophora)[32]与黄顶菊(Flaveria bidentis)[33]的竞争生长有促进作用,提高了其入侵力。本研究结果也表明,在与本地植物竞争的条件下,与AMF互作同样显著提高了入侵植物南美蟛蜞菊的竞争能力(图 4、5),这很可能在南美蟛蜞菊排挤本地植物和占领入侵地方面起到重要作用。
综上所言,AMF显著促进南美蟛蜞菊的生长及在低磷条件下的竞争力,但没有促进本地植物蟛蜞菊的生长及竞争。这一结果从共生微生物角度解释了南美蟛蜞菊相对于本地植物而言具有生长迅速且有较强竞争力的原因。因此,与AMF的共生也可能为南美蟛蜞菊向营养贫瘠土壤进行扩张做出贡献,很可能是南美蟛蜞菊成功入侵的重要机制。为此,对于管理部门应当加强贫瘠土壤环境中南美蟛蜞菊防控工作的定期监控,这样可以将其清除在入侵初期,以节约各种防控成本并提高清除效率。
| [1] |
Kula AAR, Hartnett DC, Wilson GWT. Effects of mycorrhizal symbiosis on tallgrass prairie plant-herbivore interactions[J]. Ecology Letters, 2005, 8(1): 61-69. |
| [2] |
Yooyongwech S, Samphumphuang T, Tisarum R, et al. Arbuscular mycorrhizal fungi (AMF) improved water deficit tolerance in two different sweet potato genotypes involves osmotic adjustments via soluble sugar and free proline[J]. Scientia Horticulturae, 2016, 198: 107-117. DOI:10.1016/j.scienta.2015.11.002 |
| [3] |
Lin JX, Wang YN, Sun SN, et al. Effects of arbuscular mycorrhizal fungi on the growth, photosynthesis and photosynthetic pigments of Leymus chinensis seedlings under salt-alkali stress and nitrogen deposition[J]. Science of the Total Environment, 2017, 576: 234-241. DOI:10.1016/j.scitotenv.2016.10.091 |
| [4] |
Chen Q, Wu WW, Qi SS, et al. Arbuscular mycorrhizal fungi improve the growth and disease resistance of the invasive plant Wedelia trilobata[J]. Journal of Applied Microbiology, 2019. DOI:10.1111/jam.14415 |
| [5] |
Jo I, Potter KM, Domke GM, et al. Dominant forest tree mycorrhizal type mediates understory plant invasions[J]. Ecology Letters, 2018, 21(2): 217-224. |
| [6] |
Holford ICR. Soil phosphorus: Its measurement, and its uptake by plants[J]. Australian Journal of Soil Research, 1997, 35(2): 227-240. DOI:10.1071/S96047 |
| [7] |
Roberts TL, Johnston AE. Phosphorus use efficiency and management in agriculture[J]. Resources, Conservation and Recycling, 2015, 105: 275-281. DOI:10.1016/j.resconrec.2015.09.013 |
| [8] |
Bai YF, Guo SX, Li M. Interactions between invasive plants and arbuscular mycorrhizal fungi: A review[J]. Chinese Journal of Applied Ecology, 2011, 22(9): 2457-2463. (in Chinese) 柏艳芳, 郭绍霞, 李敏. 入侵植物与丛枝菌根真菌的相互作用[J]. 应用生态学报, 2011, 22(9): 2457-2463. |
| [9] |
Zhang L, Xu MG, Liu Y, et al. Carbon and phosphorus exchange may enable cooperation between an arbuscular mycorrhizal fungus and a phosphate-solubilizing bacterium[J]. New Phytologist, 2016, 210(3): 1022-1032. DOI:10.1111/nph.13838 |
| [10] |
Zhang L, Fan JQ, Ding XD, et al. Hyphosphere interactions between an arbuscular mycorrhizal fungus and a phosphate solubilizing bacterium promote phytate mineralization in soil[J]. Soil Biology & Biochemistry, 2014, 74: 177-183. |
| [11] |
Smith SE, Smith FA. Roles of arbuscular mycorrhizas in plant nutrition and growth: New paradigms from cellular to ecosystem scales[J]. Annual Review of Plant Biology, 2011, 62: 227-250. DOI:10.1146/annurev-arplant-042110-103846 |
| [12] |
Facelli E, Smith SE, Facelli JM, et al. Underground friends or enemies: model plants help to unravel direct and indirect effects of arbuscular mycorrhizal fungi on plant competition[J]. New Phytologist, 2010, 185(4): 1050-1061. DOI:10.1111/j.1469-8137.2009.03162.x |
| [13] |
Fargione J, Tilman D. Plant species traits and capacity for resource reduction predict yield and abundance under competition in nitrogen-limited grassland[J]. Functional Ecology, 2006, 20(3): 533-540. DOI:10.1111/j.1365-2435.2006.01116.x |
| [14] |
Dai ZC, Fu W, Qi SS, et al. Different responses of an invasive clonal plant Wedelia trilobata and its native congener to gibberellin: implications for biological invasion[J]. Journal of Chemical Ecology, 2016, 42(2): 85-94. |
| [15] |
Majewska ML, Blaszkowski J, Nobis M, et al. Root-inhabiting fungi in alien plant species in relation to invasion status and soil chemical properties[J]. Symbiosis, 2015, 65(3): 101-115. DOI:10.1007/s13199-015-0324-4 |
| [16] |
Qi SS, Dai ZC, Miao SL, et al. Light limitation and litter of an invasive clonal plant, Wedelia trilobata, inhibit its seedling recruitment[J]. Annals of Botany, 2014, 114(2): 425-433. DOI:10.1093/aob/mcu075 |
| [17] |
Li ZY, Xie Y. Invasive Alien Species in China[M]. Beijing: China Forest Publishing House, 2002. (in Chinese) 李振宇, 解焱. 中国外来入侵种[M]. 北京: 中国林业出版社, 2002. |
| [18] |
Dai ZC, Wang XY, Qi SS, et al. Effects of leaf litter on inter-specific competitive ability of the invasive plant Wedelia trilobata[J]. Ecological Research, 2016, 31(3): 367-374. |
| [19] |
Hoagland DR, Arnon DI. The Water-Culture Method for Growing Plants without Soil[M]. Circular 347. Berkeley: The College of Agriculture University of California, 1950: 1-32
|
| [20] |
Phillips JM, Hayman DS. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society, 1970, 55(1): 158-161. DOI:10.1016/S0007-1536(70)80110-3 |
| [21] |
Daniel BA, Skipper HD. Methods for the Recovery and Quantitative Estimation of Propagules from Soil[M]. St. Paul: Methods & Principles of Mycorrhizal Research, American Phytopathological Society, 1982: 29-36
|
| [22] |
Wilson JB. Shoot competition and root competition[J]. Journal of Applied Ecology, 1988, 25(1): 279-296. |
| [23] |
Bunn RA, Ramsey PW, Lekberg Y. Do native and invasive plants differ in their interactions with arbuscular mycorrhizal fungi? A meta-analysis[J]. Journal of Ecology, 2015, 103(6): 1547-1556. DOI:10.1111/1365-2745.12456 |
| [24] |
Menzel A, Hempel SR, Klotz S, et al. Mycorrhizal status helps explain invasion success of alien plant species[J]. Ecology, 2017, 98(1): 92-102. |
| [25] |
van Kleunen M, Dawson W, Schlaepfer D, et al. Are invaders different? A conceptual framework of comparative approaches for assessing determinants of invasiveness[J]. Ecology Letters, 2010, 13(8): 947-958. |
| [26] |
Lagos ME, White CR, Marshall DJ. Do invasive species live faster? Mass-specific metabolic rate depends on growth form and invasion status[J]. Functional Ecology, 2017, 31(11): 2080-2086. DOI:10.1111/1365-2435.12913 |
| [27] |
Majewska ML, Rola K, Zubek S. The growth and phosphorus acquisition of invasive plants Rudbeckia laciniata and Solidago gigantea are enhanced by arbuscular mycorrhizal fungi[J]. Mycorrhiza, 2017, 27(2): 83-94. DOI:10.1007/s00572-016-0729-9 |
| [28] |
Floss DS, Levy JG, Lévesque-Tremblay V, et al. DELLA proteins regulate arbuscule formation in arbuscular mycorrhizal symbiosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(51): E5025-E5034. DOI:10.1073/pnas.1308973110 |
| [29] |
Oldroyd GED, Leyser O. A plant's diet, surviving in a variable nutrient environment[J]. Science, 2020, 368(6486): eaba0196. DOI:10.1126/science.aba0196 |
| [30] |
Lee MR, Tu C, Chen X, et al. Arbuscular mycorrhizal fungi enhance P uptake and alter plant morphology in the invasive plant Microstegium vimineum[J]. Biological Invasions, 2014, 16(5): 1083-1093. DOI:10.1007/s10530-013-0562-4 |
| [31] |
Callaway RM, Newingham B, Zabinski CA, et al. Compensatory growth and competitive ability of an invasive weed are enhanced by soil fungi and native neighbours[J]. Ecology Letters, 2001, 4(5): 429-433. DOI:10.1046/j.1461-0248.2001.00251.x |
| [32] |
Li LQ, Zhang MS, Liang ZP, et al. Arbuscular mycorrhizal fungi enhance invasive plant, Ageratina adenophora growth and competition with native plants[J]. Chinese Journal of Ecology, 2016, 35(1): 79-86. (in Chinese) 李立青, 张明生, 梁作盼, 等. 丛枝菌根真菌促进入侵植物紫茎泽兰的生长和对本地植物竞争效应[J]. 生态学杂志, 2016, 35(1): 79-86. |
| [33] |
Zhang YM, Wang Y, Li Q, et al. Mechanism of AM fungi on competitive growth between invasive plant Flaveria bidentis and native plant Setaria viridis[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(6): 1215-1221. (in Chinese) 张玉曼, 王月, 李乔, 等. AM真菌影响入侵植物黄顶菊与本土物种狗尾草竞争生长的机理研究[J]. 西北植物学报, 2015, 35(6): 1215-1221. |
 2020, Vol. 47
2020, Vol. 47