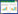扩展功能
文章信息
- 张博枰, 赵丽萍, 石芸, 洪慧, 周玉, 周芝兰, 贾雪冰, 乔晨萌, 赵炜疆, 崔春, 申延琴
- ZHANG Bo-Ping, ZHAO Li-Ping, SHI Yun, HONG Hui, ZHOU Yu, ZHOU Zhi-Lan, JIA Xue-Bing, QIAO Chen-Meng, ZHAO Wei-Jiang, CUI Chun, SHEN Yan-Qin
- 隔日禁食对帕金森病模型小鼠肠道屏障的保护作用及机制
- Protective effect and mechanisms of alternate day fasting on intestinal barrier function in Parkinson's disease model mice
- 微生物学通报, 2020, 47(11): 3789-3800
- Microbiology China, 2020, 47(11): 3789-3800
- DOI: 10.13344/j.microbiol.china.200185
-
文章历史
- 收稿日期: 2020-03-04
- 接受日期: 2020-05-27
- 网络首发日期: 2020-06-30
帕金森病(Parkinson’s disease,PD)是一种常见的神经系统退行性疾病,主要神经病理改变为中脑黑质多巴胺能神经元的丢失以及α-突触核蛋白的异常积累,其典型的症状为肌肉僵直、动作迟缓等运动功能障碍,胃肠功能紊乱被认为可能是帕金森病症状的前期阶段[1-3]。Braak等[4]发现肠内存在α-突触核蛋白的病理沉积,提示PD病理过程是由肠道扩散入脑。
间歇性禁食是利用短期禁食来控制食物摄入频次的饮食限制方式。间歇性禁食不仅有利于肥胖症等代谢性疾病的治疗,也在认知退化和包括PD在内的神经系统退行性疾病中具有一定治疗作用[5-6]。隔日禁食(alternate day fasting,ADF)是最常见的一种间歇性禁食方案[7],研究发现ADF可缓解多发性硬化症小鼠的症状,改善肠道菌群紊乱[8]。另外,5日空腹2日进食的间歇性禁食持续40 d后,老年果蝇肠道衰老相关因子表达降低,屏障功能得到改善,提示间歇性禁食有利于维持肠上皮细胞活性与肠道屏障稳态[9]。ADF已被证明对PD模型小鼠具有神经保护作用,但ADF对PD模型小鼠肠道屏障功能是否具有保护作用尚无研究报道。
研究证明,肠道菌群可通过神经、免疫、内分泌等途径参与肠道与中枢神经系统之间的通讯,即菌群-肠-脑轴[10-11]。饮食、药物、生活方式等因素均可引起肠道菌群的紊乱,不仅改变肠道黏液层的生理功能,继而出现肠屏障功能障碍[12-13],而且还会影响脑正常功能,诱导行为异常与认知障碍[14]。近年来,许多研究证实肠道菌群失调与中枢神经系统疾病的发生发展密切相关[15]。认知能力受损的阿尔茨海默症患者体内拟杆菌门(Bacteroidetes)、双歧杆菌属(Bifidobacterium)的丰度显著升高[16]。多发性硬化症患者肠道菌群结构改变,厚壁菌门(Firmicutes)的丰度较对照组显著下降,与炎症介导脱髓鞘相关[17]。自闭症模型小鼠肠道菌群改变,常伴有肠通透性增强等胃肠道异常,给予脆弱拟杆菌(Bacteroides fragilis)治疗可有效改善[18]。同样,PD患者粪便中检测到肠道菌群也存在失调现象,肠杆菌科(Enterobacteriaceae)丰度增高,其表达水平与PD患者运动障碍的严重程度成正相关[19]。值得关注的是,艾克曼菌属(Akkermansia)相较对照组丰度增加,该菌群的增加与肠黏液层降解有关[20] (表 1)。因此,本文对PD模型小鼠肠道菌群的变化、ADF对PD模型小鼠肠道菌群失调的影响进行验证与探索。
| 疾病 Disease |
菌群的变化 Altered microflora |
相关症状 Associated symptoms |
参考文献 References |
| 阿尔茨海默症 Alzheimer’s disease |
双歧杆菌属↑Bifidobacterium↑ 拟杆菌门↑Bacteroidetes↑ |
与认知障碍相关 cognitive disorder |
[16] |
| 多发性硬化症 Multiple sclerosis |
厚壁菌门↓Firmicutes↓ | 与炎症脱髓鞘相关 Inflammatory demyelinating |
[17] |
| 自闭症 Autism spectrum disorder |
脆弱拟杆菌↓Bacteroides fragilis↓ | 与焦虑、胃肠道屏障缺陷相关 Anxiet, intestinal barrier dysfunction |
[18] |
| 帕金森病 Parkinson’s disease |
肠杆菌科↑Enterobacteriaceae↑ | 与运动障碍严重程度正相关 dyscinesia |
[19] |
| 帕金森病 Parkinson’s disease |
艾克曼菌↑Akkermansia↑ | 与肠黏液层降解相关 Intestinal mucous layer degradation |
[20] |
| 注:↑:相对丰度升高;↓:相对丰度降低. Note: ↑: Relative abundance increases; ↓: Relative abundance decrease. |
|||
紧密连接蛋白也是肠道屏障的重要组成部分,对维持肠道上皮完整性至关重要[21]。临床研究发现PD患者肠道中闭合蛋白Occludin表达水平下降以及肠上皮通透性增高[22]。此外,研究发现肠道屏障的完整性与肠道能量状态有关[23]。小肠往往需要更高的ATP来保证肠上皮完整性[23]。另外,AMP依赖蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)是胃肠生长素释放肽——胃饥饿素的靶标,可在PD中发挥神经保护功能[24]。激活的AMPK是否参与ADF对PD小鼠肠屏障的作用,本文也将进行进一步研究。
1 材料与方法 1.1 主要试剂和仪器神经毒素MPTP,西格玛奥德里奇(上海)贸易有限公司;RIPA裂解液和蛋白酶抑制剂,上海碧云天生物技术公司;β-tubulin抗体,武汉三鹰生物技术有限公司;ZO-1抗体,武汉爱博泰克生物科技有限公司;PVDF膜,密理博(中国)有限公司;RT-qPCR引物和Trizol试剂,Invitrogen公司;氯仿、异丙醇,上海国药化学试剂有限公司;反转录试剂盒PrimeScriptTM RT Master Mix和荧光定量试剂盒SYBR Premix ExTaqTMⅡ,宝生物工程(大连)有限公司;QuantiFluor™-ST蓝色荧光定量系统,普洛麦格(北京)生物技术有限公司;HE染色试剂盒,北京索莱宝科技有限公司。杯式超声波细胞破碎机,宁波新芝生物科技股份有限公司;荧光定量PCR仪,罗氏(中国)有限公司;电泳仪,伯乐生命医学产品(上海)有限公司;半自动石蜡切片机,莱卡显微系统(上海)贸易有限公司。
1.2 实验设计与分组SPF级别6周龄雄性C57BL/6小鼠购于上海斯莱克实验动物有限公司,SPF级小鼠鼠粮购于上海普路腾生物科技有限公司。实验前C57BL/6小鼠放于检疫环境适应一周,给予小鼠12 h为周期的光暗循环,保持室温在24±2 ℃,空气湿度在55%±10%。将32只小鼠随机分为4组,每组8只小鼠。NS+AL组小鼠自由摄食饮水,腹腔注射生理盐水;NS+ADF组小鼠隔日禁食自由饮水,腹腔注射生理盐水;MPTP+AL组小鼠自由摄食饮水,腹腔注射MPTP;MPTP+ADF组小鼠隔日禁食自由饮水,腹腔注射MPTP神经毒素。以48 h为一个饮食周期,前24 h采取禁食,后24 h采取自由摄食,重复进行17个循环周期。每个循环期末记录本循环小鼠食物摄入量。在第12−14个周期进行腹腔注射MPTP (单次剂量30 mg/kg,每天一次,连续注射5 d),建立亚急性帕金森病小鼠模型。所有试验步骤均得到江南大学实验动物伦理委员会的批准。
1.3 行为学测试爬杆实验:小鼠所用爬杆是直径1 cm、高55 cm的金属杆,顶部有一直径约2 cm的金属小球,金属杆外包裹一层纱布防止打滑。测试时手执小鼠尾尖端,使小鼠头下尾上接触金属小球,小鼠两后肢接触金属球开始计时,记录小鼠自上而下爬完全杆的时间。测试3次取平均值。
悬挂试验:小鼠两前肢置于距地约30 cm、直径约为0.5 cm的金属线上,抓其尾部向下放,如两后肢均可抓住金属线,记4分;如一后肢可抓住金属线,记3分;如两前肢抓住金属线,记2分;如只有一只前肢可抓住金属线,记1分;掉落,计0分。
1.4 样品采集试验周期结束后,采集小鼠新鲜粪便,置于−80 ℃保存,用于后续肠道菌群测序。收取6只小鼠空肠组织,置于−80 ℃保存,以备后续RT-qPCR和Western blotting检测使用;收取2只小鼠空肠组织,置于4%的多聚甲醛中4 ℃保存,以备后续HE染色使用。
1.5 HE染色观察病理形态变化石蜡切片4 μm,经二甲苯脱蜡、梯度乙醇脱水、苏木精染核、盐酸酒精分化后返蓝,进行伊红染色,用中性胶固封后,使用数字扫描仪拍摄图像。
1.6 肠道菌群基因组抽提与测序肠道菌群基因组DNA抽提后,利用1%的琼脂糖凝胶电泳检测抽提的基因组DNA。16S rRNA基因扩增区域为V3−V4,引物序列为341F (5′-CCTAYGGGRBGCASCAG-3′)和806R (5′-GGACTACNNGGGTATCTAAT-3′)。PCR反应体系(25 μL):待扩增基因组DNA 11.5 μL,2×KAPA HiFi HotStart Ready Mix 12.5 μL,正、反向引物(10 μmol/L)各0.5 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,25个循环;72 ℃ 5 min。PCR产物用2%琼脂糖凝胶电泳检测,参照电泳初步定量结果,再将PCR产物用QuantiFluor™ -ST蓝色荧光定量系统进行检测定量,之后按照测序要求进行相应比例混合,最后使用TruSeq进行文库构建,经测序后以97%的一致性将序列聚类为操作分类单元(operational taxonomic unit,OTU)。
1.7 RT-qPCR检测小鼠空肠AMPK、ZO-1、Occludin的mRNA变化称取20 mg空肠组织,加入500 μL Trizol,45 W超声破碎50 s (工作20 s,间歇10 s)后,加入100 μL氯仿,振荡混匀后室温静置10 min,4 ℃、11 300 r/min离心15 min,取上层水相加入250 μL异丙醇,混匀后室温静置10 min,4 ℃、11 300 r/min离心10 min,弃上清,再分别经75%乙醇和无水乙醇清洗后离心10 min得到空肠总RNA并测定浓度,使用PrimeScriptTM RT Master Mix试剂盒进行反转录,得到cDNA,以该cDNA为模板,使用SYBR Premix Ex TaqTM Ⅱ进行RT-qPCR反应,使用的引物有Prkaa1、Tjp1、Ocln和Gapdh,文中用于RT-qPCR的引物序列来源于检索NCBI基因数据库,通过基因ID在Primer Bank中获得相关引物序列,详见表 2。
| 基因ID号 Gene ID |
基因名称 Gene name |
引物序列 Primers sequence (5′→3′) |
| 21872 | Zonula occludens-1 (Tjp1) | (F) GAGCGGGCTACCTTACTGAAC (R) GTCATCTCTTTCCGAGGCATTAG |
| 18260 | Occludin (Ocln) | (F) CTGGATCTATGTACGGCTCACA (R) TCCACGTAGAGACCAGTACCT |
| 105787 | AMP-activated protein kinase (Prkaa1) | (F) ATCCTTTCCGGTGTGGATTATTG (R) CAAGCAGGACGTTCTCAGGT |
| 14433 | Glyceraldehyde-3-phosphate dehydrogenase (Gapdh) | (F) AGGTCGGTGTGAACGGATTTG (R) TGTAGACCATGTAGTTGAGGTCA |
称取20 mg肠组织,加入RIPA裂解液200 μL,加入蛋白酶抑制剂2 μL,于匀浆机中研磨匀浆,4 ℃、13 000 r/min离心15 min后取上清。经聚氰基丙烯酸正丁酯Bicinchonininc acid (BCA)法检测蛋白浓度后进行Western blotting实验。一抗ZO-1 (1:1 000)、β-tubulin (1:5 000),HRP标记羊抗兔IgG二抗(1:5 000)、HRP标记羊抗小鼠IgG二抗(1:5 000)。
1.9 统计方法使用SPSS 22.0软件进行统计学分析,多组之间的分析使用单因素方差分析,数据以mean±SEM表示,将P < 0.05设定为显著性阈值(*:P < 0.05;**:P < 0.01;***:P < 0.001)。
2 结果与分析 2.1 ADF影响小鼠食物摄入量为了解ADF对小鼠食物摄入量的影响,在ADF每个循环进食日记录小鼠的食物摄入量以及摄入总量。
小鼠食物摄入量在每个ADF循环中进食日的结果显示,ADF组小鼠食物摄入量的均值比AL组小鼠显著升高(P < 0.001),几乎是AL组小鼠摄食量的2倍,如图 1A所示。小鼠食物摄入总量显示,与对照组相比,ADF对AL组小鼠的摄食总量均无显著影响(P > 0.05),如图 1B所示。各组小鼠进食日摄食量与总摄食量统计表详见表 3。

|
| 图 1 各组小鼠摄食量 Figure 1 Food intake of mice in various groups 注:A:进食日摄食量;***:P < 0.001. B:总摄食量. n=8. Note: A: Food intake on fed-day; ***: P < 0.001. B: Total food intake. n=8. |
|
|
| 摄食量 Food intake |
组别Groups | P值P value | |||||
| NS+AL (NA) | NS+ADF (NF) | MPTP+AL (MA) | MPTP+ADF (MF) | NA vs. NF | MA vs. MF | ||
| 进食日Fed-day (g) | 3.68±0.37 | 6.93±0.33 | 3.32±0.11 | 6.97±0.45 | 0.000*** | 0.000*** | |
| 总计Total (g) | 123.90±10.29 | 114.52±5.68 | 111.84±5.01 | 116.67±6.51 | 0.43 | 0.84 | |
| Note: ***: P < 0.001. | |||||||
为了验证帕金森模型小鼠的建立以及探究ADF对PD模型小鼠运动能力的影响,通过悬挂试验与爬杆实验分别检测小鼠的肌肉力量以及动作的迟缓程度来综合评价小鼠的运动能力。
悬挂实验结果显示,MPTP+AL组小鼠得分相较于NS+AL组小鼠显著降低(P < 0.01),而MPTP+ADF组得分较MPTP+AL组小鼠显著升高(P < 0.001),如图 2A所示。爬杆实验结果显示,与NS+AL组相比,MPTP+AL组小鼠所用的时间明显延长(P < 0.01),而MPTP+ADF组小鼠较MPTP+AL组所用时间显著下降(P < 0.001),如图 2B所示。通过行为学结果,一方面证明PD模型小鼠模型成功构建;另一方面证明ADF饮食方案能够改善PD模型小鼠运动迟缓与肢体力量不足等运动功能障碍。此外,ADF对于正常小鼠的运动能力没有显著的影响。
|
| 图 2 各组小鼠行为学测试 Figure 2 Behavior test in various groups 注:A:悬挂试验;B:爬杆实验;n=8. **:P < 0.01;***:P < 0.001. Note: A: Traction test; B: Pole test; n=8. **: P < 0.01; ***: P < 0.001. |
|
|
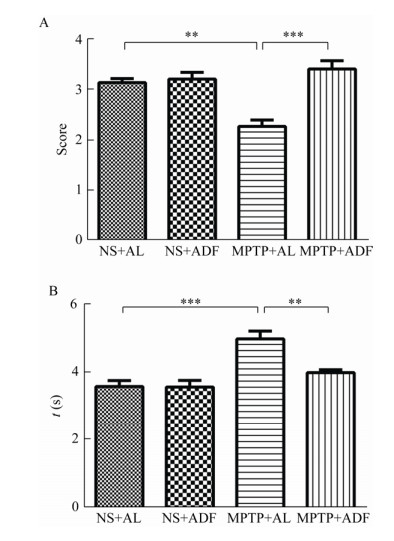
组织的病理改变通常反映功能的变化。为了探究ADF对PD模型小鼠空肠病理组织学变化的影响,通过HE染色观察空肠绒毛形态学改变。
HE染色结果显示,NS+AL组小鼠的空肠绒毛上皮结构完整,排列整齐,连接紧密,如图 3A所示。然而MPTP+AL组小鼠空肠绒毛上皮结构破损,连接断裂,出现水肿,如图 3C所示。相较于MPTP+AL组,MPTP+ADF组中小鼠肠绒毛结构完整性有所恢复,排列密集较为整齐,如图 3D所示。上述结果说明,ADF对PD模型小鼠空肠绒毛形态的完整有一定保护作用。
|
| 图 3 各组小鼠空肠绒毛组织病理形态(HE染色, 40×) Figure 3 Pathological morphology of mice jejunum villi in various groups (by HE staining, 40×) 注:A:NS+AL组;B:NS+ADF组;C:MPTP+AL组;D:MPTP+ADF组.肠绒毛是肠壁向肠腔伸出指状突起的肠组织,外覆单层柱状上皮,中间为固有层.图中深蓝色圆点状结构部分为细胞核,紫红色染色部分为细胞质,期间空泡样结构为杯状细胞. Note: A: NS+AL group; B: NS+ADF group; C: MPTP+AL group; D: MPTP+ADF group. Intestinal villi is the tissue with fingerlike protruding from the intestinal wall to the lumen. In this figure, the dot structure stained in the dark blue is nucleus, cytoplasm is stained in the purplish red, and the vacuole-like structure is goblet cells. |
|
|
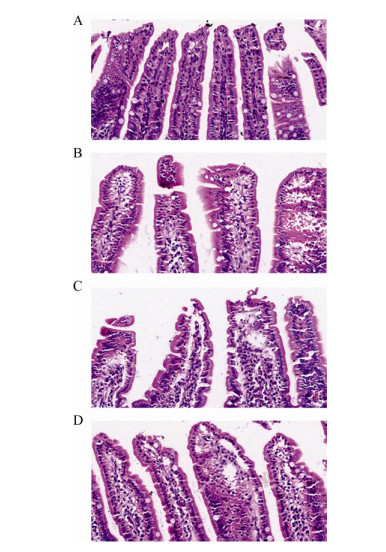
基于α多样性和β多样性对比分析,从菌群丰度多样性和菌群群落结构两方面进行系统评价。Chao1指数是反映菌群丰度的α多样性之一,结果显示,MPTP+AL组小鼠的Chao1指数较NS+AL组小鼠有显著上升趋势(P < 0.001),说明MPTP诱导的PD模型小鼠肠道菌群丰度和多样性更高,而MPTP+ADF组与MPTP+AL组小鼠并无显著差异,如图 4A所示。非度量多维尺度分析(non-metric multidimensional scaling analysis,NMDS)是β多样性分析的方法之一,NMDS图中的每个点表示一个样品,点与点之间的距离表示差异程度,同组的样品使用同一种颜色表示,Stress越小(< 0.2),说明NMDS越可以准确反映样品间的差异程度。Adonis分析用来判断分组因素对样本差异的解释度。基于Bray-Curtis距离分析结果显示,NS+AL、NS+ADF、MPTP+AL、MPTP+ADF组小鼠在菌落结构上形成明显的聚类(stress=0.061),通过ANOSIM的方法对4组小鼠菌群聚类进行分析发现差异具有显著性(P < 0.01),如图 4B所示。
|
| 图 4 ADF影响PD模型小鼠肠道菌群的构成 Figure 4 ADF affected the composition of intestinal microflora in PD model mice 注:A:肠道菌群α多样性;B:肠道菌群β多样性;C:基于OTU聚类物种科水平热图;D:艾克曼菌科相对丰度;N.A:NS+AL组(n=7);N.F:NS+ADF组(n=7);M.A:MPTP+AL组(n=8);M.F:MPTP+ADF组(n=8). **:P < 0.01;***:P < 0.001. Note: A: Alpha diversity of intestinal microflora; B: Beta diversity of intestinal microflora; C: Based on OTU clustering species abundance heat map at family level; D: Relative abundance at family level of Akkermansiaceae; N.A: NS+AL group (n=7); N.F: NS+ADF group (n=7); M.A: MPTP+AL group (n=8); M.F: MPTP+ADF group (n=8). **: P < 0.01; ***: P < 0.001. |
|
|
物种相对丰度聚类热图是在科水平不同菌群间的相对丰度差异以及菌群分布构成。结果显示:相比NS+AL组,MPTP+AL组小鼠菌群相对丰度有所改变。脱铁杆菌科(Deferribacillaceae)、螺杆菌科(Helicobacteraceae)、丹毒丝菌科(Erysipeiotrichaceae)等相对丰度均在PD模型小鼠中有所上升,在MPTP+ADF组有下降趋势,统计学上并无显著差异。其中,艾克曼菌科相对丰度在MPTP+AL组小鼠中显著上升(P < 0.01),而在MPTP+ADF组小鼠艾克曼菌科相对丰度显著下降(P < 0.01),如图 4C、4D所示。菌群测序的结果表明,PD模型小鼠肠道菌群发生变化,而ADF可以纠正艾克曼菌科丰度的异常升高。
2.5 ADF激活Prkaa1及升高PD模型小鼠空肠上皮紧密连接Ocln的表达水平为了探究ADF对PD模型小鼠空肠能量代谢分子和肠道紧密连接分子的影响,通过RT-qPCR的方法检测Prkaa1以及Ocln表达水平的变化。
小鼠空肠mRNA数据显示,与NS+AL组小鼠相比,MPTP+AL组小鼠Prkaa1表达水平显著下降(P < 0.01),而与MPTP+AL组相比,MPTP+ADF组小鼠Prkaa1分子的表达明显升高(P < 0.01),如图 5A所示。与NS+AL组小鼠相比,MPTP+AL组小鼠空肠的Ocln明显降低(P < 0.01),MPTP+ADF组小鼠空肠Ocln有上升的趋势,但没有显著性差异,如图 5B所示。上述结果说明,ADF激活PD小鼠肠道内能量代谢,可能会促进PD小鼠肠紧密连接的修复。
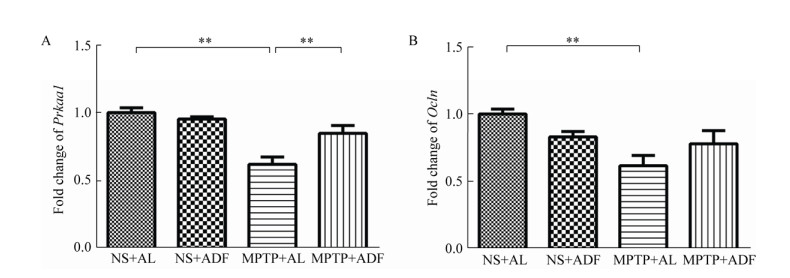
|
| 图 5 ADF促进PD模型小鼠空肠Prkaa1和Ocln表达水平 Figure 5 ADF improve the expression levels of Prkaa1 and Ocln in jejunum of PD model mice 注:A:RT-qPCR检测Prkaa1的表达水平;B:RT-qPCR检测Ocln的表达水平;n=6. **:P < 0.01. Note: A: Detected Prkaa1 expression in jejunum by RT-qPCR; B: Detected Ocln expression in jejunum by RT-qPCR; n=6. **: P < 0.01. |
|
|
为探究ADF对PD模型小鼠肠紧密连接ZO-1的影响,通过RT-qPCR和Western blotting的方法检测肠紧密连接蛋白ZO-1的表达水平。
RT-qPCR结果显示,在mRNA水平,与NS+AL组相比,MPTP+AL组小鼠空肠的Tjp1呈现出显著的降低(P < 0.01),而MPTP+ADF组ZO-1的表达比MPTP+AL组明显上升(P < 0.01),如图 6A所示。Western blotting的结果显示,MPTP+AL组相较于NS+AL组小鼠,ZO-1也呈现降低趋势,但与NS+AL组小鼠相比并无统计学意义,然而MPTP+ADF组相比MPTP+AL组ZO-1的表达明显升高(P < 0.05),如图 6B所示。上述结果表明,ADF可能对PD疾病条件下ZO-1的丢失有更显著的缓解作用。
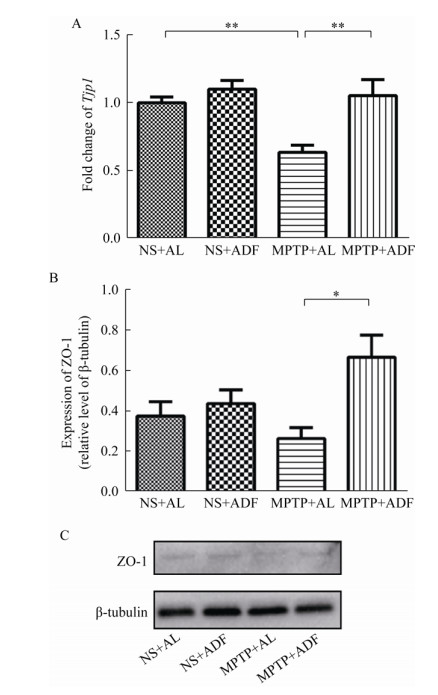
|
| 图 6 ADF缓解PD模型小鼠空肠ZO-1的丢失 Figure 6 ADF alleviat the loss of ZO-1 in jejunum of PD model mice 注:A:RT-qPCR检测Tjp1的表达水平(n=6);B、C:Western blotting检测ZO-1的表达水平(n=4). *:P < 0.05;**:P < 0.01. Note: A: Detected Tjp1 expression in jejunum by RT-qPCR (n=6); B, C: Detected ZO-1 expression in jejunum by western blotting (n=4). *: P < 0.05; **: P < 0.01. |
|
|
本研究选择ADF作为饮食限制的研究方式,发现ADF组小鼠进食日的食物摄入量显著高出AL组小鼠,但是17个循环末总摄食量保持相近水平,这表明ADF对肠道屏障功能的保护作用并非由于摄食量的减少,而是摄食频次的周期性变化。
小鼠行为学实验中PD模型小鼠运动能力下降,一方面证明PD模型构建成功,另一方面证明ADF显著改善了PD模型小鼠运动功能障碍,这与以往ADF对PD具有神经保护作用的研究结果一致[25]。值得关注的是,本研究首次发现PD模型小鼠空肠绒毛组织出现断裂、破损和水肿,肠绒毛上皮细胞的完整性遭到破坏,而ADF在一定程度上可以修复PD模型小鼠受损的空肠绒毛形态结构,说明ADF对PD模型小鼠肠道屏障具有保护作用。
艾克曼菌属位于肠道黏液层,通过降解黏液层粘蛋白获得能量[26]。其中,嗜粘蛋白-艾克曼菌(Akkermansia muciniphila)是一株严格厌氧菌,其已被证实可通过修复黏液层,在高脂喂养诱导的肥胖模型小鼠体内逆转其肠道病理变化,改善肠道屏障功能[27];然而,在高血红素铁膳食诱导下的小鼠肠道中A. muciniphila的相对丰度显著升高,其黏液层却有一定损伤[28]。临床研究发现PD患者肠道菌群中艾克曼菌属表达水平升高[29-30]。本研究在PD模型小鼠体内检测到艾克曼菌科的相对丰度较正常小鼠显著升高。推测倍增的艾克曼菌属过量消耗粘蛋白,促使黏液层变薄,肠屏障功能受到损伤[31]。研究发现,禁食节律引起肠道菌群的周期性变化有助于肠道菌群的构成改变[32]。本研究发现ADF可有效阻止艾克曼菌科在PD模型小鼠肠道中的异常升高,这提示ADF对PD模型小鼠肠屏障功能的保护作用与调节肠道菌群紊乱有关,艾克曼菌科可能发挥关键作用。目前,尚无法确定艾克曼菌科中发挥关键作用的有益菌株,这也是未来值得研究与讨论的重点。
Claudin蛋白家族为跨膜的紧密连接蛋白,参与紧密连接的屏障功能和跨膜转运功能[33]。研究发现,PD患者结肠上皮紧密连接蛋白Occludin下降[22, 34],本研究中首次检测到由MPTP诱导的PD模型小鼠空肠中Occludin的表达水平显著下降,而ADF对PD模型小鼠空肠Occludin的表达有一定恢复作用。ZO蛋白家族是膜外周蛋白[35],主要参与肠道屏障信号传导、细胞增殖与分化、免疫调节和上皮细胞极性形成等过程[36]。AMPK在钙开关诱导的ZO-1组装期间被激活,增强紧密连接组装[37],并且促进上皮分化与细胞极性的建立[38]。本次研究中关注到ZO-1的表达水平在PD模型小鼠空肠中显著下降,而ADF可以挽救PD模型小鼠空肠ZO-1的丢失;同时也发现,ADF激活PD模型小鼠空肠中Prkaa1的表达。这些结果提示ADF可能通过激活AMPK,促进PD模型小鼠肠紧密连接的表达,修复受损的肠屏障功能。
综上所述,本文首次发现ADF对PD模型小鼠肠道屏障的保护作用,探索其机制可能与维持肠道菌群中艾克曼菌科相对丰度及肠内环境稳态、提高肠紧密连接的表达有关。接下来,我们需要深入探究饮食节律对肠道屏障的保护作用机制,这将为预防和治疗帕金森病提供更广的思路。
| [1] |
Shannon KM, Keshavarzian A, Dodiya HB, et al. Is alpha-synuclein in the colon a biomarker for premotor Parkinson's disease? Evidence from 3 cases[J]. Movement Disorders, 2012, 27(6): 716-719. DOI:10.1002/mds.25020 |
| [2] |
Tereshchenko LV, Anisimov VN, Shul'govsky VV, et al. Early changes in saccadic eye movement in hemiparkinsonian MPTP-treated monkeys[J]. Perception, 2015, 44(8/9): 1054-1063. |
| [3] |
Sun MF, Shen YQ. Dysbiosis of gut microbiota and microbial metabolites in Parkinson's disease[J]. Ageing Research Reviews, 2018, 45: 53-61. DOI:10.1016/j.arr.2018.04.004 |
| [4] |
Braak H, de Vos RAI, Bohl J, et al. Gastric α-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology[J]. Neuroscience Letters, 2006, 396(1): 67-72. |
| [5] |
Anton S, Leeuwenburgh C. Fasting or caloric restriction for healthy aging[J]. Experimental Gerontology, 2013, 48(10): 1003-1005. DOI:10.1016/j.exger.2013.04.011 |
| [6] |
Amigo I, Kowaltowski AJ. Dietary restriction in cerebral bioenergetics and redox state[J]. Redox Biology, 2014, 2: 296-304. |
| [7] |
Tinsley GM, la Bounty PM. Effects of intermittent fasting on body composition and clinical health markers in humans[J]. Nutrition Reviews, 2015, 73(10): 661-674. DOI:10.1093/nutrit/nuv041 |
| [8] |
Cignarella F, Cantoni C, Ghezzi L, et al. Intermittent fasting confers protection in CNS autoimmunity by altering the gut microbiota[J]. Cell Metabolism, 2018, 27(6): 1222-1235.E6. DOI:10.1016/j.cmet.2018.05.006 |
| [9] |
Catterson JH, Khericha M, Dyson MC, et al. Short-term, intermittent fasting induces long-lasting gut health and TOR-independent lifespan extension[J]. Current Biology, 2018, 28(11): 1714-1724.e4. DOI:10.1016/j.cub.2018.04.015 |
| [10] |
Mayer EA, Tillisch K, Gupta A. Gut/brain axis and the microbiota[J]. Journal of Clinical Investigation, 2015, 125(3): 926-938. DOI:10.1172/JCI76304 |
| [11] |
Valles-Colomer M, Falony G, Darzi Y, et al. The neuroactive potential of the human gut microbiota in quality of life and depression[J]. Nature Microbiology, 2019, 4(4): 623-632. DOI:10.1038/s41564-018-0337-x |
| [12] |
Jakobsson HE, Rodríguez-Piñeiro AM, Schütte A, et al. The composition of the gut microbiota shapes the colon mucus barrier[J]. EMBO Reports, 2015, 16(2): 164-177. DOI:10.15252/embr.201439263 |
| [13] |
Liu SR, da Cunha AP, Rezende RM, et al. The host shapes the gut microbiota via fecal microRNA[J]. Cell Host & Microbe, 2016, 19(1): 32-43. |
| [14] |
Bercik P, Denou E, Collins J, et al. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice[J]. Gastroenterology, 2011, 141(2): 599-609.E3. DOI:10.1053/j.gastro.2011.04.052 |
| [15] |
Schmidt C. Mental health: thinking from the gut[J]. Nature, 2015, 518(7540): S12-S14. DOI:10.1038/518S13a |
| [16] |
Vogt NM, Kerby RL, Dill-McFarland KA, et al. Gut microbiome alterations in Alzheimer's disease[J]. Scientific Reports, 2017, 7: 13537. DOI:10.1038/s41598-017-13601-y |
| [17] |
Joscelyn J, Kasper LH. Digesting the emerging role for the gut microbiome in central nervous system demyelination[J]. Multiple Sclerosis Journal, 2014, 20(12): 1553-1559. |
| [18] |
Hsiao EY, McBride SW, Hsien S, et al. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders[J]. Cell, 2013, 155(7): 1451-1463. DOI:10.1016/j.cell.2013.11.024 |
| [19] |
Scheperjans F, Aho V, Pereira PAB, et al. Gut microbiota are related to Parkinson's disease and clinical phenotype[J]. Movement Disorders, 2015, 30(3): 350-358. DOI:10.1002/mds.26069 |
| [20] |
Scheperjans F. The prodromal microbiome[J]. Movement Disorders, 2018, 33(1): 5-7. |
| [21] |
Molendijk I, van der Marel S, Maljaars PWJ. Towards a food pharmacy: immunologic modulation through diet[J]. Nutrients, 2019, 11(6): 1239. DOI:10.3390/nu11061239 |
| [22] |
Fang X. Impaired tissue barriers as potential therapeutic targets for Parkinson's disease and amyotrophic lateral sclerosis[J]. Metabolic Brain Disease, 2018, 33(4): 1031-1043. DOI:10.1007/s11011-018-0239-x |
| [23] |
Wang XY, Liu YL, Li S, et al. Asparagine attenuates intestinal injury, improves energy status and inhibits AMP-activated protein kinase signalling pathways in weaned piglets challenged with Escherichia coli lipopolysaccharide[J]. British Journal of Nutrition, 2015, 114(4): 553-565. DOI:10.1017/S0007114515001877 |
| [24] |
Bayliss JA, Lemus MB, Stark R, et al. Ghrelin-AMPK signaling mediates the neuroprotective effects of calorie restriction in Parkinson's disease[J]. Journal of Neuroscience, 2016, 36(10): 3049-3063. DOI:10.1523/JNEUROSCI.4373-15.2016 |
| [25] |
Duan WZ, Mattson MP. Dietary restriction and 2-deoxyglucose administration improve behavioral outcome and reduce degeneration of dopaminergic neurons in models of Parkinson's disease[J]. Journal of Neuroscience Research, 1999, 57(2): 195-206. |
| [26] |
Forsyth CB, Shannon KM, Kordower JH, et al. Increased intestinal permeability correlates with sigmoid mucosa alpha-synuclein staining and endotoxin exposure markers in early Parkinson's disease[J]. PLoS One, 2011, 6(12): e28032. DOI:10.1371/journal.pone.0028032 |
| [27] |
Everard A, Belzer C, Geurts L, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(22): 9066-9071. DOI:10.1073/pnas.1219451110 |
| [28] |
Ijssennagger N, Belzer C, Hooiveld GJ, et al. Gut microbiota facilitates dietary heme-induced epithelial hyperproliferation by opening the mucus barrier in colon[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(32): 10038-10043. DOI:10.1073/pnas.1507645112 |
| [29] |
Pellegrini C, Antonioli L, Colucci R, et al. Interplay among gut microbiota, intestinal mucosal barrier and enteric neuro-immune system: a common path to neurodegenerative diseases?[J]. Acta Neuropathologica, 2018, 136(3): 345-361. DOI:10.1007/s00401-018-1856-5 |
| [30] |
Hill-Burns EM, Debelius JW, Morton JT, et al. Parkinson's disease and Parkinson's disease medications have distinct signatures of the gut microbiome[J]. Movement Disorders, 2017, 32(5): 739-749. DOI:10.1002/mds.26942 |
| [31] |
Ganesh BP, Klopfleisch R, Loh G, et al. Commensal Akkermansia muciniphila exacerbates gut inflammation in Salmonella typhimurium-infected gnotobiotic mice[J]. PLoS One, 2013, 8(9): e74963. DOI:10.1371/journal.pone.0074963 |
| [32] |
Patterson RE, Sears DD. Metabolic effects of intermittent fasting[J]. Annual Review of Nutrition, 2017, 37: 371-393. DOI:10.1146/annurev-nutr-071816-064634 |
| [33] |
Fanning AS, Mitic LL, Anderson JM. Transmembrane proteins in the tight junction barrier[J]. Journal of the American Society of Nephrology, 1999, 10(6): 1337-1345. |
| [34] |
Sikiric P, Rotkvic I, Mise S, et al. Dopamine agonists prevent duodenal ulcer relapse: a comparative study with famotidine and cimetidine[J]. Digestive Diseases and Sciences, 1991, 36(7): 905-910. DOI:10.1007/BF01297139 |
| [35] |
González-Mariscal L, Quirós M, Díaz-Coránguez M. ZO proteins and redox-dependent processes[J]. Antioxidants & Redox Signaling, 2011, 15(5): 1235-1253. |
| [36] |
Umeda K, Ikenouchi J, Katahira-Tayama S, et al. ZO-1 and ZO-2 independently determine where claudins are polymerized in tight-junction strand formation[J]. Cell, 2006, 126(4): 741-754. DOI:10.1016/j.cell.2006.06.043 |
| [37] |
Zhu MJ, Sun XF, Du M. AMPK in regulation of apical junctions and barrier function of intestinal epithelium[J]. Tissue Barriers, 2018, 6(2): 1-13. |
| [38] |
Chelakkot C, Ghim J, Ryu SH. Mechanisms regulating intestinal barrier integrity and its pathological implications[J]. Experimental & Molecular Medicine, 2018, 50(8): 103. |
 2020, Vol. 47
2020, Vol. 47