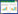扩展功能
文章信息
- 周杨, 万强, 蔡芷荷, 卢勉飞, 杨绪伟, 吴清平, 曲晓莹
- ZHOU Yang, WAN Qiang, CAI Zhi-He, LU Mian-Fei, YANG Xu-Wei, WU Qing-Ping, QU Xiao-Ying
- 可视化和实时荧光环介导恒温扩增技术快速检测原料乳中的沙门氏菌
- Rapid detection of Salmonella in raw milk by visual and real-time fluorescence loop-mediated isothermal amplification-based methods
- 微生物学通报, 2020, 47(11): 3741-3755
- Microbiology China, 2020, 47(11): 3741-3755
- DOI: 10.13344/j.microbiol.china.200155
-
文章历史
- 收稿日期: 2020-02-27
- 接受日期: 2020-07-07
- 网络首发日期: 2020-08-06
2. 广东省微生物研究所 广东 广州 510070;
3. 广东环凯生物科技有限公司 广东 肇庆 526238
2. Guangdong Institute of Microbiology, Guangzhou, Guangdong 510070, China;
3. Guangdong Huankai Biological Science and Technology Company Limited, Zhaoqing, Guangdong 526238, China
沙门氏菌(Salmonella)属于一种肠杆菌科的革兰氏阴性直杆菌,广泛分布于自然界中,是常见的食源性致病菌之一,其血清型繁多(截至目前已发现多达2 200种),具有极强的传播性[1-2]。沙门氏菌可通过多种食物、饲料以及粪便等感染、寄生于人和动物的肠道中,并引发胃肠炎、肠热症、败血症、伤寒、流产甚至是中毒死亡等病症,严重威胁着人和动物的生命健康[1-3]。据统计,在全球报道的所有食源性致病菌中毒患者中,由沙门氏菌感染的患者其占比高居首位,而在我国该占比更是高达70%-80%[4]。在日常生活中,沙门氏菌可通过被其污染的食物进入体内,若超过一定的量(如106-107 CFU/g),便可造成机体感染中毒,因此,各类法规均规定在乳品类、水产类以及肉制品类等食物中不得检出沙门氏菌[5]。随着社会的发展,营养丰富的乳制品已然是人们日常生活中不可或缺的食品,乳制品的食用安全性,尤其是在其生产过程中的各项质量管控被人们高度重视。原料乳品质的好坏直接关系到乳制品质量的优劣,而在乳制品的生产和加工环节中,原料乳又极易被多种致病菌污染。其中,以沙门氏菌为例,一旦原料乳被其污染,便可随之进入到生产中的各个环节,造成大面积污染,而且其产生的大量毒素残留会最终进入到各类乳制品中,具有极强的传播性和危害性,因此,对原料乳进行严格的沙门氏菌检测和控制是确保乳制品安全的重要环节之一[6-8]。当前,食品中沙门氏菌的检验一般遵照国标GB 4789.4-2016[9]中给出的预增菌、增菌、可疑菌分离、生化鉴定以及血清学试验等方法进行检验,该过程需要熟练技术人员并配置专门实验条件才能完成,普遍存在操作繁琐、耗时长、成本高等不足之处。加之原料乳保鲜时间短,后续又有紧凑的生产加工环节,因此很有必要研究建立一种简便快速且适用于原料乳中沙门氏菌检测的方法。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是由Notomi等最先报道提出的一种分子检测技术,其原理是针对被检测目的基因的6个序列区段设计4条特异性引物(包括FIP、BIP、F3、B3),在具有链置换特性的Bst DNA聚合酶作用下,在恒温条件下实现对目的基因的高效扩增,期间通过相关辅助手段观测扩增产物,从而实现对含有该目的基因物种的快速检测[10]。目前,LAMP技术已被广泛应用于致病微生物的检测中,且有关沙门氏菌的LAMP检测方法也多有报道,如欧新华等建立了基于LAMP技术的沙门氏菌属检测方法,并经电泳法评价其效用[11];徐义刚等建立了通过观察反应产物浊度判断结果的沙门氏菌LAMP方法[12];关玉婷等建立了一种以羟基萘酚蓝为显色指示剂的沙门氏菌可视化LAMP检测方法[13];Yang等建立了一种检测食品和饲料中沙门氏菌的LAMP实时生物荧光分析方法[14];Liu等建立的多重LAMP方法可经观测产物溶解曲线有效区分沙门氏菌和副溶血性弧菌[15];Hu等通过一种新型的实时荧光LAMP方法成功检测肠炎沙门氏菌[16]。上述方法各采用了不同的LAMP扩增产物观测手段,虽然均能检测到沙门氏菌,但其具体效果不一,或无具体论述,或其检测体系尚需要进一步优化和验证,尤其是涉及原料乳中沙门氏菌检测的相关实际应用报道较少提及。因此,本研究拟建立两种沙门氏菌LAMP检测方法,分别为以钙黄绿素为指示剂的V-LAMP方法[17]和以SYBR Green Ⅰ为荧光染料的RF-LAMP方法[18],经特异性、灵敏度、稳定性以及原料乳样品检测等试验,综合评价两种方法的实际检测效用,为原料乳中沙门氏菌的快速检测提供参考。
1 材料与方法 1.1 菌株8株沙门氏菌标准菌株,包括鼠伤寒沙门氏菌(Salmonella typhimurium) ATCC14028、鼠伤寒沙门氏菌(S. typhimurium) CMCC(B)50115、肠炎沙门氏菌(S. enteritidis) CMCC(B)50335、甲型副伤寒沙门氏菌(S. paratyphi A) CMCC(B)50093、乙副伤寒沙门氏菌(S. paratyphi B) CMCC(B)50004、乙副伤寒沙门氏菌(S. paratyphi B) CMCC(B)50094、伤寒沙门氏菌(S. typhi) CMCC(B)50071和伤寒沙门氏菌(S. typhi) CMCC(B)50098;38株非沙门氏菌标准菌株,包括大肠埃希氏菌(Escherichia coli) CMCC(B)44102、表皮葡萄球菌(Staphylococcus epidermidis) CMCC(B)26069、大肠埃希氏菌(E. coli) ATCC8739、枯草芽孢杆菌(Bacillus subtilis) ATCC6633、小肠结肠炎耶尔森氏菌(Yersinia enterocolitica) CMCC(B)52204、大肠埃希氏菌O157:H7 (E. coli O157:H7) NCTC12900、奇异变形杆菌(Proteus mirabilis) CMCC(B)49005、单核细胞增生李斯特菌(Listeria monocytogenes) ATCC19115、空肠弯曲杆菌(Campylobacter jejuni) ATCC33291、白色念珠菌(Candida albicans) ATCC10231、英诺克李斯特菌(L. innocua) ATCC33090、金黄色葡萄球菌(Staphylococcus aureus) CMCC(B)26003、嗜肺军团菌(Legionella pneumophilia) ATCC33152、金黄色葡萄球菌(S. aureus) ATCC25923、金黄色葡萄球菌(S. aureus) ATCC6538、铜绿假单胞菌(Pseudomonas aeruginosa) CMCC(B)10104、生孢梭菌(Clostridium sporogenes) ATCC19404、肺炎链球菌(Streptococcus pneumoniae) CMCC(B)31001、蜡样芽孢杆菌(B. cereus) ATCC11778、肺炎克雷伯氏菌(Klebsiella pneumoniae) CMCC(B)46117、鲍氏志贺氏菌(Shigella boydii) ATCC9207、弗氏柠檬酸杆菌(Citrobacter freundii) ATCC43864、痢疾志贺氏菌(S. dysenteriae) CMCC(B)51056、斯氏李斯特氏菌(L. seeligeri) ATCC35967、创伤弧菌(Vibrio vulnificus) ATCC27562、粪肠球菌(Enterococcus faecali) ATCC33186、副溶血性弧菌(V. parahaemolyticus) ATCC33847、苏云金芽胞杆菌(B. thuringiensis) ATCC10792、阪崎克罗诺杆菌(Cronobacter sakazakii) ATCC51329、格氏李斯特氏菌(L. grayi) ATCC25401、蕈状芽胞杆菌(B. mycoides) ATCC10206、甲型溶血性链球菌(Streptococcus hemolytic-α) CMCC(B)32213、溶藻弧菌(V. alginolyticus) ATCC 17749、伊氏李斯特氏菌(L. ivanovii) ATCC19119、乙型溶血性链球菌(S. hemolytic-β) CMCC(B)32210、粘质沙雷氏菌(Serratia marcescens) ATCC14041、产气肠杆菌(Enterobacter aerogenes) ATCC13048和普通变形杆菌(P. vulgaris) CMCC(B)49027。以上菌株均由广东环凯微生物科技有限公司提供。
1.2 主要试剂和仪器缓冲蛋白胨水(buffered peptone water,BPW) (225 mL装)、四硫磺酸钠煌绿增菌液(10 mL装)、亚硒酸盐胱氨酸增菌液(10 mL装)、亚硫酸铋琼脂、沙门氏菌显色培养基、三糖铁琼脂、沙门氏菌生化鉴定试剂盒,广东环凯微生物科技有限公司;细菌基因组DNA提取试剂盒、DNA分子量标准Marker LD 100 bp Ladder Plus,广州东盛生物科技有限公司;甜菜碱、Tris-Base、MgCl2、盐酸、十二烷基硫酸钠、钙黄绿素、乙二胺四乙酸二钠,广州化学试剂厂;Bst DNA聚合酶以及10×ThermoPol Buffer,NEB公司;SYBR Green I,Lumiprobe公司;引物,生工生物工程(上海)股份有限公司。73份原料乳样品取自光明乳业在不同厂区的奶罐车,其中,广州地区14份,北京地区34份,上海地区25份,另外10份用于人工污染试验的原料乳样品取自广州地区。
实时荧光定量PCR仪,ABI公司;自动螺旋接种仪,Don Whitley Scientific公司;电泳仪,上海天能科技有限公司;凝胶成像分析系统,UVItec公司;恒温金属浴,杭州博日科技股份有限公司;超微量分光光度计,Implen公司。
1.3 方法 1.3.1 LAMP最优反应体系和反应条件的建立选用已报道的沙门氏菌特异性基因invA[19]为检测靶基因,并根据NCBI数据库中公布的invA (登录号为U43238.1)基因序列,通过在线软件Primer Explorer V5 (http://primerexplorer.jp/lampv5e/index.html)设计得到LAMP引物组,该引物组详细信息见表 1。合成表 1中的引物F3、B3、LF、LB、FIP和BIP,并按照特定浓度比例(F3:B3:LF:LB:FIP:BIP=1:1:4:4:8:8,1代表 0.2 μmol/L)加入至LAMP反应体系中,预先设置该LAMP反应中涉及的主要反应参数梯度值,逐一进行试验,其反应产物经1.5%琼脂糖凝胶电泳观察,并根据梯状条带强弱获取各个参数对应的最优值。另外,本研究涉及的V-LAMP方法即向以上反应体系中加入钙黄绿素显色液[20],在恒温金属浴中反应,通过观察反应产物颜色变化判定结果;RF-LAMP方法即向以上反应体系中加入荧光染料SYBR Green I[21-22],在荧光定量PCR仪中反应,通过实时观察荧光曲线图判定结果。
| Primers name | Sequence (5′→3′) |
| F1c | GCAACACATAGCCAAGCTCC |
| B1c | GAACGCGCTTGATGAGCTTT |
| F2 | CAGTATTTCTGGGTAACGCA |
| B2 | ATACCGAAATATTCATTGACGT |
| F3 | CATCAGCAAGGTAGCAGT |
| B3 | AGCATATGTTTTGTTTCCTGA |
| LF | GGAGTTTCTCCCCCTCTTCA |
| LB | ACCACTGTCTGGCGGTGAC |
| FIP | GCAACACATAGCCAAGCTCCCAGTATTTCTGGGTAACGCA |
| BIP | GAACGCGCTTGATGAGCTTTATACCGAAATATTCATTGACGT |
分别取38株标准菌株纯菌培养物,经热裂解法制备其对应的DNA样品,具体操作步骤为:取30 μL无菌水于PCR管中,向其中挑取标准菌株纯菌培养物并充分悬浮,通过恒温金属浴99 ℃热裂解10 min,12 000 r/min离心15 min,上清即为待检的DNA样品,可在-20 ℃存放待用。分别通过V-LAMP方法和RF-LAMP方法检测上述制备的38份DNA样品,期间每份DNA样品设置3个平行测试,并观察统计结果。
1.3.3 灵敏度试验(1) 精提取DNA测试
向BPW中接入沙门氏菌CMCC(B)50071纯菌培养物,36±1 ℃培养18-24 h后取该增菌液,参照细菌基因组DNA提取试剂盒精提取对应的DNA,并经超微量分光光度计测定浓度为37 ng/μL。通过无菌水梯度稀释该精提取DNA,依次稀释101、102、103、104、105、106、107和108倍,得到对应浓度分别为3.7×100、3.7×10-1、3.7×10-2、3.7×10-3、3.7×10-4、3.7×10-5、3.7×10-6和3.7×10-7 ng/μL的8份稀释DNA样品,该8份样品各取3 μL分别通过V-LAMP方法和RF-LAMP方法检测,期间每份DNA样品设置3个平行测试,并观察统计结果。
(2) 纯菌培养物测试
挑取沙门氏菌CMCC(B)50071纯菌培养物置于27 mL无菌生理盐水中,充分悬浮,并通过无菌生理盐水梯度稀释该菌悬液,依次稀释101、102、103、104、105、106、107和108倍,得到8份纯菌稀释液样品。各取以上8份样品制备对应的DNA样品3 μL分别通过V-LAMP方法和RF-LAMP方法检测,期间每份DNA样品设置3个平行测试。其中,DNA样品具体制备方法为:取100 μL纯菌稀释液样品于PCR管中,以6 000 r/min的速度离心5 min,去除上清,加入30 μL无菌水充分悬浮,后续参照1.3.2进行操作。另外,各取以上8份纯菌稀释液样品100 μL,参照GB 4789.2-2016[23],经螺旋计数法测定其各自对应的含菌量。比对上述LAMP方法检测和螺旋计数结果,并通过公式[检出限(CFU)=本V-LAMP方法或RF-LAMP方法检测为阳性结果所对应的最高稀释倍数的100 μL纯菌稀释液含菌量/10]换算得到其检出限。LAMP方法检测取样量为3 μL,即约为制备的每份30 μL纯菌稀释液DNA样品的1/10。
1.3.4 稳定性试验根据研究得到的LAMP最优反应体系,分别配制V-LAMP和RF-LAMP方法对应的反应预混液,并参照1.3.3中精提取DNA灵敏度测试结果,以浓度约为3.7×10-3 ng/μL的沙门氏菌精提取DNA为阳性检测样品,以无菌水为阴性检测样品,在不同的检测时间、实验室和检测人员条件下,分别进行V-LAMP和RF-LAMP方法测试,上述同一测试反应均设置10个平行反应,统计分析其检测结果,其中,重复率=检测结果同实际结果一致数/检测总数×100%。
1.3.5 原料乳样品中沙门氏菌检测效用的比较(1) 人工污染样品检测
参照1.3.3中纯菌培养物灵敏度测试结果,取沙门氏菌CMCC(B)50071纯菌培养物,通过无菌生理盐水以10倍比梯度稀释,辅以螺旋计数,判定其各稀释液对应的含菌量,最终得到浓度约为1.3×102 CFU/mL的稀释液,记作阳性菌稀释液。取来自于广州奶厂的原料乳样品10份,参照GB 4789.4-2016[9],经标准方法检测并确证其中未受沙门氏菌污染,取10份225 mL装BPW,向其中依次对应加入上述10份原料乳样品25 mL,充分混匀,并依次取该混合液9 mL置于对应的10个无菌试管中,最后分别向上述10个试管加入1 mL阳性菌稀释液,充分混匀,并各取1 mL混合液制备相应的DNA样品。具体制备步骤为:取1 mL混合液于1.5 mL离心管中,以6 000 r/min的速度离心5 min,去除上清,并加入30 μL无菌水,充分悬浮,后续参照1.3.2中进行操作。该制备的DNA样品各取3 μL分别通过V-LAMP方法和RF-LAMP方法检测,每份DNA样品设置3个平行测试,并观察统计结果。
(2) 实际样品检测
参照GB 4789.4-2016[9],取各原料乳样品25 mL,加入到225 mL装BPW中,充分混匀,36±1 ℃培养18-24 h,取该增菌液1 mL制备实际原料乳样品对应的DNA样品,具体步骤参照上述人工污染样检测中DNA样品制备进行。该制备的DNA样品各取3 μL分别通过V-LAMP方法和RF-LAMP方法检测,每份DNA样品设置3个平行测试。同时,另取上述各原料乳样品对应的增菌液,并参照GB 4789.4-2016[9]经标准方法检测。观察并统计V-LAMP方法、RF-LAMP方法以及标准方法检测结果,其中,检出率=阳性检测结果样品例数/被检样品总例数×100%。另外,参照ISO 16140:2003[24]和SN/T 2775-2011[25],以标准方法为参照方法,分别评价V-LAMP方法和RF-LAMP方法的相对特异性、相对敏感度、相对准确率以及一致性。
相对特异性=相对于标准方法检测结果同时为阴性样品例数/(相对于标准方法检测结果同时为阴性样品例数+相对于标准方法检测结果判定为假阳性样品例数)×100%;
相对敏感度=相对于标准方法检测结果同时为阳性样品例数/(相对于标准方法检测结果同时为阳性样品例数+相对于标准方法检测结果判定为假阴性样品例数)×100%;
相对准确率=(相对于标准方法检测结果同时为阳性样品例数+相对于标准方法检测结果同时为阴性样品例数)/总被检样品例数×100%。
一致性通过卡方(χ2)检验,χ2=(|相对于标准方法检测结果判定为假阳性样品例数-相对于标准方法检测结果判定为假阴性样品例数|-1)2/(相对于标准方法检测结果判定为假阳性样品例数+相对于标准方法检测结果判定为假阴性样品例数)。当χ2 < 3.84时,表示被评价检测方法与参照方法无统计学差异;当χ2≥3.84时,表示被评价检测方法与参照方法有统计学差异[25]。
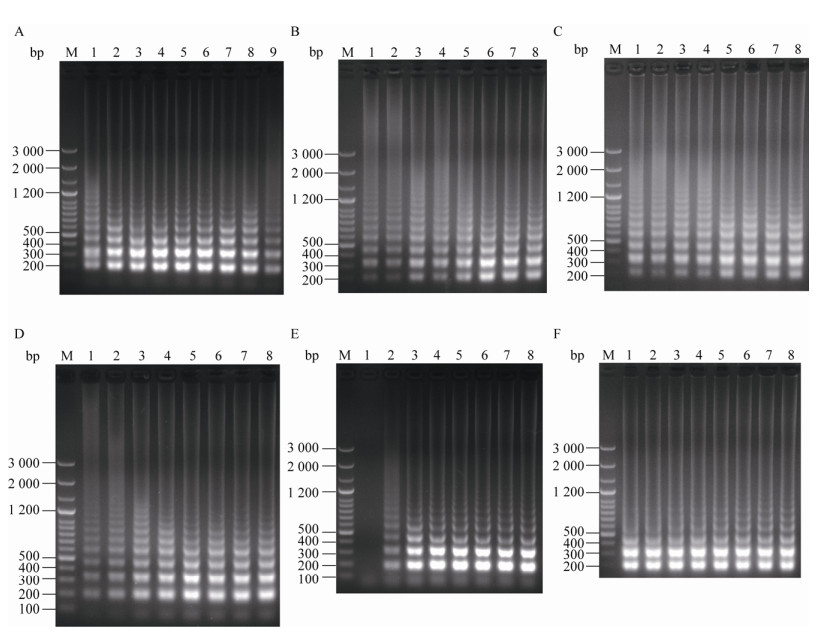
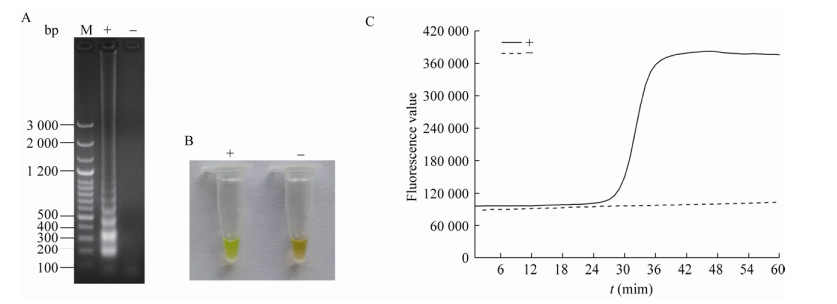
2 结果与分析 2.1 LAMP最优反应体系和反应条件的建立通过一系列反应参数测试试验,取氯化镁最优终浓度为0.4 mmol/L、甜菜碱最优终浓度为1.2 mol/L、Bst DNA聚合酶最优终浓度为0.224 U/μL、dNTPs最优终浓度为0.4 mmol/L、最优反应时间为55 min以及最优反应温度为62 ℃,见图 1。确定总体积为25 μL的LAMP反应体系,具体为:反应预混液(包括氯化镁、Bst DNA聚合酶、dNTPs、甜菜碱、10×buffer 2.5 μL、LAMP引物组和无菌水) 18 μL、显色液或荧光染料4 μL、DNA样品3 μL。另外,该LAMP反应体系的阴性、阳性样品反应产物经琼脂糖凝胶电泳观察,阳性产物条带清晰,阴性产物则未见条带,见图 2A。针对V-LAMP方法,反应结束后通过肉眼观察并判读结果,反应产物为荧光绿色时表示结果阳性,反应产物前后未出现明显变色时表示结果阴性,见图 2B。针对RF-LAMP方法,出现S型扩增曲线表示结果阳性,未出现S型扩增曲线表示结果阴性,见图 2C。另外,在RF-LAMP反应体系中,设置不同的SYBR Green I浓度逐一进行测试,观察不同浓度的SYBR Green I对应的荧光曲线图,经对比该不同荧光曲线、起峰高度差值以及起峰时间等,选取最优SYBR Green I浓度为1.2×,见图 3A;同时将其对应的反应产物经琼脂糖凝胶电泳观察,得知其各自梯状条带强弱无明显差异,见图 3B。
|
| 图 1 LAMP反应体系中不同组分浓度以及反应条件测试凝胶电泳图 Figure 1 Gel electrophoretogram for the efficiency tests of LAMP reaction systems with different component concentrations and reaction conditions 注:A:不同浓度的氯化镁反应凝胶电泳图,1-9分别表示氯化镁浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8和0.9 mmol/L;B:不同浓度的甜菜碱反应凝胶电泳图,1-8分别表示甜菜碱浓度为0.2、0.4、0.6、0.8、1.0、1.2、1.4和1.6 mol/L;C:不同浓度的Bst DNA聚合酶反应凝胶电泳图,1-8分别表示Bst DNA聚合酶浓度为0.064、0.096、0.128、0.160、0.192、0.224、0.256和0.288 U/μL;D:不同浓度的dNTPs反应凝胶电泳图,1-8分别表示dNTPs浓度为0.08、0.16、0.24、0.32、0.40、0.48、0.56和0.64 mmol/L;E:不同反应时间对应的凝胶电泳图,1-8分别表示反应时间为5、15、25、35、45、55、65和75 min;F:不同反应温度对应的凝胶电泳图,1-8分别表示反应温度为59、60、61、62、63、64和65 ℃. M:LD 100 bp Ladder Plus. Note: A: Gel electrophoretogram for the LAMP test with different concentrations of MgCl2, and 1-9 represent 0.1, 02, 0.3, 0.4, 0.5, 0.6, 0.7, 08 and 0.9 mmol/L, respectively; B: Gel electrophoretogram for the LAMP test with different concentrations of betaine, and 1-8 represent 0.2, 0.4, 0.6, 0.8, 1.0, 1.2, 1.4 and 1.6 mol/L, respectively; C: Gel electrophoretogram for the LAMP test with different concentrations of Bst DNA polymerase, and 1-8 represent 0.064, 0.096, 0.128, 0.160, 0.192, 0.224, 0.256 and 0.288 U/μL, respectively; D: Gel electrophoretogram for the LAMP test with different concentrations of dNTPs, and 1-8 represent 0.08, 0.16, 0.24, 0.32, 0.40, 0.48, 0.56 and 0.64 mmol/L, respectively; E: Gel electrophoretogram for the LAMP test with different times, and 1-8 represent 5, 15, 25, 35, 45, 55, 65 and 75 min, respectively; F: Gel electrophoretogram for the LAMP test with different temperature, and 1-8 represent 59, 60, 61, 62, 63, 64 and 65 ℃, respectively; M: LD 100 bp Ladder Plus. |
|
|
|
| 图 2 阴性、阳性结果对应的LAMP凝胶电泳图、V-LAMP显色图以及RF-LAMP曲线图 Figure 2 The positive and negative results of LAMP gel electrophoretogram, V-LAMP chromogram and RF-LAMP curve graph 注:A:LAMP凝胶电泳图;B:V-LAMP显色图;C:RF-LAMP曲线图. M:LD 100 bp Ladder Plus;+:阳性样品;–:阴性样品. Note: A: LAMP gel electrophoretogram; B: V-LAMP chromogram; C: RF-LAMP curve graph. M: LD 100 bp Ladder Plus; +: Salmonella positive result; –: Salmonella negative result. |
|
|
|
| 图 3 RF-LAMP不同荧光染料浓度测试的曲线图以及其对应的凝胶电泳图 Figure 3 Curve graph and gel electrophoretogram for the efficiency test of RF-LAMP reaction systems with different concentrations of fluorescent dye 注:A:荧光曲线图;B:凝胶电泳图. M:LD 100 bp Ladder Plus;1-9分别表示荧光染料浓度为0.4×、0.6×、0.8×、1.0×、1.2×、1.4×、1.6×、1.8×、2.0×. Note: A: Fluorescence curve graph; B: Gel electrophoretogram. M: LD 100 bp Ladder Plus; 1-9: The concentrations of fluorescent dye are 0.4×, 0.6×, 0.8×, 1.0×, 1.2×, 1.4×, 1.6×, 1.8× and 2.0×, respectively. |
|
|
对于8株沙门氏菌标准菌株样品,经V-LAMP方法检测,其对应的反应管均表现为显著的荧光绿色,结果为阳性;经RF-LAMP方法检测,均可观察到显著的S型荧光扩增曲线,结果为阳性。对于38株非沙门氏菌标准菌株样品,经V-LAMP方法检测,其对应的反应管在反应前后均未出现明显颜色变化,结果为阴性;经RF-LAMP方法检测,均未出现明显的S型荧光扩增曲线,结果为阴性。V-LAMP方法和RF-LAMP方法相比较,二者检测结果完全一致,而且与菌株实际结果完全相符,具体见表 2。
| 菌株来源 Strain source | V-LAMP方法 V-LAMP method | RF-LAMP方法 RF-LAMP method |
| ATCC14028 | + | + |
| CMCC(B)50115 | + | + |
| CMCC(B)50335 | + | + |
| CMCC(B)50093 | + | + |
| CMCC(B)50004 | + | + |
| CMCC(B)50094 | + | + |
| CMCC(B)50071 | + | + |
| CMCC(B)50098 | + | + |
| CMCC(B)44102 | - | - |
| CMCC(B)26069 | - | - |
| ATCC8739 | - | - |
| ATCC6633 | - | - |
| CMCC(B)52204 | - | - |
| NTCT12900 | - | - |
| CMCC(B)49005 | - | - |
| ATCC19115 | - | - |
| ATCC33291 | - | - |
| ATCC10231 | - | - |
| ATCC33090 | - | - |
| CMCC(B)26003 | - | - |
| ATCC33152 | - | - |
| ATCC25923 | - | - |
| ATCC6538 | - | - |
| CMCC(B)10104 | - | - |
| ATCC19404 | - | - |
| CMCC(B)31001 | - | - |
| ATCC11778 | - | - |
| CMCC(B)46117 | - | - |
| ATCC9207 | - | - |
| ATCC43864 | - | - |
| CMCC(B)51056 | - | - |
| ATCC35967 | - | - |
| ATCC27562 | - | - |
| ATCC33186 | - | - |
| ATCC33847 | - | - |
| ATCC10792 | - | - |
| ATCC51329 | - | - |
| ATCC25401 | - | - |
| ATCC10206 | - | - |
| CMCC(B)32213 | - | - |
| ATCC17749 | - | - |
| ATCC19119 | - | - |
| CMCC(B)32210 | - | - |
| ATCC14041 | - | - |
| ATCC13048 | - | - |
| CMCC(B)49027 | - | - |
| 注:+:检测结果为阳性;-:检测结果为阴性. Note: +: Positive test result; -: Negative test result. | ||
(1) 精提取DNA测试
在DNA浓度为3.7×10-3-3.7×100 ng/μL时,经V-LAMP方法检测,其对应的反应管均表现为显著的荧光绿色,为阳性结果,而其他DNA浓度样品为阴性结果,见图 4A;经RF-LAMP方法检测,其对应的反应管均可观察到显著的S型荧光扩增曲线,为阳性结果,而其他DNA浓度样品为阴性结果,见图 4B;V-LAMP方法和RF-LAMP方法相比较,二者检测结果完全一致。另外,将上述测试对应的反应产物经琼脂糖凝胶电泳观察,得知阳性样品反应产物见明显梯状条带,而阴性样品反应产物未见明显条带,见图 4C。
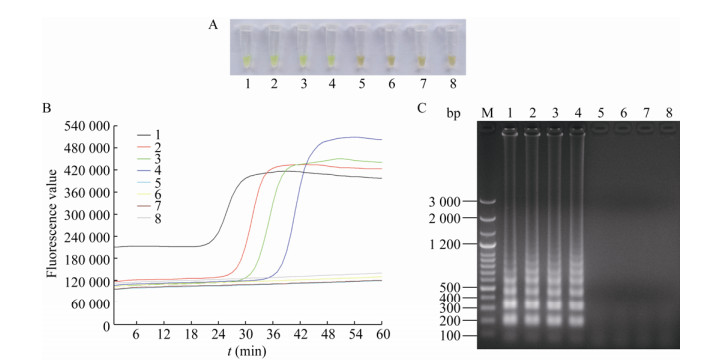
|
| 图 4 精提取DNA灵敏度测试对应的V-LAMP显色图、RF-LAMP曲线图以及LAMP凝胶电泳图 Figure 4 The results of LAMP gel electrophoretogram, V-LAMP chromogram and RF-LAMP curve graph for accurately purified DNA sensitivity test 注:A:V-LAMP显色图;B:RF-LAMP曲线图;C:LAMP凝胶电泳图. M:LD 100 bp Ladder Plus;1-8分别表示精提取DNA浓度为3.7×100、3.7×10-1、3.7×10-2、3.7×10-3、3.7×10-4、3.7×10-5、3.7×10-6和3.7×10-7 ng/μL. Note: A: V-LAMP chromogram; B: RF-LAMP curve graph; C: LAMP gel electrophoretogram. M: LD 100 bp Ladder Plus; 1-8: The concentrations of accurately purified DNA are 3.7×100, 3.7×10-1, 3.7×10-2, 3.7×10-3, 3.7×10-4, 3.7×10-5, 3.7×10-6 and 3.7×10-7 ng/μL, respectively. |
|
|
(2) 纯菌培养物测试
在纯菌培养物浓度为1.3×101-1.3×105 CFU/mL时,经V-LAMP方法检测,其对应的反应管均表现为显著的荧光绿色,为阳性结果,而其他DNA浓度样品为阴性结果,见图 5A;经RF-LAMP方法检测,其对应的反应管均可观察到显著的S型荧光扩增曲线,为阳性结果,而其他DNA浓度样品为阴性结果,见图 5B;V-LAMP方法和RF-LAMP方法相比较,二者检测结果完全一致。另外,将上述测试对应的反应产物经琼脂糖凝胶电泳观察,阳性样品反应产物见明显梯状条带,而阴性样品反应产物未见明显条带,见图 5C。总体上,通过灵敏度测试可知,该两种方法检测结果与其各自对应的梯状条带产物相互对应,无明显差异,而且进一步确定该两种方法其检测灵敏度高,检出限可达到1.3×101 CFU/mL。
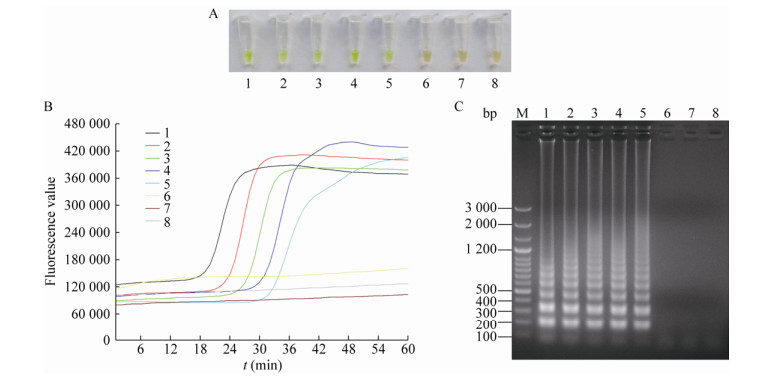
|
| 图 5 纯菌培养物灵敏度测试对应的V-LAMP显色图、RF-LAMP曲线图以及LAMP凝胶电泳图 Figure 5 The results of LAMP gel electrophoretogram, V-LAMP chromogram and RF-LAMP curve graph for pure bacterial culture sensitivity test 注:A:V-LAMP显色图;B:RF-LAMP曲线图;C:LAMP凝胶电泳图. M:LD 100 bp Ladder Plus;1-9分别表示纯菌培养物浓度为1.3×105、1.3×104、1.3×103、1.3×102、1.3×101、1.3×100、< 1和 < 1 CFU/mL. Note: A: V-LAMP chromogram; B: RF-LAMP curve graph; C: LAMP gel electrophoretogram. M: LD 100 bp Ladder Plus; 1-8: The concentrations of pure bacterial culture are 1.3×105, 1.3×104, 1.3×103, 1.3×102, 1.3×101, 1.3×100, < 1 and < 1 CFU/mL, respectively. |
|
|
在不同的检测时间、实验室和检测人员条件下,V-LAMP方法和RF-LAMP方法的检测重复率均为100%,见表 3。
| 操作条件 Operating conditions | V-RT-LAMP method | RF-RT-LAMP method | 检测重复率 Accordance rate (%) | |||
| 阴性检测样品 Negative control samples | 阳性检测样品 Positive control samples | 阴性检测样品 Negative control samples | 阳性检测样品 Positive control samples | |||
| Time 1 | 10:0 | 0:10 | 10:0 | 0:10 | 100 | |
| Time 2 | 10:0 | 0:10 | 10:0 | 0:10 | ||
| Time 3 | 10:0 | 0:10 | 10:0 | 0:10 | ||
| Laboratory 1 | 10:0 | 0:10 | 10:0 | 0:10 | 100 | |
| Laboratory 2 | 10:0 | 0:10 | 10:0 | 0:10 | ||
| Laboratory 3 | 10:0 | 0:10 | 10:0 | 0:10 | ||
| Inspector 1 | 10:0 | 0:10 | 10:0 | 0:10 | 100 | |
| Inspector 2 | 10:0 | 0:10 | 10:0 | 0:10 | ||
| Inspector 3 | 10:0 | 0:10 | 10:0 | 0:10 | ||
经检测人工污染样品,V-LAMP和RF-LAMP方法相比,二者检测结果完全一致,均能全部检出该10样品,见表 4,而且进一步证实该两种方法其检出限可达到1.3×101 CFU/mL。经检测73份实际样品,标准方法、V-LAMP方法和RF-LAMP方法三者检出率分别为6.8% (5/73)、12.3% (9/73)和13.7% (10/73),另外,以上3种方法检测上海地区样品的检出率分别为16.0% (4/25)、24.0% (6/25)和28.0% (7/25),明显高于北京和广州地区样品,具体数据见表 4。相对于标准方法,计算得到V-LAMP方法和RF-LAMP方法的相对特异性、相对敏感度、相对准确率以及一致性比较χ2值,见表 5,表明V-LAMP方法和RF-LAMP方法均与标准方法无明显差异(χ2 < 3.84,P > 0.05)。
| 样品类别 Sample type | 检出率(阳性检测结果样品例数/总被检样品例数) Detection rate sample (positive sample cases/total sample cases) (% (n/n)) | ||
| 标准方法 Standard method | V-LAMP方法 V-LAMP method | RF-LAMP方法 RF-LAMP method | |
| 人工污染样品 Artificially contaminated samples | - | 100 (10/10) | 100 (10/10) |
| 实际样品 Real samples | 6.8 (5/73) | 12.3 (9/73) | 13.7 (10/73) |
| 广州样品 Samples from Guangzhou | 0 (0/14) | 7.1 (1/14) | 7.1 (1/14) |
| 北京样品 Samples from Beijing | 2.9 (1/34) | 5.9 (2/34) | 5.9 (2/34) |
| 上海样品 Samples from Shanghai | 16.0 (4/25) | 24.0 (6/25) | 28.0 (7/25) |
| 注:-:可不用检测. Note: -: Without detection. | |||
| 检测方法 Detection method | 阳性结果 例数(例) Positive cases (n) | 阴性结果 例数(例) Negative cases (n) | 假阳性结果 例数(例) False-positive cases (n) | 假阴性结果例数(例) False-negative cases (n) | 相对特异性 Relative specificity (%) | 相对敏感度 Relative sensitivity (%) | 相对准确率 Relative accuracy (%) | χ2值 χ2 value |
| 标准方法 Standard method | 5 | 68 | 0 | 0 | - | - | - | - |
| V-LAMP方法 V-LAMP method | 9 | 64 | 4 | 0 | 94.12 | 100 | 94.52 | 2.25 |
| RF-LAMP方法 RF-LAMP method | 10 | 63 | 5 | 0 | 92.65 | 100 | 93.15 | 3.20 |
| 注:-:可不用统计分析. Note: -: Without statistical analysis. | ||||||||
有关食源性致病菌检测的传统方法多包括目标菌分离、形态学观察以及生化鉴定等繁琐过程,难以满足面向市场的一些快速检测需求,随着时代的发展,新的技术方法正在逐步进入致病微生物检验领域,其中较为典型的是酶联免疫技术和核酸检测技术。酶联免疫技术是基于抗原抗体特异性结合并产生偶联信号而检测样品中的特殊蛋白,从而实现对与该蛋白关联的目标致病菌的检测,如Western blotting法和试纸条检测法[26-28]。不过该类方法尚存不足,如抗体制备费用高昂、抗原抗体非特异性结合、抗体稳定性不足、结果易受到样品中其他蛋白干扰[26, 28]以及实际检测灵敏度低等。核酸检测技术直接检测特异性核酸,并具备适用范围广、特异性好、灵敏度高以及结果稳定等特点,如PCR法[29-30]、Southern blotting法[31]以及基因芯片[32]等。LAMP方法属于典型的核酸检测技术,而其相对于PCR方法,具备恒温反应扩增、检测灵敏度高、操作流程简便以及成本低等优点,而且正在被大量应用于致病微生物检测领域。在现有的研究报道中,多会以invA[19]基因作为目标检测基因进行沙门氏菌相关的核酸检测,本研究取该invA基因部分特异性片段设计对应的LAMP反应引物组,该引物组序列与已报道的LAMP引物序列均不同,具有唯一性。同时详细测试了该LAMP反应不同参数选取值,发现各个反应参数在低数值范围时均会降低LAMP反应效率,随着该参数数值增加,其LAMP反应效率会逐步升高,而该参数增加到一定数值时,其LAMP反应效率无明显变化,即达到一个上限,尤其是从参数Bst DNA聚合酶浓度、dNTPs浓度以及反应时间选取值的测试中均有体现(图 1C、D和E)。可见,LAMP扩增效率的高低是基于其各个反应组分和条件综合作用的结果,若其中某一参数值过低,势必会影响到整体的扩增效率;若其中某一参数值过高,但其他参数值未能相应增加,其整体的扩增效率也不会得到明显提升,甚至会出现降低(图 1A显示氯化镁终浓度高于0.7 mmol/L时其产物条带明显减弱)。本研究通过对LAMP反应不同参数选取值的优化,最终获取了最优的LAMP反应体系和条件,可保障其更高的扩增效率,也可确保各个反应组分适量加入,避免浪费。
LAMP扩增产物即为大量的目标检测基因片段,目前已报道有多种方法观测该产物,包括:(1)电泳法[11-12],经琼脂糖凝胶电泳观察是否有梯状条带出现,直接明了,但由于LAMP检测灵敏度高,需要重点避免气溶胶污染和样品交叉污染发生,而电泳法势必会暴露扩增产物于空气中,进而增加污染的风险[33]。另外,该法还需配套电泳仪、凝胶成像仪以及制备琼脂糖胶等,整体过程较为繁琐。(2)浑浊度观测法[12, 34],包括肉眼直接观察和仪器实时观察,其中,肉眼观察主观性强且无法有效留存数据结果,而用浊度仪可实时观察浊度变化,但该类仪器成本高,在一定程度上限制了其推广应用。(3)指示剂显色法[13, 17],向反应体系中加入指示剂,后经肉眼观察反应前后的颜色变化即可判读,当前常用的指示剂如钙黄绿素(反应前加入)、羟基萘酚蓝(反应前加入)以及高浓度的SYBR Green I (反应后加入),该法可达到可视化检测的效果,无需仪器,尤其是选取反应前加入的指示剂还可避免开盖污染,但在具体应用时,选取的不同指示剂其浓度配比、显色效果以及对LAMP扩增效率的影响等尚无明确定论。另外,经肉眼观察颜色变化也存在一定的主观性,可能会影响到最终结果的判定。(4)荧光染料法,即向反应体系中加入荧光染料,如SYBR Green I[21-22]、LC Green[35]以及EvaGreen[36]等,可实时观察到整个反应荧光曲线图,并保存有详细的数据结果,而且该法与当前被广泛应用的荧光定量PCR检测技术类似,易于被行业市场接受,但需要成本较高的荧光检测仪。由上可见,不同的LAMP产物观测方法各有利弊。
本研究建立了基于钙黄绿素显色液的V-LAMP方法和基于SYBR Green I荧光染料的RF-LAMP方法,其中,广东环凯微生物科技有限公司之前有报道过V-LAMP方法[20],并给出了相应的钙黄绿素显色液,相较于其他研究报道,该显色液具有特定的组分浓度配比,且显色效果明显;RF-LAMP方法中,本研究则重点测试了SYBR Green I浓度对反应的影响,并选取了其最优浓度,同时也发现了较低浓度的SYBR Green I对LAMP扩增效率无明显影响。另外,本研究还详细对比测试了该两种方法的特异性和灵敏度,证实其检测效果相当,且其检出限均可达到13 CFU/mL,这在之前相关研究中鲜有报道。
在进行酶联免疫相关检测时,原料乳中富含的多种蛋白质会对其结果产生较大影响[28],而核酸检测方法则可有效避免该影响,加之目前经LAMP技术方法检测原料乳中沙门氏菌的相关报道较少,因此本研究建立了用于检测原料乳中沙门氏菌的V-LAMP和RF-LAMP方法。经检测人工污染的原料乳样品,V-LAMP和RF-LAMP方法均能有效检测出阳性结果,检测灵敏度符合预期,两种方法无明显差异;经检测实际原料乳样品,并与标准方法检测结果相比较,该两种LAMP方法其检出率均略高于标准方法,可能是LAMP方法的检测灵敏度更高所致,或者是假阳性情况,又或是标准方法可能出现的个别样品漏检情况。但是从整体上看,通过相对特异性、相对敏感度、相对准确率以及一致性分析,表明V-LAMP方法和RF-LAMP方法分别与标准方法相比无明显差异(P > 0.05)。另外,上海地区样品的检出率明显高于北京和广州地区样品,提示上海地区原料乳可能存在沙门氏菌污染风险,需要加以重视。
综上所述,本研究设计具备唯一性的LAMP反应引物组,并详细测试得到最优的LAMP反应体系和条件,详细对比了V-LAMP方法和RF-LAMP方法的检测特异性和灵敏度。同时,将该两种LAMP方法应用于原料乳中沙门氏菌的检测,并详细分析了其相对于标准方法的检测特异性和敏感度等指标,证实该两种LAMP方法其检测效用相当、结果可靠,适用原料乳中沙门氏菌的快速检测,其应用前景值得期待。
| [1] |
Nwabor OF, Dickson ID, Ajibo QC. Epidemiology of Salmonella and Salmonellosis[J]. International Letters of Natural Sciences, 2015, 47: 54-73. DOI:10.18052/www.scipress.com/ILNS.47.54 |
| [2] |
Chen L, Zhang JM, Yang XJ, et al. Advances in Salmonella subtyping - a review[J]. Microbiology China, 2016, 43(3): 648-654. (in Chinese) 陈玲, 张菊梅, 杨小鹃, 等. 沙门氏菌分型研究进展[J]. 微生物学通报, 2016, 43(3): 648-654. |
| [3] |
Faulder KE, Simmonds K, Robinson JL. The epidemiology of childhood Salmonella infections in Alberta, Canada[J]. Foodborne Pathogens and Disease, 2017, 14(6): 364-369. DOI:10.1089/fpd.2016.2259 |
| [4] |
Huang X, Huang Q, Dun ZJ, et al. Nontyphoidal Salmonella infection, Guangdong province, China, 2012[J]. Emerging Infectious Diseases, 2016, 22(4): 726-729. DOI:10.3201/eid2204.151372 |
| [5] |
Huang BY, She ZY, Lin YW, et al. Comparison of detection of Salmonella in food by four methods[J]. Science and Technology of Food Industry, 2014, 35(15): 185-187, 192. (in Chinese) 黄宝莹, 佘之蕴, 林耀文, 等. 四种方法检测食品中沙门氏菌的比较[J]. 食品工业科技, 2014, 35(15): 185-187, 192. |
| [6] |
Amagliani G, Petruzzelli A, Carloni E, et al. Presence of Escherichia coli O157, Salmonella spp., and Listeria monocytogenes in raw ovine milk destined for cheese production and evaluation of the equivalence between the analytical methods applied[J]. Foodborne Pathogens and Disease, 2016, 13(11): 626-632. DOI:10.1089/fpd.2016.2159 |
| [7] |
Gao WR, Chen QS, Pang GC, et al. Analysis and identification on contaminated status of microorganism in raw milk in northwest regions[J]. Food Science and Technology, 2011, 36(2): 285-289. (in Chinese) 高文茹, 陈庆森, 庞广昌, 等. 西北地区原料奶沙门氏菌污染程度鉴定与分析[J]. 食品科技, 2011, 36(2): 285-289. |
| [8] |
Liu Y, Xu XX, Zhao N. The rapid detection and control methods for the air microorganism during production process of raw milk[J]. Journal of Food Safety and Quality, 2014, 5(11): 3632-3637. (in Chinese) 刘洋, 许晓曦, 赵楠. 原料乳生产中空气源微生物的快速检测及控制方法[J]. 食品安全质量检测学报, 2014, 5(11): 3632-3637. |
| [9] |
National Health and Family Planning Commission of PRC, China Food and Drug Administration. GB 4789.4-2016 Microbiological examination of food hygiene-examination of Salmonella[S]. Beijing: China Standards Press, 2017 (in Chinese) 国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 4789.4-2016食品安全国家标准食品微生物学检验沙门氏菌检验[S].北京: 中国标准出版社, 2017 |
| [10] |
Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): E63. DOI:10.1093/nar/28.12.e63 |
| [11] |
Ou XH, Zhang RS, Song KY, et al. Establishment of rapid detection of Salmonella with loop-mediated isothermal amplification[J]. Practical Preventive Medicine, 2008, 15(6): 1945-1947. (in Chinese) 欧新华, 张如胜, 宋克云, 等. 环介导等温扩增(LAMP)技术检测沙门菌属方法的建立[J]. 实用预防医学, 2008, 15(6): 1945-1947. |
| [12] |
Xu YG, Cui LC, Yang JH, et al. Development of a loop-mediated isothermal amplification method with fim Y gene for rapid detection of Salmonella in food[J]. Chinese Veterinary Science, 2010, 40(5): 452-458. (in Chinese) 徐义刚, 崔丽春, 杨君宏, 等. 食品中沙门氏菌DNA环介导等温扩增快速检测方法的建立[J]. 中国兽医科学, 2010, 40(5): 452-458. |
| [13] |
Guan YT, Liu D, Chang J, et al. Visual loop-mediated isothermal amplification assay for the detection of Salmonella and preliminary detection in raw milk[J]. Food Science and Technology, 2019, 44(11): 357-361. (in Chinese) 关玉婷, 刘东, 常江, 等. 沙门氏菌可视化环介导等温扩增检测方法的建立及初步应用[J]. 食品科技, 2019, 44(11): 357-361. |
| [14] |
Yang QR, Domesle KJ, Wang F, et al. Rapid detection of Salmonella in food and feed by coupling loop-mediated isothermal amplification with bioluminescent assay in real-time[J]. BMC Microbiology, 2016, 16(1): 112. |
| [15] |
Liu NW, Zou DY, Dong DR, et al. Development of a multiplex loop-mediated isothermal amplification method for the simultaneous detection of Salmonella spp. and Vibrio parahaemolyticus[J]. Scientific Reports, 2017, 7(1): 45601. DOI:10.1038/srep45601 |
| [16] |
Hu LJ, Ma LM, Zheng SM, et al. Development of a novel loop-mediated isothermal amplification (LAMP) assay for the detection of Salmonella ser. Enteritidis from egg products[J]. Food Control, 2018, 88: 190-197. DOI:10.1016/j.foodcont.2018.01.006 |
| [17] |
Suebsing R, Kampeera J, Sirithammajak S, et al. Colorimetric method of loop-mediated isothermal amplification with the pre-addition of calcein for detecting Flavobacterium columnare and its assessment in tilapia farms[J]. Journal of Aquatic Animal Health, 2015, 27(1): 38-44. DOI:10.1080/08997659.2014.966212 |
| [18] |
Kuang WG, Luo LX, Gao WN, et al. Development of a real-time fluorescence loop-mediated isothermal amplification assay for detection of Burkholderia gladioli pv. alliicola[J]. Journal of Phytopathology, 2017, 165(2): 82-90. DOI:10.1111/jph.12539 |
| [19] |
Ramin AG, Alizadeh F. Detection of Salmonella spp. carriers using invA gene amplification in equine feces[J]. Ippologia, 2012, 23(1): 25-31. |
| [20] |
Zhou Y, Wan Q, Cai ZH, et al. Loop-mediated isothermal amplification-based rapid detection for Shigella dysenteriae in food samples[J]. Microbiology China, 2017, 44(9): 2247-2254. (in Chinese) 周杨, 万强, 蔡芷荷, 等. 环介导等温扩增技术在食品中痢疾志贺氏菌快速检测[J]. 微生物学通报, 2017, 44(9): 2247-2254. |
| [21] |
Deb R, Sengar GS, Singh U, et al. Application of a loop-mediated isothermal amplification assay for rapid detection of cow components adulterated in buffalo milk/meat[J]. Molecular Biotechnology, 2016, 58(12): 850-860. DOI:10.1007/s12033-016-9984-4 |
| [22] |
Singh R, Singh DP, Savargaonkar D, et al. Evaluation of SYBR green I based visual loop-mediated isothermal amplification (LAMP) assay for genus and species-specific diagnosis of malaria in P. vivax and P. falciparum endemic regions[J]. Journal of Vector Borne Diseases, 2017, 54(1): 54-60. |
| [23] |
National Health and Family Planning Commission of PRC, China Food and Drug Administration. GB 4789.2-2016 National food safety standard food microbiological examination: Aerobic plate count[S]. Beijing: China Standards Press, 2017 (in Chinese) 国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 4789.2-2016食品安全国家标准食品微生物学检验菌落总数测定[S].北京: 中国标准出版社, 2017 |
| [24] |
International Organization for Standardization. ISO 16140-2-2016 Microbiology of the food chain-method validation-Part 2: Protocol for the validation of alternative (proprietary) methods against a reference method[S]. Beijing: China State Bureau of Technical Supervision, 2016 (in Chinese) 国际标准化组织. ISO 16140-2-2016食物链的微生物学-方法验证.第2部分: 参考法替代(专有)方法验证协议[S].北京: 中国国家技术监督局, 2016 |
| [25] |
The People's Republic of China, China Food and Drug Administration. SN/T 2775-2011 Methods for the evaluation of commercial test kits food testing purpose[S]. Beijing: China Standards Press, 2011 (in Chinese) 中华人民共和国国家食品药品监督管理总局. SN/T 2775-2011商品化食品检测试剂盒评价方法[S].北京: 中国标准出版社, 2011 |
| [26] |
Larsen A, Corva S, Panei J, et al. Enzyme-linked immunosorbent assays using the recombinant gp51 and p24 of Bovine Leukemia Virus for immunodetection of the disease[J]. Open Journal of Animal Sciences, 2017, 7(3): 241-253. DOI:10.4236/ojas.2017.73019 |
| [27] |
Wu WD, Li M, Chen M, et al. Development of a colloidal gold immunochromatographic strip for rapid detection of Streptococcus agalactiae in tilapia[J]. Biosensors and Bioelectronics, 2017, 91: 66-69. DOI:10.1016/j.bios.2016.11.038 |
| [28] |
Song CM, Liu C, Wu SY, et al. Development of a lateral flow colloidal gold immunoassay strip for the simultaneous detection of Shigella boydii and Escherichia coli O157:H7 in bread, milk and jelly samples[J]. Food Control, 2016, 59: 345-351. DOI:10.1016/j.foodcont.2015.06.012 |
| [29] |
Nguyen TT, van Giau V, Vo TK. Multiplex PCR for simultaneous identification of E. coli O157:H7, Salmonella spp. and L. monocytogenes in food[J]. Biotech, 2016, 6(2): 205. |
| [30] |
Yang L, Hu WZ, Jiang AL, et al. Research progress in molecular biology methods for detection of Salmonella[J]. Science and Technology of Food Industry, 2016, 37(9): 372-375, 379. (in Chinese) 杨柳, 胡文忠, 姜爱丽, 等. 分子生物学方法检测沙门氏菌的研究进展[J]. 食品工业科技, 2016, 37(9): 372-375, 379. |
| [31] |
Matloob M, Griffiths M. Ribotyping and automated ribotyping of Listeria monocytogenes[J]. Methods in Molecular Biology, 2014, 1157(4): 85-93. |
| [32] |
Jiang XR, Shao N, Jing WW, et al. Microfluidic chip integrating high throughput continuous-flow PCR and DNA hybridization for bacteria analysis[J]. Talanta, 2014, 122: 246-250. DOI:10.1016/j.talanta.2014.01.053 |
| [33] |
Wan L, Chen TL, Gao J, et al. A digital microfluidic system for loop-mediated isothermal amplification and sequence specific pathogen detection[J]. Scientific Reports, 2017, 7(1): 14586. DOI:10.1038/s41598-017-14698-x |
| [34] |
Chen Z, Yang T, Yang HW, et al. A Portable multi-channel turbidity system for rapid detection of pathogens by loop-mediated isothermal amplification[J]. Journal of Biomedical Nanotechnology, 2018, 14(1): 198-205. DOI:10.1166/jbn.2018.2524 |
| [35] |
Knopkiewicz M, Gawłowska M, Świ'cicki W. The application of high resolution melting in the analysis of simple sequence repeat and single nucleotide polymorphism markers in a pea (Pisum sativum L.) population[J]. Czech Journal of Genetics and Plant Breeding, 2014, 50(2): 151-156. DOI:10.17221/113/2013-CJGPB |
| [36] |
Tang Y, Yu X, Chen H, et al. An immunoassay-based reverse-transcription loop-mediated isothermal amplification assay for the rapid detection of avian influenza H5N1 virus viremia[J]. Biosensors and Bioelectronics, 2016, 86: 255-261. DOI:10.1016/j.bios.2016.06.063 |
 2020, Vol. 47
2020, Vol. 47