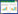扩展功能
文章信息
- 陈宁, 武艺, 刘冰, 许颖, 季宇彬
- CHEN Ning, WU Yi, LIU Bing, XU Ying, JI Yu-Bin
- 电子圆二色谱技术在微生物次级代谢产物结构研究中的应用研究进展
- Progress in the application of electronic circular dichroism technology in the structural study of microbial secondary metabolites
- 微生物学通报, 2020, 47(11): 3699-3708
- Microbiology China, 2020, 47(11): 3699-3708
- DOI: 10.13344/j.microbiol.china.191021
-
文章历史
- 收稿日期: 2019-12-10
- 接受日期: 2020-07-24
- 网络首发日期: 2020-08-07
2. 国家教育部抗肿瘤天然药物工程研究中心 黑龙江 哈尔滨 150076
2. National Center for Anticancer Natural Medicine Engineering, Harbin, Heilongjiang 150076, China
微生物的次级代谢物多含立体化学中心,因其结构的多样性和复杂性而有多种药理性质,在药物研发领域具有重要价值[1]。如来源于大鼠粪便的代谢产物V1和V2均有明显清除自由基的能力[2]。绝对构型的确定是化合物手性结构解析中最具挑战性的任务。对于微生物的次级代谢物绝对构型的确定,现有的方法包括单晶X射线衍射法、不对称合成、核磁共振光谱和手性光学方法等[3-10]。但由于微生物次级代谢产物的获得量少且结构极其复杂,导致仍有一些天然产物的绝对构型难以确定。自20世纪60年代以来,电子圆二色谱(electronic circular dichroism,ECD)凭借其样品用量少且可回收的优点,被证明是一种用于研究各种天然产物绝对构型的强大工具[11]。原则上,使用ECD方法确定绝对构型时,将计算得到的ECD谱图与实验ECD谱图进行对比,从而得出化合物的绝对构型[12]。
1 电子圆二色谱技术原理及其计算 1.1 原理圆二色性(circular dichroism,CD)[13-14],是指平面偏振光通过具有旋光性的介质时,由于介质中同一种旋光活性分子存在手性不同的两种构型,而它们对平面偏振光所分解成的右旋和左旋圆偏振光的吸收系数不同,射出时电场矢量不是圆偏振光,而是椭圆偏振光,从而产生圆二色性。CD谱利用手性化合物对左右圆偏振光吸收系数的不同和测定吸收系数之差随波长的变化来确定手性化合物的绝对构型。
1985年法国物理学家A. Cotton在研究光学活性物质的旋光性时发现了反常的旋光色散(optical rotatory dispersion,ORD)曲线,即直线偏振光透过旋光性物质时产生偏转的现象[15]。典型的圆二色谱有一个波谷和一个波峰,较长波长处的吸收称为第一科顿(cotton)效应,较短波长处的吸收为第二Cotton效应;Cotton效应可以通过圆二色谱带的符号来判断正负,当圆二色谱线出现正峰时称为正的Cotton效应;圆二色谱曲线出现负峰时称为负的Cotton效应[16-17]。每种构型对应特定的CD谱,可以根据CD谱中的Cotton效应来分析手性分子的立体构型。
1.2 计算ECD是一种研究天然产物手性的方法,同时也是一种表征电子跃迁的光谱学方法。其测定原理与紫外光谱相似,所以都需要在溶剂中进行测试。化合物构象的分布遵从玻尔兹曼分布(boltzmann),除了刚性结构外,柔性分子在溶液中往往都含有多个构象,而因其具有的专属性导致每个构象都含有特定的ECD谱,所以一般通过NMR的相关信息来辅助构象分析[18-19]。所以对于ECD的计算来说,如何获得化合物低能量态的构象是确定化合物绝对构型的关键。
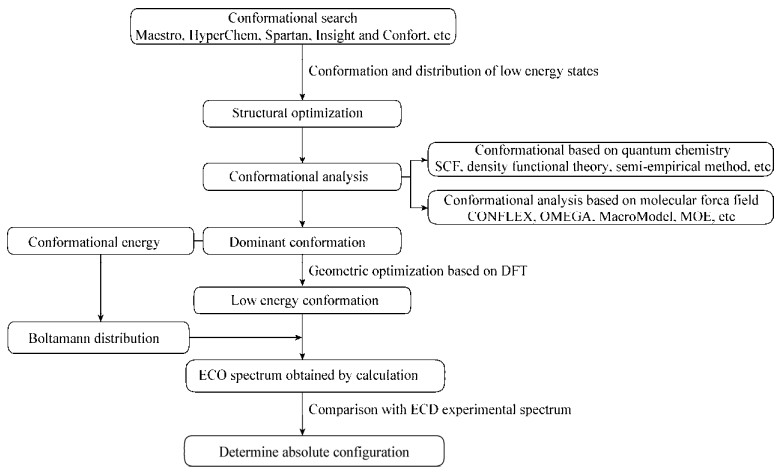
首先要进行构象搜索来确定该分子在溶剂中低能量态构象及分布,目前能够进行构象搜索的软件有Maestro (conformational search)、HyperChem (HypercuBe,gainesville,FL)、Spartan (Wavefunction,Irvine,CA)、Insight (Accerlrys,SanDiego)和Confort (Triposte,MO)等[20-21]。将得到的构象进行分析,包括基于分子力场的构象分析和基于量子化学的构象分析,目前常用的基于分子力场的构象分析软件有CONFLEX、OMEGA、MacroModel和MOE[22-23]等。然而经分子力场分析得到的构象需要通过量子化学法进一步的优化。目前量子化学的计算方法主要有从头计算方法(Ab initio Haree Fock,SCF)、半经验方法(semi-empirical method)和密度泛函理论(density functional theory,DFT)等;从头计算法通过基本的物理常量来求解薛定谔方程,具有很高的计算精度,但是对于计算机资源和计算时间有很大考验;半经验法通过拟合实验结果得到的参数来简化薛定谔方程,但是只适用于有足够原子参数的分子;DFT法和从头算法都是Haree Fock原理来计算,不同的是其简化了多电子体系的计算,目前DFT法在ECD计算中广泛应用[24-27]。常见的DFT有LSDA、B3LYP、B3PW91、MPW1PW91、PBEPBE和PBE1PBE等,其中B3LYP和B3PW91泛函由于计算结果较理想而得到大量使用[28]。除了DFT的选择,量子化学计算还需要选择涉及到描述分子轨道基组的选择。由于基组会影响计算精度与计算时间,基组的选择也是非常重要的;对于DFT和基组的选择主要通过其计算得到的对Cotton效应出峰位置与实验值越接近为最佳;常用的基组有6-31G+(d, p)、6-31G(d)和6-311G++(2dp, 2pd)等[15]。量子化学计算的软件有Gaussian、MOLPR、Q-Chem和Gamess-US等;Gaussian在研究绝对构型方面应用最多;Gaussian软件计算中,对于溶剂效应的处理其可提供Dipole、IEFPCM、CPCM和SMD模型,其中IEFPCM模型为常用模型,在Gaussian软件中为默认处理模型,而CPCM模型比较适合用于极性溶剂体系中[29]。获取低能构象后通过玻尔兹曼公式计算出玻尔兹曼分布率;之后应用几何优化与玻尔兹曼分布率相结合的方法进而得出化合物的模拟ECD谱图;再将计算得到的ECD谱图与实验ECD谱图进行对比,从而得出化合物的绝对构型(图 1)[30]。
|
| 图 1 ECD谱的计算流程 Figure 1 Calculation flow of ECD spectrum |
|
|
ECD目前已经在天然产物绝对构型研究中广泛应用[31-32]。一般在确定相对构型后使用ECD法来确定天然产物的绝对构型。但大多柔性分子在溶液中都含有多个构象,而每个构象都含有特定的ECD谱,所以一般通过其他手段来辅助构象分析。
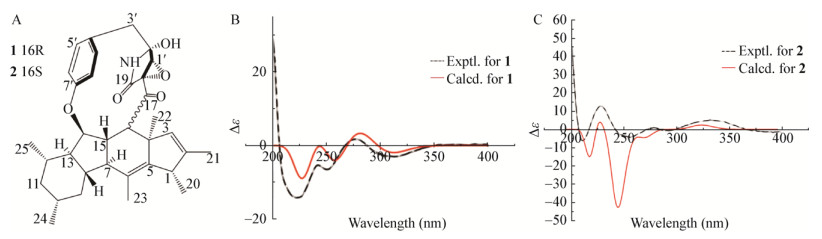
2.1 通过NMR辅助确定天然产物的绝对构型Chen等[33]从红树林内生真菌Didymella sp. CYSK-4的次级代谢产物中分离出3种新的12或13元大环生物碱,命名为Ascomylactams A-C,以及类似物Phomapyrollidone A和Phomapyrollidone C (2) (图 2A);通过NOESY确定其相对构型后在B3LYP/3-21G水平下获得的化合物Ascomylactams C (1) (图 2A)的DFT计算ECD与实验ECD进行了比较,化合物1的实验ECD在225、250和315 nm处表现出负的Cotton效应,在275 nm处表现出较弱的正Cotton效应,这与计算的结果一致;因此,将化合物1的绝对构型确定为(1S, 4R, 7S, 8S, 10R, 12S, 13R, 14R, 15S, 16R, 18R, 1′R, 2′R) (图 2B);经证实化合物2是化合物1在C-16处的差向异构体。通过计算ECD与实验ECD的比较,确定其绝对构型为(1S, 4R, 7S, 8S, 10R, 12S, 13R, 14R, 15S, 16S, 18R, 1′R, 2′R) (图 2C)。
|
| 图 2 化合物1/2的实验和计算ECD光谱(在MeOH溶液中) Figure 2 Experimental and calculated ECD spectra of compound 1/2 (in MeOH) 注:A:化合物1/2的结构;B:化合物1的实验和计算ECD光谱[33];C:化合物2的实验和计算ECD光谱[33]. Note: A: The structure diagram of compound 1/2; B: The experimental and calculated ECD spectra of compound 1[33]; C: The experimental and calculated ECD spectra of compound 2[33]. |
|
|
Li等[34]从南海淤泥真菌Aspergillus versicolor的次级代谢产物中分离得到一种新萜类,命名为Asperversins A (3) (图 3A),其相对结构也通过NOESY得到部分阐明;采用TDDFT方法在B3LYP/6-311+G(d, P)水平上对化合物Asperversins A[(1S, 5S, 6R, 8R, 9R, 10R)-3a和(1R, 5R, 6S, 8S, 9S, 10S)-3b]进行了MeOH下的ECD计算;化合物3的实验ECD与计算得到的3a的ECD曲线吻合较好,确定其绝对构型为(1S, 5S, 6R, 8R, 9R, 10R) (图 3B)[34]。
Flaviphenalenones A (4) (图 4A)是从湿地真菌Aspergillus flavipe PJ03-11的固体培养物中分离出的苯并芘衍生物,根据其质子耦合常数和NOESY确定了其相对构型,为了确定化合物4在C-6处的绝对构型,在B3LYP/6-31++G(d, p)水平上,使用TDDFT方法进行了实验和理论计算ECD之间的比较,6S-4a的ECD谱与化合物4的ECD谱吻合较好;由此推断4的绝对构型为6S[35](图 4B)。
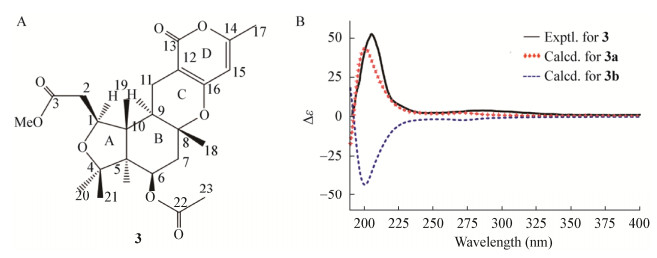
Wang等[36]从海绵共附生真菌Aspergillus sp. SCSIO 41018的次级代谢产物中分离鉴定了3个间苯三酚二聚体Gilluones A-C,其中Gilluone A存在自然界较为罕见的“皇冠”笼状结构,由两个缩酮和一个半缩酮结构片段组成;Gilluones B和C为乙酰化间苯三酚二聚体;在Gilluones B和C之间的生物活性中心(3R, 5R, 15R, 20R)的构型是相同的;采用NOE谱分析并通过比较实验和计算的ECD确定Gilluones C (5) (图 5A)的绝对构型为(3R, 5S, 6S, 15R, 20R) (图 5B)。
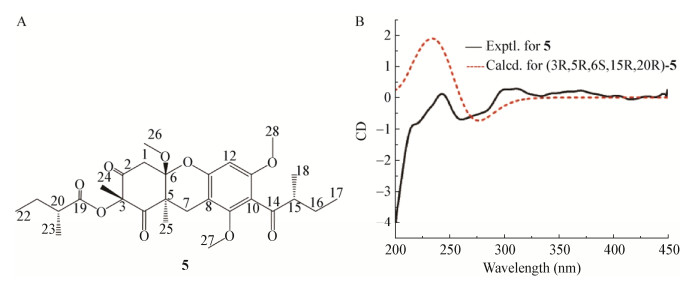
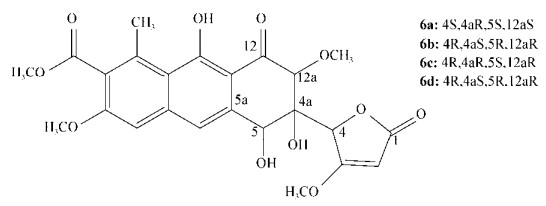
Liu等[37]从海洋来源的放线菌Saccharothrix sp. 10-10的次级代谢产物中分离出Saccharothrizons G (6) (图 6)和H (7),通过对NOE相关分析建立了化合物7的相对构型,并采用TDDFT ECD法在CAM-B3LYP/ TZVP和WB97XD/6-311++G(d, p)水平下(4S, 4aR, 5S, 12aS-6a)的计算曲线与实验谱吻合较好,从而确定了7的绝对构型为(4S, 4aR, 5S, 12aS)(图 7A);此外,根据其相同的分子式(C24H24O11)和相似的核磁共振数据,确定7为6的非对映异构体;通过比较实验和计算ECD确定化合物6的绝对构型为(4R, 4aR, 5S, 12aS-6c)(图 7B)。
|
| 图 6 化合物6的结构 Figure 6 Structure of compound 6 |
|
|
大多通过ECD确定绝对构型的天然产物都通过结合NMR的相关信息来辅助构象分析,但对于结构较复杂的化合物需要通过多种手性光学技术来协同确立其绝对构型,一般是ORD和振动圆二色谱(vibrational circular dichroism,VCD)。
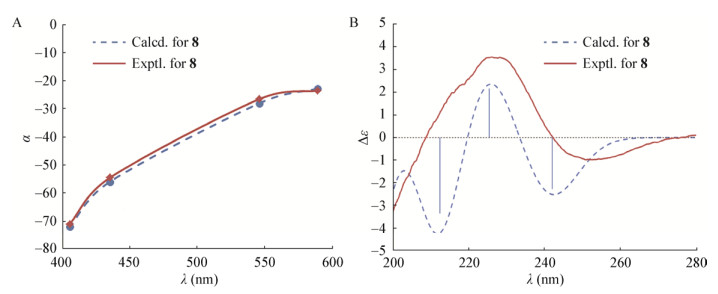
Mazzeo等[38]在P培养滤液中分离得到白色结晶固体化合物8 (图 8),在充分优化后得到了4个稳定构象;在B3LYP/aug-cc-pVDZ水平下,通过TDDFT计算得到的理论ORD曲线;玻尔兹曼平均后,将计算出的ORD与实验曲线进行比较,理论曲线很好地再现了实验ORD曲线,得到化合物8的绝对构型为(3S, 4aR, 8S, 8aR) (图 9A);ECD光谱是在CAM-B3LYP/aug-cc-pVDZ水平上,通过TDDFT计算得到的理论曲线,得到的ECD谱在210、225和242 nm处有3个跃迁;与实验得到的ECD谱图进行比较,两者吻合较好;尽管在210 nm处显示负Cotton效应在实验ECD谱中不可见;尽管存在这些小的差异,得到化合物8的绝对构型为(3S, 4aR, 8S, 8aR)与ORD分析一致(图 9B)。
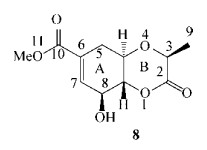
|
| 图 8 化合物8的结构 Figure 8 Structure of compound 8 |
|
|
Zhu等[39]从海洋真菌Aspergillus sp. ZA-01中分离得到化合物Aspergixanthone A (9) (图 10A),但由于化合物9的C-14和C-15是自由旋转的,所以单一方法很难确定其绝对构型;化合物9可能有8种绝对构型,分别是(14R, 15R, 20S, 25R)、(14R, 15S, 20S, 25R)、(14S, 15R, 20S, 25R)和(14S, 15S, 20S, 25R)及其对映体;首先对(14R, 15R, 20S, 25R)、(14R, 15S, 20S, 25R)、(14S, 15R, 20S, 25R)和(14S, 15S, 20S, 25R)在B3LYP/6-311++G(2d, p)水平进行了TDDFT计算,4种非对映体的ECD预测曲线与实测的ECD谱吻合良好,得到C-20和C-25处的绝对构型分别为20S和25R (图 10B);在CH3OH隐式CPCM溶剂化模型中,在B3LYP/6-311+G(2d, p)水平上对4种非对映体进行了ORD计算,得到的ORD数据可以用来排除(14S, 15R, 20S, 25R)和(14S, 15S, 20S, 25R)两种构型(图 10C);然后在PBEPBE/6-311+G(d)水平计算(14R, 15R, 20S, 25R)和(14R, 15S, 20S, 25R)的VCD频率,比较9的实验和计算VCD数据,表明结构(14R, 15R, 20S, 25R)接近9的真实结构(图 10D)。
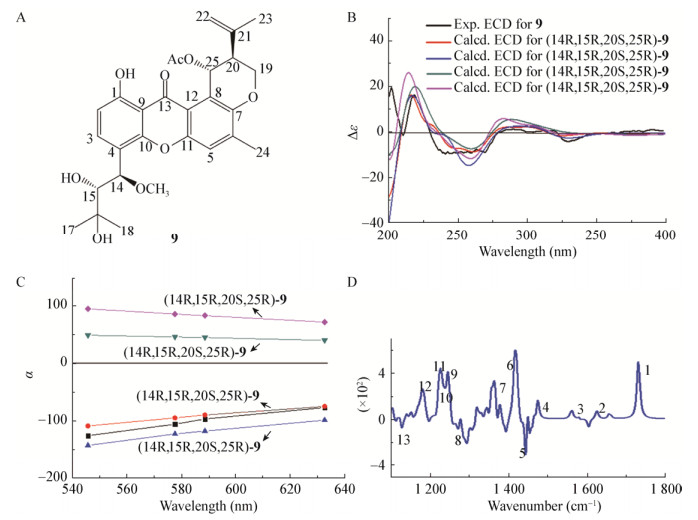
|
| 图 10 实验和计算化合物9的ECD、ORD和VCD谱 Figure 10 Experimental and calculated ECD, VCD and ORD spectra of compound 9 注:A:化合物9的结构;B:实验和计算化合物9的ECD谱[39];C:实验和计算化合物9的ORD谱[39];D:实验和计算化合物9的VCD谱[39]. Note: A: The structural diagram of compound 9; B:Experimental and calculated ECD spectra of compound 9[39]; C: Experimental and calculated ORD spectra of compound 9[39]; D: Experimental and calculated VCD spectra of compound 9[39]. |
|
|
Xu等[40]将从Aspergillus erreus得到的Pseurotin A3转化为乙酰衍生物化合物10 (图 11A),并对10的ECD和VCD进行测量;化合物10有(10R, 11R)-10a、(10R, 11S)-10b、(10S, 11R)-10c和(10S, 11S)-10d这4种可能的差向异构体;通过B3LYP/6-31G(d)优化结构分别在B3LYP/6-311+G (2d, p)水平使用PCM模型进行ECD计算(图 11B),在B3LYP/6-31G(d)水平使用PCM模型进行VCD计算,得到(10S, 11R)-10c为化合物10的绝对构型(图 11C)。
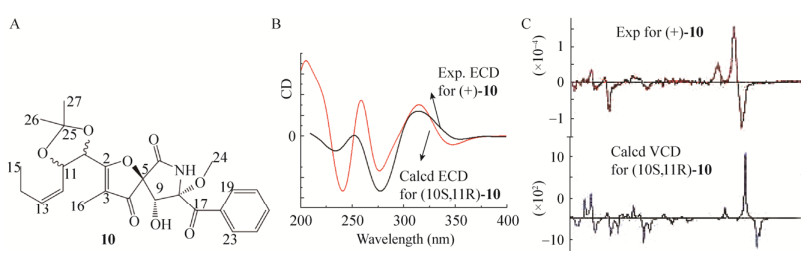
|
| 图 11 实验和计算化合物10的ECD和VCD谱 Figure 11 Experimental and calculated ECD and VCD spectra of compound 10 注:A:化合物10的结构;B:实验和计算化合物10的ECD谱[40];C:实验和计算化合物10的VCD谱[40]. Note: A: The structural diagram of compound 10; B: Experimental and calculated ECD spectra of compound 10[40]; C: Experimental and calculated VCD spectra of compound 10[40]. |
|
|
本文通过综述ECD在微生物次级代谢产物中生物碱、萜类、聚酮类等化合物绝对构型确定方面的应用实例来阐明ECD与绝对构型的关系。微生物次级代谢产物近年来已经成为药物研发的重要方向,ECD的出现使其结构与功能的研究变得更加简单高效。实验ECD的敏感性和理论计算的简单性突出了其在确定天然产物绝对构型方面的优势,ECD的TDDFT计算更简化了ECD与绝对构型之间关系的阐明,也是天然产物绝对构型确定的一种很有前景的方法。ECD有一些固有的弱点和溶剂处理方法存在缺陷、对柔性结构过多和结构复杂的天然产物的计算时间过长的局限性,而且由于信号分辨率低,在不借助激发态量子力学计算的情况下很难将信号分配到特定的发色团位置。获得天然产物的绝对构型不只有一种途径,在柔性结构过多和复杂天然产物的情况下,可协同应用一种以上的手性光学技术来明确分配绝对构型。但是,随着计算技术的不断进步,ECD计算将成为发现先导化合物的有力工具。
| [1] |
Du FX, Guo XM, Yang L, et al. Natural medicinal products of fungal origin[J]. Microbiology China, 2019, 46(9): 2411-2418. (in Chinese) 杜凤翔, 郭晓媚, 杨琳, 等. 真菌来源的药用天然产物[J]. 微生物学通报, 2019, 46(9): 2411-2418. |
| [2] |
Liu B, Chen N, Xu Y, et al. A new benzophenone with biological activities from metabolites of butyrolactone I in rat faeces[J]. Natural Product Research, 2019. DOI:10.1080/14786419.2019.1680668 |
| [3] |
Bogdán D, Haessner R, Vágvölgyi M, et al. Stereochemistry and complete 1H and 13C NMR signal assignment of C-20-xime derivatives of posterone 2, 3-cetonide in solution state[J]. Magnetic Resonance in Chemistry, 2018, 56(9): 859-866. DOI:10.1002/mrc.4750 |
| [4] |
Liu B, Wang HF, Zhang LH, et al. Isolation of a new compound from Penicillium oxalicum[J]. Chemistry of Natural Compounds, 2016, 52(5): 821-823. DOI:10.1007/s10600-016-1786-1 |
| [5] |
Zhang ZX, Wu PQ, Li HH, et al. Norcrassin A, a novel C16 tetranorditerpenoid, and bicrotonol A, an unusual dimeric labdane-type diterpenoid, from the roots of Croton crassifolius[J]. Organic & Biomolecular Chemistry, 2018, 16(21): 1745-1750. |
| [6] |
Kuroda Y, Hasegawa K, Noguchi K, et al. Confirmation of the absolute configuration of Stachybotrin C using single-crystal X-ray diffraction analysis of its 4-bromobenzyl ether derivative[J]. The Journal of Antibiotics, 2018, 71(6): 584-591. DOI:10.1038/s41429-018-0042-2 |
| [7] |
Takada A, Hashimoto Y, Takikawa H, et al. Total synthesis and absolute stereochemistry of Seragakinone A[J]. Angew andte Chemie (International ed. in English), 2011, 50(10): 2297-2301. DOI:10.1002/anie.201006528 |
| [8] |
Matsuo T, Hashimoto S, Nishikawa K, et al. Total synthesis and complete stereochemical assignment of heronapyrroles A and B[J]. Tetrahedron Letters, 2015, 56(39): 5345-5348. DOI:10.1016/j.tetlet.2015.07.094 |
| [9] |
Yang HG, Liu XY, Li XY, et al. Enantioselective total synthesis of colomitides and their absolute configuration determination and structural revision[J]. Organic & Biomolecular Chemistry, 2017, 15(17): 3728-3735. |
| [10] |
Seco JM, Quiñoa E, Riguera R. Assignment of the absolute configuration of polyfunctional compounds by NMR using chiral derivatizing agents[J]. Chemical Reviews, 2012, 112(8): 4603-4641. DOI:10.1021/cr2003344 |
| [11] |
Abbate S, Bertucci C, Bari LD, et al. Special issue "chiroptical spectroscopy: instrumentation, experimental aspects and applications" in memory of Ettore castiglioni[J]. Chirality, 2018, 30(3): 226. DOI:10.1002/chir.22809 |
| [12] |
Ariantari NP, Ancheeva E, Wang CY, et al. Indole diterpenoids from an endophytic Penicillium sp.[J]. Journal of Natural Products, 2019, 82(6): 1412-1423. DOI:10.1021/acs.jnatprod.8b00723 |
| [13] |
Beaulieu S, Comby A, Descamps D, et al. Photoexcitation circular dichroism in chiral molecules[J]. Nature Physics, 2018, 14(5): 484-489. DOI:10.1038/s41567-017-0038-z |
| [14] |
Tanaka H, Inoue Y, Nakano T, et al. Absolute configuration determination through the unique intramolecular excitonic coupling in the circular dichroisms of o, p'-DDT and o, p'-DDD. A combined experimental and theoretical study[J]. Photochemical & Photobiological Sciences, 2017, 16(4): 606-610. |
| [15] |
Zhang YL. The application of quantum chemistry in determining the absolute configuration in the study of natural chiral product[D]. Shanghai: Master's Thesis of East China University of Science and Technology, 2014 (in Chinese) 张友利.量子化学在确定天然产物绝对构型中的应用[D].上海: 华东理工大学硕士学位论文, 2014 |
| [16] |
Wu RR, Le ZJ, Wang ZZ, et al. Hyperjaponol H, a new bioactive filicinic acid-based meroterpenoid from Hypericum japonicum Thunb. ex murray[J]. Molecules, 2018, 23(3): 683. DOI:10.3390/molecules23030683 |
| [17] |
Li XC, Ferreira D, Ding YQ. Determination of absolute configuration of natural products: theoretical calculation of electronic circular dichroism as a tool[J]. Current Organic Chemistry, 2010, 14(16): 1678-1697. DOI:10.2174/138527210792927717 |
| [18] |
Albadry MA, Elokely KM, Wang B, et al. Computationally assisted assignment of Kahalalide Y configuration using an NMR-constrained conformational search[J]. Journal of Natural Products, 2013, 76(2): 178-185. DOI:10.1021/np3006088 |
| [19] |
Maarisit W, Yamazaki H, Abdjul DB, et al. A new pyranonaphtoquinone derivative, 4-Oxo-rhinacanthin A, from roots of Indonesian Rhinacanthus nasutus[J]. Chemical & Pharmaceutical Bulletin, 2017, 65(6): 586-588. |
| [20] |
Szatkowska-Wandas P, Koba M. Prediction of Acridinones' ability to interstrand DNA crosslinks formation using connected QSRR and QSAR analysis[J]. Letters in Drug Design & Discovery, 2016, 13(5): 387-394. |
| [21] |
Zhang H. Application of electronic circular dichroism spectroscopic methods in determination of absolute configuration of chiral metal complexes[J]. University Chemistry, 2017, 32(3): 1-14. (in Chinese) 章慧. 应用电子圆二色光谱方法确定手性金属配合物的绝对构型[J]. 大学化学, 2017, 32(3): 1-14. |
| [22] |
Hawkins PCD, Skillman AG, Warren GL, et al. Conformer generation with OMEGA: algorithm and validation using high quality structures from the protein databank and Cambridge structural database[J]. Journal of Chemical Information and Modeling, 2010, 50(4): 572-584. |
| [23] |
Ren PY, Wu CJ, Ponder JW. Polarizable atomic multipole-based molecular mechanics for organic molecules[J]. Journal of Chemical Theory and Computation, 2011, 7(10): 3143-3161. DOI:10.1021/ct200304d |
| [24] |
Sardella R, Ianni F, Macchiarulo A, et al. Elucidation of the chromatographic enantiomer elution order through computational studies[J]. Mini Reviews in Medicinal Chemistry, 2018, 18(2): 88-97. |
| [25] |
Bilal M, Beerwerth R, Volotka AV, et al. Ab initio calculations of energy levels, transition rates and lifetimes in Ni XⅡ[J]. Monthly Notices of the Royal Astronomical Society, 2017, 469(4): 4620-4629. DOI:10.1093/mnras/stx1203 |
| [26] |
Jaszuński M, Rizzo A, Ruud K. Molecular electric, magnetic, and optical properties[A]//Leszczynski J, Kaczmarek-Kedziera A, Puzyn T, et al. Handbook of Computational Chemistry[M]. 2nd ed. Cham: Springer, 2017: 497-592
|
| [27] |
Makarova MV, Semenov SG, Kostikov RR. A quantum chemical study of the acidity of acetylene and 1, 2-dihydrobuckminsterfullerene derivatives[J]. Journal of Structural Chemistry, 2018, 59(1): 43-46. DOI:10.1134/S0022476618010079 |
| [28] |
Ding WJ, Fang WH, Chai ZF, et al. Performance of twelve density functional theory methods in the characterization of three trivalent uranium complexes[J]. Acta Physico Chimica Sinica, 2015, 31(7): 1283-1301. DOI:10.3866/PKU.WHXB201504291 |
| [29] |
Fernandes HS, Ramos MJ, Cerqueira NMFSA. molUP: A VMD plugin to handle QM and ONIOM calculations using the gaussian software[J]. Journal of Computational Chemistry, 2018, 39(19): 1344-1353. DOI:10.1002/jcc.25189 |
| [30] |
Nugroho AE, Morita H. Circular dichroism calculation for natural products[J]. Journal of Natural Medicines, 2014, 68(1): 1-10. DOI:10.1007/s11418-013-0768-x |
| [31] |
Hu XY, Li XM, Yang SQ, et al. Three new sesquiterpenoids from the algal-derived fungus Penicillium chermesinum EN-480[J]. Marine Drugs, 2020, 18(4): 194. DOI:10.3390/md18040194 |
| [32] |
Wang Q, Tang XL, Liu H, et al. Clavukoellians G-K, new nardosinane and aristolane sesquiterpenoids with angiogenesis promoting activity from the marine soft coral Lemnalia sp.[J]. Marine Drugs, 2020, 18(3): 171. DOI:10.3390/md18030171 |
| [33] |
Chen Y, Liu ZM, Huang Y, et al. Ascomylactams A-C, Cytotoxic 12-or 13-membered-ring macrocyclic alkaloids isolated from the mangrove endophytic fungus Didymella sp. CYSK-4, and structure revisions of Phomapyrrolidones A and C[J]. Journal of Natural Products, 2019, 82(7): 1752-1758. DOI:10.1021/acs.jnatprod.8b00918 |
| [34] |
Li HQ, Sun WG, Deng MY, et al. Asperversins A and B, two novel meroterpenoids with an unusual 5/6/6/6 ring from the marine-derived fungus Aspergillus versicolor[J]. Marine Drugs, 2018, 16(6): 177. DOI:10.3390/md16060177 |
| [35] |
Zhang LH, Feng BM, Sun Y, et al. Flaviphenalenones A-C, three new phenalenone derivatives from the fungus Aspergillus flavipes PJ03-11[J]. Tetrahedron Letters, 2016, 57(6): 645-649. DOI:10.1016/j.tetlet.2015.12.099 |
| [36] |
Wang C, Wang P, Lin XP, et al. Phloroglucinol heterodimers and bis-indolyl alkaloids from the sponge-derived fungus Aspergillus sp. SCSIO 41018[J]. Organic Chemistry Frontiers, 2019, 6(17): 3053-3059. DOI:10.1039/C9QO00351G |
| [37] |
Liu B, Li J, Chen MH, et al. Seco-tetracenomycins from the marine-derived actinomycete Saccharothrix sp. 10-10[J]. Marine Drugs, 2018, 16(10): 345. DOI:10.3390/md16100345 |
| [38] |
Mazzeo G, Santoro E, Andolfi A, et al. Absolute configurations of fungal and plant metabolites by chiroptical methods. ORD, ECD, and VCD studies on phyllostin, scytolide, and oxysporone[J]. Journal of Natural Products, 2013, 76(4): 588-599. DOI:10.1021/np300770s |
| [39] |
Zhu A, Yang MY, Zhang YH, et al. Absolute configurations of 14, 15-hydroxylated prenylxanthones from a marine-derived Aspergillus sp. fungus by chiroptical methods[J]. Scientific Reports, 2018, 8: 10621. DOI:10.1038/s41598-018-28996-5 |
| [40] |
Xu LL, Cao F, Yang Q, et al. Experimental and theoretical study of stereochemistry for new pseurotin A3 with an unusual hetero-spirocyclic system[J]. Tetrahedron, 2016, 72(45): 7194-7199. DOI:10.1016/j.tet.2016.09.053 |
 2020, Vol. 47
2020, Vol. 47