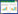扩展功能
文章信息
- 张国锋, 梁冬梅, 乔建军, 财音青格乐
- ZHANG Guo-Feng, LIANG Dong-Mei, QIAO Jian-Jun, Caiyinqinggele
- 链霉菌转运系统研究进展
- Research progress in Streptomyces transport system
- 微生物学通报, 2020, 47(11): 3689-3698
- Microbiology China, 2020, 47(11): 3689-3698
- DOI: 10.13344/j.microbiol.china.191016
-
文章历史
- 收稿日期: 2019-12-06
- 接受日期: 2020-02-13
- 网络首发日期: 2020-03-18
2. 系统生物工程教育部重点实验室 天津 300072;
3. 天津化学化工协同创新中心合成生物学平台 天津 300072
2. Key Laboratory of Systems Bioengineering, Ministry of Education, Tianjin 300072, China;
3. SynBio Research Platform, Collaborative Innovation Center of Chemical Science and Engineering (Tianjin), Tianjin 300072, China
链霉菌形态分化研究一直是链霉菌的研究热点,其与初级代谢过程中的营养摄取、复杂的次生代谢网络都有着密切关系,而在链霉菌整个复杂生命活动中涉及到众多的转运蛋白及转运系统。经鉴定,目前已完成基因组测序的链霉菌中至少含有171个转运蛋白家族[1],它们共同发挥精确的转运和定位功能。庞大的转运体系维持着链霉菌营养物质摄取等初级代谢过程、产孢等形态分化过程和抗生素分泌等次级代谢过程。因此,对链霉菌转运系统的研究不仅能够深入了解链霉菌形态分化调控过程,而且能够为抗生素生产工业菌株改造提供重要的依据。下文将从形态分化、次级代谢和初级代谢3个方面介绍链霉菌转运系统在其生命周期中的重要意义。
1 链霉菌转运系统与形态分化链霉菌作为土壤微生物中典型的革兰氏阳性丝状放线菌,在其生命周期中,菌体会经历一个复杂的形态分化过程。首先孢子在培养基中会形成具有多分枝、多核的基内菌丝,然后基内菌丝突破培养基水分的表面张力,向空气中生长形成气生菌丝,随着气生菌丝的形成,菌丝体中会均匀地形成隔膜,最终形成单核的孢子链,孢子链断裂后产生的孢子会进入下一个菌丝体分化过程。
链霉菌菌体形态分化有多个调控系统共同作用,参与形态分化的主要基因有bld家族和whi家族基因簇,bld基因主要负责调控气生菌丝的形成,而whi基因负责调控孢子的产生[2-3]。其中bld敲除菌株因其无法产生气生菌丝且培养基表型表现为光秃型而得名,whi能够产生气生菌丝但不产孢子,因其菌落表现为白色而得名。bld基因家族包括bldA (tRNA)、bldK (ABC转运系统)、bldN (σ因子)、bldG (unrelated anti-anti-sigma factor)及bldB/bldD/bldM (转录调控因子)[4],各自的作用也得到了深入的研究。基于bld基因簇在链霉菌形态分化过程中的重要调控意义,研究者们提出bld级联的代谢调控流,其中bld各个基因的调控作用具有不可逆性[5-7],如图 1所示。bld261作为信号分子启动bld调控级联,最终产生疏水蛋白SapB,从而改变培养基-空气表面张力,调控气生菌丝的产生。
|
| 图 1 bld级联的代谢调控流 Figure 1 Metabolic regulatory flow of bld cascade |
|
|
早期大多研究者认为bld基因簇通过bld级联等正向调控作用参与菌丝体形态分化过程,如应答元件bldM和σ因子bldN等[8-9],其敲除后由于代谢流的缺失无法产生气生菌丝。最新的研究表明,诸如BldD[10]、BldC[11]和BldO[12-13]等蛋白能够逆向调控菌体的形态分化过程,它们能够延缓菌体进入形态分化阶段,使其处于正常的基内菌丝生长阶段,基因敲除后菌丝体会表现为早熟的状态,这类蛋白也被称为“抑制”型的调控蛋白[8-13],这为bld基因簇参与形态分化调控研究提供了新的思路。
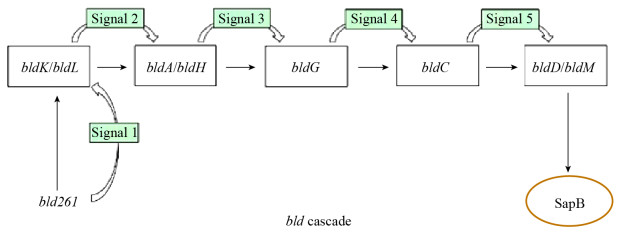
bld基因簇在菌体形态分化过程中,作为最重要的一环直接参与天蓝色链霉菌(Streptomyces coelicolor)两个形态分化调控系统。如图 2所示,其一为RamR途径,RamR是一类关键调控因子,可激活ragABKR基因簇和ramCSABR基因簇(SapB蛋白合成基因簇)的表达,产生SapB蛋白及其类似物,使得气生菌丝向空气中生长[14];其二是Chaplins途径,Chaplins是天蓝色链霉菌中另外一类疏水性分泌蛋白,与SapB蛋白类似,能够作为表面活性剂改变水-气-菌落的表面张力[15]。两个转运系统独立存在,在不同的营养条件下发挥不同的调控作用,在R2YE培养基上,天蓝色链霉菌气生菌丝的形成与bld基因、SapB和Chaplins蛋白有关,而在MS培养基上,其形态分化的调控只与bldB和Chaplins有关[15],其中X factor与RamR类似,为贫瘠营养条件下的关键调控因子,目前X factor尚未得到完整详细的阐释。
|
| 图 2 天蓝色链霉菌中形态分化调控系统 Figure 2 Regulatory system of morphological differentiation in Streptomyces coelicolor |
|
|
链霉菌复杂的形态分化过程中需要众多蛋白系统发挥作用,其中最重要的是转运蛋白及转运系统。21世纪初,链霉菌属的代表种天蓝色链霉菌、阿维链霉菌(Streptomyces avermitilis)及灰色链霉菌(Streptomyces griseus)的全基因组测序已经完成[16-17],基因组学的发展为链霉菌形态学研究提供了巨大的帮助和支持。如今蛋白质组学的飞速发展,让我们更加清晰地认识到链霉菌中数量庞大的转运蛋白家族。数据表明链霉菌中含量最为丰富的转运蛋白家族为ABC转运蛋白超家族(ATP- binding cassette superfamily)和MFS转运蛋白超家族(major facilitator superfamily)。研究者深度挖掘了11个常见的链霉菌菌种基因组数据,发现转运蛋白编码基因占据各基因组的10.2%-13.7%,其中171个蛋白家族中ABC家族和MFS家族转运蛋白的比例超过40%[18]。Shan等[19]通过基因组挖掘和同源序列比对,研究了4个纳他霉素生产菌株的ABC转运蛋白和MFS转运蛋白,发现其中51类转运蛋白具有同源性,包含29种同源性的ABC转运蛋白和22种MFS转运蛋白。链霉菌中数量众多的转运蛋白构成一个或多个独立的转运系统,共同发挥作用来控制营养物质摄入、抗生素分泌、耐药性、形态分化等重要生命过程,而不同菌种中的转运蛋白看似存在差异化,其同源性同样值得研究者们的深入思考。
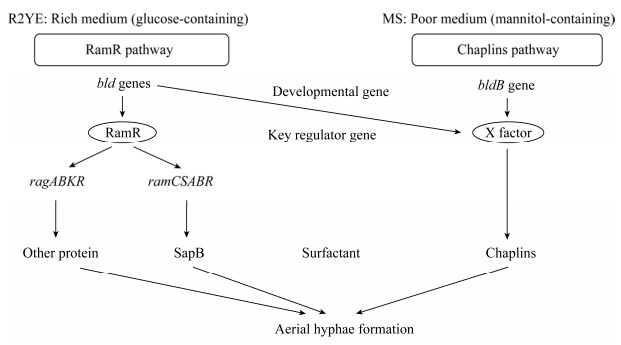
链霉菌转运系统的研究最早由Nodwell[7]提出,其在研究bld家族作用机制时发现,bldK家族基因能够影响气生菌丝形成及孢子产生等形态分化过程。bldK家族基因编码膜蛋白转运系统中ABC转运蛋白的部分组成元件,包括bldKE、bldKD、bldKA、bldKC和bldKB,在天蓝色链霉菌中,bldKA和bldKC编码透过酶,bldKE和bldKD编码ATP酶,而BldKB是一种溶液结合蛋白[7, 20],如图 3所示,这五者相辅相成构成BldK-ABC转运系统,因此BldK家族也被称为寡肽转运蛋白,其对气生菌丝等形态分化过程具有重要调控意义。除了天蓝色链霉菌以外,灰色链霉菌中BldK-ABC转运蛋白也能够控制气生菌丝的形成[20],不同菌种中的转运系统都能够通过转运外界物质来影响形态分化和次级代谢等生命过程,在完整的形态调控网络中占据中流砥柱的作用。
|
| 图 3 BldK-ABC转运系统 Figure 3 BldK-ABC transform system |
|
|
1996年研究者通过验证BldK蛋白的转运功能强有力地说明了其在形态分化方面的作用,三肽化合物Bialaphos可以通过寡肽透过酶进入细胞从而杀死野生型菌株,而对于bldK敲除菌而言,同样的培养条件下细胞可以无视Bialaphos的毒性正常生长,而bld261、bldA等敲除菌与野生型一样不具有这种抗性[7],这说明bldK基因能够控制外界寡肽物质的转入,进而影响菌丝体形态分化过程。之后,Park等[21]设计了S-腺苷蛋氨酸(S-adenosylmethionine,SAM)积累实验(SAM为胞内生命活动提供甲基),当胞外SAM积累时,BldK蛋白表达量上升了3倍,同时在寡肽结合蛋白(SCO5477/SCO5260)和BldKB蛋白(SCO5113)的作用下使得菌体膨大而不产生孢子。Meng等[22]同样在SAM诱导下发现了与菌丝体形态发育相关的5个转运蛋白,包括SCO5477、SCO5113、SCO4647、SCO4885和SCO1793。多个转运蛋白能够构成一个或多个转运系统,依托信号转导系统将胞外寡肽(信号)转变为胞内的代谢调控信号分子,最终能够改变气生菌丝等形态分化过程。因此肽转运蛋白的研究也为链霉菌转运系统的解析提供了重要的理论支持。本实验室一直致力于天蓝色链霉菌形态分化相关研究,我们发现SCO4114为一产孢相关蛋白,基因敲除后气生菌丝的形成会受到明显抑制,而且SCO5477 (寡肽转运蛋白)、SCO5113 (ABC转运脂蛋白BldKB)等蛋白的表达量明显下调;同时SCO4114基因中含有TTA密码子,能够受到编码稀有亮氨酸密码子bldA基因的调控,而且该基因敲除后会影响bld家族基因的表达,我们推测SCO5477能够与bldKA (SCO5112)、bldKC (SCO5114)、bldKD (SCO5115)等ABC转运蛋白相结合,共同调控天蓝色链霉菌形态分化等过程[23]。
天蓝色链霉菌中ABC转运系统的作用机制至今仍没有明确答案,为了研究bldK基因具体的调控作用方式,同时基于链霉菌和枯草芽孢杆菌形态分化过程的相似性,Nodwell等将天蓝色链霉菌bldK的5个多肽与枯草芽孢杆菌spo0K操纵子中相对应的基因编码产物对比,发现二者的寡肽透过酶具有较高的一致性,认为二者可能通过分泌不同的信号分子使细胞实现基内菌丝生长期到产孢期的转变[7]。Akanuma等比对了天蓝色链霉菌A3(2)中bldK操纵子(bldK-c)和灰色链霉菌中编码ABC转运系统的SRG家族基因(bldK-g),二者虽然基因序列不尽相同,但功能相似,在其形态分化过程中都发挥着重要作用[20]。
综上所述,链霉菌转运系统对菌体形态分化及次级代谢具有重要的调控意义,其依靠寡肽结合蛋白、转运蛋白和其他作用蛋白的共同作用,将外界分子转运至胞内,通过信号的转导直接影响菌丝体形态分化过程,其中影响形态分化的转运蛋白如表 1所示。同时转运系统能够耦合碳代谢调控系统等诸多调控系统共同发挥作用,构成完整的形态分化调控网络。但目前链霉菌各种转运系统相互作用机制尚未得到详细阐明,而BldK等转运蛋白能够为转运系统的深入研究提供明确的指导思路。
| 蛋白 Protein |
功能 Suggested function |
序列号 Accession No. |
功能鉴定 Identification |
调控因子 Regulation |
参考文献 References |
| SCO5477 | Putative oligopeptide-binding lipoprotein |
SC2A11.11 | Transport SBP of ABC transporter | SAM | [21-25] |
| SCO5260/AtrA | Secreted protein | 2SC7G11.22c | SAM | [21] | |
| SCO5113/BldKB | Oligopeptide ABC transport protein | SCBAC31E11.09 | ABC transport system lipoprotein | SAM | [21-22, 24] |
| SCO2008 | Putative branched chain amino acid-binding protein (ABP) | SC7H2.22 | Transport SBP of ABC transporter | [25] | |
| SCO4647 | Transcription anti-termination protein | SCD82.18 | SAM | [22] | |
| SCO4885 | Putative lipoprotein | 2SCK8.11 | SAM | [22] | |
| SCO1793 | Putative sporulation-control protein | SCI5.01 | SAM | [22] | |
| SCO2582 | Putative membrane metalloendopeptidase of unknown function |
SCC123.20 | SCO2127 | [26] |
链霉菌因其众多医用价值极高的次级代谢产物,被称为天然药物的合成工厂,也是目前天然抗生素的主要工业生产菌株,其中包括万古霉素(vancomycin)、林可霉素(lincomycin)、达托霉素(daptomycin)、氯霉素(chloramphenicol)及两性霉素B等临床上广泛使用的抗生素[27]。
链霉菌作为抗生素生产菌株,大多抗生素合成基因簇中都存在转运系统,依托相关转运蛋白和信号转导系统将抗生素等物质运送至胞外,在次级代谢产物的产生过程中发挥至关重要的作用。本实验室对多烯大环内酯抗生素(polyene macrolides,PEMs)的生物合成途径进行了全面比较分析,发现PEM生物合成基因簇中都存在一对可以形成异源二聚体的ABC转运蛋白,很可能是由其他ABC转运系统的基因复制而来,并且发挥着除PEM运输以外的其他重要功能[28]。ABC转运蛋白作为众多链霉菌转运系统的重要组成部分,能够参与调控抗生素生产及次级代谢等过程。天蓝色链霉菌中的双组分转导系统DraR-K能够影响放线紫红菌素(actinorhodin,ACT)等抗生素的产生,工业模式菌株阿维链霉菌(S. avermitilis) NRRL-8165中,DraR-K同源基因的缺失同样会影响阿维菌素和寡霉素的产量[29]。肉桂链霉菌(Streptomyces cinnamoneus)之所以可以产生羊毛硫抗生素这一抗生素[30],因其合成基因簇中含有ABC转运系统编码基因,林琴[31]将此抗生素合成基因簇在天蓝色链霉菌中进行了异源表达,结果发现天蓝色链霉菌获得羊毛硫抗生素生产能力,且其形态分化也发生了变化。抗生素的合成会受到多种影响因子的作用,其中天蓝色链霉菌及变铅青链霉菌(Streptomyces lividans)中ABC转运蛋白的功能受到高浓度的SAM调控,当变铅青链霉菌中SAM合成酶基因过表达时,胞内SAM积累,菌体ACT产量明显增加,同样灰色链霉菌链霉素的产量与胞外SAM的浓度也有着直接的关系[32-35]。我们认为SAM之所以能够影响抗生素产量是基于转运系统的作用,因此转运系统的影响因子研究对链霉菌工业价值的提升有着重要意义。
在链霉菌次级代谢过程中,MFS转运蛋白同样发挥着至关重要的作用,委内瑞拉链霉菌(Streptomyces venezuelae) ISP5230能够产生杰多霉素,最重要的原因在于jadL位于杰多霉素生物合成基因簇中,其编码的JadL蛋白作为MSF转运蛋白,能够参与杰多霉素的生产及转运过程[36]。在抗生素生产调控途径中,MFS蛋白也能作为靶标基因参与调控菌体自身稳定性发展过程,TetR家族转录调控因子是链霉菌转运系统重要的调控蛋白家族,其中AveT和GouR分别参与阿维链霉菌中阿维菌素及草链霉菌(Streptomyces graminearus)谷氏菌素的合成途径[37-38],二者能够激活靶标MFS基因的表达(aveM/gouM),从而使抗生素能够正常地运送至胞外,同时也保证菌体自身的耐药性。NemR作为LAL家族转录调控因子作用于MFS家族转运蛋白,进而调控蓝灰链霉菌(Streptomyces cyaneogriseus)中奈马菌素的合成[39],我们认为调控系统及转运系统耦合及关联阐释具有极大的拓展前景,最终能为工业化生产提供开创性的指导思路。
耐药性是链霉菌保证菌体自身稳态的重要因素,转运系统在此过程中扮演最重要的角色。灰绿链霉菌(Streptomyces griseoviridis)能够产生Griseoviridin (GV)和Viridogrisein (VG)两种抗生素,二者能够相互作用,能够更好地抵抗耐药性病原菌,具有极大的工业应用价值。在GV和VG抗生素生产过程中,SgvT1 (MFS转运蛋白家族)和SgvT2 (ABC转运蛋白家族)两种转运蛋白不可或缺,SgvT3 (MFS转运蛋白家族)能够作为SgvT1的候补途径来保证菌体受到自身抗生素的作用[40]。黄桃链霉菌(Streptomyces flavopersicus) NRRL 2820之所以能够抵抗纺锤菌素(netropsin,一种寡肽抗生素)的杀菌作用,其根本原因在于其细胞内部形成的一个多聚ABC转运蛋白能够将进入到胞内的纺锤菌素转移至胞外[41],从而使菌体免受抗生素的伤害。龟裂链霉菌(Streptomyces rimosus)是四环素类抗生素(oxytetracycline/tetracycline/ chlortetracycline,OTC)生产模式菌株,其中otrA、otrB和otrC基因编码产物共同组成一个OTC转运系统,研究表明天蓝色链霉菌中异源表达otr基因后能够获得OTC及氨基糖苷类抗生素抗性,而且形态分化过程也会发生改变[42]。
链霉菌转运系统是菌体能够作为工业生产菌株的最主要原因,其不仅能直接参与抗生素转运过程,也能与调控系统相结合共同发挥作用,保证菌体自身的稳定生长发育。调控系统与转运系统的相互作用研究目前尚不深入,研究者们可以从上游调控系统出发,以转运系统为目的构建完整的抗生素生产运输及调控系统,为链霉菌工业化快速发展提供极大的帮助。
3 链霉菌转运系统与基础生命活动上文阐述了链霉菌转运系统与形态分化和次级代谢产物的重要联系,除此之外,转运系统还能够通过一种间接的方式影响菌体形态分化等过程,即基础生命活动(初级代谢)。
众所周知,细胞内生命活动大都需要离子环境,那么培养基和环境中的离子元素需要进入到胞内发挥作用,细胞首先识别胞外的离子化合物如氧化铁、氯化钠等物质,并将其运送至胞内指定位置,整个过程必定需要某种精确的转运系统来实现。以铁离子为例,铁的化合物通过铁载体结合蛋白(siderophore-binding proteins,SBPs)耦合ABC转运系统进入胞内,天蓝色链霉菌能够产生3种铁运载蛋白(desferrioxamine B、desferrioxamine、ecoelichelin)[43-44],Patel等发现这3种铁运载蛋白能够特异性地与SBPs相结合,进而将进入细胞的铁离子转运至所需要的地方[45-46]。然而Li等在天蓝色链霉菌细胞膜上解析了多种与生命活动相关的转运蛋白,包括离子转运蛋白(SCO0494/SCO0996/ SCO2780/SCO7399)和糖类转运蛋白(SCO2231/ SCO6005/SCO6009/SCO6979),这也很直接地说明链霉菌膜上ABC转运蛋白对生命活动和细胞生长有着重要意义[47]。
转运系统除了能够为菌体提供必要的营养物质和离子条件外,还能应对外界环境的压力变化,Novotna等[24]通过研究表明很多参与形态分化调控过程的转运蛋白是压力环境诱导产生的,比如寡肽结合蛋白SCO5477在热(65 kD)和冷(74 kD)的条件下能够形成两种不同的形态,以适应外界不良环境;当盐离子或营养条件苛刻的情况下,菌体会产生BldK蛋白以适应环境。Detmers等也证实Opp蛋白能够感知胞外环境变化,调控一系列相关基因的表达来适应环境[48-49]。
Chávez等[26]在研究天蓝色链霉菌碳代谢抑制过程(carbon catabolite repression,CCR)关键调控因子SCO2127时发现,SCO2127能够通过与SCO5113 (BldKB)结合来调控其转运功能,进而影响天蓝色链霉菌的气生菌丝形成等形态分化过程。大多数bld突变体在改变碳源后(葡萄糖-甘露醇)胞外的葡萄糖浓度较低,基于转运系统的调控网络,细胞进入贫瘠营养条件下的代谢通路,绕过bld等相关基因的调控,产生孢子以适应不良环境;而bldB/bldA突变体之所以不能回复全部表型和产孢,因为二者位于形态分化调控通路的关键位置,或者是贫瘠营养代谢通路的控制链顶端[50-51]。
综上所述,作为具有重要工业价值的链霉菌,其次级代谢过程具有重要的研究意义,而转运系统不仅能够参与抗生素的运输,还能为临床耐药性的研究提供新的思路。在链霉菌复杂的生命周期中,转运系统作为调控网络的根基,能够与其他调控系统共同作用,维持并调节链霉菌菌丝体形态分化过程,同时转运系统能通过初级代谢过程中营养物质的摄入和恶劣环境下通路的改变来影响形态分化过程。天蓝色链霉菌作为模式菌株,其中具有转运功能的蛋白[47]众多,如表 2所示,我们认为链霉菌转运系统的研究不仅能够为工业生产提供指导思路,也能为完整的形态分化调控网络构建奠定坚实的基础。
| 转运蛋白 Transport protein |
蛋白名称 Protein name |
功能 Suggested function |
序列号 Accession No. |
| Oligopeptide transport | SCO5477 | Putative oligopeptide-binding lipoprotein (OBP) | SC2A11.11 |
| SCO5113/BldKB | putative ABC transport system lipoprotein | SCBAC31E11.09 | |
| SCO6644 | Putative solute-binding lipoprotein | SC4G2.18 | |
| SCO1655 | Putative lipoprotein oligopeptide-binding protein | SCI41.38c | |
| Amino acid transport | SCO2008 | Putative branched chain amino acid-binding protein (ABP) | SC7H2.22 |
| SCO2828 | Probable amino acid ABC transporter solute-binding protein | SCE20.02 | |
| SCO5776 | Glutamate-binding protein | GluB | |
| Carbohydrate transport | SCO6979 | Probable solute-binding lipoprotein | SC8F11.05 |
| SCO6005 | Putative lipoprotein | SC7B7.02 | |
| SCO2231 | Putative maltose-binding protein | SC10B7.26c | |
| SCO6009 | Solute-binding protein | SC7B7.06 | |
| SCO6257 | Putative ABC transport system sugar-binding lipoprotein | SCAH10.22 | |
| Nickel transport | SCO6451 | Putative substrate-binding protein (NikA) | SC9B5.18 |
| SCO4884 | Putative lipoprotein | 2SCK8.10 | |
| Iron transport | SCO0494 | Putative iron-siderophore-binding lipoprotein | SCF34.13c |
| SCO0996 | Putative lipoprotein | 2SCG2.09 | |
| SCO2780 | Putative secreted protein | SCC105.11 | |
| SCO7399 | Possible binding protein-dependent transport lipoprotein | SC10G8.27c |
链霉菌作为最重要的天然抗生素工业生产菌株,其形态分化和次级代谢调控网络的研究具有重要的市场应用价值,转运系统(ABC转运系统)作为调控网络的核心元件,不仅能够影响营养物质摄取及逆环境下的基础生命活动,而且能够直接参与气生菌丝形成及孢子产生等形态分化过程,进而影响次级代谢过程。
本文通过介绍链霉菌转运系统在初级代谢、次级代谢以及形态分化等过程中的重要意义,详细描述了转运系统的基本构成及其功能,为后来转运系统的相关研究搭建坚实的平台,同时也为工业抗生素的优化生产提供新的指导思路。
转运蛋白作为链霉菌转运体系的第一级类蛋白,是菌体接收外界信号的第一调控元件,从寡肽转运蛋白(SCO5477/SCO5113)到各种离子转运蛋白(SCO2008/SCO6979/SCO6451/SCO0494),它们受到越来越多研究者的关注。目前数量众多的转运蛋白并未得到系统深入的研究,这些转运蛋白与底物结合以及调控的特异性能够为链霉菌形态分化研究打开新的篇章,其广泛的覆盖性也能够使完整调控网络的研究迈入新的纪元。本实验室一直致力于构建以SCO4114或SCO5477为中心的产孢代谢调控网络,以期阐明天蓝色链霉菌形态分化过程中的代谢通路,也希望通过本文能够为后来的学者提供一定的研究方向。
| [1] |
Zhou Z. Phylogenetic evolutionary study of functional genes relating to transcriptional regulation and transport system in Streptomyces[D]. Hangzhou: Doctoral Dissertation of Zhejiang University, 2012 (in Chinese) 周展.链霉菌转录调控和转运分泌的功能基因系统进化研究[D].杭州: 浙江大学博士学位论文, 2012 |
| [2] |
Chater KF, Horinouchi S. Signalling early developmental events in two highly diverged Streptomyces species[J]. Molecular Microbiology, 2003, 48(1): 9-15. DOI:10.1046/j.1365-2958.2003.03476.x |
| [3] |
Chater KF. A morphological and genetic mapping study of white colony mutants of Streptomyces coelicolor[J]. Journal of General Microbiology, 1972, 72(1): 9-28. DOI:10.1099/00221287-72-1-9 |
| [4] |
Chater KF. Taking a genetic scalpel to the Streptomyces colony[J]. Microbiology, 1998, 144(6): 1465-1478. DOI:10.1099/00221287-144-6-1465 |
| [5] |
Nodwell JR, Yang M, Kuo D, et al. Extracellular complementation and the identification of additional genes involved in aerial mycelium formation in Streptomyces coelicolor[J]. Genetics, 1999, 151(2): 569-584. |
| [6] |
Willey J, Schwedock J, Losick R. Multiple extracellular signals govern the production of a morphogenetic protein involved in aerial mycelium formation by Streptomyces coelicolor[J]. Genes & Development, 1993, 7(5): 895-903. |
| [7] |
Nodwell JR, McGovern K, Losick R. An oligopeptide permease responsible for the import of an extracellular signal governing aerial mycelium formation in Streptomyces coelicolor[J]. Molecular Microbiology, 1996, 22(5): 881-893. DOI:10.1046/j.1365-2958.1996.01540.x |
| [8] |
Bibb MJ, Domonkos Á, Chandra G, et al. Expression of the chaplin and rodlin hydrophobic sheath proteins in Streptomyces venezuelae is controlled by σBldN and a cognate anti-sigma factor, RsbN[J]. Molecular Microbiology, 2012, 84(6): 1033-1049. DOI:10.1111/j.1365-2958.2012.08070.x |
| [9] |
Al-Bassam MM, Bibb MJ, Bush MJ, et al. Response regulator heterodimer formation controls a key stage in Streptomyces development[J]. PLoS Genetics, 2014, 10(8): e1004554. DOI:10.1371/journal.pgen.1004554 |
| [10] |
Tschowri N, Schumacher MA, Schlimpert S, et al. Tetrameric c-di-GMP mediates effective transcription factor dimerization to control Streptomyces development[J]. Cell, 2014, 158(5): 1136-1147. DOI:10.1016/j.cell.2014.07.022 |
| [11] |
Bush MJ, Chandra G, Al-Bassam MM, et al. BldC delays entry into development to produce a sustained period of vegetative growth in Streptomyces venezuelae[J]. mBio, 2019, 10(1): e02812-18. |
| [12] |
Bush MJ, Chandra G, Findlay KC, et al. Multi-layered inhibition of Streptomyces development: BldO is a dedicated repressor of whiB[J]. Molecular Microbiology, 2017, 104(5): 700-711. DOI:10.1111/mmi.13663 |
| [13] |
Flärdh K, McCormick JR. The Streptomyces O-B one connection: a force within layered repression of a key developmental decision[J]. Molecular Microbiology, 2017, 104(5): 695-699. DOI:10.1111/mmi.13688 |
| [14] |
Paolo SS, Huang JQ, Cohen SN, et al. Rag genes: novel components of the RamR regulon that trigger morphological differentiation in Streptomyces coelicolor[J]. Molecular Microbiology, 2006, 61(5): 1167-1186. DOI:10.1111/j.1365-2958.2006.05304.x |
| [15] |
Capstick DS, Willey JM, Buttner MJ, et al. SapB and the chaplins: connections between morphogenetic proteins in Streptomyces coelicolor[J]. Molecular Microbiology, 2007, 64(3): 602-613. DOI:10.1111/j.1365-2958.2007.05674.x |
| [16] |
Bentley SD, Chater KF, Cerdeño-Tárraga AM, et al. Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2)[J]. Nature, 2002, 417(6885): 141-147. DOI:10.1038/417141a |
| [17] |
Ohnishi Y, Ishikawa J, Hara H, et al. Genome sequence of the streptomycin-producing microorganism Streptomyces griseus IFO 13350[J]. Journal of Bacteriology, 2008, 190(11): 4050-4060. DOI:10.1128/JB.00204-08 |
| [18] |
Zhou Z, Sun N, Wu SS, et al. Genomic data mining reveals a rich repertoire of transport proteins in Streptomyces[J]. BMC Genomics, 2016, 17(S7): 510. DOI:10.1186/s12864-016-2899-4 |
| [19] |
Shan YM, Guo D, Gu QS, et al. Genome mining and homologous comparison strategy for digging exporters contributing self-resistance in natamycin-producing Streptomyces strains[J]. Applied Microbiology and Biotechnology, 2020, 104(2): 817-831. DOI:10.1007/s00253-019-10131-7 |
| [20] |
Akanuma G, Ueki M, Ishizuka M, et al. Control of aerial mycelium formation by the BldK oligopeptide ABC transporter in Streptomyces griseus[J]. FEMS Microbiology Letters, 2011, 315(1): 54-62. DOI:10.1111/j.1574-6968.2010.02177.x |
| [21] |
Park HS, Shin SK, Yang YY, et al. Accumulation of S-adenosylmethionine induced oligopeptide transporters including BldK to regulate differentiation events in Streptomyces coelicolor M145[J]. FEMS Microbiology Letters, 2005, 249(2): 199-206. DOI:10.1016/j.femsle.2005.05.047 |
| [22] |
Meng LZ, Yang SH, Palaniyandi SA, et al. Phosphoprotein affinity purification identifies proteins involved in S-adenosyl-L-methionine-induced enhancement of antibiotic production in Streptomyces coelicolor[J]. The Journal of Antibiotics, 2011, 64(1): 97-101. |
| [23] |
Li LF, Qiao JJ, Caiyin QGL, et al. Comparative proteomic analysis of sporulation associated protein SCO4114 in Streptomyces coelicolor[J]. Journal of Biotech Research, 2019, 10: 78-91. |
| [24] |
Novotna J, Vohradsky J, Berndt P, et al. Proteomic studies of diauxic lag in the differentiating prokaryote Streptomyces coelicolor reveal a regulatory network of stress-induced proteins and central metabolic enzymes[J]. Molecular Microbiology, 2003, 48(5): 1289-1303. DOI:10.1046/j.1365-2958.2003.03529.x |
| [25] |
Penyige A, Keserű J, Fazakas F, et al. Analysis and identification of ADP-ribosylated proteins of Streptomyces coelicolor M145[J]. The Journal of Microbiology, 2009, 47(5): 549-556. DOI:10.1007/s12275-009-0032-y |
| [26] |
Chávez A, Forero A, Sánchez M, et al. Interaction of SCO2127 with BldKB and its possible connection to carbon catabolite regulation of morphological differentiation in Streptomyces coelicolor[J]. Applied Microbiology and Biotechnology, 2011, 89(3): 799-806. DOI:10.1007/s00253-010-2905-8 |
| [27] |
Li H, Liu JB, Wang TJ, et al. Research progress of ATP-binding cassette transporters in polyene antibiotic biosynthesis gene cluster[J]. Microbiology China, 2014, 41(5): 950-958. (in Chinese) 李涵, 刘剑波, 汪谭俊, 等. 多烯类抗生素合成基因簇中ABC转运蛋白研究进展[J]. 微生物学通报, 2014, 41(5): 950-958. |
| [28] |
Liang DM, Yang XY, Liu JH, et al. Global evolution of glycosylated polyene macrolide antibiotic biosynthesis[J]. Molecular Phylogenetics and Evolution, 2018, 127: 239-247. DOI:10.1016/j.ympev.2018.06.005 |
| [29] |
Yu ZY, Zhu H, Dang FJ, et al. Differential regulation of antibiotic biosynthesis by DraR-K, a novel two-component system in Streptomyces coelicolor[J]. Molecular Microbiology, 2012, 85(3): 535-556. DOI:10.1111/j.1365-2958.2012.08126.x |
| [30] |
Widdick DA, Dodd HM, Barraille P, et al. Cloning and engineering of the cinnamycin biosynthetic gene cluster from Streptomyces cinnamoneus DSM 40005[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(7): 4316-4321. DOI:10.1073/pnas.0230516100 |
| [31] |
Lin Q. Study on the lantibiotics and leinamycin analogue biosynthetic gene clusters in Streptomycrs sp. sh-62[D]. Wuhan: Master's Thesis of Huazhong Agricultural University, 2018 (in Chinese) 林琴.链霉菌SH-62中羊毛硫抗生素和雷纳霉素类似物生物合成基因簇的研究[D].武汉: 华中农业大学硕士学位论文, 2018 |
| [32] |
Shin SK, Park HS, Kwon HJ, et al. Genetic characterization of two S-adenosylmethionine-induced ABC transporters reveals their roles in modulations of secondary metabolism and sporulation in Streptomyces coelicolor M145[J]. Journal of Microbiology and Biotechnology, 2007, 17(11): 1818-1825. |
| [33] |
Kim DJ, Huh JH, Yang YY, et al. Accumulation of S-adenosyl-L-methionine enhances production of actinorhodin but inhibits sporulation in Streptomyces lividans TK23[J]. Journal of Bacteriology, 2003, 185(2): 592-600. DOI:10.1128/JB.185.2.592-600.2003 |
| [34] |
Okamoto S, Lezhava A, Hosaka T, et al. Enhanced expression of S-adenosylmethionine synthetase causes overproduction of actinorhodin in Streptomyces coelicolor A3(2)[J]. Journal of Bacteriology, 2003, 185(2): 601-609. DOI:10.1128/JB.185.2.601-609.2003 |
| [35] |
Shin SK, Xu DL, Kwon HJ, et al. S-adenosylmethionine activates adpA transcription and promotes streptomycin biosynthesis in Streptomyces griseus[J]. FEMS Microbiology Letters, 2006, 259(1): 53-59. DOI:10.1111/j.1574-6968.2006.00246.x |
| [36] |
Forget SM, McVey J, Vining LC, et al. Streptomyces venezuelae ISP5230 maintains excretion of jadomycin upon disruption of the MFS transporter JadL located within the natural product biosynthetic gene cluster[J]. Frontiers in Microbiology, 2017, 8: 432. |
| [37] |
Wei JH, Tian YQ, Niu GQ, et al. GouR, a TetR family transcriptional regulator, coordinates the biosynthesis and export of gougerotin in Streptomyces graminearus[J]. Applied and Environmental Microbiology, 2014, 80(2): 714-722. DOI:10.1128/AEM.03003-13 |
| [38] |
Liu WS, Zhang QL, Guo J, et al. Increasing avermectin production in Streptomyces avermitilis by manipulating the expression of a novel TetR-family regulator and its target gene product[J]. Applied and Environmental Microbiology, 2015, 81(15): 5157-5173. DOI:10.1128/AEM.00868-15 |
| [39] |
Li C, He HR, Wang JB, et al. Characterization of a LAL-type regulator NemR in nemadectin biosynthesis and its application for increasing nemadectin production in Streptomyces cyaneogriseus[J]. Science China Life Sciences, 2019, 62(3): 394-405. DOI:10.1007/s11427-018-9442-9 |
| [40] |
Xie YC, Ma JY, Qin XJ, et al. Identification and utilization of two important transporters: SgvT1 and SgvT2, for griseoviridin and viridogrisein biosynthesis in Streptomyces griseoviridis[J]. Microbial Cell Factories, 2017, 16(1): 177. DOI:10.1186/s12934-017-0792-8 |
| [41] |
Stumpp T, Himbert S, Altenbuchner J. Cloning of the netropsin resistance genes from Streptomyces flavopersicus NRRL 2820[J]. Journal of Basic Microbiology, 2005, 45(5): 355-362. DOI:10.1002/jobm.200410529 |
| [42] |
Zhao YF, Lu DD, Bechthold A, et al. Impact of otrA expression on morphological differentiation, actinorhodin production, and resistance to aminoglycosides in Streptomyces coelicolor M145[J]. Journal of Zhejiang University-SCIENCE B, 2018, 19(9): 708-717. DOI:10.1631/jzus.B1800046 |
| [43] |
Lautru S, Deeth RJ, Bailey LM, et al. Discovery of a new peptide natural product by Streptomyces coelicolor genome mining[J]. Nature Chemical Biology, 2005, 1(5): 265-269. DOI:10.1038/nchembio731 |
| [44] |
Barona-Gómez F, Lautru S, Francou FX, et al. Multiple biosynthetic and uptake systems mediate siderophore-dependent iron acquisition in Streptomyces coelicolor A3(2) and Streptomyces ambofaciens ATCC 23877[J]. Microbiology, 2006, 152(11): 3355-3366. DOI:10.1099/mic.0.29161-0 |
| [45] |
Patel P, Song LJ, Challis GL. Distinct extracytoplasmic siderophore binding proteins recognize ferrioxamines and ferricoelichelin in Streptomyces coelicolor A3(2)[J]. Biochemistry, 2010, 49(37): 8033-8042. DOI:10.1021/bi100451k |
| [46] |
Hvorup RN, Goetz BA, Niederer M, et al. Asymmetry in the structure of the ABC transporter-binding protein complex BtuCD-BtuF[J]. Science, 2007, 317(5843): 1387-1390. DOI:10.1126/science.1145950 |
| [47] |
Li FH, Liang JD, Wang WX, et al. Analysis of Streptomyces coelicolor membrane proteome using two-dimensional native/native and native/sodium dodecyl sulfate gel electrophoresis[J]. Analytical Biochemistry, 2014, 465: 148-155. DOI:10.1016/j.ab.2014.08.009 |
| [48] |
Detmers FJM, Lanfermeijer FC, Poolman B. Peptides and ATP binding cassette peptide transporters[J]. Research in Microbiology, 2001, 152(3/4): 245-258. |
| [49] |
Claessen D, de Jong W, Dijkhuizen L, et al. Regulation of Streptomyces development: reach for the sky![J]. Trends in Microbiology, 2006, 14(7): 313-319. DOI:10.1016/j.tim.2006.05.008 |
| [50] |
Pope MK, Green BD, Westpheling J. The bld mutants of Streptomyces coelicolor are defective in the regulation of carbon utilization, morphogenesis and cell-cell signalling[J]. Molecular Microbiology, 1996, 19(4): 747-756. DOI:10.1046/j.1365-2958.1996.414933.x |
| [51] |
Pope MK, Green B, Westpheling J. The bldB gene encodes a small protein required for morphogenesis, antibiotic production, and catabolite control in Streptomyces coelicolor[J]. Journal of Bacteriology, 1998, 180(6): 1556-1562. DOI:10.1128/JB.180.6.1556-1562.1998 |
 2020, Vol. 47
2020, Vol. 47