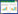扩展功能
文章信息
- 马新, 史娟, 李杨, 韩宇
- MA Xin, SHI Juan, LI Yang, HAN Yu
- 苜蓿假盘菌子囊孢子萌发特性及子实体超微结构观察
- Ascospore germination characteristics and the ultrastructure observation of fruit body of Pseudopeziza medicaginis
- 微生物学通报, 2020, 47(11): 3564-3576
- Microbiology China, 2020, 47(11): 3564-3576
- DOI: 10.13344/j.microbiol.china.190966
-
文章历史
- 收稿日期: 2019-11-21
- 接受日期: 2020-01-27
- 网络首发日期: 2020-04-09
苜蓿假盘菌(Pseudopeziza medicaginis)侵染苜蓿叶片引起的苜蓿褐斑病是苜蓿生产中的主要病害之一,该病广泛分布于国内外苜蓿产区[1],轻则引起落叶,严重时不仅影响苜蓿的产量和品质[2],而且产生的香豆雌酚等类黄酮物质会引起家畜的流产和不育[3-5]。近年随着草畜产业的发展,苜蓿种植面积的增加,褐斑病的发生呈上升趋势,对苜蓿的健康、安全生产和优质牧草加工等产生了严重的威胁[6]。因此,研究苜蓿褐斑病的发生机理对于科学控制病害发生流行具有重要的现实意义。已有研究表明,在P. medicaginis的生活史中尚未发现无性阶段[7-10],在田间该病害的侵染循环通过有性生殖产生的假子囊盘越冬,翌年通过子囊盘弹射释放出子囊孢子进行田间传播和侵染苜蓿叶片完成初侵染[11-12]。因此,探讨子囊孢子萌发特性对于深入解析病菌侵入机制具有重要的意义。
病原菌侵入寄主前,子囊孢子萌发形成芽管,继而在芽管顶端形成附着胞等侵染结构帮助其侵入寄主[13]。因此,子囊孢子的萌发和附着胞的形成对病原菌成功侵入寄主并完成初侵染具有重要意义[14]。研究表明,适当地添加碳、氮源有利于子囊孢子的萌发[15-16]。曾大兴等[17]研究发现,附着胞形成过程会受到来自寄主叶片或植株部位表面其他信息的诱导。王立安等[18]的研究结果表明,稻瘟病菌(Magnaporthe grisea)附着胞的形成过程受不同信号途径的调控,其中Ca2+信号途径参与了M. grisea孢子及疏水条件下附着胞形成过程的调控。苜蓿褐斑病菌侵染过程的研究结果表明,P. medicaginis子囊孢子成功侵入寄主细胞并不形成附着胞,而是通过芽管以直接侵入方式侵入寄主表皮细胞完成初侵染[12]。碳、氮源和Ca2+信号途径是否参与苜蓿褐斑病菌子囊孢子附着胞的形成目前尚不清楚,明确这一问题可为进一步解析调控附着胞形成的途径提供试验证据。本研究探讨了不同碳、氮源和外源Ca2+及其抑制剂对子囊孢子萌发和附着胞形成的影响,观察了子实体和子囊孢子的细胞学特征。研究结果为进一步从分子水平揭示附着胞的形成机制以及苜蓿褐斑病绿色防控提供试验依据。
1 材料与方法 1.1 材料 1.1.1 供试菌株苜蓿假盘菌(Pseudopeziza medicaginis)由实验室分离培养所得[8]。
1.1.2 培养基V8-CaCO3培养基的配制参考文献[8];基础培养基:琼脂10.0 g/L。
1.1.3 主要试剂和仪器EGTA,上海化工试剂公司;A23187、Neomycin,Sigma公司;Nicardipine、Choropromazine,大连美仑生物技术有限公司;CaCl2,河北华晨药业有限公司。奥林巴斯显微镜,Olympus有限公司;超薄切片机,Leica公司;蔡司热场发射扫描电镜,卡尔·蔡司股份公司;透射电子显微镜,株式会社日立制作所。
1.2 方法 1.2.1 P. medicaginis子囊孢子的获得将V8-CaCO3平板上培养成熟的子实体进行扩繁[19]。20 ℃黑暗条件培养20 d左右即形成成熟的子囊盘,供接种用。
1.2.2 接种与子囊孢子预培养采用逆向产孢法进行接种[12],挑取成熟的P. medicaginis子实体,移至底部铺有滤纸的培养皿盖内侧,喷足量的灭菌水保湿,置于20 ℃黑暗条件预培养6 h即为子囊孢子接种源。
1.2.3 不同碳、氮源对P. medicaginis子囊孢子萌发的影响以0.1 mol/L的碳、氮量为标准,分别向基础培养基中加入碳、氮源灭菌后滴入凹玻片,置于1.2.2预培养的接种源下方进行逆向产孢接种,20 ℃黑暗条件培养。分别于接种后的4、6、8、12、24、48和72 h观察,奥林巴斯显微镜下观察子囊孢子的萌发、附着胞的形成以及初始菌落的形成、测量芽管长度并拍照。3次重复,以水琼脂为对照。
1.2.4 Ca2+/CaM信号途径参与调控研究采用凹玻片法试验观察。依据表 1中的浓度分别配制成1%水琼脂的培养基,按照1.2.3方法接种和观察。3次重复。
| 作用方式 Mode of action |
外源物质 Exogenous substance |
外源物质浓度/比例 Concentration/Proportion of exogenous substance (mmol/L) |
| 外源Ca2+ Exogenous calcium ion |
氯化钙 Calcium chloride, CaCl2 |
0.1, 1, 10, 100 |
| Ca2+螯合剂 Calcium ion chelating agent |
乙二醇-双-(2-氨基乙醚)四乙酸 Ethylene glycol bis (2-aminoethyl ether)-N, N, Nʹ, Nʹ-tetraacetic acid, EGTA |
0.1, 1, 10 |
| EGTA的解除作用 Relieving effect of EGTA |
EGTA:CaCl2 | 10:1, 1:1, 1:10 |
| Ca2+载体 Calcium ion vector |
EGTA: A23187 | 10:0.01 |
| 磷酸酯酶抑制剂 Phosphatase inhibitor |
硫酸新霉素 Neomycin sulphate |
0.1, 1, 10, 100 |
| CaM拮抗剂 CaM antagonist |
盐酸氯丙嗪 Chloropromazine |
0.1, 1, 10, 100 |
| Ca2+通道阻断剂 Calcium channel blockers |
盐酸尼卡地平 Nicardipine hydrochloride |
0.1, 1, 10, 100 |
选取V8-CaCO3培养基上成熟的菌落,参照姚娟妮等[20]的方法制备样品。将制备好的样品在解剖镜下进行修块,在超薄切片机上切片,用1%甲苯胺蓝染色液染色,经流动水冲洗染色液并烤干,在显微镜下进行观察和拍照。
1.2.6 扫描电镜样品的制备和观察选取病叶上发育成熟的病斑,按照姚娟妮等[20]的方法制备扫描样品。蔡司热场发射扫描电镜下观察和拍照。
1.2.7 P. medicaginis子实体透射电镜样品的制备和观察选取V8-CaCO3培养基上成熟的菌落,参照姚娟妮等[20]的方法制备投射观察样品。通过半薄切片进行样品定位,超薄切片在透射电子显微镜观察并拍照。
1.2.8 结果观察及处理方法观察统计孢子的萌发率、附着胞的形成率和初始菌落的形成率。以芽管长度达到孢子宽度的一半时即可视为孢子萌发,菌丝集结即视为初始菌落的形成。
孢子萌发率(%)=(孢子萌发数/总孢子数)×100;附着胞形成率(%)=附着胞形成个数/孢子萌发数×100。使用Excel 2003进行数据处理,应用统计分析软件SPSS 20.0进行单因素方差分析。
2 结果与分析 2.1 碳源对P. medicaginis子囊孢子萌发的影响由表 2可知,不同碳源对P. medicaginis子囊孢子的萌发率、芽管长度、附着胞、菌落形成均有显著影响。对子囊孢子萌发率的影响最大的是葡萄糖,为56.06%,其次是麦芽糖、甘油、乳糖和蔗糖,对照最低为18.55%;对芽管长度的影响最大的是麦芽糖,为24.01 μm,其次是甘油、乳糖、葡萄糖和蔗糖,对照最低为6.61 μm;子囊孢子的萌发时间在4−8 h。麦芽糖、蔗糖、葡萄糖促进芽管末端膨大形成椭圆形的附着胞(图 1),乳糖、甘油及对照不能形成附着胞,附着胞形成时间在6−8 h;48 h形成菌落,对菌落形成影响最大的是葡萄糖,为67.27%,其次为蔗糖、乳糖、甘油、麦芽糖,对照始终未形成菌落。
| 碳源种类 Types of carbon source |
子囊孢子萌发率 Germination rate of ascospores (%) |
芽管长度 Length of bud tube (μm) |
附着胞形成率 Formation rate of appressorium (%) |
菌落大小 Colony size |
附着胞特征 Characteristics of appressorium |
|
| 长度 Length (μm) |
宽度 Width (μm) |
|||||
| 对照 CK |
18.55±1.01a | 6.61±0.33c | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| 葡萄糖 Glucose |
56.06±0.34c | 15.83±1.85b | 19.59±0.34c | 67.27±1.02e | 64.44±1.32d | 椭圆形 Oval |
| 麦芽糖 Maltose |
54.93±0.74d | 24.01±3.73a | 16.37±0.37b | 50.38±0.63b | 48.31±0.86b | 椭圆形 Oval |
| 乳糖 Lactose |
34.05±0.43b | 16.88±2.33b | 0.00±0.00a | 56.49±1.03d | 54.21±1.04c | − |
| 蔗糖 Sucrose |
33.26±0.34b | 15.26±3.07b | 22.48±0.54d | 67.25±1.78e | 66.57±1.30d | 椭圆形 Oval |
| 甘油 Glycerol |
38.87±0.18e | 20.18±4.22ab | 00.00±0.00a | 52.37±1.23c | 50.48±1.08bc | − |
| 注:表中各数据为每个处理的平均值±标准误;列中不同小写字母表示每个因素各水平间差异达显著水平(P < 0.05);−:该条件下未见附着胞形成. Note: All data are the mean value of each treatment±standard error; Different lowercase letters denote significant difference (P < 0.05) in each column; −: no adherent cell is formed under this condition. | ||||||
|
| 图 1 不同碳、氮源对P. medicaginis子囊孢子附着胞形成的影响(400×) Figure 1 Effect of different carbon and nitrogen sources on the appressorium formation of P. medicaginis (400×) 注:A:葡萄糖;B:麦芽糖;C:蔗糖;D:氨基乙酸;E:酵母粉;F:尿素;G:硝酸钠;H:对照. Note: A: Glucose; B: Maltose; C: Sucrose; D: Aminoacetic acid; E: Yeast powder; F: Urea; G: Sodium nitrate; H: CK. |
|
|
由表 3可知,不同氮源对P. medicaginis子囊孢子的萌发率、芽管长度、附着胞、菌落形成均有显著影响。对子囊孢子萌发率影响最大的是酵母粉,为88.39%,其次是硝酸钠、蛋白胨、氨基乙酸、牛肉膏、尿素、硝酸铵,硫酸铵、草酰乙酸的影响低于对照,草酰乙酸影响最低,为6.88%;对芽管长度影响最大的是硝酸铵,为27.98 μm,其次是尿素、蛋白胨、硫酸铵、酵母粉、硝酸钠、牛肉膏、草酰乙酸、氨基乙酸,对照最低,为6.61 μm;子囊孢子的萌发时间集中在5−13 h。氨基乙酸、尿素、草酰乙酸、硝酸钠、酵母粉、蛋白胨促进芽管末端膨大形成椭圆形的附着胞(图 1D−G),牛肉膏、硫酸铵、硝酸铵及对照不能形成附着胞(图 1H);48 h形成菌落,对菌落形成影响最大的是蛋白胨,为40.03%,其次是硝酸钠、氨基乙酸、尿素、草酰乙酸,酵母粉、牛肉膏、硫酸铵、硝酸铵及对照始终未形成菌落。
| 氮源种类 Types of nitrogen source |
子囊孢子萌发率 Germination rate of ascospores (%) |
芽管长度 Length of bud tube (μm) |
附着胞形成率 Formation rate of appressorium (%) |
菌落大小 Colony size |
附着胞特征 Characteristics of appressorium |
|
| 长度 Length (μm) |
宽度 Width (μm) |
|||||
| 对照 CK |
18.55±1.01b | 6.61±0.33d | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| 氨基乙酸 Aminoacetic acid |
64.47±0.77f | 15.17±2.31c | 10.44±0.50b | 27.54±0.55d | 26.50±0.44c | 圆形 Circular |
| 酵母粉 Yeast powder |
88.39±0.98i | 20.33±1.45b | 13.33±0.70c | 0.00±0.00a | 0.00±0.00a | 圆形 Circular |
| 尿素 Urea |
35.69±0.18d | 22.02±2.21b | 26.71±0.42e | 19.97±0.25c | 19.57±1.05b | 椭圆形 Oval |
| 牛肉膏 Beef extract |
58.56±0.34e | 18.92±3.29bc | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| 草酰乙酸 Acetoacetic acid |
6.88±0.92a | 18.01±2.59bc | 20.52±0.47d | 18.03±0.27b | 17.60±1.10b | 椭圆形 Oval |
| 硫酸铵 Ammonium sulphate |
17.64±0.24b | 20.46±3.07b | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| 蛋白胨 Peptone |
66.46±0.67g | 21.53±3.53b | 20.26±0.24d | 40.03±0.38f | 39.34±0.50d | 椭圆形 Oval |
| 硝酸铵 Ammonium nitrate |
22.87±0.61c | 27.98±2.65a | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| 硝酸钠 Sodium nitrate |
86.95±0.74h | 20.26±2.91b | 19.41±0.46d | 32.82±0.41e | 29.28±0.69c | 椭圆形 Oval |
| 注:表中各数据为每个处理的平均值±标准误;列中不同小写字母表示每个因素各水平间差异达显著水平(P < 0.05);−:该条件下未见附着胞形成. Note: All data are the mean value of each treatment±standard error; Different lowercase letters denote significant difference (P < 0.05) in each column; −: no adherent cell is formed under this condition. | ||||||
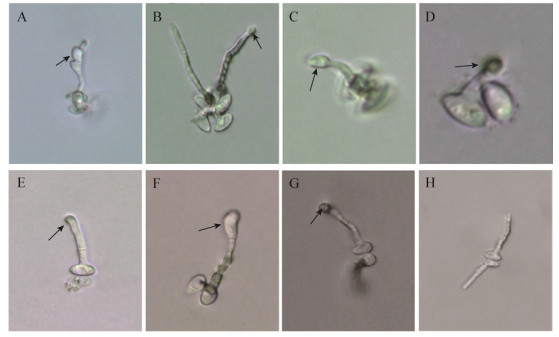
由表 4可知,外源CaCl2显著影响P. medicaginis子囊孢子的萌发率、芽管长度、附着胞、菌落的形成,当CaCl2浓度在0.1−10.0 mmol/L范围内,子囊孢子萌发率、芽管长度、附着胞、菌落形成达到最大,分别为77.35%、30.27 μm、66.67%、75.00%,可见子囊孢子萌发产生的芽管基部略膨大,芽管顶端膨大形成椭圆形和近圆形的附着胞(图 2),以0.1−1.0 mmol/L形成的近圆形附着胞最多,达到60%以上。但当Ca2+浓度增加至100 mmol/L,附着胞形成被抑制,萌发率、芽管长度等指标差异不大,苯胺蓝染色发现(图 2E),子囊孢子内的遗传物质随着芽管生长转移至附着胞内,孢子呈扁平状,表明遗传物质控制子囊孢子发育并转移至附着胞满足其侵染需要。
| 浓度 Concentration(mmol/L) |
子囊孢子萌发率 Germination rate of ascospores (%) |
芽管长度 Length of bud tube (μm) |
附着胞形成率 Formation rate of appressorium (%) |
菌落大小 Colony size |
附着胞特征 Characteristics of appressorium |
|
| 长度 Length (μm) |
宽度 Width (μm) |
|||||
| CK | 18.55±1.01a | 6.61±0.33a | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| 0.1 | 46.55±0.34b | 25.52±4.49b | 29.41±0.67b | 13.33±0.10b | 12.73±0.43b | 椭圆形 Oval |
| 1 | 61.17±0.42c | 25.91±3.52c | 30.77±0.70c | 28.57±0.44c | 27.29±0.80c | 圆形或椭圆形 Circular or oval |
| 10 | 77.35±0.16e | 30.27±2.81e | 66.67±0.15e | 75.00±0.39e | 74.45±0.79e | 圆形或椭圆形 Circular or oval |
| 100 | 71.31±0.55d | 28.17±2.03d | 35.71±0.50d | 38.46±0.23d | 37.31±0.66d | 圆形或椭圆形 Circular or oval |
| 注:表中各数据为每个处理的平均值±标准误;列中不同小写字母表示每个因素各水平间差异达显著水平(P < 0.05);−:该条件下未见附着胞形成. Note: All data are the mean value of each treatment±standard error; Different lowercase letters denote significant difference (P < 0.05) in each column; −: no adherent cell is formed under this condition. | ||||||

|
| 图 2 Ca2+对P. medicaginis子囊孢子萌发的影响(400×) Figure 2 The effect of Ca2+ on the ascospores germination of P. medicaginis (400×) Note: A−B: 0.1 mmol/L; C−E: 1 mmol/L; F−G: 10 mmol/L; H−I: 100 mmol/L. |
|
|
由表 5可知,Ca2+螯合剂EGTA对P. medicaginis子囊孢子的萌发、芽管长度、附着胞、菌落形成均有显著影响,随着EGTA浓度的增加,子囊孢子萌发率和附着胞的形成被抑制。当EGTA浓度为0.1 mmol/L时,形成椭圆形的附着胞(图 3A);当EGTA浓度大于1 mmol/L时,子囊孢子不能萌发,表明低浓度EGTA对子囊孢子的萌发和附着胞的形成不产生影响,而高浓度EGTA则抑制子囊孢子萌发。
| 浓度 Concentration(mmol/L) |
子囊孢子萌发率 Germination rate of ascospores (%) |
芽管长度 Length of bud tube(μm) |
附着胞形成率 Formation rate of appressorium (%) |
菌落大小 Colony size(μm) |
附着胞特征 Characteristics of appressorium |
| CK | 18.55±1.01c | 6.61±0.33c | − | − | − |
| 0.1 | 14.94±0.79b | 4.51±1.94b | − | − | − |
| 1 | 0.00±0.00a | 0.00±0.00a | − | − | − |
| 10 | 0.00±0.00a | 0.00±0.00a | − | − | − |
| 注:表中各数据为每个处理的平均值±标准误;列中不同小写字母表示每个因素各水平间差异达显著水平(P < 0.05);−:该条件下未见附着胞形成. Note: All data are the mean value of each treatment±standard error; Different lowercase letters denote significant difference (P < 0.05) in each column; −: no adherent cell is formed under this condition. | |||||
|
| 图 3 Ca2+调节剂对P. medicaginis子囊孢子萌发的影响(400×) Figure 3 Effects of Ca2+ regulator on ascospore germination of P. medicaginis (400×) Note: A: EGTA; B: EGTA (10 mmol/L)+A23187 (10 µmol/L); C: Chloropromazine; D−F: Nicardipine. |
|
|
由表 6可知,随着CaCl2浓度的增加,EGTA的抑制效果会被逐渐解除。EGTA与CaCl2的浓度比为10:1时,子囊孢子的萌发被完全抑制;浓度比为1:1时,子囊孢子萌发率显著高于对照,芽管长度显著低于对照,未形成附着胞和菌落;比例达到1:10时,子囊孢子的萌发率、芽管长度及附着胞的形成率显著提高并形成圆形或椭圆形的附着胞,菌落开始形成。
| EGTA:Ca2+(mole ratio) | 子囊孢子萌发率 Germination rate of ascospores (%) |
芽管长度 Length of bud tube (μm) |
附着胞形成率 Formation rate of appressorium (%) |
菌落大小 Colony size |
附着胞特征 Characteristics of appressorium |
|
| 长度 Length (μm) |
宽度 Width (μm) |
|||||
| CK | 18.55±1.01b | 6.61±0.33c | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| 10:1 | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| 1:1 | 19.07±0.06c | 5.94±0.67b | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| 1:10 | 75.34±0.36d | 28.37±0.42d | 59.69±0.58b | 76.98±0.23b | 79.45±0.72b | − |
| 注:表中各数据为每个处理的平均值±标准误;列中不同小写字母表示每个因素各水平间差异达显著水平(P < 0.05);−:该条件下未见附着胞形成. Note: All data are the mean value of each treatment±standard error; Different lowercase letters denote significant difference (P < 0.05) in each column; −: no adherent cell is formed under this condition. | ||||||
由表 7可知,在EGTA中加入Ca2+载体A23187可以解除EGTA对子囊孢子的抑制作用,子囊孢子萌发率显著增加(图 3B)。CaM拮抗剂Chloropromazine浓度为0.01 mmol/L时,子囊孢子不萌发。通过显微观察发现,24 h可看到子囊孢子周围出现絮状物,48、72 h后絮状物质逐渐增多,72 h用苯胺蓝染色后,孢子和絮状物均被染成蓝色且孢子的染色较深(图 3C)。磷酸脂酶(phospholipase C,PLC)抑制剂Neomycin浓度为0.1 mmol/L时,子囊孢子不萌发且未见溶解。细胞膜Ca2+通道阻断剂Nicardipine浓度为1 mmol/L时子囊孢子不萌发,24 h后通过显微镜观察发现子囊孢子的周围产生颗粒状的囊泡(图 3D),部分孢子呈现腐蚀状(图 3E),苯胺蓝染色后发现油滴结构并未受到Nicardipine的影响(图 3F)。
| 外源物种类 Exogenous species |
浓度/比例 Concentration (mmol/L)/Proportion |
子囊孢子萌发率 Germination rate of ascospores (%) |
芽管长度 Length of bud tube (μm) |
附着胞形成率 Formation rate of appressorium (%) |
菌落大小 Colony size |
附着胞特征 Characteristics of appressorium |
|
| 长度 Length (μm) |
宽度 Width (μm) |
||||||
| CK | 0 | 18.55±1.01b | 6.61±0.33b | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| EGTA:A23187 | 10:0.01 | 20.43±1.36c | 7.76±0.58c | 45.83±0.11b | 7.14±0.16b | 6.93±0.42b | 圆形或椭圆形 Circular or oval |
| Chloropromazine | 0.01 | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| Neomycin | 0.1, 1, 10, 100 | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| Nicardipine | 1 | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | 0.00±0.00a | − |
| 注:表中各数据为每个处理的平均值±标准误;列中不同小写字母表示每个因素各水平间差异达显著水平(P < 0.05);−:该条件下未见附着胞形. Note: All data are the mean value of each treatment±standard error; Different lowercase letters denote significant difference (P < 0.05) in each column; −: no adherent cell is formed under this condition. | |||||||
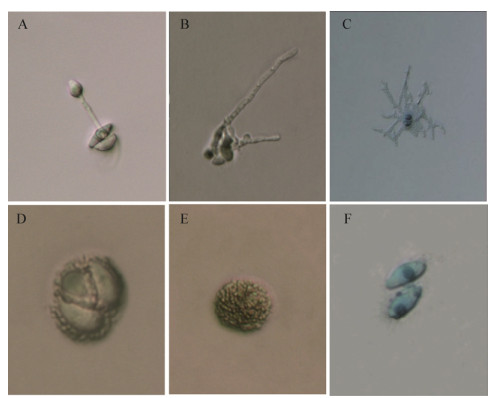
从图 4可以看出,叶片上形成的子实体黑褐色,直径为0.2−4.0 mm (图 4A);组织切片观察,子囊盘突破寄主表皮组织半埋生于叶片组织中,子实层由多个子囊和侧丝组成(图 4B);扫描电镜观察发现,未成熟的子囊盘埋生于寄主表皮细胞下(图 4C);成熟后突破寄主表皮结构呈球形状凸起,中间开裂露出内部排列整齐的子囊(图 4D);子囊顶端膨大,无囊盖,孔口呈纵向开裂(图 4E−F)。人工培养菌落灰黑色,直径1−2 mm,高度约2 mm左右,成熟后子囊孢子弹出并发育成菌落(图 4G箭头1),一个子实体大约释放出200个左右的子囊孢子(图 4G箭头2);子囊盘结构完整(图 4H),子囊内含8个子囊孢子(图 4H箭头处),子囊和侧丝基部聚生成柄状(图 4I)。
|
| 图 4 P. medicaginis子实体结构特征 Figure 4 Structural characteristics of fruit body of P. medicaginis 注:A−B:苜蓿叶片上子实体及组织切片;C:未成熟子囊盘;D:成熟子囊盘及子囊;E:子囊;F:子囊孔口;G−I:V8培养基上培养的子实体、子囊盘及子囊孢子. EC:表皮细胞;CL:裂口;SW:侧丝;AS:子囊;FB:子实体;RAS:子囊孢子. Note: A−B: Fruiting body and tissue section of alfalfa leaves; C: Immature disc; D: Mature disc and sac; E: Ascus; F: Orifice; G−I: Fruiting bodies, sac and spora spores grown on V8 medium. EC: Epidermal cells; CL: Cleft; SW: Lateral filament; AS: Ascus; FB: Fruiting body; RAS: Sac spores. |
|
|
扫描电镜发现,子囊孢子由子囊顶端的孔口释放出(图 5A),孢子尾部带有粘性物质(图 5A),弹射出的成对的孢子落在子实体周围(图 5B),子囊裂口处可见溢出的椭圆形子囊孢子(图 5C),子囊孢子饱满,卵圆形,表面光滑或有纹饰(图 5D、5E),光滑表面进一步放大发现孢子外壁为凹凸不平(图 5F),分析可能是孢子外层具有膜。透射电镜观察发现,子囊盘发育完整,包括囊基细胞、侧丝、子囊和子囊孢子。囊基细胞发达,内含大量的脂类物质(图 5G);侧丝分布在子囊周围(图 5H);菌丝细胞内有液泡和伏鲁宁体结构(图 5I),细胞核物质密集,胞内充满电子致密度高物质,菌丝壁较厚(图 5J);侧丝内富含线粒体等细胞器(图 5K),子囊孢子细胞核物质密集,核外被脂质膜(图 5L),而菌丝细胞的细胞核未观察到类似结构(图 5M);胞内线粒体、囊泡和脂类物质数量多(图 5N),分布在电子致密度高物质中,子囊孢子细胞壁较厚,内外层不同,外壁颜色较深,向内与细胞质膜方向逐渐变浅(图 5O);子囊内的子囊孢子细胞壁外层被波浪形浅色物质包裹(图 5P),子囊顶端有一类似于凸透镜结构(图 5Q),侧面有部分组织溶解(图 5R),但未观察到孔口结构,分析这个凸透镜结构是子囊孢子释放的孔口,当子囊吸水膨胀后,来自子囊内的压力将孢子挤出。
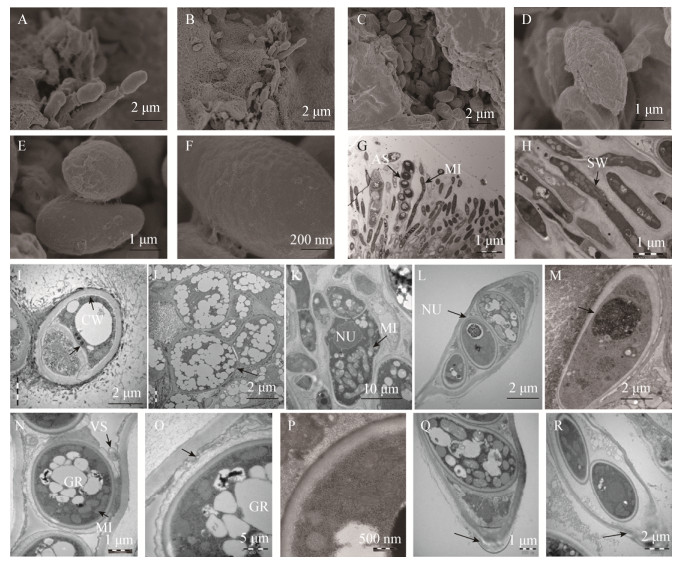
|
| 图 5 P. medicaginis子实体超微结构特征 Figure 5 Ultrastructural characteristics of fruit body of P. medicaginis 注:A:子囊顶端释放的子囊孢子;B−E:子囊孢子;F:子囊孢子外壁;G:子囊、子囊孢子及侧丝;H:侧丝;I:菌丝细胞内液泡及伏鲁宁体结构;J:子囊盘菌丝结构;K:产囊母细胞;L:子囊孢子的细胞核;M:菌丝细胞的细胞核;N:子囊内子囊孢子含有的脂类物质及线粒体;O:子囊孢子细胞壁;P:子囊内的子囊孢子细胞壁;Q:子囊顶部;R:子囊顶端溶解;CW:细胞壁内侧;FL:伏鲁宁体;MI:线粒体;GR:脂类物质;NU:细胞核;VS:泡囊结构. Note: A: Ascospores released from the tip of the ascospore; B−E: Ascospore; F: Outer wall of ascospore; G: Mature ascospores, sac spores and lateral filaments; H: Lateral filament; I: Mycelial cells and voronin body structure; J: Apothecium hyphal structure; K: Blastocyst; L: The nucleus and apex of ascospores; M: Nucleus of mycelium cell; N: Lipids and mitochondria in ascospores; O: Ascospore cell wall; P: Ascus wall and ascus; Q: A top amplification; R: Apical dissolution; CW: Medial cell wall; FL: Voronin body; MI: Mitochondrion; GR: Ascospores oil; NU: Nucleus; VS: Vesicle structure. |
|
|
P. medicaginis通过有性生殖产生子囊孢子,在条件适宜时子囊孢子萌发侵染苜蓿叶片完成侵染过程,叶片上形成的子囊盘可进行远距离传播扩散,因此,研究子囊孢子的萌发对深入研究P. medicaginis侵染机制具有重要的意义。
附着胞是植物病原真菌侵染寄主的关键结构,直接影响真菌与植物的相关识别,介导病原真菌的侵入过程[21]。前人就附着胞形成机理进行了大量的研究,研究结果为揭示病原菌附着胞形成的生物学意义和侵入机制提供了重要的依据[22-23]。王华荣等[12]研究发现,P. medicaginis侵入寄主不形成附着胞,而是以直接侵入方式侵入寄主,表明该菌侵入寄主可以不形成附着胞等侵染结构即可完成侵染,进而建立侵染关系。本试验研究结果表明,合适的碳、氮源和Ca2+能够诱导子囊孢子形成附着胞,而且Ca2+浓度的稳定对P. medicaginis子囊孢子附着胞的形成是必不可少的,充分说明适宜的环境条件可以诱导P. medicaginis子囊孢子形成附着胞,这一研究结果与杨继余等在榆白涩病病菌上的研究结果[24]相同。
EGTA作为一种金属螯合剂与Ca2+作用形成金属螯合物,从而影响胞内Ca2+的浓度[25],A23187与Ca2+形成的中性复合物进入细胞膜增加了细胞膜对Ca2+的渗透性[26]。本试验研究结果表明,添加Ca2+后EGTA的抑制作用被逐渐解除,Ca2+载体A23187能够诱导附着胞的形成,试验证明钙信号途径参与了P. medicaginis子囊孢子附着胞形成过程的调控。
PLC抑制剂Neomycin能够抑制子囊孢子的萌发,分析原因是Neomycin抑制了GTP激活磷酸脂酶C (PLC)使磷脂酰肌醇-4, 5-二磷酸(PIP2)水解为二脂酰甘油(diacyl glycerol,DAG)和三磷酸肌醇(inositol triphosphate,IP3),进而抑制了IP3诱导胞内钙库对Ca2+的释放[27];Ca2+通道调节Nicardipine和CaM拮抗剂Chloropromazine不仅抑制子囊孢子的萌发,而且导致子囊孢子出现溶解现象,推测溶解可能与细胞凋亡信号途径的启动有关。试验结果表明,钙信号途径参与了P. medicaginis子囊孢子的萌发和附着胞形成过程的调控。
菌丝细胞内丰富的内溶物有助于增加膨压,利于穿透寄主细胞壁[28],而线粒体作为真核生物重要的细胞器,为细胞的代谢过程提供必要的能量基础,在调节钙离子平衡、调控细胞的凋亡过程和代谢物的合成中发挥作用[29-31]。本试验观察发现,P. medicaginis子实体菌丝细胞内不仅存在大量内溶物,而且子囊母细胞和子囊孢子内含有丰富的线粒体,为该菌的生长发育提供了物质和能量基础。
子囊顶端的结构和开口方式不仅是盘菌分类的重要依据,而且决定了孢子的释放机制。观察发现,该菌子囊顶端未见囊盖,子囊孢子通过子囊顶部的孔口释放,研究结果与文献[32]一致,但是我们首次观察发现子囊顶端具有类似凸透镜结构,这种凸透镜结构是子囊孢子释放的孔口。扫描电镜观察发现,子囊盘弹出的子囊孢子多为成对出现,这一现象与前人的研究结果[5, 33]相同,Morgan等[5]的研究表明,子囊孢子成对出现可能是其成功侵染寄主所必需的,单个子囊孢子不利于侵染寄主,内在机制有待于深入研究。该研究结果对揭示子囊孢子的释放机制提供了重要的细胞学事件。
透射电镜观察发现,成熟子囊孢子内脂质含量明显增多,推测脂类物质为该菌的生长发育提供能量物质,分析这与苜蓿叶片富含丰富的蛋白质相关[34]。该菌通过何种途径利用脂类物质完成生活史有待于后续深入研究。
致谢: 本论文中的扫描电镜照片由山东微亚生物科技有限公司拍摄完成,透射电镜照片由宁夏医科大学医学科学技术研究中心电镜室拍摄完成,在此谨表谢意。| [1] |
Li Y, Huang HY, Wang Y, et al. Transcriptome characterization and differential expression analysis of disease-responsive genes in alfalfa leaves infected by Pseudopeziza medicaginis[J]. Euphytica, 2018, 214(7): 126. DOI:10.1007/s10681-018-2204-5 |
| [2] |
Li Y, Shi J, Cui NN, et al. Lucerne common leaf spot (Pseudopeziza medicaginis) decreases the photosynthetic performance and forage quality of Medicago sativa[J]. Acta Prataculturae Sinica, 2017, 26(10): 149-157. (in Chinese) 李杨, 史娟, 崔娜娜, 等. 苜蓿褐斑病对紫花苜蓿光合作用及草品质的影响[J]. 草地学报, 2017, 26(10): 149-157. |
| [3] |
Wong E, Flerx DS, Latch GCM. The oestrogenic activity of white clover[J]. New Zealand Journal of Agricultural Research, 1971, 14: 639-645. DOI:10.1080/00288233.1971.10421658 |
| [4] |
Bickoff EM, Loper GM, Hanson CH, et al. Effect of common leafspot on coumestans and flavones in alfalfa[J]. Crop Science, 1967, 7(3): 259-261. DOI:10.2135/cropsci1967.0011183X000700030027x |
| [5] |
Morgan WC, Parbery DG. Effects of Pseudopeziza leaf spot disease on growth and yield in lucerne[J]. Australian Journal of Agricultural Research, 1977, 28(6): 1029-1040. DOI:10.1071/AR9771029 |
| [6] |
Yuan QH, Ma HW, Xu BL. Pathogenic differentiation of Pseudopeziza medicaginis[J]. Acta Agrestia Sinica, 2007, 15(4): 312-315. (in Chinese) 袁庆华, 马鸿文, 徐秉良. 苜蓿假盘菌致病力分化研究[J]. 草地学报, 2007, 15(4): 312-315. |
| [7] |
Shi J, He DH. Review on research of Pseudopeziza mdicaginis in China[J]. Journal of Agricultural Sciences, 2005, 26(4): 68-71. (in Chinese) 史娟, 贺达汉. 我国苜蓿褐斑病研究现状[J]. 农业科学研究, 2005, 26(4): 68-71. |
| [8] |
Yuan QH, Li XL, Zhang WS. Studies on Pseudopeziza medicaginis and its biological characteristics[J]. Plant Protection, 2001, 27(1): 8-12. (in Chinese) 袁庆华, 李向林, 张文淑. 苜蓿假盘菌及其生物学特性研究[J]. 植物保护, 2001, 27(1): 8-12. |
| [9] |
Zhong SL, Wang HR, Shi J. The biological characteristics of Pseudopeziza medicaginis in alfalfa[J]. Pratacultural Science, 2011, 28(6): 946-950. (in Chinese) 钟少林, 王华荣, 史娟. 苜蓿假盘菌的生物学特性研究[J]. 草业科学, 2011, 28(6): 946-950. |
| [10] |
Zhang JY, Chen BJ. Study on isolating methods and culture characters for Pseudopeziza medicaginis[J]. Grassland and Turf, 2012, 32(4): 20-23. (in Chinese) 张君艳, 陈本建. 苜蓿假盘菌分离方法及培养性状比较研究[J]. 草原与草坪, 2012, 32(4): 20-23. |
| [11] |
Shi J, Han QM, Zhang HC, et al. Cytological observations of infection on alfalfa leaves of Pseudopeziza medicaginis[J]. Mycosystema, 2008, 27(2): 183-192. (in Chinese) 史娟, 韩青梅, 张宏昌, 等. 苜蓿假盘菌侵染苜蓿叶片的细胞学研究[J]. 菌物学报, 2008, 27(2): 183-192. |
| [12] |
Wang HR, Shi J, Ren B. Inoculation methods of Pseudopeziza medicaginis and infection pathway by scanning slectron microscope observation[J]. Pratacultural Science, 2012, 29(12): 1816-1820. (in Chinese) 王华荣, 史娟, 任斌. 苜蓿褐斑病菌离体叶片接种方法及侵染途径观察[J]. 草业科学, 2012, 29(12): 1816-1820. |
| [13] |
Huang L, Yang JY, Fang YL, et al. Efficient genetic transformation and nuclear behavior during the process of appressorial development in Colletotrichum gloeosporioides[J]. Journal of Nanjing Forestry University (Natural Science Edition), 2017, 41(6): 68-72. (in Chinese) 黄麟, 杨济云, 方玉兰, 等. 杉木炭疽菌遗传转化及附着孢发育过程的细胞核行为观察[J]. 南京林业大学学报:自然科学版, 2017, 41(6): 68-72. |
| [14] |
Lin FC. Cell biology of appressorium formation of Magnaporthe grisea[J]. Acta Phytopathologica Sinica, 2001, 31(2): 97-101. (in Chinese) 林福呈. 稻瘟病菌附着胞形成的细胞生物学[J]. 植物病理学报, 2001, 31(2): 97-101. |
| [15] |
Jin Y. Effects of different carbon and nitrogen sources on Phyllosticta chlorospora McAlp of Prunus armeniaca L[J]. Northern Horticulture, 2013(7): 140-141. (in Chinese) 金岩. 不同碳源和氮源对杏斑点病病菌的影响[J]. 北方园艺, 2013(7): 140-141. |
| [16] |
Fan WZ, An KY, Zhang XX, et al. Influence on the growth of Paeonia suffruticosa Alternaria leaf spot in different carbon and nitrogen sources[J]. Northern Horticulture, 2011(17): 154-155. (in Chinese) 范文忠, 安可英, 张晓翔, 等. 不同的碳氮源对牡丹花链格孢菌叶斑病菌生长影响[J]. 北方园艺, 2011(17): 154-155. |
| [17] |
Zeng DX, Zhang XY, Jia SJ, et al. Bacillus subtilis C-D6 as a potential biocontrol agent against appressorium formation of Colletotrichum capsici[J]. Microbiology China, 2015, 42(12): 2377-2385. (in Chinese) 曾大兴, 张晓阳, 贾书娟, 等. 枯草芽孢杆菌C-D6对辣椒炭疽菌附着胞形成的抑制作用研究[J]. 微生物学通报, 2015, 42(12): 2377-2385. |
| [18] |
Wang LA, Wang YC, Li CW, et al. Ca2+ signaling pathway involved in Magnaporthe grisea conidium germination and appressorium formation[J]. Mycosystema, 2003, 22(3): 457-465. (in Chinese) 王立安, 王源超, 李昌文, 等. Ca2+信号途径参与稻瘟病菌分生孢子萌发及附着胞形成的调控[J]. 菌物系统, 2003, 22(3): 457-465. |
| [19] |
Wang JH, Shi J, Yu YZ. Research of growth and morphology of Pseudopeziza medicaginis in different media[J]. Journal of Agricultural Sciences, 2007, 28(1): 15-17. (in Chinese) 王蓟花, 史娟, 于有志. 不同培养基上苜蓿假盘菌生长状况及形态学研究[J]. 农业科学研究, 2007, 28(1): 15-17. |
| [20] |
Yao JN, Zhao J, Zhang HC, et al. Histological and cytological observations of pycnial and aecial formation of Puccinia recondita on Clematis intricata[J]. Mycosystema, 2015, 34(6): 1085-1091. (in Chinese) 姚娟妮, 赵杰, 张宏昌, 等. 铁线莲上隐匿柄锈菌性孢子器和锈孢子器发育的组织学和细胞学观察[J]. 菌物学报, 2015, 34(6): 1085-1091. |
| [21] |
Yao Q, Guo Y, Wei FY, et al. A bZIP-type transcription factor CfHac1 is involved in regulating development and pathogenesis in Colletotrichum fructicola[J]. Mycosystema, 2019, 38(10): 1643-1652. (in Chinese) 姚权, 郭源, 魏丰园, 等. bZIP转录因子CfHac1参与调控果生刺盘孢菌的生长发育和致病力[J]. 菌物学报, 2019, 38(10): 1643-1652. |
| [22] |
Sun GC, Qi XB, Wilson RA. A feed-forward subnetwork emerging from integrated TOR- and cAMP/PKA-signaling architecture reinforces Magnaporthe oryzae appressorium morphogenesis[J]. Molecular Plant-Microbe Interactions, 2019, 32(5): 593-607. DOI:10.1094/MPMI-10-18-0287-R |
| [23] |
Nozaka A, Nishiwaki A, Nagashima Y, et al. Chloramphenicol inhibits eukaryotic Ser/Thr phosphatase and infection-specific cell differentiation in the rice blast fungus[J]. Scientific Reports, 2019(1): 9283. |
| [24] |
Yang JY, Wang N, Wang LS. Influence of different carbon and nitrogen sources on the growth of Cylindrosporium ulmi (Fr.) Vassil. of Ulmus pumila L[J]. Northern Horticulture, 2012(19): 153-154. (in Chinese) 杨继余, 王娜, 王立事. 不同碳、氮源对榆白涩病病菌的影响[J]. 北方园艺, 2012(19): 153-154. |
| [25] |
Parrotta L, Aloisi L, Suanno C, et al. A low molecular-weight cyclophilin localizes in different cell compartments of pyrus communis pollen and is released in vitro under Ca2+ depletion[J]. Plant Physiology and Biochemistry, 2019, 144: 197-206. DOI:10.1016/j.plaphy.2019.09.045 |
| [26] |
Wu JZ, Zhao J. Effects of calcium and ionophore A23187 on in vitro development of early embryo in rice (Oryza sativa L.)[J]. Journal of Wuhan Botanical Research, 2003, 21(5): 375-384. (in Chinese) 吴娟子, 赵洁. 钙和钙离子载体A23187对水稻早期胚胎离体发育的影响[J]. 武汉植物学研究, 2003, 21(5): 375-384. |
| [27] |
Hao ZM, Hao J, Li ZY, et al. Effects of phospholipase C inhibitor U-73122 on conidial germination and HT-toxin activity of Setosphaeria turcica[J]. Acta Agriculturae Boreali-Sinica, 2010, 25(6): 118-121. (in Chinese) 郝志敏, 郝杰, 李志勇, 等. 磷脂酶C特异性抑制剂U-73122对玉米大斑病菌分生孢子萌发及毒素活性的影响[J]. 华北农学报, 2010, 25(6): 118-121. |
| [28] |
Shi J, Wang HR, Zhong SL. Ultrastructural characteristics of compatible Pseudopeziza medicaginis interaction with alfalfa leaf[J]. Acta Prataculturae Sinica, 2012, 21(5): 122-127. (in Chinese) 史娟, 王华荣, 钟少林. 苜蓿假盘菌与苜蓿叶片亲和性互作的超微结构特征[J]. 草业学报, 2012, 21(5): 122-127. |
| [29] |
Mailloux RJ, Treberg JR. Protein S-glutathionlyation links energy metabolism to redox signaling in mitochondria[J]. Redox Biology, 2016, 8: 110-118. DOI:10.1016/j.redox.2015.12.010 |
| [30] |
Hockenbery DM, Giedt CD, O'Neill JW, et al. Mitochondria and apoptosis: new therapeutic targets[J]. Advances in Cancer Research, 2002, 85: 203-242. DOI:10.1016/S0065-230X(02)85007-2 |
| [31] |
Li YQ, Zhang CB, Zhao HK, et al. Extraction of high purity mitochondrial DNA from glycine max for genome sequencing[J]. Genomics and Applied Biology, 2015, 34(8): 1734-1738. (in Chinese) 李玉秋, 张春宝, 赵洪锟, 等. 适于基因组测序的高纯度的大豆线粒体基因组DNA提取方法[J]. 基因组学与应用生物学, 2015, 34(8): 1734-1738. |
| [32] |
Alexpoulos CJ. Introductory Mycology[M]. Translated by Yao YJ, Li Y. 4th ed. Beijing: China Agriculture Press, 2002: 334 (in Chinese) 阿历索保罗.菌物学概论[M].姚一建, 李玉, 译. 4版.北京: 中国农业出版社, 2002: 334 |
| [33] |
Schmiedeknecht M. Mechanik und Energetik des Sporenausstosses bei Pseudopeziza medicaginis (Lib.) Sacc[J]. Journal of Phytopathology, 1964, 51(1): 29-40. DOI:10.1111/j.1439-0434.1964.tb03409.x |
| [34] |
Li CJ, Wang YX, Zhang B. Proportional fertilization: effects on quality and yield of alfalfa[J]. Chinese Agricultural Science Bulletin, 2018, 34(36): 146-152. (in Chinese) 李陈建, 王玉祥, 张博. 配比施肥对苜蓿品质和产量的影响[J]. 中国农学通报, 2018, 34(36): 146-152. |
 2020, Vol. 47
2020, Vol. 47