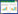扩展功能
文章信息
- 袁玉涛, 史娟, 马新, 杨凯
- YUAN Yu-Tao, SHI Juan, MA Xin, YANG Kai
- 紫花苜蓿白粉病病原菌鉴定及其生物学特性
- Identification and biological characteristics of alfalfa powdery mildew fungi
- 微生物学通报, 2020, 47(11): 3539-3550
- Microbiology China, 2020, 47(11): 3539-3550
- DOI: 10.13344/j.microbiol.china.190899
-
文章历史
- 收稿日期: 2019-11-06
- 接受日期: 2020-03-18
- 网络首发日期: 2020-05-06
紫花苜蓿(Medicago sativa L.)作为一种产量高、品质优、耐刈割的优良豆科牧草,在世界各地广泛栽培[1-4]。发展草产业促进农业供给侧结构性改革,成为草牧业发展的基础。近年来,随着优质饲草市场需求的增加,紫花苜蓿种植面积快速增加,苜蓿白粉病成为国内外苜蓿产区普遍发生的一种真菌性病害[1, 5-6],直接导致苜蓿品质下降,适口性降低。为了有效控制白粉病,国内外学者在病原菌的侵染机制[4]、品种抗病性评价[7]、病害预测预报技术[8]等方面开展了相关的研究,研究结果为苜蓿的抗病育种、监测预警及其田间防控等提供了重要支撑。宁夏作为典型的农牧区,白粉病已成为影响苜蓿优质安全生产的主要病害之一[9]。研究苜蓿白粉病病原菌的生物学特征,可为明确宁夏苜蓿白粉病病原菌的分类地位提供理论依据。
真菌有性生殖产生的子实体具有过渡不良环境的作用[10],是病原菌越冬翌年完成初侵染的重要结构。闭囊壳作为白粉菌的有性子实体,其形成条件一直是学者们关注的问题,明确闭囊壳形成条件,可为阐明苜蓿白粉病的侵染循环提供重要依据。目前有关苜蓿白粉病的病原菌鉴定,国内外学者存在3种不同的观点:Stuteville等认为苜蓿白粉病是由蓼白粉菌(Erysiphe polygoni DC.)所引起[11];李敏权等依据分生孢子和子囊果的形态学特征将甘肃省定西市九华沟紫花苜蓿白粉病病原菌鉴定为蓼白粉菌(E. polygoni DC.)[12];时永杰依据分生孢子和闭囊壳的形态学特征将甘肃地区紫花苜蓿白粉病病原菌鉴定为豆科内丝白粉菌(Leveillula leguminosarum Golov.)[5];张蓉等认为宁夏地区紫花苜蓿白粉病是由豆科内丝白粉菌(Leveillula leguminosarum Golov.)和豌豆白粉菌(E. pisi DC.)混合侵染[9]。上述研究结果充分表明,需要系统的病原菌生物学特征进行补充,才能为致病菌的鉴定提供数据支撑。鉴于此,有必要对病原菌分生孢子、有性子实体结构、生物学特性以及病害发生条件进行系统研究,阐明这些问题,可为苜蓿白粉病病原菌鉴定和病害防治提供理论依据。
1 材料与方法 1.1 供试样品和病原菌紫花苜蓿,品种为WL298HQ,原产于美国,来源于北京正道生态科技有限公司,有包衣,由宁夏大学农学院草业研究所惠赠。
苜蓿白粉病病原菌为宁夏大学农科实训中心生长的苜蓿上自然发病的白粉病病原菌。
1.2 主要试剂和仪器葡萄糖、甘露醇,天津大茂化学试剂公司;半胱氨酸、甘氨酸,博奥生物集团有限公司;琼脂,范德(北京)生物科技有限公司。
HOBO小型自动气象站,Onset公司;奥林巴斯荧光显微镜,Olympus有限公司;光照培养箱,上海甄明科学仪器有限公司。
1.3 方法 1.3.1 苜蓿的培育选取品种为WL298HQ的苜蓿种子20粒,与适量的细土混匀播于直径为20 cm的花盆中,覆土1 cm,浇透水,覆膜保湿,待出苗后去掉保鲜膜。幼苗长至三叶期疏苗,每盆15株,种植20盆。于2018年9月在宁夏大学农科实训中心日光温室种植。
1.3.2 接种方法采用振动抖落法接种。接种前先用喷壶把苜蓿叶片冲洗干净。采集具有新鲜白粉病病原菌分生孢子的叶片置于接种苜蓿叶片的上方5 cm处,轻轻敲击振动叶片,10 min后在花盆上方50 cm处喷雾。
1.3.3 病原菌形态特征观察闭囊壳和分生孢子的形态特征观察均采用实验室常规水琼脂玻片法观察。将新鲜的分生孢子用毛笔刷轻轻刷在小烧杯中,再用吸管吸一滴放入干净的载玻片上,盖上盖玻片,在显微镜下观察,在所连接的电脑上测量分生孢子的大小,保证观测的分生孢子不低于300个。采集带有大量闭囊壳的叶片在水中浸泡24 h,挑针挑下成熟的闭囊壳放于载玻片,盖上盖玻片,在荧光显微镜下观测闭囊壳、附属丝形态,然后用尖头镊子轻轻敲盖玻片,使闭囊壳释放子囊,观测子囊以及子囊内子囊孢子的形态特征,拍照记录。
1.3.4 白粉病发生条件调查2019年3月底,对越冬苜蓿进行了刈割,2019年4月1日起开始调查,每花盆按照上、中、下均匀选取10片复叶,按照0−4病级标准调查,并计算发病率和病情指数。每周调查1次。
病级标准(自定):0级:无发病叶片;1级:病斑面积 < 25%;2级:病斑面积在25%−50%之间;3级:病斑面积在50%−75%之间;4级:病斑面积 > 75%。
发病率(%)=发病叶片数/调查总叶数×100;

|
自苜蓿叶片首现白粉病开始调查闭囊壳首次出现和成熟的时间,观察闭囊壳形态变化并拍照。
1.3.6 生物学特性研究共设温度、光照、pH、碳源、氮源5种处理。参照《植病研究方法》水琼脂玻片法[13]观察,制作1.5%的水琼脂玻片,将采集好的新鲜分生孢子抖落在上面,放在底部铺有湿润滤纸培养皿中,保证相对湿度≥75%,用封口膜封住培养皿。每玻片为1个处理,每处理3个重复,每重复观察3−5个视野,保证观察的孢子个数≥300个。
温度处理:设置5、10、15、16、18、20、22、24、26、28和30 ℃共11个温度梯度。
光照处理:设置全光照(4 000 lx)、全黑暗和半光照(12 h光照和12 h黑暗) 3个处理。
pH处理:设置pH为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0共10个处理,以蒸馏水(pH 6.5)为CK。用1 mol/L的HCl和NaOH分别配制。
碳源处理:设置葡萄糖、麦芽糖、蔗糖、淀粉、D-木糖、甘露醇共6个处理。以100 mL 1.5%的水琼脂中加入2 g葡萄糖中的含碳量为标准,折算其他碳源的量,配制含不同碳源的水琼脂培养基,制作水琼脂玻片,以不加任何碳源为CK。
氮源处理:设置尿素、蛋白胨、甘氨酸、硝酸钾、半胱氨酸共5个处理。以100 mL 1.5%的水琼脂中加入2 g尿素中的含氮量为标准,折算其他氮源的量,配制含不同氮源的水琼脂培养基,制作水琼脂玻片,以不加任何氮源为CK。
将上述不同处理置于人工培养箱中培养,培养条件为光照4 000 lx、温度25 ℃、湿度≥75%。分别于3、6、12、24 h观察,统计分生孢子的萌发率,以分生孢子芽管长度超过孢子短径的1/2视为萌发,初始萌发率为0。
萌发率(%)=萌发个数/孢子总数×100。
1.4 气象数据的获得通过HOBO小型自动气象站采集气象数据。
1.5 数据处理数据采用DPS V18.10进行方差分析,LSD法进行多重比较(P=0.01)。
2 结果与分析 2.1 苜蓿白粉病症状观察苜蓿叶片正反面均可发生白粉病,严重时可蔓延至叶柄和茎秆,植株下部叶片先开始发病,发病初期叶片表面出现多个近圆形白色的小霉斑,小霉斑逐渐扩大并向四周扩展蔓延,严重的白粉层覆盖整个叶片,随后发病部位的叶组织变为淡黄色,叶片表面白粉层逐渐加厚。显微镜下观察到白粉层上许多菌丝体交替重叠,白粉层上可见橘黄色的小颗粒,逐渐发育成熟变为黄褐色或黑褐色小颗粒,即为成熟的白粉病病原菌闭囊壳。
2.2 无性态分生孢子形态特征观察分生孢子卵圆形或椭圆形,表面光滑,大小为(29−46)×(12.5−21.0) μm,平均大小为40.0 (SD=3.06)× 19.0 μm (SD=2.63) (图 1A)。分生孢子梗直立,每个分生孢子梗串生3−5个分生孢子,分生孢子梗长度为28.6×48.3 μm (图 1B、1C),以向基式的产孢方式在分生孢子梗上产孢。
|
| 图 1 分生孢子和分生孢子梗形态特征 Figure 1 Morphological characteristics of conidia and conidiophore 注:A:分生孢子;B:分生孢子梗和分生孢子;C:叶片表生的菌丝体、分生孢子梗和分生孢子. Note: A: Conidia; B: Conidiophore and conidia; C: Hypergene mycelium of leaf, conidiophore and conidia. |
|
|
闭囊壳着生在菌丝体表层,多3−5个聚生,少散生,少数被菌丝层所缠绕或埋藏在菌丝层内,发育初期为黄色,后逐渐发育为黄褐色至黑褐色。成熟的闭囊壳为黑褐色,球形或近球形,直径范围为71−135 μm,平均直径为110 μm (SD=12.71) (图 2A、2B)。闭囊壳外壁细胞呈不规则的多角形,每个闭囊壳有附属丝21−46条,多数附属丝不分枝,少数不规则分枝1−2次,有隔,表面粗糙,粗细均匀,宽度范围为4.0−11.0 μm,长度范围为19.0−245.0 μm,平均长度为100 μm (SD=46.33) (图 2C、2D),附属丝颜色基部为褐色,向上逐渐变为淡黄色至无色。闭囊壳内含有4−6个子囊,发育不成熟的子囊为双层壁,成熟时变为边界明显的单层壁。子囊倒棒型或卵圆形,具柄,通过小短柄着生在闭囊壳内侧,子囊大小为(58−90)×(29−60) μm,平均为79 (SD=7.30)×45 μm (SD=8.45) (图 2E、2F、2G)。子囊内含有4−6个子囊孢子,子囊孢子单孢、卵圆形或椭圆形,内有脂肪滴。大小为(21−34)×(10.5−20.0) μm,平均为29.0 (SD=3.15)×15.5 μm (SD=2.15) (图 2H、2I、2J)。

|
| 图 2 苜蓿白粉病病原菌有性态特征 Figure 2 The teleomorph characteristics of fungi of alfalfa powdery mildew 注:A:发病后期病叶上的白粉层和黑色小点状的闭囊壳;显微镜下,B:球形或近球形、黑褐色的闭囊壳,多聚生,少散生;C:具有大量附属丝的一个闭囊壳,附属丝表面不光滑;D:一个破裂的闭囊壳(1:不分枝的附属丝;2:偶尔分枝的附属丝);E:一个闭囊壳中含有6个成熟的子囊;F:着生在子实层上的3个子囊;G:成熟和未成熟的子囊,子囊倒棒形或卵圆形,子囊双壁;H:含有4个子囊孢子的子囊;I:含有5个子囊孢子的子囊;J:单孢子囊孢子,子囊孢子内具有脂肪滴. Note: A: At the late stage of the disease, the white powder layer and the small black punctate cleistothecium on the diseased leaves; Under microscope, B: Globular or subglobular, dark brown cleistothecium, cleistothecium more aggregate, less scattered; C: A cleistothecia with a large number of appendages. The surface of appendages is not smooth; D: A ruptured cleistothecia (1: Unbranched appendages; 2: Occasionally branched appendages); E: Six mature asci in a cleistothecia; F: The three asci are on the hymenium; G: Mature and immature asci, ascus inverted rod type or oval, ascus double-wall; H: An ascus containing four ascospores; I: An ascus containing five ascospores; J: Spore-single ascospore, ascospore contained a fat droplet. |
|
|
Erysiphe和Leveillula的共有特征是闭囊壳含有的子囊数目相近,但在Leveillula中,菌丝体半内生,分生孢子梗通常由内生菌丝产生,从寄主表皮气孔伸出,产生单个分生孢子,分生孢子哑铃形或披针形,表面有小疣[14-15],而在Erysiphe中,菌丝体两面生,附着在叶片表面生长分枝,形成足细胞分化出分生孢子梗,以向基式的产孢方式产生单个分生孢子(或假链),分生孢子卵圆形或椭圆形。依据本试验结果菌丝体表生,分生孢子梗形成方式和分生孢子形态特征,认为宁夏紫花苜蓿白粉病病原菌属于Erysiphe。在Erysiphe的分类中,Blumer (1933)和Homma (1937)把E. polygoni DC.划分为另外的亚种,依据闭囊壳的附属丝形态学特征,该亚种后来成为豌豆白粉菌E. pisi DC.。因此,E. polygoni DC.和E. pisi DC.的区分特征主要集中在附属丝的差异上,而其余特征在不同寄生上是可变的。在E. polygoni DC.中,闭囊壳附属丝具有隔膜,大多数不分枝(即少数是分枝)。在E. pisi DC.中,闭囊壳附属丝罕见不规则的分枝(即偶尔分枝)。依据本文中病原菌闭囊壳附属丝的描述,该病原菌被鉴定为E. polygoni DC.。
2.5 发生条件调查由图 3可知,2019年4月29日始见白粉病,5月30日病情持续加重达到最大,发病率为68.0% (SD=3.6%),病情指数为48.1 (SD=3.9),一直持续到6月16日病情趋于下降,6月28日发病率为58.5% (SD=2.16%),病情指数为32.75 (SD=1.9)。结合图 3气象数据分析,5月30日、6月16日和6月28日的平均温度分别为20.85、23.32和23.67 ℃,平均湿度分别为39.69%、67.47%和64.15%,可见紫花苜蓿白粉病发生的最适条件为日平均气温20−24 ℃、日平均湿度40%−60%。
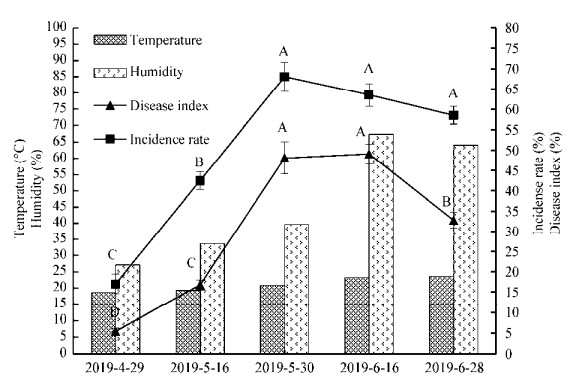
|
| 图 3 苜蓿白粉病发病率和病情指数与环境温湿度的关系 Figure 3 The relationship between the incidence rate and disease index of alfalfa powdery mildew and environmental temperature and humidity |
|
|
由表 1可知,2019年6月11日首次发现叶片表面出现橘黄色小颗粒,将小颗粒收集至实验室制片观察,确认是闭囊壳,计算开始发生白粉病到闭囊壳产生大约需要42 d,发育初期的闭囊壳为橘黄色小颗粒,随后橘黄色小颗粒颜色变深至黄褐色,最后为黑褐色,由形成闭囊壳到成熟周期大概1周左右,分析闭囊壳大量产生时近10 d的气象数据可知,温度范围为14.0−39.2 ℃,平均温度23.54 ℃,湿度范围为46.1%−99.9%,平均湿度64.26%。由此认为,闭囊壳形成的温度范围为20−25 ℃,湿度范围为50%−70%,与秋季气象条件吻合,进一步证明自然条件下苜蓿白粉病病原菌不但可以形成闭囊壳,而且以该结构越冬成为翌年初侵染源。
| 日期 Date |
最低温度 Minimum temperature (℃) |
最高温度 Maximum temperature (℃) |
平均温度 Average temperature (℃) |
最低湿度 Minimum humidity (%) |
最高湿度 Maximum humidity (%) |
平均湿度 Mean humidity (%) |
发生情况 Occurrence situation |
| 4-29 | 18.8 | 36.6 | 24.2 | 33.0 | 77.0 | 55.0 | 发生白粉病 Powdery mildew |
| 5-18 | 12.8 | 33.0 | 19.3 | 19.7 | 60.0 | 43.7 | |
| 6-11 | 10.3 | 32.3 | 20.9 | 17.8 | 59.8 | 37.7 | 发现闭囊壳 Cleistothecium found |
| 6-21 | 18.9 | 26.8 | 26.1 | 68.5 | 96.4 | 86.1 | 大量闭囊壳 Lots of cleistothecium |
| 6-26 | 17.2 | 22.5 | 20.4 | 88.8 | 96.6 | 90.8 | 闭囊壳成熟 Mature cleistothecium |
由表 2可知,分生孢子在5−30 ℃范围内均可萌发,22、24和26 ℃萌发率分别达到84.3%、87.0%和80.3%,三者没有极显著差异;24 ℃条件下萌发最快且萌发率最高,其次萌发率由高到低依次为28、20、30、18、16、15和10 ℃,5 ℃最低;12 h萌发率为11.3%,24 h萌发率仅为13.7%;10 ℃条件下,12 h萌发率为19.7%,24 h达到33.0%。结果表明,分生孢子萌发的最适宜温度为22、24和26 ℃,温度对分生孢子萌发具有高度统计学意义。
| 温度 Temperature (℃) | 萌发时间 Germination time (h) | |||
| 3 | 6 | 12 | 24 | |
| 5 | 1.3D | 2.3F | 11.3E | 13.7I |
| 10 | 2.7D | 6.0F | 19.7E | 33.0H |
| 15 | 15.0C | 29.0E | 41.0D | 48.0G |
| 16 | 16.0BC | 33.3 DE | 47.7CD | 60.3F |
| 18 | 22.7B | 39.7CD | 54.3C | 63.3EF |
| 20 | 30.3A | 45.7BC | 64.7B | 73.7CD |
| 22 | 34.0A | 54.3A | 79.3A | 84.3A |
| 24 | 36.0A | 62.0AB | 80.3A | 87.0AB |
| 26 | 29.7A | 43.7C | 73.3AB | 80.3ABC |
| 28 | 22.3B | 41.7CD | 70.7AB | 77.7BCD |
| 30 | 16.3BC | 33.3DE | 64.7B | 70.3DE |
| 注:同列不同大写字母表示差异极显著(P < 0.01).
Note: Different capital letters in the same column mean extremely significant differences (P < 0.01). | ||||
不同光照对分生孢子萌发的影响试验结果(表 3)表明,光照和半光照条件下分生孢子的萌发率达到88.0%和86.7%,两者无极显著差异,黑暗条件下分生孢子的萌发率最低为80.0%,与二者表现出极显著差异,表明光照有利于分生孢子的萌发。
| 光照 Illumination | 萌发时间 Germination time (h) | |||
| 3 | 6 | 12 | 24 | |
| 全光照 Full illumination | 29.3A | 63.3A | 83.3A | 86.7A |
| 全黑暗 Total darkness | 26.0A | 52.3B | 73.0B | 80.0B |
| 半光照 Half illumination | 29.3A | 62.7AB | 82.7A | 88.0A |
| 注:同列不同大写字母表示差异极显著(P < 0.01). Note: Different capital letters in the same column mean extremely significant differences (P < 0.01). | ||||
不同pH对分生孢子萌发的影响试验结果(表 4)表明,分生孢子在pH 3.0−12.0范围内均可萌发,pH 6.0和pH 6.5时的萌发率最大,分别为76.7%和81.3%,二者无极显著差异,但CK (pH 6.5)的萌发最快,6 h就达到50.7%,pH 5.0和pH 7.0次之,pH 9.0−12.0萌发率较低。表明中性或略偏酸性的条件更有利于苜蓿白粉病病原菌分生孢子的萌发。
| pH | 萌发时间 Germination time (h) | |||
| 3 | 6 | 12 | 24 | |
| 3.0 | 13.7BC | 29.3CD | 31.3DE | 39.7CD |
| 4.0 | 13.3BC | 37.3C | 39.0C | 44.7C |
| 5.0 | 18.7AB | 37.0B | 54.7B | 62.0B |
| 6.0 | 23.0A | 40.3A | 65.7A | 76.7A |
| 7.0 | 16.7ABC | 32.7CD | 51.0B | 60.7B |
| 8.0 | 11.0BC | 16.3E | 32.7CD | 40.0CD |
| 9.0 | 8.0C | 15.7E | 25.7DEF | 32.3DE |
| 10.0 | 8.7C | 16.7E | 25.0EFG | 31.3DE |
| 11.0 | 10.7BC | 19.3E | 23.3FG | 27.7E |
| 12.0 | 8.7C | 14.3E | 18.0G | 26.0E |
| 6.5 (CK) | 24.3A | 50.7A | 71.3A | 81.3A |
| 注:同列不同大写字母表示差异极显著(P < 0.01). Note: Different capital letters in the same column mean extremely significant differences (P < 0.01). | ||||
不同碳源对分生孢子萌发的试验结果(表 5)表明,苜蓿白粉病病原菌的分生孢子对供试的6种碳源都有不同程度的利用,以单糖最好,其次是二糖和多糖;与CK相比,葡萄糖、D-木糖和甘露醇促进分生孢子的萌发和芽管的生长,3 h萌发率分别达到55.3%、48.7%和57.3%,24 h萌发率均高于CK,三者无极显著差异;淀粉、麦芽糖和蔗糖3 h和6 h的萌发率显著低于CK,24 h三者无极显著差异。
| 碳源 Carbon source | 萌发时间 Germination time (h) | |||
| 3 | 6 | 12 | 24 | |
| 葡萄糖 Glucose | 55.3AB | 73.0A | 87.7A | 94.0A |
| 蔗糖 Sucrose | 34.3CD | 63.7B | 83.3AB | 86.7BC |
| 淀粉 Starch | 27.7D | 54.0C | 72.7C | 85.7C |
| 麦芽糖 Malt dust | 37.0BCD | 64.7B | 80.7B | 87.3BC |
| D-木糖 D-xylose | 48.7ABC | 64.7B | 84.3AB | 91.3AB |
| 甘露醇 Mannitol | 57.3A | 67.7AB | 80.7B | 89.0ABC |
| 对照 CK | 36.7BCD | 75.0A | 84.3AB | 88.3BC |
| 注:同列不同大写字母表示差异极显著(P < 0.01). Note: Different capital letters in the same column mean extremely significant differences (P < 0.01). | ||||
不同氮源对分生孢子萌发的试验结果(表 6)表明,供试的5种氮源对分生孢子萌发均产生不同程度的影响,与CK相比,3 h以半胱氨酸对孢子萌发的促进作用最明显,甘氨酸和硝酸钾基本不影响,尿素和蛋白胨表现出抑制作用;24 h除了甘氨酸促进芽管生长外,其他氮源均表现抑制萌发的作用。
| 氮源 Nitrogen source | 萌发时间 Germination time (h) | |||
| 3 | 6 | 12 | 24 | |
| 尿素 Carbamide | 18.3B | 43.7B | 65.0BC | 74.0BC |
| 蛋白胨 Peptone | 17.3B | 50.3AB | 62.3C | 77.7B |
| 甘氨酸 Glycine | 22.7AB | 51.7AB | 76.3A | 85.0A |
| 硝酸钾 Potassium nitrate | 25.7AB | 45.0AB | 58.7C | 67.7C |
| 半胱氨酸 Cysteine | 33.7A | 53.0AB | 66.7BC | 76.7BC |
| 对照 CK | 27.0AB | 53.3A | 72.3AB | 83.3A |
| 注:同列不同大写字母表示差异极显著(P < 0.01).
Note: Different capital letters in the same column mean extremely significant differences (P < 0.01). | ||||
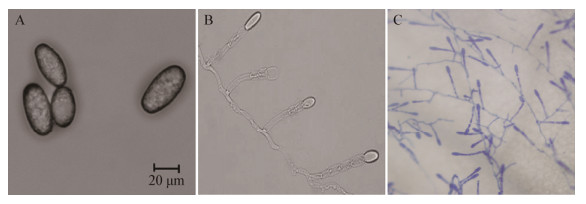
由图 4可以看出,接种在水琼脂上的分生孢子3 h时开始萌发(图 4A),在分生孢子顶端肩胛处萌发长出初生芽管;4 h时可见芽管形成分隔(图 4B);6 h时观察到部分分生孢子形成双芽管(图 4C),此时芽管顶端略彭大形成附着胞,沿附着胞一侧长出初生菌丝,个别附着胞为叉状(图 4D、4E),但大部分无此特征,而是以芽管继续生长(图 4F);12 h以后,芽管为吸取营养开始向下生长插入水琼脂,而且芽管顶端开始分泌物质或被降解(图 4G),伴随着芽管的生长,分生孢子表现出由饱满到皱缩(图 4H)。结果表明,25 ℃条件下,苜蓿白粉病病原菌分生孢子3 h开始萌发,6 h形成附着胞,6 h以后形成初生菌丝,12 h以后可侵入寄主。芽管生长速率为8.62 μm/h。

|
| 图 4 分生孢子的萌发 Figure 4 The germination of conidia 注:A:3 h分生孢子肩胛处萌发产生芽管;B:4 h分生孢子肩胛处萌发产生的芽管形成分隔;C:6 h分生孢子另一端肩胛处萌发形成双芽管;D:6 h分生孢子萌发产生的芽管顶端膨大形成附着胞;E:分生孢子萌发产生芽管顶端膨大形成分叉附着胞;F:分生孢子萌发产生的芽管继续生长;G:芽管顶端分泌物质或被降解;H:皱缩的分生孢子. Note: A: Germinating at the scapula germ tube of 3 h conidia; B: The division of the germinated bud tube at the scapula of 4 h conidia; C: At 6 h, the other end of the conidia germinated at the scapula to form a double bud tube; D: At 6 h, the apical expansion of the germ tube produced by the germination of the conidia forms the appressorium; E: The germination of conidia results in the formation of branching appressorium; F: The growth of the germ tube from the germination of the conidia; G: Secretion or degradation of the apical part of the bud tube; H: A shrunken conidia. |
|
|
关于紫花苜蓿白粉病病原菌的报道国内外有所不同,国外报道主要为E. polygoni DC.[11, 16]一种,在我国主要有E. polygoni DC.[12]、E. pisi DC.[4, 9]和Leveillula leguminosarum Golov.[5]三种,上述研究者依据分类系统[17]、结合菌丝体的着生方式和分生孢子的形态以及病原菌有性态等特征进行了鉴定,研究结果分为Leveillula属和Erysiphe属两个属。在Erysiphe属中,由于E. polygoni DC.和E. pisi DC.无性态结构相近[12],很难通过无性态结构确定病原菌种类,因此二者区分的主要依据为有性态闭囊壳附属丝的分枝;即E. pisi DC.罕见不规则分枝,而在E. polygoni DC.中,附属丝有少数不规则分枝[15],本试验结果也支持这一观点。根据前人研究结果,本试验观察了宁夏紫花苜蓿白粉病病原菌的菌丝体着生方式、无性态分生孢子和有性态闭囊壳的特征,依据菌丝体表生、分生孢子卵圆形或椭圆形的特征,确定该病原菌属于Erysiphe属,依据有性态闭囊壳附属丝有少数不规则分枝的特征,将宁夏紫花苜蓿白粉病病原菌鉴定为E. polygoni DC.,这一结论与李敏权等[12]的研究结果一致,与《中国真菌志·白粉菌目》[17]和《真菌鉴定手册》[18]中E. polygoni DC.的描述基本一致。针对这些分类鉴定研究,表明菌丝体的着生方式、分生孢子、闭囊壳特别是附属丝的形态特征是鉴定白粉病病原菌的重要指标,在今后的研究中要注意这些特征,以更精确地确定病原菌种类。
孢子的萌发条件是决定病害发生与否的首要条件。本试验对宁夏紫花苜蓿白粉病病原菌无性孢子的生物学特性进行了研究,结果表明分生孢子萌发温度范围为5−30 ℃,最适萌发温度范围为22−26 ℃,高于26 ℃时,无论是孢子萌发还是病害的扩展均呈下降趋势,表明高温抑制其生长。光照促进分生孢子的萌发,宁夏地区光照资源丰富,光照一定程度上促进了病害的发生和流行。分生孢子对碳氮源的利用结果表明,白粉病病原菌分生孢子的萌发阶段虽然对外界营养的需求不明显,分生孢子自身可以满足芽管的生长,但是12 h后自身营养已不能满足其生长。
闭囊壳的形成条件一直是学者们关注的问题。子囊孢子是否成为苜蓿白粉病发生的初侵染源尚缺乏直接证据。研究表明,小麦白粉病原菌的子囊孢子不仅是田间白粉病发生的初侵染源[19],而且小麦闭囊壳存活率与海拔高度之间存在显著的负相关性[20],高湿条件对闭囊壳发育有很好的促进作用,相对较低的温度与湿度环境会大大延长闭囊壳的存活时间[21]。本研究结果表明,宁夏紫花苜蓿白粉病病原菌闭囊壳产生的温度条件为20−25 ℃,相对湿度为50%−70%,闭囊壳的形成大约需要42 d,昼夜温差大的环境条件对闭囊壳的形成有利,闭囊壳主要集中在植株的下部叶片上,伴随闭囊壳的形成,苜蓿叶片颜色逐渐变为淡黄色,最后至枯萎脱落,进一步分析认为,满足闭囊壳形成的条件除了适宜的温湿度以外,叶片衰老可能是促进闭囊壳形成的条件之一,需要深入探讨。另外,自然条件下苜蓿白粉病发生的初侵染尚无研究报道,闭囊壳能否成为秋茬苜蓿二次侵染和翌年初侵染源还需要深入研究。
蓼白粉菌(Erysiphe polygoni DC.)隶属于真菌门(Fungi)子囊菌纲(Ascomycetes)真子囊菌亚纲(Euascomycetes)白粉菌目(Erysiphales)白粉菌科(Erysiphaceae)白粉菌属(Erysiphe)[17]。研究表明,蓼白粉菌(E. polygoni DC.)主要危害豇豆、蚕豆、扁豆、菜豆、番茄、黄瓜、南瓜、波叶大黄、甜菜等植物[22-24],主要侵染植物叶片和茎杆,引起植物代谢紊乱而使植物萎蔫,最后导致叶片枯落而使植物品质和产量下降,对紫花苜蓿的危害主要表现在降低苜蓿产量、影响苜蓿品质,进而降低家畜消化率[25]。宁夏地处西北内陆高原,属典型的大陆性半湿润半干旱气候[26],是北方重要的农牧交错带,苜蓿白粉病的频繁发生不仅降低了饲草产量,而且严重影响优质饲草的生产和供给,明确苜蓿白粉病的病原菌,阐明病原菌的特征,是制定科学有效及时防控措施的重要基础。本试验通过分生孢子和闭囊壳的形态特征,结合白粉病发生条件、闭囊壳形成条件以及病原菌的生物学特性,对宁夏紫花苜蓿白粉病病原菌进行了较为系统的研究,可为该病害的分类鉴定、有效防治以及抗病品种选育等提供新思路。
本试验是在温室内完成的,试验结果反映了温室环境条件下苜蓿白粉病的发生规律,相比大田试验调查,极大地减少了田间干扰因素,更能说明病害发生情况与环境条件的内在联系。
| [1] |
Hou TJ. The current situation of alfalfa diseases in China and the control measures[J]. Journal of Neimongol Prataculture, 1994(3/4): 4-8. (in Chinese) 侯天爵. 我国苜蓿病害发生现状及防治对策[J]. 内蒙古草业, 1994(3/4): 4-8. |
| [2] |
Li WR, Zhang SQ, Ding SY, et al. Root morphological variation and water use in alfalfa under drought stress[J]. Acta Ecologica Sinica, 2010, 30(19): 5140-5150. (in Chinese) 李文娆, 张岁岐, 丁圣彦, 等. 干旱胁迫下紫花苜蓿根系形态变化及与水分利用的关系[J]. 生态学报, 2010, 30(19): 5140-5150. |
| [3] |
Bian JH, Liu ZY, Li ZY, et al. Advances in alfalfa improvement using genetic engineering[J]. Pratacultural Science, 2020, 37(1): 139-155. (in Chinese) 边佳辉, 刘自扬, 李宗英, 等. 紫花苜蓿基因工程改良研究进展[J]. 草业科学, 2020, 37(1): 139-155. |
| [4] |
Zhang YM, Ma HL, Tang YZ. Structural changes in leaves in Medicago sativa infected with Erysiphe pisi[J]. Acta Prataculturae Sinica, 2017, 26(2): 88-94. (in Chinese) 张咏梅, 马晖玲, 唐云智. 紫花苜蓿叶片受白粉病菌侵染后结构的变化[J]. 草业学报, 2017, 26(2): 88-94. |
| [5] |
Shi YJ. Study on alfalfa powdery mildew disease[J]. Qinghai Pratacuiture, 1999, 8(1): 7-8. (in Chinese) 时永杰. 苜蓿白粉病的研究[J]. 青海草业, 1999, 8(1): 7-8. |
| [6] |
Nan ZB, Li CJ. A list of fungal diseases of herbage in China[J]. Pratacultural Science, 1994, 11(S1): 3-30. (in Chinese) 南志标, 李春杰. 中国牧草真菌病害名录[J]. 草业科学, 1994, 11(S1): 3-30. |
| [7] |
Li MQ, Chai ZX, Li JH, et al. Evaluation of alfalfa cultivars for resistance to Erysiphe polygoni in the field[J]. Pratacultural Science, 2002, 19(4): 40-42. (in Chinese) 李敏权, 柴兆祥, 李金花, 等. 紫花苜蓿品种白粉病田间抗病性评价[J]. 草业科学, 2002, 19(4): 40-42. |
| [8] |
Wang S, Tian JC, Zhu MM, et al. Preliminary study on forecasting technology of alfalfa powdery mildew in Ningxia[J]. Prataculture & Animal Husbandry, 2006(12): 15-16. (in Chinese) 王飒, 田建成, 朱猛蒙, 等. 宁夏苜蓿白粉病预测预报技术的初步研究[J]. 草业与畜牧, 2006(12): 15-16. |
| [9] |
Zhang R, Ma JH, Yang F, et al. Study on law of field development of alfalfa major diseases in Ningxia[J]. Journal of Shihezi University (Natural Science), 2004, 22(S1): 168-171. (in Chinese) 张蓉, 马建华, 杨芳, 等. 宁夏苜蓿主要病害田间发生规律的研究[J]. 石河子大学学报:自然科学版, 2004, 22(S1): 168-171. |
| [10] |
Souza EA, Camargo Jr OA, Pinto JMA. Sexual recombination in colletotrichum lindemuthianum occurs on a fine scale[J]. Genetics and Molecular Research, 2010, 9(3): 1759-1769. DOI:10.4238/vol9-3gmr863 |
| [11] |
Stuteville DL, Erwin DC. Compendium of Alfalfa Diseases[M]. 2nd ed. Minnesota, USA: APS, 1990.
|
| [12] |
Li MQ, Zhang ZH, Chai ZX, et al. Identification of pathogen on alfalfa powdery mildew[J]. Journal of Gansu Agricultural University, 2002, 37(3): 303-306, 328. (in Chinese) 李敏权, 张自和, 柴兆祥, 等. 紫花苜蓿白粉病病原鉴定[J]. 甘肃农业大学学报, 2002, 37(3): 303-306, 328. |
| [13] |
Fang ZD. Research Methods of Plant Diseases[M]. 3rd ed. Beijing: China Agricultural Press, 1998: 140-145. (in Chinese) 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 140-145. |
| [14] |
Shen RQ. Mycoflora of plant pathogenic fungi in Ningxia Hui autonomous region[D]. Yangling: Doctoral Dissertation of Northwest A & F University, 2007 (in Chinese) 沈瑞清.宁夏植物病原真菌区系研究[D].杨凌: 西北农林科技大学博士学位论文, 2007 |
| [15] |
Liu TZ. Studies on taxonomy and flora of powdery mildews (Erysiphaceae) in Inner Mongolia, China[D]. Hohhot: Doctoral Dissertation of Inner Mongolia University, 2007 (in Chinese) 刘铁志.内蒙古白粉菌分类及区系研究[D].呼和浩特: 内蒙古大学博士学位论文, 2007 |
| [16] |
Boesewinkel HJ. The morphology of the imperfect states of powdery mildews (Erysiphaceae)[J]. The Botanical Review, 1980, 46(2): 167-224. DOI:10.1007/BF02860869 |
| [17] |
Zheng RY, Yu YN. Flora of Fungi in China, Volume I, Powdery Mildew[M]. Beijing: Science Press, 1987: 5-13. (in Chinese) 郑儒永, 余永年. 中国真菌志, 第一卷, 白粉菌目[M]. 北京: 科学出版社, 1987: 5-13. |
| [18] |
Wei JC. Fungus Identification Manual[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1979: 1-9. (in Chinese) 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979: 1-9. |
| [19] |
Chen QC, Ru QH. The vitality of cleistothecia of Erysiphe graminis f. sp. tritici in Ningxia irrigated area[J]. Microbiology China, 1997, 24(2): 75-77. (in Chinese) 陈企村, 茹庆华. 宁夏灌区小麦白粉病菌子囊壳的存活力[J]. 微生物学通报, 1997, 24(2): 75-77. |
| [20] |
Cao XR, Zhou YL, Duan XY, et al. The contribution of chasmothesia of Blumeria graminis f. sp. tritici to its infection cycle[J]. Plant Protection, 2010, 36(5): 145-148. (in Chinese) 曹学仁, 周益林, 段霞瑜, 等. 小麦白粉菌有性时期闭囊壳在侵染循环中作用的初步研究[J]. 植物保护, 2010, 36(5): 145-148. |
| [21] |
Te Beest DE, Paveley ND, Shaw MW, et al. Disease-weather relationships for powdery mildew and yellow rust on winter wheat[J]. Phytopathology, 2008, 98(5): 609-617. DOI:10.1094/PHYTO-98-5-0609 |
| [22] |
Wen QW, Zhong X, Liu XX. Green control technology of cucumber powdery mildew[J]. Journal of Changjiang Vegetables, 2018(13): 56-57. (in Chinese) 温庆文, 钟霞, 刘晓霞. 黄瓜白粉病的绿色防控技术[J]. 长江蔬菜, 2018(13): 56-57. |
| [23] |
Wang BR, Liu SY, Tang SR, et al. Identification of Erysiphe polygoni causing powdery mildews on Rheum rhabarbarum[J]. Acta Phytopathologica Sinica, 2017, 47(6): 849-854. (in Chinese) 王博儒, 刘淑艳, 唐淑荣, 等. 波叶大黄白粉病病原菌的鉴定[J]. 植物病理学报, 2017, 47(6): 849-854. |
| [24] |
Hanson LE, McGrath JM. The perfect stage of powdery mildew (Erysiphe polygoni) of beta vulgaris found in Michigan[J]. Plant Disease, 2011, 95(4): 494. |
| [25] |
Hu YB, Liang XY, Ji Y, et al. Research progress in powdery mildew of forage[J]. China Herbivore Science, 2019, 39(1): 55-58. (in Chinese) 胡远彬, 梁小玉, 季杨, 等. 牧草白粉病的研究进展[J]. 中国草食动物科学, 2019, 39(1): 55-58. |
| [26] |
Wang LJ, Guo N, Wang W, et al. The soil water content monitoring based on the temperature difference in the Northwest China[J]. Research of Soil and Water Conservation, 2018, 25(5): 330-336. (in Chinese) 王丽娟, 郭铌, 王玮, 等. 基于温度差监测西北地区的土壤相对湿度[J]. 水土保持研究, 2018, 25(5): 330-336. |
 2020, Vol. 47
2020, Vol. 47