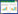扩展功能
文章信息
- 石新国, 李悦, 郑文煌, 肖宇淳, 刘乐冕, 陈剑锋
- SHI Xin-Guo1, LI Yue, ZHENG Wen-Huang, XIAO Yu-Chun, LIU Le-Mian, CHEN Jian-Feng
- 一株中肋骨条藻特异溶藻菌的分离鉴定及溶藻特性
- Isolation and algicidal characteristics of a specific algicidal bacterium on Skeletonema costatum
- 微生物学通报, 2020, 47(11): 3527-3538
- Microbiology China, 2020, 47(11): 3527-3538
- DOI: 10.13344/j.microbiol.china.190991
-
文章历史
- 收稿日期: 2019-11-27
- 接受日期: 2020-05-07
- 网络首发日期: 2020-07-17
2. 福州大学福建海产品废弃物综合利用工程技术研究中心 福建 福州 350108
2. ujian Engineering Research Center for Comprehensive Utilization of Marine Products Waste, Fuzhou University, Fuzhou, Fujian 350108, China
近几十年来,我国近海由于富营养化而引起的赤潮发生频率和规模呈现明显增加的趋势,目前赤潮已成为一个全球性的科学和环境问题,不仅直接影响到海洋生态系统稳定、海洋生物资源可持续利用和水产养殖业等海洋产业的健康发展,对人类健康也构成严重威胁,引起了各国政府及科学界的高度重视[1-3]。中肋骨条藻(Skeletonema costatum)是一种广温、低盐的近岸性硅藻,广泛分布在我国沿海海域[4],是我国影响最大的硅藻赤潮物种。
近年的研究结果显示,海洋水体中的一些异养细菌和有害藻华的暴发及消亡有着密切的关系[5-6],有些细菌在有害藻华的突然消亡过程中起到重要的作用[7-8]。因此,研究人员在溶藻菌的分离及溶藻特性方面做了较多的探索,并获得一些较为高效的溶藻细菌菌株[9]。目前已报道较为有效的溶藻菌多为广谱型溶藻细菌,对于环境中的多种赤潮藻类都有杀灭作用[10-11],而对于专门溶解中肋骨条藻的菌株报道较少。溶藻菌Kordia algicida对于硅藻具有特异的溶藻效果,然而除了对中肋骨条藻的溶藻率较高以外,对于威氏海链藻和三角褐指藻也有一定的溶藻效果[12]。
本研究从福建长乐海域筛选出一株对中肋骨条藻有高效特异溶藻活性的细菌,并对该细菌进行了鉴定。本研究还进一步探讨了该溶藻菌对中肋骨条藻的溶藻机理以及溶藻菌所分泌溶藻物质的特性,这些结果对于深入研究有害藻华过程中的菌藻关系以及开发高效的溶藻菌剂提供了良好的材料和研究基础。
1 材料与方法 1.1 主要试剂和仪器及培养基基因组提取试剂盒,上海捷瑞生物工程公司。离心机,上海安亭科学仪器厂;PCR仪、电泳仪,Bio-Rad公司;摇床,上海世平实验设备有限公司;恒温培养箱,常州国华电器有限公司;超净工作台,上海跃进医疗器械有限公司;光照培养箱,宁波海曙赛福实验仪器厂;场发射扫描电镜,FEI公司;显微镜,尼康有限公司。
F/2培养基采用Guillard等的配制方法[13]。2216E培养基(g/L):蛋白胨5.0,酵母提取物1.0,磷酸高铁0.1,海盐30.0,琼脂粉(固体培养基) 15.0。
1.2 藻种来源与培养方法中肋骨条藻(Skeletonema costatum)购自上海光语生物科技有限公司,米氏凯伦藻(Karenia mikimotoi)、三角褐指藻(Phaeodactylum tricornutum)、赤潮异弯藻(Heterosigma akashiwo)、强壮前沟藻(Amphidinium carterae)、伊姆裸甲藻(Gymnodinium impudicum)、亚历山大藻(Alexandrium tamarense)由厦门大学近海海洋环境科学国家重点实验室提供。中肋骨条藻与三角褐指藻这两种硅藻采用F/2培养基[13];东海原甲藻、赤潮异弯藻、米氏凯伦藻、强壮前沟藻、亚历山大藻和伊姆裸甲藻采用F/2-Si (不加硅)培养基[13]。藻种均培养于20 ℃光照培养箱中,光照强度100 μmol-photons/(m2·s),光暗周期14 h:10 h (光:暗)。使用Lin等的方法[14]对藻液进行预处理,用抗生素混合物处理藻液,其中含有氨苄青霉素(200 mg/L)、卡那霉素(100 mg/L)和链霉素(100 mg/L),以在溶藻实验之前去除藻细胞生长环境中的细菌,将生长状态处于指数期的培养藻液用于杀藻实验。
1.3 溶藻细菌的分离与鉴定在福建省长乐海域采取不同区域的表层海水水样,通过梯度稀释涂布的方式接种到2216E固体培养基上,28 ℃培养48 h。将长出的各个单菌落接种在1 mL的2216E液体培养基中,28 ℃、200 r/min培养24 h,取0.5 mL菌液接种到10 mL处于经过抗生素处理的对数生长期中肋骨条藻藻液中[14],48 h后使藻液呈现白化、镜检藻细胞多数破裂的菌株认为是溶藻菌。选取其中溶藻效果较好的一株细菌进行进一步研究,并将该株细菌编号为FDHY-CJ。溶藻效率计算方法:溶藻效率(%)=(1−实验组藻细胞浓度/对照组藻细胞浓度)×100。其中中肋骨条藻的藻细胞浓度用血球计数板通过显微镜计数。
溶藻细菌的形态学及生理生化特性鉴定按照《常见细菌系统鉴定手册》[15]和《一般细菌常用鉴定方法》[16]进行鉴定。使用细菌基因组提取试剂盒提取溶藻细菌的总基因组DNA作为模板,使用引物16S-27F (5′-AGAGTTTGATCMTGGCTCAG-3′)和16S-1492R (5′-TACGGYTACCTTGTTACGACTT-3′)[17]对溶藻细菌的16S rRNA基因片段进行PCR扩增[17],对扩增子进行纯化、克隆和测序。
1.4 溶藻细菌对不同赤潮藻的溶藻效果将溶藻细菌FDHY-CJ于28 ℃、200 r/min培养至指数后期(OD600为2.5,1.9×109 CFU/mL,下同),菌液以2%的浓度接种于抗生素处理后的对数生长期伊姆裸甲藻、亚历山大藻、强壮前沟藻、赤潮异弯藻、米氏凯伦藻、中肋骨条藻和三角褐指藻藻液中[14],每个藻种的处理设置3个重复,分别在0、6、24、48、72 h取样,每次取2 mL培养液进行藻细胞浓度计数。设置空白对照,对照组为加入等体积无菌2216E培养基的同时期藻液。计算藻细胞浓度和溶藻率。
为了研究不同浓度下FDHY-CJ对中肋骨条藻的溶藻活性,在菌液与藻液体积比为0.5%、1.0%、2.0%情况下进行共培养。设置空白对照,对照组为加入0.5%、1.0%、2.0%体积无菌2216E培养基的同时期藻液,计算藻细胞浓度和溶藻率。
1.5 溶藻细菌的溶藻特性为了确定溶藻细菌FDHY-CJ的溶藻方式,将对数期的中肋骨条藻分为4组,每组3个平行,每个平行样为50 mL藻液。第1组加入1 mL (2%体积)溶藻细菌菌液;第2组加入1 mL (2%体积)溶藻细菌的胞外产物,即溶藻细菌的培养液经8 000 r/min离心8 min后用0.22 μm微滤膜过滤的上清;第3组加入1 mL (2%体积)溶藻细菌的菌细胞悬液,即溶藻细菌的培养液经8 000 r/min离心8 min后去上清,用等体积无菌海水重悬清洗一次,再次离心去上清,加入等体积无菌海水重悬菌体备用;第4组加入1 mL (2%体积)无菌细菌培养基作为对照组。计算滤液和细菌细胞处理的培养物的藻细胞浓度和溶藻率。
1.6 扫描电子显微镜观察FDHY-CJ的溶藻过程将菌株FDHY-CJ培养后的上清液以2%的比例添加到中肋骨条藻对数期培养物中,于不同时间点取样,用2.5%戊二醛固定。通过3.5 kD的透析袋脱盐和脱有机物质,之后将样品上样于单晶硅片上,干燥后喷金,用场发射扫描电镜观察溶藻过程。
1.7 溶藻细菌FDHY-CJ代谢物的特性 1.7.1 理化性质将溶藻细菌的无菌滤液分别进行α-萘酚试验(Molish)、碘试验;同时用不同浓度(0.1%、0.5%、1.0%)醋酸铅处理菌液后按2.0%的体积比接入藻液中,24 h后取样,验证溶藻活性。实验做3个重复。
1.7.2 热稳定性将制备的无菌滤液在−80、20、40、80和120 ℃下保持2 h,然后在室温下解冻或冷却。将处理滤液以2%的比例接种到藻类培养物中,设置3个平行样。24 h后取样检验溶藻活性。
1.7.3 酸碱稳定性将溶藻细菌的无菌滤液pH值调节至3.0、7.0、9.0和11.0,保持2 h,然后调回初始pH值。将处理滤液以2%的比例接种到指数生长期的中肋骨条藻中,设置3个平行样。24 h后取样检验溶藻活性。
1.7.4 反复冻融将溶藻细菌的无菌滤液加入5 mL无菌离心管中,放置于液氮,5 min后取出放于65 ℃水浴锅中水浴融化,反复此冻融步骤3次。然后等其冷却至室温后,将处理滤液以2%的比例接种到指数生长期的中肋骨条藻中,设置3个平行样。24 h后取样检验溶藻活性。
1.7.5 紫外线处理将溶藻细菌的无菌滤液放置于紫外灯下(40 W) 20 cm处,分别照射30、90、150和210 min,照射后将处理滤液以2%的比例接种到指数生长期的中肋骨条藻中,设置3个平行样。24 h后取样检验溶藻活性。
1.7.6 有机溶剂萃取将溶藻细菌的无菌滤液与等体积的正己烷混合。剧烈振荡1 h后,将混合物转移到分液漏斗中静置0.5 h以收集有机相。重复操作3次,以尽可能提取活性化合物。然后将有机相的各部分合并,蒸发至干,将所得提取物定义为正己烷萃取物。根据上述方法制备各种提取物,包括正丁醇、二氯甲烷和乙酸乙酯等其他有机溶剂。将所有蒸发至干的生物有机溶剂萃取物溶于二甲基亚砜(DMSO)中。接着接种到藻类培养物中以确定杀藻活性。加入等体积浓度的DMSO作为溶剂对照,设置3个平行样。24 h后取样检验溶藻活性。
1.7.7 溶藻物质分子量大小用不同分子量大小的透析袋(3.5、10.0和14.0 kD)对溶藻细菌的无菌滤液进行透析,在透析后,将透析袋内截留产物以2%的体积比接种到指数生长期的中肋骨条藻中,24 h后取样,检验溶藻活性。加入未处理的无细胞滤液作为阳性对照,每个处理设置3个重复。
2 结果与分析 2.1 溶藻细菌的分离与鉴定从福建省长乐海域表层海水的水样中共分离纯化得到35株溶藻细菌,与藻共培养后复筛出一株对中肋骨条藻具有专一溶藻活性的海洋细菌,将其命名为FDHY-CJ。中肋骨条藻对照组呈现黄色浑浊液,实验组颜色变白并且有絮凝现象,经显微镜观察藻细胞已被溶藻细菌破坏,进而证明菌株FDHY-CJ具有溶藻的能力,该菌株对中肋骨条藻处理后的溶藻率达95.45%。
将菌株FDHY-CJ划线接种于2216E固体培养基上,培养2 d后进行形态观察及生理生态研究;菌株FDHY-CJ呈杆状,单个,革兰氏染色呈阴性,菌落形态为圆形,不透明,菌落呈米白色,表面光滑湿润,挑起为粘稠状,芽孢染色、甲基红(MR)、V-P测定、脲酶、柠檬酸盐、苯丙氨酸脱氨酶反应为阴性,接触酶、淀粉水解、葡萄糖、果糖、木糖、蔗糖、乳糖、半乳糖、甘露醇反应为阳性(表 1)。
| Items | Results |
| Gram reaction | − |
| Spore staining | − |
| Methyl red | − |
| Voges-Proskauer | − |
| Sporty | − |
| Urease activity | − |
| Citrate assimilation | − |
| Saline: | |
| 5% | + |
| 10% | + |
| 15% | + |
| 20% | − |
| Phenylalanine deaminase | − |
| Catalase test | + |
| Starch hydrolysis | + |
| Assimilation of: | |
| Glucose | + |
| Fructose | + |
| Xylose | + |
| Sucrose | + |
| Galactose | + |
| Lactose | + |
| Mannitol | + |
| 注:+:阳性;−:阴性.
Note: +: Positive; −: Negative. | |
扩增FDHY-CJ菌株的16S rRNA基因,对基因序列进行克隆和序列分析,结果显示FDHY-CJ与Alteromonas sp. strain E522-9相似性为99%,因此初步鉴定溶藻细菌FDHY-CJ属于交替单胞菌(Alteromonas sp.),将其命名为Alteromonas sp. FDHY-CJ,16S rRNA基因在GenBank的登录号为MN463606。
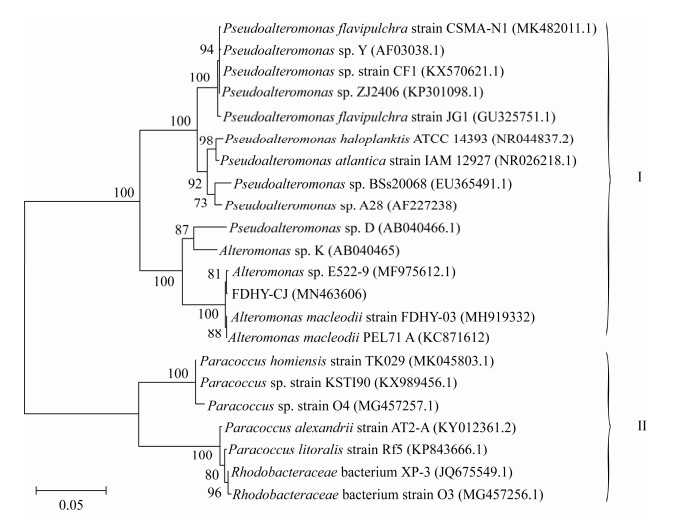
将FDHY-CJ的16S rRNA基因与GenBank上几株常见的溶藻菌种属的序列采用邻接法(neighbor-joining method)构建的系统发育树,如图 1所示。系统发育分析的结果表明15株γ-变形菌(Gammaproteobacteria)以100%的支持率聚为一支,其中FDHY-CJ以100%的支持率位于γ-变形菌的同一亚群Alteromonas属中,与目前所报道的常见假单胞菌属同属γ-变形菌,其扫描电镜图片如图 2所示。
|
| 图 1 溶藻菌株Alteromonas sp. FDHY-CJ基于16S rRNA基因序列构建的系统发育树 Figure 1 Phylogenetic tree of algicidal bacteria strain FDHY-CJ based on 16S rRNA gene sequence 注:对节点值大于50%的数值进行了标记,其中,I为γ-变形菌;II为噬纤维菌黄杆菌-拟杆菌群.分支处标注有自展值,标尺所示长度为0.05核苷酸置换率. Note: Support of nodes > 50% are shown. I: Gammaproteobacteria; II: Cytophaga-Flavobacterium-Bacteroidetes. The bootstrap values are shown at the node; Bar 0.05 means the nucleotide substitution rate of 0.05. |
|
|
|
| 图 2 溶藻细菌FDHY-CJ扫描电镜图片 Figure 2 Scanning electron microscopy image of algicidal bacterium FDHY-CJ |
|
|
将亚历山大藻、伊姆裸甲藻、强壮前沟藻、米氏凯伦藻、赤潮异弯藻、三角褐指藻和中肋骨条藻常见的赤潮藻进行接种培养,于相应的对数生长期内分别加入2%的FDHY-CJ菌液,记录藻丰度数量变化情况,并与对照组作出对比,计算出不同溶藻菌对不同赤潮藻的溶藻率。
实验结果如图 3所示,菌株FDHY-CJ表现出对中肋骨条藻的溶藻特异性,48 h溶藻率达95.37%;而对于其他赤潮藻类的溶藻率低于40%,其中包括同属于硅藻的三角褐指藻,72 h溶藻率仅为18.11%。

|
| 图 3 溶藻细菌FDHY-CJ对不同赤潮藻的溶藻效果 Figure 3 The algal-lytic activity of FDHY-CJ against several harmful-algal-bloom forming species |
|
|
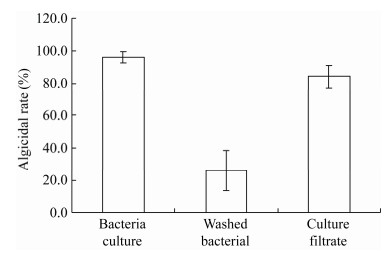
对溶藻细菌FDHY-CJ的溶藻方式进行了研究,结果如图 4所示。从图 4中的数据可以看出,FDHY-CJ的溶藻方式是以间接溶藻为主,溶藻细菌FDHY-CJ菌液的溶藻率最高达96.0%,上清液的溶藻率为84.0%,菌细胞略有一些溶藻效果,溶藻率为26.0%。
|
| 图 4 溶藻细菌对中肋骨条藻不同溶藻方式的溶藻效果 Figure 4 The attack manner of strain FDHY-CJ on S. costatum |
|
|
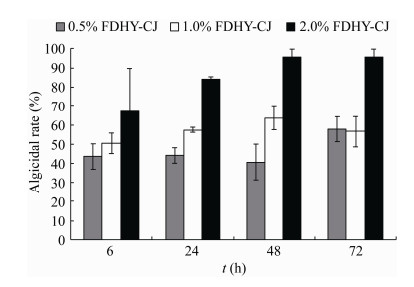
将溶藻细菌以不同初始浓度加入到对数期的中肋骨条藻藻液中,如图 5所示,以0.5%初始菌浓度将菌株FDHY-CJ发酵培养液加入对数期生长期的中肋骨条藻中,72 h溶藻率为57.89%;以1%初始菌浓度添加时,24 h溶藻效果为57.58%,48 h为63.64%,之后溶藻率变化不大;以2%浓度添加时,24 h溶藻活性可达83.76%,48 h可达95.37%,到72 h溶藻率可达95.45%。可见交替单胞菌FDHY-CJ对中肋骨条藻具有较高的溶藻效率。
|
| 图 5 不同初始浓度的FDHY-CJ溶藻细菌对中肋骨条藻的溶藻效果 Figure 5 Algicidal rate of S. costatum with different volume of FDHY-CJ culture added |
|
|
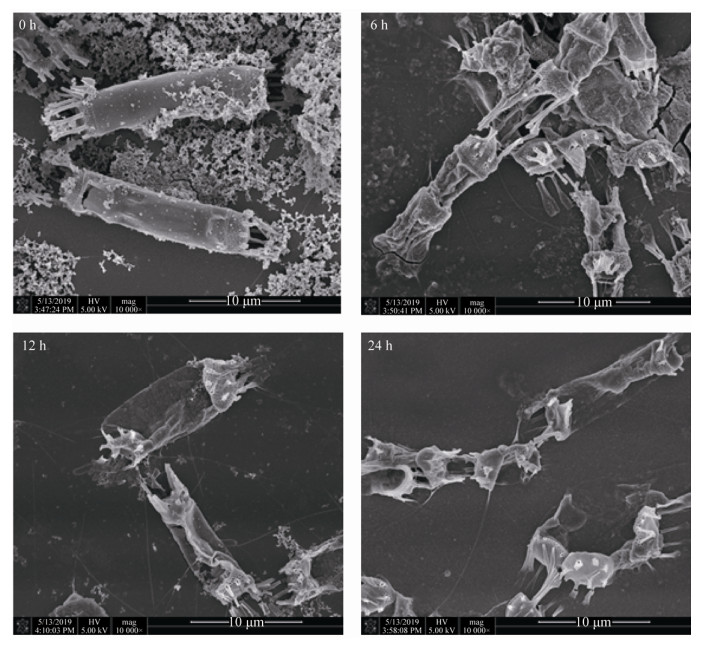
为了观察FDHY-CJ的超微结构以及该溶藻菌对中肋骨条藻的溶藻过程,用场发射扫描电镜对溶藻细菌在不同处理时间点的溶藻情况进行观察,如图 6所示,可见FDHY-CJ菌体为杆状,长约2.0 μm,宽约0.8 μm,具有明显的交替单胞菌形态特征。该溶藻菌处理中肋骨条藻6 h后,藻细胞的细胞壁开始破裂,硅质壳打开,内容物流出,之后破裂处不断扩大,表明藻细胞壁是FDHY-CJ溶藻代谢物主要的攻击对象,对于藻细胞之间的连接刺则没有破坏作用。
|
| 图 6 扫描电镜下溶藻细菌FDHY-CJ对中肋骨条藻的溶藻过程 Figure 6 Scanning electron microscopic observations of S. costatum attacked by FDHY-CJ |
|
|
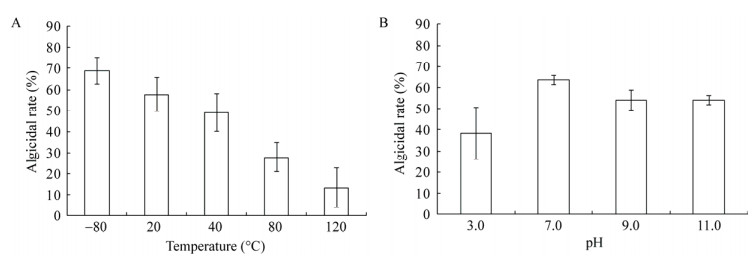
在不同温度处理条件下,FDHY-CJ溶藻代谢物对中肋骨条藻的溶藻率结果如图 7A所示,菌株FDHY-CJ代谢物的溶藻活性对温度比较敏感,当其代谢物经120 ℃处理后,溶藻物质基本失去活性,溶藻率仅13.36%,因此菌株FDHY-CJ的溶藻活性对热稳定性较低。将菌株FDHY-CJ的代谢产物经不同pH处理后,其代谢物对中肋骨条藻的溶藻率结果如图 7B所示,菌株FDHY-CJ代谢物对酸碱较敏感,在酸或碱性条件下溶藻活性均显著降低。
|
| 图 7 不同温度(A)和酸碱(B)条件处理后的菌株FDHY-CJ代谢物对中肋骨条藻的溶藻效果 Figure 7 Algicidal efficiency of FDHY-CJ metabolites treated with different temperature (A) and pH (B) conditions on S. costatum |
|
|
对FDHY-CJ进行α-萘酚、碘实验,可以看出经萘酚反应两液分界处并未出现紫红色环状,碘试验也并未出现蓝色,说明菌株FDHY-CJ产生的溶藻活性物质为非多糖类化合物。进行醋酸铅处理后溶藻效果如图 8A所示,FDHY-CJ代谢物的溶藻活性明显受醋酸铅影响,当醋酸铅浓度升高时溶藻活性物质的溶藻效果明显下降。反复冻融对FDHY-CJ溶藻物质的影响如图 8B所示,冻融后的杀藻效果和对照相比变化不大。溶藻物质可以被有机溶剂提取,其中提取效率最高的有机溶剂为乙酸乙酯(图 8C),溶藻物质经紫外线处理后溶藻效果有所下降(图 8D),说明该溶藻物质为蛋白类物质。

|
| 图 8 经不同处理后的菌株FDHY-CJ代谢物对中肋骨条藻的溶藻效果 Figure 8 Algicidal efficiency of FDHY-CJ metabolites treated with different treatments 注:A:醋酸铅处理;B:反复冻融;C:有机溶剂萃取;D:紫外线处理. Note: A: Treated by lead acetate; B: Freezing and thawing; C: Extracted by organic solvents; D: Treated by UV. |
|
|
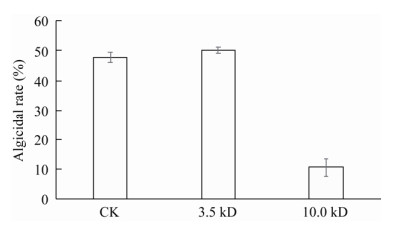
溶藻代谢物透析前后对中肋骨条藻的溶藻效率如图 9所示,使用不同分子量的透析袋对FDHY-CJ无菌滤液进行透析,先使用了MWCO为3.5 kD的透析袋,可看出在透析前后的溶藻效率无明显差异,说明透析前后代谢物中的有效溶藻分子没有流失,得出有效溶藻分子量 > 3.5 kD;接着使用了MWCO为10.0 kD的透析袋,透析后溶藻效果明显低于透析前,说明FDHY-CJ的有效溶藻物质已基本流失,分子量 < 10.0 kD。综上所述,该溶藻物质可能是水解酶类,分子量主要在3.5−10.0 kD之间。该溶藻物质较为准确的分子量还需要用其他方法(如SDS-PAGE等)进行测定。
|
| 图 9 菌株FDHY-CJ溶藻活性组分的分子量范围 Figure 9 Molecular weight of algicidal compounds of bacterium FDHY-CJ |
|
|
长期的调查研究结果显示,在赤潮暴发过程中海洋微生物群落表现出由α变形菌向γ变形菌演替的趋势[7, 18],期间γ变形菌降解藻细胞,最终会使赤潮终止[19-20],这可为开展生物法进行赤潮的防治提供丰富的生物资源[21-22]。目前已经有一些报道从赤潮发生的海域分离出溶藻细菌[6, 10, 23-24],以期用于开发防治赤潮的生物制剂[25]。本研究分离得到一株对中肋骨条藻具有特异溶藻效果的溶藻菌,属于γ变形菌纲中的交替单胞菌属,并对其溶藻特性、溶藻过程以及溶藻物质的分离进行了研究,以期为揭示溶藻菌对目标藻种的溶藻分子机制提供参考。
目前所报道的溶藻菌对于其目标藻种的溶藻作用一般都具有特异性,有些菌株溶藻的范围比较广泛,能够溶解多种门类的藻种,如Zhang等分离的一株溶藻菌Y42对多种甲藻和硅藻均具有一定的溶藻活性[11];Paul等在溶藻菌Kordia algicida中分离得到一种水解酶类物质对3种硅藻都具有一定的溶藻活性,对中肋骨条藻的溶藻作用尤为明显[12]。然而有些菌株溶藻的范围比较窄,仅能够溶解特异的类群甚至特异的藻种。管成伟[26]用菌株LP-10对25种藻种进行了溶藻试验,发现菌株仅对其中球形棕囊藻等6种藻有溶藻效果,对其余20种藻几乎没有溶藻效果。Kim等[19]发现溶藻细菌的溶藻效应也表现出一定的选择性,Pokrzywinski等[27]分离得到的菌株IRI-160仅对裸甲藻类藻种具有较高的溶藻活性。这种特性使菌株对于有害藻的控制具有选择针对性[19, 27]。溶藻菌具有广谱型或者特异型溶藻效果和溶藻菌的类型及其分泌的溶藻物质有关[21]。在海洋系统中,颗粒态存在的细菌多具有广谱溶藻效果,而游离态存在的细菌多具有特异性溶藻效果[28]。本研究分离得到的溶藻菌FDHY-CJ仅对中肋骨条藻具有较高的溶藻活性,对于其他常见赤潮藻,包括亚历山大藻、赤潮异弯藻、强壮前沟藻等溶藻活性较低,对于同属于硅藻的三角褐指藻溶藻率也仅为18.11%。因此溶藻菌FDHY-CJ可作为开发特异防控中肋骨条藻赤潮的优良材料。
本研究所分离得到的溶藻菌FDHY-CJ属于交替单胞菌属(Alteromonas),该属的细菌是海洋系统中报道最多的溶藻菌类群之一,也是海洋中丰度最高的菌群之一[29]。该类群的细菌通常和海洋浮游植物密切相关并且常表现为具有溶藻活性[30],还有报道显示该类细菌也具有溶解其他细菌[31]或者抑制其他细菌生长的作用[32]。目前已发现该属的细菌能够溶解的藻类包括骨条藻[33]、多环旋沟藻[34]、亚历山大藻以及赤潮异弯藻[30]等。该属溶藻菌的溶藻方式多为分泌胞外活性物质以降解目标藻种的表面大分子和细胞壁[10, 35]。本研究的结果显示FDHY-CJ的溶藻作用是通过间接溶藻方式,即通过产生水解酶类进行溶藻,分子量在3.5−10.0 kD之间,这为进一步研究该溶藻菌和中肋骨条藻的互作奠定了良好的研究基础。
4 结论(1) 分离得到的菌株FDHY-CJ属于交替单胞菌属(Alteromonas),按照体积比2%的比例接种中肋骨条藻后,48 h溶藻率达95.37%,为目前报道的赤潮藻高效溶藻菌之一。
(2) 溶藻菌FDHY-CJ溶藻范围较窄,对中肋骨条藻具有专一的溶藻效果,对研究中提到的其他藻类溶藻效果不明显。
(3) 溶藻菌FDHY-CJ通过胞外分泌物间接溶藻,首先溶解藻细胞壁。溶藻物质鉴定为蛋白类物质,可能是水解酶类,分子量在3.5−10.0 kD之间。
| [1] |
van Dolah FM. Diversity of marine and freshwater algal toxins[A]//Botana L. Seafood and Freshwater Toxins: Pharmacology, Physiology, and Detection[M]. New York: CRC Press, 2000: 173-186
|
| [2] |
Landsberg JH. The effects of harmful algal blooms on aquatic organisms[J]. Reviews in Fisheries Science, 2002, 10(2): 113-390. DOI:10.1080/20026491051695 |
| [3] |
Anderson DM, Cembella AD, Hallegraeff GM. Physiological Ecology of Harmful Algal Blooms[M]. Berlin: Springer, 1998: 662.
|
| [4] |
Huang XQ, Jiang XS, Wang GL, et al. Principal environmental factors during red tide outbreak of Skeletonema costatum in Yangtse estuary Ⅲ: water temperature, salinity, DO and pH[J]. Marine Science Bulletin, 1994, 13(4): 35-40. (in Chinese) 黄秀清, 蒋晓山, 王桂兰, 等. 长江口中肋骨条藻赤潮发生过程环境要素分析:水温、盐度、DO和pH特征[J]. 海洋通报, 1994, 13(4): 35-40. |
| [5] |
Buchan A, LeCleir GR, Gulvik CA, et al. Master recyclers: features and functions of bacteria associated with phytoplankton blooms[J]. Nature Reviews Microbiology, 2014, 12(10): 686-698. DOI:10.1038/nrmicro3326 |
| [6] |
Pokrzywinski KL, Tilney CL, Modla S, et al. Effects of the bacterial algicide IRI-160AA on cellular morphology of harmful dinoflagellates[J]. Harmful Algae, 2017, 62: 127-135. DOI:10.1016/j.hal.2016.12.004 |
| [7] |
Li DX, Zhang H, Chen XH, et al. Metaproteomics reveals major microbial players and their metabolic activities during the blooming period of a marine dinoflagellate Prorocentrum donghaiense[J]. Environmental Microbiology, 2018, 20(2): 632-644. DOI:10.1111/1462-2920.13986 |
| [8] |
Wichels A, Hummert C, Elbrächter M, et al. Erratum to bacterial diversity in toxic Alexandrium tamarense blooms off the Orkney isles and the firth of forth[J]. Helgoland Marine Research, 2004, 58(2): 93-103. DOI:10.1007/s10152-004-0174-6 |
| [9] |
Tilney CL, Pokrzywinski KL, Coyne KJ, et al. Effects of a bacterial algicide, IRI-160AA, on dinoflagellates and the microbial community in microcosm experiments[J]. Harmful Algae, 2014, 39: 210-222. DOI:10.1016/j.hal.2014.08.001 |
| [10] |
Shi XG, Liu LM, Li Y, et al. Isolation of an algicidal bacterium and its effects against the harmful-algal-bloom dinoflagellate Prorocentrum donghaiense (Dinophyceae)[J]. Harmful Algae, 2018, 80: 72-79. DOI:10.1016/j.hal.2018.09.003 |
| [11] |
Zhang FX, Ye Q, Chen QL, et al. Algicidal activity of novel marine bacterium Paracoccus sp. strain Y42 against a harmful algal-bloom-causing dinoflagellate, Prorocentrum donghaiense[J]. Applied and Environmental Microbiology, 2018, 84(19): e01015-18. |
| [12] |
Paul C, Pohnert G. Interactions of the algicidal bacterium Kordia algicida with diatoms: regulated protease excretion for specific algal lysis[J]. PLoS One, 2011, 6(6): e21032. DOI:10.1371/journal.pone.0021032 |
| [13] |
Guillard RRL, Ryther JH. 1962. Studies of marine planktonic diatoms: I. Cyclotella nana Hustedt, and Detonula confervacea (Cleve) gran[J]. Canadian Journal of Microbiology, 1962, 8(2): 229-239
|
| [14] |
Lin SJ, Cheng SF, Song B, et al. The Symbiodinium kawagutii genome illuminates dinoflagellate gene expression and coral symbiosis[J]. Science, 2015, 350(6261): 691-694. DOI:10.1126/science.aad0408 |
| [15] |
Dong XZ, Cai MY. Manual of Bacterial Culture Identification[M]. Beijing: Science Press, 2001: 353-390. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 353-390. |
| [16] |
Bacterial Taxonomy Group, Institute of Microbiology, Chinese Academy of Sciences. Common Identification Methods for Common Bacteria[M]. Beijing: Science Press, 1978: 1-50. (in Chinese) 中国科学院微生物研究所细菌分类组. 一般细菌常用鉴定方法[M]. 北京: 科学出版社, 1978: 1-50. |
| [17] |
DeLong EF. Archaea in coastal marine environments[J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(12): 5685-5689. DOI:10.1073/pnas.89.12.5685 |
| [18] |
Teeling H, Fuchs BM, Becher D, et al. Substrate-controlled succession of marine bacterioplankton populations induced by a phytoplankton bloom[J]. Science, 2012, 336(6081): 608-611. DOI:10.1126/science.1218344 |
| [19] |
Kim JD, Kim JY, Park JK, et al. Selective control of the Prorocentrum minimum harmful algal blooms by a novel algal-lytic bacterium Pseudoalteromonas haloplanktis AFMB-008041[J]. Marine Biotechnology, 2009, 11(4): 463-472. |
| [20] |
Ruff SE, Probandt D, Zinkann AC, et al. Indications for algae-degrading benthic microbial communities in deep-sea sediments along the Antarctic Polar Front[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2014, 108: 6-16. DOI:10.1016/j.dsr2.2014.05.011 |
| [21] |
Meyer N, Bigalke A, Kaulfuß A, et al. Strategies and ecological roles of algicidal bacteria[J]. FEMS Microbiology Reviews, 2017, 41(6): 880-899. DOI:10.1093/femsre/fux029 |
| [22] |
Anderson CR, Berdalet E, Kudela RM, et al. Scaling up from regional case studies to a global harmful algal bloom observing system[J]. Frontiers in Marine Science, 2019, 6: 250. DOI:10.3389/fmars.2019.00250 |
| [23] |
Yang XR, Li XY, Zhou YY, et al. Novel insights into the algicidal bacterium DH77-1 killing the toxic dinoflagellate Alexandrium tamarense[J]. Science of the Total Environment, 2014, 482-483: 116-124. DOI:10.1016/j.scitotenv.2014.02.125 |
| [24] |
Kristyanto S, Kim J. Isolation of marine algicidal bacteria from surface seawater and sediment samples associated with harmful algal blooms in Korea[J]. Korean Journal of Microbiology, 2016, 52(1): 40-48. |
| [25] |
Su JQ, Yang XR, Zheng TL, et al. Isolation and characterization of a marine algicidal bacterium against the toxic dinoflagellate Alexandrium tamarense[J]. Harmful Algae, 2007, 6(6): 799-810. DOI:10.1016/j.hal.2007.04.004 |
| [26] |
Guan CW. Study on algicidal characteristics and mechanism of a novel algicidal bacterium Bacillus sp. LP-10 isolated from East China Sea[D]. Xiamen: Master's Thesis of Xiamen University, 2014 (in Chinese) 管成伟.来源于中国东海的溶藻细菌Bacillus sp. LP-10的溶藻特性及溶藻机制研究[D].厦门: 厦门大学硕士论文, 2014 |
| [27] |
Pokrzywinski KL, Place AR, Warner ME, et al. Investigation of the algicidal exudate produced by Shewanella sp. IRI-160 and its effect on dinoflagellates[J]. Harmful Algae, 2012, 19: 23-29. DOI:10.1016/j.hal.2012.05.002 |
| [28] |
Park JH, Yoshinaga I, Nishikawa T, et al. Algicidal bacteria in particle-associated form and in free-living form during a diatom bloom in the Seto Inland Sea, Japan[J]. Aquatic Microbial Ecology, 2010, 60(2): 151-161. |
| [29] |
Mayali X, Azam F. Algicidal bacteria in the sea and their impact on algal blooms[J]. Journal of Eukaryotic Microbiology, 2004, 51(2): 139-144. DOI:10.1111/j.1550-7408.2004.tb00538.x |
| [30] |
Cho JY. Algicidal activity of marine Alteromonas sp. KNS-16 and isolation of active compounds[J]. Bioscience, Biotechnology, and Biochemistry, 2012, 76(8): 1452-1458. DOI:10.1271/bbb.120102 |
| [31] |
Takamoto S, Yamada K, Ezura Y. Production of bacteriolytic enzymes during the growth of a marine bacterium Alteromonas sp. No. 8-R[J]. The Journal of General and Applied Microbiology, 1994, 40(6): 499-508. |
| [32] |
Long RA, Qureshi A, Faulkner DJ, et al. 2-n-pentyl-4-quinolinol produced by a marine Alteromonas sp. and its potential ecological and biogeochemical roles[J]. Applied and Environmental Microbiology, 2003, 69(1): 568-576. |
| [33] |
Wang H, Butt L, Rooks P, et al. Characterisation of algicidal bacterial exometabolites against the lipid-accumulating diatom Skeletonema sp[J]. Algal Research, 2016, 13: 1-6. DOI:10.1016/j.algal.2015.11.012 |
| [34] |
Imai I, Kimura S. Resistance of the fish-killing dinoflagellate Cochlodinium polykrikoides against algicidal bacteria isolated from the coastal sea of Japan[J]. Harmful Algae, 2008, 7(3): 360-367. DOI:10.1016/j.hal.2007.12.010 |
| [35] |
Imai I, Ishida Y, Sakaguchi K, et al. Algicidal marine bacteria isolated from northern Hiroshima Bay, Japan[J]. Fisheries Science, 1995, 61(4): 628-636. DOI:10.2331/fishsci.61.628 |
 2020, Vol. 47
2020, Vol. 47