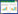扩展功能
文章信息
- 彭云, 李舒馨, 俞泽, 汤曼利, 吴海霞, 陈莹莹, 王亚楠, 马桂珍, 暴增海
- PENG Yun, LI Shu-Xin, YU Ze, TANG Man-L, WU Hai-Xia, CHEN Ying-Ying, WANG Ya-Nan, MA Gui-Zhen, BAO Zeng-Hai
- 一株海洋放线菌的鉴定及其促生作用机理
- Identification and growth promoting effect of a marine actinomycete
- 微生物学通报, 2020, 47(11): 3515-3526
- Microbiology China, 2020, 47(11): 3515-3526
- DOI: 10.13344/j.microbiol.china.190893
-
文章历史
- 收稿日期: 2019-11-04
- 接受日期: 2020-03-23
- 网络首发日期: 2020-04-16
2. 江苏海洋大学江苏省海洋生物技术重点实验室 江苏 连云港 222005;
3. 江苏海洋大学江苏省海洋生物产业技术协同创新中心 江苏 连云港 222005;
4. 河海大学海洋学院 江苏 南京 210098
2. Jiangsu Key Laboratory of Marine Biotechnology, Jiangsu Ocean University, Lianyungang, Jiangsu 222005, China;
3. Co-innovation Center of Jiangsu Marine Bio-industry Technology, Jiangsu Ocean University, Lianyungang, Jiangsu 222005, China;
4. College of Oceanography, Hohai University, Nanjing, Jiangsu 210098, China
目前,在农业生产上大量使用化学肥料和农药导致土壤出现了板结、营养流失以及微生态失调等问题,阻碍了土壤的可持续利用,不仅提高了生产成本、造成土壤二次污染,还给农产品安全带来了巨大的隐患。因此,利用具有抑菌促生作用的微生物菌株研发安全可持续的微生物肥料和农药以减少化学肥料和农药的使用具有重要意义[1]。微生物促生作用机理可分为直接作用和间接作用,直接作用的机理是可以合成一些促进植物生长的激素(如生长素等),使土壤中某些无效元素转化成有用元素而利于植物吸收(如固氮、解磷等),直接作用于植物本身,促进植物的生长发育;间接作用的机理是促生菌通过抑制病原体或减缓植物病害对植物生长产生的不利影响[2]。
放线菌作为重要的生防资源,很多菌株用于植物病害的生物防治,表现出了良好的防病促生作用。国内外不同学者研究了不同来源放线菌的抗菌防病和促生作用,甘良等[3]、胡春江等[4]从渤海海水中分离到一株能有效防治多种真菌性植物病害的放线菌,对西瓜、大豆等有良好的促生和增产作用。一些内生放线菌分别具有固氮作用,能够产生吲哚乙酸(indole acetic acid,IAA)和铁载体等,对水稻、番茄和黄瓜等幼苗生长有明显的促进作用[5-8];单文娜[9]测定了分离自不同地区茶树的根、茎和嫩叶的46株放线菌的IAA产量和1-氨基环丙烷-1-羧基(1-aminocyclopropane-1- carboxylate,ACC)脱氨酶活性,发现其中93.5%的放线菌能够产生IAA,21.7%的放线菌表现出显著的ACC脱氨酶活性,有8株放线菌既能产生IAA又具有ACC脱氨酶活性。白娟娈[10]对分离自苏北海岸的盐生植物根际放线菌的潜在促生特性进行测定,认为不同菌株分别具有解磷、固氮、产铁载体、IAA和ACC脱氨酶能力,每个菌株至少有一种或多种潜在促生特性。已有研究表明不同来源放线菌菌株的促生作用机理不同,研究具有抑菌促生作用的放线菌菌株的促生作用机理对于菌株的进一步开发应用具有重要意义。
BM-2菌株是本实验室从连云港海域海泥中分离获得的一株对小麦赤霉病菌(Fusarium graminearum)、棉花枯萎病菌(Fusarium oxysporum f. sp. vasinfectum)、番茄早疫病菌(Alternaria solani)等多种植物病原真菌和大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、嗜水气单胞菌(Aeromonas hydrophila)等多种病原菌具有较强抑制作用的优良菌株,其发酵液能提高黄瓜种子的发芽率,促进黄瓜根的伸长和须根数的增多,对黄瓜幼苗的生长有明显的促进作用,并能提高黄瓜体内苯丙氨酸解氨酶(phenylalanin ammonialyase,PAL)、过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenol oxidase,PPO)和超氧化物歧化酶(superoxide dismutase,SOD)等几种防御酶的活性,表现出良好的开发应用前景[11-13]。但有关该菌株的种属鉴定和促生作用机理尚未进行研究,本研究通过形态学观察、生理生化试验和16S rRNA基因序列分析对菌株进行鉴定,测定海洋放线菌BM-2菌株的固氮、解磷、解钾作用及产铁载体、IAA、ACC脱氨酶和植酸钙的能力,明确该菌株的促生机理,为BM-2菌株的开发利用提供理论依据。
1 材料与方法 1.1 材料 1.1.1 试验菌株海洋放线菌BM-2菌株,由本实验室从连云港海域海泥中分离获得并保存[12]。
1.1.2 培养基BM-2菌株菌落形态观察培养基:高氏Ι号培养基、PDA培养基、察氏琼脂培养基、无机盐淀粉培养基、燕麦片琼脂培养基、葡萄糖天门冬素琼脂培养基、瓦氏肉汁琼脂培养基配方参考文献[3, 10]。
解无机磷和解有机磷培养基配方参考文献[2]。IAA检测培养基、磷酸盐缓冲液(DF)培养液和铬天青(chromeazurol S,CAS)检测培养基(产铁载体定性检测培养基)参考文献[10]。ADF培养基:将DF培养液中的(NH4)2SO4替换为ACC。解钾培养基、植酸钙测定培养基和产铁载体定量测定培养基参考文献[14]。无氮固体培养基参考文献[15]。
1.1.3 主要试剂和仪器Taq DNA聚合酶、dNTPs、16S rRNA基因引物,生工生物工程(上海)股份有限公司;Salkowski’s显色剂:10.8 mol/L浓硫酸待溶液冷却后,加入4.5 g/L FeCl3溶液充分混匀。生化反应管,北京陆桥技术股份有限公司;显微镜,Nikon公司;PCR仪,Bio-Rad公司。
1.2 BM-2菌株的种属鉴定 1.2.1 菌落形态观察将BM-2菌株接种于高氏Ι号培养基、PDA培养基、察氏琼脂培养基、无机盐淀粉培养基、燕麦片琼脂培养基、葡萄糖天门冬素琼脂培养基、瓦氏肉汁琼脂培养基上,28 ℃培养7−15 d,观察记录菌株在各种培养基上菌落的形态、颜色及是否产色素情况。
1.2.2 菌体特征观察采用插片法观察菌体特征。在高氏Ι号培养基上划线接种BM-2菌株,插入灭菌的盖玻片,28 ℃分别培养1、3、5、7 d后,使用光学显微镜观察插片上的气生菌丝、基内菌丝和孢子的形态特征。
1.2.3 生理生化特性参考《链霉菌鉴定手册》[16]及相关文献[17-18],采用生化反应管进行生理生化试验。
1.2.4 16S rRNA基因序列扩增与分析采用微波法提取BM-2菌株的总DNA[19],以细菌16S rRNA基因通用引物进行PCR扩增。上游引物为27F:5′-AGAGTTTGATCATGGCTCAG-3′;下游引物为1492R:5′-ACGGTTACCTTACCTTGT TACGACTT-3′。PCR反应体系(25 μL):2×San Taq PCR Mix 12.5 µL,27F (25 μmol/L) 1 μL,1492R (50 µmol/L) 1 µL,DNA模板(10 mmol/L) 1 μL,ddH2O 9.5 µL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,35次循环;72 ℃ 7 min,4 ℃保存。
采用1.0%琼脂糖电泳对PCR扩增产物进行检测,PCR产物送生工生物工程(上海)股份服务有限公司测序。所得的16S rRNA基因序列拼接完整后与GenBank数据库中的已知序列进行BLAST比对,采用DNAMAN 4.0软件构建BM-2菌株的16S rRNA基因序列系统发育树。
1.3 BM-2菌株的促生作用机理测定 1.3.1 解磷、解钾作用挑取少量的菌体分别接种到解无机磷、解有机磷固体培养基和解钾固体培养基平板上,28 ℃培养5−7 d,观察菌落周围是否有透明圈出现。若有透明圈则说明菌株有解磷、解钾作用[2, 14],用十字交叉法分别测量菌落直径(d)与晕圈直径(D),计算D/d值,D/d值越大,解磷、解钾活性越强。
1.3.2 固氮作用挑取少量的菌体接种到无氮培养基平板上,28 ℃培养5−7 d,观察菌株在该检测培养基上能否生长,能够生长的菌株进行连续转接,若菌株转接3代后还能生长,则说明该菌株具有固氮活性[15]。以不具有固氮作用的大肠杆菌(Escherichia coli)为阴性对照,以本实验室保藏的具有固氮作用的梅久兰放线菌(Streptomyces mediolani) F28菌株为阳性对照。
1.3.3 产IAA活性将已活化的BM-2菌株接种到装有高氏Ι号液体培养基的三角瓶中(60 mL/250 mL),28 ℃、180 r/min振荡培养3 d作为种子液。
将无菌色氨酸溶液加入到装有60 mL IAA检测培养基的250 mL三角瓶中,使色氨酸的终浓度达到0.5 mg/mL,按7%的接种量接种子液,28 ℃、180 r/min条件下培养。每隔1 d取样,发酵液于4 ℃、5 000 r/min离心10 min,上清液与Salkowski’s显色剂1:1 (体积比)混匀,暗反应20 min,观察混合液颜色。若溶液变为粉红色则为阳性,说明该菌株能够产生IAA,测定OD530的吸光值,以未接菌的IAA检测培养基作为对照[10]。
IAA标准曲线的制作:配制浓度为0、0.5、1.0、1.5、2.0、2.5、3.0 mg/L等不同浓度的IAA溶液,加入Salkowski’s显色剂显色后,测定OD530吸光值。以IAA浓度为横坐标、OD530值为纵坐标绘制标准曲线,根据标准曲线计算不同培养时间样品的IAA浓度。
1.3.4 产ACC脱氨酶活性挑取少量的菌体接种到ADF固体培养基平板上,28 ℃培养7 d,观察菌株是否生长。若能生长,将菌株转接于ADF固体培养基上。若连续转接3代还能生长,说明该菌株能产生ACC脱氨酶[10]。以不能产生ACC脱氨酶的大肠杆菌为阴性对照,以本实验室保藏的能产生ACC脱氨酶的梅久兰放线菌F28菌株为阳性对照。
1.3.5 产铁载体活性定性测定采用CAS检测法[10]。将BM-2菌株点接到CAS培养基上,28 ℃培养5−7 d,观察菌落周围是否有黄色晕圈。若有晕圈则说明具有产铁载体的活性,测定晕圈直径与菌落直径的比值,比值越大产铁载体活性越大。以不能产生铁载体的梅久兰放线菌F28菌株为阴性对照,以本实验室保藏的能产生铁载体的链霉菌(Streptomyces sp.) F9菌株为阳性对照。
定量测定[14]:按7%的接种量将BM-2菌株种子液接种到产铁载体定量测定培养基中,每隔12 h取样,4 ℃、5 000 r/min离心10 min,将上清液按1:1体积比与CAS检测液混匀,避光静置40 min,测定OD630的吸光值(As),重复3次。以未接种BM-2菌株的产铁载体定量测定培养基为对照,以其吸光值作为参比值(Ar),铁载体量用铁载体活性单位表示,铁载体活性单位(%)=[(Ar−As)/Ar]×100。
1.3.6 产植酸酶活性将已活化的BM-2菌苔菌丝面朝下接种在植酸钙测定培养基上,28 ℃培养3−5 d,观察菌落周围是否产生透明圈[14]。
2 结果与分析 2.1 BM-2菌株的种属鉴定 2.1.1 菌落形态观察BM-2菌株在测试的几种培养基上生长较好,长势基本一致。在不同的培养基上气生菌丝的颜色无明显变化,基内菌丝颜色变化明显,无可溶性色素产生(表 1)。
| 培养基 Medium |
生长状态 Growth state |
颜色 Colour | 可溶性色素 Soluble pigment |
|
| 气生菌丝 Aerial mycelium |
基内菌丝 Substrate mycelium |
|||
| 高氏Ⅰ号培养基 Gause No. 1 medium |
++++ | 白色 White |
白色 White |
无 No |
| 瓦氏肉汁琼脂培养基 Waffle gravy agar medium |
++++ | 灰白色 Grey white |
浅褐色 Pale brown |
无 No |
| 葡萄糖天门冬素琼脂培养基 Glucose aspartate agar medium |
++++ | 白色 White |
灰白色 Grey white |
无 No |
| 燕麦片琼脂培养基 Oatmeal agar medium |
+++ | 灰白色 Grey white |
象牙色 Ivory |
无 No |
| 察氏琼脂培养基 Czapek dox agar medium |
+++ | 灰白色 Grey white |
淡黄色 Beige |
无 No |
| 无机盐淀粉培养基 Inorganic salts-starch agar medium |
++++ | 灰白色 Grey white |
灰白色 Grey white |
无 No |
| PDA培养基 PDA medium |
++++ | 灰白色 Grey white |
褐色 Isabellin |
无 No |
| 注:++++:生长良好;+++:生长一般;++:生长差. Note: ++++: Growing well; +++: General growth; ++: Poor growth. | ||||
使用光学显微镜观察培养不同时间的插片,BM-2菌株的基内菌丝和气生菌丝均生长旺盛,分枝多;孢子丝为直线形和波曲形,无轮生。孢子丝成熟后形成的孢子链呈串珠状,孢子长柱形,表面光滑(图 1)。
|
| 图 1 BM-2菌株的菌丝及孢子链形态(1 000×) Figure 1 Mycelium and spore chain morphology of strain BM-2 (1 000×) 注:A:菌丝形态;B:孢子链形态. Note: A: Mycelium morphology; B: Spore chain morphology. |
|
|
将BM-2菌株接种到不同的生化反应管中,进行明胶液化试验、淀粉水解试验、纤维素分解试验、油脂水解试验、尿素酶试验、石蕊牛奶试验等大分子物质水解反应,以及吲哚试验、甲基红试验、柠檬酸盐试验、V-P试验等IMViC反应以及糖发酵试验。
试验结果表明,该菌株能使明胶液化、淀粉水解、油脂水解、牛奶凝固并胨化、产过氧化氢酶和尿素酶,不产生纤维素酶、精氨基酸脱羧酶、赖氨基酸脱羧酶、苯丙氨酸脱氨酶、卵磷脂酶,生长耐盐度最高为8%。结果见表 2。
| 项目 Items |
结果 Results |
| 明胶液化试验 Gelatin liquefaction test |
+ |
| 淀粉水解试验 Starch hydrolysis test |
+ |
| 纤维素分解试验 Cellulase decomposition test |
− |
| 油脂水解试验 Oil hydrolase test |
+ |
| 尿素酶试验 Urease test |
+ |
| 甲基红试验 Methyl red test |
− |
| V-P试验 V-P test |
− |
| 吲哚试验 Indole production |
− |
| 硫化氢试验 Hydrogen sulfide test |
− |
| 柠檬酸盐试验 Citrate test |
+ |
| 过氧化氢酶试验 Catalase test |
+ |
| 精氨基酸脱羧酶试验 Arginine decarboxylase test |
− |
| 赖氨基酸脱羧酶试验 Lysine decarboxylase test |
− |
| 葡萄糖的氧化发酵试验 Oxidative fermentation test of glucose |
+ |
| 苯丙氨酸脱氨酶试验 Phenylalanine deaminase test |
− |
| 产黑色素试验 Melanin production test |
− |
| 产氨试验 Ammonia production test |
+ |
| 卵磷脂酶试验 Nagler’s reaction |
− |
| 半固体琼脂穿刺试验 Semisolid motility test |
+ |
| 生长耐盐度 Salt tolerance test (%) |
0−8 |
| 石蕊牛奶试验 Litmus milk test |
凝固,胨化 Solidification, peptonization |
| 注:+:阳性;−:阴性.
Note: +: Positive; −: Negative. | |
该菌株能利用葡萄糖、麦芽糖、乳糖、蔗糖、甘露糖、D-果糖、D-木糖、L-鼠李糖、纤维二糖、甘露醇、D-山梨醇。不能利用棉子糖、肌醇(表 3)。
| 糖种类 Type of sugar |
产酸 Acid production |
产气 Aerogenesis |
| 葡萄糖Glucose | + | − |
| 麦芽糖Maltose | + | − |
| 乳糖Lactose | + | + |
| 蔗糖Sucrose | + | + |
| 甘露糖Mannose | + | + |
| D-果糖D-fructose | + | − |
| 棉子糖Raffinose | − | − |
| D-木糖D-xylose | + | − |
| L-鼠李糖L-rhamnose monohydrate | + | − |
| 纤维二糖Cellobiose | + | − |
| 甘露醇Mannitol | + | − |
| 肌醇Inositol | − | + |
| D-山梨醇D-sorbitol | + | − |
| 注:+:阳性;−:阴性.
Note: +: Positive; −: Negative. | ||
根据培养特征、菌体形态观察及生理生化试验结果,查阅《伯杰氏细菌鉴定手册》第9版[20]和《链霉菌鉴定手册》[16]及文献[21],放线菌BM-2菌株符合链霉菌科链霉菌属(Streptomyces)的特征。
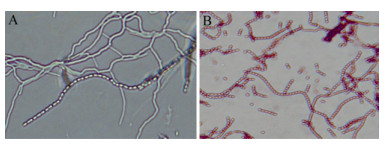
2.1.4 16S rRNA基因序列扩增与分析以BM-2菌株基因组DNA为模板,使用16S rRNA基因通用引物(27F和1492R)进行PCR扩增,获得一条符合预期大小的DNA条带(1 500 bp左右)。应用DNAMAN 4.0软件对测序结果进行拼接,得到BM-2菌株的16S rRNA基因序列,其大小为1 432 bp,将序列提交到GenBank数据库中,登录号为MN647551,用ClustalX与NCBI数据库进行BLAST比对,BM-2菌株与GenBank中Streptomyces badius (NR_112256)的16S rRNA基因序列相似性最高,达到99.72%。选取GenBank中的不同菌株与BM-2菌株用DNAStar与MEGA软件构建系统进化树,其与Streptomyces badius (NR_112256)聚在同一分支中(图 2)。结合形态学观察、生理生化反应测定结果,确定BM-2菌株为栗褐链霉菌(Streptomyces badius)。
|
| 图 2 BM-2菌株基于16S rRNA基因序列构建的系统发育树 Figure 2 Phylogenetics tree based on 16S rRNA gene sequence of BM-2 strain 注:括号内为菌株的16S rRNA基因序列在GenBank中的登录号;分支结点处数字为Bootstrap值;标尺的数据为进化距离. Note: Numbers in parentheses represent the accession numbers in the GenBank for the 16S rRNA gene sequences of the strain; Numbers on the branches refer to bootstrap values; Bar (0.002) represents sequence divergence. |
|
|
采用透明圈法、平板划线法定性测定BM-2菌株解磷、解钾作用、固氮作用和产植酸酶、ACC脱氨酶、IAA以及铁载体能力。在此基础上,采用Salkowski法和CAS检测法进行定量分析,明确该菌株的促生作用机理。
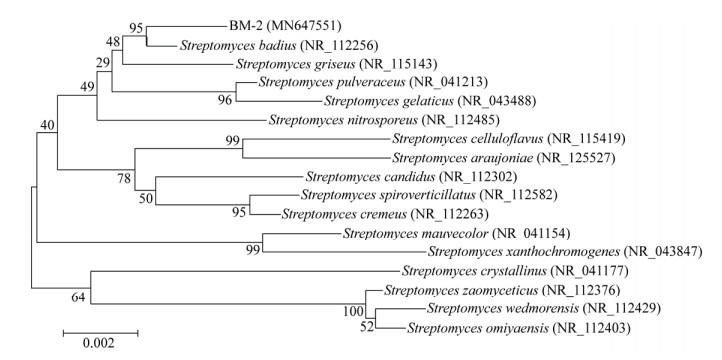
2.2.1 解磷、解钾作用BM-2菌株在解有机磷培养基中培养时形成晕圈,晕圈直径/菌落直径(D/d)为2.04,说明该菌株具有解有机磷作用;在解无机磷培养基和解钾培养基中未出现晕圈,说明菌株无解无机磷和解钾作用(图 3)。

|
| 图 3 BM-2菌株在解磷和解钾培养基上的生长状态 Figure 3 Growth state of BM-2 strain on medium of phosphate and potassium removal 注:A:有机磷培养基;B:无机磷培养基;C:解钾培养基. Note: A: Organic phosphorus medium; B: Inorganic phosphorus medium; C: Potassium medium. |
|
|
BM-2菌株和阳性对照梅久兰放线菌F28在无氮培养基上生长正常,连续转接3代后仍然生长良好,而阴性对照大肠杆菌在固氮培养基上未能生长(图 4),表明BM-2菌株具有固氮作用。促生菌株可将空气中的无机氮源转变成易被植物吸收利用的有机氮源,从而促进植物的生长发育[10]。因此,固氮作用是BM-2菌株促进植物生长的机理之一。
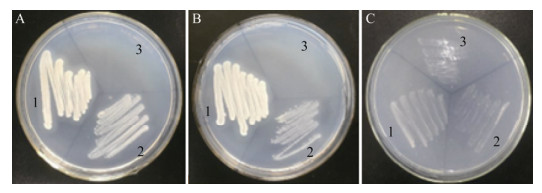
|
| 图 4 BM-2菌株在固氮培养基上的生长状态 Figure 4 Growth state of BM-2 strain on nitrogen fixing medium 注:A:第1代;B:第2代;C:第3代. 1:BM-2菌株;2:F28菌株;3:大肠杆菌. Note: A: The first generation; B: The second generation; C: The third generation. 1: BM-2 strain; 2: F28 strain; 3: E. coli. |
|
|
将BM-2菌株接种到IAA检测培养基中培养5 d,离心取上清与Salkowski’s显色剂暗反应20 min后溶液变为粉红色,为阳性(图 5),说明该菌株具有产IAA能力。

|
| 图 5 BM-2菌株发酵液与Salkowski’s显色剂的反应 Figure 5 Reaction of BM-2 fermentation broth with Salkowsk's chromogenic agent 注:1−3:对照组;4−6:处理组. Note: 1−3: CK; 4−6: Treatment. |
|
|
配制不同浓度IAA溶液,测定不同浓度溶液的OD530值,制作IAA标准曲线(图 6),得到了IAA浓度与OD530值呈线性回归关系,方程为y=0.028 1x−0.001 4,相关系数R2为0.997 9。

|
| 图 6 IAA的标准曲线 Figure 6 Standard curve of IAA |
|
|
将BM-2菌株接种到IAA检测培养基中培养不同时间,测定培养液的OD530值。结果表明,不同培养时间培养液中IAA浓度不同(图 7)。在培养2 d内,随着培养时间的延长,IAA浓度逐渐升高,到第2天最高,为2.109 mg/L;2 d后逐渐下降,至第5天时IAA浓度仅为0.719 mg/L。第1天和第3天IAA浓度差异不显著,其他时间差异均达到显著水平。
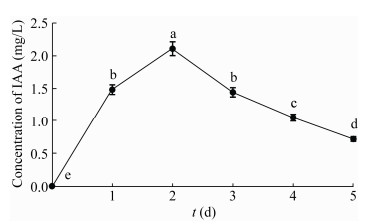
|
| 图 7 BM-2菌株产IAA的时间动态趋势 Figure 7 Time dynamic trend of IAA production by BM-2 注:小写字母表示差异显著(P < 0.05). Note: The difference of small letters is significant (P < 0.05). |
|
|
BM-2菌株和阳性对照梅久兰放线菌F28在以ACC为唯一氮源的ADF培养基上生长良好,连续转接3代后2个菌株仍能正常生长(图 8)。说明菌株能够产生ACC脱氨酶,把ACC分解为α-丁酮酸和氨[10],被BM-2菌株和阳性对照梅久兰放线菌F28所利用,满足其生长。阴性对照大肠杆菌在ADF培养基上未能生长。
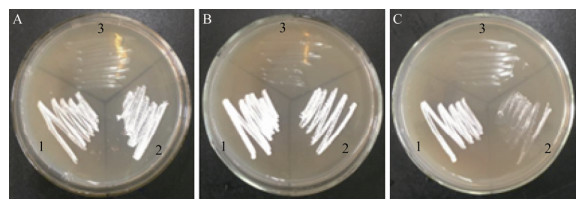
|
| 图 8 BM-2菌株在ADF培养基上的生长状态 Figure 8 Growth state of BM-2 strain on ADF culture medium 注:A:第1代;B:第2代;C:第3代. 1:BM-2菌株;2:F28菌株;3:大肠杆菌. Note: A: The first generation; B: The second generation; C: The third generation. 1: Strain BM-2; 2: Strain F28; 3: E. coli. |
|
|
ACC是乙烯合成的前体物质,生防菌能够产生ACC脱氨酶水解ACC,从而有效降低植物体内乙烯的产生,增强植物的抗逆能力,促进植物的生长发育[22-23]。试验结果表明产ACC脱氨酶是BM-2菌株促进植物生长的机理之一。
2.2.5 产铁载体活性能产铁载体的微生物在CAS检测平板上生长,产生高铁鳌合能力的铁载体夺取培养基中的铁离子,菌落周围的蓝色变成橙黄色。BM-2菌株和阳性对照链霉菌F9在CAS培养基上培养7 d,菌落周围出现了明显的黄色晕圈,阴性对照梅久兰放线菌F28未出现黄色晕圈(图 9),说明BM-2菌株能够产生铁载体。
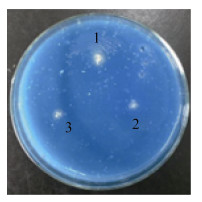
|
| 图 9 BM-2菌株在CAS培养基上的生长状态 Figure 9 Growth state of BM-2 strain on CAS culture medium 注:1:BM-2菌株;2:F28菌株;3:F9菌株. Note: 1: Strain BM-2; 2: Strain F28; 3: Strain F9. |
|
|
BM-2菌株在产铁载体培养基中培养不同时间,发酵液中铁载体活性不同,12−48 h铁载体活性随着培养时间的增长快速增加,48 h后相对活性增加缓慢,84 h活性最高,为1.47%;其后开始缓慢下降,72−96 h铁载体活性差异未达到显著水平,说明菌株产铁载体活性具有一定的稳定期;96 h后明显下降,至156 h铁载体活性仅为0.01% (图 10)。

|
| 图 10 BM-2菌株产铁载体的时间动态趋势 Figure 10 Time dynamic trend of iron production carrier of BM-2 strain 注:小写字母表示差异显著(P < 0.05). Note: The difference of small letters is significant (P < 0.05). |
|
|
铁载体是细菌、真菌等在低铁环境下分泌的一类低分子量(500−1 000 Da)的高度专一性铁螯合剂,在胞内合成后被分泌到胞外,与环境中不易被植物吸收的Fe3+结合,形成非常稳定的铁复合物,复合物与细胞膜上相应的特异性受体结合,将铁元素运输到胞内,满足植物对铁元素的需求,促进植物生长[24]。试验结果表明产铁载体也是BM-2菌株促进植物生长的机理之一。
2.2.6 产植酸酶活性BM-2菌株在植酸钙检测培养基中培养时无晕圈,说明该菌株不能产植酸酶。
3 讨论与结论海洋放线菌BM-2菌株为栗褐链霉菌(Streptomyces badius),具有固氮、解有机磷、产铁载体、IAA和ACC脱氨酶等能力,而许多文献[6-10]表明这些物质的产生是微生物促进作物生长的主要机理。本实验室前期研究发现BM-2菌株能抑制病原菌的菌丝生长和孢子萌发[11-12],并能通过提高黄瓜体内PAL、POD、PPO和SOD等防御酶的活性诱导黄瓜对枯萎病的抗病性[13],能够促进黄瓜幼苗的生长,但有关促进黄瓜幼苗生长的作用机理未进行研究。本研究结果与前期研究结果相呼应,明确了该菌株的促生作用机理。
链霉菌是重要的微生物资源,许多菌株能够产生抗生素等抑菌物质,能抑制多种病原菌,并促进植物生长,是重要的生防资源[25-26]。Khamna等[27]从药用植物根际土壤中分离筛选到具有抗菌活性的Streptomyces CMU-PA101和Streptomyces CMU-SK126,具有产生IAA和铁载体特性;Anwar等[28]从巴基斯坦旁遮普省不同的小麦和番茄土壤中分离到具有解磷、产IAA、铁载体、ACC脱氨酶活性的Streptomyces nobilis WA-3、Streptomyces enissocaesilis TA-3、Streptomyces sp. WA-1和Streptomyces djakartensis TB-4等菌株,Streptomyces nobilis WA-3等菌株能增加小麦的芽长、根长、植株鲜重、干重和叶片数,明显促进小麦的生长和增产;Hamdali等[29]和Toumatia等[30]分别从摩洛哥磷矿和撒哈拉土壤中分离到具有解磷作用的链霉菌Streptomyces griseus M1323和能产生IAA的拮抗链霉菌Streptomyces mutabilis IA1,二者均对小麦生长有显著的促进作用;Kaur等[31]从旁遮普获得的Azotobacter sp.和Streptomyces badius可以促进小麦生长,提高小麦产量,均具有解磷、产IAA、赤霉素、ACC脱氨酶特性,Streptomyces badius菌株还能够产铁载体,该结果与本研究基本一致。但已有的研究对象均来自陆源环境,有关源自海洋的链霉菌的抑菌促生作用及其机理研究尚未见报道。
栗褐链霉菌是链霉菌属中重要的种类。已有学者研究了不同栗褐链霉菌的抑菌作用和降解纤维素的能力[21, 32-33],但有关栗褐链霉菌的促生机理研究国内尚未见报道。
源自海洋的BM-2菌株具有防病促生长作用,并能诱导植物产生抗病性。本研究明确了该菌株的促生作用机理,为该菌株的开发应用提供理论依据。与陆源放线菌相比,海洋放线菌具有低温、寡营养、耐盐性和适应性广、在植物根际或不同性质的土壤中定殖能力强等特点,是开发生防菌剂的优良菌株,我们今后将进一步系统研究菌株的定殖特性及其制剂的开发,为开发新型微生物肥料或农药提供理论依据。
| [1] |
Wu W, Zhang PF, Zhang GP, et al. Screening, identification and growth promoting characteristics of high efficient organic phosphate-mineralizing bacterium from rhizosphere soils of Forsythia suspensa[J]. Journal of Southwest Forestry University, 2018, 38(3): 93-100. (in Chinese) 吴伟, 张鹏飞, 张桂萍, 等. 连翘根际高效解有机磷细菌的筛选鉴定及促生长特性研究[J]. 西南林业大学学报, 2018, 38(3): 93-100. |
| [2] |
Zhou BB. Screening of plant growth-promoting rhizobacteria and its application in strawberry[D]. Tai'an: Master's Thesis of Shandong Agricultural University, 2018 (in Chinese) 周贝贝.植物根际促生菌的筛选及其在草莓上的应用研究[D].泰安: 山东农业大学硕士学位论文, 2018 |
| [3] |
Gan L, Lan XJ, Dai PB, et al. Effect of combined biocontrol actinomycetes strains on watermelon wilt disease[J]. Chinese Journal of Biological Control, 2015, 31(4): 516-523. (in Chinese) 甘良, 蓝星杰, 戴蓬博, 等. 放线菌混合菌剂对西瓜枯萎病的防治作用研究[J]. 中国生物防治学报, 2015, 31(4): 516-523. |
| [4] |
Hu CJ, Xue DL, Wang SJ, et al. Obstacles of soybean continuous cropping Ⅲ. Mechanism of soybean yield increment by marine actinomyces MB-97[J]. Chinese Journal of Applied Ecology, 2002, 13(9): 1095-1098. (in Chinese) 胡春江, 薛德林, 王书锦, 等. 大豆连作障碍研究Ⅲ.海洋放线菌MB-97促进连作大豆增产机理[J]. 应用生态学报, 2002, 13(9): 1095-1098. |
| [5] |
Benson DR, Silvester WB. Biology of Frankia strains, actinomycete symbionts of actinorhizal plants[J]. Microbiological Reviews, 1993, 57(2): 293-319. DOI:10.1128/MMBR.57.2.293-319.1993 |
| [6] |
Liang XR, Li NH, Zhou XG, et al. Isolation and identification of tomato-associated endophytic actinomyces and their potential for plant growth promotion[J]. Microbiology China, 2018, 45(6): 1314-1322. (in Chinese) 梁新冉, 李乃荟, 周新刚, 等. 番茄根内促生放线菌的分离鉴定及其促生效果[J]. 微生物学通报, 2018, 45(6): 1314-1322. |
| [7] |
Yang XL. Screening, identification and characterization of rice endophytic actinomycetes against the pathogen of rice blast[D]. Changsha: Master's Thesis of Hunan University, 2014 (in Chinese) 杨晓璐.抗稻瘟病水稻内生放线菌的筛选鉴定及生物活性的研究[D].长沙: 湖南大学硕士学位论文, 2014 |
| [8] |
Ning CH, Li WB, Zhang C, et al. Isolation and identification of antagonizing and growth-promoting actinobacteria colonized in plant roots and rhizosphere[J]. Acta Microbiologica Sinica, 2019, 59(10): 2024-2037. (in Chinese) 宁楚涵, 李文彬, 张晨, 等. 定殖植物根内和根围放线菌的分离鉴定及其体外抑菌促生效应[J]. 微生物学报, 2019, 59(10): 2024-2037. |
| [9] |
Shan WN. Endophytic actinomycetes from tea plants (Camellia sinensis) in Fujian province: isolation, identification and analysis of bioactive metabolites[D]. Fuzhou: Master's Thesis of Fujian Agriculture and Forestry University, 2019 (in Chinese) 单文娜.福建茶树内生放线菌的分离、鉴定和活性分析[D].福州: 福建农林大学硕士学位论文, 2019 |
| [10] |
Bai JL. Study on from northern the diversity of rhizosphere actinomycetes the typical halophytes in coastal zone of Jiangsu and their plant growth-promoting effect under salt stress[D]. Xuzhou: Master's Thesis of Jiangsu Normal University, 2017 (in Chinese) 白娟娈.苏北海岸带典型盐生植物根际放线菌多样性及其耐盐促生作用研究[D].徐州: 江苏师范大学硕士学位论文, 2017 |
| [11] |
Bao ZH, Ma GZ, Wu SJ, et al. Antibacterial characteristics of actinomycete BM-2 from marine[J]. Agrochemicals, 2009, 48(9): 640-643. (in Chinese) 暴增海, 马桂珍, 吴少杰, 等. 海洋放线菌BM-2菌株的抗菌特性[J]. 农药, 2009, 48(9): 640-643. |
| [12] |
Ma GZ, Bao ZH, Xia ZQ, et al. Inhibiting effect of seven marine actinomycete strains against vegetable pathogenic microorganisms[J]. Crops, 2009(5): 35-38. (in Chinese) 马桂珍, 暴增海, 夏振强, 等. 海洋放线菌对几种蔬菜病原菌抗菌作用的测定[J]. 作物杂志, 2009(5): 35-38. |
| [13] |
Bao ZH, Ma GZ, Wang SF, et al. Growth-promoting and induced resistance of marine Paenibacillus polymyxa BM-2 in cucumber[J]. Crops, 2013(5): 94-98. (in Chinese) 暴增海, 马桂珍, 王淑芳, 等. 海洋放线菌BM-2菌株对黄瓜的促生作用和诱导抗性研究[J]. 作物杂志, 2013(5): 94-98. |
| [14] |
Li C. Study on the chearacteristics relating to pesticides of three marine Trichoderma spp.[D]. Qingdao: Master's Thesis of Qingdao University of Science and Technology, 2017 (in Chinese) 李闯. 3株海洋生境木霉与农药相关性状的研究[D].青岛: 青岛科技大学硕士学位论文, 2017 |
| [15] |
Xu LH. Study on nitrogenase gene diversity and activity of microorganism in the Taklamakan desert[D]. Wuhan: Doctoral Dissertation of China University of Geosciences (Wuhan), 2014 (in Chinese) 徐玲花.塔克拉玛干沙漠微生物固氮酶基因多样性及其活性的研究[D].武汉: 中国地质大学(武汉)博士学位论文, 2014 |
| [16] |
Actinomycetes Classification Group, Institute of Microbiology, Chinese Academy of Sciences. The Identification Manual of Streptomyces[M]. Beijing: Science Press, 1975: 19-70. (in Chinese) 中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M]. 北京: 科学出版社, 1975: 19-70. |
| [17] |
Yang XF, Liu WC, Lu CG, et al. Biocontrol effect and the taxonomy of antagonistic actinomyces strain A03[J]. Acta Phytophylacica Sinica, 2007, 34(1): 73-77. (in Chinese) 杨秀芳, 刘伟成, 卢彩鸽, 等. 拮抗放线菌A03的生防作用及其分类鉴定[J]. 植物保护学报, 2007, 34(1): 73-77. |
| [18] |
Hou ZM, Cui HX, Zhao FQ, et al. Identification and antibacterial activity of marine Streptomyces from Jiaozhou Bay[J]. Marine Sciences, 2006, 30(2): 43-46, 52. (in Chinese) 侯竹美, 崔洪霞, 赵方庆, 等. 胶州湾海洋链霉菌的初步鉴定及抑菌活性的研究[J]. 海洋科学, 2006, 30(2): 43-46, 52. |
| [19] |
Xu P, Li WJ, Xu LH, et al. A microwave-based method for genomic DNA extraction from actinomycetes[J]. Microbiology China, 2003, 30(4): 82-84. (in Chinese) 徐平, 李文均, 徐丽华, 等. 微波法快速提取放线菌基因组DNA[J]. 微生物学通报, 2003, 30(4): 82-84. |
| [20] |
Bochanan RE, Gibbons NE. Bergey's Manual of Determinative Bacteriology[M]. Translated by Liu FJ. 8th ed. Beijing: Science Press, 1984: 313-323 (in Chinese) 布坎南RE, 吉本斯NE.伯杰细菌鉴定手册[M].刘复今, 译. 8版.北京: 科学出版社, 1984: 313-323 |
| [21] |
Zhang K, Wu ML, Gu LS, et al. Identification and preliminary evaluation of a biocontrol actinomycete strain gz-8 against Colletotrichum gloeosporioides[J]. Chinese Journal of Pesticide Science, 2017, 19(6): 708-715. (in Chinese) |
| [22] |
Gamalero E, Berta G, Massa N, et al. Interactions between Pseudomonas putida UW4 and Gigaspora rosea BEG9 and their consequences for the growth of cucumber under salt-stress conditions[J]. Journal of Applied Microbiology, 2010, 108(1): 236-245. DOI:10.1111/j.1365-2672.2009.04414.x |
| [23] |
Glick BR. Bacteria with ACC deaminase can promote plant growth and help to feed the world[J]. Microbiological Research, 2014, 169(1): 30-39. DOI:10.1016/j.micres.2013.09.009 |
| [24] |
Zhang Y. Isolation of siderophore producting and mineral dissoluting bacteria and the interaction between mica minerals and bacterias[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2011 (in Chinese) 张垠.酸模根际产铁载体矿物分解细菌的分离筛选及其与矿物相互作用[D].南京: 南京农业大学硕士论文, 2011 |
| [25] |
Wang XJ, Zhang J, Wang JD, et al. Novel cyclopentenone derivatives produced by a rare actinobacterial strain Actinoalloteichus nanshanensis sp. nov. NEAU 119[J]. Natural Product Research, 2013, 27(20): 1863-1869. DOI:10.1080/14786419.2013.771349 |
| [26] |
Jeon JS, Lee SS, Kim HY, et al. Plant growth promotion in soil by some inoculated microorganisms[J]. The Journal of Microbiology, 2003, 41(4): 271-276. |
| [27] |
Khamna S, Yokota A, Lumyong S. Actinomycetes isolated from medicinal plant rhizosphere soils: diversity and screening of antifungal compounds, indole-3-acetic acid and siderophore production[J]. World Journal of Microbiology and Biotechnology, 2009, 25(4): 649-655. DOI:10.1007/s11274-008-9933-x |
| [28] |
Anwar S, Ali B, Sajid I. Screening of rhizospheric actinomycetes for various in-vitro and in-vivo plant growth promoting (PGP) traits and for agroactive compounds[J]. Frontiers in Microbiology, 2016, 7: 1334. |
| [29] |
Hamdali H, Hafidi M, Virolle MJ, et al. Growth promotion and protection against damping-off of wheat by two rock phosphate solubilizing actinomycetes in a P-deficient soil under greenhouse conditions[J]. Applied Soil Ecology, 2008, 40(3): 510-517. DOI:10.1016/j.apsoil.2008.08.001 |
| [30] |
Toumatia O, Compant S, Yekkour A, et al. Biocontrol and plant growth promoting properties of Streptomyces mutabilis strain IA1 isolated from a Saharan soil on wheat seedlings and visualization of its niches of colonization[J]. South African Journal of Botany, 2016, 105: 234-239. DOI:10.1016/j.sajb.2016.03.020 |
| [31] |
Kaur J, Pandove G, Gangwar M, et al. Development of liquid inoculants: an innovative agronomic practice for sustainable agriculture[J]. Journal of Experimental Biology and Agricultural Sciences, 2018, 6(3): 472-481. DOI:10.18006/2018.6(3).472.481 |
| [32] |
Wang W, Zheng DH, Yang CB, et al. Isolation of high efficient cellulose decomposing bacteria and biological effects on straw degradation[J]. Journal of Agricultural Science and Technology, 2019, 21(8): 36-46. (in Chinese) 王伟, 郑大浩, 杨超博, 等. 高效纤维素分解菌的分离及秸秆降解生物效应[J]. 中国农业科技导报, 2019, 21(8): 36-46. |
| [33] |
Huang HL, Zeng GM, Yu HY, et al. Studies of lignocellulose degradation by Streptomyces badius[J]. Environmental Science & Technology, 2006, 29(6): 4-5, 26. (in Chinese) 黄红丽, 曾光明, 郁红艳, 等. 栗褐链霉菌Streptomyces badius对木质纤维素的降解研究[J]. 环境科学与技术, 2006, 29(6): 4-5, 26. |
 2020, Vol. 47
2020, Vol. 47