扩展功能
文章信息
- 赵维鑫, 黄志勇, 黄津辉, 杨晨, 王波, 杨莎莎
- ZHAO Wei-Xin, HUANG Zhi-Yong, HUANG Jin-Hui, YANG Chen, WANG Bo, YANG Sha-Sha
- 厌氧消化酸抑制研究进展
- Research progress in acid inhibition in anaerobic digestion
- 微生物学通报, 2020, 47(10): 3442-3450
- Microbiology China, 2020, 47(10): 3442-3450
- DOI: 10.13344/j.microbiol.china.200604
-
文章历史
- 收稿日期: 2020-06-15
- 接受日期: 2020-08-31
- 网络首发日期: 2020-09-08
2. 中国科学院天津工业生物技术研究所 天津市工业生物系统与过程工程重点实验室 天津 300308
2. Tianjin Key Laboratory for Industrial Biological Systems and Bioprocessing Engineering, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
厌氧消化目前已经广泛应用于各类有机废水的处理处置过程中,稳定高效的运行状态对于厌氧消化系统的长期处理效果至关重要[1-2]。但在实际运行中,受物料性质、运行负荷、水力停留时间等因素的影响,厌氧消化系统常受到抑制作用,如酸、氨和硫酸根的抑制等[3-5]。其中,挥发性脂肪酸积累过多导致的酸抑制问题被认为是制约厌氧消化系统长期稳定运行的重要因素[6]。
酸抑制是厌氧消化系统中的一类特殊问题。其产生过程和抑制途径中不仅涉及pH、温度、有机负荷、进水水力停留时间等多个运行参数,而且包含产酸菌、产乙酸菌和产甲烷菌等多种微生物之间的复杂相互作用,因而难以从单一角度去解释和解决该问题。针对这一复杂问题,近年来,研究人员从物质种类变化和微生物间相互作用关系对其发生过程和抑制途径进行了探究,并尝试通过添加碱性药剂、添加微量元素、直接生物强化和采用微生物电化学技术等对其进行了恢复研究,都取得了不错的效果。
随着厌氧消化研究的不断深入,酸抑制的作用机制逐渐清晰、调控手段逐渐多样,但相关系统性的综述仍然较少,无法全面分析酸抑制的产生过程及其恢复机制。本文综述了厌氧消化过程中酸抑制的产生过程、抑制机理及恢复方法,以期为解决厌氧消化酸抑制问题提供参考。
1 酸抑制的产生及危害酸抑制产生的直接原因是系统中挥发性脂肪酸(volatile fatty acid,VFA)积累过多。VFA是指甲酸、乙酸、丙酸、丁酸、戊酸和己酸等碳链上碳原子数少于6的小分子有机酸。在厌氧消化过程中,VFA是厌氧消化过程中的重要中间代谢产物,其中乙酸和甲酸还是产甲烷古菌的代谢底物[7]。系统中VFA的种类和浓度不仅与产气量和产甲烷率密切相关,同时也关系到厌氧消化过程的稳定性[8]。当系统进水有机负荷过高或物料C/N失衡时,水解产酸菌会产生大量VFA,但由于产甲烷古菌代谢速率较为缓慢,无法在短时间内快速利用产生的VFA,导致VFA出现积累,引发系统pH值降低、出水化学需氧量(chemical oxygen demand,COD)骤增、产气性能下降等一系列问题,此问题被称之为酸抑制[9]。
表 1总结了近年来有关有机废水厌氧消化中酸抑制的相关研究,从中可以看出,酸抑制广泛存在于各类有机废水的消化过程中,而且VFA在较低浓度时就有引发酸抑制的风险。Zhang等[19]在研究中发现,酸抑制一旦发生后,VFA在短短的12 d内便可达到18 000 mg/L以上,使反应器的产甲烷过程完全失败。Voelklein等[20]认为,即使将系统运行有机负荷降低至2.5 g-VS/(L·d),消化过程仍会受到VFA的抑制。上述研究表明,除存在广泛外,酸抑制还具有作用迅速、危害巨大和解除困难的特点。
| 底物 Substrate |
运行模式 Reaction mode |
有机负荷 Organic loading |
温度 Temperature (℃) |
VFA浓度 VFA concentration |
抑制效应 Inhibition effect |
参考文献 References |
| Gin spent wash | Semi-continuous mode | 32 kg-COD/(m3·d) | 36±1 | 14.7 g-CODVFA/L | Methane production rate and COD removal rate decreased | [10] |
| Cassava wastewater | Continuous mode | 15 kg/(m3·d) | 55 | 350 mg/L | System pH and alkalinity sharply decreased | [11] |
| Cattle slaughterhouse wastewater | Semi-continuous mode | 1.82 g/(L·d) | 38 | > 400 mg/L | VFA accumulated rapidly and the gas production rate decreased | [12] |
| Ethanol wastewater | Batch mode | 18 kg-COD/(m3·d) | 37 | 100 mg/L | Biogas production rate decreased, COD of effluent increased | [13] |
| Glucose wastewater | Semi-continuous mode | 4.67 g-COD/(L·d) | 37 | 1 400 mg/L | Methane production rate decreased, VFA accumulated | [14] |
| Food wastewater | Batch mode | 50 g-COD/L | 28±2 | 7 500 mg/L | Biogas production rate decreased, COD of effluent increased | [15] |
| Nonfat dry milk | Semi-continuous mode | 2 g-COD/(L·d) | 35±2 | > 1 000 mg/L | pH of the effluent decreased, COD of effluent increased | [16] |
| Olive mill wastewaters | Continuous mode | 1.87 g-COD/(L·d) | 37 | 60 mmol/L | Methane yield and biogas roduction rate decreased | [17] |
| Rapeseed oil | Continuous mode | 10 kg-VS/(m3·d) | 50 | 1 063 mg/L | pH decreased, VFA content increased | [18] |
VFA是造成酸抑制的直接原因,其可以分为离子型和非离子型2类。离子型VFA无法自由穿越细胞膜进入胞内,因而不会对细胞产生较大危害[21]。但VFA的积累会导致pH值的降低,进而促使更多VFA由离子型转变为非离子型[22]。非离子型VFA具有亲脂性,可以自由通过细胞膜并在细胞质中解离H+,造成细胞质酸化,对细胞造成较大伤害[23]。作为应对机制,细胞会通过质子泵以主动运输的方式向外输出H+,在此过程中会消耗大量能量,降低细胞活力[24]。此外,一些游离的VFA会扩散到细胞膜中,并起到解偶联剂的作用,进一步降低细胞可用能量并抑制微生物的活性[25]。随着H+的逐渐积累,细胞内pH逐渐降低,pH一旦降至可生长范围下限,细胞就会停止生长[26]。
以上仅是VFA对单个细胞的抑制机制,在实际厌氧消化系统中存在着水解产酸菌、产乙酸菌和产甲烷古菌等多种微生物,不同微生物对VFA和pH的耐受能力不同。其中,水解菌和发酵产酸菌对pH耐受范围较宽(4.0−8.5),对VFA的耐受能力也较强;而多数产甲烷古菌适宜的pH较窄且大多在中性范围(6.8−7.2),较易受到VFA的抑制[27]。由以上分析可知,酸抑制的根本作用机制是,当消化系统因有机负荷过高或进水物料失衡而出现较高浓度VFA时,由于不同微生物的耐受能力不同,导致处于消化系统上游的水解产酸过程与下游的产甲烷过程之间的平衡被打破,水解产酸速率远高于产甲烷消耗速率,造成系统中VFA的积累并形成负向反馈,最终导致消化系统崩溃。
2.2 酸抑制的影响因素研究表明,酸抑制作用的强弱受多种因素的影响,如VFA的浓度与种类、系统pH值和温度等,并且不同因素之间相互作用,共同影响着酸抑制作用的强弱。
2.2.1 VFA的浓度与种类酸抑制的程度与VFA的浓度直接相关。Ahring等[28]研究表明,系统中VFA的浓度一旦超过200 mmol/L就有可能发生酸抑制问题,并对产甲烷过程造成严重破坏。Wang等[29]研究发现,随VFA浓度的增加,酸抑制逐渐变得更加严重。
除浓度外,酸抑制还与VFA的种类有关。不同种类的VFA对微生物的抑制作用程度不同。Fortela等[30]在TVFA浓度一定的情况下,通过研究各类VFA的抑制作用与其种类的关系发现,乙酸对微生物的抑制作用较为稳定,而丙酸和丁酸的抑制作用则取决于TVFA的浓度,其抑制作用随TVFA浓度的增加也相应地增强。除丙酸和丁酸外,Hao等[31]研究发现,较高浓度的乙酸(100 mmol/L)对产甲烷菌也有一定的抑制作用。目前在多数研究中,丙酸和丁酸被报道是引发酸抑制产生的直接原因[32-33]。

|
(1) |
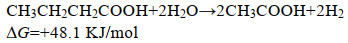
|
(2) |
由丙酸和丁酸的降解方程式可知,其降解过程的吉布斯自由能较高,属于热力学不可自发反应[34-35]。只有当降解产物浓度较低,即氢分压较低时才有可能发生丙酸和丁酸的降解反应[36]。但由于酸抑制发生后产甲烷古菌被抑制,氢气无法快速被利用,而且产氢产乙酸反应持续进行,因而氢分压始终保持在一个较高的水平,导致丙酸和丁酸的分解过程很难发生,2种酸不断积累,最终导致酸抑制的发生。虽然有关各类VFA对于微生物的抑制作用均有报道,但其抑制作用的阈值浓度尚不统一,抑制作用发生的顺序也有所不同,有待于深入研究。
2.2.2 pH值pH通过改变VFA的形态来影响酸抑制作用。Cotter等[21]研究表明,在中性pH下,VFA对细胞的毒性很小,但随着pH值的降低,越来越多的VFA由离子型转变为非离子型,VFA对细胞的毒性急剧增加。Li等[37]研究发现,消化系统在pH值为6.0时受到较强的抑制作用,其原因可能是系统在此条件下存在较多非离子型VFA,当pH值调整到8.0后,抑制作用减弱。
此外,pH可以改变产酸消化过程的代谢途径,进而导致VFA的种类和含量产生很大变化[38]。Jiang等[9]发现,当pH值为5.0时,产酸消化的主要产物是乙酸;但当pH值为6.0或7.0时,主要产物则是丁酸。Wainaina等[39]研究发现,在极端酸性(pH < 3.0)或极端碱性(pH > 12.0)的条件下,产酸菌的活性被抑制。Eryildiz等[40]研究表明,在中性环境(pH=6.0)下,VFA的含量最高,随着pH值的降低,VFA的产生途径被抑制,总含量也随之降低。
除对VFA本身的影响外,pH值还严重影响着微生物的代谢活性。相较于产甲烷古菌,产酸细菌对pH值的耐受范围更宽,对低pH值具有更好的耐受性[41]。这就导致当pH较低时,水解产酸菌仍可正常产生VFA,但产甲烷古菌由于活性受抑制而无法迅速分解VFA,造成VFA的积累,进而导致pH值进一步降低,并最终形成一个恶性循环,诱发酸抑制。
2.2.3 温度VFA的抑制程度也与消化温度有关。与中温消化相比,高温消化具有更高的底物降解率和沼气产率[30]。Cavinato等[42]研究表明,与中温消化相比,高温消化时的沼气产量可以提高约50%。但是,高温消化的稳定性较差,更容易受到VFA的抑制[43]。随着温度的升高,微生物对周围环境的变化及未解离的有机酸的敏感性增加[44]。Kim等[45]通过比较中温消化和高温消化在高负荷时的消化情况发现,在相同负荷下,高温消化更容易形成丙酸积累,并诱发pH值降低和产甲烷过程受抑制。
除微生物自身敏感性变化之外,温度还会影响VFA的产生种类、扩散速度与解离常数。Jiang等[9]研究发现,当温度为35 ℃时,乙酸是主要的VFA;当温度变为45 ℃时,丙酸成为主要的VFA;但当温度变为55 ℃时,丁酸是主要产物。He等[46]通过研究3种不同温度(35、55、70 ℃)对VFA产生过程的影响,发现丁酸在55 ℃时的产量明显高于其在35 ℃和70 ℃时的产量。Ouattara等[47]研究发现,随着温度从4 ℃升高至24 ℃,乙酸的扩散速率从1.19×10−12 m2/s增加到2.59×10−12 m2/s,丙酸的扩散速率从0.91×10−12 m2/s增加到1.87×10−12 m2/s;此外,在0−60 ℃的范围内,乙酸和丙酸的解离常数随温度先升高,并在25℃时达到峰值,之后随温度的升高而降低。
3 酸抑制的解除方法 3.1 添加碱性药剂在众多解除酸抑制的方法中,添加Ca(OH)2、NaOH、KOH等碱性化学药剂以调节系统pH值是目前改善酸抑制最常用的方法[48]。通过添加碱性药剂可以防止pH值下降太快,可以使系统保持稳定且pH接近中性的环境,进而可以提高产甲烷古菌的代谢活性。Yang等[49]研究了通过添加NaOH调节体系的pH对厌氧消化过程的影响,结果表明,通过调节pH可以有效提高有机酸的利用率,提高甲烷产量。Dai等[50]研究发现,通过在污泥与麦草厌氧消化过程中添加NaOH调节pH,可以有效改善产甲烷古菌的活性,提高甲烷产量。Zhang等[51]通过添加NaOH调节系统pH至7.5,提高了系统的缓冲能力,有效地避免了VFA的积累和酸抑制的发生,并在较高负荷下实现了稳定消化。
但通过添加碱性药剂调节pH值的方法存在一定的局限性,仅可以在酸抑制不太严重时发挥作用。当系统酸败严重,pH极低时不宜添加大量碱性物质,因为高浓度的Ca2+、Na+、K+反而抑制微生物的活动。Feng等[52]研究发现,当添加NaOH来调节pH时,产甲烷古菌会受到较高浓度Na+ (3.5 g/L)的抑制。Dai等[53]的研究也有相似的结果,高浓度的Na+ (8.0 g/L)会对产甲烷古菌的中温消化过程产生严重抑制。此外,这种方法使用时需要投加大量的化学药剂,造成运行成本增加,有研究者认为药剂投加成本约占处理总费用的5%[54]。
3.2 添加微量元素产甲烷古菌作为厌氧消化过程中最重要的微生物,其细胞中某些关键酶的合成及产甲烷功能的实现需要依赖Fe、Co、Mo、Ni等微量元素[55]。当这些微量元素含量不足时,就会限制产甲烷古菌的生长及正常生理代谢功能的实现,然而由于有机废水来源不同、成分复杂,常出现某一种或某几种微量元素缺失的问题,从而导致产甲烷古菌活动受到抑制,无法快速分解积累的VFA,正常产气活动受到抑制[56]。Wei等[57]研究了添加Fe、Co、Ni等微量元素对于食物垃圾厌氧消化的影响,结果表明,添加微量元素后酸抑制作用逐渐降低,甲烷产量显著增加。Voelklein等[20]研究了添加微量元素对于单级厌氧消化系统的影响,结果表明,添加Fe、Co、Mo、Ni、Se后厌氧消化的酸抑制问题得到明显缓解。研究表明,添加的Fe、Co、Mo、Ni等微量元素可以促进甲基还原酶、脱氢酶等参与产甲烷反应关键酶的合成,加速甲烷合成反应,缓解酸抑制[58]。
但在实际消化过程中,微量元素存在生物的可利用度和不同元素间相互作用的问题。由于添加的微量金属元素存在固相和液相两种相态,不同相态之间可能发生转变,并且其与消化池中其他元素之间可能存在复杂的相互作用,导致添加的微量元素可能无法完全被微生物所利用[59],造成资源浪费。此外有研究表明,不同微量元素之间可能存在拮抗作用,如果微量元素添加种类搭配不当,可能会对消化系统产生抑制作用[60]。
3.3 生物强化技术总结以上两种方法可以发现,添加碱性药剂与添加微量元素的方法均属于间接地通过改良微生物的生长环境以提高产甲烷菌群代谢活性的方法,作用效果比较缓慢。与之相对应,生物强化技术是指在系统中直接添加某种特定功能微生物来强化或改善某些消化结果[61]。通过向受酸抑制的消化系统中添加强化菌剂可以缩短系统恢复时间,并提高系统对酸抑制的抵抗能力。目前通过生物强化技术解除厌氧消化酸抑制、提高沼气产量已有较多研究,并都取得了不错的效果。Li等[62]通过向超负荷运行的厌氧消化反应器中添加耐酸产甲烷菌群,有效地解除了VFA的积累和酸抑制,提高了消化的稳定性。Venkiteshwaran等[63]向产甲烷反应器中添加产甲烷的丙酸盐降解菌群,结果发现甲烷产量和COD去除率明显增加。
总结相关研究发现,目前针对酸抑制问题的生物强化过程大多采用的是特定富集培养的丙酸降解菌群,其一般具有快速高效降解丙酸、丁酸等较大分子VFA的特点,并且具有较好的耐酸性,可以在较低pH的环境下生存[64-65]。当向反应器中添加这些特殊菌群后,反应器的耐酸能力和对VFA的分解转化能力大幅提高,产甲烷量也随之提高,酸抑制得到缓解。
但同时也发现,目前所用的生物强化菌剂大多是产甲烷菌群、丙酸降解菌群、丁酸降解菌群等,这些特殊微生物的富集筛选过程较为复杂,一般需要几十天甚至上百天的时间才能获得,而且对分离设备和操作人员的要求较高,因而难以在短时间内快速获得大量目标微生物。针对这一问题,Zhao等[14]创新性地提出利用“食酸释碱”的光合细菌来解除酸抑制,结果发现,酸抑制在12 d内得到明显解除,反应器的产气性能和出水指标均恢复正常。相较于其他生物强化微生物,光合细菌富集培养简单,自身生长迅速,可在5−10 d内达到对数增长期[14],可在短时间内获得大量微生物用于酸抑制解除。
3.4 微生物电化学技术近年来,随着微生物电化学技术的发展,有专家和学者提出将电化学系统或导电材料引入消化系统,提高系统的运行稳定性和甲烷产量。
一方面,通过引入电化学系统可以给微生物提供额外的能量,从而克服丙酸、丁酸在降解过程中面临的能量壁垒问题。Hou等[66]将厌氧消化反应器(anaerobic digestion,AD)与藻类微生物燃料电池(algae-assisted microbial fuel cell,AMFC)相结合,构建AD-AMFC系统,结果发现AD-AMFC系统可以加速厌氧消化过程,减轻VFA抑制,提高甲烷产量。Park等[67]将微生物电解池(microbial electrolysis cell,MEC)与厌氧消化反应器相结合,搭建MEC-AD系统,结果发现MEC可以提高甲烷的产率、缩短系统稳定时间。研究表明,与单纯的厌氧消化系统相比,MFC-AD系统和MEC-AD系统可以有效地提高COD的去除率、加快VFA的降解并提高系统稳定性和甲烷的产量[68-70]。
另一方面,通过向消化体系中添加颗粒活性炭、石墨烯、磁铁矿等导电材料,借助种间直接电子传递作用,可以构建电活性微生物与产甲烷微生物之间的联系,进而加速VFA的降解并利用和提高甲烷的产率。Yamada等[71]向嗜热厌氧消化反应器中添加磁铁矿,构建有机酸降解菌和产甲烷古菌之间的电子传递过程,加速了乙酸和丙酸向甲烷的转化速率。Li等[72]研究发现通过添加生物炭,可以缩短产甲烷滞后时间,提高甲烷产率,其原因可能是构建了有机酸氧化细菌和产甲烷古菌之间的电子传递链。有研究表明,在众多的导电材料中,生物炭由于具有较好的可重复利用性和较低的成本,因而往往被当做首选材料考虑使用[8]。此外,生物炭所具有的比表面积较大和一些独特的理化特性,可以缓冲VFA积累带来的pH值下降问题,增加系统的碱度[72-73]。
然而,目前将电化学系统和导电材料引入消化体系增强系统稳定性和产甲烷效率的方法仍处于初期研究阶段,所用材料大多为人工合成废水[8],操作模式较为单一,建议后期通过调控各项参数(如阴/阳极电势、电极材料等)来进一步探究实际废水的处理效果。
4 结论与展望厌氧消化作为一种重要的废水处理与能源生产技术,目前已广泛应用于各类有机废水的处理过程中。但由VFA积累过多引发的酸抑制问题一直是制约该技术长期稳定运行的重要因素。随着相关研究的深入,VFA的形态变化过程及其在细胞层面和微生物群落层面的抑制机制逐渐明晰。在此过程中,VFA的种类和浓度及pH、温度之间的相互关系被确认,4种因素共同影响着酸抑制作用的强弱。通过添加碱性药剂和微量元素可以从侧面改善微生物的生存环境,以提高系统对酸抑制的抵抗和恢复能力,但更为直接的是,通过生物强化和微生物电化学的方法可以有效提高系统对于VFA的消耗速率,从而快速解除酸抑制。
考虑到酸抑制体系的特殊性和复杂性,有必要加强以下几个方面的研究:
(1) 结合组学技术对酸抑制的解除机理进行深入研究。以往的研究大多是对酸抑制解除过程中VFA和微生物的种类及数量变化进行研究,而未深入研究其中的物质相互作用及变化机制。建议结合代谢组学技术及宏基因组技术对酸抑制解除过程中的微生物作用机制及物质变化规律进行深入探究。
(2) 结合数学模型对酸抑制解除过程进行深入研究。由于消化系统处于动态变化过程中,而且不同解除方法的作用机制各不相同。因而在酸抑制发生后,如何选择最佳的恢复方法和恢复剂量,在保证恢复效果的同时降低恢复成本,仍需进一步研究。建议结合数学模型对不同恢复过程中物质的数量变化与恢复剂量之间的关系进行深入研究。
(3) 开展不同方法协同作用解除酸抑制的研究。目前的研究大多采用单一方法恢复受酸抑制的反应器,解除速率和效果有限,考虑到实际运行的需要,应加强不同手段之间协同作用的研究,以加快酸抑制解除速率,提高系统运行稳定性。
| [1] |
Rocamora I, Wagland ST, Villa R, et al. Dry anaerobic digestion of organic waste:a review of operational parameters and their impact on process performance[J]. Bioresource Technology, 2020, 299: 122681. DOI:10.1016/j.biortech.2019.122681 |
| [2] |
Romero-Güiza MS, Vila J, Mata-Alvarez J, et al. The role of additives on anaerobic digestion:a review[J]. Renewable and Sustainable Energy Reviews, 2016, 58: 1486-1499. DOI:10.1016/j.rser.2015.12.094 |
| [3] |
Han Y, Green H, Tao WD. Reversibility of propionic acid inhibition to anaerobic digestion:inhibition kinetics and microbial mechanism[J]. Chemosphere, 2020, 255: 126840. DOI:10.1016/j.chemosphere.2020.126840 |
| [4] |
Yuan HP, Zhu NW. Progress in inhibition mechanisms and process control of intermediates and by-products in sewage sludge anaerobic digestion[J]. Renewable and Sustainable Energy Reviews, 2016, 58: 429-438. DOI:10.1016/j.rser.2015.12.261 |
| [5] |
Liu JB, Zheng JX, Niu YT, et al. Effect of zero-valent iron combined with carbon-based materials on the mitigation of ammonia inhibition during anaerobic digestion[J]. Bioresource Technology, 2020, 311: 123503. DOI:10.1016/j.biortech.2020.123503 |
| [6] |
Zhang WL, Xing WL, Li RD. Real-time recovery strategies for volatile fatty acid-inhibited anaerobic digestion of food waste for methane production[J]. Bioresource Technology, 2018, 265: 82-92. DOI:10.1016/j.biortech.2018.05.098 |
| [7] |
Yuan YY, Hu XY, Chen HB, et al. Advances in enhanced volatile fatty acid production from anaerobic fermentation of waste activated sludge[J]. Science of the Total Environment, 2019, 694: 133741. DOI:10.1016/j.scitotenv.2019.133741 |
| [8] |
Ryue J, Lin L, Kakar FL, et al. A critical review of conventional and emerging methods for improving process stability in thermophilic anaerobic digestion[J]. Energy for Sustainable Development, 2020, 54: 72-84. DOI:10.1016/j.esd.2019.11.001 |
| [9] |
Jiang JG, Zhang YJ, Li KM, et al. Volatile fatty acids production from food waste:effects of pH, temperature, and organic loading rate[J]. Bioresource Technology, 2013, 143: 525-530. DOI:10.1016/j.biortech.2013.06.025 |
| [10] |
Montes JA, Leivas R, Martínez-Prieto D, et al. Biogas production from the liquid waste of distilled gin production:optimization of UASB reactor performance with increasing organic loading rate for co-digestion with swine wastewater[J]. Bioresource Technology, 2019, 274: 43-47. DOI:10.1016/j.biortech.2018.11.060 |
| [11] |
Intanoo P, Rangsanvigit P, Malakul P, et al. Optimization of separate hydrogen and methane production from cassava wastewater using two-stage upflow anaerobic sludge blanket reactor (UASB) system under thermophilic operation[J]. Bioresource Technology, 2014, 173: 256-265. DOI:10.1016/j.biortech.2014.09.039 |
| [12] |
Schmidt T, McCabe BK, Harris PW, et al. Effect of trace element addition and increasing organic loading rates on the anaerobic digestion of cattle slaughterhouse wastewater[J]. Bioresource Technology, 2018, 264: 51-57. DOI:10.1016/j.biortech.2018.05.050 |
| [13] |
Intanoo P, Watcharanurak T, Chavadej S. Evolution of methane and hydrogen from ethanol wastewater with maximization of energy yield by three-stage anaerobic sequencing batch reactor system[J]. International Journal of Hydrogen Energy, 2020, 45(16): 9469-9483. DOI:10.1016/j.ijhydene.2020.02.003 |
| [14] |
Zhao WX, Jeanne Huang J, Hua BB, et al. A new strategy to recover from volatile fatty acid inhibition in anaerobic digestion by photosynthetic bacteria[J]. Bioresource Technology, 2020, 311: 123501. DOI:10.1016/j.biortech.2020.123501 |
| [15] |
Goud RK, Sarkar O, Chiranjeevi P, et al. Bioaugmentation of potent acidogenic isolates:a strategy for enhancing biohydrogen production at elevated organic load[J]. Bioresource Technology, 2014, 165: 223-232. DOI:10.1016/j.biortech.2014.03.049 |
| [16] |
Schauer-Gimenez AE, Zitomer DH, Maki JS, et al. Bioaugmentation for improved recovery of anaerobic digesters after toxicant exposure[J]. Water Research, 2010, 44(12): 3555-3564. DOI:10.1016/j.watres.2010.03.037 |
| [17] |
Mechichi T, Sayadi S. Evaluating process imbalance of anaerobic digestion of olive mill wastewaters[J]. Process Biochemistry, 2005, 40(1): 139-145. |
| [18] |
Kleyböcker A, Liebrich M, Verstraete W, et al. Early warning indicators for process failure due to organic overloading by rapeseed oil in one-stage continuously stirred tank reactor, sewage sludge and waste digesters[J]. Bioresource Technology, 2012, 123: 534-541. DOI:10.1016/j.biortech.2012.07.089 |
| [19] |
Zhang L, Jahng D. Long-term anaerobic digestion of food waste stabilized by trace elements[J]. Waste Management, 2012, 32(8): 1509-1515. DOI:10.1016/j.wasman.2012.03.015 |
| [20] |
Voelklein MA, O'Shea R, Jacob A, et al. Role of trace elements in single and two-stage digestion of food waste at high organic loading rates[J]. Energy, 2017, 121: 185-192. DOI:10.1016/j.energy.2017.01.009 |
| [21] |
Cotter PD, Hill C. Surviving the acid test:responses of gram-positive bacteria to low pH[J]. Microbiology and Molecular Biology Reviews, 2003, 67(3): 429-453. |
| [22] |
Salsali HR, Parker WJ, Sattar SA. Impact of concentration, temperature, and pH on inactivation of Salmonella spp.by volatile fatty acids in anaerobic digestion[J]. Canadian Journal of Microbiology, 2006, 52(4): 279-286. DOI:10.1139/w05-125 |
| [23] |
Puchajda B, Oleszkiewicz J, Sparling R, et al. Low-temperature inactivation of fecal coliforms in sludge digestion[J]. Water Environment Research, 2006, 78(7): 680-685. DOI:10.2175/106143006X101638 |
| [24] |
Puchajda B, Oleszkiewicz J. Extended acid digestion for inactivation of fecal coliforms[J]. Water Environment Research, 2006, 78(12): 2389-2396. DOI:10.2175/106143005X86655 |
| [25] |
Jiang Y, Xie SH, Dennehy C, et al. Inactivation of pathogens in anaerobic digestion systems for converting biowastes to bioenergy:a review[J]. Renewable and Sustainable Energy Reviews, 2020, 120: 109654. DOI:10.1016/j.rser.2019.109654 |
| [26] |
Elbeshbishy E, Dhar BR, Nakhla G, et al. A critical review on inhibition of dark biohydrogen fermentation[J]. Renewable and Sustainable Energy Reviews, 2017, 79: 656-668. DOI:10.1016/j.rser.2017.05.075 |
| [27] |
Xu Y, Lu YQ, Zheng LK, et al. Perspective on enhancing the anaerobic digestion of waste activated sludge[J]. Journal of Hazardous Materials, 2020, 389: 121847. DOI:10.1016/j.jhazmat.2019.121847 |
| [28] |
Ahring BK, Sandberg M, Angelidaki I. Volatile fatty acids as indicators of process imbalance in anaerobic digestors[J]. Applied Microbiology and Biotechnology, 1995, 43(3): 559-565. |
| [29] |
Wang B, Wan W, Wang JL. Inhibitory effect of ethanol, acetic acid, propionic acid and butyric acid on fermentative hydrogen production[J]. International Journal of Hydrogen Energy, 2008, 33(23): 7013-7019. DOI:10.1016/j.ijhydene.2008.09.027 |
| [30] |
Fortela DL, Hernandez R, French WT, et al. Extent of inhibition and utilization of volatile fatty acids as carbon sources for activated sludge microbial consortia dedicated for biodiesel production[J]. Renewable Energy, 2016, 96: 11-19. DOI:10.1016/j.renene.2016.04.068 |
| [31] |
Hao LP, Lv F, He PJ, et al. Predominant contribution of syntrophic acetate oxidation to thermophilic methane formation at high acetate concentrations[J]. Environmental science & Technology, 2011, 45(2): 508-513. |
| [32] |
Han Y, Green H, Tao WD. Reversibility of propionic acid inhibition to anaerobic digestion:inhibition kinetics and microbial mechanism[J]. Chemosphere, 2020, 255: 126840. DOI:10.1016/j.chemosphere.2020.126840 |
| [33] |
Zhang W, Zhang F, Li YX, et al. Inhibitory effects of free propionic and butyric acids on the activities of hydrogenotrophic methanogens in mesophilic mixed culture fermentation[J]. Bioresource Technology, 2019, 272: 458-464. DOI:10.1016/j.biortech.2018.10.076 |
| [34] |
Sivagurunathan P, Sen B, Lin CY. Overcoming propionic acid inhibition of hydrogen fermentation by temperature shift strategy[J]. International Journal of Hydrogen Energy, 2014, 39(33): 19232-19241. DOI:10.1016/j.ijhydene.2014.03.260 |
| [35] |
Chi X, Li JZ, Wang X, et al. Bioaugmentation with Clostridium tyrobutyricum to improve butyric acid production through direct rice straw bioconversion[J]. Bioresource Technology, 2018, 263: 562-568. DOI:10.1016/j.biortech.2018.04.120 |
| [36] |
Qiao W, Takayanagi K, Li Q, et al. Thermodynamically enhancing propionic acid degradation by using sulfate as an external electron acceptor in a thermophilic anaerobic membrane reactor[J]. Water Research, 2016, 106: 320-329. DOI:10.1016/j.watres.2016.10.013 |
| [37] |
Li Y, Zhang XD, Xu HP, et al. Acidogenic properties of carbohydrate-rich wasted potato and microbial community analysis:effect of pH[J]. Journal of Bioscience and Bioengineering, 2019, 128(1): 50-55. DOI:10.1016/j.jbiosc.2018.12.009 |
| [38] |
Zhou MM, Yan BH, Wong JWC, et al. Enhanced volatile fatty acids production from anaerobic fermentation of food waste:a mini-review focusing on acidogenic metabolic pathways[J]. Bioresource Technology, 2018, 248: 68-78. DOI:10.1016/j.biortech.2017.06.121 |
| [39] |
Wainaina S, Lukitawesa, Awasthi MK, et al. Bioengineering of anaerobic digestion for volatile fatty acids, hydrogen or methane production:A critical review[J]. Bioengineered, 2019, 10(1): 437-458. |
| [40] |
Eryildiz B, Lukitawesa, Taherzadeh MJ. Effect of pH, substrate loading, oxygen, and methanogens inhibitors on volatile fatty acid (VFA) production from citrus waste by anaerobic digestion[J]. Bioresource Technology, 2020, 302: 122800. DOI:10.1016/j.biortech.2020.122800 |
| [41] |
Yuan YY, Hu XY, Chen HB, et al. Advances in enhanced volatile fatty acid production from anaerobic fermentation of waste activated sludge[J]. Science of the Total Environment, 2019, 694: 133741. DOI:10.1016/j.scitotenv.2019.133741 |
| [42] |
Cavinato C, Bolzonella D, Pavan P, et al. Mesophilic and thermophilic anaerobic co-digestion of waste activated sludge and source sorted biowaste in pilot-and full-scale reactors[J]. Renewable Energy, 2013, 55: 260-265. DOI:10.1016/j.renene.2012.12.044 |
| [43] |
Kumar A, Samadder SR. Performance evaluation of anaerobic digestion technology for energy recovery from organic fraction of municipal solid waste:a review[J]. Energy, 2020, 197: 117253. DOI:10.1016/j.energy.2020.117253 |
| [44] |
Lin Q, de Vrieze J, Li CN, et al. Temperature regulates deterministic processes and the succession of microbial interactions in anaerobic digestion process[J]. Water Research, 2017, 123: 134-143. DOI:10.1016/j.watres.2017.06.051 |
| [45] |
Kim M, Speece RE. Reactor configuration-Part Ⅱ.Comparative process stability and efficiency of thermophilic anaerobic digestion[J]. Environmental Technology, 2002, 23(6): 643-654. DOI:10.1080/09593332308618380 |
| [46] |
He MN, Sun YB, Zou DX, et al. Influence of temperature on hydrolysis acidification of food waste[J]. Procedia Environmental Sciences, 2012, 16: 85-94. DOI:10.1016/j.proenv.2012.10.012 |
| [47] |
Ouattara B, Simard RE, Piette G, et al. Diffusion of acetic and propionic acids from Chitosan-based antimicrobial packaging films[J]. Journal of Food Science, 2000, 65(5): 768-773. DOI:10.1111/j.1365-2621.2000.tb13584.x |
| [48] |
Onwosi CO, Eke IE, Igbokwe VC, et al. Towards effective management of digester dysfunction during anaerobic treatment processes[J]. Renewable & Sustainable Energy Reviews, 2019, 116: 109424. |
| [49] |
Yang LL, Huang Y, Zhao MX, et al. Enhancing biogas generation performance from food wastes by high-solids thermophilic anaerobic digestion:effect of pH adjustment[J]. International Biodeterioration & Biodegradation, 2015, 105: 153-159. |
| [50] |
Dai XH, Li XS, Zhang D, et al. Simultaneous enhancement of methane production and methane content in biogas from waste activated sludge and perennial ryegrass anaerobic co-digestion:the effects of pH and C/N ratio[J]. Bioresource Technology, 2016, 216: 323-330. DOI:10.1016/j.biortech.2016.05.100 |
| [51] |
Zhang WL, Li LT, Xing WL, et al. Dynamic behaviors of batch anaerobic systems of food waste for methane production under different organic loads, substrate to inoculum ratios and initial pH[J]. Journal of Bioscience and Bioengineering, 2019, 128(6): 733-743. DOI:10.1016/j.jbiosc.2019.05.013 |
| [52] |
Feng K, Wang Q, Li H, et al. Effect of fermentation type regulation using alkaline addition on two-phase anaerobic digestion of food waste at different organic load rates[J]. Renewable Energy, 2020, 154: 385-393. DOI:10.1016/j.renene.2020.03.051 |
| [53] |
Dai XH, Duan NN, Dong B, et al. High-solids anaerobic co-digestion of sewage sludge and food waste in comparison with mono digestions:Stability and performance[J]. Waste Management, 2013, 33(2): 308-316. |
| [54] |
Bergersen O, Bøen AS, Sørheim R. Strategies to reduce short-chain organic acids and synchronously establish high-rate composting in acidic household waste[J]. Bioresource Technology, 2009, 100(2): 521-526. DOI:10.1016/j.biortech.2008.06.044 |
| [55] |
Xu FQ, Li YY, Ge XM, et al. Anaerobic digestion of food waste-challenges and opportunities[J]. Bioresource Technology, 2018, 247: 1047-1058. DOI:10.1016/j.biortech.2017.09.020 |
| [56] |
Thanh PM, Ketheesan B, Yan Z, et al. Trace metal speciation and bioavailability in anaerobic digestion:a review[J]. Biotechnology Advances, 2016, 34(2): 122-136. DOI:10.1016/j.biotechadv.2015.12.006 |
| [57] |
Wei QY, Zhang WQ, Guo JB, et al. Performance and kinetic evaluation of a semi-continuously fed anaerobic digester treating food waste:effect of trace elements on the digester recovery and stability[J]. Chemosphere, 2014, 117: 477-485. DOI:10.1016/j.chemosphere.2014.08.060 |
| [58] |
Choong YY, Norli I, Abdullah AZ, et al. Impacts of trace element supplementation on the performance of anaerobic digestion process:a critical review[J]. Bioresource Technology, 2016, 209: 369-379. DOI:10.1016/j.biortech.2016.03.028 |
| [59] |
Ortner M, Rameder M, Rachbauer L, et al. Bioavailability of essential trace elements and their impact on anaerobic digestion of slaughterhouse waste[J]. Biochemical Engineering Journal, 2015, 99: 107-113. DOI:10.1016/j.bej.2015.03.021 |
| [60] |
Ezebuiro NC, Techamanoon K, Körner I. Synergistic and antagonistic influences of trace elements on volatile fatty acids degradation and methane production during the methanization of a mixture of volatile fatty acids[J]. Journal of Environmental Chemical Engineering, 2018, 6(1): 1455-1467. |
| [61] |
Peng XW, Börner RA, Nges IA, et al. Impact of bioaugmentation on biochemical methane potential for wheat straw with addition of Clostridium cellulolyticum[J]. Bioresource Technology, 2014, 152: 567-571. DOI:10.1016/j.biortech.2013.11.067 |
| [62] |
Li Y, Yang GX, Li LH, et al. Bioaugmentation for overloaded anaerobic digestion recovery with acid-tolerant methanogenic enrichment[J]. Waste Management, 2018, 79: 744-751. DOI:10.1016/j.wasman.2018.08.043 |
| [63] |
Venkiteshwaran K, Milferstedt K, Hamelin J, et al. Anaerobic digester bioaugmentation influences quasi steady state performance and microbial community[J]. Water Research, 2016, 104: 128-136. DOI:10.1016/j.watres.2016.08.012 |
| [64] |
Tale VP, Maki JS, Zitomer DH. Bioaugmentation of overloaded anaerobic digesters restores function and archaeal community[J]. Water Research, 2015, 70: 138-147. DOI:10.1016/j.watres.2014.11.037 |
| [65] |
Li Y, Li LH, Sun YM, et al. Bioaugmentation strategy for enhancing anaerobic digestion of high C/N ratio feedstock with methanogenic enrichment culture[J]. Bioresource Technology, 2018, 261: 188-195. DOI:10.1016/j.biortech.2018.02.069 |
| [66] |
Hou QJ, Yang ZG, Chen SQ, et al. Using an anaerobic digestion tank as the anodic chamber of an algae-assisted microbial fuel cell to improve energy production from food waste[J]. Water Research, 2020, 170: 115305. DOI:10.1016/j.watres.2019.115305 |
| [67] |
Park J, Lee B, Tian DJ, et al. Bioelectrochemical enhancement of methane production from highly concentrated food waste in a combined anaerobic digester and microbial electrolysis cell[J]. Bioresource Technology, 2018, 247: 226-233. DOI:10.1016/j.biortech.2017.09.021 |
| [68] |
Yang G, Wang J, Zhang HW, et al. Applying bio-electric field of microbial fuel cell-upflow anaerobic sludge blanket reactor catalyzed blast furnace dusting ash for promoting anaerobic digestion[J]. Water Research, 2019, 149: 215-224. DOI:10.1016/j.watres.2018.10.091 |
| [69] |
Vu HT, Min B. Integration of submersible microbial fuel cell in anaerobic digestion for enhanced production of methane and current at varying glucose levels[J]. International Journal of Hydrogen Energy, 2019, 44(14): 7574-7582. DOI:10.1016/j.ijhydene.2019.01.091 |
| [70] |
Yin CK, Shen YW, Yuan RX, et al. Sludge-based biochar-assisted thermophilic anaerobic digestion of waste-activated sludge in microbial electrolysis cell for methane production[J]. Bioresource Technology, 2019, 284: 315-324. DOI:10.1016/j.biortech.2019.03.146 |
| [71] |
Yamada C, Kato S, Ueno Y, et al. Conductive iron oxides accelerate thermophilic methanogenesis from acetate and propionate[J]. Journal of Bioscience and Bioengineering, 2015, 119(6): 678-682. DOI:10.1016/j.jbiosc.2014.11.001 |
| [72] |
Li Q, Xu MJ, Wang GJ, et al. Biochar assisted thermophilic co-digestion of food waste and waste activated sludge under high feedstock to seed sludge ratio in batch experiment[J]. Bioresource Technology, 2018, 249: 1009-1016. DOI:10.1016/j.biortech.2017.11.002 |
| [73] |
Wang GJ, Li Q, Gao X, et al. Synergetic promotion of syntrophic methane production from anaerobic digestion of complex organic wastes by biochar:performance and associated mechanisms[J]. Bioresource Technology, 2018, 250: 812-820. DOI:10.1016/j.biortech.2017.12.004 |
 2020, Vol. 47
2020, Vol. 47




