扩展功能
文章信息
- 吕盘龙, 李子言, 赵和平
- Lü Pan-Long, LI Zi-Yan, ZHAO He-Ping
- 膜生物膜法在水污染控制及资源回收中的研究进展
- Advances in water pollution control and resource recovery by membrane-supported biofilm reactor
- 微生物学通报, 2020, 47(10): 3287-3304
- Microbiology China, 2020, 47(10): 3287-3304
- DOI: 10.13344/j.microbiol.china.200479
-
文章历史
- 收稿日期: 2020-05-15
- 接受日期: 2020-06-29
- 网络首发日期: 2020-07-23
随着我国生态文明建设战略的实施和《水污染防治行动计划》(“水十条”)的颁布,城市污水处理系统排放标准日益严格。过去几年里,我国很多城市污水处理系统通过提标改造,大幅度降低了污染物排放浓度。但当前的提标改造措施往往以高能耗、高物耗换取污染物削减,形成了“减排污染物、增排温室气体”的尴尬局面,废水处理过程中物质及能源未得到合理的回收与应用,高能耗、高物耗的废水处理工艺不符合可持续发展理念。曲久辉院士等曾指出,“城市污水中污染物去除与转化的过程与调控”以及“城市污水中化学物质的能量转换过程及调控”是促进我国城市水系统可持续发展而应重点开展的研究方向[1],强调传统污染物及新型污染物削减的同时,关注物质与能量循环利用。
研究表明,基于氢气和甲烷的膜生物膜可有效削减地下水硝酸盐及其他氧化态污染物如高氯酸盐及高价重金属盐[2],还具备城市污水处理尾水深度脱氮的潜力,而基于氧气的膜生物膜可高效同步去碳脱氮除磷[3]。作为一种新型的膜处理技术,膜生物膜法巧妙地利用无泡曝气的方式将氢气、甲烷或氧气供给附着在纤维膜表面上的生物膜,从而驱动氧化态或还原态污染物的降解[4],并产生一些具有回收潜力的中间代谢产物和类金属产物[5-6],有望实现电子高效利用、污染物高效削减和价值产物高效回收的三重目标。本文系统介绍了膜生物膜的传质过程及其去除污染物的微观机制,探讨了膜生物膜法在水处理资源回收方面的研究前景,梳理了膜生物膜反应器在水污染控制方面的实验研究和应用现状,并总结了膜生物膜法面临的挑战及发展趋势,为今后有关水污染控制及资源回收的研究及应用提供参考。
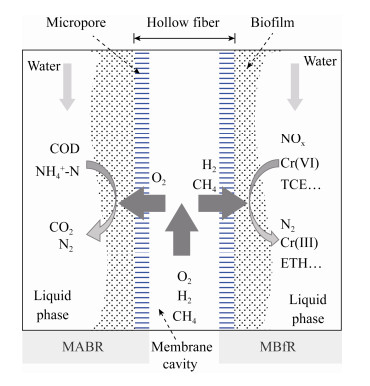
1 膜生物膜的传质过程 1.1 膜生物膜的基本概念利用透气膜进行曝气的研究始于20世纪80年代,早期研究主要聚焦于透气膜的高效供氧特性,将其用于高需氧量废水和含挥发性有机物废水的处理,但在研究中发现,透气膜上不可避免地生长生物膜,利用透气膜上的生物膜可以对水中的污染物进行高效降解[7]。因此,人们将膜微孔曝气与生物膜法结合起来,形成了膜生物膜法(membrane-supported biofilm reactor,MSBR)。膜生物膜法与传统的生物膜法的区别主要在于:传统生物膜的膜材料主要起到附着微生物及固液分离的作用,而膜生物膜法中纤维膜可以向附着在膜表面的生物膜提供气体电子供体或受体[8]。提供电子受体氧气的反应装置通常被称为膜曝气生物反应器(membrane aerated biofilm reactor,MABR)[3],而提供电子供体氢气或甲烷的装置一般被称为膜生物膜反应器(membrane biofilm reactor,MBfR)[9]。
如图 1所示,MABR通过微孔曝气的方式将电子受体氧气直接供给附着在透气膜上的异养微生物,同时液相中的化学需氧量(chemical oxygen demand,COD)、氨氮等污染物从液相向生物膜内侧扩散,生物膜可将这些污染物降解为CO2、N2等气体排出,实现高效低耗降解污染物[10]。然而对于一些氧化态污染物,如硝氮、重金属及氯代有机物,MBfR可以将膜腔中的氢气供给纤维膜表面的自养微生物,这些微生物利用氢气作为电子供体、利用无机碳(如CO2、CO32–等)作为碳源进行底物呼吸作用,将这些氧化态污染物还原为低毒或无毒的低价态产物[11]。除了氢气,近年来甲烷也被证实可作为电子供体来还原硝酸盐/亚硝酸盐、高氯酸盐/氯酸盐、铬酸盐、锑酸盐及硒酸盐等氧化态污染物,这其中涉及甲基氧化菌或甲烷氧化古菌与多种功能微生物的协同作用[12-15]及生物膜内的电子传递过程。
|
| 图 1 膜生物膜去除污染物的原理示意图 Figure 1 Schematic diagram of removing contaminants in MSBR |
|
|
膜生物膜降解污染物的过程本质上就是电子从电子供体通过一系列的电子传递链,直到最终电子受体。在氢基质膜生物膜中,氢自养反硝化菌利用中空纤维膜提供的氢气作为电子供体,经过胞内细胞膜上的NADH脱氢酶、细胞色素c、辅酶Q等递氢体将电子传递到膜依赖型的异化型硝酸还原酶(Nar),Nar利用电子将硝酸盐还原为亚硝酸盐,分泌到细胞外或通过其他还原酶逐步还原为氮气释放;或者在周质型的同化型硝酸还原酶(Nap)催化下,硝酸盐被还原为亚硝酸盐,进一步转变成铵,成为细胞的氮源[16]。在甲烷基质膜生物膜中,微生物降解污染物通常涉及多种功能菌群的种间电子传递过程,电子供体甲烷首先被甲基氧化菌利用单加氧酶氧化为甲醇,再逐步氧化为甲醛参与细胞代谢或进一步氧化为CO2释放,其间产生的一些小分子酸可直接用于硝酸盐的异化还原,或者通过胞外电子传递的方式传递给反硝化菌进行反硝化过程[17]。除了甲基氧化菌,甲烷厌氧氧化古菌(anaerobic methanotrophic archaea,ANME)也可通过甲基辅酶M还原酶将电子供体甲烷通过逆向产甲烷途径氧化为CO2,并产生电子用于硫酸盐、硝酸盐及高氯酸盐等的还原[18]。微生物胞外电子传递机制主要有3种:(1)微生物细胞通过直接接触进行种间电子传递;(2)细胞通过导电附件进行胞外电子传递;(3)微生物通过电子穿梭体进行种间电子传递[19]。电子穿梭体主要分为内源性电子穿梭体(如吩嗪类、黄素类、内源醌类物质等)和外源性电子穿梭体(如AQDS、半胱氨酸、腐殖质等)[20],Lai等[21]在利用甲烷基质膜生物膜还原钒酸盐过程中推测了由胞外聚合物(extracellular polymeric substances,EPS)介导的种间电子传递过程,但具体电子传递机理仍有待进一步研究。
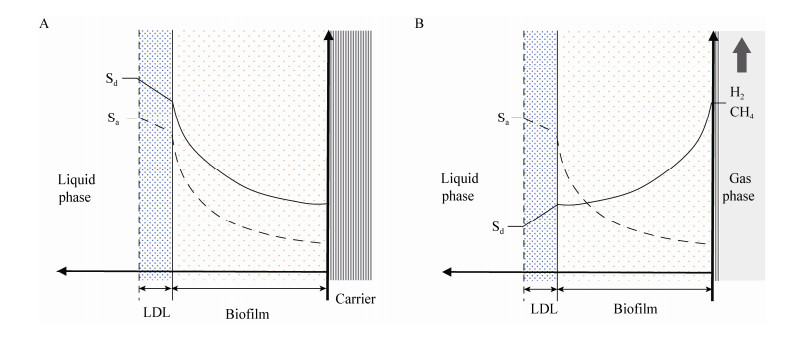
1.3 膜生物膜的反向扩散过程在传统的生物膜中,电子供体和受体都是从液相的同一侧向生物膜内扩散,这种膜也叫同向扩散膜(co-diffusion biofilm)。同向扩散膜中溶解氧由外向内浓度逐渐降低,生物膜由外而内相应生长着好氧微生物、兼性微生物和厌氧微生物。对于膜生物膜,电子供体和受体从生物膜的两侧相对扩散,也称为反向扩散膜(counter-diffusion biofilm)[22]。比如在MABR中,好氧微生物富集在生物膜底层,而靠近液相外侧则生长着一些缺氧菌。即相对于同向扩散膜,好氧层和厌氧层相对位置发生反转。在膜生物膜中,膜里层溶解氧浓度最大,有机物的浓度经过液相外侧生物膜的降解后降低,此区域适宜发生硝化反应;而在靠近液相的膜外侧,溶解氧浓度较低,液相中充足的有机碳源可以满足反硝化的需要,这种特殊的微环境可满足同步硝化反硝化的需求。因此在操作条件适宜的情况下,膜生物膜可实现同步除碳脱氮[3]。
氢/甲烷基质膜生物膜也是反向扩散膜,如图 2所示[3],污染物(电子受体)从液相向生物膜内部扩散,而氢气或甲烷(电子供体)从生物膜内部向液相扩散,代谢最活跃的区域可能在生物膜内的任何地方,这取决于生物膜中供体和受体的浓度[23]。供体和受体的反向扩散会形成独特的微生物群落结构,例如在氢自养反硝化生物膜中,当氢气从生物膜的内部供应,硝氮和氧气从液相外侧供应时,对氧敏感的微生物(如硫酸盐还原菌、脱氯拟球菌、产甲烷菌等)会在靠近纤维膜的生物膜底部增殖,而微好氧微生物在靠近液相的生物膜外侧占据优势,从而形成特殊分层的生物膜群落结构[24]。
要想达到较高的污染物去除通量,就需要足够厚度的生物膜。在传统的同向扩散生物膜中,污染物去除通量随着膜厚度增加而增大,但最终会稳定在一定水平。反向扩散生物膜在膜较薄的情况下表现相似,但过厚的生物膜会降低污染物去除通量,因为当生物膜过厚时,在膜内同一点位电子供体(由内向外扩散)和受体(由外向内扩散)的浓度差别很大,限制了微生物的活性;另一方面,在传统生物膜中,液相扩散层(liquid diffusion layer,LDL)传质阻力减小了进入生物膜的污染物通量,从而限制了生物膜的进一步生长;然而在反向扩散生物膜中,LDL可以有效防止膜内供应的氢气或甲烷过快地扩散到液相中去,因此,只要液相中的污染物并非限速因子,LDL不仅不会限制污染物去除通量,还有可能会增强微生物活性[8]。
1.4 气体在膜生物膜中的传质效率 1.4.1 MBfR中氢气、甲烷的传质效率膜生物独特的反向扩散过程提高了基质在生物膜内的传质,总体而言,气体在膜生物膜中的传质分为两个阶段,首先是气体通过纤维膜过程,在MBfR中,电子供体氢气或甲烷从膜腔透过致密纤维膜的过程满足溶解扩散模型,首先空腔中的气体与纤维膜内表面接触,分子在膜腔侧表面吸附溶解;然后在浓度差的推动下扩散透过膜,到达膜的外表面;最后气体分子在膜的外表面解吸[25]。在计算气体传质效率时,对于某种特定材质的纤维膜,气体通量的计算方式如下所示:
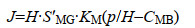
|
(1) |
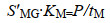
|
(2) |
其中:J为气体通量[M/(L2·T)],S'MG为气体/膜分配系数(T2/L2),KM为膜的传质系数(L/T),p为气相分压[M/(LT2)],H为亨利定律常数(L2/T2),CMB为膜-生物膜界面处的溶解气体浓度(M/L3),P是膜的渗透性(1/T),tM是膜的厚度(L)[8]。
气体通过生物膜的过程涉及微生物的代谢作用,无法通过实验测量精确计算其传质效率,但可以借助生物膜模型来简化描述气体通量,计算方式如下:
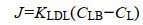
|
(3) |
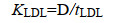
|
(4) |
其中:KLDL为液相扩散层的传质系数(L/T),CLB为生物膜-液面处的溶解气体浓度(M/L3),CL是其在液相中的浓度(M/L3)。D是溶解气体在水中的扩散系数(L2/T),tLDL是LDL的厚度(L)[26]。
1.4.2 MABR中氧的传递速率MABR中氧的传递速率是关乎反应器处理效率的关键因子,氧气透过透气膜时的传递速率计算公式如下:
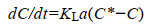
|
(5) |
式中:KL为扩散系数,h–1;a为膜组件的比表面积,m2/m3;C*为气液界面的溶解氧浓度,mg/L;C为液相中溶解氧的实际浓度,mg/L。
研究表明,KL与透气膜表层水力条件有关,增大水流速度或改平流为错流,扩散系数值KL也增大[27]。C*与透气膜的材质及氧分压有关,根据亨利定律,气相中氧气分压越大,C*值也越大;a与膜构型有关,比表面积较大,其氧传递速率也较高。
在活性污泥法或传统生物膜法中,氧气的供给方式主要为无序曝气,这样会造成大量的气体流失,同时也消耗大量能源。对于MABR,氧气可通过无泡曝气的方式直接供给膜丝表面的微生物,气体在穿过生物膜的时候基本上会被微生物消耗殆尽。对于单端通气的MABR,氧气的理论利用效率可达到100%,Brindle等[28]的研究也证实了这一点。近期,Kinh等[29]研究表明,在反向扩散膜中N2O的排放量也要显著低于同向扩散膜,这表明无泡曝气的膜生物膜在水处理节能减排方面有巨大优势。
1.5 影响膜生物膜传质的主要因素 1.5.1 气体传质效率影响膜生物膜传质的首要因素是气体的传质效率,当采用死端中空纤维膜供应气体时,会导致气体在膜腔内的径向分布不均匀,远离供应端的地方气体分压较小,会导致液相中的气体(如N2)逆向扩散进入纤维膜腔,降低气体传质效率,并导致生物膜变薄[30]。采用开放式膜通气可以有效解决这个问题,但同时也会带来基质浪费和安全隐患,Perez-Calleja等尝试定期打开密封端几秒钟,发现可以使膜内氢气分压快速回升到初始水平,保持较高的氢气传质效率[31]。Suárez等[32]利用氢基质MBfR处理冶矿废水中硫酸盐时也采用上述策略提高反应器处理效率,但发现在长期运行过程中效果不佳,可能是由于硫酸盐代谢产物沉淀附着在膜表面,阻碍了气体的传质过程。
1.5.2 生物膜特性影响膜生物膜传质的另一因素是生物膜特性,比如生物膜厚度,生物膜需达到一定厚度才能满足去除污染物的需要,但过厚会降低电子供体和受体的传质效率,例如在氢自养反硝化过程中,当生物膜的厚度比理论最佳厚度薄100 μm与厚100 μm对应的硝酸盐去除通量分别下降53%、6%,因此生物膜的厚度应维持在最佳理论值附近[23]。Martin等[24]采用多维建模评估了氢基质膜生物膜中微生物的竞争关系,产甲烷菌、硫酸盐还原菌等受硝酸盐浓度限制较小的微生物分布在生物膜内侧,而反硝化菌分布在靠近液相的膜外侧。还有研究表明,周期性生物膜脱落有助于控制生长缓慢的产甲烷菌和硫酸盐还原菌,高的粗糙度能够使生物膜的表面积增加,形成特殊的微生境,液流流经这些凸起时产生的对流能够提高传质的效果[33]。
1.5.3 水力条件水力条件主要影响液相扩散层的传质阻力和生物膜的物理特性。在水流剪切力较低区域,液相扩散层相对稳定,传质阻力会减缓液相中污染底物向生物膜内扩散,从而降低污染物去除通量,可以通过提高回流比或增加搅拌速率等手段增加膜表面的剪切力[34],在高剪切力的区域,生物膜附着较少,当发生大面积脱落时,生物膜会快速在脱落区域重新聚集生长,生物膜生长的厚度与该区域的剪切力是互相影响的,并最终会达到稳态,从而形成一定厚度的生物膜[32]。过厚的生物膜会阻碍电子供体及受体在膜内的扩散,da Silva等[35]利用不同回流速率来控制生物膜厚度,研究发现当液相回流速率从0.025 m/s升到0.065 m/s时,COD的去除率从58%提高到83%。生物膜的粘弹性也能对膜传质产生一定影响,当生物膜表现为高粘性或者低弹性的情况下,生物膜不易发生脱落现象,而是发生永久形变,形成飘带,增加其传质效果[36]。
2 膜生物膜去除污染物的微观机制 2.1 氢自养微生物降解污染物 2.1.1 无机阴离子膜生物膜通过高效的无泡曝气方式提供给附着在纤维膜表面的氢自养微生物,微生物可以利用氢气作为电子供体将NO3-/NO2-、ClO4-/ClO3-及BrO3-等无机阴离子逐步降解为无毒的低价态物质[2]。氢自养反硝化菌利用NO3-还原酶Nar、Nap将NO3-还原成NO2-,接着NO2-还原酶Cu-NirK、Cd-NirS将NO2-还原成NO,NO还原酶Nor再将NO还原成N2O,N2O还原酶Nasz将N2O还原成N2[15]。ClO4-的还原过程与反硝化类似,高氯酸盐还原菌可以利用高氯酸盐还原酶Pcr将高氯酸盐逐步还原为ClO2-,随后ClO2-被亚氯酸盐歧化酶Cld歧化为Cl-和O2[37]。
氢基质膜生物膜的群落结构主要取决于液相中污染物的种类及浓度,一般情况下,当进水污染物只有硝氮时,优势菌种主要为红环菌属(Rhodocyclus)、噬氢菌属(Hydrogenophaga)等,而当进水同时含有NO3-、SO42-、ClO4-等诸多无机阴离子时,主要菌属为硫曲菌属(Sulfuricurvum)和噬氢菌属(Hydrogenophaga)[38-39]。氢自养微生物的碳源一般为二氧化碳或碳酸根,而膜生物膜给附着在纤维膜表面的微生物提供氢气的同时也可以供给二氧化碳,Xia等[40]利用双膜同时供氢及二氧化碳进行反硝化取得了良好的脱氮效果,同时起到了调节pH的作用。
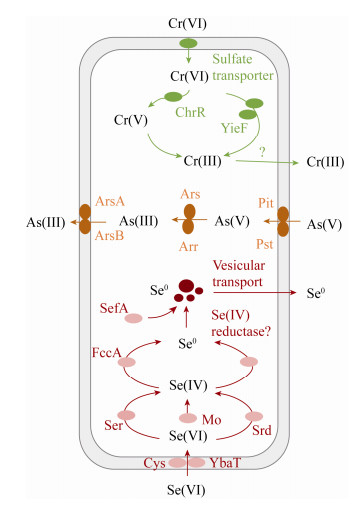
2.1.2 重金属除了无机阴离子,膜生物膜在还原高价态重金属离子方面也有巨大潜力,氢基质膜生物膜还原重金属的机理如图 3所示,微生物利用硫酸盐转运酶可将水体中CrO42-转运至细胞内,然后利用铬酸盐还原酶ChrR将Cr(Ⅵ)还原成Cr(Ⅲ)转运至胞外,Cr(Ⅲ)毒性较低,而且易形成氢氧化物沉淀,经过过滤、沉降等方式可从水中去除[41]。另外,也有报道称微生物可以通过胞外电子传递的方式直接将胞外的Cr(Ⅵ)还原为Cr(Ⅲ)[42],具体胞外还原机理有待研究。Chung等利用氢基质MBfR还原CrO42-,进水1 mg/L Cr(Ⅵ)还原率可达到84%,进水NO3--N浓度升高或H2供应量减小都会使CrO42-还原率降低;另外,溶液pH值为5.5-11.0时Cr(Ⅲ)易形成Cr(OH)3沉淀而较为稳定,但Cr(Ⅲ)沉淀易附着在生物膜表面,影响膜生物膜的传质,因此如何从生物膜中分离出这些重金属沉淀显得尤为重要[43]。
|
| 图 3 氢自养微生物还原重金属的机理 Figure 3 Reduction pathways of heavy metals by hydrogen autotrophic microorganisms |
|
|
SeO42-也可被膜生物膜利用氢气作为电子供体逐步还原,微生物利用DSMO酶将SeO42-还原成SeO32-,进一步还原成硒单质(Se0)[44],再通过胞吐或囊泡转运的方式将单质硒转运至胞外。Xia等利用氢基质MBfR同步去除硒酸盐和硝酸盐,两者的去除率分别为95%和100%;此外,异养细菌还将部分硒酸盐(3%)还原为甲基硒化物,生物膜上的优势菌种为Hydrogenophaga,该菌种既能去除硝酸盐又能去除硒酸盐[45]。Lai等[46]研究MBfR中硝酸盐对硒酸盐影响,结果发现硝酸盐表面负荷超过1.14 g-N/(m2·d)时,硒酸盐的还原受到显著抑制,硒酸盐的还原产物主要为Se0,该抑制过程有可能是两种离子对酶活位点的竞争造成的[47]。
砷(As)的存在形态主要为As(Ⅴ)和As(Ⅲ),虽然As(Ⅲ)的毒性比As(Ⅴ)大,但As(Ⅲ)易形成沉淀,因此一般废水除砷过程需将As(Ⅴ)还原成As(Ⅲ)[48]。膜生物膜去除砷酸盐的机理包括As(Ⅴ)被微生物吸附转化成As(Ⅲ)沉淀,或者与硫化物形成沉淀[49]。当反应器中没有SO42-时,As(Ⅴ)可与Fe2+及Fe(OH)3形成络合物被微生物的EPS捕获;当反应器中存在SO42-时,砷酸盐可与硫酸盐还原产物反应生成硫化物沉淀,该反应受溶液pH值和总硫化物浓度的影响[50]。
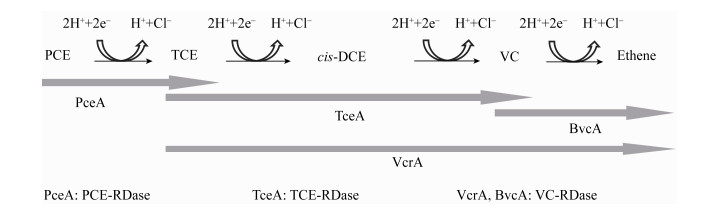
2.1.3 氯代有机物常见的氯代有机物包括氯代烷烃、氯代烯烃及氯代苯酚等,如图 4所示,膜生物可以利用氢气将氯代烯烃逐步脱氯,最终转化成无毒的乙烯(ethene,ETH),目前发现能进行还原脱氯的微生物门包括绿湾菌门(Chloroflexi)、变形菌门(Proteobacteria)和厚壁菌门(Firmicutes),但大多微生物只能将四氯乙烯(perchloroethylene,PCE)、三氯乙烯(trichloroethylene,TCE)等高氯代烃还原到二氯乙烯(dichloroethylene,DCE)或氯乙烯(vinyl chloride,VC)的程度,产乙烯脱氯拟球菌属(Dehalococcoides)是目前唯一被成功分离鉴定的可将TCE完全降解至乙烯为终产物的细菌[51],除了脱氯菌,一些非脱氯菌如地杆菌、产甲烷菌也在微生物高效脱氯过程中起到重要作用,已有诸多研究表明混培体系的微生物脱氯效率高于纯培体系,这其中涉及脱氯菌群种间微环境、种间碳源传递以及种间辅酶因子交换等各种种间协作过程[52-53]。
|
| 图 4 四氯乙烯降解机理 Figure 4 Pathway of anerobic perchloroethylene dechlorination |
|
|
除了氯代烃,膜生物膜还被用于降解含氯硝基苯、抗生素等水体污染物,Li等[54]利用硝酸盐驯化后的氢基质膜生物膜降解对氯硝基苯,研究表明反硝化及硫酸盐还原过程消耗了主要的电子供体氢气,而电子受体对氯硝基苯的加入有效改善了膜生物的群落结构。Aydın等[55]研究发现氯四环素在MBfR中的降解产物主要为差向金霉素、脱水金霉素和差向脱水金霉素,当水力停留时间为2.5 h时,氯四环素的降解速率可超过80%,降解氯四环素的微生物主要为β-变形菌纲微生物。
2.2 甲烷基质膜生物膜降解污染物甲烷是城市废水处理中剩余污泥厌氧消化的产物,同时也是一种重要的温室气体,其全球变暖潜能(global warming potential,GWP)是二氧化碳的20-30倍[56]。合理利用消化过程产生的甲烷是有效控制碳排放的重要手段。通常,甲烷可作为能源物质直接使用,但近年来甲烷氧化耦合氧化态污染物还原的研究表明,甲烷也可以作为碳源和电子供体来还原硝氮[57]、高氯酸盐[58]、硒酸盐[59]、锑酸盐[60]等氧化态污染物,这为废水处理中碳源和能源的循环利用提供了新的途径。如表 1所示,以氢气或甲烷作为电子供体来还原诸多氧化态污染物在热力学上可行,微生物可以通过还原获得自身代谢所需的能量。
| Electron donor | Electron acceptor | Reaction equation | ΔG° (kJ/mol) |
| H2 | NO3- | 2NO3-+5H2+2H+→N2+6H2O | -224.0 |
| ClO4- | ClO4-+4H2→Cl-+4H2O | -118.0 | |
| BrO3- | BrO3-+3H2→Br-+3H2O | -138.0 | |
| CrO42- | 2CrO42-+3H2+4H+→ 2Cr(OH)3+2H2O | -18.0 | |
| SeO42- | SeO42-+3H2+2H+→Se0+4H2O | -71.0 | |
| H2AsO4- | H2AsO4-+H2+H+→H3AsO3+H2O | -45.0 | |
| CH4 | SO42- | SO42-+CH4→HCO3-+HS-+H2O | -16.6 |
| NO3- | 8NO3-+5CH4+8H+→ 5CO2+4N2+14H2O | -765.0 | |
| NO2- | 8NO2-+3CH4+8H+→ 3CO2+4N2+10H2O | -928.0 | |
| ClO4- | ClO4-+CH4→HCO3-+H++Cl-+H2O | -895.9 | |
| CrO42- | 3CH4+8CrO42-+16H+→ 3CO2+4Cr2O3+14H2O | -708.0 | |
| H2AsO4- | CH4+4H2AsO4-→ CO2+4H2AsO3-+2H2O | -154.0 |
根据体系的氧气浓度,甲烷氧化耦合反硝化可以分为好氧甲烷氧化和厌氧甲烷氧化。好氧甲烷氧化耦合反硝化(aerobic oxidation of methane coupled to denitrification,AOM-D)的代谢途径主要有两种。起初人们普遍认为该过程是由混合菌群协同完成:甲烷氧化菌首先氧化甲烷,并释放甲醇、甲醛、甲酸、乙酸等中间代谢产物[17],反硝化菌利用这些有机小分子进一步还原硝氮。然而在2015年,Kits等[61]首次报道了一种甲基单胞菌,能够在氧气受限的环境中,独立完成甲烷氧化反硝化的功能,并在该菌的基因组中检测到了所有必需的功能基因,丰富了好氧甲烷氧化耦合反硝化的代谢机理。
厌氧甲烷氧化(anaerobic methane oxidation,AnMO)过程最早发现于深海沉积物中。在无氧条件下,厌氧甲烷氧化古菌(anaerobic methanotrophic archaea,ANME)可通过“逆向产甲烷”途径活化甲烷,并将产生的电子传递给硫酸盐还原菌来进行硫酸盐的还原[62]。菌群间的电子传递可以通过直接或间接的途径,直接传递主要利用色素蛋白或纳米导线等细胞结构[63],间接传递主要依靠中间代谢产物来实现[64-65]。与硫酸盐不同的是,反硝化型甲烷厌氧氧化(denitrifying anaerobic methane oxidation,DAMO)过程分为逆向产甲烷途径和内微氧途径两种。Haroon等[18]报道了ANME-2d同时具备了甲烷厌氧氧化和硝氮还原的代谢途径,能够通过逆向产甲烷过程活化甲烷并将硝氮还原为亚硝氮。Ettwig等[66]则发现在没有古菌参与的厌氧条件下,一种属于NC10门的细菌Methylomirabilis oxyfera能够将亚硝氮还原并利用某种未知的NO歧化酶进一步将NO歧化为N2和O2,而O2则被单加氧酶利用氧化甲烷,从而独立完成亚硝氮依赖型的甲烷厌氧氧化过程。
2.2.2 甲烷氧化耦合铁、锰还原铁锰依赖型AnMO过程以甲烷为电子供体,Fe3+、Mn4+为电子受体进行反应,产物是Fe2+和Mn2+[14, 67-68]。Beal等将铁和锰添加到ANME富集培养物中,通过宏基因组学及荧光原位杂交技术发现了依赖于Fe3+和Mn4+的AnMO现象;随后,Beal等将只含铁锰依赖型甲烷厌氧氧化古菌的培养物和一系列金属氧化物一起培养,发现加入柠檬酸铁可以促使甲烷发生氧化,宏基因组分析结果表明古菌能够利用金属离子作为电子受体[13],而Scheller等[69]利用13C同位素示踪证实了这一点。
近期,Leu等利用接种富集的甲烷厌氧氧化培养物,对膜生物膜反应器长期运行过程中的微生物群落动态变化和功能微生物的系统发育关系及其甲烷氧化与电子传递途径等进行了深入分析;宏基因组分析表明,主导铁型甲烷厌氧氧化的ANME (Candidatus Methanoperedensferrireducens)在整个微生物群落中占比逐渐减少,取而代之的是两种新的ANME,系统发育及氨基酸序列分析表明这两种古菌与Ca. M. ferrireducens及Candidatus Methanoperedens nitroreducens均有明显区别,是归属于Ca. Methanoperedens属的两个新种,这两种ANME被分别命名为Ca. M. manganicus和Ca. M. manganireducens;这两种菌都具有完整的甲烷厌氧氧化途径,并且相关基因的表达量都很高,同时它们都编码了大量的多血红素细胞色素c (multihemec-type cytochrome,MHC),这被认为是ANME能够进行胞外电子传递的重要证据;此外,研究还发现ANME可能会利用一种类似于鞭毛蛋白的导电结构进行电子传输,实现更长距离的胞外电子传递[70]。
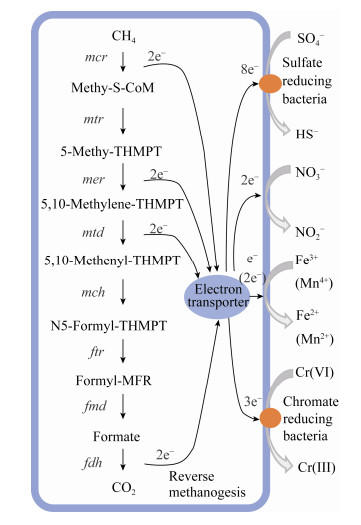
2.2.3 其他含氧阴离子除了硫酸盐、硝酸盐、铁和锰等,其他一些含氧阴离子如铬酸盐[71]、高氯酸盐[72]、硒酸盐[73]、锑酸盐[60]等都被报道可以作为甲烷氧化的电子受体。Lai等报道,在微氧情况下微生物可以利用甲烷作为电子供体将六价铬还原至三价,还原率达到95%,微生物群落分析结果表明应该是Methylosinus (一种Type Ⅱ型甲烷氧化菌)和Meiothermus (潜在铬酸盐还原菌)执行了甲烷氧化耦合铬酸盐还原这一过程:甲基氧化菌通过氧化甲烷产生的中间代谢产物被铬酸盐还原菌利用来还原铬酸盐,并生成Cr(Ⅲ)沉淀[74]。同样,硒酸盐也被报道可以作为甲烷氧化的电子受体,其还原产物主要为单质硒;当硒酸盐负荷为1 mg/L时,其还原率可达到100%[59]。高氯酸盐充当电子受体时,膜生物膜可将50 mg/L的ClO4-还原至检限以下,甲烷基质膜生物还原高氯酸盐的途径可能为:微生物将高氯酸盐逐步还原为亚氯酸盐,而亚氯酸盐歧化酶可以将亚氯酸盐歧化为氧气和氯离子,而氧气又可被微生物利用来活化甲烷[58]。当液相中同时存在硝酸盐和高氯酸盐时,膜生物会优先还原硝酸盐,因为微生物还原硝酸盐所需的能垒较低[75]。图 5总结了甲烷厌氧氧化耦合硫酸盐、硝酸盐、铁(锰)及六价铬的还原途径,但其具体的胞外电子传递过程还有待研究。
|
| 图 5 甲烷厌氧氧化耦合硫酸盐、硝酸盐、铁(锰)及六价铬的还原途径 Figure 5 Pathway of AnMO coupled to sulfate, nitrate, iron, manganese and chromate reduction |
|
|
MABR生物膜中由于传质异向可形成独特的好氧区与缺氧区,在靠近水相的生物膜表层缺氧区,BOD的浓度较高,适宜反硝化细菌生长,而在靠近透气膜表面的生物膜内侧好氧区,BOD浓度较低,硝化细菌生长旺盛[76]。这种生物膜内独特的好氧、缺氧区域微环境,有利于微生物同步硝化反硝化或厌氧氨氧化,比如,硝化细菌(AOB)生长在氨和氧都可用的好氧区,而在缺氧区,ANAMMOX细菌可将亚硝酸盐转化为氮气,这两个过程可以结合在一个足够厚的MABR生物膜中[77]。在反向扩散生物膜内层,硝化细菌利用羟胺氧化还原酶将羟胺转化为亚硝酸盐并释放少量的NO和N2O;其次,亚硝酸盐在膜外侧被亚硝酸盐还原酶和一氧化氮还原酶还原为NO和N2O[78]。生物膜内部也存在微生物种群之间对于生态位的竞争,Aybar等[79]研究发现当接种物中存在原生动物时,这些原生动物会在生物膜底部的好氧区大量繁殖,从而造成连续的空隙,导致生物膜脱落,并可能对缓慢生长的好氧微生物(如硝化细菌)产生有害影响。
由于独特的生物膜结构,MABR具有较高的稳定性和氧传速率,在难降解新型污染物去除方面也有巨大潜力。Taşkan等[80]利用MABR同步去除含铵盐及抗生素(四环素)的饲料废水,当反应器HRT为18 h、气压为0.41 bar时,膜生物膜去除四环素的效率最高(63%),同时铵盐也可同步去除。生物膜同步去除四环素和铵盐的优势菌种主要为Acidovorax caeni、Niastella koreensis、Pseudomonas simiae、Nocardia brasiliensis等[81]。Mei等[82]采用MABR去除含500 mg/L对硝基苯酚的废水,对硝基苯酚、COD及总氮(TN)的去除率分别达到95.86%、89.77%和94.81%,对苯二酚是对硝基苯酚降解的主要途径。
在除碳脱氮的同时,膜生物膜也能强化生物除磷过程。传统的生物除磷理论认为,在厌氧、好氧交替运行条件下,聚磷菌能够超量摄取磷元素并将其在体内转化为聚合磷,形成高磷污泥,在合适阶段将高磷污泥排出体系,从而达到废水除磷的目的[83]。然而进一步研究表明,除了以O2为电子受体的聚磷菌,还存在一类以硝酸盐为电子受体的反硝化聚磷菌。在厌氧、缺氧交替运行的条件下,反硝化聚磷菌以NO3--N作为氧化胞内PHB的电子受体,其利用降解厌氧段储存于体内的PHB产生的能量ATP,大部分供给自身细胞的合成及维持生命活动,一部分则用于过量摄取水中的无机磷酸盐,并以Poly-P的形式储存在细胞体内,同时NO3--N被还原为N2[84]。Peeters等[85]将MABR工艺用于市政污水处理,在运行的500 d期间,可溶性磷去除率超过72%,但如何解决富磷污泥的排放与保持足量生物浓度之间的矛盾目前仍无有效措施。
3 基于膜生物膜的资源回收 3.1 中间代谢产物甲烷基质膜生物膜在降解污染物的过程中,微生物会产生大量的碳源和储能物质,如挥发性脂肪酸(volatile fatty acids,VFA)、聚羟基脂肪酸酯(polyhydroxyalkanoates,PHA)、粗蛋白等,PHA是由很多细菌合成的一种胞内聚酯,在生物体内主要是作为碳源和能源的贮藏性物质而存在,其具有生物可降解性、生物相容性、光学活性、压电性、气体相隔性等许多优秀性能,在可生物降解的包装材料、组织工程材料、缓释材料、电学材料以及医疗材料方面有广阔的应用前景。Lai等[86]研究发现,甲烷氧化过程中会形成大量PHA类化合物,而当电子供体甲烷不足时,PHA会充当电子供体进行氧化态污染物的还原,适当控制反应条件,可以同时兼顾污染物去除与PHA生产,但目前PHA的产率很低,无法进行有效回收,可以通过基因工程等手段来提高微生物形成PHA的效率。Mei等[87]利用膜生物膜降解甲醛废水,甲醛主要通过歧化反应转化为甲酸和甲醇,形成层状生物膜结构,产酸菌可将甲醛降解为有回收价值的甲醇及VFA。除了PHA,粗蛋白、胞外聚合物(EPS)、四氢嘧啶、虾青素等都是膜生物代谢过程中产生的具有回收价值的中间产物[88],探索这些资源的回收方法是未来污水资源化的研究热点之一。
3.2 金属产物 3.2.1 纳米钯钯(Pd)是一种工业常用的贵金属催化剂,从废水中回收Pd可以降低Pd的使用成本,同时减少Pd对环境的影响[46]。Zhou等[89]发现MBfR可将模拟废水中0.21 mg/L Pd(Ⅱ)还原,还原率为99.2%,其还原产物为生物纳米钯(Pd0NPs),生物纳米钯可强化还原硝氮,与仅有Pd和仅有微生物的MBfR相比,Pd0NPs提高了硝氮的降解效率,减少了铵盐的产生[90]。在完成催化还原污染物之后,纳米钯和微生物可以通过离心或热解的方式分离从而实现钯单质(Pd0)的回收[91]。除了Pd,最近Shi等报道了TeO32-也会被膜生物膜还原为纳米Te0,其还原过程与Pd相似[92]。
3.2.2 纳米硒纳米硒(Se)有优良的光学性能和细胞保护作用,在工业生产和临床医学等不同领域都有重要的应用。Lai等[59]利用甲烷基质膜生物膜还原SeO42-,研究发现生物膜可将1 mg/L SeO42-完全还原,扫描电子显微镜和能量色散X射线分析(SEM-EDS)证实产物为单质硒。SeO42-在微生物胞内可被Ser、Srd、Sef等多种还原酶还原至Se0,然后通过胞吐或囊泡作用排出胞外;微生物形成的单质纳米硒具有粒径均匀、成本低廉等优点,极具回收价值,但如何将单质硒从生物膜中分离出来还有待研究[93]。
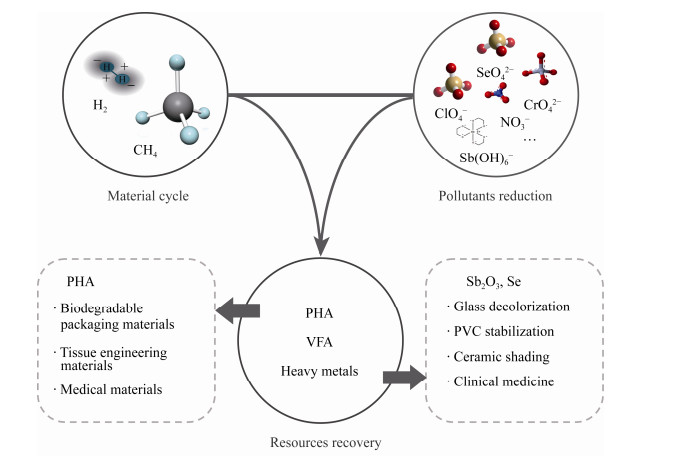
3.2.3 Sb2O3微晶我国是锑(Sb)储存和生产大国,Sb储量占世界储量的一半以上,开采和冶炼产生的废渣、废水排入环境中,会使环境中Sb浓度超标,影响人类健康[94]。同时,Sb2O3微晶也是一种极具经济价值的材料,常应用于玻璃脱色、聚氯乙烯稳定、陶瓷遮光等,纳米尺度的Sb2O3工业制造过程复杂,成本高昂[95]。有报道称,膜生物膜在还原锑酸盐的过程中会形成稳定的Sb2O3微晶[96]。微生物法制备Sb2O3微晶可以实现污染物去除与资源回收的双重目标。图 6总结了基于氢气/甲烷基质MBfR的资源回收。
|
| 图 6 基于氢气/甲烷基质MBfR的资源回收 Figure 6 Resource recovery based on H2/CH4-MBfR |
|
|
MABR的膜材料主要分为致密的无孔硅橡胶膜和疏水性微孔膜两大类。无孔硅橡胶膜采用氧氮分离系数较高的硅橡胶(polydimethylsiloxane,PDMS)制成,由于其结构致密、泡点压力高,可在较高的氧气压力下进行无泡曝气;疏水性微孔膜对氧的选择性较差,泡点压力低,但膜通量大且价格便宜,容易加工成中空纤维以增大膜组件的比表面积。疏水性微孔膜也可以进行表面修饰或亲水化处理,有效改善泡点压力低的缺点,并保留膜通量大的优点,适用于纯氧曝气[26]。常见的疏水性微孔膜有聚偏氟乙烯(polyvinylidene fluoride,PVDF)和聚丙烯(polypropylene,PP)等,Wu等比较了PVDF和PP两种不同疏水性透气膜的除碳脱氮性能,研究表明PVDF膜表面比较粗糙,亲水性较好,对微生物的亲和力也高,对COD和TN的去除率更高;但是PP膜具有严重的膜孔堵塞和较低的氧传递速率,因此PVDF膜作为MABR曝气膜材料更具优势[97]。然而MBfR一般使用纯氢气或甲烷曝气,膜材料主要为PP中空纤维膜(外径200 μm,内径50 μm)和复合中空纤维膜(外径280 μm,内径180 μm),复合中空纤维膜的H2扩散系数是PP中空纤维膜的24倍,但其制作价格昂贵[98]。
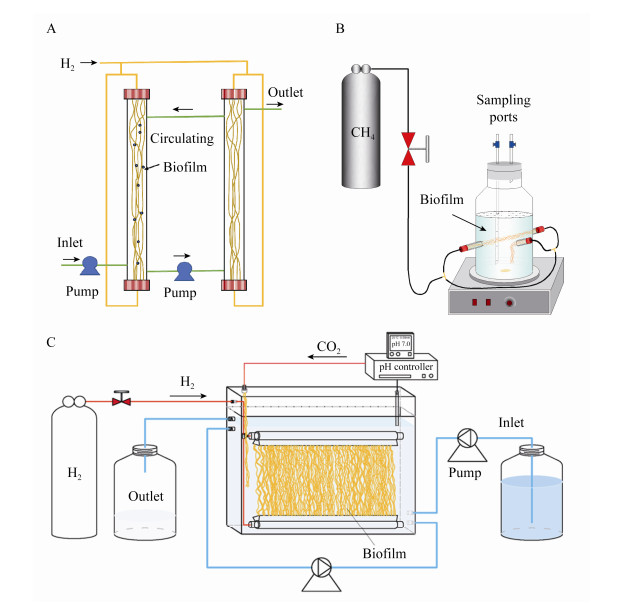
4.1.2 膜构型传统的MBfR装置如图 7A所示,小型连续流MBfR由2根玻璃管组成,分别为主管和副管,中间用硅胶管连接,进出水及水循环通过蠕动泵实现,循环泵一般维持较高的回流速率以保证反应器内液体混合均匀,并在中空纤维膜外表面形成剪切力使微生物在膜丝上均匀生长[99]。主、副两管中各有一束中空纤维膜,用于附着微生物,副管的膜丝主要用于取微生物样品,这样可以在保证取出生物样的同时不会对反应器运行造成较大干扰[100]。连续流MBfR能保持较高的污染物去除通量,但进水中携带的氧气会对一些厌氧功能微生物产生不利影响,尤其是厌氧甲烷氧化菌。因此,Lv等[72]设计了序批式膜生物膜反应器(membrane batch biofilm reactor,MBBR) (图 7B),其具有更大的体积和更优良的气密性,常用于厌氧微生物的富集培养。另外,氢基质MBfR处理污染物过程中需要额外提供无机碳源,Xia等[40]研发了一种双膜MBfR,可以同时提供氢气和二氧化碳,在提供碳源的同时也能有效调节pH。为了便于实际工程应用,在传统MBfR基础上,研究人员开发了一系列模块化的膜组件,比如帘式膜组件(图 7C)和APTwater公司研发的ARoNiteTM商业膜组件,部分已有中试或商业试验案例[101]。
|
| 图 7 膜生物膜反应器构型 Figure 7 Configurations of membrane biofilm reactor 注:A:传统双管式连续流反应器;B:序批式富集反应器;C:帘式膜生物膜反应器. Note: A: Continuous MBfR; B: Batch MBBR for enrichment; C: Curtain type MBfR. |
|
|
膜污染是膜生物膜法应用过程中的主要挑战之一,尤其对于MABR,附着在膜表面的微生物或EPS等其他物质会造成初始孔隙堵塞,然后形成污染层,严重的膜污染会阻碍氧传递过程,降低反应器效能;如何形成具有最佳生物膜厚度和其他特性(密度、孔隙率、稳定性、需氧、缺氧和厌氧区)的稳定生物膜是膜污染控制的关键,也是MABR落地的必要技术条件[35]。微生物初期在透气膜表面的粘附主要与膜特性有关,比如疏水性、表面电荷和表面粗糙度等,因此可以通过选择合适特性的膜材料来防止膜污染;然而一旦形成稳定的生物膜,生物膜特性主要受微生物生长速率及营养条件等调控,膜表面的生物膜为COD/BOD和营养盐的去除提供了必要的生物量,但过厚的生物膜会导致额外的传质阻力[102]。膜污染的生物控制法主要集中在抑制细菌生物膜的形成,基于群体感应原理,利用细菌产生的自诱导信号分子来调控种群密度和生物膜形成;另一方面,控制生物膜厚度也是防止膜污染的关键环节,比较实用的MABR生物膜厚度控制方法是采用间歇空气冲刷的方法,优化空气冲刷频率(间歇)和强度,可实现生物膜厚度的精确控制[101]。近期,也有研究发现,原生动物的捕食作用也对控制MABR生物结垢有正面作用,原生动物可以在氧浓度较高的生物膜底层通过捕食作用生长繁殖,形成空隙,使生物膜脱落,比如,Klein等使用两种不同类型的后生动物(Aelosoma hemprichi和Plectus aquatilis)去除生物膜附着层,结果表明,与不添加捕食者的对照组相比,使用后生动物的膜通量分别增加了50%和119%-164%[103]。此外,Derlon等[104]也发现微生物捕食作用可以显著改善膜通量,目前这一发现已被用于控制MABR生物膜的形成和结构[79]。
4.3 中试及应用实例 4.3.1 MBfR目前,MBfR在国外已有中试规模的应用,主要是利用MBfR膜组件对地下水中硝氮、高氯酸盐、六价铬等氧化态污染物的去除;MBfR中试装置一般由多个膜组件组成,具备模块化特点,可根据处理量及污染物浓度增减膜组件,方便高效且耐冲击负荷[101]。Tang等[105]利用总膜丝面积为36.4 m2的MBfR中试装置可将进水中12 mg-N/L的硝氮还原到低于1 mg-N/L,最大表面负荷可达5.9 g-N/(m2·d)。Rittmann等[106]利用MBfR处理含高氯酸盐、硝酸盐复合污染的地下水,进水流量设为2 L/min,出水高氯酸盐浓度低于4 μg/L,硝氮浓度为0.2 mg-N/L。除了地下水污染处理,MBfR还可用于污水的三级脱氮或预脱氮。Rittmann等[106]以纽约市多级预脱氮工厂的一级出水作为MBfR进水,在不提前接种微生物的情况下,MBfR可将进水中10-20 mg-N/L硝酸盐还原至低于1 mg-N/L。另外,APTwater公司针对加利福尼亚州地下水污染研发的ARoNiteTM商业膜组件系统,可高效去除地下水中高氯酸盐、硝酸盐及微量铬酸盐,出水达到美国环保署规定的饮用水标准,展现出MBfR巨大的应用前景[107-109]。
4.3.2 MABR虽然MABR的工程化应用仍存在诸多挑战,但已有不少中试和商业规模的MABR应用案例[76]。表 2总结了膜生物膜法部分典型中试及商业应用案例。由于MABR工艺具有氧传质效率高、生物膜功能分层及耐冲击负荷等优点,特别适用于处理高COD、TN及综合复杂废水。比如苏伊士科技与解决方案公司研发的ZeeLung®系统,该系统使用紧凑型中空纤维膜组件,比表面积为810 m2/m3,处理能力可达到3.6 g-COD/(m2·d),并使用低压空气(41 kPa)替代高压纯氧[112]。Terada等[113]采用单端供气MABR处理含高浓度氨氮养殖废水,试验结果表明,在进水总有机碳(TOC)和总氮(TN)表面负荷为5.76、4.48 g/(m2·d)时,两者的平均去除率分别达到96%和83%。除了高负荷生活污水及养殖废水,MABR在处理垃圾渗滤液方面也有优良表现,Syron等[114]利用体积为60 L的MABR处理含有极高浓度COD (1 000-3 000 mg/L)和铵盐(500-2 500 mg/L)的垃圾渗滤液,当HRT为5 d时,其硝化效率可达到80%-99%,曝气效率也超过了10 kg-O2/(kW·h)。除了同步除碳脱氮,MABR在除磷方面也有潜在优势,研究表明,MABR中缺氧/厌氧区的存在增强了生物膜除磷效果[115]。
| Type of reactor | Type of wastewater | System type | Outcome | Reference |
| MBfR | Groundwater NO3-/Cr(Ⅵ) | Commercial module | Tested low μg/L Cr(Ⅵ) removal | APTwater |
| Groundwater ClO4- | Pilot test | Successfully treat 14 mg/L to 4 μg/L | APTwater | |
| Tertiary effluent NO3- | Commercial module | Tested multitude of large modules in one system | APTwater | |
| MABR | Municipal sewage | Pilot test | 91% TSS, 83% COD, 95% N-NH4+, 66% total organic nitrogen (TON) | [110] |
| Municipal sewage | Pilot test | 96% N-NH4+ | [111] | |
| Municipal sewage | Pilot test | 77.5% SCOD, 97.5% N-NH4+, 80.9% TON, 72.1% P | [85] |
膜生物膜法是一种新型、高效的水处理工艺,具有处理成本低、不产生二次污染、处理效果稳定等多种优点,膜生物膜法处理污染物过程中还会产生一些具备回收潜力的中间代谢产物及纳米金属单质,为水污染控制与资源回收的研究提供了新方法。目前国内外对于膜生物膜法的研究和应用还处于实验室小试和中试规模阶段,尚有许多科学问题及技术挑战亟需解决。一方面,膜生物膜去除氧化态污染物过程中的电子传递机制尚不明确,废水再生及循环的物质转化与能源转换机制缺乏研究,高价值产物的回收方法还有待探索;另一方面,膜生物膜反应器落地过程还存在诸多制约因素,如膜组件的检修过程复杂、膜污染的控制难度大、膜组件处理能力较小等,未来的研究重点将集中在膜污染的控制、反应器的优化改进及工程推广等。
| [1] |
Qu JH, Zhao JC, Ren NQ, et al. Critical fundamental scientific problems in reclamation and reuse of municipal wastewater[J]. China Basic Science, 2017, 19(1): 6-12. (in Chinese) 曲久辉, 赵进才, 任南琪, 等. 城市污水再生与循环利用的关键基础科学问题[J]. 中国基础科学, 2017, 19(1): 6-12. |
| [2] |
Zhang X, Huang LJH, Huang WF, et al. A new process for removing oxidized pollutants from water: Hydrogen-based membrane biofilm reactor[J]. Environmental Chemistry, 2020, 39(5): 1307-1320. (in Chinese) 张鑫, 黄李金鸿, 黄万抚, 等. 去除水中氧化性污染物的新工艺-氢基质膜生物膜反应器(MBfR)[J]. 环境化学, 2020, 39(5): 1307-1320. |
| [3] |
Syron E, Casey E. Membrane-aerated biofilms for high rate biotreatment: performance appraisal, engineering principles, scale-up, and development requirements[J]. Environmental Science & Technology, 2008, 42(6): 1833-1844. |
| [4] |
Nerenberg R. The membrane-biofilm reactor (MBfR) as a counter-diffusional biofilm process[J]. Current Opinion in Biotechnology, 2016, 38: 131-136. DOI:10.1016/j.copbio.2016.01.015 |
| [5] |
Cantera S, Lebrero R, Rodriguez E, et al. Continuous abatement of methane coupled with ectoine production by Methylomicrobium alcaliphilum 20Z in stirred tank reactors: A step further towards greenhouse gas biorefineries[J]. Journal of Cleaner Production, 2017, 152: 134-141. DOI:10.1016/j.jclepro.2017.03.123 |
| [6] |
Shi LD, Wang M, Han YL, et al. Multi-omics reveal various potential antimonate reductases from phylogenetically diverse microorganisms[J]. Applied Microbiology and Biotechnology, 2019, 103(21): 9119-9129. |
| [7] |
Côté P, Bersillon JL, Huyard A. Bubble-free aeration using membranes: mass transfer analysis[J]. Journal of Membrane Science, 1989, 47(1/2): 91-106. |
| [8] |
Meng FG, Chae SR, Drews A, et al. Recent advances in membrane bioreactors (MBRs): membrane fouling and membrane material[J]. Water Research, 2009, 43(6): 1489-1512. DOI:10.1016/j.watres.2008.12.044 |
| [9] |
Martin KJ, Nerenberg R. The membrane biofilm reactor (MBfR) for water and wastewater treatment: principles, applications, and recent developments[J]. Bioresource Technology, 2012, 122: 83-94. DOI:10.1016/j.biortech.2012.02.110 |
| [10] |
Li XJ, Sun S, Badgley BD, et al. Nitrogen removal by granular nitritation-anammox in an upflow membrane- aerated biofilm reactor[J]. Water Research, 2016, 94: 23-31. DOI:10.1016/j.watres.2016.02.031 |
| [11] |
Rittmann BE. The membrane biofilm reactor is a versatile platform for water and wastewater treatment[J]. Environmental Engineering Research, 2007, 12(4): 157-175. |
| [12] |
Haroon MF, Hu SH, Shi Y, et al. Anaerobic oxidation of methane coupled to nitrate reduction in a novel archaeal lineage[J]. Nature, 2013, 500(7464): 567-570. DOI:10.1038/nature12375 |
| [13] |
Beal EJ, House CH, Orphan VJ. Manganese- and iron-dependent marine methane oxidation[J]. Science, 2009, 325(5937): 184-187. DOI:10.1126/science.1169984 |
| [14] |
Fu L, Li SW, Ding ZW, et al. Iron reduction in the DAMO/Shewanella oneidensis MR-1 coculture system and the fate of Fe(Ⅱ)[J]. Water Research, 2016, 88: 808-815. DOI:10.1016/j.watres.2015.11.011 |
| [15] |
Dong QY, Wang Z, Shi LD, et al. Anaerobic methane oxidation coupled to chromate reduction in a methane-based membrane biofilm batch reactor[J]. Environmental Science and Pollution Research, 2019, 26(25): 26286-26292. DOI:10.1007/s11356-019-05709-7 |
| [16] |
Galloway JN, Dentener FJ, Capone DG, et al. Nitrogen cycles: past, present, and future[J]. Biogeochemistry, 2004, 70(2): 153-226. DOI:10.1007/s10533-004-0370-0 |
| [17] |
Costa C, Dijkema C, Friedrich M, et al. Denitrification with methane as electron donor in oxygen-limited bioreactors[J]. Applied Microbiology and Biotechnology, 2000, 53(6): 754-762. DOI:10.1007/s002530000337 |
| [18] |
Haroon MF, Hu SH, Shi Y, et al. Erratum: anaerobic oxidation of methane coupled to nitrate reduction in a novel archaeal lineage[J]. Nature, 2013, 501(7468): 578. |
| [19] |
Logan BE. Exoelectrogenic bacteria that power microbial fuel cells[J]. Nature Reviews Microbiology, 2009, 7(5): 375-381. DOI:10.1038/nrmicro2113 |
| [20] |
Shi L, Dong HL, Reguera G, et al. Extracellular electron transfer mechanisms between microorganisms and minerals[J]. Nature Reviews Microbiology, 2016, 14(10): 651-662. DOI:10.1038/nrmicro.2016.93 |
| [21] |
Lai CY, Dong QY, Chen JX, et al. Role of extracellular polymeric substances in a methane based membrane biofilm reactor reducing vanadate[J]. Environmental Science & Technology, 2018, 52(18): 10680-10688. |
| [22] |
Wang RC, Terada A, Lackner S, et al. Nitritation performance and biofilm development of co- and counter- diffusion biofilm reactors: modeling and experimental comparison[J]. Water Research, 2009, 43(10): 2699-2709. DOI:10.1016/j.watres.2009.03.017 |
| [23] |
Martin KJ, Picioreanu C, Nerenberg R. Multidimensional modeling of biofilm development and fluid dynamics in a hydrogen-based, membrane biofilm reactor (MBfR)[J]. Water Research, 2013, 47(13): 4739-4751. DOI:10.1016/j.watres.2013.04.031 |
| [24] |
Martin KJ, Picioreanu C, Nerenberg R. Assessing microbial competition in a hydrogen-based membrane biofilm reactor (MBfR) using multidimensional modeling[J]. Biotechnology and Bioengineering, 2015, 112(9): 1843-1853. DOI:10.1002/bit.25607 |
| [25] |
Miller-Chou BA, Koenig JL. A review of polymer dissolution[J]. Progress in Polymer Science, 2003, 28(8): 1223-1270. DOI:10.1016/S0079-6700(03)00045-5 |
| [26] |
Hou DX, Jassby D, Nerenberg R, et al. Hydrophobic gas transfer membranes for wastewater treatment and resource recovery[J]. Environmental Science & Technology, 2019, 53(20): 11618-11635. |
| [27] |
Cote PL, Bersillon JL, Huyard A. Bubble-free aeration using membranes: process analysis[J]. Journal Water Pollution Control Federation, 1988, 60(11): 1986-1992. |
| [28] |
Brindle K, Stephenson T. Nitrification in a bubbleless oxygen mass transfer membrane bioreactor[J]. Water Science and Technology, 1996, 34(9): 261-267. DOI:10.2166/wst.1996.0227 |
| [29] |
Kinh CT, Suenaga T, Hori T, et al. Counter-diffusion biofilms have lower N2O emissions than co-diffusion biofilms during simultaneous nitrification and denitrification: insights from depth-profile analysis[J]. Water Research, 2017, 124: 363-371. DOI:10.1016/j.watres.2017.07.058 |
| [30] |
Ahmed T, Semmens MJ, Voss MA. Oxygen transfer characteristics of hollow-fiber, composite membranes[J]. Advances in Environmental Research, 2004, 8(3/4): 637-646. |
| [31] |
Perez-Calleja P, Aybar M, Picioreanu C, et al. Periodic venting of MABR lumen allows high removal rates and high gas-transfer efficiencies[J]. Water Research, 2017, 121: 349-360. DOI:10.1016/j.watres.2017.05.042 |
| [32] |
Suárez JI, Aybar M, Nancucheo I, et al. Influence of operating conditions on sulfate reduction from real mining process water by membrane biofilm reactors[J]. Chemosphere, 2020, 244: 125508. DOI:10.1016/j.chemosphere.2019.125508 |
| [33] |
Pavissich JP, Aybar M, Martin KJ, et al. A methodology to assess the effects of biofilm roughness on substrate fluxes using image analysis, substrate profiling, and mathematical modelling[J]. Water Science & Technology, 2014, 69(9): 1932-1941. |
| [34] |
Radu AI, Vrouwenvelder JS, van Loosdrecht MCM, et al. Effect of flow velocity, substrate concentration and hydraulic cleaning on biofouling of reverse osmosis feed channels[J]. Chemical Engineering Journal, 2012, 188: 30-39. DOI:10.1016/j.cej.2012.01.133 |
| [35] |
da Silva TS, Matsumoto T, dos Anjos ML, et al. Organic matter removal in a membrane-aerated biofilm reactor[J]. Journal of Environmental Engineering, 2018, 144(8): 04018057. DOI:10.1061/(ASCE)EE.1943-7870.0001393 |
| [36] |
Tierra G, Pavissich JP, Nerenberg R, et al. Multicomponent model of deformation and detachment of a biofilm under fluid flow[J]. Journal of the Royal Society Interface, 2015, 12(106): 20150045. DOI:10.1098/rsif.2015.0045 |
| [37] |
Zhao HP, van Ginkel S, Tang YN, et al. Interactions between perchlorate and nitrate reductions in the biofilm of a hydrogen-based membrane biofilm reactor[J]. Environmental Science & Technology, 2011, 45(23): 10155-10162. |
| [38] |
Zhao HP, Ontiveros-Valencia A, Tang YN, et al. Removal of multiple electron acceptors by pilot-scale, two-stage membrane biofilm reactors[J]. Water Research, 2014, 54: 115-122. DOI:10.1016/j.watres.2014.01.047 |
| [39] |
Ontiveros-Valencia A, Ziv-El M, Zhao HP, et al. Interactions between nitrate-reducing and sulfate-reducing bacteria coexisting in a hydrogen-fed biofilm[J]. Environmental Science & Technology, 2012, 46(20): 11289-11298. |
| [40] |
Xia SQ, Xu XY, Zhou C, et al. Direct delivery of CO2 into a hydrogen-based membrane biofilm reactor and model development[J]. Chemical Engineering Journal, 2016, 290: 154-160. DOI:10.1016/j.cej.2016.01.021 |
| [41] |
Xu WH, Jian H, Liu YG, et al. Bioreduction of chromate by an isolated Bacillus anthracis Cr-4 with soluble Cr(Ⅲ) product[J]. Water, Air, & Soil Pollution, 2015, 226(3): 82. |
| [42] |
Viti C, Marchi E, Decorosi F, et al. Molecular mechanisms of Cr(Ⅵ) resistance in bacteria and fungi[J]. FEMS Microbiology Reviews, 2014, 38(4): 633-659. DOI:10.1111/1574-6976.12051 |
| [43] |
Chung J, Nerenberg R, Rittmann BE. Bio-reduction of soluble chromate using a hydrogen-based membrane biofilm reactor[J]. Water Research, 2006, 40(8): 1634-1642. DOI:10.1016/j.watres.2006.01.049 |
| [44] |
Nancharaiah YV, Lens PN. Ecology and biotechnology of selenium-respiring bacteria[J]. Microbiology and Molecular Biology Reviews, 2015, 79(1): 61-80. |
| [45] |
Xia SQ, Xu XY, Zhou LJ. Insights into selenate removal mechanism of hydrogen-based membrane biofilm reactor for nitrate-polluted groundwater treatment based on anaerobic biofilm analysis[J]. Ecotoxicology and Environmental Safety, 2019, 178: 123-129. DOI:10.1016/j.ecoenv.2019.04.005 |
| [46] |
Lai CY, Yang XE, Tang YN, et al. Nitrate shaped the selenate-reducing microbial community in a hydrogen-based biofilm reactor[J]. Environmental Science & Technology, 2014, 48(6): 3395-3402. |
| [47] |
Shi LD, Lv PL, Niu ZF, et al. Why does sulfate inhibit selenate reduction: molybdenum deprivation from Mo-dependent selenate reductase[J]. Water Research, 2020, 178: 115832. DOI:10.1016/j.watres.2020.115832 |
| [48] |
Gushgari-Doyle S, Alvarez-Cohen L. Effects of arsenic on trichloroethene-dechlorination activities of Dehalococcoides mccartyi 195[J]. Environmental Science & Technology, 2020, 54(2): 1276-1285. |
| [49] |
Drewniak L, Stasiuk R, Uhrynowski W, et al. Shewanella sp. O23S as a driving agent of a system utilizing dissimilatory arsenate-reducing bacteria responsible for self-cleaning of water contaminated with arsenic[J]. International Journal of Molecular Sciences, 2015, 16(7): 14409-14427. |
| [50] |
Chung J, Li XH, Rittmann BE. Bio-reduction of arsenate using a hydrogen-based membrane biofilm reactor[J]. Chemosphere, 2006, 65(1): 24-34. DOI:10.1016/j.chemosphere.2006.03.018 |
| [51] |
Karataş S, Hasar H, Taşkan E, et al. Bio-reduction of tetrachloroethen using a H2-based membrane biofilm reactor and community fingerprinting[J]. Water Research, 2014, 58: 21-28. DOI:10.1016/j.watres.2014.03.053 |
| [52] |
Liu N, Li HJ, Li MY, et al. Oxygen exposure effects on the dechlorinating activities of a trichloroethene-dechlorination microbial consortium[J]. Bioresource Technology, 2017, 240: 98-105. DOI:10.1016/j.biortech.2017.02.112 |
| [53] |
Wen LL, Li YR, Zhu LZ, et al. Influence of non-dechlorinating microbes on trichloroethene reduction based on vitamin B12 synthesis in anaerobic cultures[J]. Environmental Pollution, 2020, 259: 113947. DOI:10.1016/j.envpol.2020.113947 |
| [54] |
Li HX, Zhou LJ, Lin H, et al. Dynamic response of biofilm microbial ecology to para-chloronitrobenzene biodegradation in a hydrogen-based, denitrifying and sulfate-reducing membrane biofilm reactor[J]. Science of the Total Environment, 2018, 643: 842-849. DOI:10.1016/j.scitotenv.2018.06.245 |
| [55] |
Aydın E, Şahin M, Taşkan E, et al. Chlortetracycline removal by using hydrogen based membrane biofilm reactor[J]. Journal of Hazardous Materials, 2016, 320: 88-95. |
| [56] |
Howarth RW, Santoro R, Ingraffea A. Methane and the greenhouse-gas footprint of natural gas from shale formations[J]. Climatic Change, 2011, 106(4): 679-690. |
| [57] |
Raghoebarsing AA, Pol A, van de Pas-Schoonen KT, et al. A microbial consortium couples anaerobic methane oxidation to denitrification[J]. Nature, 2006, 440(7086): 918-921. DOI:10.1038/nature04617 |
| [58] |
Luo YH, Chen R, Wen LL, et al. Complete perchlorate reduction using methane as the sole electron donor and carbon source[J]. Environmental Science & Technology, 2015, 49(4): 2341-2349. |
| [59] |
Lai CY, Wen LL, Shi LD, et al. Selenate and nitrate bioreductions using methane as the electron donor in a membrane biofilm reactor[J]. Environmental Science & Technology, 2016, 50(18): 10179-10186. |
| [60] |
Lai CY, Dong QY, Rittmann BE, et al. Bioreduction of antimonate by anaerobic methane oxidation in a membrane biofilm batch reactor[J]. Environmental Science & Technology, 2018, 52(15): 8693-8700. |
| [61] |
Kits KD, Klotz MG, Stein LY. Methane oxidation coupled to nitrate reduction under hypoxia by the Gammaproteobacterium Methylomonas denitrificans, sp. nov. type Strain FJG1[J]. Environmental Microbiology, 2015, 17(9): 3219-3232. DOI:10.1111/1462-2920.12772 |
| [62] |
Hinrichs KU, Hayes JM, Sylva SP, et al. Methane-consuming archaebacteria in marine sediments[J]. Nature, 1999, 398(6730): 802-805. DOI:10.1038/19751 |
| [63] |
Wegener G, Krukenberg V, Riedel D, et al. Intercellular wiring enables electron transfer between methanotrophic archaea and bacteria[J]. Nature, 2015, 526(7574): 587-590. DOI:10.1038/nature15733 |
| [64] |
Moran JJ, Beal EJ, Vrentas JM, et al. Methyl sulfides as intermediates in the anaerobic oxidation of methane[J]. Environmental Microbiology, 2008, 10(1): 162-173. |
| [65] |
Milucka J, Ferdelman TG, Polerecky L, et al. Zero-valent sulphur is a key intermediate in marine methane oxidation[J]. Nature, 2012, 491(7425): 541-546. DOI:10.1038/nature11656 |
| [66] |
Ettwig KF, Butler MK, le Paslier D, et al. Nitrite-driven anaerobic methane oxidation by oxygenic bacteria[J]. Nature, 2010, 464(7288): 543-548. DOI:10.1038/nature08883 |
| [67] |
Cai C, Leu AO, Xie GJ, et al. A methanotrophic archaeon couples anaerobic oxidation of methane to Fe(Ⅲ) reduction[J]. The ISME Journal, 2018, 12(8): 1929-1939. DOI:10.1038/s41396-018-0109-x |
| [68] |
Egger M, Rasigraf O, Sapart CJ, et al. Iron-mediated anaerobic oxidation of methane in brackish coastal sediments[J]. Environmental Science & Technology, 2015, 49(1): 277-283. |
| [69] |
Scheller S, Yu H, Chadwick GL, et al. Artificial electron acceptors decouple archaeal methane oxidation from sulfate reduction[J]. Science, 2016, 351(6274): 703-707. DOI:10.1126/science.aad7154 |
| [70] |
Leu AO, Cai C, McIlroy SJ, et al. Anaerobic methane oxidation coupled to manganese reduction by members of the Methanoperedenaceae[J]. The ISME Journal, 2020, 14(4): 1030-1041. DOI:10.1038/s41396-020-0590-x |
| [71] |
Lu YZ, Fu L, Ding J, et al. Cr(Ⅵ) reduction coupled with anaerobic oxidation of methane in a laboratory reactor[J]. Water Research, 2016, 102: 445-452. DOI:10.1016/j.watres.2016.06.065 |
| [72] |
Lv PL, Shi LD, Wang Z, et al. Methane oxidation coupled to perchlorate reduction in a membrane biofilm batch reactor[J]. Science of the Total Environment, 2019, 667: 9-15. DOI:10.1016/j.scitotenv.2019.02.330 |
| [73] |
Shi LD, Wang M, Li ZY, et al. Dissolved oxygen has no inhibition on methane oxidation coupled to selenate reduction in a membrane biofilm reactor[J]. Chemosphere, 2019, 234: 855-863. DOI:10.1016/j.chemosphere.2019.06.138 |
| [74] |
Lai CY, Zhong L, Zhang Y, et al. Bioreduction of chromate in a methane-based membrane biofilm reactor[J]. Environmental Science & Technology, 2016, 50(11): 5832-5839. |
| [75] |
Lv PL, Shi LD, Dong QY, et al. How nitrate affects perchlorate reduction in a methane-based biofilm batch reactor[J]. Water Research, 2020, 171: 115397. DOI:10.1016/j.watres.2019.115397 |
| [76] |
Lu DW, Bai H, Kong FG, et al. Recent advances in membrane aerated biofilm reactors[J]. Critical Reviews in Environmental Science and Technology, 2020, 1-55. |
| [77] |
Gong Z, Liu ST, Yang FL, et al. Characterization of functional microbial community in a membrane-aerated biofilm reactor operated for completely autotrophic nitrogen removal[J]. Bioresource Technology, 2008, 99(8): 2749-2756. DOI:10.1016/j.biortech.2007.06.040 |
| [78] |
Gong Z, Yang FL, Liu ST, et al. Feasibility of a membrane-aerated biofilm reactor to achieve single-stage autotrophic nitrogen removal based on Anammox[J]. Chemosphere, 2007, 69(5): 776-784. DOI:10.1016/j.chemosphere.2007.05.023 |
| [79] |
Aybar M, Perez-Calleja P, Li M, et al. Predation creates unique void layer in membrane-aerated biofilms[J]. Water Research, 2019, 149: 232-242. DOI:10.1016/j.watres.2018.10.084 |
| [80] |
Taşkan B, Casey E, Hasar H. Simultaneous oxidation of ammonium and tetracycline in a membrane aerated biofilm reactor[J]. Science of the Total Environment, 2019, 682: 553-560. DOI:10.1016/j.scitotenv.2019.05.111 |
| [81] |
Çelik A, Casey E, Hasar H. Degradation of oxytetracycline under autotrophic nitrifying conditions in a membrane aerated biofilm reactor and community fingerprinting[J]. Journal of Hazardous Materials, 2018, 356: 26-33. DOI:10.1016/j.jhazmat.2018.05.040 |
| [82] |
Mei X, Liu J, Guo ZW, et al. Simultaneous p-nitrophenol and nitrogen removal in PNP wastewater treatment: Comparison of two integrated membrane-aerated bioreactor systems[J]. Journal of Hazardous Materials, 2019, 363: 99-108. DOI:10.1016/j.jhazmat.2018.09.072 |
| [83] |
de-Bashan LE, Bashan Y. Recent advances in removing phosphorus from wastewater and its future use as fertilizer (1997-2003)[J]. Water Research, 2004, 38(19): 4222-4246. DOI:10.1016/j.watres.2004.07.014 |
| [84] |
Falkentoft CM, Harremoës P, Mosbæk H. The significance of zonation in a denitrifying, phosphorus removing biofilm[J]. Water Research, 1999, 33(15): 3303-3310. DOI:10.1016/S0043-1354(99)00042-1 |
| [85] |
Peeters J, Long Z, Houweling D, et al. Nutrient removal intensification with MABR-developing a process model supported by piloting[J]. Proceedings of the Water Environment Federation, 2017, 2017(3): 657-669. DOI:10.2175/193864717821494204 |
| [86] |
Lai CY, Lv PL, Dong QY, et al. Bromate and nitrate bioreduction coupled with poly-β-hydroxybutyrate production in a methane-based membrane biofilm reactor[J]. Environmental Science & Technology, 2018, 52(12): 7024-7031. |
| [87] |
Mei X, Guo ZW, Liu J, et al. Treatment of formaldehyde wastewater by a membrane-aerated biofilm reactor (MABR): the degradation of formaldehyde in the presence of the cosubstrate methanol[J]. Chemical Engineering Journal, 2019, 372: 673-683. DOI:10.1016/j.cej.2019.04.184 |
| [88] |
Tao L, Sedkova N, Yao H, et al. Expression of bacterial hemoglobin genes to improve astaxanthin production in a methanotrophic bacterium Methylomonas sp.[J]. Applied Microbiology and Biotechnology, 2007, 74(3): 625-633. |
| [89] |
Zhou C, Ontiveros-Valencia A, Wang ZC, et al. Palladium recovery in a H2-based membrane biofilm reactor: formation of Pd(0) nanoparticles through enzymatic and autocatalytic reductions[J]. Environmental Science & Technology, 2016, 50(5): 2546-2555. |
| [90] |
Zhou C, Wang ZC, Ontiveros-Valencia A, et al. Coupling of Pd nanoparticles and denitrifying biofilm promotes H2-based nitrate removal with greater selectivity towards N2[J]. Applied Catalysis B: Environmental, 2017, 206: 461-470. DOI:10.1016/j.apcatb.2017.01.068 |
| [91] |
Zhou C, Wang Z, Rittmann BE. Biofilm as a versatile stablizer and promoter for Pd nanoparticle (PdNP) recovery and catalytic denitrification[A]//Advanced Materials- TechConnect Briefs 2016[C]. Washington: TechConnect, 2016
|
| [92] |
Shi LD, Du JJ, Wang LB, et al. Formation of nanoscale Te0 and its effect on TeO32- reduction in CH4-based membrane biofilm reactor[J]. Science of The Total Environment, 2019, 655: 1232-1239. DOI:10.1016/j.scitotenv.2018.11.337 |
| [93] |
Shi LD, Chen YS, Du JJ, et al. Metagenomic evidence for a Methylocystis species capable of bioremediation of diverse heavy metals[J]. Fronties in Microbiology, 2019, 9: 3297. DOI:10.3389/fmicb.2018.03297 |
| [94] |
He MC, Wang XQ, Wu FC, et al. Antimony pollution in China[J]. Science of the Total Environment, 2012, 421-422: 41-50. DOI:10.1016/j.scitotenv.2011.06.009 |
| [95] |
Abin CA, Hollibaugh JT. Dissimilatory antimonate reduction and production of antimony trioxide microcrystals by a novel microorganism[J]. Environmental Science & Technology, 2014, 48(1): 681-688. |
| [96] |
Lai CY, Wen LL, Zhang Y, et al. Autotrophic antimonate bio-reduction using hydrogen as the electron donor[J]. Water Research, 2016, 88: 467-474. DOI:10.1016/j.watres.2015.10.042 |
| [97] |
Wu Y, Wu ZD, Chu HL, et al. Comparison study on the performance of two different gas-permeable membranes used in a membrane-aerated biofilm reactor[J]. Science of the Total Environment, 2019, 658: 1219-1227. DOI:10.1016/j.scitotenv.2018.12.121 |
| [98] |
Tang YN, Zhou C, van Ginkel SW, et al. Hydrogen permeability of the hollow fibers used in H2-based membrane biofilm reactors[J]. Journal of Membrane Science, 2012, 407-408: 176-183. DOI:10.1016/j.memsci.2012.03.040 |
| [99] |
Nerenberg R, Rittmann BE. Hydrogen-based, hollow-fiber membrane biofilm reactor for reduction of perchlorate and other oxidized contaminants[J]. Water science and Technology, 2004, 49(11/12): 223-230. |
| [100] |
Ran YJ, Zhou Y, Yang XX, et al. Research process of the hydrogen-based membrane biofilm reactor on the treatment of oxidized pollutants in water[J]. China Environmental Science, 2018, 38(12): 4484-4493. (in Chinese) 冉雅郡, 周云, 杨潇潇, 等. MBfR处理水中氧化性污染物的研究进展[J]. 中国环境科学, 2018, 38(12): 4484-4493. |
| [101] |
Zhou C, Ontiveros-Valencia A, Nerenberg R, et al. Hydrogenotrophic microbial reduction of oxyanions with the membrane biofilm reactor[J]. Frontiers in Microbiology, 2019, 9: 3268. DOI:10.3389/fmicb.2018.03268 |
| [102] |
Castrillo M, Díez-Montero R, Esteban-Garcia AL, et al. Mass transfer enhancement and improved nitrification in MABR through specific membrane configuration[J]. Water Research, 2019, 152: 1-11. DOI:10.1016/j.watres.2019.01.001 |
| [103] |
Klein T, Zihlmann D, Derlon N, et al. Biological control of biofilms on membranes by metazoans[J]. Water Research, 2016, 88: 20-29. DOI:10.1016/j.watres.2015.09.050 |
| [104] |
Derlon N, Peter-Varbanets M, Scheidegger A, et al. Predation influences the structure of biofilm developed on ultrafiltration membranes[J]. Water Research, 2012, 46(10): 3323-3333. DOI:10.1016/j.watres.2012.03.031 |
| [105] |
Tang YN, Ziv-El M, Zhou C, et al. Bioreduction of nitrate in groundwater using a pilot-scale hydrogen-based membrane biofilm reactor[J]. Frontiers of Environmental Science & Engineering in China, 2010, 4(3): 280-285. |
| [106] |
Rittmann B, Nerenberg R, Stinson B, et al. Hydrogen-based membrane biofilm reactor for wastewater treatment[J]. Water Science and Technology, 2004(4): 127-133. |
| [107] |
Wang Z, Chen XM, Ni BJ, et al. Model-based assessment of chromate reduction and nitrate effect in a methane-based membrane biofilm reactor[J]. Water Research X, 2019, 5: 100037. DOI:10.1016/j.wroa.2019.100037 |
| [108] |
Lv PL, Zhong L, Dong QY, et al. The effect of electron competition on chromate reduction using methane as electron donor[J]. Environmental Science and Pollution Research, 2018, 25(7): 6609-6618. DOI:10.1007/s11356-017-0937-7 |
| [109] |
Wang Z, Shi LD, Lai CY, et al. Methane oxidation coupled to vanadate reduction in a membrane biofilm batch reactor under hypoxic condition[J]. Biodegradation, 2019, 30(5/6): 457-466. |
| [110] |
Côté P, Peeters J, Adams N, et al. A new membrane-aerated biofilm reactor for low energy wastewater treatment: Pilot results[J]. Proceedings of the Water Environment Federation, 2015, 2015(13): 4226-4239. DOI:10.2175/193864715819540883 |
| [111] |
Li Y, Zhang KS. Pilot scale treatment of polluted surface waters using Membrane-Aerated Biofilm Reactor (MABR)[J]. Biotechnology & Biotechnological Equipment, 2018, 32(2): 376-386. |
| [112] |
Stricker AE, Lossing H, Gibson JH, et al. Pilot scale testing of a new configuration of the Membrane Aerated Biofilm Reactor (MABR) to treat high-strength industrial sewage[J]. Water Environment Research, 2011, 83(1): 3-14. |
| [113] |
Terada A, Hibiya K, Nagai J, et al. Nitrogen removal characteristics and biofilm analysis of a membrane-aerated biofilm reactor applicable to high-strength nitrogenous wastewater treatment[J]. Journal of Bioscience and Bioengineering, 2003, 95(2): 170-178. |
| [114] |
Syron E, Semmens MJ, Casey E. Performance analysis of a pilot-scale membrane aerated biofilm reactor for the treatment of landfill leachate[J]. Chemical Engineering Journal, 2015, 273: 120-129. DOI:10.1016/j.cej.2015.03.043 |
| [115] |
Wei X. Study and application of nitrogen and phosphorus removal using novel MABR technology[D]. Tianjin: Doctoral Dissertation of Tianjin University, 2012 (in Chinese) 魏昕.新型MABR除磷脱氮技术的研究与应用[D].天津大学博士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10056-1013004967.htm |
 2020, Vol. 47
2020, Vol. 47