扩展功能
文章信息
- 张瑜, 李维林, 杨金水, 李宝珍, 袁红莉
- ZHANG Yu, LI Wei-Lin, YANG Jin-Shui, LI Bao-Zhen, YUAN Hong-Li
- 重度霾污染时空气细菌群落特征及与关键环境因子的相关性
- Community characteristics of airborne bacteria in severe haze and its correlation with key environmental factors
- 微生物学通报, 2020, 47(10): 3126-3140
- Microbiology China, 2020, 47(10): 3126-3140
- DOI: 10.13344/j.microbiol.china.200524
-
文章历史
- 收稿日期: 2020-05-28
- 接受日期: 2020-07-23
- 网络首发日期: 2020-08-07
霾污染对生态环境、人类健康和社会经济发展都造成了严重的威胁。霾污染是以空气动力学直径小于2.5 μm的细颗粒物(PM2.5)浓度激增为主要特征;根据中国环境监测总站对我国74个主要城市的PM2.5浓度进行平均统计,发现2013年1月期间PM2.5日均最高浓度为766 μg/m3,超过世界卫生组织的指导标准(PM2.5日均浓度25 μg/m3) 30倍以上[1]。霾污染不仅使空气能见度显著降低,影响公共交通及人们的正常生活[2],还会导致严重的疾病或过敏反应,危害人类健康[3-4]。生态环境保护是关乎民生的千秋大计,随着大气污染防治“十条措施”和《大气污染防治行动计划》等系列政策的发布,大气污染治理工作在全国范围内大力开展。2015年8月通过的《大气污染防治法》明确提出了“科技治霾”的要求,对霾污染物成分进行深入研究并全面明确霾污染形成的相关机制对实现科学、有效的霾污染治理及危害防治至关重要。
颗粒物之所以会对人类健康、能见度、气候变化等产生深刻影响,主要取决于其气溶胶的特性,包括浓度、粒径大小及组成等。气溶胶的组成复杂多变,不仅包括有机物、无机物等化学组分,还包括细菌、真菌等生物组分;相对于霾污染中颗粒物化学组分的解析,生物气溶胶的研究非常有限。生物气溶胶占到城市气溶胶总量的30%以上,不但与人类健康密切相关,同时在整个生态系统,特别是大气圈与生物圈的相互作用中发挥着重要作用[5]。例如,空气微生物既可以作为高效生物冰核,改变全球云分布及降水[6-7];也可以参与碳、氮等物质循环[8]。生物气溶胶包含的过敏原、致病菌、病毒等可引起过敏反应、呼吸系统疾病等,对人类健康、畜牧业养殖、作物栽培等也存在潜在威胁[9-12]。研究霾污染中空气微生物的变化特征对于解析霾污染的成因、预防霾污染的危害具有重要意义。空气微生物的存在特征主要包括浓度、群落组成、粒径分布和功能基因分布等特点,而且极易受到地域、气候、污染等环境因子的影响。空气中影响微生物的主要环境因子分为三类:(1)颗粒物及气态污染物,通常包括PM2.5、PM10、SO2、NO2、O3和CO;(2)气象因子,通常包括气压、温度和相对湿度;(3)化学组分,通常包括空气中常见的水溶性离子,如Cl-、NO3-、SO42-、Na+、NH4+、K+、Mg2+和Ca2+ [5, 13-14]。众多环境因素皆能不同程度地影响空气微生物的特征,而明确霾污染中影响空气微生物的关键环境因子是探究霾污染与空气微生物互作机制的桥梁,对进一步阐明空气微生物在霾污染发生中的机制至关重要。
深冬季节是霾污染发生最频繁、最严重的时期,2016年12月16日至12月21日华北地区发生了严重的霾污染,北京市发布了史上第3个霾污染“红色预警”。本研究采集了北京地区2016年12月20日至23日的重度霾污染“红色预警”期间的空气样品,测定了颗粒物的化学组分,分析了空气细菌的群落结构及与环境因子的相关性,旨在明确重度霾污染时空气细菌的群落特征,阐明影响空气微生物群落结构的关键环境因子,为进一步认识空气微生物对霾污染的反馈作用、深入研究霾污染时空气微生物的传播机制和环境评价提供参考。
1 材料与方法 1.1 主要试剂和仪器DNeasy® PowerSoil® Kit,凯杰企业管理有限公司;GenMag Spin® Viral DNA Kit,北京金麦格生物技术有限公司。微电脑TSP大流量采样器,青岛金仕达电子科技有限公司;离子色谱仪,戴安有限公司;电感耦合等离子体质谱仪,赛默飞世尔科技有限公司;微波消解仪,CEM公司。
1.2 空气样品采集为反映城市相应环境下的空气微生物特征,本次采样避开医院、公路和养殖场等特殊环境的干扰,选择北京市中国农业大学西校区生命科学研究中心三段顶层为采样点,距离地面约20 m (40°01′28′′N,116°16′41′′E)。用微电脑TSP大流量采样器(采样器流量:1.03 m3/min)采集3个重度霾污染样品(RH1、RH2、RH3)和2个非污染样品(RNH1,RNH2)。采样前在超净台中将无菌滤膜放入采样滤膜放置器(filter holder)并密封,达到采样点后打开密封将Filter holder放置于采样器中进行采样。根据霾污染持续时间确定采样时间。采样完成后,用无菌锡箔纸包裹滤膜并密封,存于-80 ℃用于下游分析。本过程中,采样滤膜、锡箔纸采用干热灭菌(200 ℃,灭菌5 h),其他实验材料采用75%乙醇消毒[15]。样品详细信息如表 1所示。
| Sample numbers | Sampling times | PM2.5 (μg/m3) | PM10 (μg/m3) | SO2 (μg/m3) | NO2 (μg/m3) | CO (mg/m3) | O3 (μg/m3) |
| RH1 | 2016.12.20. 16:00-19:00 | 331 | 410 | 13 | 174 | 6.8 | 5 |
| RH2 | 2016.12.20. 20:00-24:00 | 384 | 377 | 9 | 152 | 8.7 | 6 |
| RH3 | 2016.12.21. 16:00-24:00 | 377 | 388 | 21 | 193 | 7.0 | 5 |
| RNH1 | 2016.12.22. 12:00-24:00 | 11 | NA | 6 | 31 | 0.5 | 46 |
| RNH2 | 2016.12.23. 16:00-24:00 | 81 | 89 | 22 | 86 | 1.5 | 4 |
| 注:数据来源于http://www.bjmemc.com.cn/;NA:数据缺失. Note: Data from http://www.bjmemc.com.cn/; NA: Data missing. | |||||||
取1/16采样后的石英滤膜剪碎放入15 mL离心管中,加入10 mL经过滤除菌的Milli-Q水,超声波振荡30 min后用0.22 μm滤器过滤,滤液用于水溶性离子浓度测定。用离子色谱仪测定水溶性阴离子(Cl-、NO3-、SO42-),配套设备为CR-ATC的EGC氢氧化钾淋洗液自动发生罐、IonpacAS11阴离子分离柱、AG11阴离子保护柱、ASRS300连续自动再生电解微膜抑制器。流动相为3-35 mmol/L氢氧化钾,流速1.0 mL/min。由离子色谱仪测定水溶性阳离子(Na+、NH4+、K+、Mg2+、Ca2+),配套设备为ED50电导检测器、GP50梯度泵、LC20色谱箱、IonpacCS12A阳离子分离柱、CG12A阳离子保护柱、CSRS300连续自动再生电解微膜抑制器。流动相为20 mmol/L甲磺酸,流速1.0 mL/min,检出限为0.000 1-0.005 mg/L,线性范围0.05-200 mg/L,于北京师范大学检测中心完成。
1.3.2 元素浓度测定将采样后1/16的石英膜放入消解管中,加入HNO3、HCL、HF,使用微波消解仪对样品进行消解后,用电感耦合等离子体质谱仪测定空气样品中K、Na、Ca、Mg、Al、P、Ti、V、Fe、Mn、Cu、Zn、Co、Ni、As、Se、Ba、Mo、Cd、Tl、Pb、Th、U元素的浓度,由北京新奥环标技术服务有限公司完成。
1.4 扩增子高通量测序综合使用DNeasy® PowerSoil® Kit和GenMag Spin® Viral DNA Kit提取空气样品的基因组DNA,送至北京诺禾致源生物信息有限公司进行高通量测序。测序平台为Illumina HiSeq,测序方法通过构建小片段文库进行双末端测序(paired-end),测序片段为16S rRNA基因的V3-V4区,测序引物为341F (5′-CCTAYGGGRBGCASCAG-3′)和806R (5′-GGACTACNNGGGTATCTAAT-3′) [15]。原始数据(raw data)依据Barcode进行拆分,截去Barcode和引物序列,并用FLASH (V1.2.7)进行序列拼接。拼接后的序列参照QIIME (V1.7.0)的质控流程进行截取、长度过滤和嵌合体的去除,最终得到进行下游数据分析的有效序列。测序所得原始序列提交NCBI GenBank数据库,登录号为SRP189601。
1.5 数据分析样品中细菌OTU聚类及物种注释基于QIIME软件完成。16S rRNA基因V3-V4区测序所得的有效序列采用QIIME默认的De novo OTU分析方法,按照97%的相似度划分OTU并挑选代表序列[16]。为消除测序深度的影响,均按照最小的序列条数进行均一化处理。依据GreenGenes数据库完成代表序列的注释。
各样品α多样性的计算通过QIIME软件(V1.7.0)完成。Chao1指数、Shannon指数、谱系多样性和观测物种数的计算均使用Alpha diversity.py命令完成。样品α多样性、特定微生物种属的相对丰度与环境因子的Pearson相关性分析通过SPSS软件(V18.0)进行,两两之间显著性检验使用t检验(t test),多重比较(ANOVA)使用Duncan test,以95%作为相关关系显著的置信度。空气微生物群落结构与环境因子相关性的Mantel test分析使用R软件的Vegan包(V2.5-2)完成。
不同样品间群落结构与组成差异分析主要进行了热图分析和Linear discriminant analysis (LDA) effect size (LEfSe)分析。热图分析使用R软件Pheatmap包进行,分析前取各样品相对丰度的自然对数进行数据的标准化。LEfSe分析通过网站(http://huttenhower.sph.harvard.edu/galaxy/)进行[16]。
2 结果与分析 2.1 空气颗粒物化学组分分析如表 2所示,本次霾污染样品颗粒物中的部分离子和元素的浓度呈上升趋势。其中,NO3-、SO42-和NH4+平均浓度分别为52.60、46.04、27.01 μg/m3,显著高于非污染对照样品的6.05、4.60、2.65 μg/m3 (t检验,P < 0.05)。霾污染样品中Cl-、K+、Mg2+、Zn、Cd、Tl、Pb的平均浓度分别达到9.76、2.32、0.76、437.68、4.61、3.54、259.94 μg/m3,也显著高于非污染对照样品的1.88、0.39、0.16、96.39、0.83、0.59、47.11 μg/m3 (t检验,P < 0.05)。在3个污染样品中,RH2的平均PM2.5浓度为384 μg/m3,略高于RH3 (376 μg/m3),但整体上RH3中PM10、SO2和常见元素及离子的浓度均为最高(表 1-3),为污染最严重样品。
| Elements | RH1 | RH2 | RH3 | RNH1 | RNH2 | RH | RNH |
| P | 453.49 | 184.77 | 214.25 | 83.95 | 138.65 | 284.17 (147.37)a | 111.3 (38.67)a |
| Ca | 7.58 | 4.68 | 9.49 | 5.68 | 7.90 | 7.25 (2.42)a | 6.79 (1.58)a |
| Ti | 713.37 | 315.74 | 407.21 | 225.71 | 263.33 | 478.78 (208.25)a | 244.52 (26.61)a |
| V | 9.99 | 6.23 | 11.58 | 6.57 | 7.42 | 9.26 (2.75)a | 6.99 (0.6)a |
| Co | 4.68 | 2.34 | 4.06 | 1.36 | 1.55 | 3.69 (1.22)a | 1.46 (0.13)a |
| Ni | 20.54 | 8.96 | 20.85 | 4.37 | 4.84 | 16.78 (±6.78)a | 4.60 (0.33)a |
| Cu | 91.26 | 79.07 | 82.56 | 12.98 | 44.41 | 84.30 (6.28)a | 28.69 (22.22)a |
| Zn | 381.16 | 441.98 | 489.91 | 55.13 | 137.66 | 437.68 (54.50)a | 96.39 (58.36)b |
| As | 0.27 | 0.10 | 0.00 | 0.00 | 0.00 | 0.12 (0.14)a | 0a |
| Se | 0.78 | 7.77 | 12.45 | 0.00 | 0.00 | 7.00 (5.87)a | 0a |
| Mo | 0.00 | 0.00 | 2.89 | 4.56 | 0.79 | NA | 2.68 (2.66) |
| Cd | 4.19 | 4.82 | 4.81 | 0.41 | 1.26 | 4.61 (0.36)a | 0.83 (0.60)b |
| Tl | 2.86 | 3.20 | 4.56 | 0.44 | 0.74 | 3.54 (0.90)a | 0.59 (0.21)b |
| Pb | 223.81 | 243.96 | 312.06 | 28.49 | 65.74 | 259.94 (46.25)a | 47.11 (26.33)b |
| Th | 0.87 | 0.63 | 1.41 | 0.67 | 0.91 | 0.97 (±0.40)a | 0.79 (0.16)a |
| U | 0.43 | 0.31 | 0.61 | 0.29 | 0.28 | 0.45 (±0.15)a | 0.28 (0.01)a |
| Na | 1.39 | 1.78 | 4.93 | 2.01 | 1.11 | 2.70 (1.94)a | 1.56 (0.64)a |
| Mg | 1.63 | 1.22 | 2.54 | 1.80 | 2.05 | 1.80 (0.67)a | 1.92 (0.18)a |
| Al | 4.38 | 2.51 | 5.46 | 3.42 | 4.01 | 4.12 (1.49)a | 3.72 (0.42)a |
| K | 2.31 | 2.53 | 3.64 | 0.94 | 1.41 | 2.83 (0.71)a | 1.17 (0.33)a |
| Mn | 141.69 | 116.65 | 178.56 | 71.98 | 106.16 | 145.63 (31.14)a | 89.07 (24.17)a |
| Fe | 4.34 | 2.97 | 5.19 | 2.46 | 3.55 | 4.16 (1.12)a | 3.01 (0.77)a |
| Ba | 114.35 | 98.00 | 141.84 | 46.82 | 99.78 | 118.06 (22.15)a | 73.30 (37.45)a |
| 注:RH1、RH2、RH3:霾污染样品;RNH1、RNH2:非污染对照样品;RH和RNH分别代表污染样品和非污染样品中元素浓度的平均值及标准偏差;数据上不同的字母代表污染与非污染样品之间具有显著差异,t test,P < 0.05.
Note: RH1, RH2, RH3: Haze polluted samples; RNH1, RNH2: Non-polluted samples; RH and RNH represent the average and standard deviation of polluted and non-polluted samples, respectively; Different letters represent significant differences between polluted and non-polluted samples, t test, P < 0.05. | |||||||
| Ions | RH1 | RH2 | RH3 | RNH1 | RNH2 | RH | RNH |
| Cl- | 9.06 | 8.41 | 11.82 | 0.89 | 2.87 | 9.76 (1.81)a | 1.88 (1.39)b |
| NO3- | 41.41 | 44.53 | 71.86 | 1.81 | 10.29 | 52.60 (16.75)a | 6.05 (6.00)b |
| SO42- | 37.69 | 43.22 | 57.22 | 3.65 | 5.54 | 46.04 (10.07)a | 4.60 (1.33)b |
| Na+ | 3.83 | 1.70 | 3.59 | 0.42 | 1.07 | 3.04 (1.17)a | 0.75 (0.46)a |
| NH4+ | 25.27 | 25.71 | 30.05 | 1.36 | 3.94 | 27.01 (2.64)a | 2.65 (1.82)b |
| K+ | 1.82 | 2.23 | 2.92 | 0.24 | 0.55 | 2.32 (0.56)a | 0.39 (0.22)b |
| Mg2+ | 0.59 | 0.69 | 1.00 | 0.11 | 0.20 | 0.76 (0.22)a | 0.16 (0.06)b |
| Ca2+ | 3.67 | 3.69 | 7.39 | 1.14 | 2.46 | 4.91 (2.14)a | 1.80 (0.93)a |
| 注:RH1、RH2、RH3:霾污染样品;RNH1、RNH2:非污染对照样品;RH和RNH分别代表污染样品和非污染样品中水溶性离子浓度的平均值及标准偏差;数据上不同的字母代表污染与非污染样品之间具有显著差异, t test, P < 0.05.
Note: RH1, RH2, RH3: Haze polluted samples; RNH1, RNH2: Non-polluted samples; RH and RNH represent the average and standard deviation of polluted and non-polluted samples, respectively; Different letters represent significant differences between polluted and non-polluted samples, t test, P < 0.05. | |||||||
二次气溶胶是在空气中通过化学转化生成,而非由污染源直接排放到空气中,目前被认为是霾污染中急剧上升的颗粒物的最重要组成部分。SO2、NO2和NH3在相对湿度较高的条件下迅速生成的SO42-、NO3-和NH4+被认为是最关键的二次无机气溶胶[17-18]。化石燃料燃烧产生的Cl-和K+及来源于土壤环境的Mg2+也被报道在霾污染中显著上升[5, 19-20]。此外,大气重金属污染也是我国空气污染问题之一,霾污染中大气重金属浓度的上升不容小觑[21-22]。此前有研究报道京津冀地区霾污染空气中SO42-、NO3-和NH4+的总浓度为85.9±22.4 μg/m3[23],本研究结果也显示,此次霾污染中它们的总浓度达125.65±29.34 μg/m3,而且霾污染中SO42-、NO3-和NH4+的浓度均分别提高了约10倍。此外,Cl-、K+、Mg2+和重金属元素Zn、Cd、Tl、Pb的浓度也上升了5倍以上,因此本次“红色预警”的霾污染为典型的重度霾污染事件。
2.2 霾污染时空气细菌α多样性特征及与环境因子的相关性本次重度霾污染各样品细菌多样性指数及物种丰富度如图 1所示,多样性指数中的Shannon指数和谱系多样性分别分布在6.10-8.90和72.15-137.83的范围之间,物种丰富度中Chao1指数和可观测物种数目则分别分布于1 444-3 691和2 546.03-5 681.34的范围。课题组前期对2015年10月至2016年1月期间9次霾污染样品进行了连续跟踪和报道,其细菌多样性指数及物种丰富度的检测结果与本次重度霾污染样品处于同一水平[15]。
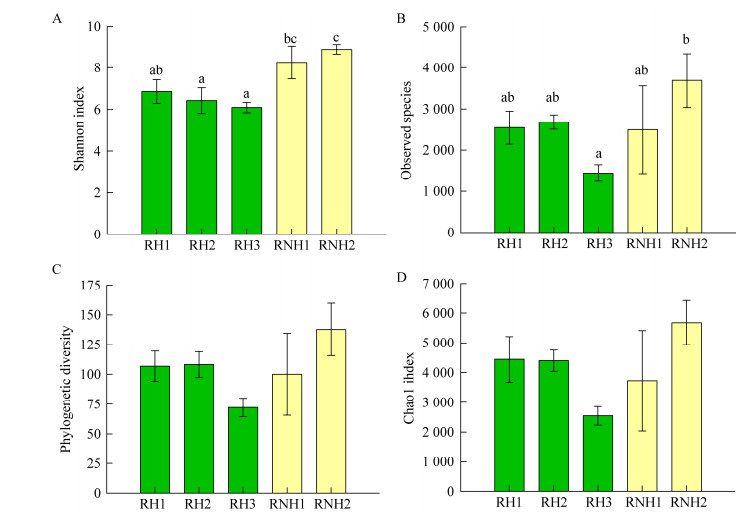
|
| 图 1 重度霾污染过程中空气细菌α多样性指数及物种丰富度 Figure 1 Species richness and α-diversity index of airborne bacterial community in severe haze 注:A:空气细菌Shannon指数;B:可观测物种数目;C:谱系多样性;D:Chao1指数.数据上的不同的英文字母代表差异显著性(ANOVA,Duncan,P < 0.05);RH1、RH2和RN3为霾污染样品, RNH1和RNH2为非污染对照样品.数据误差线为标准偏差(n=3). Note: A: Shannon index of airborne bacteria; B: Observed species of airborne bacteria; C: Phylogenetic diversity of airborne bacteria; D: Chao1 index of airborne bacteria. Letters above the data represent the significant difference (ANOVA, Duncan, P < 0.05); RH1, RH2, RH3: haze polluted samples; RNH1, RNH2: Non-polluted samples; Error bars represent standard deviation of the data (n=3). |
|
|
比较霾污染时细菌α多样性变化趋势发现,霾污染样品平均Shannon指数、Chao1指数、谱系多样性和可观测物种数目分别为6.46、3 797.65、95.78和2 224,均低于非污染样品中的水平(分别为8.58、4 704.77、118.98和3 094)。然而这些α多样性指数及物种丰富度中,仅Shannon指数及可观测物种数目在霾与非霾样品之间存在显著差异(图 1A和图 1B)。在本次霾污染中,细菌α多样性指数及物种丰富度降低,但整体变化并不显著。霾污染的发生横跨秋、冬、春3个季节,本次霾污染事件发生在12月20-23日之间,属于深冬季节。前期研究结果同样表明,深冬季节的霾污染样品α多样性的变化幅度较小[15],因此,霾污染中空气细菌α多样性虽然降低,但空气细菌的结构很可能保持着一定的季节稳定性。此外,尽管多个α多样性指数在各样品间未呈现显著差异,但如图 1所示,污染程度最为严重的样品RH3各α多样性指数和物种丰富度均最低,而且其Shannon指数及可观测物种数目均显著低于非污染样品(ANOVA,P < 0.05)。因此,尽管深冬季节霾污染对空气细菌α多样性影响较小,但极严重的霾污染会在一定程度上加重这一影响。
样品细菌α多样性与环境因子的Pearson相关性结果如表 4所示,Shannon指数与可溶性离子(Cl-、NO3-、SO42-、NH4+、K+、Mg2+)、颗粒物(PM2.5、PM10)、气态污染物(CO)和金属元素(Zn、Cd、Tl、Pb)均呈现显著负相关关系,其相关性系数分别为-0.923 (P < 0.05)、-0.925 (P < 0.05)、-0.971 (P < 0.01)、-0.960 (P < 0.01)、-0.950 (P < 0.05)、-0.935 (P < 0.05)、-0.937 (P < 0.05)、-0.919 (P < 0.05)、-0.923 (P < 0.05)、-0.943 (P < 0.05)、-0.966 (P < 0.01)、-0.952 (P < 0.05)和-0.952 (P < 0.05)。谱系多样性与Mo呈现显著负相关关系(r=-0.931,P < 0.05),而其他α多样性指数及物种丰富度均与环境因子之间无显著相关关系。如表 2和表 3所示,NO3-、SO42-、NH4+、Cl-、K+、Mg2+、Zn、Cd、Tl、Pb是霾污染中浓度显著增加的化学组分,这些化学组分与空气细菌α多样性指数之间呈现显著负相关关系,说明它们可能是影响空气细菌群落的重要环境因子。目前研究空气中水溶性离子与微生物群落之间相关性的报道较少,这一现象值得进一步研究。
| Environmental factors | Shannon | Observed species | Phylogenetic diversity | Chao1 |
| PM2.5 | -0.937* | -0.533 | -0.479 | -0.373 |
| PM10 | -0.919* | -0.533 | -0.472 | -0.357 |
| SO2 | 0.038 | 0.038 | 0.066 | 0.071 |
| NO2 | -0.858 | -0.522 | -0.458 | -0.352 |
| CO | -0.923* | -0.471 | -0.419 | -0.313 |
| O3 | 0.414 | -0.071 | -0.135 | -0.226 |
| Cl- | 9.06 | 8.41 | 11.82 | 0.89 |
| NO3- | 41.41 | 44.53 | 71.86 | 1.81 |
| SO42- | 37.69 | 43.22 | 57.22 | 3.65 |
| Na+ | 3.83 | 1.70 | 3.59 | 0.42 |
| NH4+ | 25.27 | 25.71 | 30.05 | 1.36 |
| K+ | 1.82 | 2.23 | 2.92 | 0.24 |
| Mg2+ | 0.59 | 0.69 | 1.00 | 0.11 |
| Ca2+ | 3.67 | 3.69 | 7.39 | 1.14 |
| P | -0.472 | -0.185 | -0.112 | 0.005 |
| Ti | -0.482 | -0.264 | -0.194 | -0.083 |
| V | -0.527 | -0.650 | -0.605 | -0.553 |
| Co | -0.731 | -0.588 | -0.523 | -0.420 |
| Ni | -0.766 | -0.686 | -0.627 | -0.536 |
| Cu | -0.805 | -0.365 | -0.295 | -0.175 |
| Zn | -0.943* | -0.591 | -0.539 | -0.441 |
| As | -0.361 | 0.010 | 0.073 | 0.187 |
| Se | -0.813 | -0.733 | -0.723 | -0.696 |
| Mo | 0.299 | -0.068 | -0.931* | -0.155 |
| Cd | -0.966** | -0.609 | 0.211 | -0.497 |
| Tl | -0.952* | -0.735 | -0.691 | -0.609 |
| Pb | -0.952* | -0.668 | -0.618 | -0.526 |
| Th | -0.382 | -0.586 | -0.564 | -0.555 |
| U | -0.720 | -0.847 | -0.814 | -0.770 |
| Al | -0.218 | -0.504 | -0.477 | -0.465 |
| Mn | -0.752 | -0.620 | -0.566 | -0.489 |
| Fe | -0.544 | -0.535 | -0.483 | -0.421 |
| Ba | -0.634 | -0.399 | -0.340 | -0.260 |
| P | -0.472 | -0.185 | -0.112 | 0.005 |
| Ti | -0.482 | -0.264 | -0.194 | -0.083 |
| V | -0.527 | -0.650 | -0.605 | -0.553 |
| Co | -0.731 | -0.588 | -0.523 | -0.420 |
| Ni | -0.766 | -0.686 | -0.627 | -0.536 |
| 注:**:在0.01水平(双侧)上显著相关;*:在0.05水平(双侧)上显著相关.
Note: **: Significant correlation at 0.01 level (two-sided test); *: Significant correlation at 0.05 level (two-sided test). | ||||
为寻找重度霾污染中显著影响细菌群落组成的关键环境因子,进一步进行了空气颗粒物化学组分与细菌群落组成的Mantel检验。结果如表 5所示,颗粒物PM2.5和PM10对空气细菌群落具有显著的影响(r=0.303 1,P=0.010;r=0.291 8,P=0.010),这一结论与课题组前期对北京地区连续9次霾污染的跟踪报道结论[15]一致。Mantel检验结果还显示,水溶性离子Cl-、NO3-、SO42-、Na+、NH4+、K+、Mg2+和金属元素Ni、Cu、Zn、Cd、Tl、Pb均对空气细菌群落组成具有显著影响(P < 0.05)。其中Cl-、NO3-、SO42-、NH4+、K+、Mg2+等水溶性离子和Zn、Cd、Tl、Pb等金属元素在重度霾污染样品中浓度显著上升(表 2和表 3),而且与细菌Shannon指数之间呈现显著的负相关关系(表 4),因此,确定颗粒物浓度和上述化学组分是影响空气细菌的群落组成的关键环境因子。此外,与气态污染物SO2和NO2相比,水溶性离子硫酸盐、硝酸盐和铵盐对空气细菌群落结构的影响更大(表 5)。
| Environmental factors | r | P value |
| PM2.5 | 0.303 1 | 0.010 |
| PM10 | 0.291 8 | 0.010 |
| SO2 | -0.006 9 | 0.505 |
| NO2 | 0.297 2 | 0.014 |
| CO | 0.286 9 | 0.011 |
| O3 | 0.148 7 | 0.188 |
| Cl- | 0.321 3 | 0.006 |
| NO3- | 0.315 0 | 0.007 |
| SO42- | 0.318 7 | 0.003 |
| Na+ | 0.171 0 | 0.037 |
| NH4+ | 0.317 8 | 0.002 |
| K+ | 0.317 3 | 0.002 |
| Mg2+ | 0.311 7 | 0.001 |
| Ca2+ | 0.243 6 | 0.075 |
| P | -0.018 9 | 0.522 |
| Ti | -0.023 6 | 0.526 |
| V | 0.089 8 | 0.214 |
| Co | 0.139 2 | 0.062 |
| Ni | 0.167 8 | 0.032 |
| Cu | 0.259 6 | 0.034 |
| Zn | 0.316 0 | 0.006 |
| As | -0.071 1 | 0.660 |
| Se | 0.168 9 | 0.101 |
| Mo | 0.134 1 | 0.133 |
| Cd | 0.303 6 | 0.009 |
| Tl | 0.318 4 | 0.002 |
| Pb | 0.324 9 | 0.003 |
| Th | 0.078 2 | 0.286 |
| U | 0.146 4 | 0.189 |
| Al | 0.058 5 | 0.321 |
| Mn | 0.231 7 | 0.059 |
| Fe | 0.122 0 | 0.145 |
| Ba | 0.199 5 | 0.109 |
| P | -0.018 9 | 0.522 |
| Ti | -0.023 6 | 0.526 |
| V | 0.089 8 | 0.214 |
| Co | 0.139 2 | 0.062 |
| Ni | 0.167 8 | 0.032 |
分析本次重度霾污染过程中空气细菌在不同分类水平上的组成特征表明,共注释到35个细菌门类,包括100个纲180个目278个科521个属。如图 2所示,相对丰度前十的细菌门类分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、螺旋体门(Spirochaetes)、Synergistetes、芽单胞菌门(Gemmatimonadetes),其相对丰度总和达97.69%。与2015年北京地区霾污染时相比,空气细菌群落结构在门类水平上保持着较高的一致性。此外,变形菌门、厚壁菌门和放线菌门为最优势的细菌门类,其相对丰度总和达88.08%,与2015年的结果(87.26%)无显著差异[15]。
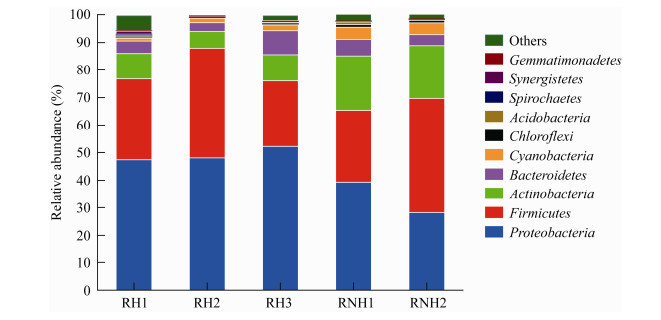
|
| 图 2 重度霾污染时空气细菌在门水平上的特征 Figure 2 Characteristics of airborne bacteria at phylum level in severe haze 注:RH1、RH2、RH3:霾污染样品;RNH1、RNH2:非污染样品. Note: RH1, RH2, RH3: Haze polluted samples; RNH1, RNH2: Non-polluted samples. |
|
|
分析本次重度霾污染时空气细菌门类特征发现,与非污染的样品相比,变形菌门的平均相对丰度由33.94%上升至49.39%,放线菌门的相对丰度则由19.45%显著下降至8.28% (t检验,P < 0.05),而Firmicutes的相对丰度在霾污染中仍保持稳定(由33.78%变为31.02%)。在北京地区2015年深冬季节发生霾污染时,空气细菌中变形菌门的相对丰度由25.99%上升至32.71%,而放线菌门的相对丰度由28.09%下降至20.88%[15]。综合以上结果,霾污染均会导致空气细菌中变形菌门的富集和放线菌门相对丰度的降低,而且随着霾污染程度的加剧,这种影响更为明显。
进一步分析空气细菌中平均相对丰度前1%的最优势纲在重度霾污染时的变化趋势,结果如图 3所示。变形菌门的α变形菌纲(Αlphaproteobacteria)和γ变形菌纲(Gammaproteobacteria)在重度霾污染样品中平均相对丰度分别为37.23%和8.46%,均高于其在非污染样品时的水平(分别为24.38%和5.95%)。厚壁菌门中梭菌纲(Clostridia)在重度霾污染时,平均相对丰度由19.26%上升至23.67%,而芽孢杆菌纲(Bacilli)则由13.88%显著降低至6.70% (t检验,P < 0.001)。放线菌门在霾污染中相对丰度的降低仍然主要由放线菌纲(Actinobacteria)的下降导致,其在重度霾污染样品中由17.39%显著下降至7.21% (t检验,P < 0.001)。本课题组在对2015年12月至2016年1月霾污染空气微生物群落结构变化的研究中同样发现了相同的变化趋势[15],从一定程度上证实了深冬季节霾污染中变形菌门的上升同样主要由α变形菌纲和γ变形菌纲的富集引起,放线菌门的下降主要由放线菌纲相对丰度的下降引起,而尽管霾污染中厚壁菌门无稳定变化,但其中芽孢杆菌纲的相对丰度显著下降。
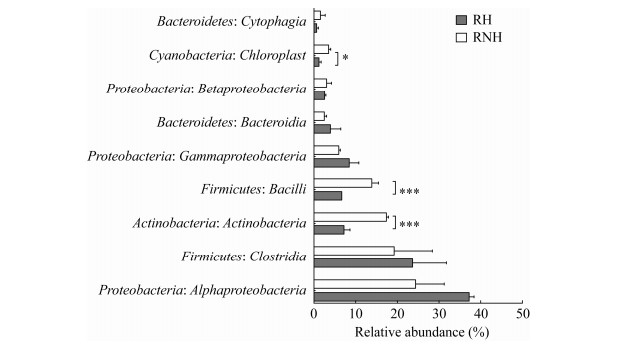
|
| 图 3 重度霾污染时空气细菌在纲水平的相对丰度 Figure 3 Relative abundance of airborne bacteria at class level in severe haze 注:图中数据为平均相对丰度前1%的优势细菌纲;RH和RNH分别为污染样品和非污染样品;星号表示差异显著性(t test,*:P < 0.05; **:P < 0.01; ***:P < 0.001);误差线为标准偏差(n≥6). Note: Data showed the relative abundance of the top 1% dominant bacteria at class level; RH: Haze polluted samples; RNH: Non-polluted samples; Asterisks represent the significant difference (t test, *: P < 0.05; **: P < 0.01; ***: P < 0.001); Error bars represent standard deviation of the data (n≥6). |
|
|
据研究报道,α变形菌纲、γ变形菌纲、芽孢杆菌纲和放线菌纲是空气颗粒物上的主要细菌类别[24-25]。α变形菌纲包含众多与植物相关的细菌种类,γ变形菌纲则包含众多人类致病菌[25]。霾污染发生时,颗粒物主要来源于地面悬浮,同时也和人类活动密切相关,可能会造成α变形菌纲和γ变形菌纲细菌在霾污染中的富集。
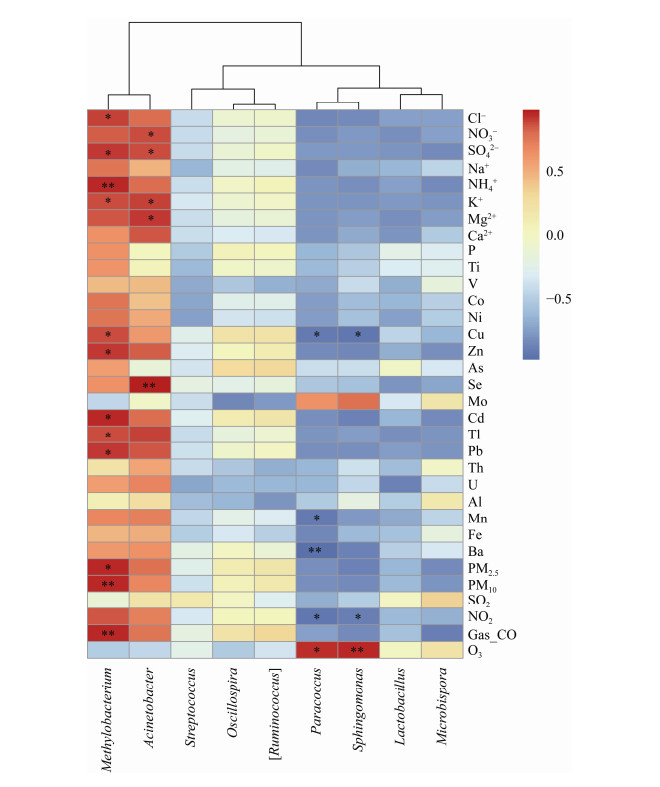
为了详细分析重度霾污染对空气细菌群落结构的影响,选择所有样品中平均相对丰度前50的属绘制热图。如图 4所示,甲基杆菌属(Methylobacterium)在3个污染样品中的相对丰度分别为29.98%、31.00%和28.48%,显著高于非污染样品(11.13%和7.45%,t检验,P < 0.05)。不动杆菌属(Acinetobacter)在全部霾污染样品(相对丰度分别为3.10%、5.37%和6.47%)均高于非污染样品(相对丰度分别为2.56%和2.50%)。然而Paracoccus、Lactobacillus、Microbispora、Sphingomonas、Rubellimicrobium、Planomicrobium、Hymenobacter、Kaistobacter、Planococcus、Carnobacterium、Agrobacterium、Staphylococcus、Brachybacterium、Skermanella、Methanobrevibacter、Jeotgalicoccus、Agrococcus和Devosia属的相对丰度在霾污染样品中均低于非污染样品。所有样品中平均相对丰度超过1%的最优势属分别为Methylobacterium、Acinetobacter、Paracoccus、Lactobacillus、Oscillospira、Lachnospiraceae_ [Ruminococcus]、Microbispora、Sphingomonas和Streptococcus,对它们进行进一步比较分析发现,其中Paracoccus、Microbispora、Methylobacterium、Streptococcus和Sphingomonas 5个属在2015年所采集的霾污染空气样品中也是平均相对丰度超过1%的最优势属[15]。更重要的是,尽管这些属在霾污染中的变化程度存在差异,但其变化趋势一致:除Methylobacterium相对丰度上升外,Paracoccus、Microbispora、Streptococcus和Sphingomonas在霾污染中均呈现下降趋势。空气细菌属水平特征与颗粒物主要化学组分的Pearson相关性分析也在一定程度上证实了这种变化趋势。Methylobacterium和Acinetobacter与霾污染中显著上升的Cl-、NO3-、SO42-、NH4+、K+、Mg2+等水溶性离子和Zn、Cd、Tl、Pb等金属元素之间分别呈现显著的正相关关系,Paracoccus和Sphingomonas则分别于NO2、Cu、Mn和Ba呈现显著负相关关系,而Microbispora和Streptococcus则与各污染物及化学组分均无显著相关性(图 5)。
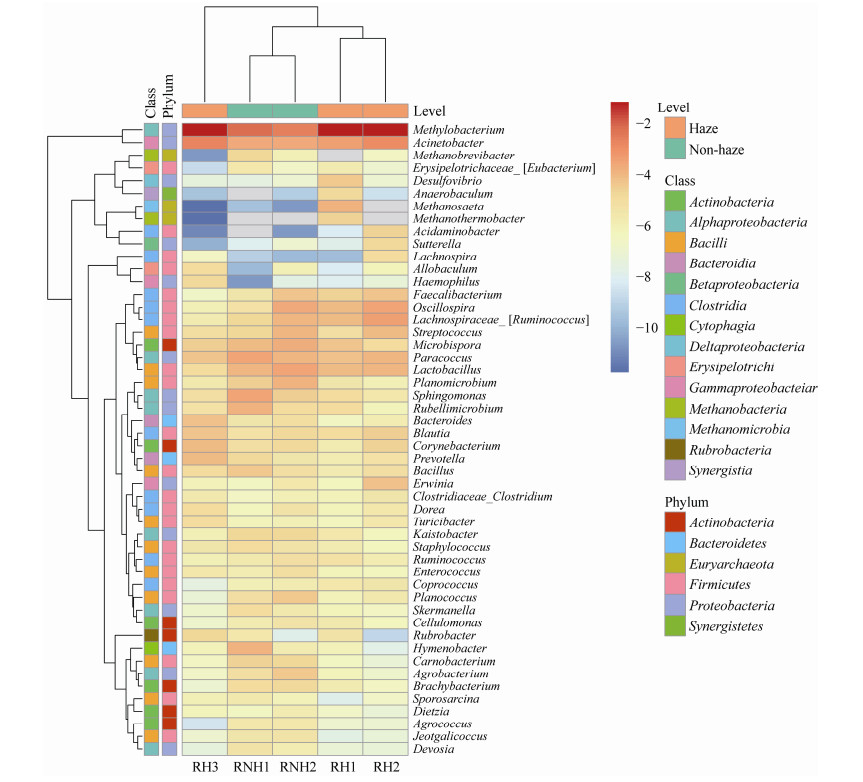
|
| 图 4 重度霾污染时空气细菌平均丰度前50的细菌属水平的差异 Figure 4 Difference of average abundance of the dominant top 50 airborne bacteria at genus level in severe haze 注:RH1、RH2、RH3:霾污染样品;RNH1、RNH2:非污染样品;取各样品相对丰度的自然对数进行数据标准化. Note: RH1, RH2, RH3: Haze polluted samples; RNH1, RNH2: Non-polluted samples; Natural logarithm of the relative abundance of each sample was taken to perform data standardization. |
|
|
|
| 图 5 重度霾污染时空气细菌相对丰度前1%的最优势属与环境因子的Pearson相关性 Figure 5 Pearson correlations between the top 1% dominant airborne bacteria at genus level and environmental factors in severe haze 注:**:在0.01水平(双侧)上显著相关;*:在0.05水平(双侧)上显著相关. Note: **: Significant correlation at 0.01 level (two-sided test); *: Significant correlation at 0.05 level (two-sided test). |
|
|
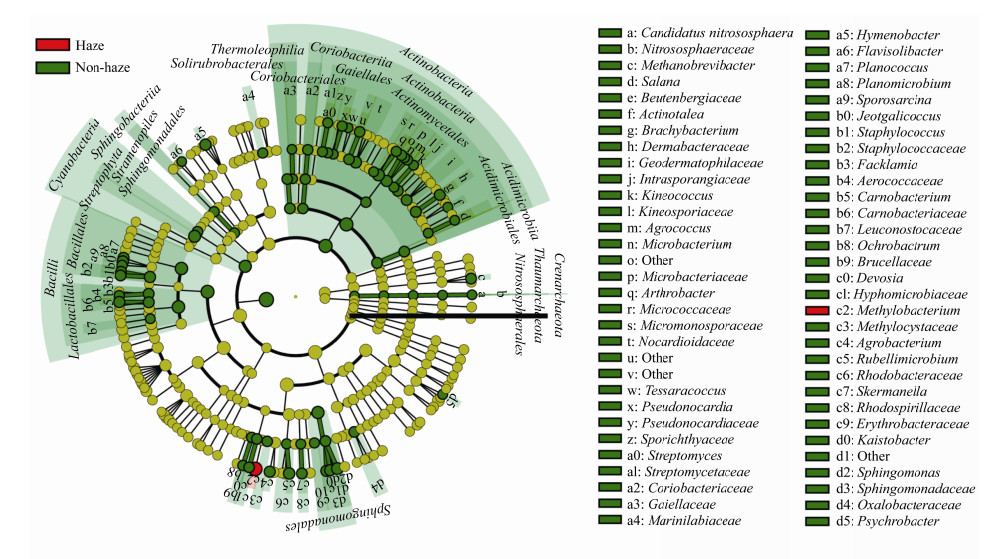
为进一步确认霾污染中具有统计学差异变化的空气细菌,选择平均相对丰度超过0.1%的属进行了LEfSe分析。如图 6所示,本次重度霾污染中甲基杆菌属(Methylobacterium)被显著富集。相对丰度显著下降的细菌种类较多,其中芽孢杆菌纲(Bacilli)、乳杆菌目(Lactobacillales)、肉杆菌科(Carnobacteriaceae)、放线菌门(Actinobacteria)、放线菌纲(Actinobacteria)、放线菌目(Actinomycetales)同样在2015年同一时间段的霾污染事件中被观测到与本次相同的显著降低趋势。目前有研究报道霾污染中优势的细菌种类差异较大,很难得出普遍规律[26]。甲基杆菌属具有较好的多环芳烃降解能力,通常分离来自多环芳烃污染的垃圾处理厂等高污染环境[27-28]。本次重度霾污染中甲基杆菌属被显著富集,提示北京周边一些高污染环境可能加剧了此次霾污染。
|
| 图 6 LEfSe分析重度霾污染时空气细菌在属水平的差异 Figure 6 Difference of airborne bacteria at the genus level in severe haze measured by LEfSe analysis 注:绿色和红色代表有显著差异的细菌类群;经过Kruskal Wallis秩和检验,仅有LDA score>2且P <0.05的细菌类群被标记为具有显著差异. Note: Diferent group of bacteria were colored in green and red; Bacteria were defined as significantly different by Kruskal Wallis rank test (LDA score>2, P <0.05). |
|
|
空气微生物极易受到地域、气候和污染等环境因子的影响。霾污染发生时,稳定的气候条件[29]和过量的污染物排放[30]使细菌附着在颗粒物上或作为颗粒物直接进入空气,因此,颗粒物浓度的升高不仅会引起空气细菌浓度的升高,而且与空气细菌α多样性和群落结构的改变之间也表现出极显著的相关性[31-32]。通过对本次重度霾污染中空气细菌群落组成特征的分析,确定了霾污染中显著富集的细菌门类为变形菌门,纲水平上为α变形菌纲或γ变形菌纲。然而显著降低的细菌门类为放线菌门,纲水平包括放线菌纲和芽孢杆菌纲。目前国内关于霾污染空气细菌群落组成的研究均发现,变形菌门、厚壁菌门和放线菌门是空气中优势的细菌门类[26],本研究则在此基础上进一步明确了重度的霾污染发生时空气细菌群落结构的变化规律,结合前期对连续多次霾污染的跟踪报道,明确空气细菌变化规律的季节稳定性尚属首次。
本文通过对重度霾污染时空气细菌群落结构特征和霾污染物相关性的系统分析,明确了颗粒物浓度和水溶性离子SO42-、NH4+、Cl-、K+、Mg2+及金属元素Zn、Cd、Tl、Pb是影响空气细菌群落结构的关键环境因子。本研究首次明确了水溶性离子,尤其是NO3-、SO42-、NH4+对空气细菌群落结构的影响大于NO2、SO2等气态污染物。与气态前体物质NO2和SO2等相比,颗粒物上形成的二次气溶胶化学组分(NO3-、SO42-、NH4+)是影响空气细菌的关键因素。值得注意的是,在空气污染红色预警时,重度霾污染中细菌群落组成与NO2具有显著的相关性,可能是随着污染程度的加重,空气中的一次气溶胶能更快速形成二次气溶胶,这对全面解析空气细菌对霾污染的反馈机制尤为重要。霾污染过程中,颗粒物和气态污染物浓度与空气细菌浓度呈现显著正相关关系[15]。NO2和SO2是霾污染中重要的气体污染物,其主要来源分别为机动车尾气和化石燃料的燃烧排放[33]。当霾污染发生时,颗粒物浓度升高,细菌附着在颗粒物或者本身作为颗粒物由污染源直接排放进入空气,显著提高空气细菌浓度。较高的相对湿度是霾污染的另一重要特征。随着霾污染程度的加剧,二次气溶胶大量形成,例如在含有NH3和NO2的细颗粒物上,SO2被迅速氧化生成大量硫酸盐,并同时促进颗粒物上硝酸盐和有机物的生成,这些二次气溶胶的形成加剧了霾污染[18, 34],并显著改变空气细菌群落结构。关于水溶性离子对微生物生存的影响已经有报道:SO42-会影响微生物的生长周期[35],Cl-会影响亚硝酸盐细菌的生存也可能杀死微生物[18],高浓度K+可能会破坏微生物的结构导致微生物死亡[36],三者浓度的上升可能来源于北方的集中供暖和生物质的燃烧[37]。另外,过量的重金属Zn、Cd、Tl、Pb更是对生物生存具有不利影响[22]。本研究结果说明,除了颗粒物浓度外,这些化学组分同样是影响空气细菌群落的关键环境因子。在稳定且湿润的气象条件下,SO2、NO2、NH3迅速转化生成大量的SO42-、NO3-、NH4+,不仅造成了严重的霾污染,还显著影响了空气细菌的群落组成。
空气微生物的浓度和群落特征直接关系到人类健康,目前尚无针对室外环境空气微生物所判定的空气质量标准,这在科学治理霾污染中表现出一定的局限性。本文通过对重度霾污染时空气微生物的群落结构特征和关键环境因子的系统研究,为深入解析霾污染时空气微生物的传播机制提供数据支持,同时为建立更完善的环境评价体系和有效预防霾污染危害提供一定的参考。
| [1] |
He JH, Ding S, Liu DF. Exploring the spatiotemporal pattern of PM2.5 distribution and its determinants in Chinese cities based on a multilevel analysis approach[J]. Science of the Total Environment, 2019, 659: 1513-1525. DOI:10.1016/j.scitotenv.2018.12.402 |
| [2] |
Li X, Huang L, Li JY, et al. Source contributions to poor atmospheric visibility in China[J]. Resources, Conservation and Recycling, 2019, 143: 167-177. DOI:10.1016/j.resconrec.2018.12.029 |
| [3] |
Xu P, Chen YF, Ye XJ. Haze, air pollution, and health in China[J]. The Lancet, 2013, 382(9910): 2067. DOI:10.1016/S0140-6736(13)62693-8 |
| [4] |
Yang J, Zhou MG, Yin P, et al. Mortality as a function of dust-haze in China: a multi-city time-series study[J]. The Lancet, 2016, 388(S1): S19. |
| [5] |
Sun YJ, Xu SW, Zheng DY, et al. Effects of haze pollution on microbial community changes and correlation with chemical components in atmospheric particulate matter[J]. Science of the Total Environment, 2018, 637-638: 507-516. DOI:10.1016/j.scitotenv.2018.04.203 |
| [6] |
Bowers RM, Lauber CL, Wiedinmyer C, et al. Characterization of airborne microbial communities at a high-elevation site and their potential to act as atmospheric ice nuclei[J]. Applied and Environmental Microbiology, 2009, 75(15): 5121-5130. DOI:10.1128/AEM.00447-09 |
| [7] |
Maki T, Furumoto S, Asahi Y, et al. Long-range transported bioaerosols captured in snow cover on mount Tateyama, Japan: impacts of Asian-dust events on airborne bacterial dynamics relating to ice-nucleation activities[J]. Atmospheric Chemistry and Physics, 2018, 18(11): 8155-8171. DOI:10.5194/acp-18-8155-2018 |
| [8] |
Fröhlich-Nowoisky J, Kampf CJ, Weber B, et al. Bioaerosols in the earth system: climate, health, and ecosystem interactions[J]. Atmospheric Research, 2016, 182: 346-376. DOI:10.1016/j.atmosres.2016.07.018 |
| [9] |
Kim KH, Kabir E, Jahan SA. Airborne bioaerosols and their impact on human health[J]. Journal of Environmental Sciences, 2018, 67: 23-35. DOI:10.1016/j.jes.2017.08.027 |
| [10] |
Walser SM, Gerstner DG, Brenner B, et al. Evaluation of exposure-response relationships for health effects of microbial bioaerosols—a systematic review[J]. International Journal of Hygiene and Environmental Health, 2015, 218(7): 577-589. DOI:10.1016/j.ijheh.2015.07.004 |
| [11] |
Yang W, Guo M, Liu G, et al. Detection and analysis of fine particulate matter and microbial aerosol in chicken houses in Shandong Province, China[J]. Poultry Science, 2018, 97(3): 995-1005. DOI:10.3382/ps/pex388 |
| [12] |
Ye Q, Fu JF, Mao JH, et al. Haze is an important medium for the spread of rotavirus[J]. Environmental Pollution, 2016, 216: 324-331. DOI:10.1016/j.envpol.2016.05.090 |
| [13] |
Zhen Q, Deng Y, Wang YQ, et al. Meteorological factors had more impact on airborne bacterial communities than air pollutants[J]. Science of the Total Environment, 2017, 601/602: 703-712. DOI:10.1016/j.scitotenv.2017.05.049 |
| [14] |
Gao JF, Fan XY, Li HY, et al. Airborne bacterial communities of PM2.5 in Beijing-Tianjin-Hebei megalopolis, China as revealed by Illumina MiSeq sequencing: a case study[J]. Aerosol and Air Quality Research, 2017, 17(3): 788-798. DOI:10.4209/aaqr.2016.02.0087 |
| [15] |
Li WL, Yang JS, Zhang DZ, et al. Concentration and community of airborne bacteria in response to cyclical haze events during the fall and midwinter in Beijing, China[J]. Frontiers in Microbiology, 2018, 9: 1741. DOI:10.3389/fmicb.2018.01741 |
| [16] |
Segata N, Izard J, Waldron L, et al. Metagenomic biomarker discovery and explanation[J]. Genome Biology, 2011, 12(6): R60. DOI:10.1186/gb-2011-12-6-r60 |
| [17] |
Huang RJ, Zhang YL, Bozzetti C, et al. High secondary aerosol contribution to particulate pollution during haze events in China[J]. Nature, 2014, 514(7521): 218-222. DOI:10.1038/nature13774 |
| [18] |
Wang GH, Zhang RY, Gomez ME, et al. Persistent sulfate formation from London Fog to Chinese haze[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(48): 13630-13635. DOI:10.1073/pnas.1616540113 |
| [19] |
Du HH, Kong LD, Cheng TT, et al. Insights into summertime haze pollution events over Shanghai based on online water-soluble ionic composition of aerosols[J]. Atmospheric Environment, 2011, 45(29): 5131-5137. DOI:10.1016/j.atmosenv.2011.06.027 |
| [20] |
Ouyang J, Yang GS, Ma LL, et al. Chlorine levels and species in fine and size resolved atmospheric particles by X-ray absorption near-edge structure spectroscopy analysis in Beijing, China[J]. Chemosphere, 2018, 196: 393-401. DOI:10.1016/j.chemosphere.2017.12.126 |
| [21] |
Zhang N, Han B, He F, et al. Characterization, health risk of heavy metals, and source apportionment of atmospheric PM2.5 to children in summer and winter: an exposure panel study in Tianjin, China[J]. Air Quality, Atmosphere & Health, 2015, 8(4): 347-357. |
| [22] |
Cheng K, Wang Y, Tian HZ, et al. Atmospheric emission characteristics and control policies of five precedent-controlled toxic heavy metals from anthropogenic sources in China[J]. Environmental Science & Technology, 2015, 49(2): 1206-1214. |
| [23] |
Li Y, Tao J, Zhang LM, et al. High contributions of secondary inorganic aerosols to PM2.5 under polluted levels at a regional station in northern China[J]. International Journal of Environmental Research and Public Health, 2016, 13(12): 1202. DOI:10.3390/ijerph13121202 |
| [24] |
Guo ZD, Wang ZY, Qian LA, et al. Biological and chemical compositions of atmospheric particulate matter during hazardous haze days in Beijing[J]. Environmental Science and Pollution Research, 2018, 25(34): 34540-34549. DOI:10.1007/s11356-018-3355-6 |
| [25] |
Yan D, Zhang T, Su J, et al. Structural variation in the bacterial community associated with airborne particulate matter in Beijing, China, during hazy and nonhazy days[J]. Applied and Environmental Microbiology, 2018, 84(9): e00004-18. |
| [26] |
Xie ZS, Fan CL, Lu R, et al. Characteristics of ambient bioaerosols during haze episodes in China: a review[J]. Environmental Pollution, 2018, 243: 1930-1942. DOI:10.1016/j.envpol.2018.09.051 |
| [27] |
Nzila A, Thukair A, Sankara S, et al. Isolation and characterization of naphthalene biodegrading Methylobacterium radiotolerans bacterium from the eastern coastline of the kingdom of Saudi Arabia[J]. Archives of Environmental Protection, 2016, 42(3): 25-32. DOI:10.1515/aep-2016-0028 |
| [28] |
Ventorino V, Sannino F, Piccolo A, et al. Methylobacterium populi VP2: plant growth-promoting bacterium isolated from a highly polluted environment for polycyclic aromatic hydrocarbon (PAH) biodegradation[J]. The Scientific World Journal, 2014, 2014: 931793. |
| [29] |
Ouyang Y. China wakes up to the crisis of air pollution[J]. The Lancet Respiratory Medicine, 2013, 1(1): 12. DOI:10.1016/S2213-2600(12)70065-6 |
| [30] |
Wang LL, Liu ZR, Sun Y, et al. Long-range transport and regional sources of PM2.5 in Beijing based on long-term observations from 2005 to 2010[J]. Atmospheric Research, 2015, 157: 37-48. DOI:10.1016/j.atmosres.2014.12.003 |
| [31] |
Smets W, Moretti S, Denys S, et al. Airborne bacteria in the atmosphere: presence, purpose, and potential[J]. Atmospheric Environment, 2016, 139: 214-221. DOI:10.1016/j.atmosenv.2016.05.038 |
| [32] |
Zhai YB, Li X, Wang TF, et al. A review on airborne microorganisms in particulate matters: composition, characteristics and influence factors[J]. Environment International, 2018, 113: 74-90. DOI:10.1016/j.envint.2018.01.007 |
| [33] |
Qiao T, Zhao MF, Xiu GL, et al. Simultaneous monitoring and compositions analysis of PM1 and PM2.5 in Shanghai: implications for characterization of haze pollution and source apportionment[J]. Science of the Total Environment, 2016, 557-558: 386-394. DOI:10.1016/j.scitotenv.2016.03.095 |
| [34] |
Quan JN, Tie XX, Zhang Q, et al. Characteristics of heavy aerosol pollution during the 2012–2013 winter in Beijing, China[J]. Atmospheric Environment, 2014, 88: 83-89. DOI:10.1016/j.atmosenv.2014.01.058 |
| [35] |
Scherer P, Sahm H. Influence of sulphur-containing compounds on the growth of Methanosarcina barkeri in a defined medium[J]. European Journal of Applied Microbiology and Biotechnology, 1981, 12(1): 28-35. |
| [36] |
Xu CH, Wei M, Chen JM, et al. Bacterial characterization in ambient submicron particles during severe haze episodes at Ji'nan, China[J]. Science of the Total Environment, 2017, 580: 188-196. DOI:10.1016/j.scitotenv.2016.11.145 |
| [37] |
Chen JM, Li CL, Ristovski Z, et al. A review of biomass burning: emissions and impacts on air quality, health and climate in China[J]. Science of the Total Environment, 2017, 579: 1000-1034. DOI:10.1016/j.scitotenv.2016.11.025 |
 2020, Vol. 47
2020, Vol. 47




