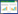扩展功能
文章信息
- 胡林杰, 孟野, 周玉龙, 贾伟强, 翟海瑞, 武瑞, 侯喜林
- HU Lin-Jie, MENG Ye, ZHOU Yu-Long, JIA Wei-Qiang, ZHAI Hai-Rui, WU Rui, HOU Xi-Ling
- 检测牛冠状病毒抗体间接ELISA方法的建立与应用
- Establishment and application of indirect ELISA for detection of bovine coronavirus antibody
- 微生物学通报, 2020, 47(1): 330-338
- Microbiology China, 2020, 47(1): 330-338
- DOI: 10.13344/j.microbiol.china.190422
-
文章历史
- 收稿日期: 2019-05-14
- 接受日期: 2019-09-04
- 网络首发日期: 2019-09-27
牛冠状病毒(Bovine coronavirus,BCoV)属于套式病毒目(Nidovirales)冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus),是具有多形性、有囊膜、单股正链的RNA病毒[1]。BCoV是引起牛呼吸道感染、新生犊牛腹泻和成年牛冬痢的主要病原[2]。从1972年起,BCoV已被多个国家报道,该病呈世界性分布,不仅影响奶牛产奶性能,而且病愈后的犊牛生长、发育和生产性能都会受到影响。BCoV主要经由消化道和呼吸道两种途径传播,感染牛会在特定时间排毒来感染牛群[3]。
BCoV粒子共有5种主要结构蛋白,分别是囊膜蛋白M、核衣壳蛋白N、纤突蛋白S、小膜蛋白E和血凝脂酶糖蛋白HE[4]。核衣壳蛋白(N)含有3个结构域,是一种碱性磷蛋白,具有高度保守性的抗原,在冠状病毒RNA合成中发挥作用,多用于BCoV的早期诊断[5]。牛冠状病毒的检测方法有很多,包括透射电子显微镜、间接免疫荧光、血凝试验、RT-PCR和RT-qPCR等,虽然前几种方法可以对BCoV进行早期诊断,但费时且成本高昂,对操作人员要求较高,不适于牛场大规模检疫[6-9]。ELISA方法操作简便,不需要特殊仪器设备,适合于血清学流行病学调查。本研究前期建立的ELISA方法所使用的重组N蛋白抗原以包涵体形式表达,通过电洗脱变性条件下纯化得到,其作为ELISA抗原存在用量大、敏感性低和亲和力弱等不足。本研究通过对上述方法进行改进,使用经DNAStar软件预测的免疫原性较好的N蛋白抗原表位作为抗原,经基因工程方法获得可溶性重组蛋白,采用镍柱天然条件下纯化得到亲和力较好的活性蛋白,容易与抗体结合,建立的方法敏感性更高、稳定性更好,可进一步装配成稳定的ELISA诊断试剂盒,进一步丰富了BCoV检测技术,为BCoV实验室诊断和流行病学调查提供了技术保障,为防控BCoV提供了有效的检测手段。
1 材料与方法 1.1 材料 1.1.1 病毒及阳性血清BCoV-CD分离毒株由本实验室分离鉴定及保存[10];标准阴性血清、标准阳性血清、牛副流感3型(BPIV3)、牛轮状病毒(BRV)、牛呼吸道合胞体病毒(BRSV)、牛传染性鼻气管炎病毒(IBRV)、牛病毒性腹泻-粘膜病(BVDV)、大肠杆菌(E. coli)阳性血清均由黑龙江八一农垦大学传染病研究室制备保存[1, 11-15]。
1.1.2 主要试剂和仪器ELISA板购自Costar有限公司;脱脂乳购自BD公司;SDS-PAGE凝胶制备试剂盒购自索莱宝公司;TMB显色液及其它试剂均为国产分析纯。PCR仪、半干转膜仪、全自动凝胶成像系统和酶标仪均为Bio-Rad产品。
1.1.3 引物设计与合成利用DNAStar软件对BCoV-CD毒株n基因抗原表位进行预测,使用Premier 5.0软件设计n基因扩增引物,引物两端引入Sal I和BamH I酶切位点,具体序列:F:5′-GGATCCGATCAGTCCGACC AATCTAG-3′;R:5′-GTCGACAGGGCTCATCCAT CTTCTTA-3′。
1.1.4 临床检测样本临床样本是本实验室2007-2017年收集并保存的牛血清,具体信息见表 1。
| Area | Quantity |
| 哈尔滨Harbin | 30 |
| 齐齐哈尔Qiqihar | 90 |
| 鸡西Jixi | 50 |
| 鹤岗Hegang | 30 |
| 双鸭山Shuangyashan | 30 |
| 大庆Daqing | 60 |
| 伊春Yichun | 71 |
| 佳木斯Jiamusi | 62 |
| 七台河Qitaihe | 30 |
| 牡丹江Mudanjiang | 60 |
| 黑河Heihe | 60 |
| 绥化Suihua | 30 |
以BCoV-CD分离毒株的cDNA为模板,通过PCR使用n基因扩增引物扩增目的片段,PCR反应体系(25 μL):Quick Taq HS DyeMix (2×) 12.5 μL,上、下游引物各(12.5 μmol/L) 1 μL,cDNA 2.0 μL,ddH2O 8.5 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 50 s,56 ℃ 50 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。目的片段为1 241 bp,构建出pMD18-T-N质粒,将阳性质粒与pET-32a(+)表达载体同时用BamH I和Sal I进行双酶切,凝胶回收基因和线性化的pET-32a载体,利用T4 DNA酶连接后转化至大肠杆菌BL21(DE3)感受态细胞中进行诱导表达鉴定。将表达的重组菌超声破碎,300 V每次超声10 s,超声6次后取裂解的菌液通过SDS-PAGE电泳进行可溶性分析。
1.2.2 重组蛋白的鉴定及纯化以Anti-His-Tag单克隆抗体为一抗,对表达的重组蛋白进行Western blotting鉴定。按照CTB His-Binding-resin镍柱说明书在非变性条件下进行重组蛋白纯化。
1.3 BCoV间接ELISA条件优化 1.3.1 抗原包被条件及样品稀释浓度的优化包被抗原时,选择50 mmol/L pH 9.6的碳酸盐缓冲液(CBS)、50 mmol/L pH 7.6的Tris盐酸缓冲液(TBS)、10 mmol/L pH 7.6的磷酸盐缓冲液(PBS)作为包被液,采用2.5、5.0、7.5和10.0 μg/mL的抗原浓度包被,选择37 ℃包被(1.0 h和2.0 h)、4 ℃过夜、37 ℃包被(1.0 h和2.0 h)后4 ℃过夜等5个条件进行包被,BCoV标准阳性血清、阴性血清按照1:50、1:100、1:200进行稀释,每组做4次重复。
1.3.2 二抗及血清反应条件的优化分别采用5%脱脂乳、1% BSA、PBS、1% BSA+5%犊牛血清、PBST对标准阳性、阴性血清进行稀释。将HRP标记羊抗牛IgG按照1:2 500、1:5 000、1:7 500、1:10 000的浓度进行稀释。选取1%明胶、5%明胶、5%脱脂乳、1% BSA、10%犊牛血清作为封闭液,每组做4次重复。
1.4 阴阳性临界值的确定采用优化的间接ELISA方法对24份经病毒中和试验检测过的BCoV阴性血清进行检测,每份血清样品均多次重复检测,测其OD450,通过公式计算阳性和阴性的临界值,临界值=X+3SD,当待检样品的OD450 > X+3SD时,判定为阳性;当待检样品的OD450 < X+3SD时,判定为阴性;当待检样品的OD450=X+3SD时,判定为可疑[10]。
1.5 交叉反应、符合率、重复性试验 1.5.1 交叉反应试验采用优化的间接ELISA方法检测对本实验室保存的BRSV、BRV、IBRV、BPIV3、BVDV和E. coli等6种阳性血清进行检测,每个样品进行4次重复,同时设BCoV标准阳性血清、阴性血清和空白对照孔,确定该方法是否存在交叉反应。
1.5.2 符合率试验利用病毒中和试验[11]和建立的间接ELISA方法对40份疑似BCoV感染的牛血清样品进行检测。根据OD450值判定样品阴阳性,确定该方法与病毒中和试验的符合率。
1.5.3 重复性试验随机挑选5个样品进行批内和批间重复试验,计算每份样本的平均值(X)、标准差(SD)和变异系数(CV)。
1.6 黑龙江省BCoV血清流行病学调查结果采用间接ELISA方法对2010-2017年间黑龙江省不同地区603份牛血清进行检测,调查其血清阳性率。
2 结果与分析 2.1 BCoV N蛋白原核表达载体的构建和表达构建的pMD18-T-N质粒经Sal I和BamH I双酶切后,经1%凝胶电泳出现1 241 bp和2 692 bp基因,与预期目的基因片段大小一致,见图 1A。重组表达载体质粒pET-32a-N用Sal I和BamH I进行双酶切鉴定,结果显示在1 241 bp和5 900 bp处出现条带,分别与载体和目的条带大小一致,说明表达质粒构建成功,如图 1B所示。对重组菌的菌液上清和菌体沉淀做SDS-PAGE凝胶分析,结果菌液上清和沉淀当中都出现了大小约为66 kD目的条带,表明该融合蛋白存在可溶性表达,见图 1C。
|
| 图 1 BCoV N蛋白的重组表达 Figure 1 Recombinant expression of BCoV N protein 注:A:pMD18-T-N克隆载体双酶切鉴定;M1:DL2000 DNA Marker;1:BamH I+Sal I双酶切产物,2 692 bp/1 241 bp;2:重组质粒对照. B:pET-32a-N表达载体双酶切鉴定;M1:DL10000 DNA Marker;1:BamH I+Sal I双酶切产物,5 900 bp/1 241 bp;2:重组质粒对照组;M2:DL2000 DNA Marker. C:重组N蛋白SDS-PAGE鉴定及可溶性分析;M:低相对分子质量蛋白Marker;1:未诱导的pET-32a-N;2:沉淀;3:上清. Note: A: Identification of pMD18-T-N Clone Vector by double Enzymatic digestion; M1: DL2000 DNA Marker; 1: BamH I+Sal I double digestion product, 2 692 bp/1 241 bp; 2: Plasmid control; M2: DL10000 DNA Marker. B: Identification of pET-32a-N expression vector by double enzymatic digestion; M1: DL10000 DNA Marker; 1: BamH I+Sal I double digestion product; 2: Plasmid control; M2: DL2000 DNA Marker. C: Identification and soluble analysis of recombinant N protein by SDS-PAGE; M: Low molecular weight protein marker; 1: Uninduced pET-32a-N; 2: Precipitate; 3: Supernatant. |
|
|
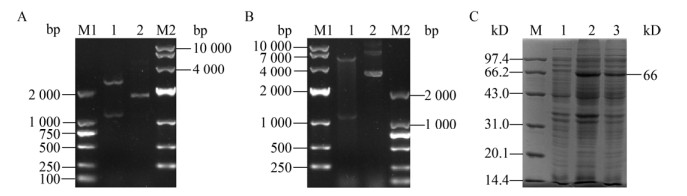
Western blotting结果显示重组菌在约66 kD处有特异性免疫印迹,而空载体对照未出现,见图 2A,结果表明BCoV N蛋白在大肠杆菌中融合表达。通过镍柱在自然条件下获得了较纯的重组蛋白,咪唑浓度为200 mmol/L时洗脱效果最佳,见图 2B。
|
| 图 2 重组蛋白的鉴定及纯化结果 Figure 2 The results of identification and purification of recombinant protein 注:A:Western blotting鉴定结果;M:低相对分子质量蛋白Marker;1、2:诱导的pET-32a-N重组菌;3:pET-32a空载体对照. B:重组N蛋白纯化结果;M:低相对分子质量蛋白Marker;1:菌液沉淀;2:菌液上清;3-8:咪唑浓度分别为20、50、100、150、200、250 mmol/L. Note: A: Western blotting identification of recombinant N protein; M: Low molecular weight protein marker; 1, 2: Induced recombinant E. coli including pET-32a-N; 3: Negative control. B: Purification of recombinant N protein; M: Low molecular weight protein marker; 1: Precipitate; 2: Supernatant; 3-8: Imidazole concentration of 20 mmol/L, 50 mmol/L, 100 mmol/L, 150 mmol/L, 200 mmol/L, 250 mmol/L. |
|
|
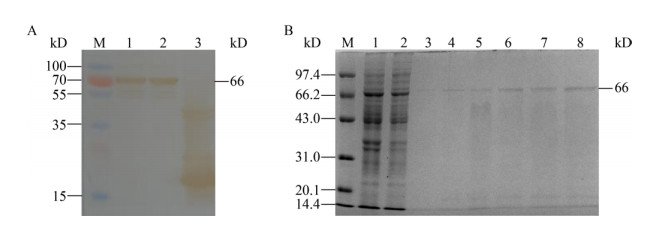
由图 3A和3B可知选取碳酸盐(CBS)缓冲液作为包被液,在37 ℃包被1.0 h时,P/N值最大,包被效果最好。由图 3C和3D可知,当抗原包被浓度为2.5 μg/mL效果最好,样品进行1:50稀释时P/N值最大,样品稀释效果最佳。
|
| 图 3 抗原包被条件及样品稀释浓度的优化结果 Figure 3 The results of optimal conditions of antigen coating and sample dilution concentration 注:A:包被缓冲液优化;B:包被条件优化(B1-B5表示包被条件分别为37 ℃ 1 h,37 ℃ 2 h,4 ℃过夜,37 ℃ 1 h 4℃过夜,37 ℃ 2 h 4 ℃过夜);C:抗原包被浓度优化(μg/mL);D:样品的稀释浓度优化. Note: A: Optimization of coating buffer; B: Optimization of coating conditions (B1-B5 indicates that the coating conditions are 37 ℃ 1 h, 37 ℃ 2 h, 4 ℃ overnight, 37 ℃ 1 h 4 ℃ overnight, 37 ℃ 2 h 4 ℃ overnight); C: Optimization of the antigen coating concentration (μg/mL); D: Optimization of sample dilution concentration. |
|
|
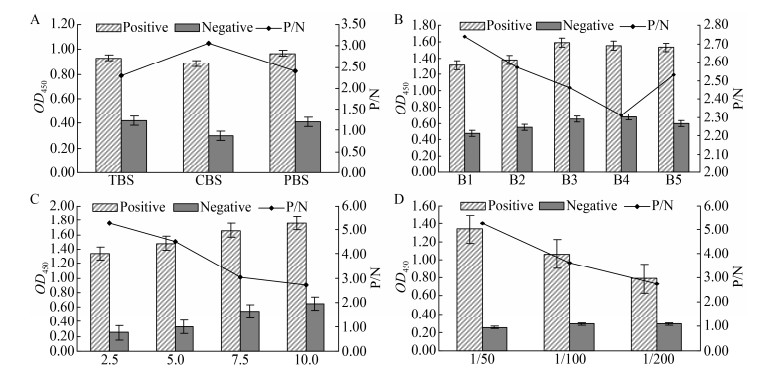
由图 4可知,当HRP标记羊抗牛IgG稀释度为1:7 500,封闭条件为1%明胶封闭0.5 h,样本稀释液选择PBST时,P/N值最高,ELISA反应效果最佳。

|
| 图 4 二抗浓度、封闭条件及样本稀释液的优化结果 Figure 4 Optimization of concentration of horseradish peroxidase labeled second antibody, blocking conditions and sample diluent 注:A:HRP标记羊抗牛IgG稀释度优化;B:封闭液优化(B1-B5分别表示包被液种类为1%明胶、5%明胶、5%脱脂乳、1% BSA、10%犊牛血清);C:封闭时间优化;D:样品稀释液的优化(D1-D5分别表示的稀释液为5%脱脂乳、1% BSA、PBS、1% BSA+5%血清、PBST). Note : A: Optimization of dilution of Sheep Anti-Bovine IgG with HRP marker; B: Optimization of the type of blocking solution (B1-B5 indicates that the types of coating solution are 1% gelatin, 5% gelatin, 5% skim milk, 1% BSA, 10% calf serum, respectively); C: Optimization of blocking time optimization; D: Optimization of the type of sample diluent (D1–D5 indicates that the diluents are 5% skim milk, 1% BSA, PBS, 1% BSA and 5% serum, PBST). |
|
|
24份BCoV阴性血清样品OD450平均值为0.168,标准差为0.019,根据公式计算阴阳临界值X+3SD=0.225。因此待检样品OD450 > 0.225为阳性,待检样品OD450 < 0.225时为阴性,待检样品OD450=0.225为可疑。
2.5 交叉反应、重复性、符合率试验 2.5.1 交叉反应试验采用优化的间接ELISA方法对实验室保存的BCoV、BRV、BRSV、BVDV、IBRV、BPIV3和E. coli的阳性血清进行检测,结果表明建立的检测方法与BRV、BRSV、BVDV、IBRV、BPIV3和E. coli抗体无交叉反应,特异性良好,见表 2。
| Sample | OD450 | P/N | Result |
| BCoV | 1.134 | 5.040 | + |
| BRSV | 0.162 | 0.720 | - |
| BRV | 0.153 | 0.680 | - |
| BPIV3 | 0.143 | 0.636 | - |
| BVDV | 0.147 | 0.653 | - |
| IBRV | 0.179 | 0.796 | - |
| E. coli | 0.168 | 0.747 | - |
| Note: +: Positive; -: Negative. | |||
随机挑选5个样品进行批内和批间重复试验,批内最大的变异系数为8.97%,批间重复的最大变异系数为4.24%,均小于10%,说明建立的检测方法重复性良好,结果见表 3。
| Sample | Inter-batch repetition | Intra-batch repetition | |||
| X+SD | CV (%) | X+SD | CV (%) | ||
| 1 | 0.427+0.018 | 4.24 | 0.398+0.025 | 6.38 | |
| 2 | 0.090+0.004 | 4.22 | 0.088+0.008 | 8.97 | |
| 3 | 1.336+0.049 | 3.64 | 1.287+0.400 | 3.10 | |
| 4 | 1.193+0.049 | 4.10 | 1.168+0.037 | 3.18 | |
| 5 | 1.294+0.031 | 2.42 | 1.211+0.054 | 4.49 | |
应用病毒中和试验和建立的间接ELISA方法分别对40份疑似BCoV感染的牛血清样品进行检测。在病毒中和试验中,31份样品被确定为中和抗体阳性;在间接ELISA方法中29份样品被确定为阳性,结果见表 4。
| Virus neutralization test | Indirect ELISA method | ||
| + | - | Total | |
| + | 29 | 2 | 31 |
| - | 0 | 9 | 9 |
| Total | 29 | 11 | 40 |
| Sensitivity (%) | 93.5 (29/31) | ||
| Specificity (%) | 100 (9/9) | ||
| Coincidence rate (%) | 95 (38/40) | ||
| Note: +: Positive; -: Negative. | |||
采用优化好的间接ELISA方法对黑龙江省603份待检血清进行检测,结果为596份阳性血清,7份阴性血清,BCoV的阳性率为98.84%。各地区的阳性率分别为齐齐哈尔97.78%,鸡西98%,大庆98.83%,牡丹江96.67%,绥化96.67%,其余地区的阳性率都为100%。
3 讨论与结论腹泻是新生犊牛最严重的疾病之一,腹泻发生率随年龄的增长而下降,1月龄以内的犊牛发生腹泻的风险最大。BRV、BCoV、产肠毒素性大肠杆菌(K99)和隐孢子虫等是引起犊牛腹泻的主要病原[16-18]。BRV和BCoV在世界各国的牛群中广泛传播,而BCoV的发生频率往往高于BRV[5, 19-20]。对于BCoV的检测方法有很多,但是大多不适合大量样本的快速检测,而ELISA方法可以弥补上述缺陷。
本研究利用当地分离的流行毒株BCoV-CD基因组为模板扩增得到n基因,通过原核表达获得可溶性蛋白作为ELISA抗原,建立的方法更适合于当前国内BCoV感染的流行病学调查。本试验建立的间接ELISA方法与常见的牛腹泻病原BRV、BVDV和大肠杆菌等阳性血清无交叉反应,而且与病毒中和试验符合率达到95%,说明本方法可以用于临床诊断。采用本试验建立的间接ELISA方法,对603份实验室采集并保存的牛血清进行检测,并完善黑龙江省BCoV流行病学调查,结果表明,BCoV血清阳性率高达98.84%,个别地区阳性率可达100%。比以前刘合义等检测的阳性率65.23%明显升高[10],可能由于当前集约化养殖程度提高,饲养密度加大,使BCoV传染的风险增加[10, 16]。BCoV感染成年牛导致“冬痢”,该病传播速度非常快,在几天内可波及全群或整个地区。最近研究表明,BCoV能够引起持续感染,感染牛长期带毒和连续排毒,造成该病毒在牛群中长期存在[21]。
本试验建立的间接ELISA方法不仅原料易于获得,而且成本低廉,所建方法特异性强、敏感性高、稳定性好,利于装配成检测试剂盒,更适合于基层单位推广使用。然而该方法还需要通过对大量临床样本的检测和验证来进一步完善,并组装成快速检测试剂盒,为我国养牛业健康发展提供技术保障。
| [1] |
Gao GQ, Wang MX, Liu MM, et al. Sequence analysis and prokaryotic expression of bovine coronavirus S gene[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(7): 1740-1749. (in Chinese) 高国强, 王梦心, 刘明明, 等. 牛冠状病毒S基因的序列分析及原核表达[J]. 中国畜牧兽医, 2018, 45(7): 1740-1749. |
| [2] |
Alenius S, Niskanen R, Juntti N, et al. Bovine coronavirus as the causative agent of winter dysentery: serological evidence[J]. Acta Veterinaria Scandinavica, 1991, 32(2): 163-170. |
| [3] |
Lu YD, Liu XX, Chen CF. Prokaryotic expression and identification of bovine coronavirus nucleocapsid protein[J]. Xinjiang Agricultural Sciences, 2018, 55(6): 1154-1165. (in Chinese) 陆亚冬, 刘贤侠, 陈创夫. 牛冠状病毒核衣壳蛋白原核表达及鉴定[J]. 新疆农业科学, 2018, 55(6): 1154-1165. |
| [4] |
Cao Y. Establishment and Application of BRV and BCoV SYBR Green I RT-qPCR Detection method[D]. Daqing: Master's Thesis of Heilongjiang Bayi Agricultural University, 2018 (in Chinese) 曹禹. BRV与BCoV SYBR Green I RT-qPCR检测方法的建立及应用[D].大庆: 黑龙江八一农垦大学硕士学位论文, 2018 |
| [5] |
Nemoto M, Kanno T, Bannai H, et al. Antibody response to equine coronavirus in horses inoculated with a bovine coronavirus vaccine[J]. Journal of Veterinary Medical Science, 2017, 79(11): 1889-1891. |
| [6] |
Gomez DE, Arroyo LG, Poljak Z, et al. Detection of bovine coronavirus in healthy and diarrheic dairy calves[J]. Journal of Veterinary Internal Medicine, 2017, 31(6): 1884-1891. |
| [7] |
Hou PL, Wang HM, He HB. Establishment and application of a multiple RT-PCR for detection of BVDV, BCoV and BEV[J]. Chinese Journal of Veterinary Science, 2016, 36(10): 1672-1675, 1700. (in Chinese) 侯佩莉, 王洪梅, 何洪彬. 牛病毒性腹泻病毒、牛冠状病毒和牛肠道病毒多重RT-PCR检测方法的建立及初步应用[J]. 中国兽医学报, 2016, 36(10): 1672-1675, 1700. |
| [8] |
Sun LX, Zhu PJ, Li WH, et al. Research development of bovine coronavirus detection methods[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2014(5): 20-22. (in Chinese) 孙留霞, 朱平军, 李文华, 等. 牛冠状病毒检测方法的研究进展[J]. 上海畜牧兽医通讯, 2014(5): 20-22. |
| [9] |
Shen FY. Development and application of a SYBR Green I real-time PCR assay for detection of bovine coronavirus[D]. Jinan: Master's Thesis of Shandong Normal University, 2015 (in Chinese) 沈付娆.牛冠状病毒实时荧光定量PCR检测方法的建立及应用[D].济南: 山东师范大学硕士学位论文, 2015 |
| [10] |
Liu HY, Sun LX, Wang JY, et al. Development of an indirect ELISA for the detection of Bovine coronavirus using recombinant N protein[J]. Chinese Journal of Preventive Veterinary Medicine, 2009, 31(8): 618-622. (in Chinese) 刘合义, 孙留霞, 王进轶, 等. 牛冠状病毒重组N蛋白间接ELISA检测方法的建立[J]. 中国预防兽医学报, 2009, 31(8): 618-622. |
| [11] |
Xie JX, Hou XL, Dong HX, et al. The isolation and its genotype identification of neonatal bovine rotavirus[J]. Journal of Heilongjiang Bayi Agricultural University, 2010, 22(5): 56-59. (in Chinese) 谢金鑫, 侯喜林, 董华兴, 等. 新生牛轮状病毒的分离及其基因型鉴定[J]. 黑龙江八一农垦大学学报, 2010, 22(5): 56-59. |
| [12] |
Hou MR, Gao JF, Zhou QM, et al. A summary of the detection techniques for bovine rotaviruses[J]. China Herbivore Science, 2013, 33(2): 63-66. (in Chinese) 侯美如, 高俊峰, 周庆民, 等. 牛轮状病毒诊断方法研究进展[J]. 中国草食动物科学, 2013, 33(2): 63-66. |
| [13] |
Zhou YL, Wu HT, Ren YC, et al. Isolation and identification of bovine parainfluenza virus type 3 and the growth and decline antibody titer of the infected dairy cattle[J]. Chinese Journal of Zoonoses, 2011, 27(1): 23-28. (in Chinese) 周玉龙, 吴海涛, 任亚超, 等. 牛副流感病毒3型的分离鉴定及感染牛抗体消长规律的研究[J]. 中国人兽共患病学报, 2011, 27(1): 23-28. |
| [14] |
Zhou YL, Wu DD, Zhou JL, et al. Establishment of multiple PCR detection method of bovine respiratory disease complex[J]. Journal of Heilongjiang Bayi Agricultural University, 2016, 28(6): 97-101. (in Chinese) 周玉龙, 吴丹丹, 周金玲, 等. 牛呼吸道综合症多重PCR检测方法的建立[J]. 黑龙江八一农垦大学学报, 2016, 28(6): 97-101. |
| [15] |
Zhang GH, Wu DD, Zhou YL, et al. Isolation and identification of bovine viral diarrhea virus from Heilongjiang province[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(10): 805-807. (in Chinese) 张国华, 吴丹丹, 周玉龙, 等. 牛病毒性腹泻病毒黑龙江分离株的分离鉴定[J]. 中国预防兽医学报, 2015, 37(10): 805-807. |
| [16] |
Hu CW, Jia Z, Jian ZY, et al. Epidemiological investigation of coronavirus in three northeastern provinces[J]. Heilongjiang Animal Science and Veterinary Medicine, 2006(12): 88-89. (in Chinese) 胡传伟, 贾赞, 简中友, 等. 东北三省冠状病毒流行病学调查[J]. 黑龙江畜牧兽医, 2006(12): 88-89. |
| [17] |
Alkan F, Timurkan MÖ, Karayel I. The molecular characterization and detection of Group A rotavirus from calves with diarrhea in Turkish Republic of Northern Cyprus[J]. Kafkas Üniversitesi Veteriner Fakültesi Dergisi, 2015, 21(1): 127-130. |
| [18] |
Lee SH, Vanbik D, Kim HY, et al. Multilocus typing of Cryptosporidium spp. in young calves with diarrhea in Korea[J]. Veterinary Parasitology, 2016, 229: 81-89. |
| [19] |
Beuttemmuller EA, Alfieri AF, Headley SA, et al. Brazilian strain of bovine respiratory coronavirus is derived from dual enteric and respiratory tropism[J]. Genetics and Molecular Research, 2017, 16(2): gmr16029580. |
| [20] |
Jia WQ, Hu LJ, Meng Y, et al. Molecular epidemiology of bovine rotavirus infections in some areas of Daqing City of Heilongjiang province[J]. Animal Husbandry and Feed Science, 2019, 40(5): 107-108, 112. (in Chinese) 贾伟强, 胡林杰, 孟野, 等. 黑龙江省大庆市部分地区牛轮状病毒腹泻的分子流行病学调查[J]. 畜牧与饲料科学, 2019, 40(5): 107-108, 112. |
| [21] |
Kanno T, Ishihara R, Hatama S, et al. A long-term animal experiment indicating persistent infection of bovine coronavirus in cattle[J]. Journal of Veterinary Medical Science, 2018, 80(7): 1134-1137. |
 2020, Vol. 47
2020, Vol. 47