扩展功能
文章信息
- 连拯民, 田明星, 尹伊, 石文弢, 包世俊, 于圣青
- LIAN Zheng-Min, TIAN Ming-Xing, YIN Yi, SHI Wen-Tao, BAO Shi-Jun, YU Sheng-Qing
- 一种基于NanoLuc荧光素酶报告布鲁菌基因启动子活性质粒的构建及应用
- Construction and application of a novel plasmid for promoter activity determination of Brucella genes base on NanoLuc luciferase
- 微生物学通报, 2020, 47(1): 322-329
- Microbiology China, 2020, 47(1): 322-329
- DOI: 10.13344/j.microbiol.china.190141
-
文章历史
- 收稿日期: 2019-02-27
- 接受日期: 2019-04-11
- 网络首发日期: 2019-05-20
2. 中国农业科学院上海兽医研究所 上海 200241;
3. 扬州大学兽医学院 江苏 扬州 225009
2. Shanghai Veterinary Research Institute, Chinese Academy of Agriculture Sciences (CAAS), Shanghai 200241, China;
3. College of Veterinary Medicine, Yangzhou University, Yangzhou, Jiangsu 225009, China
布鲁菌病是由布鲁菌感染引起的一种呈全球性分布的重要的人兽共患细菌性传染病[1],主要引起公畜生殖障碍和孕畜流产[2],人类主要通过接触患病动物或食用带有病原菌的食物感染,该病对畜牧业发展和人类健康构成巨大的威胁[1, 3]。布鲁菌是一种革兰氏阴性短杆菌,兼性胞内寄生,主要侵袭巨噬细胞、树突状细胞、上皮细胞以及胎盘滋养层细胞等[4]。布鲁菌毒力基因的鉴定,对于阐明布鲁菌入侵宿主细胞,并在胞内建立慢性感染的分子机制具有重要意义。启动子作为启动基因转录和表达的重要结构,在启动布鲁菌毒力基因转录过程中发挥重要作用,毒力基因在特定条件下的转录和表达可通过测定其启动子的活性来进行监测和定量分析。gfp和lacZ是常被用来测定基因启动子活性的报告基因[5-6],但它们对弱启动子的报告活性不灵敏,精确度不高,对设备仪器要求高,测定方法复杂。因此,构建一种可以更精确简便地报告布鲁菌基因启动子活性的质粒,对于布鲁菌致病机制的研究具有重要意义。
NanoLuc荧光素酶(Nluc)是一种来自深海虾Oplophorus gracilirostris并经基因工程改造的新型发光系统,具有分子量小、灵敏度高、发光持续时间长、物理性质稳定、不依赖ATP等特点[7]。相较于萤火虫荧光素酶(Fluc)、海肾荧光素酶(Rluc)等传统的荧光素酶,Nluc具有更强的酶活性,且Nluc以更加稳定的新型腔肠素衍生物为底物,可维持更长时间、更加稳定的发光,可精确测定其发光值[7]。Nluc在哺乳动物细胞中的表达不需要翻译后修饰[7],因此,作为报告基因检测布鲁菌启动子活性具有较大的应用潜力。
1 材料与方法 1.1 主要材料流产布鲁菌S2308株购自中国兽医药品监察所;pBBR1MCS质粒由Kovach ME博士惠赠;胰蛋白胨大豆肉汤培养基(TSA、TSB)购自BD公司;细菌基因组DNA提取试剂盒、大肠杆菌(Escherichia coli,E. coli) DH5α和BL21(DE3)感受态细胞、质粒快速小提试剂盒和胶回收试剂盒均购自北京天根生化科技有限公司;PrimeSTAR® Max DNA聚合酶及限制性内切酶购自TaKaRa公司;ClonExpressTM快速克隆试剂盒购自诺唯赞生物科技有限公司;pET-28a(+)质粒购自Novagen公司;BeaverBeads- His-Tag蛋白纯化试剂盒购自海狸生物科技有限公司;B-PER-细菌蛋白质提取试剂购自Thermo Fisher Scientific公司;新西兰兔购自上海市松江区松联实验动物场;小鼠单核巨噬细胞系RAW264.7购自中国科学院细胞库;pNL1.1质粒和Nano-Glo-荧光素酶检测试剂盒购自Promega公司。PCR引物序列见表 1,由睿勉基因合成有限公司合成。
| 引物名称 Primers name |
引物序列 Primers sequence (5′→3′) |
| eNluc-F | AGCAAATGGGTCGCGGATCCATGGTCTTCACACTCGAAGA |
| eNluc-R | TGGTGGTGGTGGTGCTCGAGTTACGCCAGAATGCGTTCGC |
| pBBR1-F | TTAATGAATCGGCCAACGCG |
| pBBR1-R | CAATTCGCCCTATAGTGAGT |
| Nluc-F | TGGCCGATTCATTAAGTCTTCACACTCGAAGATTTC |
| Nluc-R | CTATAGGGCGAATTGTTACGCCAGAATGCGTTCGC |
| pNluc-R | GTCTTCACACTCGAAGATTTC |
| Bcsp31-F | TGGCCGATTCATTAAGAAACCCGACTATGCCATTC |
| Bcsp31-R | TTCGAGTGTGAAGACCATAATACCAGTCCTCTTCCCGC |
| VirB-F | TGGCCGATTCATTAAATGACAGGCATATTTCAACGCGAC |
| VirB-R | TTCGAGTGTGAAGACCACCATAGGATCGTCTCCTTCTC |
PCR仪购自ABI公司;生物安全柜购自Labconco公司;CO2培养箱购自Thermo Fisher公司;化学发光检测仪购自Eppendorf公司。
1.2 方法 1.2.1 nluc基因克隆表达和蛋白纯化以pNL1.1质粒为模板,使用eNluc-F/R为引物PCR扩增获得nluc基因片段,胶回收纯化PCR产物。用限制性内切酶BamHⅠ和XhoⅠ酶切pET-28a(+)质粒,胶回收纯化酶切产物。通过同源重组方法,将纯化的nluc基因片段与线性化的pET-28a(+)连接,连接产物转化大肠杆菌DH5α感受态细胞。
测序分析重组质粒,鉴定正确的重组质粒命名为pET-Nluc,随后将该质粒转化至大肠杆菌BL21(DE3)感受态细胞,重组菌经IPTG (终浓度为50 mg/L)进行诱导表达,收集菌体沉淀,超声破碎20 min (功率300 W,工作5 s,间歇5 s),8 000 r/min离心10 min,分离沉淀和上清,经SDS-PAGE凝胶电泳分析后,通过BeaverBeads- His-Tag蛋白纯化试剂盒从上清中纯化Nluc蛋白,BCA蛋白浓度测定试剂盒测定纯化蛋白浓度,分装保存于−80 ℃超低温冰箱备用。
1.2.2 多克隆抗体制备及ELISA效价测定将纯化蛋白与弗氏佐剂等体积混合乳化后,按照1 mg/只免疫新西兰大白兔,首次免疫用弗氏完全佐剂,免疫后间隔两周使用弗氏不完全佐剂加强免疫2次(1 mg/只)。第3次免疫1周后,耳缘静脉采血,分离血清检测其效价。
以纯化蛋白为抗原,1 μg/孔包被96孔板,经5%脱脂乳封闭,以梯度稀释的兔血清为一抗,HRP (辣根过氧化物酶)标记的羊抗兔抗体为二抗,反应后加入TMB (3, 3ʹ, 5, 5ʹ-四甲基联苯胺)显色液显色,用2 mol/L硫酸终止反应,酶标仪检测A450值。试验设阴性对照(兔阴性血清)和空白对照(PBST),P/N≥2.1判为阳性,否则为阴性。效价检测合格后,大量分离兔血清,分装保存于–80 ℃超低温冰箱备用。
1.2.3 质粒的构建以pBBR1MCS质粒为模板,使用pBBR1-F/R为引物PCR扩增制备线性化的pBBR1MCS质粒;以pNL1.1质粒为模板,使用Nluc-F/R为引物,PCR扩增nluc基因片段(不含起始密码子ATG),同源重组试剂盒连接nluc基因片段和线性化的pBBR1MCS质粒,连接产物转化至大肠杆菌DH5α感受态细胞,构建用于报告布鲁菌基因启动子活性的质粒,鉴定正确的质粒命名为pNluc。
为验证pNluc质粒报告布鲁菌基因启动子活性的能力,将bcsp31和virB基因的启动子克隆至pNluc质粒中,具体方法为:以pNluc质粒为模板,使用pBBR1-F/pNluc-R为引物,PCR扩增后切胶回收制备线性化的pNluc质粒;以流产布鲁菌S2308基因组为模板,使用Bcsp31-F/R和VirB-F/R为引物,PCR扩增bcsp31和virB基因启动子片段,通过同源重组试剂盒连接胶回收产物和线性化的pNluc质粒,构建pBcsp31-Nluc和pVirB-Nluc质粒。
1.2.4 布鲁菌重组菌株的构建流产布鲁菌S2308接入TSB培养基中,37 ℃、200 r/min培养至对数生长前期(OD600为0.6−0.8),冰浴15 min,8 000 r/min离心2 min收集菌体沉淀,预冷的无菌去离子水洗涤菌体2次,加入无菌的10%甘油重悬菌体沉淀。分别加入2 μg的pNluc、pBcsp31-Nluc和pVirB-Nluc质粒,冰浴10 min,2.4 kV、400 Ω条件下将质粒电转化至S2308菌株中,涂布含氯霉素(20 mg/L)的TSA平板筛选阳性克隆,构建S2308 (Nluc)、S2308 (Bcsp31-Nluc)和S2308 (VirB-Nluc)重组菌株,鉴定正确后,保存菌种备用。
1.2.5 免疫印迹分析纯化蛋白用PBS稀释至1 mg/mL,制备样品进行SDS-PAGE凝胶电泳后,转印至硝酸纤维膜,并用5%脱脂乳封闭,用制备的抗Nluc兔血清为一抗、HRP标记的山羊抗兔IgG为二抗分别孵育后,通过ECL底物显色液进行显色。
复苏S2308、S2308(Bcsp31-Nluc)和S2308(VirB-Nluc)菌株,于TSB培养基中37 ℃、200 r/min培养至对数期,各取1 mL菌液,离心收集菌体沉淀,制备样品进行SDS-PAGE凝胶电泳后,转印至硝酸纤维膜,并用5%脱脂乳封闭,用制备的抗Nluc兔血清为一抗、HRP标记的山羊抗兔IgG为二抗分别孵育后,通过ECL底物显色液进行显色。
1.2.6 Nluc酶活性检测复苏S2308(pNluc)、S2308(Bcsp31-Nluc)和S2308(VirB-Nluc) 3个菌株,于TSB培养基中37 ℃、200 r/min培养至对数生长前期,取适量菌液离心收集沉淀,磷酸盐缓冲液(PBS)重悬菌体沉淀,测定其OD600值,按1:1体积比加入B-PERTM细菌蛋白质提取试剂,室温孵育1 h,12 000 r/min离心10 min,收集上清,取50 μL裂解上清,通过Nano- Glo-荧光素酶检测试剂盒测定Nluc发光值。
S2308(VirB-Nluc)培养至对数生长期,离心收集沉淀,PBS重悬沉淀,10倍比稀释后涂布TSA平板,37 ℃培养72 h后计数CFU,并取适量菌液加入B-PER细菌蛋白质提取试剂,测定Nluc发光值(方法同上)。RAW264.7细胞接种于24孔板,生长至单层细胞,DMEM洗涤细胞2次,按照感染复数(细菌:细胞) 1:1 000的比例接种重组菌S2308(VirB-Nluc),400×g离心5 min,37 ℃感染1 h,PBS洗涤细胞2次,加入含有100 μg/mL庆大霉素的DMEM,37 ℃杀菌1 h,PBS洗涤细胞2次,加入含有2% FBS和20 μg/mL庆大霉素的DMEM维持细胞,于感染后2、4和8 h,加入400 μL 0.2% Triton X-100水溶裂解细胞,取100 μL裂解液10倍比稀释后涂布TSA平板,计算胞内细菌CFU[8],另取50 μL裂解液按1:1体积比加入B-PER细菌蛋白质提取试剂,室温孵育1 h,12 000 r/min离心10 min,收集上清,测定Nluc酶活性。
2 结果与分析 2.1 Nluc表达质粒的构建及蛋白纯化结果以pNL1.1质粒为模板,PCR扩增获得nluc基因片段(约500 bp,图 1),经酶切制备线性化的pET-28a(+)质粒(约5 000 bp,图 1)。连接成功的重组质粒pET-Nluc转化至大肠杆菌BL21(DE3)感受态细胞,构建重组菌株BL21(pET-Nluc)。BL21(pET-Nluc)经IPTG诱导表达,收集菌体沉淀超声破碎后,表达产物经SDS-PAGE凝胶电泳分析,结果显示目的蛋白在上清、沉淀中均有表达,大小约22 kD (图 2),使用His-Tag蛋白纯化试剂盒从上清中纯化得到Nluc蛋白(图 2)。

|
| 图 1 pET-28a(+)双酶切及PCR扩增nluc基因 Figure 1 pET-28a(+) digested by double restriction enzymes and PCR amplification of nluc gene 注:M:DL5000 DNA Marker;1:pET-28a(+)双酶切产物;2:nluc扩增产物. Note: M: DL5000 DNA Marker; 1: pET-28a(+) digested by double enzymes; 2: PCR product of nluc gene. |
|
|

|
| 图 2 Nluc蛋白表达和纯化 Figure 2 Expression and purification of Nluc protein 注:M:蛋白分子质量标准;1:IPTG诱导的BL21(pET-28a);2:IPTG诱导的BL21(pET-Nluc);3:裂解后上清;4:裂解后沉淀;5:纯化的Nluc蛋白. Note: M: Protein marker; 1: E. coli BL21(pET-28a) cells with IPTG; 2: E. coli BL21(pET-Nluc) cells with IPTG; 3: Supernatant from E. coli BL21(pET-Nluc) cells with IPTG; 4: Sediment from E. coli BL21(pET-Nluc) cells with IPTG; 5: Purified Nluc protein. |
|
|
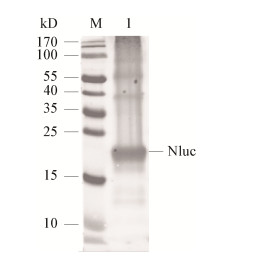
纯化蛋白混合弗氏佐剂免疫新西兰大白兔后,收集兔血清,以纯化蛋白为抗原,经ELISA测定其效价高于1:100 000。在后续试验中,通过免疫印迹试验证明制备的多克隆抗体对外源表达的融合蛋白Nluc具有较强的反应原性(图 3)。
|
| 图 3 Nluc蛋白反应原性分析 Figure 3 Reactogenicity analysis of Nluc protein 注:M:蛋白分子质量标准;1:纯化的Nluc蛋白. Note: M: Protein marker; 1: Purified Nluc protein. |
|
|
以pBBR1MCS质粒为模板,通过PCR扩增获得约4 500 bp大小的pBBR1MCS质粒片段(图 4A);以pNL1.1质粒为模板,PCR扩增获得约500 bp大小的nluc基因片段(图 4B),PCR产物与线性化的pBBR1MCS质粒片段连接,构建了重组质粒pNluc。

|
| 图 4 PCR扩增pBBR1MCS (A)和nluc基因(B) Figure 4 PCR amplification of pBBR1MCS (A) and nluc gene (B) 注:M1:DL10000 DNA Marker;M2:DL5000 DNA Marker;1:pBBR1MCS扩增产物;2:nluc基因扩增产物. Note: M1: DL10000 DNA Marker; M2: DL5000 DNA Marker; 1: PCR product of pBBR1MCS; 2: PCR product of nluc gene. |
|
|
通过PCR获得线性化的pNluc质粒,目的片段约5 000 bp (图 5),以流产布鲁菌S2308基因组为模板,PCR扩增得到bcsp31基因和virB启动子片段,大小分别为200 bp和450 bp左右(图 5),并与线性化的pNluc质粒连接,构建了pBcsp31-Nluc和pVirB-Nluc重组质粒。

|
| 图 5 PCR扩增pNluc、bcsp31基因启动子及virB启动子 Figure 5 PCR amplification of pNluc, promoters of bcsp31 gene and virB 注:M:DL5000 DNA Marker;1:pNluc扩增产物;2:bcsp31基因启动子扩增产物;3:virB启动子扩增产物. Note: M: DL5000 DNA Marker; 1: PCR product of pNluc; 2: PCR product of bcsp31 gene promoter; 3: PCR product of virB promoter. |
|
|
将pBcsp31-Nluc和pVirB-Nluc质粒电转化至流产布鲁菌野生株中,构建了重组菌株S2308 (Bcsp31-Nluc)和S2308(VirB-Nluc),以制备的抗Nluc兔血清为一抗,对S2308(Bcsp31-Nluc)和S2308(VirB-Nluc)进行免疫印迹分析, 其中野生株S2308作为阴性对照,布鲁菌的GAPDH蛋白作为内参蛋白。结果显示,在流产布鲁菌中bcsp31基因启动子和virB启动子能成功表达Nluc报告基因(图 6),野生株S2308无Nluc蛋白的表达。之后定量测定了体外培养的S2308(Nluc)、S2308(Bcsp31-Nluc)和S2308(VirB-Nluc)菌株的发光值,结果显示S2308(Bcsp31-Nluc)和S2308(VirB-Nluc)发光值显著高于S2308(Nluc) (图 7),证明pNluc质粒可以用于测定bcsp31基因和virB基因的启动子活性。

|
| 图 6 免疫印迹验证S2308(Bcsp31-Nluc)和S2308(VirB-Nluc)中Nluc的表达 Figure 6 Identification of Nluc expression in S2308(Bcsp31-Nluc) and S2308(VirB-Nluc) by western blotting Note:1: S2308(Bcsp31-Nluc); 2: S2308(VirB-Nluc); 3: S2308. |
|
|

|
| 图 7 体外培养条件下bcsp31基因启动子及virB启动子活性分析 Figure 7 Analysis of bcsp31 gene promoter and virB promoter activity in TSB Note: **: P < 0.01; ***: P < 0.001. |
|
|
为进一步探讨Nluc用于布鲁菌启动子诱导表达分析的可行性,比较分析了virB基因启动子在布鲁菌体外培养和胞内感染状态下的活性。结果显示,布鲁菌在胞内感染状态下virB启动子活性显著高于体外培养条件下的活性,且在布鲁菌感染细胞2、4和8 h时,virB启动子活性不断增强(图 8)。该结果表明pNluc质粒可以评价胞内感染条件下布鲁菌基因启动子的活性,以及启动子活性的动态变化。

|
| 图 8 virB启动子胞内诱导活性分析 Figure 8 Analysis of virB promoter activity in Brucella within RAW264.7 cells Note: ***: P < 0.001. |
|
|
Nluc荧光素酶基因是一种新型报告基因。本研究通过构建原核表达载体,成功表达并纯化得到了Nluc荧光素酶重组蛋白,将重组蛋白免疫新西兰大白兔制备获得抗Nluc多克隆抗体,为Nluc荧光素酶的进一步应用奠定了基础。通过免疫印迹验证发现nluc基因可在布鲁菌bcsp31基因启动子和virB启动子的控制下表达,预示Nluc在布鲁菌的研究中具有进一步应用的价值。
bcsp31基因编码布鲁菌的一种膜蛋白,具有表达量高、保守性高等特点,且BCSP31蛋白具有较高的免疫原性,因此可将其作为一个布鲁菌病的诊断靶标[9]。本研究通过PCR扩增bcsp31基因启动子片段构建S2308(Bcsp31-Nluc)菌株,通过测定Nluc酶活性验证pNluc质粒能否准确报告布鲁菌基因启动子活性,发现构建的pNluc质粒能高效地报告布鲁菌基因启动子的活性,为布鲁菌基因启动子活性研究提供了一种新的研究方法。virB操纵子编码布鲁菌四型分泌系统(T4SS)组分,是影响布鲁菌胞内存活的一种重要的毒力因子[10-12];布鲁菌感染巨噬细胞后,virB操纵子被迅速激活,编码的T4SS帮助布鲁菌逃逸胞内溶酶体的降解,并促进BCV小体移行至内质网建立胞内复制环境[13],virB操纵子可在巨噬细胞内被特异性诱导表达,如低pH、营养匮乏等条件[10]。本研究探讨了基于Nluc能否实时监测胞内感染条件下布鲁菌virB操纵子的活性,通过测定S2308(VirB-Nluc)菌株体外培养和感染小鼠巨噬细胞2、4和8 h的Nluc酶活性,发现在胞内感染状态下virB启动子活性明显高于体外培养条件下的活性,且感染细胞后8 h内virB启动子活性呈上升趋势,说明pNluc质粒能够准确报告体外培养和胞内感染状态下布鲁菌基因启动子活性,还可以通过动态测定的方法准确报告布鲁菌基因启动子活性的变化趋势。
布鲁菌无经典的毒力因子[14],其致病性主要表现在感染宿主细胞后的存活和繁殖能力。目前已鉴定的布鲁菌毒力相关组分有脂多糖(lipopolysaccharide,LPS)、四型分泌系统(type Ⅳsecretion system,T4SS)、双组分调控系统(two component signaling or regulatory system,TCS)等,该系列组分在布鲁菌感染宿主细胞并在宿主体内建立慢性感染过程中发挥着重要作用[15-17],鉴定布鲁菌毒力相关基因对阐明其致病机制有着重要意义。启动子作为启动基因转录和表达的重要结构,Tian等[18]通过测定β-半乳糖苷酶活性成功分析了布鲁菌新的毒力相关基因vhpA的启动子活性,间接证明vhpA基因可在布鲁菌中成功转录和表达。本研究利用新型报告基因Nluc荧光素酶基因建立了一种新的布鲁菌基因启动子活性报告系统,该报告系统可以准确报告体外培养状态和胞内感染状态下布鲁菌基因启动子的活性,以及启动子活性的变化趋势;相比于传统的lacZ报告系统,该报告系统可以更精确地检测到10 CFU布鲁菌中待测启动子的活性。因此,基于Nluc荧光素酶报告布鲁菌基因启动子活性系统的建立为鉴定布鲁菌新的毒力基因、揭示布鲁菌的致病机制奠定了基础。
| [1] |
Boschiroli ML, Foulongne V, O'callaghan D. Brucellosis: a worldwide zoonosis[J]. Current Opinion in Microbiology, 2001, 4(1): 58-64. DOI:10.1016/S1369-5274(00)00165-X |
| [2] |
Von Bargen K, Gorvel JP, Salcedo SP. Internal affairs: investigating the Brucella intracellular lifestyle[J]. FEMS Microbiology Reviews, 2012, 36(3): 533-562. DOI:10.1111/j.1574-6976.2012.00334.x |
| [3] |
Atluri VL, Xavier MN, De Jong MF, et al. Interactions of the human pathogenic Brucella species with their hosts[J]. Annual Review of Microbiology, 2011, 65: 523-541. DOI:10.1146/annurev-micro-090110-102905 |
| [4] |
Roop Ⅱ RM, Gaines JM, Anderson ES, et al. Survival of the fittest: how Brucella strains adapt to their intracellular niche in the host[J]. Medical Microbiology and Immunology, 2009, 198(4): 221-238. DOI:10.1007/s00430-009-0123-8 |
| [5] |
Ferent J, Ruat M, Traiffort E. Investigation of the proteolipid protein promoter activity during demyelination and repair[J]. Differentiation, 2013, 85(4/5): 182-189. |
| [6] |
Zhang X, Bremer H. Control of the Escherichia coli rrnB P1 promoter strength by ppGpp[J]. The Journal of Biological Chemistry, 1995, 270(19): 11181-11189. DOI:10.1074/jbc.270.19.11181 |
| [7] |
Hall MP, Unch J, Binkowski BF, et al. Engineered luciferase reporter from a deep sea shrimp utilizing a novel imidazopyrazinone substrate[J]. ACS Chemical Biology, 2012, 7(11): 1848-1857. DOI:10.1021/cb3002478 |
| [8] |
Tian MX, Bao YQ, Li P, et al. The putative amino acid ABC transporter substrate-binding protein AapJ2 is necessary for Brucella virulence at the early stage of infection in a mouse model[J]. Veterinary Research, 2018, 49: 32. DOI:10.1186/s13567-018-0527-9 |
| [9] |
Zhang L, Wu XA, Zhang FL, et al. Soluble expression and purification of Brucella cell surface protein (BCSP31) of Brucella melitensis and preparation of anti-BCSP31 monoclonal antibodies[J]. Molecular Biology Reports, 2012, 39(1): 431-438. DOI:10.1007/s11033-011-0755-9 |
| [10] |
Boschiroli ML, Ouahrani-Bettache S, Foulongne V, et al. The Brucella suis virB operon is induced intracellularly in macrophages[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(3): 1544-1549. DOI:10.1073/pnas.032514299 |
| [11] |
O'callaghan D, Cazevieille C, Allardet-Servent A, et al. A homologue of the Agrobacterium tumefaciens VirB and Bordetella pertussis Ptl type Ⅳ secretion systems is essential for intracellular survival of Brucella suis[J]. Molecular Microbiology, 1999, 33(6): 1210-1220. |
| [12] |
Sieira R, Comerci DJ, Sanchez DO, et al. A homologue of an operon required for DNA transfer in Agrobacterium is required in Brucella abortus for virulence and intracellular multiplication[J]. Journal of Bacteriology, 2000, 182(17): 4849-4855. DOI:10.1128/JB.182.17.4849-4855.2000 |
| [13] |
Celli J, De Chastellier C, Franchini DM, et al. Brucella evades macrophage killing via VirB-dependent sustained interactions with the endoplasmic reticulum[J]. The Journal of Experimental Medicine, 2003, 198(4): 545-556. DOI:10.1084/jem.20030088 |
| [14] |
Seleem MN, Boyle SM, Sriranganathan N. Brucella: a pathogen without classic virulence genes[J]. Veterinary Microbiology, 2008, 129(1/2): 1-14. |
| [15] |
Porte F, Naroeni A, Ouahrani-Bettache S, et al. Role of the Brucella suis lipopolysaccharide O antigen in phagosomal genesis and in inhibition of phagosome-lysosome fusion in murine macrophages[J]. Infection and Immunity, 2003, 71(3): 1481-1490. DOI:10.1128/IAI.71.3.1481-1490.2003 |
| [16] |
Lacerda TLS, Salcedo SP, Gorvel JP. Brucella T4SS: the VIP pass inside host cells[J]. Current Opinion in Microbiology, 2013, 16(1): 45-51. DOI:10.1016/j.mib.2012.11.005 |
| [17] |
Altamirano-Silva P, Meza-Torres J, Castillo-Zeledon A, et al. Brucella abortus senses the intracellular environment through the BvrR/BvrS two-component system, which allows B. abortus to adapt to its replicative niche[J]. Infection and Immunity, 2018, 86(4): e00713-17. |
| [18] |
Tian MX, Lian ZM, Bao YQ, et al. Identification of a novel, small, conserved hypothetical protein involved in Brucella abortus virulence by modifying the expression of multiple genes[J]. Transboundary and Emerging Diseases, 2019, 66(1): 349-362. DOI:10.1111/tbed.13028 |
 2020, Vol. 47
2020, Vol. 47