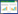扩展功能
文章信息
- 李婉娟, 王龙龙, 喻飞, 赵燕楠, 吕利群
- LI Wan-Juan, WANG Long-Long, YU Fei, ZHAO Yan-Nan, LYU Li-Qun
- 草鱼Ⅲ型呼肠孤病毒NS66抗体制备及应用
- Polyclonal antibody preparation and application of grass carp reovirus genotype Ⅲ nonstructural protein NS66 Microbial Engineering and Medicine
- 微生物学通报, 2020, 47(1): 182-189
- Microbiology China, 2020, 47(1): 182-189
- DOI: 10.13344/j.microbiol.china.190479
-
文章历史
- 收稿日期: 2019-06-04
- 接受日期: 2019-08-16
- 网络首发日期: 2019-09-09
2. 上海海洋大学农业部淡水水产种质资源重点实验室 上海 201306;
3. 上海海洋大学水产科学国家级实验教学示范中心 上海 201306
2. Key Laboratory of Agriculture Ministry for Freshwater Aquatic Genetic Resources, Shanghai Ocean University, Shanghai 201306, China;
3. National Experimental Teaching Demonstration Center for Fishery Sciences, Shanghai Ocean University, Shanghai 201306, China
GCRV104病毒是2009年Fan等从湖北患典型草鱼出血病的草鱼体内分离到的一株新致病型草鱼呼肠孤病毒(hubei grass carp disease reovirus,HGDRV)。此病毒基因组总大小为23 706 bp,(G+C)mol%含量为51%,由11个分节段的dsRNA片段组成[1]。除第2节段与水生呼肠孤病毒属或者正呼肠孤病毒属相似性较高外,其他片段使用BLASTn的核苷酸序列相似性搜索与GCRV其他株无显著相似性[1]。目前已报道的20多个GCRV毒株中的基因组序列存在一定的变异差异[2-4],根据系统进化树不同GCRV毒株的核苷酸序列比对结果,把GCRV各毒株划分为Ⅰ型、Ⅱ型和Ⅲ型病毒,同一类型下的毒株间核苷酸序列相似性大于95%,而不同类型间的GCRV毒株相似性小于30%[5-6]。GCRV一般可以编码多种结构蛋白[7],其他非结构蛋白不是病毒粒子的组成成分,但可以在感染病毒的细胞中检测到[8-9]。
GCRV 11个分节段的dsRNA片段编码12种蛋白质(其中第11节段dsRNA片段编码2种蛋白)。GCRV104 NS66蛋白由基因组片段s6编码,通过对比发现GCRV104的s6编码的NS66与GCRV873的s4编码的NS80,GCRV HZ08的s4编码的NS79和GCRV GD108的M4编码的NS1同源[1]。多数研究认为Ⅰ型GCRV非结构蛋白NS80募集VP4和NS38,共同作用形成病毒加工的包涵体,在病毒复制和组装中起关键性作用[10-12]。就目前而言,尚没有相关文献报道NS66蛋白在病毒感染中的作用,因而其实际功能仍不清楚。本实验对草鱼呼肠孤病毒104株s6基因编码的NS66蛋白进行了原核表达、蛋白纯化以及多克隆抗体的制备和分析,运用制备的抗草鱼IgM多克隆抗体进行针对病毒的血清学检测,为Ⅲ型GCRV血清学检测方法的建立以及NS66蛋白相关功能研究奠定基础。
1 材料与方法 1.1 实验材料GCRV104病毒来自于武汉长江水产研究所,pGEX-4T-3和pEGFP-N1质粒由本实验室保存,大肠杆菌DH5α和BL21 (DE3)感受态细胞购自天根科技生化有限公司。草鱼肾脏细胞系CIK (ctenopharyngon idellus kideny)细胞系和草鱼卵巢细胞系GCO由本实验室保存。
1.2 主要试剂和仪器Prime Star Max、Primer Script First Strand cDNA Synthesis Kit、限制性内切酶BamH Ι、DNA连接酶、DNA Marker和IPTG等购自TaKaRa公司;HRP标记的羊抗鼠IgG多克隆抗体购自生工生物工程(上海)股份有限公司;实验小鼠由虔碧生物科技有限公司提供;M199培养基购自吉诺生物医药技术有限公司;胎牛血清购自杭州四季青生物工程材料公司。
净化工作台和恒温摇床,上海博讯实业有限公司;凝胶电泳仪,上海天能科技有限公司;PCR仪、蛋白测定仪、免疫印迹电转仪和凝胶成像系统购自伯乐生命医学产品有限公司;荧光倒置显微镜,奥林巴斯有限公司。
1.3 目的基因PCR扩增与重组表达质粒构建参照GenBank上发表的GCRV104 NS66基因序列,利用引物设计软件Primer Premier 5设计用于原核表达和真核表达的特异性引物:pGEX-4T- 3-NS66-F (5′-ATCTGGTTCCGCGTGGATCCATGC TCTCCGCTAGTCTATACT-3′)和pGEX-4T-3-NS66-R (5′-ACCCGGGAATTCGGGGATCCCTACAACTTCAGACCCTTTGAC-3′) (划线处为限制性内切酶BamH I酶切位点)用于基因的原核表达;pEGFP-N1-NS66-F (5′-GTACCGCGGGCCCGGGA TCCATGCTCTCCGCTAGTCTATACT-3′)和pEGFP- N1-NS66-R (5′-TGGTGGCGACCGGTGGATCCCT ACAACTTCAGACCCTTTGAC-3′) (划线处为限制性内切酶BamH I酶切位点)用于基因的真核表达。提取GCRV104病毒基因组RNA,使用Primer Script First Strand cDNA Synthesis Kit反向转录合成第一链cDNA作为PCR反应的模板,构建50 μL PCR反应体系:cDNA模板(8.5 mmol/L) 1 μL,上、下游引物(10 μmol/L)各1 μL,ExTaq酶0.5 μL,10×Buffer 5 μL,dNTPs (2.5 mmol/L) 4 μL,加无菌去离子水至总体积50 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 2 min,34个循环;72 ℃ 10 min。PCR产物经1.5%琼脂糖凝胶电泳检测后,用纯化回收试剂盒纯化目的片段送生工生物工程(上海)股份有限公司测序。
对应的载体分别进行酶切,酶切产物进行割胶回收后用DNA连接酶50 ℃温育1 h连接,连接产物转化感受态大肠杆菌DH5α,用PCR初步挑选阳性克隆,提取质粒,送生工生物工程(上海)股份有限公司测序鉴定。
1.4 重组蛋白表达纯化及多抗制备大量培养测序结果与目的基因序列一致的阳性菌株,提取质粒后转化感受态大肠杆菌BL21,氨苄霉素筛选,并再次测序验证序列。挑取单个阳性菌落接种于含有氨苄霉素浓度50 mg/L的LB液体培养基中,37 ℃、180 r/min培养。培养菌浓度OD600约为0.6时,加入IPTG至其终浓度为1 mmol/L,诱导5 h,4 ℃、8 500 r/min离心10 min收集菌体沉淀,用PBS溶液重悬后,超声破碎处理(功率400 W,4 ℃,工作4 s,间隔4 s,100次)至液体呈现澄清透明状。超声后,4 ℃、8 000 r/min离心30 min,然后用尿素纯化,蛋白测定仪检测纯化蛋白浓度。分别取诱导前、诱导后、纯化后蛋白进行SDS-PAGE分析以确定重组蛋白的特异性。LB培养基、PBS溶液和含5%牛奶的PBST溶液配制方法参照孔善云等[13]。
用纯化的pGEX-4T-3-NS66重组蛋白免疫小鼠。采用腹腔注射免疫,弗氏完全佐剂与抗原1:1充分混匀乳化后免疫;首次免疫7 d后进行第2次免疫,弗氏不完全佐剂与抗原1:1充分混匀乳化后免疫;7 d后进行第3次免疫;第3次免疫2周后进行第4次加强免疫,不加佐剂,注射0.2 mg重组蛋白。第4次免疫7 d后进行眼球采血,血液经37 ℃静置1 h后,4 ℃过夜。次日,4 ℃、4 000 r/min离心15 min取上清,分装后置于−80 ℃备用。
1.5 Western blotting检测分析用MOI=10的病毒感染草鱼肾脏细胞,接毒72 h后,去除细胞培养板内的培养基,加入适量2×蛋白上样缓冲液收集细胞,裂解进行Western blotting分析鉴定。经SDS-PAGE电泳(80 V,30 min;120 V,60 min)后,采用湿转膜法(100 V,60 min)将蛋白转至PVDF膜,10 mL含5%牛奶的PBST缓冲液室温振荡封闭2 h。以制备的多克隆抗体作为一抗(以1:5 000比例稀释)室温孵育1 h后4 ℃过夜,次日用PBST溶液清洗5次,每次8 min洗去残余的抗体,再用HRP标记的羊抗鼠的IgG抗体作为二抗(以1:5 000比例稀释)室温振荡孵育2 h,用PBST缓冲液清洗5次,每次8 min,最后将PVDF膜放入用天能ECL化学发光底物进行孵育显色,凝胶成像系统拍照观察结果。
1.6 效价分析如1.5所述制样、电泳,并将蛋白转移到PVDF膜上,用脱脂牛奶封闭。将纯化的多克隆抗体分别稀释5 000、8 000、10 000、20 000、50 000倍,孵育封闭好的PVDF膜,其余步骤同1.5。
1.7 NS66亚细胞定位将草鱼卵巢细胞传代至12孔细胞培养板中,待细胞长至单层铺满80%左右后,用灭菌的PBS缓冲液洗涤细胞,将1 μg的pEGFP-N1-NS66质粒按Lipo 3000使用说明转染入细胞,pEGFP-N1空载体作为阴性对照。转染48 h后,荧光倒置显微镜下观察转染效率及蛋白表达信号;然后将转染细胞用PBS缓冲液洗涤3次,每次5 min,进行亚细胞定位,步骤如下:每孔加入300 μL 4%的多聚甲醛固定10 min,PBS缓冲液洗涤3次,每次5 min,每孔300 μL免疫通透液进行细胞透化,摇床室温孵育15 min;PBS洗涤3遍,每次5 min,最后加入DAPI染色10 min,每孔加入300 μL抗荧光衰减剂,荧光倒置显微镜下观察结果。
1.8 间接免疫荧光试验(IFA)将草鱼肾脏细胞传代至12孔细胞培养板中,待细胞长至单层铺满90%左右后,接种MOI=10的GCRV104病毒,以未接种病毒的正常细胞作为阴性对照。病毒接种3 d后,吸净细胞培养板内的培养基,用预冷PBS缓冲液(0.01 mol/L)清洗3次,使用4%多聚甲醛溶液固定,免疫通透液破坏细胞膜系结构,5%脱脂牛奶封闭1 h。一抗为1׃1 000稀释的鼠抗NS66蛋白多克隆抗体,37 ℃作用1 h后,PBST清洗3次,每次5 min;二抗为1׃500稀释的四甲基异硫氰酸罗丹明(TRITC)标记的兔抗鼠IgG,37 ℃作用1 h,PBST缓冲液轻洗3次,每次5 min。最后加入DAPI染色10 min,每孔加入300 μL抗荧光衰减剂,荧光倒置显微镜下观察结果。
1.9 蛋白表达动力学将草鱼肾脏细胞传代至6孔细胞培养板中,待细胞长至单层铺满90%左右后,接种MOI=10的GCRV104病毒,以未接种病毒的正常细胞作为阴性对照。以空白细胞为对照,在感染12、24、36、48、60、72、96 h分别吸除细胞培养板上的培养基,加入适量蛋白上样缓冲液取一次样。如1.5所述进行Western blotting分析。
2 结果与分析 2.1 NS66基因扩增鉴定与重组质粒的构建根据GenBank中草鱼呼肠孤病毒的NS66序列设计引物,并以GCRV104基因组RNA作为初始模板,逆转录后经PCR扩增获得NS66序列。PCR产物经1.5%琼脂糖凝胶电泳分析,扩增出一条大小约为1 800 bp的特异性条带(图 1),与预期大小基本一致,表明目的基因扩增成功。

|
| 图 1 NS66基因PCR扩增产物电泳图 Figure 1 Electrophoretic profile of PCR products of NS66 gene 注:M:DL2000分子量标准;1:pGEX-4T-3-NS66 PCR产物;2:pEGFP-N1-NS66 PCR产物. Note: M: DL2000 DNA Marker; 1: pGEX-4T-3-NS66 PCR products; 2: pEGFP-N1-NS66 PCR products. |
|
|
将上述PCR产物割胶回收,质粒分别进行酶切、纯化回收后进行连接、转化,最后提取质粒,PCR扩增、测序等方法鉴定重组表达载体,测序结果显示重组表达载体构建成功。
2.2 重组蛋白的表达和纯化及多克隆抗体的制备将原核表达重组表达载体转化到大肠杆菌BL21后,用于诱导表达重组蛋白pGEX-4T-3- NS66,用终浓度为1 mmol/L的IPTG进行诱导,4 h后取总菌体制样进行SDS-PAGE分析。与未经IPTG诱导组相比,经IPTG诱导的菌体在66 kD处出现一条明显的目的条带(图 2),说明重组蛋白诱导成功。用尿素纯化重组蛋白,经SDS-PAGE分析,在66 kD处出现一条单一条带,说明获得了纯的pGEX-4T-3-NS66重组蛋白,可用于后续实验。
|
| 图 2 纯化的重组NS66蛋白SDS-PAGE分析 Figure 2 SDS-PAGE of purified product 注:M:蛋白分子量标准样;1:未诱导菌体;2:诱导菌体;3:纯化后的pGEX-4T-3-NS66蛋白. Note: M: Protein marker; 1: Uninduced bacterial; 2: Induced bacterial; 3: The purified protein. |
|
|
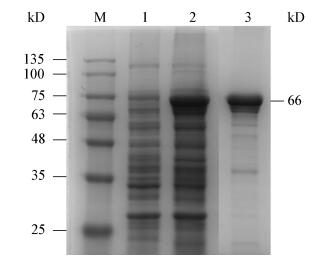
以GCRV104病毒感染的草鱼肾脏细胞总蛋白为材料,NS66多克隆抗体为一抗进行Western blotting,未感染病毒草鱼肾脏细胞总蛋白为对照,检测病毒感染表达的NS66蛋白。结果显示,感染病毒72 h的样品泳道中,约66 kD处出现一条特异性条带,与病毒s6基因自身编码的蛋白大小基本一致(图 3),而加入空白细胞对照组的孔道中未出现条带,表明制备的多抗能特异识别感染GCRV104病毒的对应蛋白,具有良好的特异性。
|
| 图 3 Western blotting分析多克隆抗体特性 Figure 3 Analysis of the character of serum antibody by western blotting 注:1:正常肾脏细胞;2:感染GCRV 72 h的细胞. Note: 1: Normal kidney cell; 2: Cells infected GCRV 72 h. |
|
|
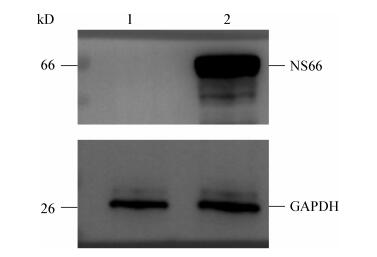
以GCRV104病毒感染的草鱼肾脏细胞总蛋白为材料,NS66多克隆抗体为一抗,HRP (辣根过氧化物酶)标记的兔抗鼠IgG为二抗,使用Western blotting方法测定抗体效价,结果显示该NS66重组蛋白多克隆抗体效价大于1׃50 000 (图 4),抗体效价较高。
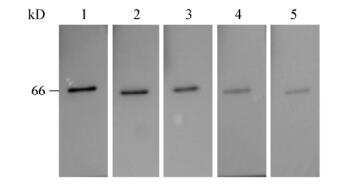
|
| 图 4 多抗效价的检测 Figure 4 Determination of the titers of the serum antibody 注:稀释比例:1:5 000;2:8 000;3:10 000;4:20 000;5:50 000. Note: Dilution ratio: 1: 5 000; 2: 8 000; 3: 10 000; 4: 20 000; 5: 50 000. |
|
|
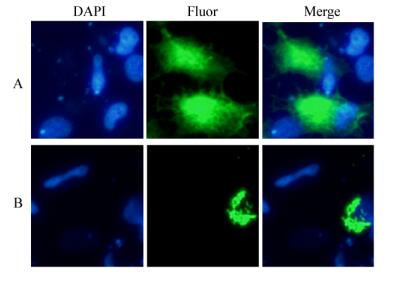
在草鱼卵巢细胞中分别过表达绿色荧光蛋白pEGFP-N1和重组载体pEGFP-N1-NS66,发现荧光信号后进行固定和透化,在荧光显微镜下发现pEGFP-N1-NS66蛋白分布在细胞核外的细胞基质中,呈点块状分布(图 5)。
|
| 图 5 荧光免疫细胞化学方法显示NS66蛋白的分布 Figure 5 Expression pattern of NS66 by fluorescent immunocytochemistry 注:A:过表达pEGFP-N1质粒的对照细胞;B:过表达pEGFP-N1-NS66质粒的细胞. Note: A: The cell with overexpressed pEGFP-N1; B: The cell with overexpressed pEGFP-N1-NS66. |
|
|
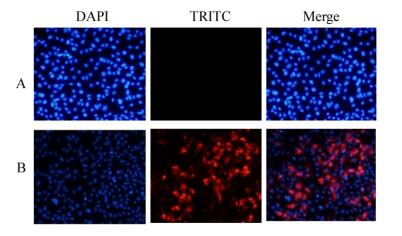
用正常细胞和攻毒3 d的草鱼肾脏细胞固定和透化处理,以NS66蛋白多克隆抗体为一抗,HRP标记的兔抗鼠IgG为二抗,DAPI染核固定后在荧光显微镜下发现,感染GCRV104病毒的草鱼肾脏细胞能观察到特异性的红色荧光信号(图 6A),而未感染病毒的正常草鱼肾脏细胞中观察不到荧光信号(图 6B),表明制备的多克隆抗体能特异性识别GCRV104病毒。
|
| 图 6 多克隆抗体的IFA鉴定 Figure 6 Identification of IFA with polyclonal antibody 注:A:正常肾脏细胞;B:感染GCRV 72 h的细胞. Note: A: Normal kidney cell; B: Cells infected GCRV 72 h. |
|
|
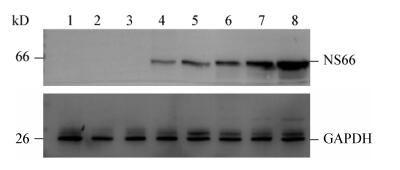
如图 7所示,GCRV104 NS66蛋白随着感染时间的推移表达量逐渐升高。
|
| 图 7 病毒感染条件下检测NS66蛋白的表达 Figure 7 Detection the expression of NS66 protein by viral infection 注:1:正常细胞;2:感染12 h;3:感染24 h;4:感染36 h;5:感染48 h;6:感染60 h;7:感染72 h;8:感染96 h. Note: 1: Normal cells; 2: 12 h; 3: 24 h; 4: 36 h; 5: 48 h; 6: 60 h; 7: 72 h; 8: 96 h. |
|
|
草鱼呼肠孤病毒感染养殖草鱼引起的草鱼出血病传染率高、致病性强、流行范围广,死亡率高达80%[2, 14]。青鱼(Mylopharyngodon piceus)、稀有鮈鲫(Gobiocypris rarus)和麦穗鱼(Pseudorasbora parva)等水生动物也能被此病毒感染[15],感染GCRV的草鱼体表、肌肉和内脏组织等器官广泛出血、缺血、坏死以及肝功能代谢失调,最终导致死亡[16]。GCRV在形态结构、细胞的感染特性、宿主的敏感性和基因组等研究方面都取得较大进展[17],目前GCRV104病毒全基因组序列测定已经完成,但是对该毒株各基因节段及其编码的蛋白功能还没有进行系统研究[1]。蛋白作为主要生物功能的执行者是病毒与宿主之间相互作用的关键性媒介。了解GCRV各节段基因及其编码蛋白的功能,不仅对该病毒的深入研究具有重要意义,对草鱼出血病的疫苗、诊断试剂、药物等防控产品的开发也具有更为深远的意义。
通过对NS66氨基酸序列分析表明NS66只有一个卷曲结构,与草鱼呼肠孤病毒其他株的同源序列对比没有保守组氨酸和半胖氨酸位点,此前研究发现非结构蛋白NS66与水生呼肠孤病毒非结构蛋白的相似性很低(15%–21%)[1],且其与正呼肠孤病毒的μNS蛋白相似性也很低(12%),但是NS66与正呼肠孤病毒的同源μNS蛋白都有的卷曲结构可能是正呼肠孤病毒参与病毒组装和复制的关键结构[18]。不同基因型草鱼呼肠孤病毒间基因组序列相似性较低[19],在病毒毒力、感染特性上具有较大的差异[20-21],NS66蛋白与GCRV其他基因型同源蛋白不一致的结构很可能与GCRV104病毒所特有的一些生物学特性密切相关。目前尚无相关文献报道NS66蛋白在病毒感染中的作用,因而其实际功能仍不清楚,但是可以根据其同源蛋白预测其功能。在哺乳动物中,MRV通过编码的µNS参与病毒包涵体的形成和装配[22-24],在病毒复制中起关键性作用[25]。与GCRV104病毒同源性很近的Ⅰ型草鱼呼肠孤病毒中,非结构蛋白NS80是形成病毒包涵体的基本结构[26],在病毒复制和组装过程中招募病毒的其他蛋白到包涵体中,将病毒的各结构成分组装成完整的病毒粒子[27]。Ⅱ型草鱼呼肠孤病毒中,与NS80同源的蛋白为NS79蛋白,也具有形成病毒包涵体的功能[28]。
本研究通过对草鱼呼肠孤病毒NS66基因原核表达质粒的构建,表达并制备了NS66原核表达的多克隆抗体,效价大于1:50 000。用Western blotting和间接荧光免疫的方法检测抗体感染病毒细胞的总蛋白,pGEX-4T-3-NS66多克隆抗体能特异性地检测GCRV,说明该抗体效价和特异性满足后续GCRV免疫检测的要求。呼肠孤病毒在复制和组装过程中主要集中分布在感染细胞中的细胞质中,分布在细胞核周围[29-30]。真核表达细胞亚定位结果表明,NS66蛋白分布于细胞质中,团状分布,可能是病毒复制过程中的“病毒工厂”结构区。因而我们预测NS66蛋白也可能具有形成病毒包涵体的功能。利用NS66原核表达的多克隆抗体,我们同时探究了GCRV104病毒感染草鱼肾脏细胞后NS66蛋白的表达动力学,NS66在感染后24 h开始出现少量的表达,24–96 h期间随着感染时间的推移表达量逐渐升高,直至84 h出现明显的增加,我们推测晚期大量表达的NS66蛋白可能是满足后期大量病毒颗粒组装和复制的需要。本实验对于Ⅲ型呼肠孤病毒研究提供了前提基础,可用于NS66在病毒致病机制方面的研究,为抗GCRV104病毒新型疫苗的创制和免疫检测试剂盒的研发奠定了前期基础。
| [1] |
Fan YD, Rao SJ, Zeng LB, et al. Identification and genomic characterization of a novel fish reovirus, Hubei grass carp disease reovirus, isolated in 2009 in China[J]. Journal of General Virology, 2013, 94(10): 2266-2277. |
| [2] |
Wang T, Li JL, Lu LQ. Quantitative in vivo and in vitro characterization of co-infection by two genetically distant grass carp reoviruses[J]. Journal of General Virology, 2013, 94: 1301-1309. DOI:10.1099/vir.0.049965-0 |
| [3] |
Ye X, Tian YY, Deng GC, et al. Complete genomic sequence of a reovirus isolated from grass carp in China[J]. Virus Research, 2012, 163(1): 275-283. DOI:10.1016/j.virusres.2011.10.014 |
| [4] |
Hao GJ, Shen JY, Pan XY, et al. Isolation and identification of a strain of grass carp reovirus in Huzhou[J]. Progress in Fishery Sciences, 2011, 32(1): 47-52. (in Chinese) 郝贵杰, 沈锦玉, 潘晓艺, 等. 草鱼呼肠孤病毒湖州分离株的分离及鉴定[J]. 渔业科学进展, 2011, 32(1): 47-52. DOI:10.3969/j.issn.1000-7075.2011.01.007 |
| [5] |
Zeng WW, Wang Q, Liu YK, et al. Isolation and identification of new GCRV strain and primary study on its immunogenicity[J]. Acta Hydrobiologica Sinica, 2011, 35(5): 790-795. (in Chinese) 曾伟伟, 王庆, 刘永奎, 等. 一株草鱼呼肠孤病毒弱毒株的分离、鉴定及免疫原性初步分析[J]. 水生生物学报, 2011, 35(5): 790-795. |
| [6] |
Ma J. Study on the inhibition of replication of grass carp reovirus by RNA interference[D]. Wuhan: Doctoral Dissertation of Huazhong Agriculture University, 2013(in Chinese) 马杰. RNA基因干扰技术抑制草鱼呼肠孤病毒复制的研究[D].武汉: 华中农业大学博士学位论文, 2013 |
| [7] |
Zhang X, Jin L, Fang Q, et al. 3.3Å Cryo-EM structure of a nonenveloped virus reveals a priming mechanism for cell entry[J]. Cell, 2010, 141(3): 472-482. DOI:10.1016/j.cell.2010.03.041 |
| [8] |
Cheng LP, Fang Q, Shah S, et al. Subnanometer-resolution structures of the grass carp reovirus core and virion[J]. Journal of Molecular Biology, 2008, 382(1): 213-222. |
| [9] |
Becker MM, Peters TR, Dermody TS. Reovirus σNS andµNS proteins form cytoplasmic inclusion structures in the absence of viral infection[J]. Journal of Virology, 2003, 77(10): 5948-5963. DOI:10.1128/JVI.77.10.5948-5963.2003 |
| [10] |
Cai L, Sun XY, Shao L, et al. Functional investigation of grass carp reovirus nonstructural protein NS80[J]. Virology Journal, 2011, 8: 168. DOI:10.1186/1743-422X-8-168 |
| [11] |
Fan C, Zhang LL, Lei CF, et al. Expression and identification of inclusion forming-related domain of NS80 nonstructural protein of grass carp reovirus[J]. Virologica Sinica, 2009, 24(3): 194-201. DOI:10.1007/s12250-009-3028-1 |
| [12] |
Fan C, Shao L, Fang Q. Characterization of the nonstructural protein NS80 of grass carp reovirus[J]. Archives of Virology, 2010, 155(11): 1755-1763. DOI:10.1007/s00705-010-0753-6 |
| [13] |
Kong SY, Jiang YS, Xu D, et al. An immunological method to detect CyHV-2 based on capsid protein 72[J]. Journal of Fishery Sciences of China, 2016, 23(2): 328-335. (in Chinese) 孔善云, 姜有声, 许丹, 等. 一种基于Ⅱ型鲤疱疹病毒衣壳蛋白72的免疫学检测方法[J]. 中国水产科学, 2016, 23(2): 328-335. |
| [14] |
Ge XP, Miao LH. Current state and development suggestion on national conventional freshwater fishery industry[J]. Chinese Fishery Quality and Standards, 2011, 1(3): 22-31. (in Chinese) 戈贤平, 缪凌鸿. 我国大宗淡水鱼产业发展现状与体系研究进展[J]. 中国渔业质量与标准, 2011, 1(3): 22-31. |
| [15] |
Zhang LL, Luo Q, Fang Q, et al. An improved RT-PCR assay for rapid and sensitive detection of grass carp reovirus[J]. Journal of Virological Methods, 2010, 169(1): 28-33. DOI:10.1016/j.jviromet.2010.06.009 |
| [16] |
Yin L. Diversity analysis on biological characteristics of three strains of grass carp reovirus from different genotype[D]. Shanghai: Master's Thesis of Shanghai Ocean University, 2014(in Chinese) 殷亮.三株不同基因型草鱼呼肠孤病毒生物学特性的差异分析[D].上海: 上海海洋大学硕士学位论文, 2014 |
| [17] |
Li X, Zeng WW, Wang Q, et al. Progress on grass carp reovirus[J]. Progress in Veterinary Medicine, 2016, 37(7): 94-101. (in Chinese) 李贤, 曾伟伟, 王庆, 等. 草鱼呼肠病毒研究进展[J]. 动物医学进展, 2016, 37(7): 94-101. DOI:10.3969/j.issn.1007-5038.2016.07.019 |
| [18] |
Shao L, Fan C, Maj E, et al. Molecular characterization of nonstructural protein NS38 of grass carp reovirus[J]. Virologica Sinica, 2010, 25(2): 123-129. DOI:10.1007/s12250-010-3115-3 |
| [19] |
Fang Q, Seng EK, Ding QQ, et al. Characterization of infectious particles of grass carp reovirus by treatment with proteases[J]. Archives of Virology, 2008, 153(4): 675-682. DOI:10.1007/s00705-008-0048-3 |
| [20] |
Zhang C, Wang Q, Shi CB, et al. Isolation and identification of a grass carp reovirus isolate GCRV HZ08[J]. Journal of Fishery Sciences of China, 2010, 17(6): 1257-1263. (in Chinese) 张超, 王庆, 石存斌, 等. 草鱼呼肠孤病毒HZ08株的分离与鉴定[J]. 中国水产科学, 2010, 17(6): 1257-1263. |
| [21] |
Xu Y, Hao GJ, Shen JY, et al. Isolation and identification of two grass carp reovrius strains in Jiangxi province[J]. Freshwater Fisheries, 2010, 40(3): 44-49. (in Chinese) 徐洋, 郝贵杰, 沈锦玉, 等. 两株草鱼呼肠孤病毒江西株的分离与鉴定[J]. 淡水渔业, 2010, 40(3): 44-49. DOI:10.3969/j.issn.1000-6907.2010.03.008 |
| [22] |
Wiener JR, Bartlett JA, Joklik WK. The sequences of reovirus serotype 3 genome segments M1 and M3 encoding the minor proteinµ2 and the major nonstructural proteinµNS, respectively[J]. Virology, 1989, 169(2): 293-304. DOI:10.1016/0042-6822(89)90154-2 |
| [23] |
Broering TJ, Kim J, Miller CL, et al. Reovirus nonstructural proteinµNS recruits viral core surface proteins and entering core particles to factory-like inclusions[J]. Journal of Virology, 2004, 78(4): 1882-1892. DOI:10.1128/JVI.78.4.1882-1892.2004 |
| [24] |
Tourís-Otero F, Martínez-Costas J, Vakharia VN, et al. Characterization of the nucleic acid-binding activity of the avian reovirus non-structural protein σNS[J]. Journal of General Virology, 2005, 86: 1159-1169. DOI:10.1099/vir.0.80491-0 |
| [25] |
Arnold MM, Murray KE, Nibert ML. Formation of the factory matrix is an important, though not a sufficient function of nonstructural proteinµNS during reovirus infection[J]. Virology, 2008, 375(2): 412-423. DOI:10.1016/j.virol.2008.02.024 |
| [26] |
Trask SD, McDonald SM, Patton JT. Structural insights into the coupling of virion assembly and rotavirus replication[J]. Nature Reviews Microbiology, 2014, 12(1): 70. |
| [27] |
Ke F, He LB, Zhang QY, et al. Nonstructural protein NS80 is crucial in recruiting viral components to form aquareoviral factories[J]. PLoS One, 2013, 8(5): e63737. DOI:10.1371/journal.pone.0063737 |
| [28] |
Sun XY, Pei C, Song HL, et al. Polyclonal antibody preparation of grass carp reovirus NS79 protein[J]. Henan Fisheries, 2018(2): 21-24. (in Chinese) 孙效迎, 裴超, 宋华丽, 等. 草鱼呼肠孤病毒NS79蛋白多克隆抗体制备[J]. 河南水产, 2018(2): 21-24. |
| [29] |
Broering TJ, Arnold MM, Miller CL, et al. Carboxyl-proximal regions of reovirus nonstructural proteinµNS necessary and sufficient for forming factory-like inclusions[J]. Journal of Virology, 2005, 79(10): 6194-6206. DOI:10.1128/JVI.79.10.6194-6206.2005 |
| [30] |
Miller DJ, Schwartz MD, Ahlquist P. Flock house virus RNA replicates on outer mitochondrial membranes in Drosophila cells[J]. Journal of Virology, 2001, 75(23): 11664-11676. DOI:10.1128/JVI.75.23.11664-11676.2001 |
 2020, Vol. 47
2020, Vol. 47