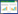扩展功能
文章信息
- 吴旭光, 王红, 徐一凡, 杨文飞, 李槿年, 解光艳
- WU Xu-Guang, WANG Hong, XU Yi-Fan, YANG Wen-Fei, LI Jin-Nian, XIE Guang-Yan
- 猪源肠外致病性大肠埃希氏菌的生物膜形成能力及耐药性
- Biofilm-forming capability and drug resistance of extraintestinal pathogenic Escherichia coli isolated from diseased swine
- 微生物学通报, 2020, 47(1): 162-171
- Microbiology China, 2020, 47(1): 162-171
- DOI: 10.13344/j.microbiol.china.190355
-
文章历史
- 收稿日期: 2019-04-22
- 接受日期: 2019-06-05
- 网络首发日期: 2019-06-19
2. 安徽中医药大学 安徽 合肥 230038
2. Anhui University of Traditional Chinese Medicine, Hefei, Anhui 230038, China
肠外致病性大肠埃希氏菌(extraintestinal pathogenic Escherichia coli,ExPEc)是一类定殖于肠道外其他组织中的人畜共患病原菌,可引起人和动物的肺炎、脑膜炎、败血症和泌尿道感染[1-2]。自2004年以来,猪源ExPEc在猪群中的分离率呈现明显上升趋势,且常与副猪嗜血杆菌、猪瘟病毒和猪伪狂犬病病毒等其他病原混合感染[3-5]。由于猪源ExPEc也是生物膜感染的常见病原菌,多表现出多重耐药性,使得抗生素的效用大大降低,导致病猪死亡率不断提高,给我国养猪业造成严重的经济损失。
细菌生物膜(bacterial biofilm,BF)是细菌为适应生存环境,黏附于有生命或无生命物体表面后,被细菌自身产生的胞外多聚物基质包裹的膜状细菌群体[6]。据美国国立卫生研究院(Nationat Instirutes of Health,NIH)的初步统计,大约85%的细菌性疾病与生物被膜形成有关。由于BF具有屏障作用,可阻止抗生素渗入,同时其中的细菌生长速度较慢,对抗生素不敏感,有的BF细菌还能分泌抗生素分解酶、产生抗生素耐药基因,导致其耐药性较浮游态细菌增强10−1 000倍[7]。因此,在研究病原菌生物膜形成能力、调控机制以及生物膜形成与耐药性相关性的基础上,寻找有效的BF抑制剂或清除剂,对防治细菌生物膜相关感染具有重要意义。
本试验以从肺炎病猪体内分离鉴定的ExPEc为研究对象,通过优化分离株形成生物膜的最佳条件,检测其生物膜形成能力及携带的成膜相关基因,比较浮游状态和生物膜状态下分离菌株的耐药性,探讨生物膜形成与耐药性的关系,以期为从抗生物膜形成角度防治猪肠外大肠埃希氏菌病提供科学依据。
1 材料与方法 1.1 实验材料 1.1.1 细菌菌株3株猪源ExPEc (SE-1、SE-2、SE-3)由本实验室从患有肺炎病猪的肺脏内分离鉴定并保存。
1.1.2 主要试剂与仪器细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司;BHI培养基、TSB培养基、MH培养基和营养肉汤培养基,杭州微生物试剂有限公司;头孢噻肟、头孢曲松和庆大霉素等12种抗菌药物,中国兽医药品监察所。
医用低温保存箱,海尔特种电器有限公司;紫外可见分光光度计,上海仪电分析仪器有限公司;高速冷冻离心机,贝克曼库尔特公司;生化培养箱,上海一恒科学仪器有限公司;扫描电镜,日立公司。
1.2 分离菌株生物膜形成条件的优化为了探讨培养基、培养温度、培养时间和初始菌液浓度对分离菌株生物膜形成的影响,选取培养基种类(BHI、TSB和营养肉汤)、培养温度(34、37、40 ℃)、培养时间(24、36、48 h)和初始菌液浓度(OD600值0.2、0.3、0.5) 4个因素,每个因素各取3个水平,按L9(34)进行正交试验(表 1),采用文献[8]报道的微孔板结晶紫染色法检测细菌生物膜。主要步骤为:将分离菌株接种不同培养基培养至不同OD600值,取菌液加至96孔细胞培养板,200 μL/孔,按表 1中设置温度与时间进行培养,共做3个复孔,同时设置培养基作空白对照。培养结束后对生物膜依次进行甲醇固定、0.5%结晶紫染色、33%冰醋酸溶解结晶紫、测定溶解液OD570值,通过分析各试验组与空白对照组的平均OD570,确定3株分离菌株形成生物膜的最佳条件。
| 水平 Levels |
因素 Factors |
|||
| A培养时间 Incubation time (h) |
B培养基种类 Medium types |
C培养温度 Incubation temperature (℃) |
D初始菌液OD600值 OD600 of initial bacterial suspension |
|
| 1 | 24 | Nutrient broth | 34 | 0.1 |
| 2 | 36 | BHI | 37 | 0.3 |
| 3 | 48 | TSB | 40 | 0.5 |
在最佳成膜条件下采用微孔板结晶紫染色法检测分离菌株形成生物膜能力。根据文献[9]报道,将空白对照组平均OD570值加上其3倍标准差(SD)作为细菌生物膜形成的临界值(ODc),OD570≤ ODc判为无生物膜形成能力,ODc < OD570≤ 2ODc判为生物膜形成能力较弱,2ODc < OD570≤ 4ODc判为生物膜形成能力中等,OD570 > 4ODc判为生物膜形成能力强。
1.3.2 扫描电镜观察法检测生物膜结构根据优化的成膜最佳条件,将3株分离菌株(SE-1、SE-2、SE-3)分别接种其最适培养基培养至最适的OD600值。然后将菌液加到预先放有细胞爬片的6孔细胞培养板中,2 mL/孔,在各自最适温度下培养24 h或36 h。培养结束后,取出细胞爬片依次进行漂洗、2.5%戊二醛固定、酒精梯度脱水、丙酮脱水、CO2临界点干燥和真空中离子溅射喷金,在扫描电镜下放大6 000倍进行细菌生物膜结构观察并拍照。试验中同时设置浮游态菌作对照。
1.4 分离菌株携带的生物膜形成相关基因检测根据GenBank中收录的大肠埃希氏菌黏附素编码基因iha、I型菌毛蛋白编码基因fimA、鞭毛编码基因flhD/flhC、毒蛋白编码基因hipA、S-核糖同型半胱氨酸裂解酶编码基因luxS以及编码β-1, 6-N-乙酰葡聚糖胺合成酶基因(pgaA、pgaB、pgaC、pgaD)序列设计合成10对特异性引物(表 2),PCR检测分离菌株是否携带这些生物膜形成相关基因。PCR反应体系:2×PCR Mix 6 μL,上、下游引物(10 μmol/L)各0.5 μL,DNA模板1 μL,ddH2O 4 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,46−54 ℃ (不同基因的退火温度见表 2) 30 s,72 ℃ 2 min,35个循环;72 ℃ 5 min。1.0%琼脂糖凝胶电泳检测PCR产物并拍照。
| 基因 Gene |
引物序列 Primes sequence (5′→3′) |
大小 Size (bp) |
退火温度 Annealing temperature (℃) |
| iha | F: gcttccgtagtcattccc R: atagttcagcgacatccag | 2 064 | 49.6 |
| fimA | F: ctacgacggtaaatggtggg R: cctggaacggaatggtgtt | 399 | 57.86 |
| flhD | F: ccgagacgaaacatagcgga R: tgcatacctccgagttgctg | 109 | 53.8 |
| flhC | F: ccgcaagcagaagaagga R: tgggataatatcggcagga | 160 | 49.6 |
| hipA | F: gtcacttggatgaacaac R: acttactaccgtattctc | 1 309 | 49.6 |
| luxS | F: atgccgttgttagatagc R: ctagatgtgcagttcctg | 516 | 46.9 |
| pgaA | F: gggctttgaaacttcttact R: gtatggagtgtcgtgttctg | 2 099 | 54.65 |
| pgaB | F: tgatgacggctaccagag R: ctgttgaaaactcaggacg | 1 658 | 54.84 |
| pgaC | F: atgattaatcgcatcgtatcg R: ttaacctctcagaatcccac | 1 326 | 49.1 |
| pgaD | F: cgacaatcgccagtacgtttaat R: tacgctcatcctgtggcttt | 327 | 52.5 |
采用微量肉汤稀释法[10]检测12种抗菌药物对生物膜态与浮游态猪源ExPEc分离株的最小抑菌浓度(minimum inhibitory concentration,MIC)。
1.5.1 生物膜态猪源ExPEc分离株的培养参考陈迁[11]报道的培养方法,将3株分离菌株分别接种MH肉汤培养液,37 ℃、180 r/min振荡培养过夜,取50 μL菌液加至预先置有细胞爬片的6孔细胞培养板中,再加入5 mL MH培养液,37 ℃培养,每24 h换液一次,连续培养7 d,取出细胞爬片用PBS冲去表面浮游菌,用细胞刮刀刮下生物膜态细菌,并用MH培养液将其浓度稀释为107 CFU/mL,用于后续MIC测定。
1.5.2 浮游态猪源ExPEc分离株的培养将3株分离菌株分别接种MH培养液,37 ℃、180 r/min振荡培养,并用MH培养液将菌液浓度稀释至107 CFU/mL,用于后续MIC测定。
1.5.3 MIC测定抗菌药物用灭菌蒸馏水配制成浓度为1 280 μg/mL的药物原液。在96孔微量板每排的第1孔加160 μL MH培养液,其余各孔加100 μL MH培养液。然后,向第1孔内加入40 μL药物原液、混匀,吸出100 μL至第2孔进行稀释,依次类推稀释至第10孔,使1−10孔的药物终浓度依次为128、64、32、16、8、4、2、1、0.5和0.25 μg/mL,第11孔和第12孔分别用作培养液对照和菌液对照。最后,向1−10孔加入100 μL浓度为107 CFU/mL的生物膜态或浮游态菌液、混匀,置37 ℃培养20 h,以能使孔内液体澄清、无絮状或沉淀物生成的最低药物浓度为其对测试菌的MIC。试验重复3次。
2 结果与分析 2.1 猪源ExPEc分离株生物膜形成的最佳条件选取培养基种类、培养温度、培养时间和初始菌液浓度4个因素,设计4因素3水平正交试验。结果如表 3所示,通过比较4因素的极差R值,发现3株猪源ExPEc成膜的最佳条件并不一致。其中,菌株SE-1成膜最佳条件为A1B1C2D3,即将OD600为0.5的起始菌液接种TSB培养基,37 ℃培养24 h,可产生最大量的生物膜;菌株SE-2形成的最佳条件为A1B3C1D2,即将OD600为0.3的起始菌液接种营养肉汤,34 ℃培养24 h;菌株SE-3形成的最佳条件为A2B2C1D3,即将OD600为0.5的起始菌液接种BHI培养基,34 ℃培养36 h。
| 分组Group | 因素A Factor A | 因素B Factor B | 因素C Factor C | 因素D Factor D | OD570 | ||||||||||||||
| SE-1 | SE-2 | SE-3 | SE-1 | SE-2 | SE-3 | SE-1 | SE-2 | SE-3 | SE-1 | SE-2 | SE-3 | SE-1 | SE-2 | SE-3 | |||||
| G1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1.22 | 3.28 | 1.75 | ||||
| G2 | 1 | 1 | 1 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 1.1 | 2.44 | 1.39 | ||||
| G3 | 1 | 1 | 1 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 1.16 | 1.68 | 0.45 | ||||
| G4 | 2 | 2 | 2 | 1 | 1 | 1 | 2 | 2 | 2 | 3 | 3 | 3 | 1.78 | 1.76 | 1.91 | ||||
| G5 | 2 | 2 | 2 | 2 | 2 | 2 | 3 | 3 | 3 | 1 | 1 | 1 | 0.53 | 1.25 | 1.16 | ||||
| G6 | 2 | 2 | 2 | 3 | 3 | 3 | 1 | 1 | 1 | 2 | 2 | 2 | 1.0 | 2.9 | 1.03 | ||||
| G7 | 3 | 3 | 3 | 1 | 1 | 1 | 3 | 3 | 3 | 2 | 2 | 2 | 0.80 | 0.9 | 0.71 | ||||
| G8 | 3 | 3 | 3 | 2 | 2 | 2 | 1 | 1 | 1 | 3 | 3 | 3 | 0.35 | 1.95 | 2.07 | ||||
| G9 | 3 | 3 | 3 | 3 | 3 | 3 | 2 | 2 | 2 | 1 | 1 | 1 | 0.60 | 1.76 | 0.94 | ||||
| K1 | 1.16 | 2.47 | 1.2 | 1.27 | 1.98 | 1.46 | 0.86 | 2.71 | 1.61 | 0.78 | 2.01 | 1.28 | |||||||
| K2 | 1.10 | 1.97 | 1.37 | 0.66 | 1.88 | 1.54 | 1.16 | 1.99 | 1.54 | 0.97 | 2.08 | 1.04 | |||||||
| K3 | 0.58 | 1.54 | 1.24 | 0.92 | 2.12 | 0.81 | 0.83 | 1.28 | 0.77 | 1.1 | 1.8 | 1.48 | |||||||
| R | 0.58 | 0.93 | 0.17 | 0.61 | 0.24 | 0.73 | 0.33 | 1.43 | 0.84 | 0.31 | 0.29 | 0.44 | |||||||
| 注:K1、K2和K3分别表示每一列“1”、“2”和“3”水平所对应的试验指标平均值;R表示极差(K1、K2、K3中最大值减最小值). Note: K1, K2 and K3 are on behalf of the average of the test index for the level of “1”, “2” and “3” in each column. R means extreme difference (the maximum value in K1, K2 and K3 minus the minimum value). |
|||||||||||||||||||
在最佳成膜条件下采用微孔板结晶紫染色法检测3株猪源ExPEc的成膜能力。结果如图 1所示,3株分离菌在孔侧壁与底部均有明显附着,而空白对照孔内无染液附着。SE-1、SE-2和SE-3菌株的平均OD570值分别为2.15±0.07、4.19±0.06和4.30±0.02,均显著大于4ODc (0.09±0.001),表明3株猪源ExPEc的成膜能力均很强。
|
| 图 1 结晶紫染色的3株猪源ExPEc生物膜 Figure 1 The biofilms of three porcine ExPEc strains stained with crystal violet 注:A:菌株SE-1;B:菌株SE-2;C:菌株SE-3;D:培养基空白对照. Note: A: Strain SE-1; B: Strain SE-2; C: Strain SE-3; D: Blank control of culture medium. |
|
|
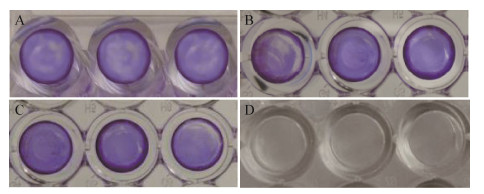
扫描电镜下可以观察到最佳成膜条件下培养的菌株SE-1在细胞爬片表面聚集后形成明显的片状生物膜(图 2A);菌株SE-2和SE-3能在细胞爬片表面明显聚集,形成多层结构的生物膜,并且聚集体间有空隙(图 2C、E);浮游态下的3株细菌散在细胞爬片上,无聚集现象(图 2B、D、F)。
|
| 图 2 3株猪源ExPEc生物膜的扫描电镜观察(6 000×) Figure 2 The biofilms of three porcine ExPEc strains observed by scanning electron microscopy (6 000×) 注:A:生物膜态SE-1菌株;B:浮游态SE-1菌株;C:生物膜态SE-2菌株;D:浮游态SE-2菌株;E:生物膜态SE-3菌株;F:浮游态SE-3菌株. Note: A: Biofilm of strain SE-1; B: Planktonic strain SE-1; C: Biofilm of strain SE-2; D: Planktonic strain SE-2; E: Biofilm of strain SE-3; F: Planktonic strain SE-3. |
|
|
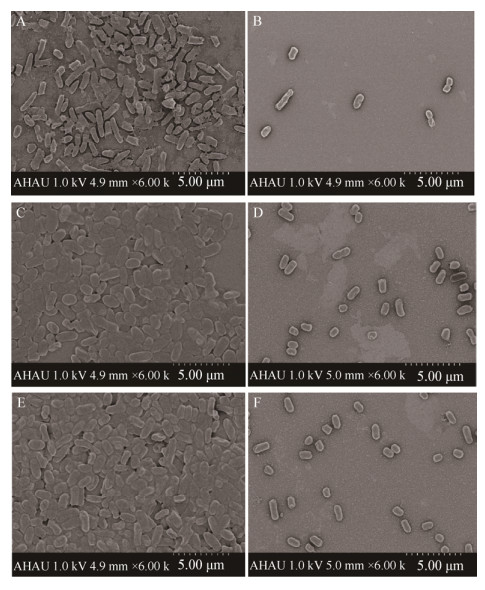
以3株猪源ExPEc基因组DNA为模板,PCR检测生物膜形成相关基因。结果如图 3所示,从3株分离菌中均扩增到pgaA、pgaB、pgaC、pgaD、luxS、fimA、hipA、iha、flhC和flhD基因,说明它们均同时携带所检测的10个生物膜相关基因。
|
| 图 3 3株猪源ExPEc携带的生物膜相关基因PCR检测 Figure 3 Detection of biofilm-related genes from three porcine ExPEc strains by PCR 注:A:luxS、fimA、pgaC、pgaD、flhC和flhD基因;B:hipA与iha基因;C:pgaA与pgaB基因. M:DNA分子质量标准;1:阴性对照;2−4:SE-1、SE-2和SE-3菌株luxS、hipA及pgaA基因的PCR产物;5−7:SE-1、SE-2和SE-3菌株fimA、iha及pgaB基因的PCR产物;8−19:SE-1、SE-2和SE-3菌株pgaC、pgaD、flhC及flhD基因的PCR产物. Note: A: luxS, fimA, pgaC, pgaD, flhC and flhD genes; B: hipA and iha genes; C: pgaA and pgaB genes. M: DNA Marker; 1: Negative control; 2−4: PCR products of luxS, hipA and pgaA from SE-1, SE-2 and SE-3 strains; 5−7: PCR products of fimA, iha and pgaB genes from SE-1, SE-2 and SE-3 strains; 8−19: PCR products of pgaC, pgaD, flhC and flhD genes from SE-1, SE-2 and SE-3 strains. |
|
|
结果如表 4所示,与浮游态细菌相比,头孢噻肟、头孢曲松、环丙沙星、恩诺沙星和氟苯尼考对生物膜态SE-1菌株的MIC值分别提高了8、32、32、32和4倍,且该菌株形成生物膜后对后4种药物的敏感性由原来敏感转为中敏或耐药。头孢噻肟、头孢曲松、氨苄西林、庆大霉素、安普霉素、恩诺沙星、阿奇霉素和氟苯尼考对生物膜态SE-2菌株的MIC值分别提高了16、32、8、16、2、8、16和16倍,其对头孢噻肟、头孢曲松、氨苄西林、庆大霉素和恩诺沙星的敏感性由原来敏感或中敏转为中敏或耐药。头孢噻肟、头孢曲松和恩诺沙星对生物膜态SE-3菌株的MIC值分别增加了4、16和8倍,其对头孢曲松和恩诺沙星的敏感性由原来敏感转为耐药。
| 抗菌药物 Antibiotics |
细菌类型 Bacterial type |
菌株 Strain |
||
| SE-1 | SE-2 | SE-3 | ||
| 头孢噻肟CEF | Biofilm | 8/S | 16/I | 8/S |
| Plankton | 1/S | 1/S | 2/S | |
| 头孢曲松CRO | Biofilm | 8/R | 8/R | 4/R |
| Plankton | < 0.25/S | < 0.25/S | < 0.25/S | |
| 氨苄西林AMP | Biofilm | 32/R | 128/R | 128/R |
| Plankton | 32/R | 16/I | >128/R | |
| 庆大霉素GEM | Biofilm | 2/S | 32/R | 4/S |
| Plankton | 2/S | 2/S | 4/S | |
| 阿米卡星AMK | Biofilm | 2/S | 4/S | 4/S |
| Plankton | 2/S | 4/S | 4/S | |
| 安普霉素APR | Biofilm | 8/I | 16/I | 8/I |
| Plankton | 8/I | 8/I | 8/I | |
| 多西环素DOX | Biofilm | 8/I | 8/I | 2/S |
| Plankton | 8/I | 8/I | 2/S | |
| 四环素ET | Biofilm | 64/R | 64/R | 32/R |
| Plankton | 64/R | 64/R | 32/R | |
| 环丙沙星CIP | Biofilm | 8/R | < 0.25/S | < 0.25/S |
| Plankton | < 0.25/S | < 0.25/S | < 0.25/S | |
| 恩诺沙星ENR | Biofilm | 8/R | 2/R | 2/R |
| Plankton | 0.25/S | < 0.25/S | < 0.25/S | |
| 阿奇霉素AZM | Biofilm | 0.5/S | 4/S | 0.5/S |
| Plankton | 0.5/S | < 0.25/S | 0.5/S | |
| 氟苯尼考FLO | Biofilm | 8/I | 4/S | < 0.25/S |
| Plankton | 2/S | < 0.25/S | < 0.25/S | |
| 注:S:敏感;I:中敏;R:耐药. Notes: S: Sensitivity; I: Intermediation; R: Resistance. |
||||
近年来,有关猪源ExPEc分离鉴定的文献报道较多[4, 12-13],但猪源ExPEc生物膜形成能力与耐药性的研究鲜有报道。夏京津等[14]研究发现细菌生物膜的形成受菌株、菌液初始浓度、营养条件、培养条件等多种因素影响。对此,本研究首先设计4因素3水平的正交实验探讨菌液初始浓度、培养基种类、培养温度及培养时间对3株猪源ExPEc生物膜形成的影响,结果显示3株猪源ExPEc的最佳成膜条件并不一致。其中,SE-1菌株的最佳成膜条件是将OD600为0.5的起始菌液接种TSB培养基,37 ℃培养24 h;SE-2菌株的最佳成膜条件是将OD600为0.3的起始菌液接种营养肉汤,34 ℃培养24 h;SE-3菌株的最佳成膜条件是将OD600为0.5的起始菌液接种BHI培养基,34 ℃培养36 h。最佳成膜条件的确定,为后续检测其生物膜形成能力及生物膜态下细菌的耐药性奠定基础。
大肠埃希氏菌生物膜的形成与其黏附、运动、群体感应及代谢等均有关系,受多种相关基因的调控。已有研究报道[15-16]外膜蛋白Iha和I型菌毛蛋白是致病性大肠埃希氏菌的重要黏附素,其编码基因iha和fimA是重要的生物膜形成相关基因。张祥武[17]研究发现鞭毛调控基因flhD/flhC通过调控大肠埃希氏菌运动性而影响其生物膜形成。赵俊桥[18]证实大肠埃希氏菌毒素——抗毒素(toxin-antitoxin,TA)系统中的hipA基因可通过影响胞外DNA浓度而影响生物膜形成。Vuotto等[19]报道了LuxS和pga操纵子(A/B/C/D)是大肠埃希氏菌群体感应系统(quorum sensing,QS)中的两个重要调节基因,它们分别编码QS信号分子合成酶和生物膜中多糖主要成分β-1, 6-N-乙酰葡聚糖胺合成酶,在细菌生物膜形成过程的初始黏附和成熟过程中发挥调节作用。本研究采用PCR方法检测猪源ExPEc分离株携带生物膜形成相关基因情况,结果显示它们均同时携带上述10种生物膜形成相关基因,这一结果从基因层面初步揭示了3株猪源ExPEc成膜能力强的主要原因,这也预示着可将抑制成膜基因的表达或研制其编码蛋白的结构竞争物来抑制生物膜的形成,从而作为一种抗菌治疗的研究方向达到抗生物膜细菌感染的目的。
MIC值是美国国家临床实验室标准化委员会(Clinical and Laboratory Standards Instute,NCCLS)制定的体外试验敏感与耐药的判断标准。本研究检测了12种抗菌药物对浮游态与生物膜态猪源ExPEc分离株的MIC值,结果发现,与浮游菌相比,头孢曲松、环丙沙星、恩诺沙星和氟苯尼考对生物膜态SE-1菌株的MIC值分别提高了4−32倍,药物敏感性由敏感转为中敏或耐药;头孢噻肟、头孢曲松、氨苄西林、庆大霉素和恩诺沙星对生物膜态SE-2菌株的MIC值分别提高了8−32倍,由敏感转为中敏或由中敏转为耐药;头孢曲松和恩诺沙星对生物膜态SE-3菌株的MIC值分别增加了8−16倍,由敏感转为耐药。上述结果表明仅以浮游菌所做的药敏试验结果可能并不能真实评估抗菌药物对生物膜细菌的耐药性,在临床上判断抗菌药物治疗效果应依据实际造成感染的细菌状态来确定。
已有研究认为细菌的生物膜形成能力与耐药性是密切相关的,一方面生物膜胞外多糖可阻止外源抗生素进入膜内,降低了抗生素对膜内细菌的抑制或杀伤作用[20];另一方面细菌生物膜内营养缺乏使细菌生长与代谢较游离态缓慢,导致其对抗生素不敏感[21]。此外,生物膜内细菌的群体感应系统与一些耐药基因可协同表达而导致耐药[22]。药物外排泵和超广谱β-内酰胺酶(extended-spectrum β-lactamase,ESBLs)的产生分别是细菌对喹诺酮类药物和头孢曲松耐药的主要机制之一[23-24],本研究中3株生物膜态猪源ExPEc对头孢曲松和喹诺酮类药物均呈现耐药,我们认为这些分离株可能是通过表达LuxS基因和pga操纵子,协同表达了外排泵基因和ESBLs基因而导致耐药性的产生,但其内在的相关性机制有待于进一步研究。猪源ExPEc生物膜形成能力与耐药性的关系仍需使用大样本进行广泛深入研究,才能得到客观、准确的评价。
| [1] |
Dezfulian H, Batisson I, Fairbrother JM, et al. Presence and characterization of extraintestinal pathogenic Escherichia coli virulence genes in F165-positive E. coli strains isolated from diseased calves and pigs[J]. Journal of Clinical Microbiology, 2003, 41(4): 1375-1385. DOI:10.1128/JCM.41.4.1375-1385.2003 |
| [2] |
Maynard C, Bekal S, Sanschagrin F, et al. Heterogeneity among virulence and antimicrobial resistance gene profiles of extraintestinal Escherichia coli isolates of animal and human origin[J]. Journal of Clinical Microbiology, 2004, 42(12): 5444-5452. DOI:10.1128/JCM.42.12.5444-5452.2004 |
| [3] |
Zhang QX, Xu YD, Wang ZF, et al. Identification and drug resistance analysis of Escherichia coli isolated from pig origin[J]. Shanghai Animal Husbandry and Veterinary Newsletter, 2017(6): 6-9. (in Chinese) 张青娴, 徐引弟, 王治方, 等. 猪源肠外大肠杆菌的分离鉴定及耐药性分析[J]. 上海畜牧兽医通讯, 2017(6): 6-9. |
| [4] |
Zhu YC, Dong WY, Ma JL, et al. Characterization and virulence clustering analysis of extraintestinal pathogenic Escherichia coli isolated from swine in China[J]. BMC Veterinary Research, 2017, 13(1): 94. DOI:10.1186/s12917-017-0975-x |
| [5] |
Zhu XT. Isolation and identification of procine extracorporeal pathogenic Escherichia coli and pathogenicity evaluation[D]. Master's Thesis of Anhui Agricultural University, 2018 (in Chinese) 朱雪婷.猪源肠外致病性大肠杆菌的分离鉴定及致病性评价[D].安徽农业大学硕士学位论文, 2018 http://cpfd.cnki.com.cn/Article/CPFDTOTAL-SYBL201807001003.htm |
| [6] |
Dufour D, Leung V, Lévesque CM. Bacterial biofilm: structure, function, and antimicrobial resistance[J]. Endodontic Topics, 2010, 22(1): 2-16. DOI:10.1111/j.1601-1546.2012.00277.x |
| [7] |
Abdullahi UF, Igwenagu E. Intrigues of biofilm: a perspective in veterinary medicine[J]. Veterinary World, 2016, 9(1): 12-18. DOI:10.14202/vetworld.2016.12-18 |
| [8] |
Pál Z, Urbán E, Dósa E, et al. Biofilm formation on intrauterine devices in relation to duration of use[J]. Journal of Medical Microbiology, 2005, 54(12): 1199-1203. DOI:10.1099/jmm.0.46197-0 |
| [9] |
Stepanović S, Vuković D, Dakić I, et al. A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J]. Journal of Microbiological Methods, 2000, 40(2): 175-179. DOI:10.1016/S0167-7012(00)00122-6 |
| [10] |
Andrews JM. Determination of minimum inhibitory concentrations[J]. Journal of Antimicrobial Chemotherapy, 2001, 48(S1): 5-16. |
| [11] |
Chen Q. Research progress on experimental methods of bacterial biofilm[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 1997, 2(4): 295-298, 304. (in Chinese) 陈迁. 细菌生物被膜实验方法的研究进展[J]. 中国临床药理学与治疗学杂志, 1997, 2(4): 295-298, 304. |
| [12] |
Tang XB, Tan C, Zhang X, et al. Antimicrobial resistances of extraintestinal pathogenic Escherichia coli isolates from swine in China[J]. Microbial Pathogenesis, 2011, 50(5): 207-212. DOI:10.1016/j.micpath.2011.01.004 |
| [13] |
Jahanbakhsh S, Smith MG, Kohan-Ghadr HR, et al. Dynamics of extended-spectrum cephalosporin resistance in pathogenic Escherichia coli isolated from diseased pigs in Quebec, Canada[J]. International Journal of Antimicrobial Agents, 2016, 48(2): 194-202. DOI:10.1016/j.ijantimicag.2016.05.001 |
| [14] |
Xia JJ, Zhang HY, Xu R, et al. Establishment of in vitro biofilm model and influence factors of Aeramonasveronii[J]. Chinese Journal of Veterinary Drug, 2015, 49(10): 10-14. (in Chinese) 夏京津, 张海月, 许瑞, 等. 维氏气单胞菌生物膜体外模型的建立及影响因素的研究[J]. 中国兽药杂志, 2015, 49(10): 10-14. |
| [15] |
Wang JY, Stanford K, McAllister TA, et al. Biofilm formation, virulence gene profiles, and antimicrobial resistance of nine serogroups of non-O157 shiga toxin-producing Escherichia coli[J]. Foodborne Pathogens and Disease, 2016, 13(6): 316-324. DOI:10.1089/fpd.2015.2099 |
| [16] |
Dong J. Cloning and expression of fimA from uropathogenic Escherichia coli[D]. Master's Thesis of Tianjin Medical University, 2011 (in Chinese) 董杰.尿道致病性大肠杆菌fimA基因的克隆与表达[D].天津医科大学硕士学位论文, 2011 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2001363 |
| [17] |
Zhang XW. The role of E. coli density-sensing regulator C (QseC) in the expression of flagellum-regulated gene flhDC[D]. Master's Thesis of Kunming Medical University, 2015 (in Chinese) 张祥武.大肠杆菌密度感应调节子C (QseC)在鞭毛调控基因flhDC mRNA表达中的作用研究[D].昆明医科大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10678-1015632521.htm |
| [18] |
Zhao JQ. The TA system gene hipBA in Escherichia coli affects biofilm formation and DNA release[D]. Master's Thesis of Shandong University, 2012 (in Chinese) 赵俊桥.大肠杆菌TA系统基因hipBA对生物膜的形成以及DNA释放的影响[D].山东大学硕士学位论文, 2012 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2182304 |
| [19] |
Vuotto C, Longo F, Pascolini C, et al. Biofilm formation and antibiotic resistance in Klebsiella pneumoniae urinary strains[J]. Journal of Applied Microbiology, 2017, 123(4): 1003-1018. DOI:10.1111/jam.13533 |
| [20] |
Anderl JN, Franklin MJ, Stewart PS. Role of antibiotic penetration limitation in Klebsiella pneumoniae biofilm resistance to ampicillin and ciprofloxacin[J]. Antimicrobial Agents and Chemotherapy, 2000, 44(7): 1818-1824. DOI:10.1128/AAC.44.7.1818-1824.2000 |
| [21] |
Szomolay B, Klapper I, Dockery J, et al. Adaptive responses to antimicrobial agents in biofilm[J]. Environmental Microbiology, 2005, 7(8): 1186-1191. DOI:10.1111/j.1462-2920.2005.00797.x |
| [22] |
Ehrlich GD, Ahmed A, Earl J, et al. The distributed genome hypothesis as a rubric for understanding evolution in situ during chronic bacterial biofilm infectious processes[J]. FEMS Immunology & Medical Microbiology, 2010, 59(3): 269-279. |
| [23] |
Shao LP, Zhang JY. Research advances on antibacterial activity and bacterial resistance of quinolones[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(9): 2773-2782. (in Chinese) 邵莉萍, 张继瑜. 喹诺酮类药物的抗菌活性与细菌耐药性研究进展[J]. 中国畜牧兽医, 2017, 44(9): 2773-2782. |
| [24] |
Li CQ, Yao XK, Zhou QX. Analysis of literatures about drug resistant trend of pathogens causing urinary tract infection to ceftriaxone[J]. Chinese Journal of Pharmacoepidemiology, 2015, 24(12): 746-749. (in Chinese) 李苌清, 姚欣凯, 周岐新. 尿路感染病原菌对头孢曲松耐药的文献分析[J]. 药物流行病学杂志, 2015, 24(12): 746-749. |
 2020, Vol. 47
2020, Vol. 47