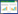扩展功能
文章信息
- 刘一贤, 施玉萍, 戴利铭, 李岚岚, 蔡志英
- LIU Yi-Xian, SHI Yu-Ping, DAI Li-Ming, LI Lan-Lan, CAI Zhi-Ying
- 橡胶褐根病拮抗放线菌17-7的筛选、鉴定及发酵条件优化
- Screening, identification and fermentation optimization of an antimicrobial actinomycete strain 17-7 to Phellinus noxius
- 微生物学通报, 2020, 47(1): 118-129
- Microbiology China, 2020, 47(1): 118-129
- DOI: 10.13344/j.microbiol.china.190160
-
文章历史
- 收稿日期: 2019-03-04
- 接受日期: 2019-06-17
- 网络首发日期: 2019-07-10
橡胶树根病是严重危害橡胶树的一类病害,我国胶园发病率在2%以上[1]。褐根病是由有害木层孔菌(Phellinus noxius Corner)侵染引起的橡胶树根部病害,受害胶树地上部分表现为叶片黄化、变小、容易脱落,树干逐渐干枯至死亡。该病原菌危害范围较广,可侵染超过59科200种植物[2-4]。褐根病在国内的植胶园中普遍发生,发病严重的林段发病率达到10%[5],对橡胶树造成根部腐烂,轻病患株吸收功能下降,影响产胶量,严重发病时可以引起整株树根腐烂,最终导致植株死亡。对于橡胶树根病的防治,目前生产上通常采用化学药剂结合农业措施,深挖隔离沟阻断病根接触,挖除病根表土、对病根进行高温暴晒,通过高温和连续光照杀死病原菌,从而减少病原菌侵染和传播途径,达到防治目的[6]。十三吗啉等作为防治橡胶树根病的有效药剂,其防治成本较高;多菌灵、三唑类杀菌剂等农药的普遍使用,对作物及其环境均存在一定的药害和污染,且连续使用易产生抗药性。
绿色发展是当今时代的主题,利用有益微生物对植物病害进行生物防治已成为当今社会发展的需要,国内外已有不少关于橡胶病害生物防治的研究报道。赵璐璐等[7]从橡胶树根部分离到一株枯草芽孢杆菌(Bacillus subtilis),其对5种橡胶树根病菌都具有很强的抑菌活性。李和平等[8]、秦云霞等[9]测定了不同木霉菌株对橡胶树褐根病菌和红根病菌的拮抗能力,发现木霉菌对橡胶褐根病菌和红根病菌具有显著拮抗作用。时涛等[10]从橡胶树根、花序、树皮、叶柄、叶片和果实等部位分离到两株内生芽孢杆菌,对橡胶树多主棒孢病菌(Corynespora cossiicola)和炭疽病菌(Colletotrichum gloeosporioides)具有较好的拮抗作用。放线菌是一类具有重要经济价值和生物研究价值的微生物资源菌,能够产生大量的抗生素、酶及其抑制剂等具有生物活性的物质[11]。放线菌产生的抗生素在农作物病虫害的生物防治上也有广泛的应用[12],如井冈霉素[13-14]、农抗120[15-16]等,但目前对于放线菌防治橡胶树根病的报道甚少。本研究从云南省植胶区橡胶树根际土壤中筛选到一株对橡胶树褐根病具有强拮抗作用的生防放线菌,并对该菌株进行鉴定、发酵条件优化等研究,以期为开发防治橡胶树根病的生防菌剂提供理论基础。
1 材料与方法 1.1 材料 1.1.1 供试样品从云南省红河(河口、金平)、德宏(盈江、瑞丽)、临沧(孟定)、普洱(江城、西蒙)等植胶区采集橡胶树根际土样。采土时,先铲去表层土,挖5−20 cm深度的土壤100 g,装入自封袋内,写好标签,封好袋口,带回实验室。
1.1.2 培养基土壤分离培养基为高氏一号培养基;平板对峙培养基为马铃薯葡萄糖琼脂培养基(PDA);种子液培养为液体高氏一号培养基;活性检测培养基为酵母麦芽汁葡萄糖培养基(YMG)[17];基础发酵培养基(g/L):淀粉10.0,KNO3 20.0,KH2PO4 1.0,NaCl 1.0,CaCO3 3.0,pH 7.2−7.4。
1.1.3 主要试剂和仪器Bacteria Genomic DNA Kit,北京康为世纪公司;PCR引物,北京六合华大基因科技有限公司;可溶性淀粉、KNO3、KH2PO4等分析纯试剂,生工生物工程(上海)股份有限公司。PCR仪,Applied Biosystems公司;电泳仪,北京六一生物科技有限公司;恒温培养箱,明尼苏达矿务及制造业公司;恒温振荡培养箱,上海博迅实业有限公司。
1.1.4 供试菌株橡胶树白根病菌(Rigidoporus lignosus)、橡胶树褐根病菌(Phellinus noxius)、尖孢炭疽病菌(Colletotrichum acutatum)、胶孢炭疽病菌(Colletotrichum gloeosporioides)、棒孢霉落叶病菌(Corynespora cassiicola)均由本实验室保存。
1.2 方法 1.2.1 放线菌的分离与纯化先将采集的土样在自然条件下风干,再用灭菌的研钵研磨,称取2.5 g研磨后的样品于盛有25 mL无菌水的三角瓶中,振荡均匀后静置10 min,采用梯度稀释法,取稀释100倍的200 μL稀释液均匀涂布在高氏一号平板上。设置培养箱温度为28 ℃,将涂布好的平板放入培养箱内,4−5 d后根据所培养的菌落特点,初步鉴定为放线菌后挑取单菌落进行编号。采用划线法对分离到的菌株进行纯化后于斜面4 ℃保存和甘油管中−20 ℃保存。
1.2.2 拮抗放线菌初筛采用平板对峙法对分离到的放线菌进行抑菌活性的初筛。在平板四周等距离处接种放线菌,28 ℃培养2 d,待放线菌略长出菌丝后,在平板中央接入一个褐根病菌(Phellinus noxius)菌饼(直径为5 mm)。以只接种病原菌的平板作为对照,重复3次,调节培养箱温度为28 ℃,将平板置于培养箱内4−5 d后,取出测量病原菌直径。
1.2.3 拮抗放线菌复筛采用菌丝生长速率法。用活性检测培养基YMG进行摇瓶培养,28 ℃、160 r/min培养5 d后取1 mL经0.22 μm滤膜过滤后的发酵液与19 mL融化后冷却至60 ℃左右的PDA培养基混匀,以等体积无菌水与PDA混合作为对照,制成平板。在平板中央分别接入橡胶树白根病菌(Rigidoporus lignosus)、橡胶树褐根病菌(Phellinus noxius)、尖孢炭疽病菌(Colletotrichum acutatum)、胶孢炭疽病菌(Colletotrichum gloeosporioides)、棒孢霉落叶病菌(Corynespora cassiicola)菌饼(直径为5 mm),重复3次,设置培养箱温度为28 ℃,置于培养箱内4−5 d后取出。各处理菌落直径采用十字交叉法进行测量,并计算菌丝生长抑制率:抑制率(%)=[(对照病原菌菌落直径−处理病原菌菌落直径)/(对照病原菌菌落直径−菌饼直径)]×100。
1.2.4 菌株的鉴定形态鉴定[18]:采用插片法,将融化的高氏一号培养基制成具有一定厚度的平板,灭菌的盖玻片斜插入培养基中,然后将菌株接种于插片和培养基接触处。在28 ℃恒温培养箱中培养10−30 d后,用镊子小心将盖玻片取出,置于擦拭干净的载玻片上,在光学显微镜下观察记录基内菌丝、气生菌丝的形状特征以及孢子链的有无等。
培养特征及生理生化特征:菌株培养特征观察及生理生化试验参照徐丽华等[19]的方法进行。
系统发育学特征[18]:提取目标菌株总DNA,采用16S rRNA基因的通用引物27-F和1492-R对基因组DNA进行PCR扩增。扩增产物送往深圳华大基因进行一代双向测序,经Contig Express软件拼接后将序列提交至GenBank。根据BLAST在线比对结果,选取覆盖度和相似性较高并且有效发表的菌株序列,用MEGA 6.0软件邻接法进行聚类分析,构建系统发育树。
1.2.5 目标菌株发酵液制备种子液:挑取单个菌落接种于装有100 mL液体高氏一号培养基的三角瓶中,置于28 ℃恒温振荡培养箱140 r/min培养5 d。
发酵:在500 mL三角瓶中装入100 mL基础发酵培养基,以10%的接种量在三角瓶中接入已培养好的种子液,置于28 ℃恒温振荡培养箱160 r/min培养5 d后,发酵液12 000 r/min离心15 min,将上清液吸取至另一灭菌的离心管中,经0.22 µm的微孔滤膜过滤,获得无菌发酵滤液。
1.2.6 发酵条件优化(1) 不同碳、氮源对菌株17-7发酵液抑菌活性的影响:采用基础发酵培养基,以1% (质量体积比)的比例,分别选用蔗糖、葡萄糖、可溶性淀粉、麦芽糖、乳糖作为碳源; 以2%的比例,分别选用蛋白胨、大豆粉、牛肉膏、酵母膏、硫酸铵、麦芽浸粉、KNO3作为碳源。根据预实验结果将菌株发酵滤液稀释5倍后取1 mL与99 mL融化冷却至60 ℃左右的PDA培养基混匀,以等体积无菌水与PDA混合作为对照,制成平板。在平板中央接入一个橡胶褐根病菌(直径为5 mm),重复3次,计算菌丝生长抑制率。发酵培养后,将发酵液过滤烘干,称得菌体干重,换算出1 L发酵液里所含的菌体干重(g),用质量浓度表示菌浓度(g/L),筛选出最佳碳氮源。
(2) 正交试验:根据基础发酵培养基中除碳氮源以外的3种无机盐,以及上述单因子试验所筛选出的最佳碳氮源,设计5因素4水平的正交试验(表 1)。
| 因子Factors | 水平Levels | |||
| 1 | 2 | 3 | 4 | |
| A Glucose (g/L) | 10.0 | 15 | 20.0 | 25 |
| B Soy powder (g/L) | 10.0 | 15 | 20.0 | 25 |
| C KH2PO4 (g/L) | 0.5 | 1 | 1.5 | 2 |
| D NaCl (g/L) | 0.5 | 1 | 1.5 | 2 |
| E CaCO3 (g/L) | 0.5 | 1 | 1.5 | 2 |
(3) 发酵条件优化:在确定发酵基础培养基中各成分最佳配比的基础上,测定不同发酵条件下菌株17-7菌丝干重和发酵滤液对橡胶褐根病菌的抑菌活性。1)起始pH:保持其他培养条件不变,调节培养基的起始pH值为5.0、6.0、7.0、8.0、9.0、10.0,确定最适pH值;2)瓶装量:保持其他培养条件不变,在500 mL的三角瓶中,分别装入50、100、150、200 mL的培养基,确定最适装瓶量;3)培养温度:保持其他培养条件不变,设置摇床培养温度为25、28、30、32 ℃,确定最适培养温度;4)转速:保持其他培养条件不变,设置摇床转速为140、160、180、200、220 r/min,确定最佳培养转速。5)接种量:保持其他培养条件不变,将种子液以2%、4%、6%、8%、10%的接种量接入到培养基中,确定最佳接种量;6)培养时间:保持其他培养条件不变,分别培养5、6、7、8、9、10 d,确定最佳培养时间。
2 结果与分析 2.1 放线菌的分离与纯化从云南省主要橡胶树根病发生区普洱(江城、西蒙)、红河(河口、金平)、德宏(瑞丽、盈江)、临沧(孟定)采集土壤样品。从采集到的44份土样中分离到放线菌161株,这些菌株的气生菌丝呈不同的颜色,除少部分菌株产生可溶性色素外,大部分菌株不产生色素。
2.2 拮抗放线菌的初筛采用平板对峙法对分离到的放线菌进行初筛,筛选到一株对橡胶树褐根病菌有较好抑制作用的放线菌(图 1),编号为17-7,病原菌直径为46.84 mm,与对照相比具有明显的抑制效果。

|
| 图 1 菌株17-7对橡胶褐根病菌的拮抗作用 Figure 1 The antagonism of strain 17-7 against Phellinus noxius 注:A:菌株17-7的拮抗作用;B:对照. Note: A: The antagonism of strain 17-7; B: Control. |
|
|
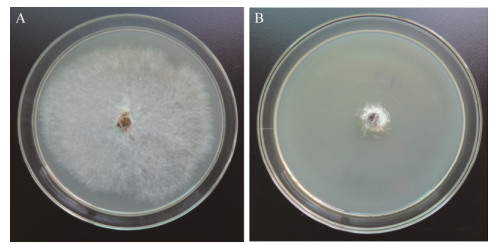
采用活性检测培养基对菌株17-7进行发酵后获得发酵液,菌丝生长速率法测定了菌株17-7对橡胶树上5种病原菌的抑菌活性,结果显示菌株17-7发酵滤液对供试的5种病原真菌都具有较强的抑制作用(表 2),抑菌率在78.71%−90.01%之间,抑菌谱较广。对橡胶树胶孢炭疽菌和褐根病菌(图 2)抑制效果最显著,抑菌率分别为90.01%、89.28%。对尖孢炭疽菌抑制效果最差,抑菌率为78.71%。
|
| 图 2 菌株17-7发酵滤液对橡胶褐根病菌的抑制效果 Figure 2 Inhibition effect of fermentation filtrate of strain 17-7 on Phellinus noxius 注:A:对照;B:菌株17-7. Note: A: Control; B: Strain 17-7. |
|
|
| 供试菌株 Plant pathogenes |
抑菌率 Inhibition rate (%) |
| Colletotrichum gloeosporioides | 90.01±1.69a |
| Colletotrichum acutatum | 78.71±3.22b |
| Corynespora cassiicola | 79.08±1.95b |
| Rigidoporus lignosus | 82.62±4.09b |
| Phellinus noxius | 89.28±1.38a |
| 注:表中数据后小写字母不同表示在P < 0.05水平差异显著. Note: Significant difference at P < 0.05 level was reflected in different lowercase letters following the figures. |
|
菌株17-7在高氏一号培养基上起初为白色,慢慢变为紫灰色,后期变为黑色,气生菌丝较为丰富(图 3)。放线菌17-7在表 3中供试的9种培养基上均生长良好,气生菌丝呈白色(ISP1、ISP5、ISP6)、黑色(ISP2、ISP7、高氏一号培养基)、深灰色(PDA)、灰黑色(ISP3、ISP4),基内菌丝呈橙黄色(PDA)、白色(ISP1、ISP2、ISP3、ISP5、ISP6、高氏一号培养基)、浅褐色(ISP4)、红棕色(ISP7),产生黄色(ISP3)、橙黄色(ISP2、ISP7)色素(表 3)。

|
| 图 3 菌株17-7在光学显微镜下的气生菌丝形态(400×) Figure 3 Aerial mycelia of strain 17-7 under optical microscope (400×) |
|
|
| 培养基 Medium |
气生菌丝 Aerial mycelium |
营养菌丝 Vegetative myceliun |
可溶性色素 Soluble pigment |
| PDA | Dark grey | Orange-yellow | None |
| Gause No.1 agar | Black | White | None |
| ISP1 | White | White | None |
| ISP2 | Black | White | Orange-yellow |
| ISP3 | Gray black | White | Yellow |
| ISP4 | Gray black | Sandy beige | None |
| ISP5 | White | White | None |
| ISP6 | White | White | None |
| ISP7 | Black | Reddish brown | Orange-yellow |
生理生化特征试验结果显示(表 4),菌株17-7能产生过氧化氢酶、脲酶和脂酶,能使明胶液化、牛奶凝固和胨化、硝酸盐还原、纤维素分解(产生纤维素酶),不能使淀粉水解(产生淀粉酶),不能产生氧化酶和H2S,NaCl的耐受范围为1%−4%,pH的耐受范围为6.0−8.0,可以利用葡萄糖、麦芽糖、蔗糖、乳糖,不能利用果糖,氮源利用试验表明不能利用丙氨酸、甘氨酸、天冬氨酸、酪氨酸、精氨酸。
| 试验项目 Items |
结果 Results |
| Oxidase test | − |
| Catalase test | + |
| Urease | + |
| Lipoidase | + |
| Gelatin liquefaction | + |
| Coagulation of milk | + |
| Peptonization of milk | + |
| Hydrolysis of starch | − |
| Cellulose decomposition | + |
| Nitrate reduction | + |
| H2S production | − |
| Salt tolerance | 1%−4% |
| Glucose | + |
| Maltose | + |
| Cane-sugar | + |
| D-fructose | − |
| Lactose | + |
| Alanine | − |
| Arginine | − |
| Asparagine | − |
| Tyrosine | − |
| Glycine | − |
| 注:+:阳性;−:阴性. Note: +: Positive; −: Negative. |
|
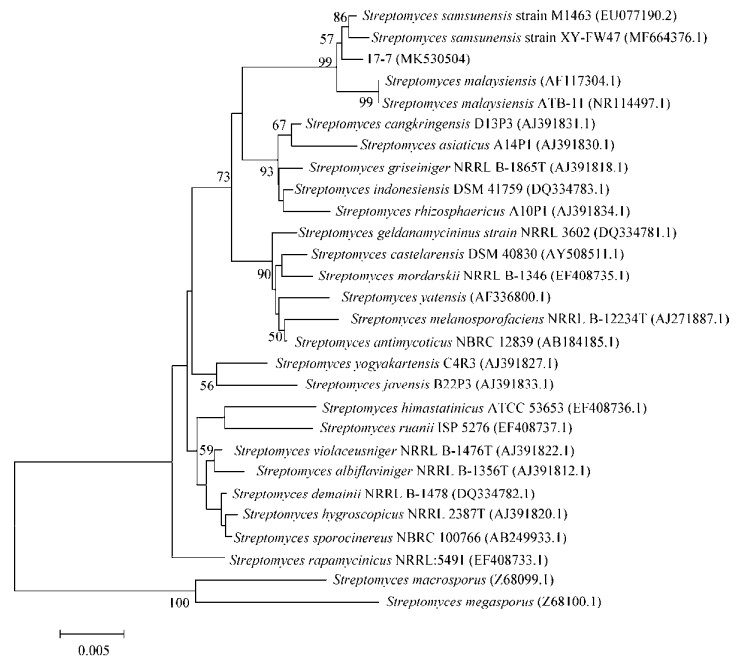
用16S rRNA基因通用引物对菌株17-7进行序列扩增并测序得到1 520 bp的序列,将序列提交到GenBank,获得登录号为MK530504,经BLAST比对,选取覆盖度和相似性较高且有效发表的菌株进行16S rRNA基因序列的系统发育分析,构建系统发育树(图 4)。从聚类结果可以看出菌株17-7与桑树链霉菌(Streptomyces samsunensis) M1463聚在同一个分支上,且序列相似性为99.72%。结合菌株的培养特征和生理生化特征,鉴定菌株17-7为桑树链霉菌(Streptomyces samsunensi)。
2.7 菌株17-7培养条件的优化 2.7.1 不同碳源和氮源对菌株17-7发酵液抑菌活性和菌丝干重的影响采用5种碳源获得的菌株17-7发酵液经稀释后均对橡胶褐根病菌有一定的抑制作用,其中葡萄糖作为碳源的菌株发酵液抑菌率最高,为65.00%,显著高于其他碳源(表 5)。果糖、蔗糖、麦芽糖、可溶性淀粉作为碳源抑菌活性不理想,其中抑菌率最差的是蔗糖(13.92%)。比较5种碳源发酵后的菌体干重,葡萄糖作为碳源时菌体干重为9.91 g/L,高于其他碳源,因此选择葡萄糖作为液体发酵培养基的最佳碳源。比较7种氮源下菌株17-7发酵液的抑菌活性,得知7种氮源均对橡胶褐根病菌有一定的抑制作用,其中抑菌活性较好的是麦芽浸粉和大豆粉,抑菌率分别为45.01%、40.94%,显著高于其他氮源。比较不同氮源发酵后的菌体干重,麦芽浸粉、牛肉浸膏、大豆粉时菌体干重显著高于其他氮源,分别为6.47、6.13、6.08 g/L (表 6)。由于麦芽浸粉和大豆粉时二者抑菌率和菌体干重无显著差异,出于成本考虑选择大豆粉作为液体发酵培养基的最佳氮源。
| 碳源 Carbon source |
抑菌率 Inhibition rate (%) |
菌体干重 Dry weight (g/L) |
| Sucrose | 13.96±2.82c | 8.21±0.33b |
| Maltose | 17.56±0.08cb | 8.10±0.41b |
| Lactose | 22.53±3.28b | 8.09±1.03b |
| Glucose | 65.00±4.11a | 9.91±0.92a |
| Soluble starch | 15.80±4.67c | 8.90±0.98ab |
| 注:表中数据后小写字母不同表示在P < 0.05水平差异显著. Note: Significant difference at P < 0.05 level was reflected in different lowercase letters following the figures. |
||
| 氮源 Nitrogen source |
抑菌率 Inhibition rate (%) |
菌体干重 Dry weight (g/L) |
| Soy flour | >40.94±1.22a | >6.08±0.32ab |
| Beef extract | >14.54±5.61d | >6.13±0.96ab |
| KNO3 | >12.64±2.62d | >4.00±0.08c |
| (NH4)2SO4 | >9.76±1.08d | >3.93±0.03c |
| Peptone | >21.75±6.69c | >5.31±0.49b |
| Yeast extract | >32.34±4.23b | >5.47±0.37b |
| Malt extract | >45.01±3.43a | >6.47±0.4a |
| 注:表中数据后小写字母不同表示在P < 0.05水平差异显著. Note: Significant difference at P < 0.05 level was reflected in different lowercase letters following the figures. |
||
|
| 图 4 基于16S rRNA基因序列的菌株17-7及GenBank数据库中相关菌株的系统发育分析 Figure 4 Phylogenetic tree of strain 17-7 and other related strains downloaded from GenBank based on 16S rRNA gene sequence 注:Bootstrap次数设置为1 000,邻接法构建系统发育树;括号内代表序列GenBank登录号;分支处的数字表示Bootstrap支持率;标尺表示0.5%的序列进化差异. Note: The number at branch nodes are the percentage bootstrap support based on neighbor-joining analysis of 1 000 resample data sets. Numbers in parentheses are GenBank accession number. The numbers in each branch point denote the percentages supported by bootstrap. The scale presents 0.5% sequence variance. |
|
|
根据碳源、氮源的试验结果,选择葡萄糖、大豆粉、KH2PO4、NaCl、CaCO3 5个因素,进行5因素4水平正交试验(表 7),根据抑菌活性和菌体干重结果确定最终发酵配方。正交实验结果表明,5个因素对橡胶褐根病菌抑制率的影响顺序为B > A > C > D > E,最佳水平组合为A3B4C2D3E3,方差分析表明A因素对橡胶褐根病菌抑制率的影响显著高于其他几个因素。5个因素对菌株17-7发酵液菌体干重的影响顺序为B > E > D > C > A,最佳水平组合为A3B4C2D1E4。根据方差分析的结果,D、E因素各个水平之间的抑菌率无差异显著性,由于CaCO3不溶于水,E因素各水平之间菌体干重的差异可能是由于CaCO3不溶造成的,综合两者的测定结果并出于成本的考虑,最佳组合为A3B4C2D1E1,即1 L发酵培养基中含葡萄糖20.0 g、大豆粉25.0 g、KH2PO4 1.0 g、NaCl 0.5 g、CaCO3 0.5 g。
| No. | A | B | C | D | E | 抑菌率 Inhibition ratio (%) |
菌丝干重 Dry weight (g/L) |
| >1 | >1 | >1 | >1 | >1 | >1 | >20.79 | >4.70 |
| >2 | >1 | >2 | >2 | >2 | >2 | >36.93 | >7.04 |
| >3 | >1 | >3 | >3 | >3 | >3 | >2.02 | >9.60 |
| >4 | >1 | >4 | >4 | >4 | >4 | >37.00 | >11.93 |
| >5 | >2 | >1 | >2 | >3 | >4 | >36.11 | >7.35 |
| >6 | >2 | >2 | >1 | >4 | >3 | >38.39 | >8.24 |
| >7 | >2 | >3 | >4 | >1 | >2 | >12.57 | >8.56 |
| >8 | >2 | >4 | >3 | >2 | >1 | >42.23 | >9.16 |
| >9 | >3 | >1 | >3 | >4 | >2 | >15.92 | >5.39 |
| >10 | >3 | >2 | >4 | >3 | >1 | >44.25 | >6.06 |
| >11 | >3 | >3 | >1 | >2 | >4 | >15.25 | >10.88 |
| >12 | >3 | >4 | >2 | >1 | >3 | >58.14 | >11.61 |
| >13 | >4 | >1 | >4 | >2 | >3 | >18.23 | >6.88 |
| >14 | >4 | >2 | >3 | >1 | >4 | >12.39 | >9.57 |
| >15 | >4 | >3 | >2 | >4 | >1 | >2.13 | >7.94 |
| >16 | >4 | >4 | >1 | >3 | >2 | >50.06 | >8.15 |
| K1 | >24.19 | >22.76 | >31.12 | >25.97 | >27.35 | ||
| K2 | >32.33 | >32.99 | >33.33 | >28.16 | >28.87 | ||
| K3 | >33.39 | >7.99 | >18.14 | >33.11 | >29.20 | ||
| K4 | >20.70 | >46.86 | >28.01 | >23.36 | >25.19 | ||
| R | >12.69 | >38.87 | >15.19 | >9.75 | >4.01 | ||
| K1′ | >8.32 | >6.08 | >7.99 | >8.61 | >6.97 | ||
| K2′ | >8.33 | >7.73 | >8.49 | >8.49 | >7.29 | ||
| K3′ | >8.49 | >9.25 | >8.43 | >7.79 | >9.08 | ||
| K4′ | >8.14 | >10.21 | >8.36 | >8.38 | >9.93 | ||
| R′ | >0.35 | >4.13 | >0.49 | >0.82 | >2.97 |
在正交试验确定了最优发酵培养基配方的基础上,对发酵条件进行了优化。在优先考虑抑菌率的前提下明确菌株17-7最优的发酵条件:培养基装瓶量为150 mL/500 mL,起始pH 8.0,摇瓶培养转速为140 r/min,接种量为10%,培养温度为28 ℃,培养时间为5 d,这时抑菌活性最佳(图 5)。

|
| 图 5 不同培养条件对菌株17-7发酵液抑菌率及菌体干重的影响 Figure 5 Effect of different culture conditions on the accumulation of mycelium and inhibition activity of submerged cultured 17-7 注:A:初始pH;B:接种量;C:转速;D:装液量;E:发酵时间;F:温度.小写字母不同表示在P < 0.05水平差异显著. Note: A: Initial pH; B: Inoculation amount; C: Rotate speed; D: Medium volume; E: Fermentation time; F: Temperature. Significant difference at P < 0.05 level was reflected in different lowercase letters. |
|
|
放线菌是一类具有发展前景的微生物资源,其中链霉菌(Streptomyces)因其产孢量大、孢子存活时间长、易于制成活细胞制剂(如孢子粉剂、种衣剂)、菌丝体培养物等优点被广泛应用于农业病害防治中[20-21]。拮抗放线菌通过对土壤或者植物根际中碳源的竞争利用可以有效阻止病原菌的生长,从而能够阻止病原菌对植物的侵染[22]。本研究从云南省根病发生区采集的橡胶树根际土壤中分离到一株对橡胶树根病具有较好抑制作用的放线菌,编号为17-7。根据形态特性、培养特征、生理生化特征及16S rRNA基因序列的进化关系鉴定菌株17-7为链霉菌,与桑树链霉菌(Streptomyces samsunensis)具有较近的亲缘关系,且培养特征等生理指标与其相符,属于紫黑链霉菌16S rRNA基因进化分支(Streptomyces violaceusniger 16S rRNA gene clade)[23]。紫黑链霉菌16S rRNA基因进化分支的成员包括Streptomyces samsunensis、Streptomyces himastatinicu、Streptomyces mordarskii、Streptomyces rapamycinicus、Streptomyces ruanii、Streptomyces castelarensis[24]等多个种,是链霉菌16S rRNA基因系统发育树中的一个重要进化分支。紫黑链霉菌具有丰富的生物活性,能产生多种重要的抗生素,如雷帕霉素[24]、黑莫他丁[24]、井冈霉素、有效霉素和农抗120[25-27]等,且对多种病害具有较好的拮抗效果。焦敬华等[27]报道了紫黑链霉菌进化分支菌株对山药炭疽病具有较好的拮抗效果,Getha等[28]报道了其对香蕉枯萎病菌具有较好的生防潜力。菌株17-7发酵滤液对橡胶树的5种病原真菌都具有较强的抑制作用,抑菌率在78.71%−90.01%之间,抑菌谱较广,对橡胶树胶孢炭疽菌和褐根病菌抑制效果最显著,抑菌率分别为90.01%、89.28%,具有较大的生防潜力,有望开发成一种具广谱杀菌活性的生防菌剂。
发酵是微生物获得活性物质的重要途径,而发酵培养基对活性物质的代谢合成具有十分重要的作用[29],不同的发酵培养基对其代谢产物的抑菌活性也具有较大影响[30]。大量研究表明,优化培养基配方及其培养条件能显著提高链霉菌发酵液的抑菌活性。本研究采用单因子试验和正交试验相结合对目标菌株17-7进行发酵条件优化,在综合考虑抑菌率及发酵成本的前提下,获得了适宜目标菌株产活性物质的发酵培养基配方和培养条件,但未考虑交互作用,优化后菌株的抑菌活性和菌体干重都显著提高。不同碳源、氮源对菌株17-7抑菌活性物质的产生具有较大差异,葡萄糖作为碳源时,稀释后抑菌率为65.00%,大豆粉为氮源时稀释后抑菌率为40.94%。根据正交试验结果,大豆粉为影响菌株抑菌活性的主效因子,与焦敬华等[27]对山药炭疽病拮抗菌株30702的主效因子为可溶性淀粉的研究结果不一致。虽然菌株17-7与山药炭疽病拮抗菌株30702同为紫黑链霉菌16S rRNA基因进化分支菌株,但影响其抑菌活性的主要因素不同,可能是由于不同种菌株代谢途径、代谢产物之间存在差异造成的。发酵是一个复杂的过程,微生物的代谢途径,各理化因素需求不一样,其培养条件也存在差异[7, 31]。本研究仅对拮抗菌株进行了适宜产活性物质的发酵条件进行了优化。根据王游游等[32]、朱丹璐等[33]对拮抗微生物发酵液稳定性的研究表明,发酵液抑菌活性受紫外、光照、pH、高温等因素的影响,抑菌活性会减弱或丧失。因此,下一步将对发酵液中的活性物质进行分离鉴定及田间防效试验,以期能开发出稳定性好、防效高的微生物源农药。
| [1] |
He QG, Wu GL, Zheng FC. Preliminary report on chemical control of rubber root disease[J]. China Tropical Agriculture, 2011(4): 43-44. (in Chinese) 何其光, 邬国良, 郑服丛. 橡胶树根病化学防治试验初报[J]. 中国热带农业, 2011(4): 43-44. DOI:10.3969/j.issn.1673-0658.2011.04.018 |
| [2] |
Huang YZ, Liu CF. Rubber root disease and treating measures[J]. Tropical Agricultural Science & Technology, 1993, 16(1): 7-14, 29. (in Chinese) 黄雅志, 刘昌芬. 橡胶树根病及其治理措施[J]. 云南热作科技, 1993, 16(1): 7-14, 29. |
| [3] |
Li ZP, Lou DQ. Diagnostic Spectrum of Disease and Insect Pest of Rubber Tree[M]. Beijing: China Agricultural Press, 2007: 65. (in Chinese) 李增平, 罗大全. 橡胶树病虫害诊断图谱[M]. 北京: 中国农业出版社, 2007: 65. |
| [4] |
He CP, Li R, Wu WH, et al. Evaluation of 12 fungicides for suppression of Phellinus noxius[J]. Chinese Journal of Tropical Crops, 2013, 34(10): 1987-1990. (in Chinese) 贺春萍, 李锐, 吴伟怀, 等. 12种杀菌剂对橡胶树褐根病菌的毒力测定[J]. 热带作物学报, 2013, 34(10): 1987-1990. DOI:10.3969/j.issn.1000-2561.2013.10.023 |
| [5] |
Liu WB, Wu GL. Biological characteristics of fungus Phellinus noxius causing brown root disease of Hevea brasiliensis[J]. Chinese Journal of Tropical Crops, 2009, 30(12): 1835-1839. (in Chinese) 刘文波, 邬国良. 橡胶树褐根病病原菌生物学特性研究[J]. 热带作物学报, 2009, 30(12): 1835-1839. DOI:10.3969/j.issn.1000-2561.2009.12.023 |
| [6] |
He CP, Wu HL, Li R, et al. Biological characters of the pathogenic fungus causing Rigidoprus lignosu of rubber tree[J]. Chinese Journal of Tropical Crops, 2010, 31(11): 1981-1985. (in Chinese) 贺春萍, 吴海理, 李锐, 等. 橡胶树白根病菌生物学研究[J]. 热带作物学报, 2010, 31(11): 1981-1985. DOI:10.3969/j.issn.1000-2561.2010.11.020 |
| [7] |
Zhao LL, He CP, Zheng XL, et al. Effect of Bacillus subtilis strain Czk1 on different rubber root pathogens and in vitro control of Colletotrichum gloeosporioides on rubber leaf[J]. Journal of Southern Agriculture, 2011, 42(7): 740-743. (in Chinese) 赵璐璐, 贺春萍, 郑肖兰, 等. 枯草芽孢杆菌Czk1菌株对橡胶树根病菌的抑制作用及对炭疽病生防效果研究初报[J]. 南方农业学报, 2011, 42(7): 740-743. DOI:10.3969/j.issn.2095-1191.2011.07.013 |
| [8] |
Li HP, Tang CR, Yang MF, et al. Antagonistic effects of Trichoderma strains on Phellinus noxius in Hevea brasiliensis[J]. Fujian Journal of Agricultural Sciences, 2015, 30(4): 362-366. (in Chinese) 李和平, 唐朝荣, 阳美芳, 等. 木霉菌对橡胶树褐根病菌的拮抗作用[J]. 福建农业学报, 2015, 30(4): 362-366. DOI:10.3969/j.issn.1008-0384.2015.04.010 |
| [9] |
Qin YX, Tu M, Yang MF, et al. Antagonistic effect of eight strains of Trichoderma on Ganoderma pseudoferreum causing red root rot of rubber tree[J]. Chinese Journal of Tropical Agriculture, 2015, 35(3): 41-45, 53. (in Chinese) 秦云霞, 涂敏, 阳美芳, 等. 8株木霉菌对橡胶树红根病的拮抗作用[J]. 热带农业科学, 2015, 35(3): 41-45, 53. DOI:10.3969/j.issn.1009-2196.2015.03.010 |
| [10] |
Shi T, Peng JH, Liu XB, et al. Rubber endophytic bacteria population diversity and screening of antagonistic strains[J]. Forest Pest and Disease, 2011, 30(2): 5-9. (in Chinese) 时涛, 彭建华, 刘先宝, 等. 橡胶树内生细菌多样性初探及拮抗菌株的筛选[J]. 中国森林病虫, 2011, 30(2): 5-9. DOI:10.3969/j.issn.1671-0886.2011.02.002 |
| [11] |
da Vinha FNM, Gravina-Oliveira MP, Franco MN, et al. Cellulase production by Streptomyces viridobrunneus SCPE-09 using lignocellulosic biomass as inducer substrate[J]. Applied Biochemistry and Biotechnology, 2011, 164(3): 256-267. |
| [12] |
Shahidi Bonjar GH, Fooladi MH, Mahdavi MJ, et al. Broadspectrim, a novel antibacterial from Streptomyces sp.[J]. Biotechnology, 2004, 3(2): 126-130. |
| [13] |
Asano N, Kameda Y, Matsui K, et al. Validamycin H, a new pseudo-tetrasaccharide antibiotic[J]. The Journal of Antibiotics, 1990, 43(8): 1039-1041. DOI:10.7164/antibiotics.43.1039 |
| [14] |
Chen XL, Fang X, Shen YC. Mechanism, resistance and security of Jinggangmycin against Rhizoctonia solani[J]. Agrochemicals, 2010, 49(7): 481-483. (in Chinese) 陈小龙, 方夏, 沈寅初. 纹枯病菌对井冈霉素的作用机制、抗药性及安全性[J]. 农药, 2010, 49(7): 481-483. DOI:10.3969/j.issn.1006-0413.2010.07.004 |
| [15] |
Wang XS, Ren QS, Tong ZH, et al. Studies on the effective components of agricultural antibiotic 120[J]. Chinese Journal of Biological Control, 1994, 10(3): 131-134. (in Chinese) 王学士, 任清水, 仝赞华, 等. 农用抗生素120有效成份的研究[J]. 生物防治通报, 1994, 10(3): 131-134. |
| [16] |
Zhu CX, Xie DL, Ni CF. A laboratory inhibitory test of agricultural antibiotic 120 on the watermelon wither, Fusarium oxysporum[J]. Chinese Journal of Biological Control, 1990, 6(3): 124-127. (in Chinese) 朱昌雄, 谢德龄, 倪楚芳. 农抗120防治西瓜枯萎病菌的室内药效实验[J]. 生物防治通报, 1990, 6(3): 124-127. |
| [17] |
Zhao SL, Ren FE, Liu JL, et al. Screening, identification and optimization of fermentation conditions of an antagonistic actinomycetes strain to Setosphaeria turcica[J]. Acta Microbiologica Sinica, 2012, 52(10): 1228-1236. (in Chinese) 赵淑莉, 任飞娥, 刘金亮, 等. 玉米大斑病生防放线菌的筛选鉴定及发酵条件优化[J]. 微生物学报, 2012, 52(10): 1228-1236. |
| [18] |
Li W, Xiao XO, Li K, et al. Screening, identification and fermentation optimization of an antagonistic actinomycete strain XL-6 against Ralstonia solanacearum[J]. Microbiology China, 2018, 45(2): 357-367. (in Chinese) 李威, 肖熙鸥, 李可, 等. 茄子青枯病拮抗放线菌XL-6的筛选、鉴定及发酵条件优化[J]. 微生物学通报, 2018, 45(2): 357-367. |
| [19] |
Xu LH, Li WJ, Liu ZH, et al. Actinomycete Systematic—Principle, Methods and Practice[M]. Beijing: Science Press, 2007. (in Chinese) 徐丽华, 李文均, 刘志恒, 等. 放线菌系统学——原理、方法及实践[M]. 北京: 科学出版社, 2007. |
| [20] |
Xia L, Zou XW, Wang N, et al. Advances in biological control of agricultural diseases by endophytic actinomycetes[J]. Journal of Green Science and Technology, 2017(23): 116-118. (in Chinese) 夏蕾, 邹晓威, 王娜, 等. 植物内生放线菌生物防治农业病害的研究进展[J]. 绿色科技, 2017(23): 116-118. |
| [21] |
Zhan Q, Cao YL. Isolation and application of actinomycetes in soil[J]. Xiandai Horticulture, 2017(3): 24-25. (in Chinese) 詹庆, 曹雅丽. 土壤中放线菌的分离与应用[J]. 现代园艺, 2017(3): 24-25. |
| [22] |
Li L. Studies on the biocontrol mechanism of actinomycetes strainYB024 to take-all[D]. Zhengzhou: Master's Thesis of Henan Agricultural University, 2006 (in Chinese) 李乐.放线菌株YB024对小麦全蚀病生物防治机制研究[D].郑州: 河南农业大学硕士学位论文, 2006 http://cdmd.cnki.com.cn/article/cdmd-10466-2006064125.htm |
| [23] |
Sazak A, Sahin N, Güven K, et al. Streptomyces samsunensis sp. nov., a member of the Streptomyces violaceusniger clade isolated from the rhizosphere of Robinia pseudoacacia[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(6): 1309-1314. DOI:10.1099/ijs.0.021329-0 |
| [24] |
Kumar Y, Goodfellow M. Five new members of the Streptomyces violaceusniger 16S rRNA gene clade: Streptomyces castelarensis sp. nov., comb. nov., Streptomyces himastatinicus sp. nov., Streptomyces mordarskii sp. nov., Streptomyces rapamycinicus sp. nov. and Streptomyces ruanii sp. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(6): 1369-1378. DOI:10.1099/ijs.0.65408-0 |
| [25] |
Cui ZJ, Zhang KC, She GM, et al. Progress on the research of active components in antifungal agricultural antibiotics[J]. Chinese Agricultural Science Bulletin, 2010, 26(5): 213-218. (in Chinese) 崔增杰, 张克诚, 折改梅, 等. 抗真菌农用抗生素有效成分研究进展[J]. 中国农学通报, 2010, 26(5): 213-218. |
| [26] |
Zhao H. Biopesticides, its future research and applications[J]. Zhang YX, trans. World Pesticides, 2010, 32(2): 16-24, 30 (in Chinese) 招衡.生物农药及其未来研究和应用[J].张翼翾, 译.世界农药, 2010, 32(2): 16-24, 30 |
| [27] |
Jiao JH, Huang DY, Wu WQ, et al. Identification and optimization of fermentation medium of antagonistic actinomycete 30702 against yam anthracnose[J]. Chinese Journal of Tropical Crops, 2016, 37(4): 775-783. (in Chinese) 焦敬华, 黄东益, 吴文嫱, 等. 山药炭疽病菌拮抗放线菌30702菌株的初步鉴定及发酵培养基优化[J]. 热带作物学报, 2016, 37(4): 775-783. DOI:10.3969/j.issn.1000-2561.2016.04.020 |
| [28] |
Getha K, Vikineswary S. Antagonistic effects of Streptomyces violaceusniger strain G10 on Fusarium oxysporum f. sp. cubense race 4: indirect evidence for the role of antibiosis in the antagonistic process[J]. Journal of Industrial Microbiology and Biotechnology, 2002, 28(6): 303-310. DOI:10.1038/sj.jim.7000247 |
| [29] |
Lu CG, Dong HP, Zhang DP, et al. Optimization of fermentation medium components and cultural conditions for Bacillus amyloliquefaciens MH71 in flask[J]. Chinese Journal of Biological Control, 2015, 31(3): 369-377. (in Chinese) 卢彩鸽, 董红平, 张殿朋, 等. 解淀粉芽胞杆菌MH71摇瓶发酵培养基及发酵条件优化[J]. 中国生物防治学报, 2015, 31(3): 369-377. |
| [30] |
Gurovic MSV, Olivera NL. Antibacterial producing actinomycetes from Extra Andean Patagonia[J]. Journal of Arid Environments, 2017, 144: 216-219. DOI:10.1016/j.jaridenv.2017.04.015 |
| [31] |
Wang Y, Niu SQ, Zheng DD, et al. Screening, identification and optimization of fermentation conditions of an antagonistic actinomycetes to cucumber Fusarium wilt[J]. Microbiology China, 2019, 46(5): 1062-1073. (in Chinese) 王彦, 牛世全, 郑豆豆, 等. 黄瓜枯萎病拮抗放线菌的筛选、鉴定及发酵条件优化[J]. 微生物学通报, 2019, 46(5): 1062-1073. |
| [32] |
Wang YY, Jiang JZ, Wang XN, et al. Identification of antagonistic bacteria WL2 against Phytophthora infestans and stability analysis of its fermentation broth[J]. Journal of Agricultural University of Hebei, 2017, 40(4): 90-95. (in Chinese) 王游游, 蒋继志, 王雪宁, 等. 致病疫霉拮抗细菌WL2鉴定及其发酵液稳定性分析[J]. 河北农业大学学报, 2017, 40(4): 90-95. |
| [33] |
Zhu DL, Liu ZX, Liu XF, et al. Fermentation conditions and antibacterial stability of Salix matsudana wilt disease antagonistic fungi YQT13[J]. Journal of Northeast Forestry University, 2017, 45(7): 94-97. (in Chinese) 朱丹璐, 刘忠玄, 刘雪峰, 等. 拮抗旱柳枯萎病菌YQT13菌株发酵条件和抑菌稳定性[J]. 东北林业大学学报, 2017, 45(7): 94-97. DOI:10.3969/j.issn.1000-5382.2017.07.019 |
 2020, Vol. 47
2020, Vol. 47