扩展功能
文章信息
- 杨重, 徐天怡, 刘奕含, 周豪
- YANG Zhong, XU Tian-Yi, LIU Yi-Han, ZHOU Hao
- 耐盐菌Staphylococcus sp. YZ-1和Bacillus cereus CC-1的Cr(Ⅵ)脱毒特性与机理
- Cr(Ⅵ) detoxification characteristics of salt-tolerant Staphylococcus sp. YZ-1 and Bacillus cereus CC-1
- 微生物学通报, 2020, 47(1): 66-75
- Microbiology China, 2020, 47(1): 66-75
- DOI: 10.13344/j.microbiol.china.190358
-
文章历史
- 收稿日期: 2019-04-22
- 接受日期: 2019-07-29
- 网络首发日期: 2019-09-09
Cr(Ⅵ)是一种广泛存在于皮革、电镀、印染等行业废水中的污染物,对人体具有潜在的致癌、致畸、致突变效应。常用的去除方法主要包括吸附法和还原法,其中将高毒性的Cr(Ⅵ)还原为低毒性且水溶性较差的Cr(Ⅲ)是目前较为主流的方法。在这些方法中,生物移除Cr(Ⅵ)具有绿色友好、成本低廉等特点,因此在实际应用中广泛采用[1]。但是,在实际的含Cr(Ⅵ)废水中通常还会包含大量的盐分[2],筛选出能够耐受高盐度的微生物是进行生物处理高盐含铬废水的关键因素。目前已经有多种具有耐盐特性的铬移除菌株从不同的环境中筛选获得,例如Exiguobacterium sp. GS1[3]、Vigribacillus sp. H4[4]和Dunaliella sp. 1[5]。另一方面,细菌的耐盐机制已经得到了较多报道,主要的耐盐机理为利用甘氨酸甜菜碱和四氢嘧啶等物质调节体内渗透压[6]。同时也有研究者采用微生物群落直接对高盐含铬废水进行处理[7]。由于天然或人工合成的微生物群落相比于单菌具有更强的稳定性、代谢多样性以及环境适应性,研究微生物群落中的Cr(Ⅵ)去除性能具有更大的实用价值。
微生物群落去除Cr(Ⅵ)的前提条件在于这些微生物具有Cr(Ⅵ)的耐受性能。微生物在高浓度的Cr(Ⅵ)存在时,主要存在着四大类的耐受机制。首先,细菌可以通过专门的Cr(Ⅵ)膜转运蛋白(ChrA)或者非特异性的硫酸盐转运蛋白(Cys操纵子编码蛋白)以及氯高铁血红素转运蛋白将Cr(Ⅵ)从细胞质中泵出;其次,可以通过特异性或非特异性的铬还原过程(铬还原蛋白或者还原性小分子)将Cr(Ⅵ)还原为Cr(Ⅲ)。除此之外,细菌还可以通过过表达氧化压力应答蛋白(超氧化物歧化酶、谷胱甘肽转移酶、过氧化氢酶)以及DNA修复系统相关蛋白(RecG、RuvB、DNA解旋酶)等方式应对Cr(Ⅵ)的胁迫[8]。这些途径可以单独或者同时存在于特定的菌株中。
基于上述研究背景,本文的主要研究目的在于获取不同铬耐受性能的菌株,并比较其铬耐受特性;通过基因组测序及分析,从基因层面推测铬耐受相关的基因;通过构建铬还原菌的混菌体系,考察混菌对去除污染物的协同作用。
1 材料与方法 1.1 菌株和培养基实验所研究的菌株包括CC-1和YZ-1,其中CC-1为实验室前期筛选获得的硒还原菌并已被鉴定为Bacillus cereus (CICC 24251)[9],而YZ-1为本研究筛选所得。实验所用培养基为修正后的LB培养基(g/L):蛋白胨10.0,酵母浸粉5.0,NaCl 0−200.0;固体LB培养基则额外加入2.0%−2.5%琼脂。LB培养基pH为6.5−7.0,使用前需高压蒸汽灭菌(1×105 Pa,20 min),随后再在无菌操作台中紫外灭菌15 min。
1.2 主要试剂和仪器蛋白胨、酵母浸粉,北京奥博星生物技术有限公司;重铬酸钾,天津市光复科技发展有限公司;氯化钠,天津市东丽区天大化学试剂厂;氯化铜、氯化钴、氯化锰,天津市大茂化学试剂厂;亚碲酸钠,阿拉丁工业公司。电感耦合等离子体质谱仪ICP-MS,安捷伦科技有限公司;紫外分光光度计,上海舜宇恒平科学仪器有限公司;全基因组测序,北京诺禾致源科技股份有限公司。
1.3 菌株筛选与鉴定高盐铬耐受菌的筛选利用来源于青海茶卡盐湖的湖水样品。在灭菌后的修饰LB培养基(NaCl浓度为5%)中添加0.1 mmol/L K2Cr2O7以及1 mL湖水样品,30 ℃、150 r/min下培养24 h进行平板涂布,反复多轮纯化后获取纯菌,命名为YZ-1。菌株的鉴定采用16S rRNA基因测序,利用正向引物27F (5′-AGAGTTTGATCCTGGCTGGCTCAG-3′)和反向引物1492R (5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增[10]。PCR产物回收后由生工生物工程(上海)股份有限公司进行测序,获得的序列通过在线服务器Ezbiocloud (https://www.ezbiocloud.net)进行序列一致性比较,随后通过MEGA 8.0构建系统进化树。
1.4 Cr(Ⅵ)、Te(Ⅳ)测定所用测定Cr(Ⅵ)浓度的方法为二苯碳酰二肼分光光度法(GB/T 15555.5-1995)[11],测定Te(Ⅳ)浓度的方法为二乙基二硫代氨基甲酸钠(DDTC)法[12],分别利用紫外分光光度计在波长为540、340 nm下进行测量,每一组实验重复3次。
1.5 菌株YZ-1和CC-1性能研究 1.5.1 菌株YZ-1和CC-1的基本特性分别设置pH为4.0−11.0,NaCl浓度为0、50、100、150、200 g/L,Cr(Ⅵ)浓度为0.05、0.1、0.2、0.5、1 mmol/L,Cu(Ⅱ)、Co(Ⅱ)、Mn(Ⅱ)浓度为0.1、0.2、0.5 mmol/L与0.1 mmol/L Cr(Ⅵ)共存的LB培养基,接种1%菌液后培养48 h,通过菌株生长情况判断菌株YZ-1和CC-1对环境条件和常见金属离子的耐受性能。
1.5.2 菌株YZ-1和CC-1的Cr(Ⅵ)去除性能设置Cr(Ⅵ)浓度为0.1 mmol/L和NaCl浓度为50 g/L的LB培养基,分别接种1%的YZ-1和CC-1菌液,每隔12 h测量菌株的生长情况以及溶液中Cr(Ⅵ)浓度;并设置不含菌液的空白对照,在无菌条件下每隔24 h测量培养基内Cr(Ⅵ)浓度。将48 h后的样品在10 000 r/min下离心10 min,取上清液过0.22 μm PVDF膜后利用ICP-MS对总Cr浓度进行测量,根据Cr(Ⅵ)的移除率和水相中残留的总铬含量计算两株菌的Cr吸附量。
1.5.3 菌株YZ-1和CC-1的铬还原酶活性分别将菌株YZ-1和CC-1在含0.1 mmol/L Cr(Ⅵ)以及不含Cr(Ⅵ)的LB培养基中培养48 h,分别取20 mL菌液在转速为10 000 r/min下离心10 min,收集上清液用于胞外酶活的测定;将菌液沉淀用Tris-HCl (10 mmol/L,pH 8.0)洗3次,并用细胞破碎机在300 W功率下间隔1 s对细胞破碎20 min。将细胞破碎后的菌液在14 000 r/min下离心10 min,收集上清液用于胞内酶活的测定;将细胞破碎后的菌液沉淀再次用Tris-HCl洗3次,重新悬浮后用于细胞膜酶活的测定。酶活测定方法采用二苯碳酰二肼法,4 mL反应体系包括0.04 mL Cr(Ⅵ)、0.2 mL NADH、2.96 mL Tris-HCl和0.8 mL蛋白液,体系中Cr(Ⅵ)、NADH、Tris-HCl浓度分别为0.05、1、10 mmol/L,30 min后测量Cr(Ⅵ)浓度,并利用Bradford法测量体系中的蛋白含量[13],计算比酶活[μg/(mg·h)]。
1.6 菌株CC-1的休眠细胞性能研究(1) Cr(Ⅵ)浓度对CC-1休眠细胞Cr(Ⅵ)还原性能的影响
取20 mL对数生长期的CC-1菌液,10 000 r/min离心10 min后用Tris-HCl缓冲溶液重新悬浮,并利用紫外分光光度计在波长为660 nm下调节其吸光度为1.5,随后分别设置Cr(Ⅵ)浓度为0.1、0.2、0.5、1 mmol/L的休眠细胞体系,培养24 h测量溶液中Cr(Ⅵ)浓度变化。
(2) pH对CC-1休眠细胞Cr(Ⅵ)还原性能的影响
用HCl和NaOH调节pH为4.0−12.0的休眠细胞体系,加入Cr(Ⅵ)使其浓度为0.2 mmol/L,培养24 h测量溶液中Cr(Ⅵ)浓度变化。
(3) 电子供体对CC-1休眠细胞Cr(Ⅵ)还原性能的影响
分别设置电子供体为5 g/L丙酮酸钠、乙酸钠、乳酸钠、葡萄糖、甘油和柠檬酸钠的休眠细胞体系,加入Cr(Ⅵ)使其浓度为0.2 mmol/L,培养24 h测量溶液中Cr(Ⅵ)浓度变化;另设不含电子供体的空白对照,测量Cr(Ⅵ)浓度变化。
1.7 全基因组测序及生物信息学分析本实验室前期研究已经获得了菌株CC-1的基因组完成图(Genbank登录号为CP023179−CP023183)[9]。菌株YZ-1的菌体收集、DNA提取和纯度检测、测序组装、注释过程与CC-1类似(Genbank登录号为QHJX01000001−QHJX01000018)。注释采用的数据库包括KEGG、GO、NR。同时,在线服务器RAST Server也被用于基因的注释。
1.8 YZ-1/CC-1复合菌群的Cr(Ⅵ)−Te(Ⅳ)移除性能设置反应体系为20 mL 0.1 mmol/L K2Cr2O7和Na2TeO3共存的LB培养基。共接种5%菌液,分别设置菌液中YZ-1占比为100%、80%、60%、40%、20%、0% (对应的CC-1占比为0%、20%、40%、60%、80%、100%),测定24 h内Cr(Ⅵ)、Te(Ⅳ)去除率。
2 结果与分析 2.1 菌株YZ-1的鉴定通过对茶卡盐湖中耐盐菌的分离获得了一株铬耐受菌YZ-1 (GenBank登录号为MH426978),对其16S rRNA基因进行比对,表明其与Staphylococcus warneri ATCC 27836的序列一致性最高,达到了99.79%,据此构建了YZ-1的系统进化树(图 1),确定该菌株为葡萄球菌属(Staphylococcus)。

|
| 图 1 菌株YZ-1基于16S rRNA基因序列的系统进化树 Figure 1 Phylogenetic tree based on 16S rRNA gene sequences of Staphylococcus sp. YZ-1 注:括号中的序号表示菌株的GenBank号;分支上的数字为Bootstrap值,表示置信度;标尺长度代表核苷酸序列差异. Note: The number in parentheses indicates the GenBank accession numbers of bacteria; The number on each branch are bootstrap values, which represent confidence coefficient; The ruler length represents the nucleotide sequence difference. |
|
|
首先对菌株YZ-1和CC-1的基本特性进行了考察,由表 1可知,菌株YZ-1和CC-1均属于耐盐菌,且YZ-1具有更高的耐盐性能,这一性能可能与YZ-1及CC-1具有合成细胞相容性介质的基因有关。同时,两者可以耐受0.5 mmol/L的Cr(Ⅵ),这一性能介于已报道的Bacillus及Staphylococcus属细菌的耐受范围内[14-15]。此外,菌株CC-1和YZ-1对常见的重金属离子,如Cu(Ⅱ)、Co(Ⅱ)和Mn(Ⅱ)均具有一定的耐受性,在0.5 mmol/L上述离子存在时,两株菌均可以正常生长。
| 菌株Strains | NaCl (g/L) | pH | Cr(Ⅵ) (mmol/L) | Cu(Ⅱ) (mmol/L) | Co(Ⅱ) (mmol/L) | Mn(Ⅱ) (mmol/L) |
| YZ-1 | 100 | 5.0−8.0 | 0.5 | 0.5 | 0.5 | 0.5 |
| CC-1 | 50 | 4.0−11.0 | 0.5 | 0.5 | 0.5 | 0.5 |
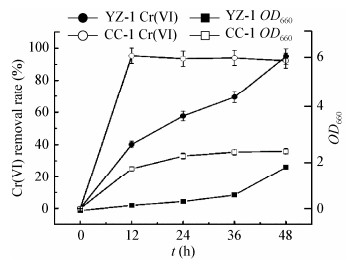
图 2展示了菌株YZ-1和CC-1在修饰LB培养基中的Cr(Ⅵ)性能和生长曲线。CC-1可以在12 h内移除95.3%的Cr(Ⅵ),而YZ-1则需要48 h才可将Cr(Ⅵ)完全移除;然而在最开始的12 h内,YZ-1并没有体现出明显的生长趋势,而溶液中的Cr(Ⅵ)已经被去除了40.1%,这意味着LB培养基里的还原性成分可能也参与到了Cr(Ⅵ)的去除过程中;通过不加菌液的LB空白培养基实验表明,LB培养基自身可在48 h内还原43%的Cr(Ⅵ)。这一结果表明在LB培养基中的Cr(Ⅵ)去除,是培养基自身组分的化学作用,及微生物的生物吸附/还原作用共同导致的结果[16]。
|
| 图 2 菌株YZ-1和CC-1的Cr(Ⅵ)去除率和生长曲线 Figure 2 Cr(Ⅵ) removal rate and growth curves of Staphylococcus sp. YZ-1 and Bacillus cereus CC-1 |
|
|
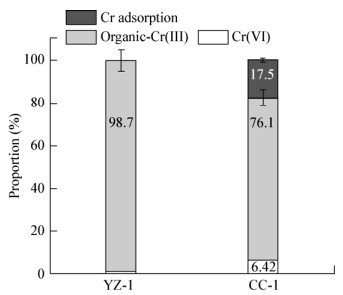
图 3展示了YZ-1和CC-1的Cr(Ⅵ)移除性能,YZ-1在还原Cr(Ⅵ)时,水相中可溶的有机态Cr(Ⅲ)占比为98.7%,说明YZ-1对Cr(Ⅲ)几乎没有吸附效果;而CC-1还原过程中,水相中的Cr(Ⅲ)占比为76.1%,被吸附的Cr物种占比17.5%。这一结果表明,两株铬还原菌在去除Cr(Ⅵ)时,YZ-1主要依靠生物还原作用,而CC-1依赖生物吸附/还原作用。
|
| 图 3 Cr(Ⅵ)经Staphylococcus sp. YZ-1和Bacillus cereus CC-1反应后的产物分析 Figure 3 Cr species after Cr(Ⅵ) removal by Staphylococcus sp. YZ-1 and Bacillus cereus CC-1 |
|
|
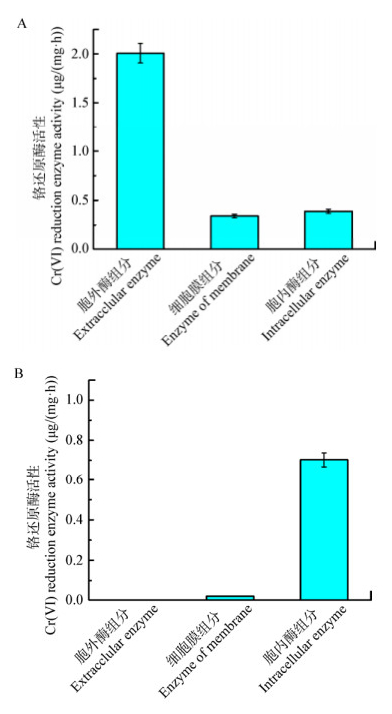
为了进一步区分菌株YZ-1及CC-1的铬耐受机制,进行了铬还原酶活力的测试。在不含Cr(Ⅵ)的培养基中进行培养,菌株CC-1具有铬还原酶活性,而YZ-1不具有铬还原酶活性,在对YZ-1进行Cr(Ⅵ)诱导后,YZ-1表现出了铬还原活性。如图 4所示,菌株CC-1的胞外、细胞膜及胞内酶组分均体现出了铬还原活性,比酶活分别为2.01、0.34、0.39 μg/(mg·h),表明CC-1可能通过多种酶对Cr(Ⅵ)进行还原,且这些酶为组成酶。菌株YZ-1在含0.1 mmol/L Cr(Ⅵ)的培养基中进行培养后,细胞膜和胞内组分表现出了铬还原酶活性,比酶活分别为0.02、0.70 μg/(mg·h),表明YZ-1的铬还原酶为诱导型还原酶。
|
| 图 4 菌株CC-1 (A)和YZ-1 (B)的铬还原酶活性 Figure 4 Chromate reductase activity of Bacillus cereus CC-1 (A) and Staphylococcus sp. YZ-1 (B) 注:A:菌株CC-1没有经过Cr(Ⅵ)诱导的铬还原酶活性;B:菌株YZ-1经过0.1 mmol/L Cr(Ⅵ)诱导后的铬还原酶活性. Note: A: chromate reductase activity of Bacillus cereus CC-1 without Cr(Ⅵ) induced; B: chromate reductase activity of Staphylococcus sp. YZ-1 with the 0.1 mmol/L Cr(Ⅵ) induced. |
|
|
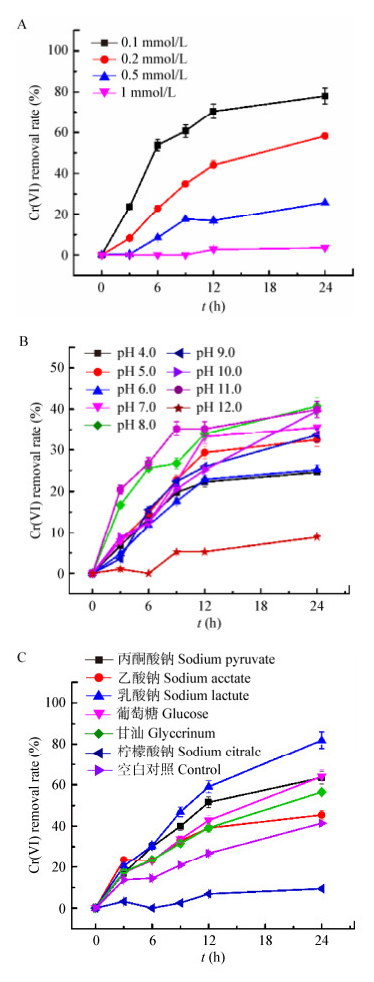
由于菌株CC-1的铬还原酶为组成型酶,相较于YZ-1来说不需要提前诱导,在实际应用中具有潜在优势,因此选择菌株CC-1进行进一步研究。如图 5A所示,菌株CC-1休眠细胞铬还原的百分比随初始Cr(Ⅵ)的增加而下降,0.1 mmol/L的Cr(Ⅵ)在24 h内可被移除80%,而初始Cr(Ⅵ)浓度升至1 mmol/L时,移除率下降到5%以内。图 5B展示了不同pH对于菌株CC-1移除0.2 mmol/L Cr(Ⅵ)的影响,pH 8.0时,菌株CC-1对Cr(Ⅵ)的还原率能达到40.7%,而在pH 4.0−11.0的范围内,菌株在24 h内都对Cr(Ⅵ)具有20%以上的去除率说明菌株CC-1的pH耐受范围较广,大部分菌株如Bacillus cereus S5.4[17]、Klebsiella pneumonia MKPF5、Acinetobacter gerneri MKPF7[18]等,最适pH在7.0左右,在pH为5.0或9.0时,菌株的活性就会受到抑制,从而导致Cr(Ⅵ)还原能力下降。外源电子供体的加入对菌株CC-1移除Cr(Ⅵ)的性能具有不同的影响,如图 5C所示。在无外加电子供体的情况下,菌株可在24 h内还原40%的Cr(Ⅵ);乳酸钠、葡萄糖、丙酮酸钠、甘油和乙酸钠均可不同程度地增强菌株的Cr(Ⅵ)还原性能,而柠檬酸钠的加入抑制了Cr(Ⅵ)的还原,24 h的还原率仅为9.4%。
|
| 图 5 CC-1休眠细胞在不同Cr(Ⅵ)浓度(A)、pH (B)和电子供体(C)下的Cr(Ⅵ)去除率 Figure 5 Cr(Ⅵ) removal rate of CC-1 rest cells with different Cr(Ⅵ) concentrations (A), pH (B) and electron donors (C) |
|
|
对菌株YZ-1和CC-1进行了全基因组测序,YZ-1序列总长为2.66 Mb,CC-1为5.08 Mb。YZ-1的(G+C)mol%含量为32.53%,CC-1为35.47%。高质量片段组装后,YZ-1获得19个Contig和18个Scaffold,而CC-1获得5个Contig。YZ-1全基因组数据中包含预测的基因2 630个,蛋白编码区2 569个,而CC-1包含预测的基因5 516个,蛋白编码区5 483个。两株菌的耐盐和耐受重金属离子相关基因如表 2所示。
| 基因功能 Gene function |
Staphylococcus sp. YZ-1 | Bacillus cereus CC-1 | |||
| 注释 Annotation |
GenBank登录号 GenBank accession No. |
注释 Annotation |
GenBank登录号 GenBank accession No. |
||
| 耐盐 Salt resistance |
编码甘氨酸甜菜碱转运蛋白 Glycine betaine transporter OpuD |
PXX85639.1 | 编码甘氨酸甜菜碱转运蛋白 Glycine betaine transporter OpuD |
ASZ20207.1 | |
| 铜耐受Cu(Ⅱ) resistance |
编码铜转运P型ATP酶 Copper-translocating P-type ATPase |
PXX83918.1 | 编码铜抗性蛋白 Copper resistance protein D |
ASZ20373.1 | |
| 锰耐受Mn(Ⅱ) resistance |
编码二价金属阳离子转运酶 Divalent metal cation transporter |
PXX86338.1 | 编码锰超氧化物歧化酶 Superoxide dismutase [Mn] 1 |
ASZ67998.1 | |
| 钴耐受Co(Ⅱ) resistance |
编码镁-钴泵出蛋白CorC Magnesium and cobalt efflux protein CorC |
PXX86172.1 | 编码镁-钴转运蛋白CorA Magnesium and cobalt transport protein CorA |
ASZ17274.1 | |
| 铬耐受 Cr(Ⅵ) resistance |
编码假定硫酸盐出口转运蛋白 Putative sulfate exporter transporter |
PXX86188.1 | 编码铬转运蛋白ChrA Chromate transport protein ChrA |
ASZ19960.1 | |
| 编码硫酸盐通透酶 Sulfate permease |
PXX84713.1 | 编码硫酸盐通透酶 Sulfate permease |
ASZ15760.1 | ||
| 编码ABC转运通透酶 ABC transporter permease |
PXX86061.1 | 编码SOS应激抑制因子和蛋白酶LexA SOS-response repressor and protease LexA |
ASZ16672.1 | ||
| 编码多重耐药家族外排泵蛋白 MATE family efflux transporter |
PXX84100.1 | 编码ATP依赖的DNA解旋酶 ATP-dependent DNA helicase RecQ |
ASZ17545.1 | ||
| 编码过氧化氢酶 catalase |
PXX86581.1 | 编码ABC转运体底物结合蛋白 ABC transporter substrate-binding protein |
ASZ18470.1 | ||
| 编码ATP依赖的DNA解旋酶 ATP-dependent DNA helicase |
PXX84877.1 | ||||
| 铬还原 Cr(Ⅵ) reduction |
编码亚硝酸盐还原酶 Nitrite reductase |
PXX84071.1 | 编码亚硝酸盐还原酶 Nitrite reductase |
ASZ18103.1 | |
| 编码依赖NADPH氧化还原酶 NADPH-dependent oxidoreductase |
PXX84912.1 | 编码亚硫酸盐还原酶黄素蛋白 Sulfite reductase [NADPH] flavoprotein |
ASZ19570.1 | ||
| 编码亚硫酸盐还原酶NADPH黄素蛋白 Sulfite reductase [NADPH] flavoprotein |
PXX84584.1 | 编码黄素氧化还原蛋白 Flavodoxin |
ASZ16465.1 | ||
| 编码细胞色素C氧化还原酶Cytochrome C reductase | ASZ65286.1 | ||||
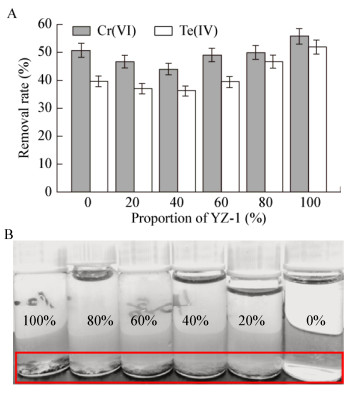
考虑到铬还原菌通常会具有Cr(Ⅵ)类似物如Se(Ⅳ)、Te(Ⅳ)的还原活性,本研究考虑构建YZ-1/CC-1复合体系,以探索混菌在去除Cr(Ⅵ)、Te(Ⅳ)时的性能变化。混菌体系在24 h内对Cr(Ⅵ)和Te(Ⅳ)的去除性能如图 6所示。单菌YZ-1比CC-1体现出了更强的Cr(Ⅵ)、Te(Ⅳ)移除特性。同时反应体系中产生大量的黑色絮凝物,表明YZ-1在高盐条件下形成的自絮凝体可以有效地还原并吸附碲单质,另一方面,CC-1单独存在时,Te(Ⅳ)的移除率虽然较高,但是反应产物并没有明显的黑色,表明Te(Ⅳ)更多地被转化为低价态的有机碲物种,不易实现Te(Ⅳ)从水中的完全去除。当两者以不同比例混合时,YZ-1主导的自絮凝特性仍然可以得以体现,从而实现单质碲从水相中的移除。
3 讨论与结论本研究筛选并鉴定了一株耐盐铬耐受菌Staphylococcus sp. YZ-1,将其与实验室之前筛选的硒还原菌Bacillus cereus CC-1进行基本特性的对比,菌株YZ-1能耐受100 g/L的NaCl,CC-1仅能耐受50 g/L;在0.1 mmol/L的Cr(Ⅵ)浓度条件下,12 h内YZ-1去除40.1%的Cr(Ⅵ),而CC-1去除95.3%。这一实验现象说明YZ-1和CC-1皆为耐盐铬还原菌,之前有文献报道过Staphylococcus arlettae strain Cr11能在24 h内还原100 mg/L的Cr(Ⅵ),且同样能耐受100 g/L NaCl[19],与之相比YZ-1的铬还原效率较低。也有文献报道过Bacillus circulans BWL1061能在60 g/L NaCl条件下,36 h内还原50 mg/L Cr(Ⅵ),性能优于CC-1[20]。酶活研究发现菌株YZ-1在Cr(Ⅵ)诱导后具有铬还原活性,所含的铬还原酶为诱导型酶,而CC-1所含铬还原酶为组成型酶。同时,YZ-1仅有细胞膜和胞内组分检测到了Cr(Ⅵ)的还原活性,而CC-1在胞内、细胞膜上以及胞外均可以检测到Cr(Ⅵ)的还原,这一结果意味着两者的铬还原过程均由多种酶共同催化,且这些酶的存在场所具有差异。
对两株菌的全基因组进行分析,发现都具有与铬耐受和铬还原相关的基因,YZ-1具有编码硫酸盐转运蛋白的基因、编码外排泵蛋白的基因、编码亚硝酸盐还原酶的基因以及编码NAD(P)H氧化还原酶的基因。曾有报道Cr(Ⅵ)可以通过硫酸盐转运通道在细菌体内进出[21],而Staphylococcus aureus LZ-01能通过29-ABC型金属/抗生素转运蛋白和外排泵耐受Cr(Ⅵ)[22],据赵欣欣报道,亚硝酸盐还原酶和Cr(Ⅵ)去除相关[23],而NAD(P)H氧化还原酶也被报道过具有Cr(Ⅵ)还原的作用[24]。此外,菌株YZ-1中识别出的UvrD-like的DNA解旋酶编码基因以及过氧化氢酶编码基因也可能和DNA修复以及氧化压力应答相关,对Cr(Ⅵ)具有潜在的贡献[25]。另一方面,在菌株CC-1中,识别出了编码铬转运蛋白ChrA的基因、编码黄素蛋白的基因、编码细胞色素C氧化还原酶、以及编码DNA解旋酶的基因。何敏艳曾报道过ChrA是与铬转运相关的基因[26],在Dong等对沙雷氏菌Serratia sp. S2的铬代谢相关基因分析中发现了ChrA蛋白在Cr(Ⅵ)泵出机制中起到关键作用[27]。Beller报道了黄素蛋白通过电子转移可以催化Cr(Ⅵ)的还原[28],Xia等报道了黄素蛋白是一种非特异性还原酶,对Se(Ⅳ)和Cr(Ⅵ)都有还原作用[29],Han等报道过黄素氧化还原酶能在Cu(Ⅱ)存在的条件下帮助菌株提高Cr(Ⅵ)还原性能[30],Belchik等报道了细胞色素C对Cr(Ⅵ)的胞外还原[31],据此推测Bacillus cereus CC-1的胞外Cr(Ⅵ)还原可能与黄素蛋白和细胞色素C相关。同时,结合休眠细胞、酶活性测试以及基因组分析结果,推测两株菌的Cr(Ⅵ)脱毒机理均包括铬酸盐外排和铬酸盐还原两个主要的过程,而DNA解旋酶介导的DNA修复和氧化压力应答的相关酶对耐受Cr(Ⅵ)也具有潜在的贡献。在培养菌株YZ-1的过程中,可以发现YZ-1在Te(Ⅳ)存在时可以形成具有黑色的自絮凝菌体,意味着Te(Ⅳ)的存在可以诱导YZ-1发生絮集,同时将Te(Ⅳ)转化为单质碲纳米颗粒。曾有报道Bacillus thermoamylovorans SKC1能同时对Cr(Ⅵ)和Te(Ⅳ)具有还原作用[32],Shi等报道过亚硫酸盐还原酶黄素蛋白与Te(Ⅳ)还原有关[33],由于黄素蛋白已被Xia等报道过与Cr(Ⅵ)、Se(Ⅳ)的还原相关[29],由此说明黄素蛋白是一类非特异性还原酶,对Cr(Ⅵ)、Se(Ⅳ)、Te(Ⅳ)都具有还原作用。当将YZ-1与CC-1混合组成混菌体系后,YZ-1的自絮凝特性仍然可以保留,且Cr(Ⅵ)和Te(Ⅳ)的还原效率并未发生明显的下降,且Te(Ⅳ)的还原产物可以有效地与水相进行分离。因此,将具有铬还原性能的耐盐菌进行组合,可以构建出代谢更为多样且处理性能稳定的人工菌群,在实际的水处理中可能具有潜在的应用价值。
|
| 图 6 不同比例下的混菌体系对Cr(Ⅵ)、Te(Ⅳ)的移除率(A)和自絮凝性能(B) Figure 6 The removal rate of Cr(Ⅵ), Te(Ⅳ) (A) and self-agglutinability (B) by mixed bacteria system at different proportion 注:B:在不同YZ-1占比(100%−0%)下的混菌体系的自絮凝性能. Note: B: The self-agglutinability of mixed bacteria system in different Staphylococcus sp. YZ-1 proportions (100%−0%). |
|
|
综上所述,本文对两株耐盐铬还原菌进行基本特性、酶活以及全基因组的研究,从基因层面对两种铬还原菌的脱毒特性和机理差异进行了分析;另外构建出两种铬还原菌的混菌体系,使其代谢多样性增强并引入自絮凝性能,在实际应用中更具潜在优势。
| [1] |
Xia X, Li MS, Wu SJ, et al. Research progress in microbial chromium-transformation and resistance and bioremediation[J]. Microbiology China, 2017, 44(7): 1668-1675. (in Chinese) 夏险, 李明顺, 武士娟, 等. 微生物铬转化和抗性机制与生物修复研究进展[J]. 微生物学通报, 2017, 44(7): 1668-1675. |
| [2] |
Alves MM, Beça CGG, de Carvalho RG, et al. Chromium removal in tannery wastewaters "polishing" by Pinus sylvestris bark[J]. Water Research, 1993, 27(8): 1333-1338. DOI:10.1016/0043-1354(93)90220-C |
| [3] |
Okeke BC. Bioremoval of hexavalent chromium from water by a salt tolerant bacterium, Exiguobacterium sp. GS1[J]. Journal of Industrial Microbiology & Biotechnology, 2008, 35(12): 1571-1579. |
| [4] |
Mishra RR, Dhal B, Dutta SK, et al. Optimization and characterization of chromium(Ⅵ) reduction in saline condition by moderately halophilic Vigribacillus sp. isolated from mangrove soil of Bhitarkanika, India[J]. Journal of Hazardous Materials, 2012, 227/228: 219-226. DOI:10.1016/j.jhazmat.2012.05.063 |
| [5] |
Dönmez G, Aksu Z. Removal of chromium(Ⅵ) from saline wastewaters by Dunaliella species[J]. Process Biochemistry, 2002, 38(5): 751-762. DOI:10.1016/S0032-9592(02)00204-2 |
| [6] |
Shen E, Wang P, Zhou H, et al. Isolation, identification and the salt-tolerant mechanism of a salt-tolerant strain for phenol degradation[J]. Acta Scientiae Circumstantiae, 2013, 33(2): 377-382. (in Chinese) 沈娥, 王平, 周豪, 等. 一株耐盐苯酚降解菌的分离、鉴定及耐盐机制研究[J]. 环境科学学报, 2013, 33(2): 377-382. |
| [7] |
Sivaprakasam S, Mahadevan S, Sekar S, et al. Biological treatment of tannery wastewater by using salt-tolerant bacterial strains[J]. Microbial Cell Factories, 2008, 7: 15. DOI:10.1186/1475-2859-7-15 |
| [8] |
Ramírez-Díaz MI, Díaz-Pérez C, Vargas E, et al. Mechanisms of bacterial resistance to chromium compounds[J]. BioMetals, 2008, 21(3): 321-332. DOI:10.1007/s10534-007-9121-8 |
| [9] |
Che L, Xu WP, Zhan JJ, et al. Complete genome sequence of Bacillus cereus CC-1, a novel marine selenate/selenite reducing bacterium producing metallic selenides nanomaterials[J]. Current Microbiology, 2019, 76(1): 78-85. DOI:10.1007/s00284-018-1587-9 |
| [10] |
Cao P. Isolation and identification of a strain of tomato endophytic actinomycetes against Verticilium dahlia[D]. Harbin: Master's Thesis of Northeast Agricultural University, 2016 (in Chinese) 曹鹏.一株抗黄萎病的番茄内生放线菌的分离、筛选和鉴定[D].哈尔滨: 东北农业大学硕士学位论文, 2016 |
| [11] |
Ma XZ, Fei BJ, Jin N, et al. Characteristics of reduce Cr(Ⅵ) by Desulfovibrio SRB7[J]. Microbiology China, 2009, 36(9): 1324-1328. (in Chinese) 马小珍, 费保进, 金楠, 等. 脱硫弧菌SRB7对重金属铬Cr(Ⅵ)的还原特性[J]. 微生物学通报, 2009, 36(9): 1324-1328. |
| [12] |
Wang ZW, Bu YB, Zhao YH, et al. Morphology-tunable tellurium nanomaterials produced by the tellurite-reducing bacterium Lysinibacillus sp. ZYM-1[J]. Environmental Science and Pollution Research, 2018, 25(21): 20756-20768. DOI:10.1007/s11356-018-2257-y |
| [13] |
Kruger NJ. The bradford method for protein quantitation[A]//Walker JM. The Protein Protocols Handbook[M]. Totowa: Humana Press, 2002: 15-21
|
| [14] |
Ontañon OM, Fernandez M, Agostini E, et al. Identification of the main mechanisms involved in the tolerance and bioremediation of Cr(Ⅵ) by Bacillus sp. SFC 500-1E[J]. Environmental Science and Pollution Research, 2018, 25(16): 16111-16120. DOI:10.1007/s11356-018-1764-1 |
| [15] |
Pereira EJ, Ramaiah N. Chromate detoxification potential of Staphylococcus sp. isolates from an estuary[J]. Ecotoxicology, 2019, 28(4): 457-466. DOI:10.1007/s10646-019-02038-w |
| [16] |
Middleton SS, Latmani RB, Mackey MR, et al. Cometabolism of Cr(Ⅵ) by Shewanella oneidensis MR-1 produces cell-associated reduced chromium and inhibits growth[J]. Biotechnology and Bioengineering, 2003, 83(6): 627-637. DOI:10.1002/bit.10725 |
| [17] |
Xiao W, Wang L, Zhang SW, et al. Isolation, identification and hexavalent chromium reduction studies of Bacillus cereus S5.4[J]. Industrial Microbiology, 2007, 37(6): 1-6. (in Chinese) 肖伟, 王磊, 张思维, 等. 六价铬还原细菌Bacillus cereus S5.4的筛选鉴定及还原特性研究[J]. 工业微生物, 2007, 37(6): 1-6. DOI:10.3969/j.issn.1001-6678.2007.06.001 |
| [18] |
Kabir MM, Fakhruddin ANM, Chowdhury MAZ, et al. Isolation and characterization of chromium(Ⅵ)-reducing bacteria from tannery effluents and solid wastes[J]. World Journal of Microbiology and Biotechnology, 2018, 34(9): 126. DOI:10.1007/s11274-018-2510-z |
| [19] |
Sagar S, Dwivedi A, Yadav S, et al. Hexavalent chromium reduction and plant growth promotion by Staphylococcus arlettae strain Cr11[J]. Chemosphere, 2012, 86(8): 847-852. DOI:10.1016/j.chemosphere.2011.11.031 |
| [20] |
Liu WJ, Liu C, Liu L, et al. Simultaneous decolorization of sulfonated azo dyes and reduction of hexavalent chromium under high salt condition by a newly isolated salt-tolerant strain Bacillus circulans BWL1061[J]. Ecotoxicology and Environmental Safety, 2017, 141: 9-16. DOI:10.1016/j.ecoenv.2017.03.005 |
| [21] |
Alvarez AH, Moreno-Sánchez R, Cervantes C. Chromate efflux by means of the ChrA chromate resistance protein from Pseudomonas aeruginosa[J]. Journal of Bacteriology, 1999, 181(23): 7398-7400. DOI:10.1128/JB.181.23.7398-7400.1999 |
| [22] |
Zhang XW, Wu WY, Virgo N, et al. Global transcriptome analysis of hexavalent chromium stress responses in Staphylococcus aureus LZ-01[J]. Ecotoxicology, 2014, 23(8): 1534-1545. DOI:10.1007/s10646-014-1294-7 |
| [23] |
Zhao XX. Mechanism study on Cr(Ⅵ) removal by a strain of Bacillus sp. based on characteristics of NiR enzyme[D]. Guangzhou: Master's Thesis of Guangdong University of Technology, 2013 (in Chinese) 赵欣欣.基于亚硝酸盐还原酶酶学特性的优势菌除Cr(Ⅵ)机理研究[D].广州: 广东工业大学硕士学位论文, 2013 |
| [24] |
Pradhan SK, Singh NR, Rath BP, et al. Bacterial chromate reduction: a review of important genomic, proteomic, and bioinformatic analysis[J]. Critical Reviews in Environmental Science and Technology, 2016, 46(21/22): 1659-1703. |
| [25] |
Ahemad M. Bacterial mechanisms for Cr(Ⅵ) resistance and reduction: an overview and recent advances[J]. Folia Microbiologica, 2014, 59(4): 321-332. DOI:10.1007/s12223-014-0304-8 |
| [26] |
He MY. Characterization and genomic analysis of highly chromate-reducing strains Bacillus cereus SJ1 and Lysinibacillus fusiformis ZC1[D]. Wuhan: Doctoral Dissertation of Huazhong Agricultural University, 2010 (in Chinese) 何敏艳.高效铬还原菌Bacillus cereus SJ1和Lysinibacillus fusiformis ZC1的铬还原特性和全基因组序列分析[D].武汉: 华中农业大学博士学位论文, 2010 |
| [27] |
Dong LL, Zhou SM, He Y, et al. Analysis of the genome and chromium metabolism-related genes of Serratia sp. S2[J]. Applied Biochemistry and Biotechnology, 2018, 185(1): 140-152. |
| [28] |
Beller HR, Han RY, Karaoz U, et al. Genomic and physiological characterization of the chromate-reducing, aquifer-derived firmicute Pelosinus sp. strain HCF1[J]. Applied and Environmental Microbiology, 2013, 79(1): 63-73. DOI:10.1128/AEM.02496-12 |
| [29] |
Xia X, Wu SJ, Li NH, et al. Novel bacterial selenite reductase CsrF responsible for Se(Ⅳ) and Cr(Ⅵ) reduction that produces nanoparticles in Alishewanella sp. WH16-1[J]. Journal of Hazardous Materials, 2018, 342: 499-509. DOI:10.1016/j.jhazmat.2017.08.051 |
| [30] |
Han HW, Ling ZM, Zhou TY, et al. Copper (Ⅱ) binding of NAD(P)H-flavin oxidoreductase (NfoR) enhances its Cr (Ⅵ)-reducing ability[J]. Scientific Reports, 2017, 7: 15481. DOI:10.1038/s41598-017-15588-y |
| [31] |
Belchik SM, Kennedy DW, Dohnalkova AC, et al. Extracellular reduction of hexavalent chromium by cytochromes MtrC and OmcA of Shewanella oneidensis MR-1[J]. Applied and Environmental Microbiology, 2011, 77(12): 4035-4041. DOI:10.1128/AEM.02463-10 |
| [32] |
Slobodkina GB, Bonch-Osmolovskaya EA, Slobodkin AI. Reduction of chromate, selenite, tellurite, and iron (Ⅲ) by the moderately thermophilic bacterium Bacillus thermoamylovorans SKC1[J]. Microbiology, 2007, 76(5): 530-534. DOI:10.1134/S0026261707050037 |
| [33] |
Shi LD, Du JJ, Wang LB, et al. Formation of nanoscale Te0 and its effect on TeO32– reduction in CH4-based membrane biofilm reactor[J]. Science of the Total Environment, 2019, 655: 1232-1239. DOI:10.1016/j.scitotenv.2018.11.337 |
 2020, Vol. 47
2020, Vol. 47