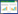扩展功能
文章信息
- 曾思钰, 潘雪珊, 沈亮, 凌雪萍, 卢英华
- ZENG Si-Yu, PAN Xue-Shan, SHEN Liang, LING Xue-Ping, LU Ying-Hua
- 一种富集高温栅藻Desmodesmus sp. F51的新型生物絮凝剂
- Effective harvesting of the microalgae Desmodesmus sp. F51 with a novel bioflocculant
- 微生物学通报, 2020, 47(1): 35-42
- Microbiology China, 2020, 47(1): 35-42
- DOI: 10.13344/j.microbiol.china.190462
-
文章历史
- 收稿日期: 2019-05-28
- 接受日期: 2019-08-08
- 网络首发日期: 2019-09-16
2. 厦门大学化学化工学院 福建 厦门 361005
2. College of Chemistry and Chemical Engineering, Xiamen University, Xiamen, Fujian 361005, China
微藻广泛分布于自然界,具有光合作用效率高、环境适应能力强、生长速率快、生长周期短、占地面积小、生物质产率高、可高效吸收废水中的氮、磷等营养元素等优点[1-3],已被普遍应用于生物燃料、医学原料、优质食品源及畜牧养殖业等领域[4]。目前限制微藻生物技术发展的主要挑战之一就是微藻的富集。由于微藻个体小且能稳定悬浮于溶液中,密度低,表面通常带负电荷[5],如何从微藻培养基中高效收获微藻是目前学者们积极探索的难题。与常规富集方法如离心、过滤等相比,絮凝法被认为是低成本富集微藻的高效手段[6]。絮凝法通常包括化学絮凝法、物理絮凝法、自絮凝法和生物絮凝法。其中,生物絮凝法是一种绿色环保且高效的富集方法,某些特定细菌可分泌具有絮凝活性的胞外聚合物,起到絮凝微藻的作用,具有富集潜能。因此,有必要开发一种高效、低成本的下游工艺,从培养基中获取微藻细胞,并在适当的领域使用并保持其活力和生物活性。
生物絮凝剂是将产絮凝剂的微生物在特定的培养基中培养,使微生物产生并分泌的具有絮凝活性的物质。生物絮凝剂作为一种天然产物,由于其安全性和高效的絮凝效率,被认为是一种很有前途的微藻处理和回收技术;另外,生物絮凝剂也因具有可生物降解且无二次污染的优点,受到了很多研究者的广泛关注[7]。关于絮凝机理,现有研究提出,絮凝剂的官能团可能通过电性中和微藻细胞表面电荷,或通过架桥吸附或网捕作用富集微藻,但哪种机制对微藻富集起主导作用还有待进一步研究[8-9]。
高温栅藻(Desmodesmus sp. F51)是一种具有较高叶黄素含量和生物量产率的微藻,被认为是一种新兴的叶黄素来源[10]。海科贝特氏菌(C. marina)是一种从沿海海水中分离得到的革兰氏阴性海洋细菌,是一种亲水细菌,可产生大量的细胞外产物[11]。近年来Lei等[12]发现其具有生物絮凝活性,试验结果表明20 mg/L海科贝特氏菌产生的生物絮凝剂与5 mmol/L CaCl2共作用可有效收集小球藻,絮凝效率达到92.7%,可视为一种新型的生物絮凝剂,而且该生物絮凝剂在较宽的pH值和温度范围内保持稳定,有利于在各种条件下应用。利用该生物絮凝剂富集高温栅藻尚未见相关报道,因此本研究拟利用C. marina所产生的新型生物絮凝剂富集高温栅藻,并解析其絮凝机理。
1 材料与方法 1.1 试验材料 1.1.1 絮凝菌种海科贝特氏菌(C. marina MCCC 1113),由国家海洋局第三海洋研究所中国海洋微生物菌种资源保藏管理中心提供。
固体琼脂培养基(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 30.0,琼脂20.0。种子培养基(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 30.0。发酵培养基(g/L):葡萄糖10.0,胰蛋白胨5.0,酵母粉1.0,溶于80% (体积比)人工海水和20% (体积比)去离子水中。人工海水成分(g/L):NaCl 24.0,MgCl2·6H2O 11.0,Na2SO4 4.0,CaCl2·6H2O 2.0,KCl 0.7,KBr 0.1,H3BO3 0.003,Na2SiO3·9H2O 0.005,SrCl2·6H2O 0.004,NaF 0.003,NH4NO3 0.002。
从固体琼脂培养基上挑取菌落接种于种子培养基中,28 ℃、150 r/min培养36 h。将种子菌液按接种量10% (体积比)转接至发酵培养基,28 ℃、150 r/min培养32 h。
1.1.2 藻种高温栅藻(Desmodesmus sp. F51)[13]由中国台湾成功大学张嘉修教授提供;种子培养基为Modified Bold Basal 3N培养基[13],实验培养基为Modified Bristol培养基[13],培养方式参照谢友坪等[13]。从平板上刮取1-2个藻体,接种于250 mL玻璃瓶中,35 ℃培养,300 r/min磁力搅拌,2.5% CO2-空气混合气,通气量0.05 L/min,光照强度60 μmol/(m2·s),培养至OD685为3.5作为种子。将种子接种于1 L玻璃瓶中,接种量9%,400 r/min磁力搅拌,通气量0.2 L/min,光照强度600 μmol/(m2·s),其余条件同上。
1.1.3 主要试剂和仪器培养基成分及生物絮凝剂制备相关试剂等均为国产分析纯试剂,购自国药集团化学试剂有限公司。电子分析天平、pH计,Sarotius公司;恒温式磁力搅拌器,河南省巩义市予华仪器有限责任公司;冷冻干燥机,上海爱朗仪器有限公司;Zeta电位分析仪,马尔文公司;FTIR分光光度计,Thermo公司。
1.2 试验方法 1.2.1 生物絮凝剂的制备生物絮凝剂的制备方法参见文献[14]。具体步骤为:发酵液于4 ℃、9 000 r/min离心15 min,收集上清液,加入3倍体积的无水乙醇(4 ℃预冷),轻轻振荡,然后将混合物置于4 ℃过夜,9 000 r/min离心15 min收集沉淀,加入10%十六烷基吡啶(CPC)搅拌,溶于去离子水,静置2–3 h后,9 000 r/min离心15 min收集沉淀,用75%乙醇洗涤沉淀3次,冷冻干燥后即得生物絮凝剂。将纯化后的生物絮凝剂加入无菌蒸馏水中,配置最终浓度为10 g/L,用于后续试验。
1.2.2 絮凝剂理化特性检测100 mL藻液在磁性搅拌装置中混合均匀(60 r/min)。利用1 mol/L HCl或NaOH将藻液pH值分别调为4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0。将2.0 mL 20 mg/L生物絮凝剂分别加入不同pH的藻液中。用Zeta电位仪测定藻液、添加生物絮凝剂的藻液在不同pH条件下的Zeta电位。
采用FTIR分光光度计,将收集到的干燥生物絮凝剂与溴化钾(KBr)粉磨碎,压入KBr盘,在4 000-400 cm-1波数范围内进行傅里叶红外光谱(fourier transform infrared spectroscopy,FTIR)测量,以确定生物絮凝剂的特征化学基团。
利用光学显微镜观察微藻絮凝前后的形态变化。利用苯酚-硫酸法测定多糖含量[15];Bradford法测定蛋白质含量[16];水合茚三酮法检测α-氨基酸[17];黄蛋白反应检测芳香族氨基酸[17];Benedict试验检测还原糖[17]。
2 结果与分析 2.1 不同生长时期添加生物絮凝剂对高温栅藻絮凝效率的影响为了研究高温栅藻在不同生长时期对絮凝效率的影响,采用以下实验组:1)于栅藻生长停滞期时加入生物絮凝剂;2)于栅藻对数生长期时加入生物絮凝剂;3)于栅藻生长稳定期时加入生物絮凝剂。设定未添加生物絮凝剂的正常生长藻类为对照组,藻类细胞絮凝后,从底部2/3的高度对处理组和对照组的培养物进行取样,用分光光度计测定685 nm处吸光度值以评价絮凝效果[18]。每组实验均设3组生物学重复。
高温栅藻生长曲线及絮凝效率如图 1所示。栅藻在接种后前3天为生长停滞期,藻体密度无显著增长,培养至第4天即进入对数生长期,第6天开始进入稳定期。随着高温栅藻生物量的增大,自沉降效率随之升高,栅藻的最高自沉降效率出现在稳定期(11.4%),这是由于在生长初期生物量较低,藻细胞密度小,不易聚集沉降;随着藻细胞生长至指数期后期和稳定期,藻细胞密度增大,相对运动产生的有效碰撞次数增加,更易聚集自沉降。在耐温栅藻生长至稳定期添加生物絮凝剂,絮凝效率可达74.6%。这可能是由于指数生长期的高温栅藻相比稳定期会分泌更多的胞外多糖,它们能与培养基中的金属离子络合,从而影响絮凝效果[18-19]。因此,在耐温栅藻生长至稳定期添加生物絮凝剂的效果最佳。
|
| 图 1 不同生长时期添加生物絮凝剂对高温栅藻絮凝效率的影响 Figure 1 Effect of bioflocculant addition time on flocculating efficiency of Desmodesmus sp. F51 |
|
|
将不同体积的絮凝剂分别加入预培养至稳定期的栅藻中,絮凝剂添加量对絮凝效率的影响如图 2所示。未添加絮凝剂的栅藻自沉降效率为14.2%,随着絮凝剂添加量的增加,絮凝效率随之增大。其中,添加2 mL生物絮凝剂时絮凝效率为77.2%,添加3 mL絮凝剂时得到最大絮凝效率,为78.2%。分析认为,加入絮凝剂后,悬浮液中的微藻颗粒失稳,粒子之间范德华力作用大于静电斥力,从而聚集沉降。随着絮凝剂添加量继续增加至4 mL时,絮凝效率有所下降,这可能因为絮凝剂与栅藻之间的结合位点已接近饱和,阻碍了絮体进一步形成,导致絮凝效率下降。在任何絮凝过程中,絮凝剂的添加量都是直接影响絮凝效果的关键因素,本研究也表明在生物絮凝过程中,生物絮凝剂的添加量过高或过低都会影响最终的絮凝效率。鉴于添加2 mL和3 mL生物絮凝剂二者絮凝效率相差不大,综合考虑后选择添加2 mL生物絮凝剂进行后续试验研究。

|
| 图 2 絮凝剂添加量对高温栅藻絮凝效率的影响 Figure 2 Effect of bioflocculant addition amount on bioflocculating efficiency of Desmodesmus sp. F51 |
|
|
在藻液中加入生物絮凝剂,于振荡器上混匀5 s,分别静置5、10、15、20、25、30、35、40、45、50、55和60 min,取上清液测OD685。以未加絮凝剂的原始藻液为空白对照,计算絮凝效率,结果如图 3所示。随着絮凝时间的延长,絮凝效果逐渐增强,絮凝时间在15 min絮凝效率已趋最大,为80.8%,以后变化趋于平缓。这可能因为加入生物絮凝剂后,絮凝剂迅速与藻细胞结合在一起,使体系中出现大量的絮状物悬浮,在重力作用下渐渐地沉降下来,随着絮凝时间的增加,吸附位点逐渐达到饱和,絮凝效率不再继续增加。而对照组的自沉降效率在静置15 min后才达到8.9%,远低于生物絮凝剂处理组。由此可见,生物絮凝剂的加入可以有效缩短栅藻的絮凝时间,从工业应用角度分析,可以有效地节约收集栅藻的时间和成本。

|
| 图 3 絮凝时间对高温栅藻絮凝效率的影响 Figure 3 Effect of time on flocculating efficiency of Desmodesmus sp. F51 |
|
|
采用红外光谱法对生物絮凝剂的官能团进行分析,结果如图 4所示。光谱在3 417 cm-1处显示出强烈的宽拉伸峰,这由糖环中的羟基官能团(-OH)伸缩和N-H振动引起,说明分子中存在氢键。在2 924 cm-1处,谱线显示出较弱的C-H伸缩振动带,这是糖类的特征峰。拉伸峰值出现在1 723 cm-1处,表明存在C=O的拉伸振动。此外,在1 643 cm-1处出现的拉伸峰为多糖中乙酰氨基(-NHCOCH3)的羧基(C=O)存在拉伸振动。在1 539 cm-1处观测到一个弱对称拉伸峰,表明生物絮凝剂中存在羧基拉伸振动。此外,1 000-1 100 cm-1之间的吸收峰是糖类衍生物的特征,这些基团是絮凝过程的首选基团。拉伸峰值出现在1 061 cm-1,说明酯中存在C-O-C拉伸振动。根据以上结果,FTIR图谱不仅显示了多糖的特征结构,而且显示了酰胺结构的特征吸收峰。表明该新型生物絮凝剂属胞外高聚物,分子中既含有碱性的氨基,又含有酸性的羧基,这与Zhang等的研究结果[20]相一致。羧基的存在可以作为二价阳离子的结合位点[21]。絮凝剂中的羰基、羟基和氨基等官能团可能是通过破坏微藻细胞表面电荷平衡,进而实现絮凝微藻的作用。由此可以推测絮凝剂絮凝高温栅藻的絮凝机理中占主导地位的可能是吸附架桥作用,一定量的羧基可以使絮凝剂分子充分延展,产生架桥使藻细胞吸附到絮凝剂上,形成网状的空间絮体。

|
| 图 4 生物絮凝剂的红外光谱分析图 Figure 4 Fourier transform-infrared spectrograms of the bioflocculant |
|
|
综上所述,推测生物絮凝剂主要是杂多糖的混合物,含有少量蛋白质,根据Bradford法测定絮凝剂中蛋白含量约为0.4% (质量比),通过苯酚-硫酸法测定总糖质量分数约为34.5% (质量比),与FTIR分析结果基本相符;而且通过水合茚三酮法、黄蛋白反应、Benedict试验测得该生物絮凝剂中α-氨基酸、芳香族氨基酸、还原糖均为阳性。
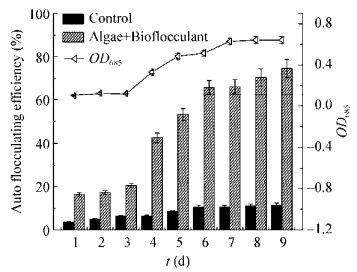
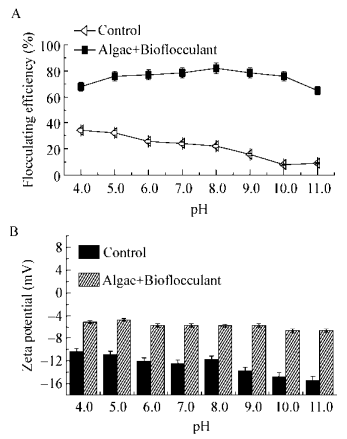
2.5 pH对高温栅藻絮凝效率的影响图 5为不同pH条件下生物絮凝剂对高温栅藻絮凝效率的影响。由图 5可知,酸性时随着pH的升高,絮凝效率逐渐增大,pH为8.0时絮凝效率最高(82.1%),之后pH进一步升高时絮凝效率却缓慢下降。对照组的自沉降率随着pH的升高而呈现下降趋势,总体低得多。试验结果表明,生物絮凝剂在pH 4.0-11.0之间都保持60%以上的絮凝效率。絮凝剂在碱性条件下絮凝效率有所下降,可能由于所带基团离子状态的改变导致对藻细胞的吸附作用大幅下降,弱化了絮凝体的形成。生物絮凝剂在酸性条件下形成带正电荷的离子,碱性条件下形成带负电荷的离子,且由于其分子中氨基和羧基等正负电荷的数目并不完全相等,分子所产生的正负离子数也不相等。微藻pH的改变会影响絮凝剂对藻类细胞的电荷中和作用。不同生物絮凝剂的适宜絮凝pH值可能因其自身组成及絮凝对象的不同而不同。由此推测pH变化会影响絮凝剂的官能团电荷特性,进而影响细胞与絮凝剂官能团之间的架桥和粘附作用力,从而导致絮凝能力的不同[22]。pH 4.0-11.0未添加生物絮凝剂的微藻培养液无明显絮凝或絮凝率很低。

|
| 图 5 pH对高温栅藻絮凝效率的影响 Figure 5 Effect of pH on the floculating efficiency of Desmodesmus sp. F51 |
|
|
测定了不同pH条件下添加生物絮凝剂后高温栅藻的Zeta电位值变化,并以未添加生物絮凝剂的藻液作为对照。由图 6可知,未添加生物絮凝剂时高温栅藻的Zeta电位绝对值随pH的增大而增大,絮凝效率降低;经生物絮凝剂处理后,藻液的Zeta电位绝对值明显降低,絮凝效率高,随着pH的增大,藻液的Zeta电位一直保持在低负电位。结果表明,电荷中和在栅藻絮凝过程中起一定作用,但不是主导作用。
|
| 图 6 不同pH值下Zeta絮凝效率(A)及电位(B) Figure 6 Flocculating efficiency (A) and Zeta potential (B) of Desmodesmus sp. F51 at different pH |
|
|
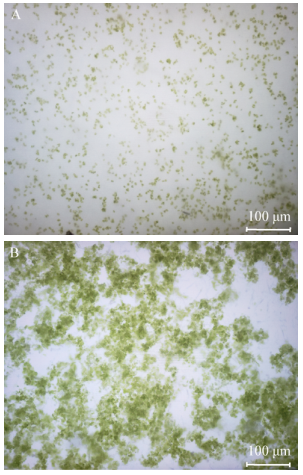
栅藻添加絮凝剂前后的显微照片见图 7。从图 7A可以看出栅藻细胞在絮凝前均匀分布于培养基中,添加絮凝剂后(图 7B)藻细胞显著聚集。
|
| 图 7 添加生物絮凝剂前(A)后(B)高温栅藻的显微照片 Figure 7 Microscopic photos of Desmodesmus sp. F51 before (A) and after (B) bioflocculation added |
|
|
生物絮凝法是一种环境友好且高效的微藻富集方法,海科贝特氏菌(C. marina)是一种新型的生物絮凝剂产生菌,Lei等[12]开发了一种采集微藻细胞的新方法,发现海科贝特氏菌产生的生物絮凝剂可以通过浮选有效地收集小球藻。这种生物絮凝剂在低廉收集微藻领域有着很好的应用潜力。高温栅藻(Desmodesmus sp. F51)是一种新兴的叶黄素来源,本研究旨在开发一种高效、低成本的从培养液中高效获取高温栅藻细胞的下游工艺,并对其絮凝机制进行初步分析。研究表明在很多生物絮凝过程中,生物絮凝剂都有最适浓度,添加量过高或过低都会影响最终的絮凝效率。如红平红球菌(Rhodococcus erythropolis)产生的生物絮凝剂的最适浓度为20 mg/L[23]。絮凝剂的最适浓度首先受絮凝剂的理化性质决定,其次和絮凝对象相关。有报道将Solibacillus silvestris W01菌株所产絮凝剂用于絮凝收集微拟球藻(Nannochloropsis oceanica),絮凝剂质量浓度为200 mg/L时絮凝率达76.3%[24]。将芽孢杆菌(Bacillus agaradhaerens)所产生物絮凝剂用于絮凝收集极微小球藻,絮凝剂质量浓度为8 mg/L时絮凝率为80.63%[25]。在高温栅藻生长至稳定期添加2 mL生物絮凝剂,在15 min内絮凝效率为82.1%。微藻pH的改变会影响絮凝剂对藻类细胞的电荷中和作用。不同生物絮凝剂的适宜絮凝pH值可能因其自身组成及絮凝对象的不同而不同。如Bacillus sp. PY-90产生的絮凝剂在酸性条件下絮凝活性最高[26],R. erythropolis产生的絮凝剂在中性条件具有最高絮凝活性[27]。克雷伯氏菌(Klebsiella sp.)所产絮凝剂在pH为4.0-8.0时絮凝活性均超过80%,最适宜pH值为7.0[27]。本研究中的生物絮凝剂在pH在4.0-11.0之间都保持60%以上的絮凝效率,说明该新型生物絮凝剂能适应较宽的pH范围,具有良好的应用前景。当然,后续仍需更多的实验深入研究分析,以便为实现生物絮凝剂的低成本、高效益和规模化生产奠定良好的理论和实验基础。
| [1] |
Georgianna DR, Mayfield SP. Exploiting diversity and synthetic biology for the production of algal biofuels[J]. Nature, 2012, 488(7411): 329-335. DOI:10.1038/nature11479 |
| [2] |
Fan H, Han P, Wang JH, et al. Status and prospects of microalgae harvesting with biological flocculation[J]. Journal of Biology, 2017, 34(2): 26-32. (in Chinese) 樊华, 韩佩, 王菁晗, 等. 微藻生物采收技术的现状和展望[J]. 生物学杂志, 2017, 34(2): 26-32. |
| [3] |
Christenson L, Sims R. Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts[J]. Biotechnology Advances, 2011, 29(6): 686-702. DOI:10.1016/j.biotechadv.2011.05.015 |
| [4] |
Lin Z, Kuang YL, Guo J, et al. A review of microalgae recovery technology[J]. The Chinese Journal of Process Engineering, 2009, 9(6): 1242-1248. (in Chinese) 林喆, 匡亚莉, 郭进, 等. 微藻采收技术的进展与展望[J]. 过程工程学报, 2009, 9(6): 1242-1248. DOI:10.3321/j.issn:1009-606X.2009.06.037 |
| [5] |
He N, Li Y, Chen J, et al. Recent investigations and applications of bioflocculant[J]. Microbiology China, 2005, 32(2): 104-108. (in Chinese) 何宁, 李寅, 陈坚, 等. 生物絮凝剂的最新研究进展及其应用[J]. 微生物学通报, 2005, 32(2): 104-108. DOI:10.3969/j.issn.0253-2654.2005.02.022 |
| [6] |
Guo SL, Zhao XQ, Bai FW. Research progress in harvesting microalgae — a review[J]. Microbiology China, 2015, 42(4): 721-728. (in Chinese) 郭锁莲, 赵心清, 白凤武. 微藻采收方法的研究进展[J]. 微生物学通报, 2015, 42(4): 721-728. |
| [7] |
Dwyer R, Bruckard WJ, Rea S, et al. Bioflotation and bioflocculation review: microorganisms relevant for mineral beneficiation[J]. Mineral Processing and Extractive Metallurgy, 2012, 121(2): 65-71. DOI:10.1179/1743285512Y.0000000005 |
| [8] |
van den Hende S, Vervaeren H, Desmet S, et al. Bioflocculation of microalgae and bacteria combined with flue gas to improve sewage treatment[J]. New Biotechnology, 2011, 29(1): 23-31. DOI:10.1016/j.nbt.2011.04.009 |
| [9] |
Subramanian SB, Yan S, Tyagi RD, et al. Extracellular polymeric substances (EPS) producing bacterial strains of municipal wastewater sludge: isolation, molecular identification, EPS characterization and performance for sludge settling and dewatering[J]. Water Research, 2010, 44(7): 2253-2266. DOI:10.1016/j.watres.2009.12.046 |
| [10] |
Wu ZY, Shi XM, Zeng J. Research progress of lutein biosynthesis by microalga[J]. Food Science, 2010, 31(1): 268-273. (in Chinese) 吴正云, 史贤明, 曾娟. 微藻生物合成叶黄素的研究进展[J]. 食品科学, 2010, 31(1): 268-273. |
| [11] |
Lelchat F, Cérantola S, Brandily C, et al. The marine bacteria Cobetia marina DSMZ 4741 synthesizes an unexpected K-antigen-like exopolysaccharide[J]. Carbohydrate Polymers, 2015, 124: 347-356. DOI:10.1016/j.carbpol.2015.02.038 |
| [12] |
Lei XQ, Chen Y, Shao ZZ, et al. Effective harvesting of the microalgae Chlorella vulgaris via flocculation-flotation with bioflocculant[J]. Bioresource Technology, 2015, 198: 922-925. DOI:10.1016/j.biortech.2015.08.095 |
| [13] |
Xie YP, Yang XQ, Chen JF, et al. Effects of indoor and outdoor cultivation conditions on the cell growth and lutein accumulation of thermo-tolerant Desmodesmus sp. F51[J]. The Chinese Journal of Process Engineering, 2016, 16(5): 849-855. (in Chinese) 谢友坪, 阳需求, 陈剑锋, 等. 室内外培养对耐温微藻Desmodesmus sp. F51细胞生长和叶黄素积累的影响[J]. 过程工程学报, 2016, 16(5): 849-855. |
| [14] |
Li Y, Xu YT, Liu L, et al. First evidence of bioflocculant from Shinella albus with flocculation activity on harvesting of Chlorella vulgaris biomass[J]. Bioresource Technology, 2016, 218: 807-815. DOI:10.1016/j.biortech.2016.07.034 |
| [15] |
Cai WC, Yuan HJ. Chemical Analysis Methods of Biological Substance[M]. Beijing: Science Press, 1982. (in Chinese) 蔡武城, 袁厚积. 生物物质常用化学分析法[M]. 北京: 科学出版社, 1982. |
| [16] |
Castillo-Castillo Y, Ruiz-Barrera O, Burrola-Barraza ME, et al. Isolation and characterization of yeasts from fermented apple bagasse as additives for ruminant feeding[J]. Brazilian Journal of Microbiology, 2016, 47(4): 889-895. DOI:10.1016/j.bjm.2016.07.020 |
| [17] |
Kim DG, Oh HM, Park YH, et al. Optimization of flocculation conditions for Botryococcus braunii using response surface methodology[J]. Journal of Applied Phycology, 2013, 25(3): 875-882. DOI:10.1007/s10811-012-9948-4 |
| [18] |
Morineau-Thomas O, Jaouen P, Legentilhomme P. The role of exopolysaccharides in fouling phenomenon during ultrafiltration of microalgae (Chlorella sp. and Porphyridium purpureum): advantage of a swirling decaying flow[J]. Bioprocess and Biosystems Engineering, 2002, 25(1): 35-42. |
| [19] |
Chen L, Wang CW, Wang WG, et al. Optimal conditions of different flocculation methods for harvesting Scenedesmus sp. cultivated in an open-pond system[J]. Bioresource Technology, 2013, 133: 9-15. DOI:10.1016/j.biortech.2013.01.071 |
| [20] |
Zhang JG, Hu B. A novel method to harvest microalgae via co-culture of filamentous fungi to form cell pellets[J]. Bioresource Technology, 2002, 114: 529-535. |
| [21] |
He J, Zou J, Shao ZZ, et al. Characteristics and flocculating mechanism of a novel bioflocculant HBF-3 produced by deep-sea bacterium mutant Halomonas sp. V3a'[J]. World Journal of Microbiology and Biotechnology, 2010, 26(6): 1135-1141. DOI:10.1007/s11274-009-0281-2 |
| [22] |
Salehizadeh H, Shojaosadati SA. Extracellular biopolymeric flocculants: recent trends and biotechnological importance[J]. Biotechnology Advances, 2001, 19(5): 371-385. DOI:10.1016/S0734-9750(01)00071-4 |
| [23] |
Liu CW, Liu HS. Rhodococcus erythropolis strain NTU-1 efficiently degrades and traps diesel and crude oil in batch and fed-batch bioreactors[J]. Process Biochemistry, 2011, 46(1): 202-209. DOI:10.1016/j.procbio.2010.08.008 |
| [24] |
Wan C, Zhao XQ, Guo SL, et al. Bioflocculant production from Solibacillus silvestris W01 and its application in cost-effective harvest of marine microalga Nannochloropsis oceanica by flocculation[J]. Bioresource Technology, 2013, 135: 207-212. DOI:10.1016/j.biortech.2012.10.004 |
| [25] |
Liu C, Wang K, Jiang JH, et al. A novel bioflocculant produced by a salt-tolerant, alkaliphilic and biofilm-forming strain Bacillus agaradhaerens C9 and its application in harvesting Chlorella minutissima UTEX2341[J]. Biochemical Engineering Journal, 2015, 93: 166-172. DOI:10.1016/j.bej.2014.10.006 |
| [26] |
Salim S, Kosterink NR, Tchetkoua Wacka ND, et al. Mechanism behind autoflocculation of unicellular green microalgae Ettlia texensis[J]. Journal of Biotechnology, 2014, 174: 34-38. DOI:10.1016/j.jbiotec.2014.01.026 |
| [27] |
Garzon-Sanabria AJ, Davis RT, Nikolov ZL. Harvesting Nannochloris oculata by inorganic electrolyte flocculation: effect of initial cell density, ionic strength, coagulant dosage, and media pH[J]. Bioresource Technology, 2012, 118: 418-424. DOI:10.1016/j.biortech.2012.04.057 |
 2020, Vol. 47
2020, Vol. 47