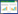扩展功能
文章信息
- 赵晨, 孟慧敏, 李家欣, 张培玉, 李福利, 王士安
- ZHAO Chen, MENG Hui-Min, LI Jia-Xin, ZHANG Pei-Yu, LI Fu-Li, WANG Shi-An
- 解脂耶罗维亚酵母工程菌合成超长链脂肪酸及温度的影响
- Engineering the yeast Yarrowia lipolytica to synthesize very-long-chain fatty acids and the effects of temperature on fatty acids synthesis
- 微生物学通报, 2020, 47(1): 13-23
- Microbiology China, 2020, 47(1): 13-23
- DOI: 10.13344/j.microbiol.china.190090
-
文章历史
- 收稿日期: 2019-01-28
- 接受日期: 2019-04-03
- 网络首发日期: 2019-04-15
2. 中国科学院青岛生物能源与过程研究所 山东 青岛 266101;
3. 青岛市食品药品检验研究院 山东 青岛 266071;
4. 中国科学院大学 北京 100039
2. Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao, Shandong 266101, China;
3. Qingdao Institute for Food and Drug Control, Qingdao, Shandong 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100039, China
解脂耶罗维亚酵母属于产油酵母,具有产油量高、易培养、繁殖快、易于遗传改造等优点,其产油可以达到细胞干重的70%,并且该酵母属于“生物安全性第一级微生物” (Biosafety class 1 microorganism)[1-2],近年来,解脂耶罗维亚酵母被广泛用于微生物油脂和不饱和脂肪酸的开发[3-4]。应用解脂耶罗维亚酵母合成长链油脂已经接近理论水平,糖油转化率达到0.269 g/g,油脂发酵浓度可达到98.9 g/L[5]。然而,应用解脂耶罗维亚酵母合成超长链脂肪酸仍待研究。
超长链脂肪酸通常指主碳链上碳原子数大于18的脂肪酸。已有研究表明多种超长链脂肪酸具有重要应用价值,例如多不饱和脂肪酸中的二十碳五烯酸(eicosapentaenoic acid,EPA)具有预防脑血栓、脑溢血、高血压等心血管疾病的作用[6],二十二碳六烯酸(DHA)可促进婴儿智力和视力发育[7]。此外,还有多种超长链脂肪酸具有重要应用价值,但是其生物合成研究和开发仍亟待加强,如芥酸(C22:1Δ13)、神经酸(C24:1Δ15)、二十六碳酸(C26:0)、二十八碳酸(C28:0)、三十碳酸(C30:0)等。芥酸是重要的化工原料,主要用于生产芥酸酰胺。神经酸主要以鞘糖脂和鞘磷脂的形式存在于动物大脑白质和髓鞘的神经纤维中,可用于治疗人的多发性硬化症(multiple sclerosis)等神经紊乱病症[8-10]。二十六碳酸、二十八碳酸和三十碳酸等可用于特种合成或医药中间体。
解脂耶罗维亚酵母合成的脂肪酸以C16和C18链长为主,因缺少合成超长链脂肪酸的延长酶,野生型菌株无法合成超长链脂肪酸。但是,应用代谢工程和合成生物学方法,有望将该酵母发展为超长链脂肪酸细胞工厂。目前发现的脂肪酸延长酶的种类和数量繁多,在同一种生物体可有超过20种的脂肪酸延长酶,这些酶的底物专一性往往不同。在酿酒酵母表达植物拟南芥的脂肪酸延长酶基因AtFAE1,可以催化合成C20–C26链长的脂肪酸,其中C20:1脂肪酸比例最高[11]。在酿酒酵母表达非洲芥菜(Brassica tournefortii)延长酶基因BtFAE1,能够催化合成2.3%的芥酸(C22:1)[12-13],而在酿酒酵母表达碎米芥属植物Cardamine graeca的延长酶基因CgKCS,可以催化合成碳链更长的神经酸(C24:1)[14]。酿酒酵母是验证基因功能的模式体系,但是酿酒酵母不是产油酵母,通常油脂的细胞含量低于20%[15]。上述脂肪酸延长酶基因在产油酵母中表达可能呈现不同于酿酒酵母的结果。本文首先研究了在解脂耶罗维亚酵母表达脂肪酸延长酶基因AtFAE1、BtFAE1和CgKCS合成超长链脂肪酸的情况。此外,培养和发酵温度对解脂耶罗维亚酵母生理代谢影响显著[16],因此本文还以工程菌株为材料,研究了温度对脂肪酸合成的影响,该项研究为开发超长链脂肪酸酵母细胞工厂提供理论和技术参考。
1 材料与方法 1.1 菌株实验所用解脂耶罗维亚酵母出发菌株为Po1g (MATa、leu2-270、ura3-302::URA3、xpr2-3),Yeastern Biotech公司。构建质粒所用大肠杆菌感受态为E. coli Trans1-T1,购自北京全式金生物技术有限公司。
1.2 培养基LB培养基(g/L):酵母提取物5.0,胰蛋白胨10.0,氯化钠10.0。1×105 Pa蒸汽灭菌30 min,固体培养基添加1.5%的琼脂。氨苄青霉素100 μg/mL。
YPD培养基(g/L):酵母提取物10.0,蛋白胨20.0,葡萄糖20.0。0.67×105 Pa蒸汽灭菌30 min,固体培养基添加1.5%的琼脂。
YNB培养基(g/L):葡萄糖50.00,酵母提取物1.50,尿嘧啶0.02,亮氨酸0.10,YNB 1.70。0.67×105 Pa蒸汽灭菌30 min,固体培养基添加1.5%的琼脂。
亮氨酸营养缺陷型培养基(g/L):葡萄糖20.0,Leu Minus Media 8.0,调节pH为5.5。0.67×105 Pa蒸汽灭菌30 min,固体培养基添加1.5%的琼脂。
1.3 主要试剂和仪器蛋白胨、琼脂,北京Solarbio公司;胰蛋白胨、酵母粉,Oxoid公司;氯化钠、葡萄糖,国药集团化学试剂有限公司;YNB (yeast nitrogen base without amino acids),生工生物工程(上海)股份有限公司;尿嘧啶,上海源叶生物科技有限公司;亮氨酸,上海麦克林生化科技有限公司;亮氨酸营养缺陷型培养基(Leu minus media),北京泛基诺科技有限公司。
真菌DNA快速提取试剂盒,生工生物工程(上海)股份有限公司;质粒快速抽提试剂盒、EasyTaq DNA聚合酶、DNA Marker,北京全式金生物技术有限公司;PCR产物纯化试剂盒、琼脂糖凝胶回收试剂盒,Omega公司;Gibson assembly,Applied Biological Materials Inc公司;限制性内切酶,Thermo Scientific公司;高保真DNA聚合酶,KAPA Biosystems公司。
PCR扩增仪、离心机,Eppendorf公司;气相色谱分析仪,Agilent公司;电子天平,Sartorius Group公司;超净工作台,苏州安泰空气技术有限公司;恒温摇床,上海智诚实验设备有限公司;紫外分光光度计,尤尼柯(上海)仪器有限公司;氮吹仪,天津市恒奥科技发展有限公司;电热恒温鼓风干燥箱、培养箱,上海精宏实验有限公司。
1.4 重组菌株的构建所需的PCR扩增引物见表 1,由青岛擎科梓熙生物技术有限公司合成,所有质粒采用Gibson assembly法构建。根据真菌DNA快速提取试剂盒说明书提取解脂耶罗维亚酵母的基因组DNA,以解脂耶罗维亚酵母的基因组DNA作为模板,以DGAT-F/DGAT-R为引物序列,采用KAPA HiFi高保真DNA聚合酶扩增DGAT1基因片段。基因AtFAE1、BtFAE1和CgKCS均由无锡青兰生物科技有限公司合成获得,以合成的基因为模板,应用表 1中引物分别扩增AtFAE1、BtFAE1和CgKCS基因片段。以解脂耶罗维亚酵母的基因组DNA作为模板,以TEF1-F/TEF1-R和XPR2-F/XPR2-R作为引物序列,PCR扩增TEF1启动子和XPR2终止子。所有质粒的构建以pYLEX1为基本骨架,PCR扩增质粒基本骨架片段。根据构建质粒所需的片段长度(bp)和所测浓度(ng/µL),按照摩尔数1:5的比例混合到PCR管中,同时添加5 µL Gibson assembly试剂,使得总体积为10 µL,体系混匀后50 ℃连接1−2 h。取2 µL装配产物转化大肠杆菌感受态细胞Trans1-T1,通过抗性筛选、PCR扩增、酶切验证获得重组质粒pYLEX1-AtFAE1、pYLEX1- BtFAE1、pYLEX1-CgKCS、PYLEX1-AtFAE1- BtFAE1-CgKCS和pYLEX1-CgKCS-DGAT1。将得到的重组质粒用NotⅠ酶切线性化,采用醋酸锂转化法转化解脂耶罗维亚酵母,涂布亮氨酸营养缺陷型筛选平板,筛选阳性克隆[17]。PCR反应体系(25 µL):2×高保真DNA聚合酶12.5 µL,10 µmol/L上、下游引物各1.5 µL;模板1 µL,ddH2O 8.5 µL。PCR反应条件:95 ℃ 3 min;98 ℃ 20 s,65 ℃ 15 s,72 ℃延伸时间按照2 000 bp/min计算,35个循环;72 ℃ 10 min。
| 引物 Primers |
引物序列 Primer sequence (5′→3′) |
长度 Size (bp) |
| p-F | AATTCCGTCGTCGCCTGAGTC | 21 |
| p-R | GTCGACCGATGCCCTTGAGAG | 21 |
| AtFAE1-F | catagcacgcgtgtagatacTTAAGATCGGCCGTTCTGCAC | 41 |
| AtFAE1-R | gaattaaacacacatcaacaATGACCTCTGTGAACGTGAAG | 41 |
| BtFAE1-F | actttttgcagtactaaccgcagACCTCTGTGAACGTGAAGCTG | 44 |
| BtFAE1-R | gcaagaccggcaacgtggggTTAAGATCGGCCGTTCTGCAC | 41 |
| CgKCS-F | actttttgcagtactaaccgcagACCTCTATCAACGTGAAGCTG | 44 |
| CgKCS-R | gcaagaccggcaacgtggggTTAAGATCGGCCGTTTTGGG | 40 |
| DGAT-F | actttttgcagtactaaccgcagACTATCGACTCACAATACTAC | 44 |
| DGAT-R | gcaagaccggcaacgtggggTTACTCAATCATTCGGAACTC | 41 |
| TEF1-F | tctcaagggcatcggtcgacAGAGACCGGGTTGGCGGCGC | 40 |
| TEF1-R | CTGCGGTTAGTACTGCAAAAAGTGCTGGTCG | 31 |
| XPR2-F | CCCCACGTTGCCGGTCTTGC | 20 |
| XPR2-R | gctgtcaaacatgagaattcGGACACGGGCATCTCACTTGC | 41 |
| 注:小写字母代表Gibson assembly装配的重叠片段,大写字母代表扩增引物. Note: Lower-case letters represent overlapping fragments for Gibson assembly and upper-case letters represent synthesized primers. |
||
取−80 ℃保存的解脂耶罗维亚酵母菌株Po1g和Po1g-VL在YPD固体培养基上划线,置于28 ℃培养箱培养48 h,从固体培养基取单克隆接种于50 mL YPD液体培养基,于28 ℃、250 r/min培养27 h作为种子液,按3.5%的接种量将种子液接种于100 mL(装液量为1/5) YNB发酵培养基。分别在22、25、28、32 ℃的条件下,以250 r/min转速发酵培养。每个条件设置3个平行,并做一次生物学重复。
1.5.2 生长曲线的测定分别于培养0、5、14、27、74、120、144、168 h取适量菌液,于600 nm下测量其吸光度值,以培养时间为横坐标、OD600值为纵坐标绘制生长曲线。
1.5.3 生物量的测定将发酵液于12 000 r /min离心5 min收集菌体,用蒸馏水洗涤2次,去掉上清,置于85 ℃烘箱烘干至恒重,计算烘干前后两次离心管的质量差得到菌体的干重。
1.5.4 油脂的提取发酵培养结束后,用50 mL离心管收集发酵培养液,6 000 r/min高速离心10 min收集菌体,油脂提取方法采用酸热法[18]:1 g湿菌体加入4 mol/L盐酸10 mL,振荡混匀,室温放置1 h,沸水浴8 min,立即放于−20 ℃速冷30 min;然后加入氯仿-甲醇(1:1,体积比)充分混合,4 000 r/min离心5 min;收集下层氯仿层,加入等体积质量分数为0.15%的氯化钠,4 000 r/min离心5 min;收集氯仿层,使用氮吹快速除去氯仿得到油脂,比较前后两次离心管的质量得到油重,产油量(g/L)以每升菌液的油重表示,细胞油脂含量以油重与菌体干重的比率表示。
1.5.5 脂肪酸甲酯化对提取的油脂称重后,在玻璃管中添加2.6 mL甲醇-硫酸溶液(体积比98:2),于85 ℃烘箱反应3 h,放入冰箱冷却,添加1 mL饱和氯化钠溶液和1 mL正己烷,振荡混匀后于4 000 r/min离心5 min,收集上层氯仿层添加到气相色谱小瓶中,编号进行气相色谱分析[19]。
1.5.6 气相色谱分析脂肪酸成分色谱检测条件如下:色谱柱为HP-5 (30 m× 0.32 mm×0.25 μm);进样温度:250 ℃;检测器温度:250 ℃;进样体积:1 μL;起始柱温为140 ℃,保持1 min,以10 ℃/min升温至180 ℃,保持2 min,以5 ℃ /min升温至210 ºC,保持4 min,以5 ℃ /min升温至250 ℃,保持4 min。以面积归一法得到各脂肪酸组分的相对含量。
2 结果与分析 2.1 解脂耶罗维亚酵母工程菌的构建解脂耶罗维亚酵母本身不能合成超长链脂肪酸,需要表达外源脂肪酸延长酶基因,构建外源合成途径,实现超长链脂肪酸的合成(图 1)。选择不同的脂肪酸延长酶和产油基因构建了重组质粒pYLEX1-AtFAE1、pYLEX1-BtFAE1、pYLEX1- CgKCS、pYLEX1-AtFAE1-BtFAE1-CgKCS和pYLEX1- CgKCS-DGAT1,转化解脂耶罗维亚酵母出发菌株Po1g,通过诊断PCR和序列测定筛选阳性工程菌株,分别命名为Po1g-AtFAE1、Po1g-BtFAE1、Po1g- CgKCS、Po1g-AtFAE1-BtFAE1-CgKCS和Po1g-VL (表 2)。
|
| 图 1 解脂耶罗维亚酵母合成超长链脂肪酸的代谢途径设计 Figure 1 Design of metabolic pathways for synthesis of very-long-chain fatty acids in Y. lipolytica 注:实线框内为内源途径,虚线框内为外源途径. Note: Full line denotes the native pathway. Dotted line denotes the exogenous pathway. |
|
|
| Strains and plasmids | Characteristics | Source |
| Strains | ||
| Po1g | MATa, leu2-270, ura3-302::URA3, xpr2-3 | Yeastern |
| Po1g-AtFAE1 | Po1g, pYLEX1-AtFAE1 | This work |
| Po1g-BtFAE1 | Po1g, pYLEX1-BtFAE1 | This work |
| Po1g-CgKCS | Po1g, pYLEX1-CgKCS | This work |
| Po1g-AtFAE1-BtFAE1-CgKCS | Po1g, pYLEX1-AtFAE1-BtFAE1-CgKCS | This work |
| Po1g-VL | Po1g, pYLEX1-CgKCS-DGAT1 | This work |
| Plasmids | ||
| pYLEX1 | pINA1269-Leu | Yeastern |
| pYLEX1-AtFAE1 | pYLEX1, PTEF1-AtFAE1-TXPR2 | This work |
| pYLEX1-BtFAE1 | pYLEX1, PTEF1-BtFAE1-TXPR2 | This work |
| pYLEX1-CgKCS | pYLEX1, PTEF1-CgKCS-TXPR2 | This work |
| pYLEX1-AtFAE1-BtFAE1-CgKCS | pYLEX1, PTEF1-AtFAE1-TXPR2, PTEF1-BtFAE1-TXPR2, PTEF1-CgKCS-TXPR2 | This work |
| pYLEX1-CgKCS-DGAT1 | pYLEX1, PTEF1-CgKCS-TXPR2, PTEF1-DGAT1-TXPR2 | This work |
测定解脂耶罗维亚酵母Po1g-AtFAE1、Po1g- BtFAE1和Po1g-CgKCS培养至第5天时的脂肪酸组成,结果如图 2所示。出发菌株Po1g主要合成链长为C16和C18的脂肪酸,其中C18:1为主要组分,含量接近总脂肪酸的一半。而工程菌株Po1g-AtFAE1能够合成C20:1脂肪酸,占总油脂的4.4%;Po1g-BtFAE1能够合成芥酸(C22:1),占总油脂的5.3%;Po1g-CgKCS能够合成神经酸(C24:1),占总油脂的6.4%,并且合成少量C20:1和C22:1。3种单基因表达菌株的C16:1含量均比出发菌株高,而C18:1含量均低于出发菌株。

|
| 图 2 解脂耶罗维亚酵母工程菌的脂肪酸组成变化 Figure 2 Fatty acid composition in Y. lipolytica Note: A: Po1g-AtFAE1; B: Po1g-BtFAE1; C: Po1g-CgKCS; D: Po1g-AtFAE1-BtFAE1-CgKCS. |
|
|
测定3基因共表达菌株Po1g-AtFAE1-BtFAE1- CgKCS的脂肪酸组成,结果显示神经酸含量占总油脂的5.1%,比只表达CgKCS的含量降低1.4%,C24:0含量占总油脂的8.5%,比只表达CgKCS的含量增加了4.5%。这表明脂肪酸延长酶AtFAE1、BtFAE1和CgKCS并没有协同延长单不饱和脂肪酸,CgKCS基因可直接催化油酸(C18:1)合成神经酸(C24:1) (图 2D)。基于此,在Po1g-CgKCS基础上,过表达内源二酯酰甘油酰基转移酶基因DGAT1得到菌株Po1g-VL,发酵培养5 d后测定细胞油脂含量。结果显示,过表达DGAT1基因可以有效提高细胞油脂含量,Po1g、Po1g-CgKCS和Po1g-VL的细胞油脂含量分别为17%、18%和27%,菌株Po1g-VL与Po1g-CgKCS相比细胞油脂含量提高了50%,脂肪酸组成也出现一定变化,尤其是C16:0、C18:2和C24:0 (图 3)。

|
| 图 3 解脂耶罗维亚酵母高表达DGAT1基因的细胞油脂含量(A)和脂肪酸组成(B) Figure 3 Lipid content (A) and fatty acid composition (B) in Y. lipolytica overexpressing the gene DGAT1 |
|
|
以工程菌株Po1g为研究对象,首先设置了4个不同温度28、31、34、37 ℃开展预实验,结果表明37 ℃对解脂耶罗维亚酵母生长具有明显胁迫作用(图 4A)。基于这一结果,在低于37 ℃的范围内设置了4个温度22、25、28、32 ºC,研究了温度对解脂耶罗维亚酵母生长、产油以及脂肪酸组成的影响。

|
| 图 4 不同温度下解脂耶罗维亚酵母的生长差异 Figure 4 The growth of Y. lipolytica under different temperatures 注:A:温度预实验结果;B:Po1g菌株的生长情况;C:Po1g-VL菌株的生长情况. Note: A: Preliminary experiment; B: The growth of the strain Po1g; C: The growth of the strain Po1g-VL. |
|
|
出发菌株Po1g与工程菌株Po1g-VL在4种不同温度下培养5 d的生长情况如图 4B和4C所示。随温度变化,两株菌呈现了相同的生长趋势,都是在28 ℃条件下生长最快且稳定期的生物量最大,其次为25、22、32 ℃。不同的是,Po1g-VL菌株在所有温度条件下的生物量明显大于出发菌株Po1g,在28 ℃培养条件下Po1g-VL的OD600最高为28.0,而Po1g仅为10.8,可能原因是工程菌株Po1g-VL回补了营养缺陷型基因Leu,并高表达了产油基因DGAT1。
2.3.2 温度对解脂耶罗维亚酵母产油的影响出发菌株Po1g与工程菌株Po1g-VL在4种不同温度下培养5 d后的细胞油脂含量和产油量如图 5所示。Po1g和Po1g-VL的细胞油脂含量均随着温度升高而降低,22 ℃条件下最大,分别为23.2%和33.2%,与Po1g相比,Po1g-VL的细胞油脂含量提高了43%,表明DGAT1基因的有效表达促进了细胞油脂的合成。Po1g和Po1g-VL的油脂产量也是在22 ℃培养条件下最大,分别为0.9 g/L和2.3 g/L。可见,在本研究测试范围内最适产油温度(22 ℃)不同于最适生长温度(28 ℃)。

|
| 图 5 不同温度下Po1g (A)与Po1g-VL (B)油脂产量和细胞油脂含量的变化 Figure 5 The lipid production and lipid content of Po1g (A) and Po1g-VL (B) under different temperatures |
|
|
应用气相色谱测定了不同培养温度下工程菌株Po1g-VL和出发菌株Po1g的脂肪酸组成(图 6)。随着温度的改变,两株菌在总饱和脂肪酸和总不饱和脂肪酸上表现了一致趋势,都是随温度升高饱和脂肪酸含量增加而不饱和脂肪酸含量降低,其中工程菌株Po1g-VL在22 ℃总不饱和脂肪酸含量达到72.2% (图 6A和6B)。在单一脂肪酸组分含量上,两株菌既表现了一致趋势,也有相反的结果。
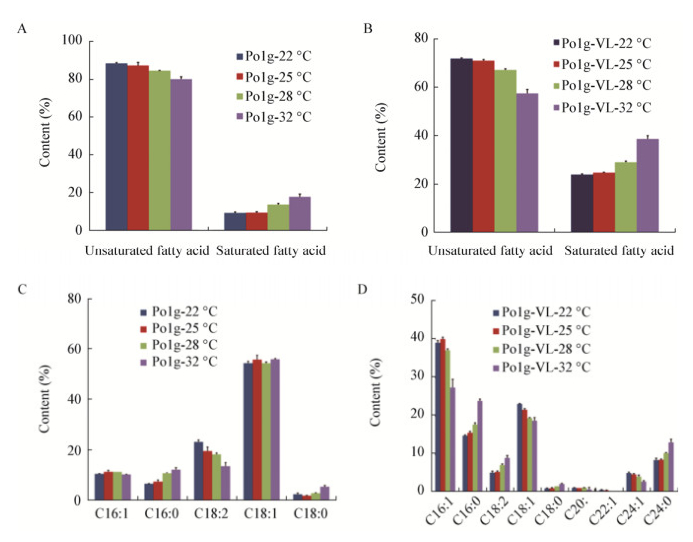
|
| 图 6 不同温度下Po1g与Po1g-VL的脂肪酸变化 Figure 6 The fatty acid change of Po1g and Po1g-VL under different temperatures 注:A:Po1g的总饱和脂肪酸与总不饱和脂肪酸;B:Po1g-VL的总饱和脂肪酸与总不饱和脂肪酸;C:Po1g的脂肪酸组成;D:Po1g-VL的脂肪酸组成. Note: A: The total saturated and unsaturated fatty acid content of Po1g; B: The total saturated and unsaturated fatty acid content of Po1g-VL; C: The fatty acid composition of Po1g; D: The fatty acid composition of Po1g-VL. |
|
|
出发菌株Po1g主要合成链长为C16和C18脂肪酸,其中油酸(C18:1)含量最高,占总脂肪酸的50%以上。在各组分中,软脂酸(C16:0)和亚油酸(C18:2)随温度变化表现出明显的含量变化,其中软脂酸含量随温度升高而明显升高,由22 ℃条件下的6.8%升至32 ℃条件下的12.5%,接近1倍;亚油酸的含量随温度升高明显下降,由22 ℃条件下的23.5%降至32 ℃条件下的13.9% (图 6C)。
工程菌株Po1g-VL除了合成C16和C18脂肪酸,还合成了C24脂肪酸,并且合成少量C20和C22链长的脂肪酸。各脂肪酸组分在22 ℃和32 ℃条件下展现了明显的差异,其中饱和脂肪酸组分软脂酸(C16:0)、硬脂酸(C18:0)和木焦油酸(C24:0)在32 ℃下比22 ℃含量提高52%至110%,单不饱和脂肪酸棕榈油酸(C16:1)、油酸和神经酸在32 ℃下比22 ℃含量降低19%至45%。值得关注的是Po1g-VL菌株的亚油酸含量随温度升高而升高,22、25、28、32 ℃下分别为5.1%、5.3%、7.1%、9%,这种趋势与出发菌株Po1g相反(图 6D)。
3 讨论与结论随着油脂类可再生能源产品和功能食品需求的增长,解脂耶罗维亚产油酵母被广泛用于长链脂肪酸和油脂的开发研究,但是应用该酵母合成超长链脂肪酸仍待研究。虽然超长链脂肪酸在医药、大健康、化工等领域具有重要应用价值,目前还缺乏相关产品的微生物细胞工厂。在超长链脂肪酸的合成中,脂肪酸延长酶尤为关键。本文通过研究不同来源的脂肪酸延长酶在解脂耶罗维亚酵母的表达,发现延长酶CgKCS可催化合成神经酸(C24:1),BtFAE1可催化合成芥酸(C22:1),AtFAE1可催化合成C20:1脂肪酸。但是,共表达这3个酶未能提高神经酸产量,这表明CgKCS可直接催化C18:1脂肪酸合成C24:1脂肪酸,而C20:1脂肪酸和芥酸含量较少,可能为中间产物。3个酶共用底物油酰基辅酶A (C18:1),并与酯化酶和去饱和酶竞争该底物,底物竞争可能是3个酶共表达仅明显检测到神经酸的主要原因。该发现也暗示,虽然在酵母中脂肪酸延长是通过丙二酰辅酶A脱羧每次添加一个二碳单元,但在应用代谢工程构建超长链脂肪酸菌株时,目标产物的获得并不一定遵循逐一增加二碳单元的思路。
微生物产油通常需要胁迫诱导,培养和发酵条件对油脂和脂肪酸组成往往具有重要影响。本文通过研究温度对解脂耶罗维亚酵母产油的影响,发现低温有利于不饱和脂肪酸合成,而高温有利于饱和脂肪酸合成。类似的趋势也在其它微生物中有所报道,如:米曲霉合成油脂[20],红冬孢酵母合成多不饱和脂肪酸[21],三角褐指藻和微拟球藻合成饱和脂肪酸[22]。微生物的脂肪酸组成影响膜流动性,细胞膜脂中饱和脂肪酸与不饱和脂肪酸的平衡是影响膜流动性的重要生物物理因素。在低温条件下,通常微生物细胞通过增加不饱和脂肪酸合成,以降低脂质双分子层中饱和脂肪酸与不饱和脂肪酸的比例,实现低温适应[23-24]。值得指出的是,本研究发现工程菌株Po1g-VL的亚油酸含量随温度升高而升高(图 6D),不符合低温有利于不饱和脂肪酸合成的规律,这可能与工程菌中亚油酸的底物浓度及去饱和酶的活性有关。
综上,本研究表明,可以通过表达不同的脂肪酸延长酶实现解脂耶罗维亚酵母合成芥酸、神经酸等超长链脂肪酸,而且低温有利于解脂耶罗维亚酵母合成不饱和脂肪酸,高温利于其合成饱和脂肪酸。本研究为构建超长链脂肪酸细胞工厂以及发酵优化提供理论和技术参考。
| [1] |
Ratledge C, Wynn JP. The biochemistry and molecular biology of lipid accumulation in oleaginous microorganisms[J]. Advances in Applied Microbiology, 2002, 51: 1-52. DOI:10.1016/S0065-2164(02)51000-5 |
| [2] |
Groenewald M, Boekhout T, Neuvéglise C, et al. Yarrowia lipolytica: safety assessment of an oleaginous yeast with a great industrial potential[J]. Critical Reviews in Microbiology, 2014, 40(3): 187-206. DOI:10.3109/1040841X.2013.770386 |
| [3] |
Xu P, Qiao KJ, Ahn WS, et al. Engineering Yarrowia lipolytica as a platform for synthesis of drop-in transportation fuels and oleochemicals[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(39): 10848-10853. DOI:10.1073/pnas.1607295113 |
| [4] |
Xie DM, Miller E, Sharpe P, et al. Omega-3 production by fermentation of Yarrowia lipolytica: from fed-batch to continuous[J]. Biotechnology and Bioengineering, 2017, 114(4): 798-812. DOI:10.1002/bit.26216 |
| [5] |
Qiao KJ, Wasylenko TM, Zhou K, et al. Lipid production in Yarrowia lipolytica is maximized by engineering cytosolic redox metabolism[J]. Nature Biotechnology, 2017, 35(2): 173-177. DOI:10.1038/nbt.3763 |
| [6] |
Saravanan P, Davidson NC, Schmidt EB, et al. Cardiovascular effects of marine omega-3 fatty acids[J]. Lancet, 2010, 376(9740): 540-550. DOI:10.1016/S0140-6736(10)60445-X |
| [7] |
Li WZ, Wang L. Research progress on genetic engineering for long-chain polyunsaturated fatty acids EPA and DHA[J]. Biotechnology Bulletin, 2016, 32(8): 1-7. (in Chinese) 李文宗, 王磊. 长链多不饱和脂肪酸EPA、DHA的基因工程研究进展[J]. 生物技术通报, 2016, 32(8): 1-7. |
| [8] |
de Vries GJ, Mocking R, Lok A, et al. Fatty acid concentrations in patients with posttraumatic stress disorder compared to healthy controls[J]. Journal of Affective Disorders, 2016, 205: 351-359. DOI:10.1016/j.jad.2016.08.021 |
| [9] |
Assies J, Pouwer F, Lok A, et al. Plasma and erythrocyte fatty acid patterns in patients with recurrent depression: a matched case-control study[J]. PLoS One, 2010, 5(5): e10635. DOI:10.1371/journal.pone.0010635 |
| [10] |
Tanaka K, Shimizu T, Ohtsuka Y, et al. Early dietary treatments with Lorenzo's oil and docosahexaenoic acid for neurological development in a case with Zellweger syndrome[J]. Brain and Development, 2007, 29(9): 586-589. DOI:10.1016/j.braindev.2007.02.005 |
| [11] |
Trenkamp S, Martin W, Tietjen K. Specific and differential inhibition of very-long-chain fatty acid elongases from Arabidopsis thaliana by different herbicides[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(32): 11903-11908. DOI:10.1073/pnas.0404600101 |
| [12] |
Sun XQ, Pang H, Li MM, et al. Evolutionary pattern of the FAE1 gene in Brassicaceae and its correlation with the erucic acid trait[J]. PLoS One, 2013, 8(12): e83535. DOI:10.1371/journal.pone.0083535 |
| [13] |
Pang H, Li Y, Li MM, et al. Cloning and function verification of FAE1 gene in some species of Brassicaceae[J]. Journal of Plant Resources and Environment, 2013, 22(1): 8-13. (in Chinese) 庞慧, 李莹, 李密密, 等. 十字花科植物FAE1基因的克隆与功能验证[J]. 植物资源与环境学报, 2013, 22(1): 8-13. DOI:10.3969/j.issn.1674-7895.2013.01.02 |
| [14] |
Taylor DC, Francis T, Guo YM, et al. Molecular cloning and characterization of a KCS gene from Cardamine graeca and its heterologous expression in Brassica oilseeds to engineer high nervonic acid oils for potential medical and industrial use[J]. Plant Biotechnology Journal, 2009, 7(9): 925-938. DOI:10.1111/j.1467-7652.2009.00454.x |
| [15] |
Czabany T, Athenstaedt K, Daum G. Synthesis, storage and degradation of neutral lipids in yeast[J]. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids, 2007, 1771(3): 299-309. DOI:10.1016/j.bbalip.2006.07.001 |
| [16] |
Timoumi A, Guillouet SE, Molina-Jouve C, et al. Impacts of environmental conditions on product formation and morphology of Yarrowia lipolytica[J]. Applied Microbiology and Biotechnology, 2018, 102(9): 3831-3848. DOI:10.1007/s00253-018-8870-3 |
| [17] |
Chen DC, Beckerich JM, Gaillardin C. One-step transformation of the dimorphic yeast Yarrowia lipolytica[J]. Applied Microbiology and Biotechnology, 1997, 48(2): 232-235. DOI:10.1007/s002530051043 |
| [18] |
Xiao AF, Jiang XL, Ni H, et al. Study on the relationship between intracellular metabolites and astaxanthin accumulation during Phaffia rhodozyma fermentation[J]. Electronic Journal of Biotechnology, 2015, 18(3): 148-153. DOI:10.1016/j.ejbt.2015.02.002 |
| [19] |
Tian DY. Cloning of KCS genes from microalgae and Malania oleifera, and the preliminary exploration of producing nervonic acid by Yarrowia lipolytica[D]. Qingdao: Master's Thesis of Qingdao University of Science & Technology, 2015 (in Chinese) 田德雨.微藻和蒜头果来源3-酮脂酰-CoA合酶基因克隆及耶鲁维亚酵母(Yarrowia lipolytica)产神经酸的初步研究[D].青岛: 青岛科技大学硕士学位论文, 2015 |
| [20] |
Miranti A, Arbianti R, Utami TS. Effect of pH, temperature and medium agitation rate in production of AA, DHA, EPA from Aspergillus oryzae with submerged fermentation[J]. IOP Conference Series: Earth and Environmental Science, 2018, 105: 012113. DOI:10.1088/1755-1315/105/1/012113 |
| [21] |
He SW, Yang ZJ, Lin LB, et al. Correlation of polyunsaturated fatty acids and the cold adaptation of Rhodosporidium kratochvilovae[J]. Journal of Yunnan University (Natural Sciences Edition), 2014, 36(4): 594-599. (in Chinese) 何仕武, 杨昭杰, 林连兵, 等. 多不饱和脂肪酸与红冬孢酵母低温适应性的关系研究[J]. 云南大学学报:自然科学版, 2014, 36(4): 594-599. |
| [22] |
Zhao T, Han XT, Zhan TR, et al. Effect of temperature on growth and lipid properties of four oil-producing microalgae[J]. Oceanologia et Limnologia Sinica, 2016, 47(6): 1140-1148. (in Chinese) 赵婷, 韩笑天, 詹天荣, 等. 温度对四种产油微藻生长和油脂特性的影响[J]. 海洋与湖沼, 2016, 47(6): 1140-1148. |
| [23] |
Chintalapati S, Kiran MD, Shivaji S. Role of membrane lipid fatty acids in cold adaptation[J]. Cellular and Molecular Biology, 2004, 50(5): 631-642. |
| [24] |
Zhang Q, Wang Z, He SW, et al. Effects of polyunsaturated fatty acids on the cold adaptation of microoganisms[J]. Chinese Bulletin of Life Sciences, 2012, 24(1): 58-62. (in Chinese) 张琦, 王志, 何仕武, 等. 多不饱和脂肪酸对微生物低温适应性的影响[J]. 生命科学, 2012, 24(1): 58-62. |
 2020, Vol. 47
2020, Vol. 47