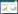扩展功能
文章信息
- 朱华玲, 班立桐, 黄亮, 王玉, 杨红澎, 孙宁
- ZHU Hua-Ling, BAN Li-Tong, HUANG Liang, WANG Yu, YANG Hong-Peng, SUN Ning
- 几种真姬菇菌种保藏方法的保藏效果对比
- Effect comparison of several preservation methods for strains of Hypsizygus marmoreus
- 微生物学通报, 2019, 46(9): 2353-2361
- Microbiology China, 2019, 46(9): 2353-2361
- DOI: 10.13344/j.microbiol.china.180751
-
文章历史
- 收稿日期: 2018-09-27
- 接受日期: 2019-02-13
- 网络首发日期: 2019-03-19
2. 天津农学院农学与资源环境学院 天津 300384
2. College of Agriculture and Resources and Environment, Tianjin Agricultural College, Tianjin 300384, China
近年来,随着真姬菇栽培行业的迅速发展,作为生产源头的菌种成为直接关系到最终产品的产量和质量的关键因素。菌种保藏方法与效果作为种质资源研究的重要方面,是菌种质量的前提和保证。建立经济有效的菌种保藏方法,不仅可以有效保存菌种的优良性状、保持其活力与产量,而且对于种质资源的保存与后续研究都有极其重要的作用[1-12]。在众多保藏方法中,有的保藏方法如冷冻干燥保藏、液氮低温保藏法等保藏效果良好,但对于技术、设备及资金要求较高,不适宜企业的生产,有的保藏方法如试管斜面传代保藏法等,操作相对简便、价格低廉,但易造成菌种的退化,给生产带来损失[13-15]。因此,探讨高效廉价、操作简单的菌种保藏方法十分必要[16-17]。本文从方便生产的角度出发,本着简便、高效、廉价等目标,通过对比菌种保藏后菌丝的生长速率、菌丝脱氢酶活性以及色度培养基(Liquid medium supplemented with bromothymol blue and lactose,LBL)脱色率等指标参数[18-25],研究了斜面保藏法、木屑保藏法以及水溶液保藏法三大类共27种真姬菇菌种的常见保藏方法的保藏效果,以期获得可在行业内推广应用的菌种保藏方法。
1 材料与方法 1.1 材料供试菌株真姬菇菌种HB-1斜面母种由天津农学院食用菌研发中心提供。
溴百里酚蓝(BTB)、3-(4, 5-二甲基-2-噻唑)-2, 5-二苯基溴化四唑(MTT),均为分析纯,天津百奥泰科技发展有限公司;马铃薯淀粉与葡萄糖混合物(PD粉,质量比1:4),青岛海博生物技术有限公司;栎木木屑、杨木木屑、腐木木屑、麸皮等,山东九竹节能科技有限公司。
超净工作台,北京亚泰科隆仪器技术有限公司;紫外-可见分光光度计,上海析谱仪器有限公司;水分测定仪,江苏维科特仪器仪表有限公司;立式压力蒸汽灭菌器,上海三申医疗器械有限公司。
PDA培养基(g/L):马铃薯200.0,葡萄糖20.0,琼脂20.0,pH自然。
1.2 保藏方法 1.2.1 斜面保藏法称取25 g马铃薯淀粉与葡萄糖混合物(PD粉)和20 g琼脂置于烧杯中,加适量水,加热溶解后,加水定容至1 L,分装,1×105 Pa灭菌20 min,灭菌后摆斜面。
将真姬菇斜面母种转接至PDA平板中,置于培养箱中25 ℃培养,待菌丝长满平板。将此菌丝的一部分作为原始种使用,不经保藏,直接参与指标检测;另一部分作为各种保藏方法的初始菌种使用。
用直径9 mm打孔器在长有初始菌种的平板上打孔,得到9 mm菌块,挑取一个菌块接种于试管斜面上,于25 ℃培养箱中培养。培养15 d后,观察菌落的生长形态以及其他特征,判断该培养物是否与原菌种一致,并检查是否染杂菌。检查确认无误后,将长好的斜面试管置于4 ℃冰箱内进行保藏,平行保藏5支试管斜面,保藏3个月后进行指标检测。
1.2.2 木屑保藏法使用2-3目的筛子对所有木屑进行过筛处理,去掉颗粒较小的木屑和碎皮。配制木屑浸泡盐溶液,溶液组成为:磷酸二氢钾0.05%,硫酸镁0.05%,pH 7.0。为保证灭菌彻底,不造成杂菌污染,实验所用木屑内部需完全湿润。本实验中所有木屑分别用纯净水或浸泡盐溶液进行了充分浸泡。最佳浸泡时间、温度等浸泡条件经过实验优化确定如下:
栎木:24 h室温浸泡,每100 g木屑浸泡于400 mL浸泡液,经测定含水量为42%;
杨木:5 h室温浸泡,每100 g木屑浸泡于800 mL浸泡液,经测定含水量为60%;
腐木:本身足够湿润,不需浸泡,经测定含水量为67%。
加速保藏实验的木屑用盐溶液浸泡,浸泡时间和温度条件同上。
将锥形瓶洗净、烘干后,1×105 Pa灭菌1 h。在灭菌的锥形瓶中装入保藏培养基,培养基分为上下两层,上层为木屑+麸皮+石膏,下层为纯木屑,上下层质量比为1:3,上层麸皮与木屑(含少量石膏)的质量比为1:4,各保藏培养基的具体组成如表 1所示。将保藏培养基装瓶时需边装边摇,尽量减少空隙,并保证培养瓶外表面及瓶口无培养基残留。将培养瓶包好透气膜,1×105 Pa高压蒸汽灭菌2.5 h。灭菌完成后,放入接种工作台进行接种。
| Media name | Upper layer | Lower layer |
| Oak | 11.7 g Sawdust + 3 g Bran + 0.3 g Plaster | 45 g Sawdust |
| Rotten wood | 11.7 g Sawdust + 3 g Bran + 0.3 g Plaster | 45 g Sawdust |
| Poplar | 10.41 g Sawdust + 2.66 g Bran + 0.266 g Plaster | 40 g Sawdust |
待保藏培养基温度降至30 ℃以下时,从供试菌种平板中取生长健壮、长势良好的直径为9 mm的2块菌块接种于培养基表面,25 ℃恒温培养箱培养20 d。待培养瓶内培养料长满菌丝后,将其放在4 ℃冰箱中保藏,每种木屑及浸泡液的培养基均平行实验5瓶。加速保藏实验在25 ℃下进行,其他操作不变,保藏3个月后进行指标检测。
1.2.3 水溶液保藏法使用蒸馏水配制各浓度的NaCl溶液,与矿泉水等各种水一起,1×105 Pa高压灭菌20 min。用灭菌后的蒸馏水溶解葡萄糖和聚乙二醇,制备成所需浓度的保藏水溶液,再经0.22 μm滤膜过滤除菌。
以蒸馏水保藏过程为例:取直径为9 mm的菌块,用接种针转入已灭菌的5 mL冻存管中,重复操作,每一冻存管放入5个菌块,用移液枪向每一冻存管移入3-4 mL无菌蒸馏水,使蒸馏水浸没菌块,密封,置于4 ℃冰箱中保藏,平行保藏5支冻存管。加速保藏实验在25 ℃下进行,其他操作不变。
葡萄糖溶液、NaCl溶液、聚乙二醇溶液、矿泉水、纯净水、超纯水等的保藏过程与蒸馏水保藏相同,只需将蒸馏水替换成对应浓度的各种溶液即可,平行保藏5支冻存管,保藏3个月后进行指标检测。
1.3 菌种保藏效果检测 1.3.1 菌丝生长速率取保藏3个月菌种在25 ℃下复苏培养3 d,然后取直径9 mm菌块转接到PDA培养平板上,菌丝萌发后测量菌落直径D1,25 ℃下培养48 h后测量菌落直径D2,进一步计算菌丝生长速率。计算公式:

|
式中,V表示菌丝生长速率,数值越高,则菌丝活力越高,菌种质量越高。
1.3.2 菌丝脱氢酶活性按照文献[26]进行菌丝脱氢酶活性测定,从PDA培养平板中刮取菌丝体适量,称取0.1 g菌丝体装入15 mL离心管中,依次加入2 mL蒸馏水和0.2 mL 5 mg/mL的MTT水溶液,于35 ℃水浴中避光静置3 h。5 000 r/min离心5 min去上清,加入2 mL二甲基亚砜(DMSO)摇匀,35 ℃水浴中避光静置4 h。5 000 r/min离心5 min取上清液100 μL在490 nm波长处测量吸光值OD490,DMSO作空白。OD490值越大,则酶活性越高,菌种质量越高。
1.3.3 LBL培养基脱色法按照表 2的用量制作LBL培养基,配制方法与PDA培养基相同。
| Component | 土豆 Potato | 乳糖 Lactose | NH4NO3 | MgSO4·7H2O | KH2PO4 | BTB | pH |
| Dosage | 200.0 g/L | 20.0 g/L | 2.0 g/L | 0.5 g/L | 1.5 g/L | 0.06 g/L | 7.0 |
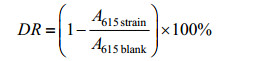
从PDA培养皿中取2个直径9 mm菌丝块置于一个5 mL冻存管中,匀浆30 s后接入装有35 mL LBL培养基的50 mL离心管中,于25 ℃条件下进行液体培养。液体培养16 d后取培养液500 μL,5 000 r/min、4 ℃离心15 min,移取100 μL上清液加入酶标板,使用酶标仪测定615 nm处吸光度值,导入脱色率公式计算脱色率。脱色率计算公式:
|
式中,DR表示脱色率,A615 strain为接种菌株培养后的吸光度值,A615 blank为空白培养液的吸光度值。DR值越高,表示菌丝活力越高,菌种质量越高。
1.4 数据分析采用软件SPSS 22.0对实验数据进行单因素方差分析(One-way ANOVA),使用Duncan检验方法,显著水平设为P < 0.05[27],考察不同保藏方法的菌丝生长速率、脱氢酶活性以及LBL脱色率之间的相关性和差异性水平。
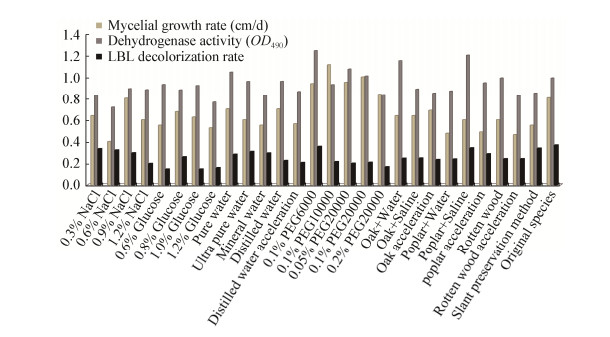
2 结果与分析采用各保藏方法对真姬菇菌种保藏3个月后进行相应指标参数的测定。根据测定得到的菌落直径,490 nm处测得的吸光值OD,以及615 nm处测得的吸光度值A615,结合相应的计算公式得到各种保藏方法的平均菌丝生长速率、平均菌丝脱氢酶活性和平均LBL脱色率,计算结果如表 3和图 1所示。
| 保藏方法 Preservation method | 保藏效果 Preservation result | |||
| 菌丝生长速率 Mycelial growth rate (cm/d) | 脱氢酶活性 Dehydrogenase activity (OD490) | LBL脱色率 LBL decolorization rate (%) | ||
| 水溶液保藏法 Aqueous solution preservation method | 0.3% NaCl | 0.637 5 | 0.826 6 | 33.4 |
| 0.6% NaCl | 0.400 0 | 0.716 5 | 32.2 | |
| 0.9% NaCl | 0.800 0 | 0.890 5 | 29.6 | |
| 1.2% NaCl | 0.600 0 | 0.880 3 | 19.8 | |
| 0.6%葡萄糖 0.6% Glucose | 0.550 0 | 0.929 5 | 14.7 | |
| 0.8%葡萄糖 0.8% Glucose | 0.675 0 | 0.879 1 | 25.9 | |
| 1.0%葡萄糖 1.0% Glucose | 0.625 0 | 0.919 5 | 14.7 | |
| 1.2%葡萄糖 1.2% Glucose | 0.525 0 | 0.763 8 | 15.9 | |
| 纯净水 Pure water | 0.700 0 | 1.044 1 | 28.2 | |
| 超纯水 Ultra pure water | 0.600 0 | 0.957 6 | 30.8 | |
| 矿泉水 Mineral water | 0.550 0 | 0.825 5 | 29.5 | |
| 蒸馏水 Distilled water | 0.700 0 | 0.959 0 | 22.5 | |
| 蒸馏水加速 Distilled water acceleration | 0.562 5 | 0.862 8 | 20.7 | |
| 0.1% PEG6000 | 0.937 5 | 1.242 9 | 35.5 | |
| 0.1% PEG10000 | 1.112 5 | 0.928 1 | 21.5 | |
| 0.05% PEG20000 | 0.950 0 | 1.072 4 | 20.0 | |
| 0.1% PEG20000 | 1.000 0 | 1.008 3 | 20.8 | |
| 0.2% PEG20000 | 0.837 5 | 0.833 8 | 16.8 | |
| 木屑保藏法 Sawdust preservation method | 栎木+水 Oak+Water | 0.637 5 | 1.149 5 | 24.6 |
| 栎木+盐水 Oak+Saline | 0.637 5 | 0.885 8 | 24.8 | |
| 栎木加速实验 Oak acceleration | 0.687 5 | 0.848 3 | 23.4 | |
| 杨木+水 Poplar+Water | 0.475 0 | 0.868 0 | 23.9 | |
| 杨木+盐水 Poplar+Saline | 0.600 0 | 1.200 8 | 34.1 | |
| 杨木加速试验 Poplar acceleration | 0.487 5 | 0.944 8 | 28.7 | |
| 腐木 Rotten wood | 0.600 0 | 0.990 0 | 24.2 | |
| 腐木加速实验 Rotten wood acceleration | 0.462 5 | 0.824 0 | 24.2 | |
| 斜面保藏法 Slant preservation method | 0.550 0 | 0.849 1 | 33.9 | |
| 原始种 Original species | 0.804 4 | 0.990 0 | 36.8 | |
|
| 图 1 各保藏方法的保藏效果对比示意图 Figure 1 Contrast diagram of preservation effect of different preservation methods |
|
|
由表 3和图 1可以看出,不同保藏条件下菌丝的生长速率、脱氢酶活性及LBL脱色率各不相同。与原始种相比,所有保藏方法的LBL脱色率均有一定程度下降,但各保藏方法的LBL脱色率相差不是特别悬殊,菌种退化指标不明显[28];除水溶液保藏法中的聚乙二醇溶液保藏法之外,其余保藏法的菌丝生长速率也呈下降趋势;而不同保藏方法的脱氢酶活性则有升有降。
对比三大类菌种保藏方法的保藏效果发现,大多数水溶液保藏法的菌丝生长速率及菌丝脱氢酶活性高于斜面保藏法,大多数木屑保藏法的菌丝脱氢酶活性高于斜面保藏法,菌丝生长速率与斜面保藏法接近,而斜面保藏法的菌丝生长速率和菌丝脱氢酶活性则较低,略好于加速保藏实验。由此可以判断真姬菇的三大类菌种保藏方法的保藏效果大致有以下顺序:水溶液保藏法 > 木屑保藏法 > 斜面保藏法,略好于加速保藏实验。
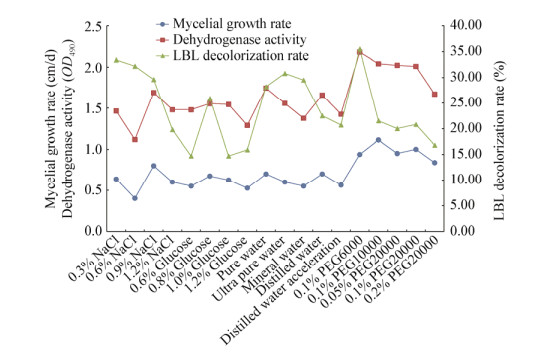
2.1 水溶液保藏法保藏效果的对比分析经过3个月保藏后,不同水溶液保藏真姬菇菌种的平均菌丝生长速率、平均脱氢酶活性以及平均LBL脱色率的对比情况如图 2所示。从表 3和图 2可以看出,不同水溶液对真姬菇菌种的保藏效果各有不同。从菌丝生长速率看,具有如下变化顺序:聚乙二醇溶液 > 各种水 > NaCl溶液 > 葡萄糖溶液 > 蒸馏水加速;从菌丝脱氢酶活性来看,变化顺序则是:聚乙二醇溶液 > 各种水 > 葡萄糖溶液 > 蒸馏水加速 > NaCl溶液。从LBL培养基脱色率来看,虽然NaCl溶液及各种水保藏的菌丝脱色率较高,但与其他水溶液保藏的菌丝脱色率差别不明显。综合上述结果可以看出,不同保藏溶液中聚乙二醇溶液的保藏效果最好,其次是各种水,而NaCl溶液、葡萄糖溶液和蒸馏水加速实验的保藏效果虽有差别,但差别不大。
|
| 图 2 不同水溶液对真姬菇菌种的保藏效果对比 Figure 2 Preservation effects of different water solutions on Hypsizygus marmoreus strains |
|
|
进一步对比发现,不同浓度的水溶液对真姬菇菌种的保藏效果差别也较大,其中0.9% NaCl溶液是各浓度NaCl溶液中保藏效果最好的,而0.8%的葡萄糖溶液则是各浓度葡萄糖溶液中保藏效果最好的。不同水的保藏效果相差不大,但纯净水的保藏效果较好;不同浓度和分子量的聚乙二醇溶液中,0.1% PEG6000的保藏效果最好。将各类水溶液中保藏效果最好的方法筛选出来,进一步进行保藏效果对比(图 3)发现,0.1% PEG6000 > 0.9% NaCl > 纯净水 > 0.8%葡萄糖。
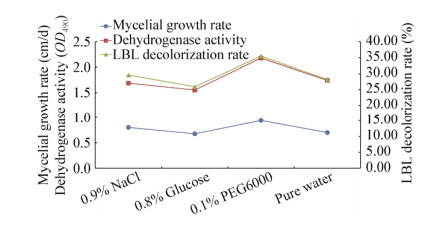
|
| 图 3 各类水溶液中保藏效果最好的方法的保藏效果对比 Figure 3 Effect comparison of the best methods of different preservation solutions |
|
|
不同木屑保藏法的保藏效果(图 4)显示,盐水浸泡过的杨木木屑对真姬菇菌种的保藏效果最好,其次是水浸泡过的栎木木屑,第三是腐木木屑,其他木屑的保藏效果相当,接近于加速保藏实验的效果。从不同种类木屑的保藏效果看,杨木木屑略好于栎木木屑与腐木木屑。在加速保藏实验中虽然3种木屑的保藏效果相比于低温保藏法在数值上均有不同程度的下降,但栎木加速试验的下降趋势并不明显,甚至在菌丝生长速率上还略有上升。

|
| 图 4 不同木屑保藏法的保藏效果对比 Figure 4 Comparison of preservation effects of different sawdust preservation methods |
|
|
为寻找高效、简便、廉价的真姬菇菌种保藏方法,从斜面保藏法、木屑保藏法和水溶液保藏法中分别挑选出一种保藏效果最优的方法进行了对比分析,结果(图 5)显示,与原始种相比,经过3个月的保藏后,0.1% PEG6000保藏的菌丝生长速率、菌丝脱氢酶活性均有所升高,LBL脱色率略有降低;盐水浸泡过的杨木木屑的菌丝只有菌丝脱氢酶活性略微上升,其余指标均呈下降趋势;而斜面保藏法则3个指标均明显下降,因而从保藏效果来看0.1% PEG6000 > 杨木+盐水 > 斜面保藏法。

|
| 图 5 三大类保藏方法中最优保藏方法的效果对比 Figure 5 Effect comparison of the best preservation methods among three kinds of preservation methods |
|
|
为评价实验中采用的3种指标参数(菌丝生长速度、脱氢酶活性以及LBL脱色率)在评价保藏效果的优劣性上是否一致,进一步采用Duncan检验方法对表 3中的实验数据进行了单因素方差分析,分别考察了脱氢酶活性、LBL脱色率对菌丝生长速率的差异性水平,结果显示脱氢酶活性、LBL脱色率对菌丝生长速率的显著性结果分别为0.552和0.707,均大于0.05,表明无显著差异。
3 讨论优良菌种的保藏是制约食用菌产业发展的瓶颈问题之一。目前真姬菇菌种的保藏方法众多,如何从中选出简单、高效、廉价的保藏方法已经成为迫在眉睫需要解决的问题。本实验选择了文献中报道的菌丝生长速度、菌丝脱氢酶活性以及LBL脱色率等参数来衡量27种真姬菇菌种保藏方法的保藏效果。虽然这3个指标在评价保藏效果的优劣性上无显著差异,但LBL脱色率反映的是液体培养中培养基pH的变化,其值往往受到菌丝的呼吸作用和膜的通透性等因素影响。一般情况下,菌丝生长越旺盛,菌丝呼吸作用越强,脱色率越高;但脱色率高的菌丝体其生长速率不一定大,因为脱色率还与膜的通透性有关,膜的通透性越好脱色率越高。因此,在衡量保藏效果好坏时应以菌丝生长速率和菌丝脱氢酶活性为主,以LBL脱色率为辅。
水溶液保藏法是食用菌菌种保藏的常用方法之一,目前主要有蒸馏水保藏法和生理盐水保藏法[29]。本实验将真姬菇菌种保藏溶液的种类范围进行了拓宽,3个月的保藏实验结果表明实验所用的菌种保藏水溶液中,聚乙二醇水溶液的保藏效果最好,其次是各种水,而NaCl溶液、葡萄糖溶液的保藏效果略差,这可能源于聚乙二醇对菌丝细胞具有保护作用,而NaCl溶液、葡萄糖溶液则具有一定渗透压。
4 结论采用三大类27种方法对真姬菇菌种进行保藏实验。结果表明,与当前真姬菇菌种保藏的常规方法(斜面保藏法、蒸馏水保藏法和生理盐水保藏法等)相对比,本实验所采用的菌种保藏方法大大拓宽了菌种保藏方法的种类范围,提高了菌种保藏的效果。通过对真姬菇菌种进行3个月的短期保藏发现,水溶液保藏法的保藏效果最好,其中0.1% PEG6000水溶液对真姬菇菌种的保藏效果最佳;其次是木屑保藏法,其中以盐水浸泡过的杨木木屑保藏效果最好;斜面保藏法和加速保藏法的保藏效果略差。
由于保藏时间所限,本试验尚未能进行各种保藏方法的中长期保藏效果研究,在后续的研究中我们将完善这方面的数据,并将其与短期保藏法进行对比,以期为真姬菇菌种的中长期保藏研究提供参考。
| [1] |
Sun L. Strain collection and expanding process in cultivation of ten edible mushrooms[D]. Yantai: Master's Thesis of Ludong University, 2016 (in Chinese) 孙磊.十种常见栽培食用菌菌种保藏及菌种扩大工艺优化[D].烟台: 鲁东大学硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10451-1016189286.htm |
| [2] |
Zhang WG, Zhang QG, Xie J, et al. Analysis for possibility of using corncob instead of corn kernel as primary medium of Hypsizigus marmoreus[J]. Journal of Inner Mongolia University for Nationalities (Natural Sciences), 2008, 23(1): 45-47. (in Chinese) 张卫国, 张庆国, 谢君, 等. 真姬菇原种培养基配方的初步研究[J]. 内蒙古民族大学学报:自然科学版, 2008, 23(1): 45-47. DOI:10.3969/j.issn.1671-0185.2008.01.016 |
| [3] |
Zhang LR. Study on quality control technology of Volvariella volvacea spawn[D]. Fuzhou: Master's Thesis of Fujian Agriculture and Forestry University, 2011 (in Chinese) 张丽蓉.草菇菌种质量控制技术研究[D].福州: 福建农林大学硕士学位论文, 2011 http://cdmd.cnki.com.cn/article/cdmd-10389-1011164846.htm |
| [4] |
Jiang N. How to select the best strains[J]. Chinese Edible Fungus, 1994(5): 28. (in Chinese) 江农. 如何选购优质菌种[J]. 中国食用菌, 1994(5): 28. |
| [5] |
Fu JQ. Suggestions on popularizing and improving the scientific research and production level of distiller's yeast as well as promoting the development of wine-making industry[J]. Wine Making, 1988(4): 19. (in Chinese) 傅金泉. 关于普及与提高酒曲生产科研水平、促进酿酒工业发展的建议[J]. 酿酒, 1988(4): 19. |
| [6] |
Cui FJ, Song Y. Importance and related problems of edible fungi introduction[J]. Forest By-Product and Speciality in China, 2005(3): 84. (in Chinese) 崔凤江, 宋烨. 食用菌引种的重要性及相关问题[J]. 中国林副特产, 2005(3): 84. DOI:10.3969/j.issn.1001-6902.2005.03.058 |
| [7] |
Chang W. Storage technology of strain in refrigerator[J]. Henan Science and Technology: Country version, 2007(8): 25. (in Chinese) 常伟. 冰箱贮藏菌种技巧[J]. 河南科技:乡村版, 2007(8): 25. |
| [8] |
Zhou YR. Strain-making method of artificial-cultivated Pleurotus ostreatus[J]. Sichuan Agricultural Science and Technology, 1982(4): 42-43. (in Chinese) 周裕荣. 平菇人工栽培的制种方法[J]. 四川农业科技, 1982(4): 42-43. |
| [9] |
Tan JL, Liu MY, Cai YH. Studies on the culture conditions of Pleurotus ostreatus and Lentinus edodes[J]. Edible Fungi, 1993(6): 11-12. (in Chinese) 谭金莲, 刘明月, 蔡永红. 平菇和香菇菌种培养条件的研究[J]. 食用菌, 1993(6): 11-12. |
| [10] |
Lv ZH. Quality identification of edible fungus strains[J]. Hubei Plant Protection, 1994(6): 19-20. (in Chinese) 吕祖慧. 食用菌菌种质量鉴别[J]. 湖北植保, 1994(6): 19-20. |
| [11] |
Huang ZZ. Study on quality control technology of Pleurotus eryngii and Flammulina velutipes strains[D]. Fuzhou: Master's Thesis of Fujian Agriculture and Forestry University, 2011 (in Chinese) 黄贞贞.杏鲍菇和金针菇菌种质量控制技术研究[D].福州: 福建农林大学硕士学位论文, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10389-1011164847.htm |
| [12] |
An BY. Key identification technology of edible fungi strains[J]. Rural Practical Technology, 2006(8): 16. (in Chinese) 安保一. 食用菌种质量鉴别诀窍[J]. 农村实用科技, 2006(8): 16. |
| [13] |
Chen LL. The explore and potimization on preservation condition of preservation tube method for storage of foodborne pathogenic microorganisms[D]. Shanghai: Master's Thesis of Shanghai Jiao Tong University, 2015 (in Chinese) 陈露露.食源性致病菌标准菌株保藏管法保藏条件探究及优化[D].上海: 上海交通大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10248-1016789382.htm |
| [14] |
Zhang F. Introduction of a simple method of preserving strain[J]. Technology Newsletter of Fermentation, 1988(4): 30-31. (in Chinese) 张福. 介绍一种简易保藏菌种的方法[J]. 发酵科技通讯, 1988(4): 30-31. |
| [15] |
Yan ZX. Local methods of preservation strain[J]. Sichuan Agricultural Science and Technology, 1996(1): 46. (in Chinese) 严泽湘. 土法保藏菌种[J]. 四川农业科技, 1996(1): 46. |
| [16] |
Xiong Y, Tong YX, Tang LM, et al. Studies on the conserving methods of edible fungus strain resources[J]. Southwest China Journal of Agricultural Sciences, 2001, 14(1): 96-98. (in Chinese) 熊鹰, 童云霞, 唐利民, 等. 食用菌种质资源保藏方法研究[J]. 西南农业学报, 2001, 14(1): 96-98. DOI:10.3969/j.issn.1001-4829.2001.01.024 |
| [17] |
Lin QY, Ye YS, Song B, et al. Studies on cultivation conditions of white Hypsizygus marmoreus in refrigeration house[J]. Guangdong Agricultural Science, 2011, 38(18): 35-37. (in Chinese) 林群英, 叶运寿, 宋斌, 等. 白玉菇冷库工厂化栽培技术研究[J]. 广东农业科学, 2011, 38(18): 35-37. DOI:10.3969/j.issn.1004-874X.2011.18.016 |
| [18] |
Wang QL, Fan BW, Qi JW, et al. Characteristic study of liquid and solid strains of agaric[J]. Modern Horticulture, 2016(7): 6-7. (in Chinese) 王清霖, 范博文, 祁金威, 等. 木耳液体菌种与固化菌种的特性研究[J]. 现代园艺, 2016(7): 6-7. DOI:10.3969/j.issn.1006-4958.2016.07.003 |
| [19] |
Li S, Liu Y, Ma K, et al. Application of protoplast mononuclear technique in the purification and rejuvenation of Pleurotus nebrodensis strains[J]. Jiangsu Agricultural Science, 2015, 43(5): 248-250. (in Chinese) 李莎, 刘宇, 马康, 等. 原生质体单核化技术在白灵菇菌种提纯复壮中的应用[J]. 江苏农业科学, 2015, 43(5): 248-250. |
| [20] |
Zhou LY. Establishment of wild macrofungi preservation method[D]. Nanchang: Master's Thesis of Jiangxi Agricultural University, 2013 (in Chinese) 周龙洋.野生大型真菌保藏方法的确立[D].南昌: 江西农业大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10410-1013343191.htm |
| [21] |
Niu SL, Yan L, Zhang L, et al. Study on the variation characteristics of biological characteristics of degraded Cordyceps militaris[J]. Henan Agriculture, 2016(26): 61-62. (in Chinese) 牛世莉, 闫玲, 张林, 等. 退化蛹虫草生物学特性的变化特征研究[J]. 河南农业, 2016(26): 61-62. |
| [22] |
Wang ZF. Study on methods of examination and quality measurement of edible mushroom strains[J]. Edible Fungi of China, 1997, 16(1): 18-20. (in Chinese) 王振幅. 食用菌菌种质量检测方法的研究[J]. 中国食用菌, 1997, 16(1): 18-20. |
| [23] |
Qu DH, Tang CH, Chen H, et al. Bromothymol blue decolorization rates and evaluation of mycelial biomass production, flavone levels and antioxidant activity of ten sanghuangporus strains[J]. Acta Edulis Fungi, 2016, 23(2): 84-87, 109. (in Chinese) 曲德辉, 唐传红, 陈辉, 等. LBL法评价桑黄菌株活性[J]. 食用菌学报, 2016, 23(2): 84-87, 109. |
| [24] |
Li S. Construction of a rapid screening system for mushroom breeding in Pleurotus nebrodensis[D]. Baoding: Master's Thesis of Hebei Agricultural University, 2015 (in Chinese) 李莎.白灵菇杂交育种快速筛选体系的构建[D].保定: 河北农业大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10086-1015386413.htm |
| [25] |
Liu Y. Reserach on evaluation method of spawn quality of Hypsizygus marmoreus[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2010 (in Chinese) 刘洋.真姬菇菌种质量评价方法的研究[D].南京: 南京农业大学硕士学位论文, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10307-1012491132.htm |
| [26] |
Xiong C, Luo Q, Jin X, et al. Physiochemical properties immunoregulatory effects of the polysaccharides from Ganodema lingzhi[J]. Microbiology China, 2018, 45(4): 825-835. (in Chinese) 熊川, 罗强, 金鑫, 等. 人工栽培灵芝中多糖的部分理化性质及免疫调节作用[J]. 微生物学通报, 2018, 45(4): 825-835. |
| [27] |
Hu XJ, Wen GL, Tian YJ, et al. Effects of four physical and chemical factors on the nitrification activity of strain XH1[J]. Microbiology China, 2019, 46(6): 1291-1299. (in Chinese) 胡晓娟, 文国梁, 田雅洁, 等. 4种理化因子对菌株XH1硝化效果的影响[J]. 微生物学通报, 2019, 46(6): 1291-1299. |
| [28] |
Li S, Liu Y, Ma K, et al. Methods for rapid differentiation of degenerate strains for cultivated Pleurotus nebrodensis[J]. Biotechnology, 2014, 24(6): 66-68. (in Chinese) 李莎, 刘宇, 马康, 等. 白灵菇菌种退化的快速鉴别方法[J]. 生物技术, 2014, 24(6): 66-68. |
| [29] |
Zhang RY, Hu DD, Zuo XM, et al. Advances in the preservation of edible mushroom cultures[J]. Acta Edulis Fungi, 2010, 17(4): 84-88. (in Chinese) 张瑞颖, 胡丹丹, 左雪梅, 等. 食用菌菌种保藏技术研究进展[J]. 食用菌学报, 2010, 17(4): 84-88. DOI:10.3969/j.issn.1005-9873.2010.04.023 |
 2019, Vol. 46
2019, Vol. 46