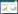扩展功能
文章信息
- 王佳平, 赵光显, 刘宇, 高建义, 谢琼, 韩延平, 李勇枝
- WANG Jia-Ping, ZHAO Guang-Xian, LIU Yu, GAO Jian-Yi, XIE Qiong, HAN Yan-Ping, LI Yong-Zhi
- “实践十号”搭载大肠杆菌代谢组学分析
- Effects of space flight by "SJ-10" satellite on metabolic characteristics of Escherichia coli
- 微生物学通报, 2019, 46(9): 2337-2344
- Microbiology China, 2019, 46(9): 2337-2344
- DOI: 10.13344/j.microbiol.china.180728
-
文章历史
- 收稿日期: 2018-09-19
- 接受日期: 2019-01-24
- 网络首发日期: 2019-02-19
2. 军事医学科学院微生物所 病原微生物生物安全国家重点实验室 北京 100071
2. State Key Laboratory of Pathogen and Biosecurity, Beijing Institute of Microbiology and Epidemiology, Beijing 100071, China
大肠杆菌是一种常见的革兰氏阴性菌,主要存在于人和动物的肠道,一般情况下多不致病,当外界环境发生变化时,可引起肠道外感染,危及人类健康[1]。而随着抗生素的广泛使用和介入技术的不断发展,大肠杆菌感染水平不断增加,耐药性不断增加[2]。近年来,随着载人航天事业的不断发展,航天员在轨作业的时间越来越长,而大肠杆菌广泛存在于人体肠道内,同时俄罗斯生物医学问题研究所对国际空间站的环境监测也发现了大肠杆菌的存在[3],究竟空间环境对大肠杆菌会产生怎样的影响一直是个疑问。太空环境因素复杂,微重力、高真空、强辐射等因素都可能诱导大肠杆菌发生基因突变,进而影响其生物学性状及代谢水平。已有多项研究表明太空环境可影响细菌的增殖水平、毒力以及耐药性[4-6]。因此,研究太空环境下大肠杆菌相应的生物学改变可为载人航天医监医保提供理论依据和技术支持。
代谢组学是20世纪90年代中期迅速发展起来的一门学科,它作为系统生物学中重要的组成部分,具有易检测、信息量大、高效率等特点,已被广泛应用于微生物领域、植物领域、疾病诊断、制药等多个方面[7]。本实验通过“实践十号”返回式科学实验卫星搭载大肠杆菌K12在轨飞行12 d。应用非靶向代谢组学技术分析太空飞行后大肠杆菌代谢水平的变化,找出潜在差异代谢物,并由此推论太空环境可能对大肠杆菌生物学性状的影响,以期为空间环境微生物相关性状及机理的研究提供新的参考。
1 材料与方法 1.1 菌株大肠杆菌K12 (Escherichia coli 1.2389)购自中国普通微生物菌种保藏管理中心。
1.2 培养基LB液体培养基(g/L):含胰蛋白胨10.0,酵母粉5.0,氯化钠10.0,用于大肠杆菌培养。
1.3 主要试剂和仪器甲醇,Fisher Scientific公司;PBS溶液,Gibco公司;其余常规代谢分析试剂均为进口纯级产品。反向色谱柱、超快速液相色谱、四极杆飞行时间质谱,Waters公司;台式高速冷冻离心机,Hettich科学仪器公司;超声波振荡器,昆山市超声仪器有限公司;进样瓶,DIKMA公司;内插管,ANPEL公司;生物安全柜,北京东联哈尔公司;恒温振荡培养箱,上海知楚仪器有限公司;分光光度计,上海第三分析仪器厂。
1.4 搭载菌株的培养将大肠杆菌K12培养到对数生长中期(OD600=1.0),取菌液20 μL涂布到LB斜面培养基上,37 ℃恒温培养16 h后,搭载“实践十号”返回式科学实验卫星在轨飞行12 d,返回后-20 ℃保存菌种。
1.5 样本制备将卫星搭载的大肠杆菌和地面对照组甘油种接种在营养琼脂平板上,37 ℃培养过夜,搭载组与地面对照组各挑6个单菌落依次接种于含10 mL LB液体培养基的12个试管中,37 ℃、200 r/min振荡培养至对数生长中期(OD600=1.0),将菌液依次装入1.5 mL离心管中4 ℃、4 000 r/min离心5 min,弃上清,无菌PBS溶液冲洗菌液3次,收集大肠杆菌沉淀于-80 ℃保存以待样本制备。将大肠杆菌沉淀样本4 ℃融化30–60 min后加入300 μL的甲醇,超声提取10 min。振荡15 s,进行蛋白沉淀。经上述处理后样本蛋白4 ℃、12 000 r/min离心10 min,取上层溶液100 μL,置于200 μL内衬管中,待测。
1.6 检测方法本实验主要通过高效液相色谱-飞行时间质谱进行检测分析,首先使用高效液相色谱(Ultra performance liquid chromatography,UPLC)对菌液样本进行反相色谱分离,其次运用四极杆飞行时间质谱仪进行一二级质谱扫描,提取代谢物母离子以及碎片离子信息,然后运用主成分分析(Principal component analysis,PCA)及正交偏最小二乘判别分析(Orthogonal partial least squares discriminant analysis,OPLS-DA)鉴定两组样本差异的显著性,最后根据一二级质谱扫描信息匹配公共数据库找出组间的潜在生物标志物及可能代谢途径。
1.6.1 色谱条件色谱分离,采用Waters公司的UPLC对菌液样本进行分析。梯度系统的条件分别见表 1。
| Time (min) | A (%) | B (%) |
| 0 | 100 | 0 |
| 1 | 100 | 0 |
| 7 | 0 | 100 |
| 11 | 0 | 100 |
| 14 | 100 | 0 |
色谱柱:Waters UPLC HSS T3 (1.8 μm×2.1 mm× 100 mm)。
流动相:A (水,0.1%甲酸)和B (乙腈,0.1%甲酸);洗脱程序见表 1,流速:0.3 mL/min;进样量为1.0 μL;柱温:45 ℃。
1.6.3 质谱条件质谱分析采用装备了热电喷雾离子源的飞行时间质谱仪。正负离子离子源电压分别为3.7 kV和2.2 kV。毛细管加热温度320 ℃。鞘气压力30 psi,辅助气压力10 psi。容积加热蒸发温度300 ℃。鞘气和辅助气均为氮气。碰撞气为氮气,压力为1.5 mTorr。液质系统由MassLynx 4.1软件控制,数据采集也由该软件操作。
质谱数据的采集方法利用的是Waters质谱仪高分辨质谱正负离子模式下的全信息串联质谱(MSE)数据采集模式。MSE检测时通过低能量和高能量两种模式进行交替扫描。低能量模式进行一级质谱扫描,能量为15 eV,质谱检测器采集检测物的分子离子峰,记录母离子质荷比、离子强度等信息;高能量模式进行二级质谱扫描,能量为45 eV,这时气态离子发生碰撞,碎裂成子离子碎片,通过分析化学键断裂位置及断裂形成的离子碎片大小辅助定性鉴别。MSE数据采集模式通过母离子与其碎片离子具有相同色谱行为的特性进行母-子离子的关联归属。
1.6.4 质量控制为了评价样品采集过程中系统的稳定性和重复性,将所有样本均移取固定体积混合均匀后得到质控样本。实验首先采用5个空白样本平衡色谱柱,再采用3个质控样本平衡柱条件,然后每间隔3个样本后插入1个质控样本以监测系统的稳定性及重复性。同时计算质控样本中提取的代谢特征的变异系数值,删除变异系数超过15%的代谢特征。
1.6.5 数据处理所有采集好的数据,无论是正离子还是负离子模式,均采用Progenesis QI软件处理,包括的步骤依次为导入原始数据、峰对齐、峰提取、归一化处理,最终形成保留时间、质荷比和峰强度的表格。色谱柱自动峰采集时长为14 min,峰提取的强度限定为模式1。对采集过程中得到的各种加合离子相关参数进行解卷积。运用Simca软件对采集的离子数据进行PCA分析及OPLS-DA分析。
1.6.6 差异性代谢物的鉴定为寻找两组间的差异生物标志物,本实验采用OPLS-DA模型的变量重要性值(Variable importance in the projection,VIP) (阈值> 1)筛选出代谢物,并结合ANOVA分析的P值(P < 0.05)来寻找显著性差异生物标志物。差异生物标志物的定性方法为:搜索公共数据库METLIN (https://metlin.scripps.edu)、ECMDB (http://www.ecmdb.ca)、LIPID MAPS (https://www.lipidmaps.org)及KEGG (https://www.kegg.jp),比较质谱的质荷比m/z或者精确分子质量Mass,误差限制0.01 kD,并根据二级图谱中特征碎片离子进行辅助定性鉴别,最后找出其可能的代谢途径。
2 结果与分析 2.1 质控评估结果采用无监督技术PCA分析对质控样本进行分析。质控样本是相同的成分,若系统重复性好,质控样本应该在PCA得分图中聚在一起。在图 1、2中分别显示了ESI反相色谱正离子、负离子分离的PCA得分图,其中每组图中横坐标代表第一主成分,纵坐标代表第二主成分,椭圆内代表主成分积分值95%可信区间范围,其中qc (Quality control)代表质控样本,Sample代表普通样本。相对聚集在一起的qc样品表明,系统重复性好,所采集的数据满足质控要求。

|
| 图 1 正离子模式质控样本评估 Figure 1 Quality control in positive ion mode |
|
|

|
| 图 2 负离子模式质控样本评估 Figure 2 Quality control in negative ion mode |
|
|
图 3、4依次为反相色谱正离子、负离子模式下的总离子流图。每幅图中的A图为搭载组总离子流图,B图为地面对照组总离子流图。其中正离子模式下有448个特征峰被保留,负离子模式下有427个特征峰被保留。从图中可看出,无论是正离子模式下的总离子流图,还是负离子模式下的总离子流图,搭载组与地面对照组整体离子变化趋势大体一致,但反应在个别细节处时有变化。

|
| 图 3 正离子模式总离子流图 Figure 3 Total ion current map in positive ion mode 注:A:搭载组总离子流图;B:地面对照组总离子流图. Note: A: Total ion current map of space flight; B: Total ion current map of ground control. |
|
|
|
| 图 4 负离子模式总离子流图 Figure 4 Total ion current map in negative ion mode 注:A:搭载组总离子流图;B:地面对照组总离子流图. Note: A: Total ion current map of space flight; B: Total ion current map of ground control. |
|
|
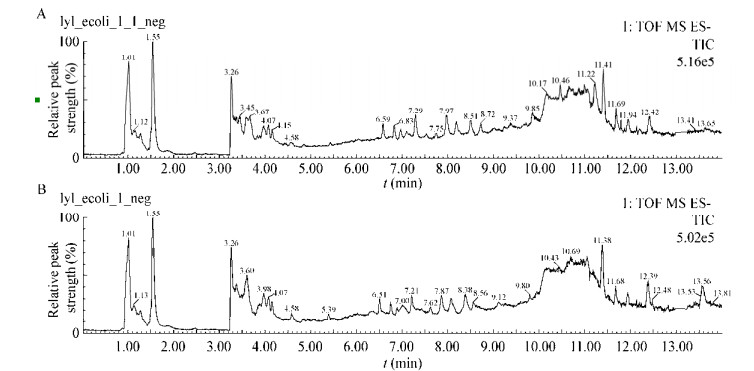
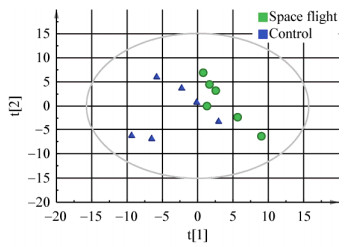
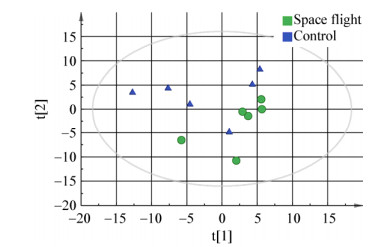
两组样本PCA得分图(Scores plot)如图 5、6所示,图 5代表正离子PCA得分图,图 6代表负离子PCA得分图,每组图中X轴代表第一主成分,Y轴代表第二主成分,椭圆内代表主成分积分值95%可信区间范围,绿色圆圈符号代表搭载组6个样本,蓝色三角符号代表地面对照组6个样本。从图 5、6可以看出,搭载组(Space flight)和地面对照组(Control)样本均在95%可信区间内,虽然两组代谢差异并没有明显分离,但整体反映出组间代谢谱有明显差异。
|
| 图 5 正离子模式PCA得分图 Figure 5 PCA scores plot in positive ion mode |
|
|
|
| 图 6 负离子模式PCA得分图 Figure 6 PCA scores plot in negative ion mode |
|
|
OPLS-DA得分图(Scores plot)如图 7、8所示。图 7代表正离子OPLS-DA得分图,图 8代表负离子OPLS-DA得分图,图中圆圈符号代表搭载组6个样本,三角符号代表地面对照组6个样本,椭圆内代表OPLS-DA积分值95%可信区间范围。从正、负离子OPLS-DA得分图可以看出搭载组样本(Space flight)和地面对照组样本(Control)显著分成两群,且均在95%可信区间内,两组代谢谱有明显组间差异。

|
| 图 7 正离子模式OPLS-DA得分图 Figure 7 OPLS-DA scores plot in positive ion mode |
|
|

|
| 图 8 负离子模式OPLS-DA得分图 Figure 8 OPLS-DA scores plot in negative ion mode |
|
|
通过对差异代谢物的定性共找出12种显著差异生物标志物。其中,正离子模式下有5种,负离子模式下有7种,根据差异代谢物一二级质谱信息代入公共数据库中匹配其分子式及可能的代谢途径如表 2所示。通过代谢物质谱峰的峰面积(丰度)进行定量,如图 9所示,这12种细菌代谢物的水平发生了明显改变,搭载组与地面对照组相比,除右-3-羟基-十八烷酸[(R)-3-Hydroxy-octadecanoic acid]代谢水平下调,其余11种生物标志物代谢水平均呈上调趋势。
| 模式 Mode | 质荷比 m/z | 碎片离子 MSE fragment ions | 保留时间 Retention time (min) | 代谢物名称 Accepted description | 分子式 Formula | 相关代谢途径 Related pathway |
| ESI+ | 480.308 886 7 | 339.291 0, 149.025 3, 116.977 4 | 8.45 | LysoPE (18:1 (11Z)/0:0) | C23H46NO7P | 甘油磷脂代谢 Glycerophospholipid metabolism |
| 452.277 467 2 | 311.260 2, 149.022 9, 119.086 7 | 7.28 | LysoPE (16:1 (9Z)/0:0) | C21H42NO7P | 甘油磷脂代谢 Glycerophospholipid metabolism | |
| 466.293 236 4 | 325.273 7, 200.202 3, 149.026 8 | 7.94 | LysoPC (14:1 (9Z)) | C22H44NO7P | 甘油磷脂代谢 Glycerophospholipid metabolism | |
| 664.116 564 0 | 428.038 9, 524.058 4, 136.062 5 | 1.52 | Fenugreekine | C21H27N7O14P2 | 能量代谢 Energy metabolism | |
| 348.070 754 0 | 235.121 2, 136.062 5, 110.071 9 | 1.52 | 3ʹ-AMP | C10H14N5O7P | 嘌呤代谢 Purine metabolism | |
| ESI– | 299.258 331 1 | 281.246 8, 267.232 1, 253.216 9 | 9.34 | (R)-3-Hydroxy- octadecanoic acid | C18H36O3 | 脂肪酸代谢 Fatty acid metabolism |
| 784.148 965 9 | 655.251 3, 569.291 3, 128.034 4 | 3.45 | FAD | C27H33N9O15P2 | 能量代谢 Energy metabolism | |
| 464.277 554 0 | 267.232 6, 253.216 6, 196.038 5 | 7.96 | LysoPC (14:1 (9Z)) | C22H44NO7P | 甘油磷脂代谢 Glycerophospholipid metabolism | |
| 424.246 319 4 | 374.244 2, 253.216 1, 227.201 4 | 7.01 | LysoPE (0:0/14:0) | C19H40NO7P | 甘油磷脂代谢 Glycerophospholipid metabolism | |
| 450.261 896 6 | 253.217 1, 215.008 4, 199.038 6, | 7.34 | LysoPE (16:1 (9Z)/0:0) | C21H42NO7P | 甘油磷脂代谢 Glycerophospholipid metabolism | |
| 478.293 216 9 | 281.247 4, 253.217 1, 196.037 2 | 8.46 | LysoPE (18:1 (11Z)/0:0) | C23H46NO7P | 甘油磷脂代谢 Glycerophospholipid metabolism | |
| 218.102 677 2 | 180.103 3, 128.033 5, 88.047 0 | 3.40 | Pantothenic acid | C9H17NO5 | 能量代谢 Energy metabolism |
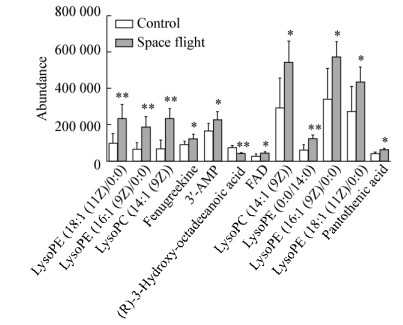
|
| 图 9 12种显著差异生物标志物 Figure 9 12 significant difference biomarkers Note: *: P < 0.05; **: P < 0.01. |
|
|
在本研究中,如图 9所示,搭载组大肠杆菌与地面对照组相比,共发现了11种潜在生物标志物代谢上调,1种生物标志物代谢下调,整体代谢水平呈上调趋势。在上调的11种生物标志物中,我们发现参与甘油磷脂代谢的5种溶血磷脂酰乙醇胺(Lyso PE)和2种溶血磷脂酰胆碱(Lyso PC)代谢上调,磷脂酰胆碱(Phosphatidyl cholines,PC)和磷脂酰乙醇胺(Phosphatidyl ethanolamine,PE)是构成生物细胞膜双分子层的重要磷脂分子[8],而Lyso PE和Lyso PC通常则是由PC和PE通过磷脂酶水解得到。Lyso PE和Lyso PC代谢上调表明搭载组大肠杆菌细胞膜磷脂代谢水平增加,潜在生物膜形成能力可能增加。我们课题组在模拟微重力条件下对大肠杆菌的研究中发现模拟微重力组生物膜形成能力增加[9]。
其次,在搭载组我们也发现4种与能量代谢相关的生物标志物含量上调,它们分别是3′-一磷酸腺苷(3′-AMP)、黄素腺嘌呤二核苷酸(Flavin adenine dinuclea tide,FAD)、葫芦巴肽脂(Fenugreekine)和泛酸(Pantothenic acid)。3′-AMP参与嘌呤代谢,可由ATP水解转化生成[10],FAD是三羧酸循环中的一种重要黄素辅基,参与能量代谢中的电子传递及氧化磷酸化过程[11],Fenugreekine属于嘌呤核苷酸糖类有机化合物,即它是由嘌呤核苷酸末端磷酸基团结合到糖类衍生物所生成,有研究表明它能促进能量代谢中葡萄糖转运和碳水化合物的吸收[12],泛酸(Pantothenic acid)是形成CoA的重要组成部分,而CoA参与糖、脂肪、蛋白质和能量代谢,是生物体能量提供的重要物质[13]。以上4种物质都与细菌的能量代谢密切相关。搭载组大肠杆菌3′-AMP、FAD、Fenugreekine和Pantothenic acid代谢水平提高高度说明搭载组大肠杆菌能量代谢旺盛,结合细胞膜形成相关甘油磷脂代谢水平提高,潜在提示搭载组大肠杆菌增殖能力可能增强。Zea等[14]在国际空间站针对大肠杆菌的研究中发现空间站搭载的大肠杆菌相对于地面对照组存活率有明显提高,而且这些大肠杆菌能够在通常条件下抑制其生长的庆大霉素硫酸盐中生长,细胞聚集能力增加,潜在生物膜形成能力增加,这些都证实了之前的推断。
最后,在鉴定的潜在生物标志物中,我们发现了一种标志物在搭载组代谢水平下调,就是(R)-3-Hydroxy-octadecanoic acid,其中文名是(R)-3-羟基-十八烷酸,它是脂肪酸生物合成的中间体,参与脂肪酸代谢[15]。搭载组大肠杆菌(R)-3-羟基-十八烷酸代谢下调提示脂肪酸合成相关通路代谢水平下调,相反提示能量代谢相关通路代谢水平可能上调,再结合之前有关能量代谢的相关生物标志物的推论,我们由此推测搭载组大肠杆菌能量代谢水平提高,潜在增殖水平可能提高。
当然,究竟是何种因素导致太空环境下大肠杆菌能量代谢和甘油磷脂相关标志物代谢水平提高目前还不十分清楚。然而也有研究指出在太空环境下大肠杆菌的增殖速率下降,生长变缓[16]。由于“实践十号”卫星的辐射剂量为0.26 mGy/d,属于辐射水平较大的太空飞行,而上述大肠杆菌实验是在“神舟十号”舱内进行,辐射水平低,这提示太空辐射可能是影响大肠杆菌增殖水平的重要因素之一。然而,究竟是否是辐射因素导致上述代谢水平变化还需后续一系列实验研究。相信随着对空间环境下致病微生物不断深入的研究,可为航天员未来在轨作业以及长时间太空驻留提供重要安全保障和理论基础。
| [1] |
Vila J, Sáez-López E, Johnson JR, et al. Escherichia coli: an old friend with new tidings[J]. FEMS Microbiology Reviews, 2016, 40(4): 437-463. DOI:10.1093/femsre/fuw005 |
| [2] |
Mellata M. Human and avian extraintestinal pathogenic Escherichia coli: infections, zoonotic risks, and antibiotic resistance trends[J]. Foodborne Pathogens and Disease, 2013, 10(11): 916-932. DOI:10.1089/fpd.2013.1533 |
| [3] |
Novikova N, de Boever P, Poddubko S, et al. Survey of environmental biocontamination on board the International Space Station[J]. Research in Microbiology, 2006, 157(1): 5-12. DOI:10.1016/j.resmic.2005.07.010 |
| [4] |
Kim W, Tengra FK, Young Z, et al. Spaceflight promotes biofilm formation by Pseudomonas aeruginosa[J]. PLoS One, 2013, 8(4): e62437. DOI:10.1371/journal.pone.0062437 |
| [5] |
Wilson JW, Ott CM, Quick L, et al. Media ion composition controls regulatory and virulence response of Salmonella in spaceflight[J]. PLoS One, 2008, 3(12): e3923. DOI:10.1371/journal.pone.0003923 |
| [6] |
Hammond TG, Stodieck L, Birdsall HH, et al. Effects of microgravity on the virulence of Listeria monocytogenes, Enterococcus faecalis, Candida albicans, and methicillin-resistant Staphylococcus aureus[J]. Astrobiology, 2013, 13(11): 1081-1090. DOI:10.1089/ast.2013.0986 |
| [7] |
Klassen A, Faccio AT, Canuto GAB, et al. Metabolomics: definitions and significance in systems biology[A]//Sussulini A. Metabolomics: From Fundamentals to Clinical Applications[M]. Cham: Springer, 2017
|
| [8] |
Sohlenkamp C, López-Lara IM, Geiger O. Biosynthesis of phosphatidylcholine in bacteria[J]. Progress in Lipid Research, 2003, 42(2): 115-162. DOI:10.1016/S0163-7827(02)00050-4 |
| [9] |
Rong D, Wang JP, Wang HL, et al. Effect of microgravity on Escherichia coli K12 phenotype and gene expression[J]. Microbiology China, 2017, 44(5): 1038-1046. (in Chinese) 容丹, 王佳平, 王海立, 等. 模拟失重对大肠杆菌K12基因表达及表型的影响[J]. 微生物学通报, 2017, 44(5): 1038-1046. |
| [10] |
Bushfield M, Shoshani I, Johnson RA. Tissue levels, source, and regulation of 3ʹ-AMP: an intracellular inhibitor of adenylyl cyclases[J]. Molecular Pharmacology, 1990, 38(6): 848-853. |
| [11] |
de-Los-Santos-Álvarez N, de-Los-Santos-Álvarez P, Lobo-Castañón MJ, et al. Flavin adenine dinucleotide as precursor for NADH electrocatalyst[J]. Analytical Chemistry, 2005, 77(13): 4286-4289. DOI:10.1021/ac048545p |
| [12] |
Bharti SK, Krishnan S, Kumar A, et al. Antidiabetic phytoconstituents and their mode of action on metabolic pathways[J]. Therapeutic Advances in Endocrinology and Metabolism, 2018, 9(3): 81-100. DOI:10.1177/2042018818755019 |
| [13] |
Yang YH, Xiao CL. The functions and biosynthesis of pantothenate[J]. Chemistry of Life, 2008, 28(4): 448-452. (in Chinese) 杨延辉, 肖春玲. 泛酸的功能和生物合成[J]. 生命的化学, 2008, 28(4): 448-452. DOI:10.3969/j.issn.1000-1336.2008.04.020 |
| [14] |
Zea L, Larsen M, Estante F, et al. Phenotypic changes exhibited by E. coli cultured in space[J]. Frontiers in Microbiology, 2017, 8: 1598. DOI:10.3389/fmicb.2017.01598 |
| [15] |
Suda Y, Kim YM, Ogawa T, et al. Chemical structure and biological activity of a lipid A component from Helicobacter pylori strain 206[J]. Journal of Endotoxin Research, 2001, 7(2): 95-104. DOI:10.1177/09680519010070020301 |
| [16] |
Zhang XL, Xie Q, Liu CT. Effects of space flight on biological characteristics of Escherichia coli[J]. Manned Spaceflight, 2015, 21(2): 200-204. (in Chinese) 张学林, 谢琼, 刘长庭. 太空飞行对大肠杆菌生物学性状影响的研究[J]. 载人航天, 2015, 21(2): 200-204. DOI:10.3969/j.issn.1674-5825.2015.02.017 |
 2019, Vol. 46
2019, Vol. 46