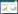扩展功能
文章信息
- 韩生义, 刘晓丽, 张国权, 陈金梅, 杨孝朴
- HAN Sheng-Yi, LIU Xiao-Li, ZHANG Guo-Quan, CHEN Jin-Mei, YANG Xiao-Pu
- 牦牛瘤胃中产脂肪酶微生物的分离与鉴定
- Isolation and identification of lipase produced by microbes in yak rumen
- 微生物学通报, 2019, 46(9): 2292-2301
- Microbiology China, 2019, 46(9): 2292-2301
- DOI: 10.13344/j.microbiol.china.180577
-
文章历史
- 收稿日期: 2018-07-23
- 接受日期: 2018-12-06
- 网络首发日期: 2019-05-31
2. 中牧实业股份有限公司兰州生物药厂 甘肃 兰州 730046;
3. 甘肃畜牧工程职业技术学院 甘肃 武威 733006
2. China Animal Husbandry Industry Co. Ltd., Lanzhou Bio-pharmaceutical Companies, Lanzhou, Gansu 730046, China;
3. Gansu Polytechnic College of Animal Husbandry & Engineering, Wuwei, Gansu 733006, China
脂肪酶(Lipase,EC 3.1.1.3)是一种与众不同的酯键水解酶,属于单纯蛋白酶类,该酶可以对三酯酰甘油进行水解催化[1]。脂肪酶有很多来源,脂类的水解、醇解、酯类交换与合成等反应都可以通过脂肪酶催化完成。脂肪酶主要用于药物合成、食品加工、生物传感器(酶传感器)、生物柴油制备等领域[2-3]。目前已知的可以产生脂肪酶的微生物大约有2%[4],其中放线菌4个属、酵母菌10个属、细菌28个属和其他真菌23个属的微生物均可以产生脂肪酶。来源于不同的微生物所产生的脂肪酶组成成分、理化特性各不相同[5]。20世纪中旬以来,越来越多的微生物被从瘤胃中分离和鉴定,普遍认为反刍动物的饲料富含纤维素,关于瘤胃纤维素降解菌的研究报道较多,但是研究产脂肪酶微生物或瘤胃脂类降解菌的极少。目前,国外发现仅有脂解厌氧弧菌是瘤胃内产脂肪酶的微生物[6],而国内暂无对瘤胃中产脂肪酶的微生物研究的相关报道。
我国脂肪酶的研究与开发开始于20世纪60年代,目前得到开发和研究的微生物主要有:解脂假丝酵母(Candida lipolytica)、阿氏假囊酵母(Eremothecium ashbyii)、假单胞菌(Pseudomonas)、地霉(Geotrichum sp.)和青霉(Penicillium)。其中仅有扩展青霉(Penicillium expansum)和解脂假丝酵母(Candida lipolytica)产生的脂肪酶运用到工业化生产中。国内脂肪酶制剂研发较晚,种类少[7]。分离筛选、研究和开发酶活性高、生产成本低和具有新特性的产脂肪酶微生物及其脂肪酶具有现实意义和充分的必要性。本文旨在筛选产脂肪酶新菌种,同时也为探索高原牦牛瘤胃微生物种群和消化特点提供参考依据。
1 材料与方法 1.1 材料 1.1.1 样品从天祝县牦牛屠宰场,采取新鲜的牦牛瘤胃内容物10份并密封保存,标记为TZ-1-10。
1.1.2 培养基培养基配置见参考文献[8]。
1.1.3 主要试剂和仪器橄榄油,上海索莱宝生物科技有限公司;Goldview Ⅰ型核酸染料、细菌基因组提取试剂盒,天根生化科技(北京)有限公司;HP Fungal DNA Kit,OMEGA公司。低温摇床,上海南荣实验室设备有限公司;凝胶成像分析仪,西盟生命技术有限公司。
1.2 方法 1.2.1 产脂肪酶菌株的分离筛选初步分离与筛选:将采集的样品取5.0 g置于灭菌烧杯中,加入蒸馏水50 mL,充分混匀,静置30 min,取上层清液1.0 mL,接种于100.0 mL的已配置好的富集培养基,37 ℃、200 r/min培养3 d。菌液梯度稀释,选取1.0 mL 10-4、10-5和10-6的稀释菌液,涂布于中性红油脂平板培养基,37 ℃培养2 d,选取出现红色变色圈的菌落,作为初步分离筛选的菌株[9]。
复筛:获得的目的菌株接种发酵培养基,32 ℃、180 r/min培养3-5 d,发酵液中脂肪酶酶活力的测定选择改进铜皂-分光光度法[10],以酶活力较高的菌株为目的菌株。实验步骤:(1)在反应组和对照组试管中分别加入橄榄油-聚乙烯醇乳化液2.0 mL和pH 7.0、浓度为0.05 mol/L磷酸盐缓冲液2.5 mL,置入40 ℃水浴锅中预热10 min。(2)吸取培养3 d的发酵液3.0 mL,5 000 r/min离心2 min (用高速组织匀浆机将培养液中的菌块破碎),再离心取上清为粗酶液。(3)将0.5 mL粗酶液加入反应组试管中,振荡均匀,40 ℃反应15 min后迅速加入12 mol/L的浓盐酸1.0 mL和95%的乙醇6.0 mL,摇匀,反应被终止。对照组为:取1.0 mL 12 mol/L的浓盐酸和6.0 mL 95%的乙醇于0.5 mL预热好的粗酶液中,摇匀后置于准备好的底物-缓冲液混合液中,振荡15 s后40 ℃水浴锅中反应15 min。后续实验步骤两组相同。(4)加入3.0 mL异辛烷,涡旋振荡混匀90 s,置入60 ℃水浴锅2 h,再冷水浴10 min。(5)取一个新的试管,加入上清液1.0 mL,随后加入乙酸铜显色剂1.0 mL和异辛烷4.0 mL,涡旋混匀90 s,静置2 min。(6)比色皿中加入上层澄清有机溶液2 mL,放入分光光度计中,测定吸光值(714 nm),按下式计算其酶活力:

|
形态学以及生化鉴定:在LB固体培养基上接种细菌菌株,置37 ℃恒温培养2 d,纯化培养3次,对其菌落形态进行观察记录,革兰氏染色后镜下观察,遵照《常见细菌系统鉴定手册》[11]和《伯杰细菌鉴定手册》[12]进行生理生化实验。在PDA培养基上接种真菌菌株,37 ℃培养1-2 d,观察其菌落形态后取菌丝进行棉兰染液染色,对孢子进行孢子染色后镜检,再结合《真菌鉴定手册》[13]中的描述,初步鉴定其目的真菌的种属。
菌株的分子鉴定:用细菌基因组提取试剂盒提取基因组,采用16S rRNA基因通用引物进行扩增。PCR反应条件:95 ℃ 5 min;94 ℃ 45 s,58 ℃ 45 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。PCR反应体系:基因组DNA 2.0 μL,27F、1492R引物(10 μmol/L)各1.0 μL,Taq DNA聚合酶12.5 μL,ddH2O 8.5 μL。真菌采用HP Fungal DNA Kit提取基因组DNA,并作为模板;用ITS序列通用引物ITS4 (5′-TCCTCC GCTTATTGATATGC-3′)和ITS1 (5′-TCCGTAGGTG AACCTGCGG-3′)进行PCR扩增,PCR反应条件:95 ℃ 5 min;94 ℃ 45 s,60 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min;或使用18S rRNA基因保守序列的通用引物Fung (5′-ATTCCCCGTTACCCG TTG-3′)和NS1F (5′-GTAGTCATATGCTTGTCTC-3′)进行PCR扩增,PCR反应条件:95 ℃ 5 min;94 ℃ 45 s,60 ℃ 45 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。PCR产物直接测序(苏州金唯智生物科技有限公司),测序结果在NCBI上进行比对,选取并下载Identity≥99%的序列,用MEGA 7.0中的ClustalW进行多序列比对并构建系统发育树。
1.2.3 脂肪酶酶学性质的研究测定酶促反应的最适温度:设立65、60、55、50、45、40、35、30、25、20 ℃等10个不同的温度,测定待测酶液的相对酶活力,确定酶促反应最适作用温度。
测定酶促反应的最适pH值:设立11.0、10.0、9.0、8.0、7.0、6.0、5.0、4.0、3.0、2.0等10个pH值,测定待测酶液的相对酶活力,确定酶促反应最适pH值。
脂肪酶酶活与有机溶剂、表面活性剂和金属离子的关系:将各种盐溶液(Ca2+、Mg2+、Na+、K+、Fe2+、Zn2+)加入待测粗酶液中,再加入终浓度为2 mmol/L的EDTA,在最适pH和温度的反应条件下测定脂肪酶的活力;将不同的有机溶剂(丙三醇、乙醇、甲醇和丙酮)分别加入到反应组的待测粗酶液中,直至有机溶剂体积分数占总体积的5%,在最适pH和温度的反应条件下测定脂肪酶的活力;分别加入各种的表面活性剂(吐温20、吐温80和SDS)至待测粗酶液中,直至表面活性剂体积分数占总体积的1%,在最适pH值和温度下,测定其酶活值。
2 结果与分析 2.1 产脂肪酶菌株的分离筛选中性红油脂平板显色反应进行初步分离筛选,共获得6株有透明圈或变色圈的菌株(图 1),分别命名为TZ-2、TZ-4、TZ-6、TZ-7、TZ-8和TZ-9。发酵培养3 d后在40 ℃、pH 7.0条件下测定酶活,酶活分别为3.30、2.96、4.82、5.48、3.12和4.40 U/mL。
|
| 图 1 6株目的菌株在中性红油脂平板上的变色圈 Figure 1 The color-changing circle of 6 strains on the red-oil medium Note: A, B, E: Serratia liquefaciens; C, F: Geotrichum candidum; D: Mutor circinelloides. |
|
|
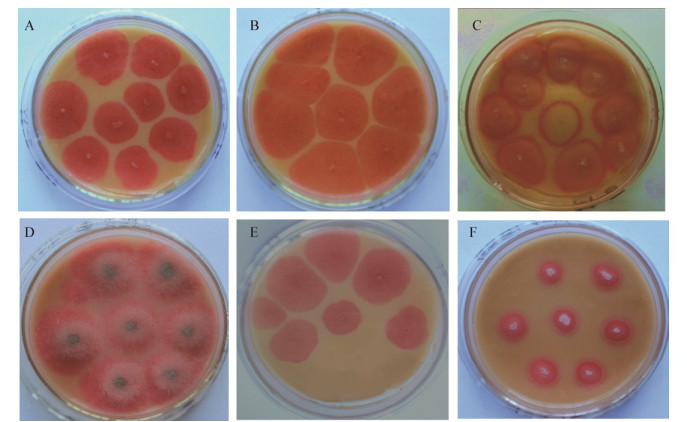
菌株TZ-2、TZ-4、TZ-8都是小菌落,不透明,菌落表面光滑,中间略为突起,淡黄色。镜下观察发现3者均为阴性短小的杆菌(图 2),两端钝圆,无芽孢,长约0.9 μm-2.0 μm,直径0.5 μm-1.0 μm,染色均匀。
|
| 图 2 菌株TZ-2 (A)、TZ-4 (B)和TZ-8 (C)的显微形态(1 000×) Figure 2 The morphology magnification of strain TZ-2 (A), TZ-4 (B) and TZ-8 (C) (1 000×) Note: A–C: Serratia liquefaciens. |
|
|
在PDA平板上,菌株TZ-7在平板培养基上生长快,菌落初为苍白色,菌丝为蓬松绒毛状;后菌落为黑褐色,菌丝密集并附着褐色孢子囊(图 3A);菌丝附着的孢子成熟后,整个菌落由白色变为褐色。低倍镜下观察,发现该菌菌丝长直发达,孢子梗不分枝,且直立,菌丝没有横隔,球形的顶生孢子囊,且内部含有许多褐色孢子(图 3B);在高倍镜下观察发现该菌孢子为卵圆形或圆柱形,长为4 μm-6 μm,宽为2 μm-3 μm (图 3C),根据形态学观察推测该菌是毛霉科的成员。

|
| 图 3 菌株TZ-7的形态学观察 Figure 3 Morphology of strain of TZ-7 注:A:菌株TZ-7的形态观察;B:菌株TZ-7显微观察(100×);C:菌株TZ-7孢子显微形态(1 000×). Note: A: The morphologic observation of strain TZ-7; B: The microscopic observation of strain TZ-7 (100×); C: Strain TZ-7 spore morphology magnification (1 000×). |
|
|
在PDA平板上,菌株TZ-6、TZ-9的菌落呈乳白色,平面扩散,生长快,中心凸起,短绒毛状(图 4A、4D);在显微镜下观察,发现两菌株的节孢子多为单个或多个成链存在(图 4B、4E);孢子体积比较大,多为圆柱形或长方形,两端钝圆或平直,宽约2 μm-4 μm,长约5 μm-8 μm (图 4C、4F),孢子梗短而直,初步推测两种菌为地霉属成员。

|
| 图 4 菌株TZ-6和TZ-9的形态学观察 Figure 4 Morphology of strain of TZ-6 and TZ-9 注:A、D:菌株TZ-6和TZ-9的形态观察;B、E:菌株TZ-6和TZ-9在100×倍镜下显微观察;C、F:菌株TZ-6和TZ-9在1 000×倍镜下的孢子形态. Note: A, D: The morphologic observation of strain TZ-6 and TZ-9; B, E: The microscopic observation of strain TZ-6 and TZ-9 (100×); C, F: The spore morphology of strain TZ-6 and TZ-9 (1 000×). |
|
|
七种糖类均可被菌株TZ-4、TZ-2和TZ-8发酵,部分产气,柠檬酸盐、硝酸盐、触酶、明胶液化、氧化酶和V-P实验呈阳性;脲酶和甲基红实验呈阴性,结合形态学观察初步断定出3株菌均为肠杆菌科成员。生理生化试验结果见表 1。
| 试验项目 Test items | TZ-2 | TZ-4 | TZ-8 |
| 葡萄糖发酵 Glucose fermentation | ⊕ | ⊕ | ⊕ |
| 乳糖发酵 Lactose fermentation | ⊕ | ⊕ | ⊕ |
| 半乳糖发酵 Galactose fermentation | ⊕ | ⊕ | ⊕ |
| 蔗糖发酵 Sugar fermentation | ⊕ | ⊕ | ⊕ |
| 麦芽糖发酵 Maltose fermentation | ⊕ | ⊕ | ⊕ |
| 阿拉伯糖发酵 Arabinose fermentation | + | + | + |
| 纤维二糖发酵 Cellose fermentation | + | + | + |
| 硝酸盐实验 Nitrate test | + | + | + |
| 柠檬酸盐实验 Citrate test | + | + | + |
| 吲哚实验 Indole test | - | - | - |
| MR实验 MR test | - | - | - |
| V-P实验 V-P test | + | + | + |
| 触酶实验 Catalase test | + | + | + |
| 氧化酶实验 Oxidase test | + | + | + |
| 脲酶实验 Urease test | - | - | - |
| 明胶液化实验 Gelaune liquefaction test | + | + | + |
| 注:⊕:阳性并产气;+:阳性;–:阴性. Note: ⊕: Positive and produce gas; +: Positive; –: Negative. | |||
菌株TZ-8、TZ-4和TZ-2的16S rRNA基因扩增片段的电泳结果表明,3个菌株扩增片段大小很相近,约1 400 bp。测序结果显示,3个菌株扩增片段的大小分别为1 401 bp (KU886192)、1 392 bp (KU899091)和1 408 bp (KU899092)。BLAST比对结果表明与3个序列相似性最高的都是液化沙雷氏菌的16S rRNA基因序列。系统进化树显示,菌株TZ-2、TZ-4和TZ-8与液化沙雷氏菌16S rRNA基因序列位于同一进化树分支上,有共同的进化起源。再结合之前的实验结果证实菌株TZ-2、TZ-4和TZ-8均为液化沙雷氏菌(Serratia liquefaciens)。
菌株TZ-7 ITS扩增片段电泳结果表明,长度为600 bp左右。测序结果(KU899095)经BLAST比对表明,该序列与卷枝毛霉(Mucor circinelloides)的ITS序列相似性最高。系统进化树显示,该菌与卷枝毛霉(OTU31)均有共同的进化起源,再结合之前的实验结果确定该菌为卷枝毛霉(Mucor circinelloides)。
菌株TZ-9和TZ-6的18S rRNA扩增产物大小为1 700 bp左右。测序结果表明两序列长度分别为1 658 bp (KU899093)和1 686 bp (KU899094)。BLAST比对结果表明,二者都和白地霉(Geotrichum candidum)的18S rRNA基因序列相似性最高。系统进化树显示,菌株TZ-6和TZ-9与白地霉位于同一进化分支上,具有共同的进化起源,再结合形态学结果证实菌株TZ-9和TZ-6为白地霉(Geotrichum candidum)。
2.3 酶学性质研究 2.3.1 脂肪酶酶促反应的最适作用温度在不同反应温度下,测定3种脂肪酶酶促反应的酶活值,发现在30-50 ℃范围内液化沙雷氏菌脂肪酶活性较高,最适作用温度为45 ℃;卷枝毛霉脂肪酶在25-55 ℃范围内活性较高,最适作用温度为40 ℃;白地霉脂肪酶在25-40 ℃范围内酶活值高,最适的酶促反应温度为35 ℃ (图 5)。

|
| 图 5 作用温度对酶活值的影响 Figure 5 The relationship between reaction temperature with lipase activity |
|
|
在不同pH值条件下,测定3种脂肪酶酶促反应的酶活值,发现液化沙雷氏菌脂肪酶在pH值7.0-9.0范围内酶活性较高,最适pH值为8.0;卷枝毛霉脂肪酶和白地霉脂肪酶在pH值6.0-8.0范围内酶活性较高,最适pH值为7.0 (图 6)。

|
| 图 6 pH值对酶活性的影响 Figure 6 The effect of reaction pH on the enzyme activity |
|
|
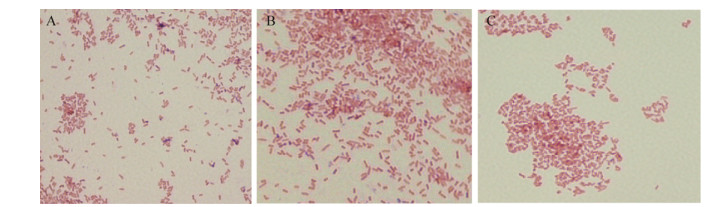
结果表明(图 7),Mg2+、Ca2+对3种酶的酶活力都有较为明显的激活作用;对于液化沙雷氏菌脂肪酶和白地霉脂肪酶,Ca2+的激活作用要强于Mg2+;对于卷枝毛霉脂肪酶,Mg2+的激活作用要强于Ca2+;Na+、K+对3种酶的酶活力刺激作用都比较弱;Fe2+对液化沙雷氏菌脂肪酶和卷枝毛霉脂肪酶有抑制作用,但对白地霉有明显的激活作用;Zn2+对3种酶的酶活力有不同程度的抑制作用;加入SDS和EDTA后3种脂肪酶均失活;白地霉脂肪酶和液化沙雷氏菌脂肪酶对丙酮、乙醇和甲醇有较低的耐受性,丙三醇对二者酶活值的影响较小,卷枝毛霉则对4种有机溶剂的耐受力都比较高。
|
| 图 7 金属离子、有机溶剂以及表面活性剂与脂肪酶酶活值的关系 Figure 7 The relationship between metal ions, organic solvents and surfactants with lipase activity |
|
|
国外首次发现微生物脂肪酶是在20世纪初,越来越多的产脂肪酶的微生物被分离报道,产脂肪酶的微生物约65个属[14],占2%。到目前,研究者发现的可以产生脂肪酶的微生物绝大部分是从油污水和土壤中分离的,对上述微生物及其脂肪酶均有广泛的研究报道。但是,近年来一些产脂肪酶的微生物被从海水[15]、冰川[16]、盐湖[17]和温泉[18-19]等自然环境以及松毛虫[20]、家蚕[21]、鱼[22]等动物消化道中分离出来,这些研究报道表明,自然界中广泛存在着的微生物可以产生脂肪酶,除了含油脂的环境中存在以外,还存在于其他的环境中,而且从上述环境中分离出来的产脂肪酶的微生物大多是第一次发现的或者具有新的特性,比如对有机溶剂[23]、高温[24]和低温[25]有很强的耐性等。20世纪中期以来,瘤胃中分离和鉴定出的微生物日渐增多,到目前已获得产脂肪酶古细菌和细菌菌株分别为68个和882个,仅11%的微生物可被分离培养[26]。瘤胃中各种各样的微生物参与日粮营养物质的降解过程,普遍认为反刍动物的饲料富含纤维素,瘤胃微生物的开发利用着重于纤维素分解菌,而可以分解利用脂肪的微生物的研究和开发近乎空白。仅报道发现瘤胃中定殖的脂解厌氧弧菌[6]可以分解利用脂类。笔者获得的6株菌来源于牦牛瘤胃,其中1株为卷枝毛霉,2株为白地霉,3株为液化沙雷氏菌,都是产脂肪酶的微生物,具有高酶活的特性,表明瘤胃产脂肪酶微生物具有较好的研究和开发前景,同时也为反刍动物瘤胃微生物的研发与生产运用提供了新方法和各项资料和数据。
3.2 菌种鉴定已发现的沙雷氏菌属内的产脂肪酶菌种成员主要为粘质沙雷氏菌[27],多年来,液化沙雷氏菌主要被当作消化道和呼吸道的条件致病性进行研究[28-29],而被作为产脂肪酶菌株来研究的报道很少,目前,我国从富油脂土壤环境中分离获得的产脂肪酶的液化沙雷氏菌只有一篇文献[30]。同时,常见的产脂肪酶真菌(如毛霉和白地霉等)也是从富含油脂的自然环境中被分离[31-32]。上述3种微生物是在牦牛瘤胃中被分离出来的产脂肪酶的菌种,在国内是第一次。到目前毛霉属的雅致放射毛霉[33]和米黑根毛霉[34]是主要的产脂肪酶菌种,本试验发现毛霉属的卷枝毛霉也可以产生脂肪酶,这也在我国是第一次分离报道。
3.3 酶学性质的研究谭珍连等[35]测得白地霉酶活为8.7 U/mL,较TZ-6和TZ-9高。刘思佳等[36]从传统发酵豆酱中分离出一株卷枝毛霉,其酶活值为4.130 U/mL,较TZ-7低。目前已有液化沙雷氏菌产过氧化氢酶的报道[37],仅有一篇报道[6]表明其可产脂肪酶,但无其具体的酶活数据,本实验从瘤胃中分离筛选出一株产脂肪酶的液化沙雷氏菌,测定其酶活值,并进行了酶学性质的研究。本实验所筛选的3种菌所产的脂肪酶最适温度和最适pH值虽然都不相同,但是在40 ℃左右,pH 7.0-8.0的范围内均表现出较高的酶活性,这与瘤胃内的温度和pH值[38]很接近。经实验验证白地霉脂肪酶的酶学性质符合相关文献报道[39],在较低的作用温度和中性的pH环境中表现出较高的酶活性;作为典型的细菌脂肪酶,液化沙雷氏菌脂肪酶具有较高的作用温度,且在弱碱环境下表现出较高的酶活;而卷枝毛霉脂肪酶的酶学性质研究国内暂无相关报道,实验发现该菌所产脂肪酶在高温下仍能保持较高的酶活,且对有机溶剂的耐受性较高。本次从牦牛瘤胃中筛选出的3种微生物所产的脂肪酶均表现出不同特色的酶学性质,有望在不同的工业领域发挥相应作用,尤其是卷枝毛霉脂肪酶,具有较高的酶活性和耐高温耐有机溶剂特性,在未来具有很大的开发潜力。
| [1] |
Wang ZS, Zhang J, Ma JY, et al. Reseach and application progress on lipases[J]. Journal of Anhui Agricultural Sciences, 2011, 39(7): 3798-3800, 3855. (in Chinese) 王自社, 张继, 马君义, 等. 脂肪酶的研究及应用进展[J]. 安徽农业科学, 2011, 39(7): 3798-3800, 3855. DOI:10.3969/j.issn.0517-6611.2011.07.007 |
| [2] |
Qian Z, Lutz S. Improving the catalytic activity of Candida antarctica lipase B by circular permutation[J]. Journal of the American Chemical Society, 2005, 127(39): 13466-13467. DOI:10.1021/ja053932h |
| [3] |
Contesini FJ, Lopes DB, Macedo GA, et al. Aspergillus sp. lipase: potential biocatalyst for industrial use[J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 67(3/4): 163-171. |
| [4] |
Hasan F, Shah AA, Hameed A. Industrial applications of microbial lipases[J]. Enzyme and Microbial Technology, 2006, 39(2): 235-251. DOI:10.1016/j.enzmictec.2005.10.016 |
| [5] |
Wang XF, Wang J, Yang JK, et al. Recent progress on the production of lipase by microbial fermentation[J]. Biotechnology Bulletin, 2008(4): 47-53. (in Chinese) 汪小锋, 王俊, 杨江科, 等. 微生物发酵生产脂肪酶的研究进展[J]. 生物技术通报, 2008(4): 47-53. |
| [6] |
Edwards JE, McEwan NR, Travis AJ, et al. 16S rDNA library-based analysis of ruminal bacterial diversity[J]. Antonie van Leeuwenhoek, 2004, 86(3): 263-281. DOI:10.1023/B:ANTO.0000047942.69033.24 |
| [7] |
Li XC. The research progress of lipase[J]. Meat Industry, 2003(4): 45-48. (in Chinese) 李香春. 脂肪酶的研究进展[J]. 肉类工业, 2003(4): 45-48. DOI:10.3969/j.issn.1008-5467.2003.04.023 |
| [8] |
Han SY. Screening of lipase producing microorganism and cloning and expression of lipase gene[D]. Lanzhou: Master's Thesis of Gansu Agricultural University, 2016 (in Chinese) 韩生义.产脂肪酶微生物的筛选及脂肪酶基因的克隆表达[D].兰州: 甘肃农业大学硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10733-1016902661.htm |
| [9] |
Han SY, Zhao SQ, Liu XL, et al. Screening, identification and enzymatic properties of an alkaline lipase producing strain[J]. Journal of Gansu Agricultural University, 2017, 52(1): 119-125. (in Chinese) 韩生义, 赵淑琴, 刘晓丽, 等. 一株碱性脂肪酶产生菌的筛选、鉴定及酶学性质研究[J]. 甘肃农业大学学报, 2017, 52(1): 119-125. |
| [10] |
Hou AJ, Xu BB, Liang L, et al. A modified colorimetric assay of lipase activity using emulsified olive oil as the substrate[J]. Leather Science and Engineering, 2011, 21(1): 22-27. (in Chinese) 侯爱军, 徐冰斌, 梁亮, 等. 改进铜皂-分光光度法测定脂肪酶活力[J]. 皮革科学与工程, 2011, 21(1): 22-27. DOI:10.3969/j.issn.1004-7964.2011.01.005 |
| [11] |
Dong XZ, Cai MY. Common Bacteria Identification System Manual[M]. Beijing: Science Press, 2001. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [12] |
Buchanan RE, Gibbons NE. Bergey's Manual of Determinative Bacteriology[M]. Berger Bacterial Identification Manual, Institute of Microbiology, Chinese Academy of Sciences, trans. 8th ed. Beijing: Science Press, 1984 (in Chinese) 布坎南RE, 吉本斯NE.伯杰细菌鉴定手册[M].中国科学院微生物研究所《伯杰细菌鉴定手册》, 译. 8版.北京: 科学出版社, 1984 |
| [13] |
Wei JC. Fungal Identification Manual[M]. Shanghai: Shanghai Science and Technology Publishing House, 1979. (in Chinese) 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979. |
| [14] |
Zhi Q, Wang B, Xue YC. Research progress of microbial lipase[J]. Journal of Anhui Agricultural Sciences, 2013, 41(4): 1453-1455. (in Chinese) 智倩, 王彪, 薛永常. 微生物脂肪酶的研究进展[J]. 安徽农业科学, 2013, 41(4): 1453-1455. DOI:10.3969/j.issn.0517-6611.2013.04.016 |
| [15] |
Yumoto I, Hirota K, Sogabe Y, et al. Psychrobacter okhotskensis sp. nov., a lipase-producing facultative psychrophile isolated from the coast of the Okhotsk Sea[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(6): 1985-1989. DOI:10.1099/ijs.0.02686-0 |
| [16] |
Zhang YH. Diversity of cold-related lipases in glacier soil and cloning of some lipase genes[D]. Beijing: Doctoral Dissertation of Chinese Academy of Agricultural Sciences, 2008 (in Chinese) 张宇宏.冰川土壤低温脂肪酶基因多样性研究及其基因克隆[D].北京: 中国农业科学院博士学位论文, 2008 http://d.wanfangdata.com.cn/Thesis/Y1422501 |
| [17] |
Vargas VA, Delgado OD, Hatti-kaul R, et al. Lipase-producing microorganisms from a Kenyan alkaline soda lake[J]. Biotechnology Letters, 2004, 26(2): 81-86. DOI:10.1023/B:BILE.0000012898.50608.12 |
| [18] |
Akanbi TO, kamaruzaman AL, Abu Bakar F, et al. Highly thermostable extracellular lipase-producing Bacillus strain isolated from a Malaysian hotspring and identified using 16S rRNA gene sequencing[J]. International Food Research Journal, 2010, 17(1): 45-53. |
| [19] |
Tayyab M, Rashid N, Akhtar M. Isolation and identification of lipase producing thermophilic Geobacillus sp. SBS-4S: cloning and characterization of the lipase[J]. Journal of Bioscience and Bioengineering, 2011, 111(3): 272-278. DOI:10.1016/j.jbiosc.2010.11.015 |
| [20] |
Sun YH, Zhou KY, Xiong Z. Screening and identification of lipase-producing bacteria from intestinal canal of Dendrolimus kikuchii and preliminary studies on its enzyme properties[J]. Journal of microbiology, 2012, 32(2): 64-67. (in Chinese) 孙佑赫, 周开艳, 熊智. 思茅松毛虫肠道产脂肪酶菌株的筛选鉴定及酶学性质初步研究[J]. 微生物学杂志, 2012, 32(2): 64-67. DOI:10.3969/j.issn.1005-7021.2012.02.012 |
| [21] |
Feng W. Different comparison and characterization of lipase-producing bacteria in the silkworm intestinal microflora[D]. Chongqing: Master's Thesis of Southwest University, 2011 (in Chinese) 冯伟.家蚕肠道微生态产脂肪酶细菌的分离鉴定与差异性比较[D].重庆: 西南大学硕士学位论文, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10635-1011112293.htm |
| [22] |
Zhang JR. Isolation and verification of strains producing cold-active enzymes from the intestinal tracts of cold-water fish and study on enzymatic properties[D]. Shihezi: Master's Thesis of Shihezi University, 2013 (in Chinese) 张建荣.冷水鱼肠道产低温酶菌株的分离鉴定及其酶学性质的研究[D].石河子: 石河子大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10759-1013366317.htm |
| [23] |
Zhang ZH, Wang C, Dou YC, et al. Screening of organic solvent tolerance lipase-producing strains and tolerance property of the lipase[J]. China Brewing, 2016, 35(1): 19-23. (in Chinese) 张梓涵, 王晨, 窦迎春, 等. 耐有机溶剂脂肪酶菌株的筛选及其耐受特性初探[J]. 中国酿造, 2016, 35(1): 19-23. |
| [24] |
Zhou ZM, Lin J, Lin XJ, et al. Screening and identification of lipase-producing marine microorganisms and study of enzymatic properties[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(11): 62-70. (in Chinese) 周智敏, 林娟, 林仙菊, 等. 产脂肪酶海洋微生物的筛选、鉴定及酶学性质研究[J]. 中国食品学报, 2015, 15(11): 62-70. |
| [25] |
Liang QY. Study on the screening, optimization of its fermentation conditions and enzymatic properties of a cold-adapted lipase-producing strain[D]. Shihezi: Master's Thesis of Shihezi University, 2014 (in Chinese) 梁秋艳.低温脂肪酶产生菌株的筛选、发酵条件优化及其酶学性质研究[D].石河子: 石河子大学硕士学位论文, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10759-1015511114.htm |
| [26] |
Kim M, Morrison M, Yu Z. Status of the phylogenetic diversity census of ruminal microbiomes[J]. FEMS Microbiology Ecology, 2011, 76(1): 49-63. DOI:10.1111/j.1574-6941.2010.01029.x |
| [27] |
Zhang KP. Screening of thermostable acid lipase strain and its lipase characterizations[D]. Zhengzhou: Master's Thesis of Henan University of Technology, 2013 (in Chinese) 张开平.耐高温酸性脂肪酶产生菌的选育及其酶学特性研究[D].郑州: 河南工业大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10463-1014117404.htm |
| [28] |
Yu QH. Serratia liquefaciens infection characteristics and the commonly used antimicrobial drug resistance analysis[J]. Journal of Medical Theory and Practice, 2009, 22(5): 613-614. (in Chinese) 于清华. 沙雷氏菌医院感染特点及对常用抗菌药物的耐药性分析[J]. 医学理论与实践, 2009, 22(5): 613-614. DOI:10.3969/j.issn.1001-7585.2009.05.089 |
| [29] |
Peng XY, Yao B, Li XB. Gram-negative bacteria distribution and drug resistance in our hospital from 2009 to 2011[J]. Northwest Pharmaceutical Journal, 2013, 28(2): 201-203. (in Chinese) 彭晓燕, 姚冰, 李晓波. 2009-2011年医院革兰氏阴性菌分布及耐药性分析[J]. 西北药学杂志, 2013, 28(2): 201-203. DOI:10.3969/j.issn.1004-2407.2013.02.032 |
| [30] |
Zou WX, Liu H, Yu WH. Isolation of lipase producing Serratia liquefaciens and characterization of its lipase[J]. Journal of Nanjing University (Natural Sciences), 1996, 32(4): 713-716. (in Chinese) 邹文欣, 刘慧, 郁文焕. 脂肪酶产生菌Serratia liquefaciens的分离及其酶性质的研究[J]. 南京大学学报(自然科学版), 1996, 32(4): 713-716. |
| [31] |
Wang JZ, Yuan JG, Yang D, et al. Screening of lipase producing strains and its breeding by UV-photoreactivation mutagenesis[J]. Food and Drug, 2011, 13(5): 192-195. (in Chinese) 王金主, 袁建国, 杨丹, 等. 产脂肪酶菌株的筛选及紫外-光复活诱变[J]. 食品与药品, 2011, 13(5): 192-195. |
| [32] |
Guo RR. Screening of high-yield lipase strains and discovery of enzymology character[D]. Chongqing: Master's Thesis of Southwest University, 2010 (in Chinese) 郭冉冉.高产脂肪酶菌株的筛选及酶学性质的研究[D].重庆: 西南大学硕士学位论文, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10635-2010094240.htm |
| [33] |
Li B, Li XH, Yi JR. Determination on lipase enzymatic characteristics and activity of Actinomucor elegans by pNP method[J]. Science and Technology of Food Industry, 2011, 32(11): 220-222, 263. (in Chinese) 李蓓, 李晓晖, 衣杰荣. 对硝基苯酚法对雅致放射毛霉脂肪酶特性的研究[J]. 食品工业科技, 2011, 32(11): 220-222, 263. |
| [34] |
Jiang FC, Lin Y, Ye YR. Surface display of Rhizomucor miehei lipase in Pichia pastoris using Sed1p as an anchor protein and its application[J]. Microbiology China, 2010, 37(10): 1506-1511. (in Chinese) 江逢春, 林影, 叶燕锐. 利用Sed1p锚定蛋白在毕赤酵母表面展示米黑根毛霉脂肪酶及其应用[J]. 微生物学通报, 2010, 37(10): 1506-1511. |
| [35] |
Tan ZL, Liang JJ, Pang ZW, et al. Breeding of higher lipase activity mutants by protoplast mutagenesis of ultraviolet irradiation[J]. Biotechnology, 2007, 17(2): 42-44. (in Chinese) 谭珍连, 梁静娟, 庞宗文, 等. 原生质体紫外诱变选育白地霉GXU08脂肪酶高产菌株[J]. 生物技术, 2007, 17(2): 42-44. DOI:10.3969/j.issn.1004-311X.2007.02.015 |
| [36] |
Liu SJ, Sun XD, Lu MM, et al. Screening of lipase-producing strains from traditional fermented soybean paste[J]. China Brewing, 2015, 34(12): 34-37. (in Chinese) 刘思佳, 孙晓东, 卢萌萌, 等. 传统发酵豆酱中产脂肪酶菌株的筛选[J]. 中国酿造, 2015, 34(12): 34-37. DOI:10.11882/j.issn.0254-5071.2015.12.008 |
| [37] |
Ao J, Chi NY, Dou SH, et al. Screening and identification of psychrotrophilic catalase strains and its enzymatic characterization[J]. China Condiment, 2013, 38(3): 31-35. (in Chinese) 奥杰, 迟乃玉, 窦少华, 等. 海洋低温过氧化氢酶菌株的筛选及酶学性的研究[J]. 中国调味品, 2013, 38(3): 31-35. DOI:10.3969/j.issn.1000-9973.2013.03.008 |
| [38] |
Zhang CY, Hu GL, Cao HB. Characteristics and control measures of the rumen environment[J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(4): 18-20. (in Chinese) 张彩英, 胡国良, 曹华斌. 反刍动物瘤胃内环境的特点及调控措施[J]. 动物营养与饲料科学, 2010, 37(4): 18-20. |
| [39] |
Wang JH. Studies on low-temperature lipase of Cryytococcus neoformans[D]. Urumchi: Master's Thesis of Xinjiang University, 2007 (in Chinese) 王俊华.白地霉低温脂肪酶的研究[D].乌鲁木齐: 新疆大学硕士学位论文, 2007 http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_Y1098995 |
 2019, Vol. 46
2019, Vol. 46