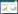扩展功能
文章信息
- 陆春波, 毛银, 李国辉, 赵运英, 邓禹
- LU Chun-Bo, MAO Yin, LI Guo-Hui, ZHAO Yun-Ying, DENG Yu
- 植物乳杆菌DY6主要抑菌代谢物的分析和鉴定
- Analysis and identification of main antibacterial metabolites secreted by Lactobacillus plantarum DY6
- 微生物学通报, 2019, 46(9): 2258-2271
- Microbiology China, 2019, 46(9): 2258-2271
- DOI: 10.13344/j.microbiol.china.180720
-
文章历史
- 收稿日期: 2018-09-13
- 接受日期: 2019-01-14
- 网络首发日期: 2019-02-28
2. 江南大学生物工程学院 江苏 无锡 214122
2. School of Biotechnology, Jiangnan University, Wuxi, Jiangsu 214122, China
食品的安全问题与人们的日常生活和身体健康息息相关,特别是近几年来食源性疾病严重威胁食品的品质和安全。常见的致病因素包括细菌性、病毒性和化学性等,常见的致病菌有沙门氏菌、志贺氏菌、致病性大肠杆菌、布氏杆菌等[1]。人工化学杀菌剂已被广泛应用于预防和杀灭致病菌,但其大量的使用会造成许多副作用,例如容易造成耐药菌株的出现,另外对人体健康也有影响。因此,开发新的、更安全的杀菌剂刻不容缓,通过微生物自身的发酵来生产天然防腐产品是一个合适选择,而对宿主健康有好处的乳酸菌是极具开发潜力的菌株[2],乳酸菌可以产生多种抗菌物质诸如有机酸[3]、脂肪酸[4]、有抑菌作用的蛋白质[5]或多肽类物质等[6-7],已逐渐成为关注热点。
乳酸菌发酵过程中可以产生诸如乳酸、乙酸等有机酸,显著地降低了生长环境pH[8],不利于沙门氏菌、布氏杆菌等有害菌的生长,从而具有抑菌作用。许多研究人员认为乳酸菌发酵产物之所以能够抑菌是由于发酵液中多种有机酸协同作用导致,马欢欢等[9]通过实验发现植物乳杆菌产生的乙酸和乳酸共同对黑曲霉起抑菌作用;Corsetti等[10]研究发现乳酸菌发酵产生的乙酸、甲酸、丙酸、丁酸等共同对霉菌起抑菌作用;Wang等[11]通过半制备分离得到了植物乳杆菌的主要抑菌物质为苯乳酸,它能够较好地抑制多种引起食物腐败的有害菌。许多研究发现脂肪酸也具有良好的抑菌作用[12],Guo等[13]从乳酸菌分离到3-羟基癸酸、癸酸都对真菌有很好的抑制作用,张希等[14]发现中链饱和脂肪酸对Escherichia coli O157和Candida albicans都有极强的抑菌效果。
本文选择了一株抑菌效果优异的植物乳杆菌为研究对象,对其产生的抑菌物质展开分析,采用GC-MS和代谢组学的方法对乳酸菌发酵上清液进行代谢物组分析,寻找抗菌差异标志物,对其主要抑菌物质进行分析,并结合半制备液相对发酵上清液进行初步分离,得到抑菌部分并进行分析,为开发天然防腐剂提供理论依据。
1 材料 1.1 菌株植物乳杆菌DY1、副干酪乳杆菌DY2 (CCTCC2017303)、鼠李糖乳杆菌DY3、鼠李糖乳杆菌DY4 (CCTCC2017279)、乳酸片球菌DY5 (CCTCC2017280)、植物乳杆菌DY6 (CCTCC2017138),从酸菜样品和豆粕样品中分离获得;大肠杆菌、金黄色葡萄球菌、沙门氏菌,本实验室保藏。
1.2 主要试剂和仪器乙酸钠、K2HPO4、MgSO4·7H2O、MnSO4·4H2O、柠檬酸三铵、乙酸乙酯、吡啶、乳酸、丙酸、柠檬酸、乙酸、3-苯基乳酸、癸酸、辛酸、棕榈酸、壬酸、油酸、月桂酸和N, O-双三甲基硅三氟乙酰胺购自阿拉丁公司。
三重四级杆气质联用仪,Thermo公司;氮吹仪,上海泉岛公司;旋转蒸发仪,上海比朗仪器有限公司;半制备高效液相色谱仪,沃特世科技(上海)有限公司;智能生化培养箱,上海三发科学仪器有限公司;酶标仪,BioTek公司;冷冻离心机,Eppendorf公司;高效液相色谱仪Chromaster,日立公司。
1.3 培养基参照文献[11]配制MRS液体培养基和LB培养基。
2 方法 2.1 乳酸菌的活化将保藏的菌种接种于50 mL MRS培养基中,37 ℃、200 r/min培养18 h,活化3代,以2%的接种量接入50 mL的MRS培养基,继续培养24 h,每4 h取一次样,测定各个时间点的OD600,绘制原始生长曲线图。
2.2 指示菌菌悬液的制备把大肠杆菌、沙门氏菌和金黄色葡萄球菌这3种致病菌接入50 mL LB培养基中,37 ℃、200 r/min培养16−18 h。
2.3 抗指示菌乳酸菌的筛选取直径约为90 mm的培养皿,加入已经融化好的LB培养基18−20 mL,让其在平板内能够均匀分布,放置一段时间让它凝固,作为底层。然后取半固体营养琼脂培养基(琼脂含量为1%)进行加热融化后,等其冷却至48−50 ℃,每50−100 mL的半固体中加入指示菌菌悬液0.1−0.2 mL,在底层上加入5 mL半固体培养基,使其在第一层上能够均匀分布,作为第二层。然后在平板中放置4个牛津杯,间隔距离相同,待其冷却后,取8 000 r/min离心5 min后的乳酸菌发酵上清液,每个双层平板中的牛津杯中分别加200 μL样品,37 ℃培养24 h后,测定各个抑菌圈直径的大小以作出评价。
2.4 不同发酵时间上清液的抑菌活性研究参考2.1的方法将植物乳杆菌DY6进行活化3代,按照2%的接种量转接到200 mL的MRS培养基中,37 ℃、200 r/min培养48 h,分别在0、4、8、12、16、20、24、36、48 h取5 mL发酵液,测定其OD600值;将8 000 r/min离心5 min后的上清液用牛津杯法测定每个时间段对大肠杆菌的抑菌活性,同时测定有机酸的含量,测定方法参考文献[15]。
2.5 GC-MS分析代谢物组 2.5.1 发酵液样品预处理取50 mL发酵液4 ℃、8 000 r/min离心10 min获取上清液,取10 mL发酵上清液加入终浓度为10 mmol/L的己二酸作为内标物,先用10 mL乙酸乙酯对样品进行萃取后,然后用5 mL乙酸乙酯对萃余相再次萃取,将两次萃取相进行混合备用。
2.5.2 样品的衍生化取上述处理过的萃取相氮吹干燥,然后加入50 μL N, O-双三甲基硅三氟乙酰胺和5 μL吡啶,80 ℃反应20 min[16],氮吹干燥后溶于正己烷中备用。
2.5.3 GC-MS条件扫描的质量数范围为50–650 amu,离子源类型为EI源,离子源温度为300 ℃,传输线温度为280 ℃。程序升温:起始温度为40 ℃,维持2 min后以10 ℃/min的升温速率提高至280 ℃,在此条件下维持8 min;载气(He)流速1 mL/min;电子能量:70 eV;发射电流:25 μA;柱子型号为TG-5 (30 m×0.25 mm×0.25 μm);分流比5:1。
2.5.4 数据采集与分析使用GC-MS联用仪对发酵液组分进行检测分析,对所产生的原始数据文件进行峰的提取、对保留时间进行校正、峰对齐等处理得到包括组分的质谱信息、峰面积和保留时间等相关数据。采集整理的数据通过Simca 14.1软件处理[17],进行主成分分析,观察总的代谢差异,采用OPLS-DA方法对样本进行分析,找到可以显著区分这两个样本的代谢产物。
2.6 乳酸菌发酵液抑菌物质理化特性研究 2.6.1 温度对抑菌物质的影响将发酵上清液分别在−20、4、30、60、80、100、121 ℃中处理30 min,比较经过不同处理后的样品对大肠杆菌的抑菌活性变化[18]。
2.6.2 pH对抑菌物质的影响用1 mol/L的HCl和NaOH将发酵上清液调至pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0并保持1 h,然后再调整至发酵液初始pH值[19],比较经过不同处理的样品对大肠杆菌的抗菌情况。
2.6.3 酶处理对抑菌物质的影响用胰蛋白酶、胃蛋白酶和蛋白酶K处理发酵上清液,将酶溶液调节至1 mg/mL的浓度,并调节至酶的最适pH:胃蛋白酶pH 2.0、过氧化氢酶pH 7.0、胰蛋白酶pH 7.0和蛋白酶K pH 7.5。将酶溶液和上清液等体积混合,酶解3 h后将发酵上清液的pH值重新调整至初始pH,测定对大肠杆菌抗菌活性的变化,没有经过酶处理的样品作为空白对照。
2.7 有机酸的抑菌活性研究根据发酵上清液有机酸的测定结果,在MRS培养基中分别加入与发酵上清液相同浓度的乳酸、乙酸、丙酸、柠檬酸、苯乳酸和五种混合酸,然后通过牛津杯法测定对大肠杆菌的抑菌情况。
2.8 抑菌物质初步分离纯化 2.8.1 不同有机溶剂萃取效果比较将发酵液10 000 r/min离心10 min后取上清,以1:1.5的体积比与乙酸乙酯、正己烷、三氯甲烷、二氯甲烷、丙酮分别进行萃取[20],充分混合后12 000 r/min离心5 min,吸出有机相,用旋转蒸发仪进行旋蒸,用水复溶,获取萃取相和萃余相[21],以大肠杆菌为指示菌,通过牛津杯法测定抑菌效果。
2.8.2 抑菌物质的分离与鉴定将200 mL发酵上清液进行冷冻干燥,冷冻干燥后用10 mL无菌水复溶,用有机溶剂以1:1.5的体积比进行萃取,氮吹仪吹干,用10 mL无菌蒸馏水再次复溶,半制备液相色谱分离,色谱柱为C18柱,流动相A为甲醇溶液,流动相B为0.05%三氟乙酸水溶液,流速为3 mL/min,A流动相在30 min内由10% (体积比)到100% (体积比),100%的A维持5 min,然后在5 min内由100%到10% (体积比)。检测波长为210 nm。分离的抑菌部分检测通过GC-MS鉴定,参照2.5。
2.9 脂肪酸的抑菌活性测定 2.9.1 菌液制备将实验室保藏的大肠杆菌接种到营养琼脂斜面培养基上进行菌种的活化培养,37 ℃、200 r/min培养18 h活化3代,然后通过平板计数确定菌液的浓度,根据菌液浓度用LB培养基稀释至105 CFU/mL。
2.9.2 抗菌剂的制备将脂肪酸先通过无水乙醇溶解,再加入等体积的吐温-80溶液,配制出浓度为200 mmol/L的储备溶液,取一定量储备溶液到LB培养基中,使其浓度稀释到20 mmol/L,并用0.22 μm滤膜进行除菌处理,制成抗菌剂。
2.9.3 抑菌率的测定取2 mL灭过菌的离心管,加入0.8 mL抗菌剂和0.2 mL的指示菌液,将离心管密封后37 ℃、200 r/min培养24 h,通过平板计数法测定各离心管的菌落总数,然后计算抑菌率,抑菌率(%)=[(对照实验组菌落总数–实验组菌落总数)/对照组菌落总数]×100,对照组是将同浓度菌液接种到LB培养基(含同浓度乙醇和甘油)但不含抗菌剂[14]。
3 结果与分析 3.1 不同乳酸菌生长情况比较测定各个乳酸菌OD600后比较它们的生长情况。由图 1可以看出,植物乳杆菌DY6生长情况最佳,副干酪乳杆菌DY2生长情况较其他菌株最弱,植物乳杆菌DY6从4 h开始进入对数期,到了24 h后进入平台期。
|
| 图 1 不同乳酸菌生长曲线比较 Figure 1 Comparison of the growth curve of different lactic acid bacteria |
|
|
运用牛津杯法测定6株不同乳酸菌的抑菌能力,由表 1可以发现,植物乳杆菌DY6对大肠杆菌和金黄色葡萄球菌抑菌效果最好,抑菌直径分别为15.32 mm和16.08 mm;植物乳杆菌DY1对沙门氏菌的抑菌情况最佳,抑菌直径达到了15.93 mm;其余两株鼠李糖乳酸菌和乳酸片球菌抑菌能力相对较弱,副干酪乳杆菌的抗菌能力最弱,对3株指示菌抑菌效果不佳;植物乳杆菌DY6对沙门氏菌抗菌能力仅次于植物乳杆菌DY1。综上所述,植物乳杆菌DY6抑菌效果最佳,选此菌进行下一步实验。
| 菌株编号 Strain number |
大肠杆菌 Escherichia coli |
沙门氏菌 Salmonella |
金黄色葡萄球菌 Staphylococcus aureus |
| Lactobacillus plantarum DY1 | 12.89±0.21 | 15.93±0.22 | 15.70±0.41 |
| Lactobacillus casei DY2 | 10.25±0.23 | 10.72±0.37 | 12.10±0.29 |
| Lactobacillus rhamnose DY3 | 13.43±0.39 | 11.57±0.26 | 13.83±0.35 |
| Lactobacillus rhamnose DY4 | 13.22±0.14 | 12.20±0.30 | 13.55±0.38 |
| Pediococcus acidilactici DY5 | 12.81±0.22 | 11.60±0.34 | 13.77±0.22 |
| Lactobacillus plantarum DY6 | 15.32±0.28 | 13.18±0.19 | 16.08±0.31 |
| 注:表中所列抑菌直径数据为3次重复的平均值. Note: The bacteriostatic diameter data listed in the table is the average of three repeats. | |||
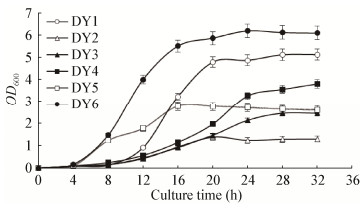
根据图 2可以发现,植物乳杆菌DY6从4 h开始进入对数期,到24 h后到达平台期。发酵上清液在0−4 h无抗菌能力,在8 h时抑菌效果得到显著提高,抑菌直径接近10.43 mm;从8 h开始到24 h,抗菌能力逐渐增强,24 h时抑菌直径达到了15.13 mm;发酵36、48 h后,抑菌变化差异不明显。图 2可以直观看出发酵上清液抑菌效果与菌的生长情况有正相关性。由表 2可见,从8 h开始,发酵上清液中有机酸种类和含量都在增加,推测抑菌作用与菌体生长过程中代谢物种类和量的持续增加有关。
|
| 图 2 不同发酵时间下抑菌效果 Figure 2 Antibacterial activity of different fermentation time |
|
|
| 时间 Time (h) |
乳酸 Lactic acid |
乙酸 Acetic acid |
丙酸 Propionic acid |
柠檬酸 Citric acid |
3-苯基乳酸 3-Phenyllactic acid |
4-羟基苯基乳酸 4-Hydroxyphenyl lactic acid |
| 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 4 | 0 | 0.60±0.01 | 0 | 0 | 0 | 0 |
| 8 | 1.13±0.02 | 3.97±0.12 | 0.12±0.02 | 0.20±0.01 | 0.07±0.01 | 0 |
| 12 | 8.98±0.36 | 10.34±0.49 | 0.77±0.05 | 0.58±0.06 | 0.16±0.02 | 0.03±0.00 |
| 16 | 13.33±0.55 | 11.68±0.57 | 0.96±0.21 | 0.70±0.10 | 0.21±0.01 | 0.07±0.00 |
| 24 | 17.64±0.61 | 11.90±0.68 | 1.13±0.34 | 0.78±0.12 | 0.34±0.05 | 0.12±0.01 |
| 36 | 22.68±0.86 | 13.94±0.79 | 1.34±0.32 | 0.84±0.11 | 0.31±0.05 | 0.14±0.01 |
| 48 | 19.78±0.96 | 13.37±0.72 | 1.24±0.25 | 0.75±0.08 | 0.35±0.04 | 0.17±0.02 |
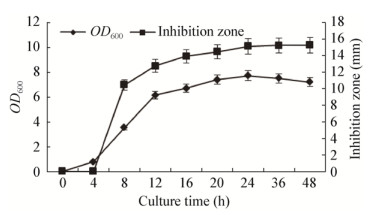
用PCA对8个时间段的发酵上清液物质进行分析,结果见图 3,8组样品基本可以区分开。0 h及4 h发酵上清液差异不明显,不能显著区分,此结果与抑菌试验结果相符合;发酵8 h后,代谢物种类增多,上清液抑菌效果也显著上升,并与0、4 h显著区分开来;发酵24 h后代谢物差异不明显,趋于稳定,抑菌效果差异不显著。
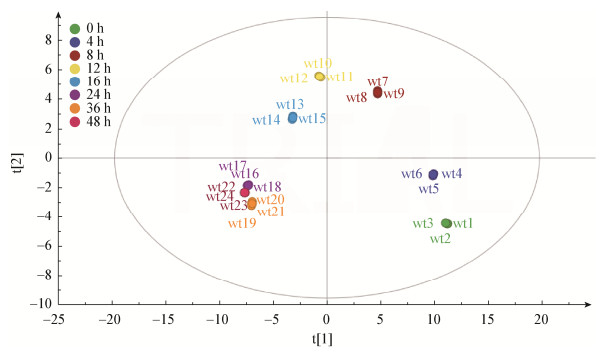
|
| 图 3 发酵上清液GC-MS谱PCA分析散点图 Figure 3 GC-MS spectrum PCA scores plots of fermentation supernatant |
|
|
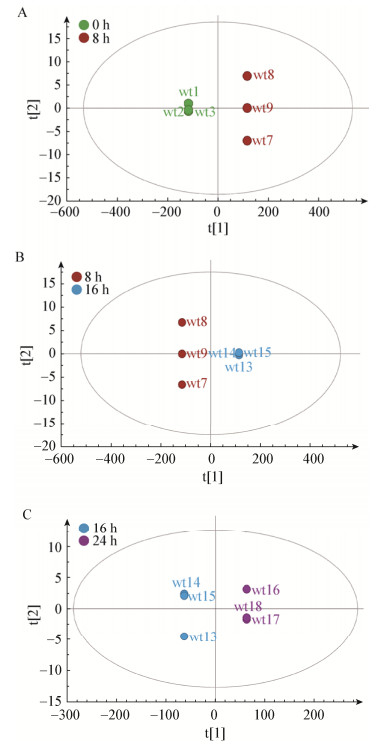
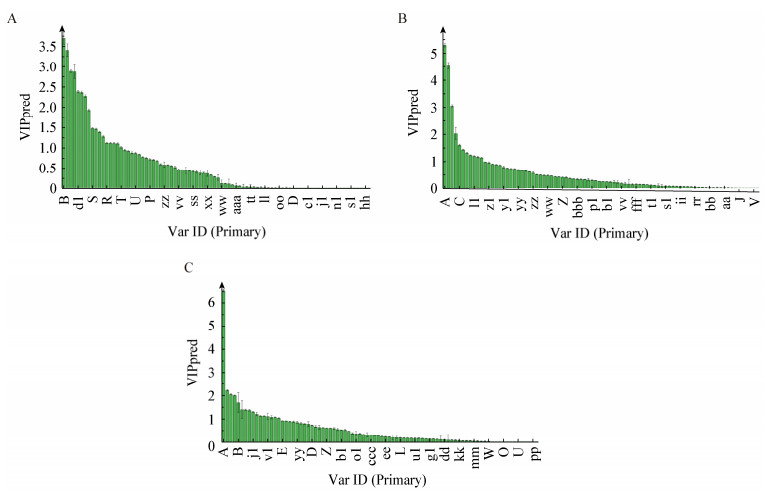
利用OPLS-DA对发酵上清液物质进行分析,由图 4可以看出,发酵0 h和8 h,发酵8 h和16 h,发酵16 h和24 h,这3组能够显著区分,说明这3组之间发酵液代谢物产生了明显的变化。在图 5的S-plot图中,这3张图中每一个绿色的点就是一个代谢物,离原点越远的变量对它的影响就越大,成为差异性代谢物的可能性就越高;用红色所标记的为差异性代谢物。计算发酵液上清液代谢物中各变量的VIP值(图 6),挑选VIP值> 1的变量,初步鉴定发酵0 h和8 h差异代谢物有12种,发酵8 h和16 h差异代谢物总共11种,发酵16 h和24 h的差异代谢物总共16种,结果见表 3、4、5,其中发酵0、8 h的差异性代谢物上调的有乙酸、乳酸、癸酸、辛酸,发酵8、16 h的差异性代谢物上调的有乳酸、乙酸、辛酸、癸酸、丙酸、丁酸、柠檬酸、乙偶姻、3-甲基丁醛,发酵16、24 h的差异代谢物上调的有乳酸、癸酸、2, 5-二甲基吡嗪、辛酸、乙酸、2, 3-丁二酮、2, 4-二甲基苯甲醛、丙酸、乙偶姻、3-苯基乳酸、3-癸烯酸、3-甲基丁醛。结合上述3组差异性代谢物,推测主要抑菌物质为有机酸和脂肪酸,此外的2, 3-丁二酮、3-甲基丁醛等多为香味物质,其对抑菌活性影响较小。
|
| 图 4 不同发酵时间的OPLS-DA图 Figure 4 OPLS-DA diagram of different fermentation time Note: A: 0 h and 8 h; B: 8 h and 16 h; C: 16 h and 24 h. |
|
|

|
| 图 5 不同发酵时间的S-plot图 Figure 5 S-plot diagram of different fermentation time Note: A: 0 h and 8 h; B: 8 h and 16 h; C: 16 h and 24 h. |
|
|
|
| 图 6 基于不同发酵时间样品OPLS-DA分析的VIP图 Figure 6 VIP diagram based on OPLS-DA analysis of samples with different fermentation time Note: A: 0 h and 8 h; B: 8 h and 16 h; C: 16 h and 24 h. |
|
|
| Number | VIP | Name |
| B | 3.18 | 乙酸Acetic acid |
| A | 2.93 | 乳酸Lactic acid |
| K | 2.48 | 棕榈酸Palmitic acid |
| Q | 2.47 | 癸酸Tannic acid |
| d1 | 2.05 | 辛酸Octoic acid |
| y1 | 2.03 | 苯甲醛Benzaldehyde |
| H | 1.95 | 硬脂酸Stearic acid |
| J | 1.66 | 9-十八碳烯酸9-Octadecenoic acid |
| S | 1.27 | 肌苷Inosine |
| L | 1.25 | D-呋喃阿拉伯糖D-araabin arabinose |
| Z1 | 1.19 | 2, 5-二甲基吡嗪2, 5-Dimethylpyrazine |
| yy | 1.09 | 壬醛Furfural |
| Number | VIP | Name |
| A | 5.29 | 乳酸Lactic acid |
| B | 4.54 | 乙酸Acetic acid |
| d1 | 3.05 | 辛酸Octoic acid |
| Q | 2.02 | 癸酸Tannic acid |
| C | 1.60 | 丙酸Propionic acid |
| K | 1.43 | 棕榈酸Palmitic acid |
| I | 1.32 | 丁酸Butyric acid |
| F | 1.22 | 柠檬酸Citric acid |
| I1 | 1.19 | 乙偶姻Acetoin |
| m1 | 1.17 | 3-甲基丁醛3-Methyl butyral |
| X | 1.14 | D-呋喃半乳糖苷D-furan galactoside |
| Number | VIP | Name |
| A | 6.52 | 乳酸Lactic acid |
| Q | 2.22 | 癸酸Tannic acid |
| z1 | 2.04 | 2, 5-二甲基吡嗪2, 5-Dimethylpyrazine |
| d1 | 2.00 | 辛酸Octoic acid |
| B | 1.64 | 乙酸Acetic acid |
| x1 | 1.38 | 2, 3-丁二酮2, 3-Butanedione |
| uu | 1.37 | 二甲基苯甲醛Dimethylbenzaldehyde |
| C | 1.37 | 丙酸Propionic acid |
| j1 | 1.30 | 苯乙醇Phenylethanol |
| vv | 1.20 | 十六烷Hexadecane |
| i1 | 1.13 | 乙偶姻Acetoin |
| G | 1.12 | 3-苯基乳酸3-Phenyllactic acid |
| v1 | 1.12 | 2, 4-二叔丁基苯酚2, 4-Ditertbutyl phenol |
| y1 | 1.08 | 苯甲醛Benzaldehyde |
| m1 | 1.07 | 3-甲基丁醛3-Methyl butyral |
| k1 | 1.04 | 3-癸烯酸3-Decenoic acid |
通过表 6可以发现,抑菌物质在100 ℃处理30 min仍有抑菌活性,直至在121 ℃处理30 min抑菌活性才消失,表明抑菌物质有较好的耐热性。
| 温度 Temperature (℃) |
抑菌圈直径 Inhibition zone (mm) |
| −20 | 14.57±0.15 |
| 4 | 14.41±0.23 |
| 30 | 15.00±0.22 |
| 60 | 13.68±0.59 |
| 80 | 13.19±0.45 |
| 100 | 11.91±0.21 |
| 121 | − |
| 注:−:无抑菌活性. Note: −: No antibacterial activity. | |
由表 7可以得出,抑菌物质在pH为2.0−4.0时有较好的抑菌活性,当pH > 5.0时抑菌活性完全丧失,表明抑菌物质在酸性环境下能更好地显示出抑菌效果。
| pH | 抑菌圈直径 Inhibition zone (mm) |
| 2.0 | 15.43±0.31 |
| 3.0 | 14.61±0.40 |
| 4.0 | 14.20±0.38 |
| 5.0 | 8.60±0.12 |
| 6.0 | − |
| 7.0 | − |
| 8.0 | − |
| 注:−:无抑菌活性. Note: −: No antibacterial activity. | |
由表 8可以看出,发酵上清液经过胰蛋白酶、过氧化氢酶、胃蛋白酶、蛋白酶K处理后,抑菌效果变化较小,说明抑菌物质对这些酶并不敏感,且排除了H2O2的干扰。
| 酶种类 Types of enzymes |
抑菌圈直径 Inhibition zone (mm) |
| 对照Control | 14.10±0.21 |
| 胰蛋白酶Trypsin | 13.82±0.26 |
| 胃蛋白酶Pepsin | 13.71±0.38 |
| 蛋白酶K Proteinase K | 13.90±0.50 |
| 过氧化氢酶Catalase | 13.87±0.32 |
| 注:对照为未经过酶处理的发酵上清液. Note: The control is a fermentation supernatant without treatment by enzymes. | |
乳酸菌发酵上清液中抑菌物质主要为有机酸、过氧化氢、脂肪酸和肽类物质等,根据高效液相色谱测定的主要有机酸浓度配制相同浓度的有机酸和有机酸混合液,比较抑菌活性。结果如表 9所示,可以看出乳酸、乙酸的含量很大,远远大于其他有机酸的含量,这两种酸有很强的抑菌活性,其余的有机酸由于含量低,没有明显的抑菌作用。另外,混合酸的抑菌活性小于发酵上清液抑菌活性,推测除了这些常规有机酸外还有其他代谢物起到了协同作用。
| 有机酸 Organic acid |
含量 Content (mg/mL) |
抑菌圈直径 Inhibition zone (mm) |
| 乳酸Lactic acid | 20.10±0.57 | 12.8±0.48 |
| 乙酸Acetic acid | 12.24±0.52 | 13.19±0.39 |
| 丙酸Propionic acid | 1.56±0.16 | 8.33±0.12 |
| 柠檬酸Citric acid | 0.70±0.12 | − |
| 3-苯基乳酸3-Phenyllactic acid | 0.16±0.04 | − |
| 混合酸Mixed acid | 34.76±0.49 | 14.18±0.11 |
| 发酵上清液Fermentation supernatant | 14.85±0.14 | |
| 注:−:无抑菌活性. Note: −: No antibacterial activity. | ||
对不同溶剂萃取发酵上清液代谢物的能力进行比较的结果如表 10所示。乙酸乙酯、正己烷、三氯甲烷、二氯甲烷提取都出现了明显的分层现象,通过丙酮提取时并未出现分层现象,说明丙酮不适合作为萃取剂;而二氯甲烷和三氯甲烷的萃取相中并未检测到抑菌活性,也不适合作为萃取剂;正己烷和乙酸乙酯萃取相都有抑菌效果。由表 10可以看出乙酸乙酯萃取相有明显的抑菌效果,因此选取乙酸乙酯作为萃取剂。
| 有机溶剂 Organic reagent |
萃取相 Extraction phase |
萃余相 Raffinate phase |
| 正己烷Hexane | 8.71±0.10 | 14.50±0.64 |
| 乙酸乙酯Ethyl acetate | 13.76±0.63 | 10.33±0.37 |
| 二氯甲烷Dichloromethane | 0 | 14.27±0.58 |
| 三氯甲烷Trichloromethane | 0 | 14.37±0.56 |
| 丙酮Acetone | − | − |
| 注:−:无法萃取. Note: −: Unable to extract. | ||
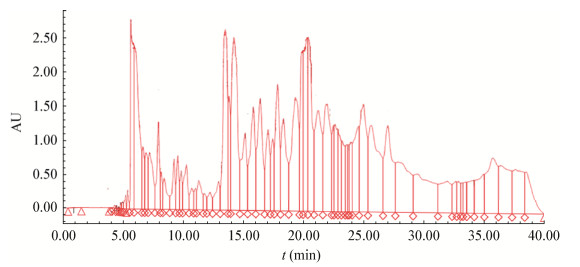
通过半制备高效液相色谱对发酵上清液进行分离,色谱图见图 7,共分成11个组分,其中4个部分具有抑菌活性(表 11)。从表 11、12可以看出,第1部分的抑菌直径为14.23 mm,其中主要成分为乳酸、乙酸;第5部分的抑菌直径为11.18 mm,主要是一些脂肪酸和含苯环的小分子酸,另外还有一些醇类和吡嗪物质;第7部分的抑菌直径为12.95 mm,主要成分为脂肪酸及一些脂肪酸衍生物;第10部分的抑菌直径为11.53 mm,主要为脂肪酸和一些小分子有机酸,其中苯甲醛占比很高,而苯甲醛已经被报道用于食品防腐,推测其与脂肪酸和有机酸一起作用起到了抑菌效果。通过半制备分离的结果推测植物乳杆菌的主要抑菌物质为有机酸和脂肪酸,另外有一些起辅助抑菌作用的醇类。
|
| 图 7 发酵上清液半制备液相色谱图 Figure 7 Semi-preparation liquid chromatography of fermented supernatant |
|
|
| 项目 Items |
分离部分 Separate part |
||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | |
| 分离时间 Separation time (min) |
4.0−6.6 | 6.7−8.0 | 8.0−9.0 | 9.0−10.0 | 10.0−11.0 | 11.0−12.0 | 12.0−14.0 | 14.0−15.0 | 15.0−16.0 | 16.0−18.0 | 18.0−20.0 |
| 抑菌活性 Antibacterial activity |
+++ | − | − | − | + | − | ++ | − | − | + | − |
| 抑菌直径 Inhibition zone (mm) |
14.23±0.44 | − | − | − | 11.18±0.25 | − | 12.95±0.36 | − | − | 11.53±0.42 | − |
| 注:−:无抑菌活性;+:有抑菌活性;加号越多抑菌活性越强. Note: −: No antibacterial activity; + : Antibacterial activity; The more the addition, the stronger the antibacterial activity. | |||||||||||
| 1 | 5 | 7 | 10 |
| 乳酸 Lactic acid |
壬酸 N-Nonoic acid |
戊酸 Valeric acid |
棕榈酸 Palmitic acid |
| 乙酸 Acetic acid |
1-己醇 1-Hexanol |
棕榈酸 Palmitic acid |
苯甲醛 Benzaldehyde |
| 癸酸 Decyl acid |
硬脂酸 Stearic acid |
硬脂酸 Stearic acid |
苯丙酸 Phenylpropionic acid |
| 月桂酸 Lauric acid |
2, 5-二甲基吡嗪 2, 5-Dimethylpyrazine |
壬酸 N-nonoic acid |
壬酸 N-nonoic acid |
| 苯甲醛 Benzaldehyde |
辛酸 Octanoic acid |
亚油酸 Linoleic acid |
苯丙氨酸 Phenylalanine |
| 苯二甲酸 Phthalic acid |
丙酸 Propionic acid |
十八烷酸 Stearic acid |
|
| 苯丙酸 Phenylpropionic acid |
油酸 Oleic acid |
癸酸 Decyl acid |
|
| 甘油单硬脂酸酯 Glycerol monostearate |
辛酸 Octanoic acid |
||
| 8-甲基壬酸 8-Methyl decanoic acid |
|||
| 2-甲基丁酸 2-Methylbutyric acid |
|||
| 苯甲醇 Benzyl alcohol |
|||
| 戊二酸 Glutaric acid |
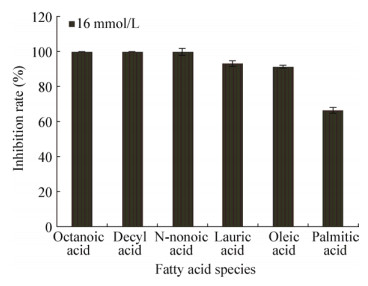
由图 8可以看出,在16 mmol/L浓度条件下这6种饱和脂肪酸对大肠杆菌的生长有明显的抑制作用。发酵上清液的脂肪酸浓度结果见表 13,按表 13测得的浓度将6种脂肪酸进行混合测定抑菌效果,抑菌直径约为10.15 mm。根据发酵上清液有机酸和脂肪酸浓度的测定结果,在MRS培养基中分别加入与发酵上清液相同浓度的脂肪酸和有机酸进行测定的结果见表 14,发现抑菌直径为14.69 mm,优于两者之一,因此可推测有机酸和脂肪酸共同参与起到了抑菌作用。实验结果证明了脂肪酸对有害菌有抑制作用,而在食品领域,拥有抗菌能力的脂肪酸和它的衍生物也被作为防腐剂添加到食品加工和防腐领域。
|
| 图 8 脂肪酸对大肠杆菌的抑菌作用 Figure 8 Antibacterial activity of fatty acids on Escherichia coli |
|
|
| 脂肪酸 Fatty acid |
含量 Content (mmol/L) |
| 辛酸Octoic acid | 10.27±0.38 |
| 癸酸Decyl acid | 7.44±0.44 |
| 壬酸N-nonoic acid | 1.63±0.12 |
| 月桂酸Lauric acid | 0.10±0.00 |
| 油酸Oleic acid | 0.40±0.01 |
| 棕榈酸Palmitic acid | 0.53±0.10 |
| 抑菌物质 Antibacterial substance |
抑菌圈直径 Inhibition zone (mm) |
| 混合有机酸Mixed organic acid | 14.18±0.11 |
| 混合脂肪酸Mixed fatty acid | 10.15±0.23 |
| 以上两者混合Above both the mix | 14.69±0.15 |
本研究将不同样品来源的乳酸菌进行抑菌能力的比较,从中挑选出了一株抑菌性能优良的植物乳杆菌DY6,其抑菌谱广,能抑制大肠杆菌、金黄色葡萄球菌、沙门氏菌等;在研究其不同发酵时间的抑菌能力变化时发现其抑菌效果与菌的生长情况有正相关性,通过GC-MS代谢组学方法分析发酵上清液代谢物组的变化规律,发现其差异性代谢物有乳酸、乙酸、丙酸等小分子酸和癸酸、辛酸、壬酸等脂肪酸,另外对发酵上清液抑菌物质进行初步分离,得到了有抑菌活性的4个部分,鉴定出各部分主要抑菌物质为小分子有机酸和脂肪酸,得出植物乳杆菌DY6的主要抑菌物质为有机酸和脂肪酸。对有机酸和脂肪酸的抑菌活性进行了测定,发现在一定浓度下诸如乳酸、乙酸、辛酸、癸酸等对指示菌有很好的抑菌效果,也证明了乳酸菌的抑菌作用是多种代谢物综合作用的结果,这和熊骏等[22]的结果大致相同。有机酸抑菌机制多种多样,常见的有通过与细胞膜上的脂多糖等成分结合破坏菌膜稳定性,达到抑菌作用[23],或通过降低胞内pH影响致病菌代谢活动而达到抑菌目的等。而脂肪酸如月桂酸、油酸、亚麻酸已被发现对幽门螺旋杆菌有很好的抑菌作用[24],脂肪酸的抑菌机制常见的有通过渗透入致病菌细胞并和它的质膜结合,改变膜的渗透性而致细胞死亡[12],或通过影响细胞膜的流动性而达到抑制致病菌的生长等。乳酸菌在发酵过程还会产生大量其他有抑菌作用的代谢物,如刘冬梅等[25]对乳酸菌代谢物进行分析认为其主要抑菌物质除了乳酸外还有其他蛋白类物质,Yi等[26]从乳酸菌中分离到了具有抑菌作用的细菌素。现在大多数的研究都集中在细菌素[27-28]和一些常见有机酸上[29],容易忽略代谢物中其他有价值的抑菌产物,而本研究提供的筛选潜在抑菌代谢物的方法可以有效减少这种情况。现阶段本研究主要集中在抑菌物质的分析与鉴定上,但其如何对指示菌起到抑菌作用还需要进一步验证,2018年Piewngam等[30]发现芽孢杆菌产生的脂肽通过影响抗原体群体感应系统,干扰其定殖来达到抑菌作用,这也为我们之后研究益生菌的抑菌作用方式提供了一个新的角度。在今后抑菌物质的研究过程中,可以将抑菌物质进行进一步分离得到单一物质,然后结合实验对单一物质进行机理和安全性研究,从而探索出可以应用在食品领域的优质防腐产品。
| [1] |
Brooks P. Lactic acid bacteria improve food safety[J]. Song XG, trans. Pigs and Poultry, 2004, 24(4): 53-54 (in Chinese) Brooks P.乳酸菌改善食品安全[J].宋晓光, 译.国外畜牧学-猪与禽, 2004, 24(4): 53-54 |
| [2] |
Holzapfel WH, Geisen R, Schillinger U. Biological preservation of foods with reference to protective cultures, bacteriocins and food-grade enzymes[J]. International Journal of Food Microbiology, 1995, 24(3): 343-362. DOI:10.1016/0168-1605(94)00036-6 |
| [3] |
Reis JA, Paula AT, Casarotti SN, et al. Lactic acid bacteria antimicrobial compounds: characteristics and applications[J]. Food Engineering Reviews, 2012, 4(2): 124-140. DOI:10.1007/s12393-012-9051-2 |
| [4] |
Ogawa J, Kishino S, Ando A, et al. Production of conjugated fatty acids by lactic acid bacteria[J]. Journal of Bioscience and Bioengineering, 2005, 100(4): 355-364. DOI:10.1263/jbb.100.355 |
| [5] |
Vahedi SR, Kasra KR, Ghadam P. The inhibitory effect of bacteriocin produced by Lactobacillus acidophilus ATCC 4356 and Lactobacillus plantarum ATCC 8014 on planktonic cells and biofilms of Serratia marcescens[J]. Turkish Journal of Medical Sciences, 2016, 46(4): 1188-1196. |
| [6] |
Li TJ, Li AY, Zhang XF. Advances on antimicrobial mechanisms of lactic acid bacteria[J]. Microbiology China, 2002, 29(5): 81-85. (in Chinese) 李铁军, 李爱云, 张晓峰. 乳酸菌抗菌机理研究进展[J]. 微生物学通报, 2002, 29(5): 81-85. |
| [7] |
Fan X, Zhang H, Guo HY, et al. Research progress in antibacterial function of lactic acid bacteria[J]. China Dairy, 2012(9): 52-54. (in Chinese) 樊星, 张昊, 郭慧媛, 等. 乳酸菌抑菌功能的研究进展[J]. 中国乳业, 2012(9): 52-54. DOI:10.3969/j.issn.1671-4393.2012.09.014 |
| [8] |
Stiles ME, Holzapfel WH. Lactic acid bacteria of foods and their current taxonomy[J]. International Journal of Food Microbiology, 1997, 36(1): 1-29. DOI:10.1016/S0168-1605(96)01233-0 |
| [9] |
Ma HH, Lin Y, Lv XR, et al. Screening and inhibition mechanism of lactic acid bacteria against Aspergillus niger using 96-well microtiter plates[J]. Science and Technology of Food Industry, 2017, 38(12): 171-175. (in Chinese) 马欢欢, 林洋, 吕欣然, 等. 96孔板法筛选抗黑曲霉性乳酸菌及抑菌机理研究[J]. 食品工业科技, 2017, 38(12): 171-175. |
| [10] |
Corsetti A, Gobbetti M, Rossi J, et al. Antimould activity of sourdough lactic acid bacteria: identification of a mixture of organic acids produced by Lactobacillus sanfrancisco CB1[J]. Applied Microbiology and Biotechnology, 1998, 50(2): 253-256. DOI:10.1007/s002530051285 |
| [11] |
Wang HK, Yan YH, Wang JM, et al. Production and characterization of antifungal compounds produced by Lactobacillus plantarum IMAU10014[J]. PLoS One, 2012, 7(1): e29452. DOI:10.1371/journal.pone.0029452 |
| [12] |
Bergsson G, Arnfinnsson J, Steingrímsson , et al. In vitro killing of Candida albicans by fatty acids and monoglycerides[J]. Antimicrobial Agents and Chemotherapy, 2001, 45(11): 3209-3212. DOI:10.1128/AAC.45.11.3209-3212.2001 |
| [13] |
Guo JH, Brosnan B, Furey A, et al. Antifungal activity of Lactobacillus against Microsporum canis, Microsporum gypseum and Epidermophyton floccosum[J]. Bioengineered Bugs, 2012, 3(2): 104-113. DOI:10.4161/bbug.19624 |
| [14] |
Zhang X, Yang M, Song F, et al. Antimicrobial activity of selected fatty acids and their derivatives[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2013, 39(2): 155-160. (in Chinese) 张希, 杨明, 宋飞, 等. 脂肪酸及其衍生物的抑菌活性[J]. 浙江大学学报:农业与生命科学版, 2013, 39(2): 155-160. |
| [15] |
Zhao M, Huang DX, Zhang XJ, et al. Metabolic engineering of Escherichia coli for producing adipic acid through the reverse adipate-degradation pathway[J]. Metabolic Engineering, 2018, 47: 254-262. DOI:10.1016/j.ymben.2018.04.002 |
| [16] |
Medeiros PM, Simoneit BRT. Analysis of sugars in environmental samples by gas chromatography–mass spectrometry[J]. Journal of Chromatography A, 2007, 1141(2): 271-278. DOI:10.1016/j.chroma.2006.12.017 |
| [17] |
Becerra V, Odermatt J, Nopens M. Identification and classification of glucose-based polysaccharides by applying Py-GC/MS and SIMCA[J]. Journal of Analytical and Applied Pyrolysis, 2013, 103: 42-51. DOI:10.1016/j.jaap.2012.12.018 |
| [18] |
Song DF, Hu MY, Gu Q. Purification and characterization of plantaricin ZJ5, a new bacteriocin produced by Lactobacillus plantarum ZJ5[J]. PLoS One, 2014, 9(8): e105549. DOI:10.1371/journal.pone.0105549 |
| [19] |
Muhialdin BJ, Hassan Z, Sadon SK, et al. Effect of pH and heat treatment on antifungal activity of Lactobacillus fermentum Te007, Lactobacillus pentosus G004 and Pediococcus pentosaceus Te010[J]. Innovative Romanian Food Biotechnology, 2011, 8: 41-53. |
| [20] |
Gao P, Han JZ, Lu ZX, et al. Isolation and identification of lactic acid bacterial strain with broad-spectrum antibacterial activity and extraction and purification of bacteriocin produced by it[J]. Food Science, 2016, 37(11): 160-166. (in Chinese) 高鹏, 韩金志, 陆兆新, 等. 广谱抗菌乳酸菌的分离鉴定及细菌素的提取和纯化[J]. 食品科学, 2016, 37(11): 160-166. DOI:10.7506/spkx1002-6630-201611028 |
| [21] |
Burianek LL, Yousef AE. Solvent extraction of bacteriocins from liquid cultures[J]. Letters in Applied Microbiology, 2010, 31(3): 193-197. |
| [22] |
Xiong J, Han RN, Zhang ZH, et al. Screening of lactic acid bacteria strains with high antibacterial activity from Douchi and it's research of bacteriostatic[J]. Chinese Journal of Microecology, 2011, 23(6): 485-489. (in Chinese) 熊骏, 韩瑞娜, 张忠华, 等. 豆豉中高效抑菌活性乳酸菌的筛选及其抑菌研究[J]. 中国微生态学杂志, 2011, 23(6): 485-489. |
| [23] |
Gong YH, Li TY, Li SY, et al. Achieving high yield of lactic acid for antimicrobial characterization in cephalosporin resistant Lactobacillus by the co-expression of the phosphofructokinase and glucokinase[J]. Journal of Microbiology and Biotechnology, 2016, 26(6): 1148-1161. DOI:10.4014/jmb.1601.01043 |
| [24] |
Sun CQ, O'Connor CJ, Roberton AM. Antibacterial actions of fatty acids and monoglycerides against Helicobacter pylori[J]. FEMS Immunology and Medical Microbiology, 2003, 36(1/2): 9-17. |
| [25] |
Liu DM, Li L, Liang SZ, et al. Study on inhibitory effect and characterisation of antimicrobial substances produced by Lactobacillus rhamnosus[J]. China Dairy Industry, 2006, 34(1): 13-16. (in Chinese) 刘冬梅, 李理, 梁世中, 等. 鼠李糖乳杆菌产生抗菌物质的抑菌作用和特性研究[J]. 中国乳品工业, 2006, 34(1): 13-16. DOI:10.3969/j.issn.1001-2230.2006.01.003 |
| [26] |
Yi LH, Ying D, Wu JL, et al. Purification and characterization of a novel bacteriocin produced by Lactobacillus crustorum MN047 isolated from koumiss from Xinjiang, China[J]. Journal of Dairy Science, 2016, 99(9): 7002-7015. DOI:10.3168/jds.2016-11166 |
| [27] |
Pei JJ, Jiang L, Dai HP, et al. Application of nisin – the well-known lactic acid bacteria bacteriocin – against spoilage bacteria in tangerine wine[J]. Czech Journal of Food Sciences, 2016, 34(6): 488-494. DOI:10.17221/545/2015-CJFS |
| [28] |
Hu YX, Liu XL, Shan CJ, et al. Novel bacteriocin produced by Lactobacillus alimentarius FM-MM4 from a traditional Chinese fermented meat Nanx Wudl: Purification, identification and antimicrobial characteristics[J]. Food Control, 2017, 77: 290-297. DOI:10.1016/j.foodcont.2017.02.007 |
| [29] |
Dang TDT, Vermeulen A, Ragaert P, et al. A peculiar stimulatory effect of acetic and lactic acid on growth and fermentative metabolism of Zygosaccharomyces bailii[J]. Food Microbiology, 2009, 26(3): 320-327. DOI:10.1016/j.fm.2008.12.002 |
| [30] |
Piewngam P, Zheng Y, Nguyen TH, et al. Pathogen elimination by probiotic Bacillus via signalling interference[J]. Nature, 2018, 562(7728): 532-537. DOI:10.1038/s41586-018-0616-y |
 2019, Vol. 46
2019, Vol. 46