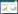扩展功能
文章信息
- 刘晓慧, 李晓敏, 禹伟, 吴殿辉, 陆健
- LIU Xiao-Hui, LI Xiao-Min, YU Wei, WU Dian-Hui, LU Jian
- 短乳杆菌2-34中瓜氨酸转运蛋白的鉴定
- Identification of a putative citrulline transporter in Lactobacillus brevis 2-34
- 微生物学通报, 2019, 46(9): 2249-2257
- Microbiology China, 2019, 46(9): 2249-2257
- DOI: 10.13344/j.microbiol.china.180794
-
文章历史
- 收稿日期: 2018-10-15
- 接受日期: 2019-01-08
- 网络首发日期: 2019-05-29
2. 江南大学粮食发酵工艺与技术国家工程实验室 江苏 无锡 214122;
3. 江南大学生物工程学院 江苏 无锡 214122;
4. 江苏省生物活性制品加工工程技术研究中心 江苏 无锡 214122
2. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi, Jiangsu 214122, China;
3. School of Biotechnology, Jiangnan University, Wuxi, Jiangsu 214122, China;
4. Jiangsu Provincial Research Center for Bioactive Product Processing Technology, Wuxi, Jiangsu 214122, China
传统黄酒生产是一个以酿酒酵母为主,富含乳酸菌和曲霉的开放式混合发酵过程。其中乳酸菌起着调节酒醪pH值、保持和改善黄酒酿造微生态环境、促进糖化与发酵、促进黄酒香味物质及其前驱物质的生成等重要作用[1]。然而,乳酸菌也会产生生物胺和瓜氨酸(氨基甲酸乙酯的前体物质)等,造成潜在的食品安全问题[2-5]。瓜氨酸主要通过乳酸菌的精氨酸脱亚胺酶途径(Arginine deimine pathway,ADI)代谢精氨酸形成,ADI途径包括以下步骤:精氨酸经过转运蛋白(AO antiporter,arcD基因编码)吸收进细胞内,精氨酸在精氨酸脱亚胺酶(ADI,arcA基因编码)作用下脱亚胺形成瓜氨酸,部分瓜氨酸可分泌至细胞外,进而与乙醇反应形成氨基甲酸乙酯。因此,通过调控瓜氨酸的形成理论上可以降低黄酒中氨基甲酸乙酯的含量,但由于瓜氨酸的胞内外运输机制尚不明确[6],给调控策略的优化带来一定的困难。
本课题组在前期研究中,首次从黄酒发酵液中分离得到一株具有瓜氨酸吸收功能的乳酸菌——短乳杆菌Lactobacillus brevis 2-34[7],该菌株不积累生物胺,且能将发酵体系中其它微生物分泌的瓜氨酸吸收并利用,达到有效降低发酵液中瓜氨酸含量从而减少氨基甲酸乙酯形成的目的。
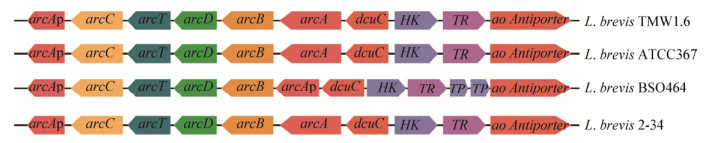
将L. brevis 2-34的arc基因簇[8]与NCBI中已完成全基因组测序的短乳杆菌L. brevis ATCC367、L. brevis TMW1.6和L. brevis BSO464中的arc基因簇进行比较(图 1),基因簇中所含基因的种类以及各基因的位置分布基本一致,且在基因簇下游均存在两个可能的瓜氨酸转运蛋白编码基因dcuC和ao Antiporter,二者分别与清酒乳杆菌Lactobacillus saki CTC494的PTP基因和肺炎链球菌Streptococcus pneumonia D39的arcE基因具有80%和55%的相似性(图 2)[7]。Rimaux等敲除PTP基因,发现与野生菌相比较,突变菌株在发酵过程中分泌的瓜氨酸减少,而精氨酸消耗完时胞外的瓜氨酸未被重吸收入细胞内,证明了PTP基因参与瓜氨酸转运的极大可能性[9]。D39中的ArcE蛋白对瓜氨酸具有较高的亲和力和转运活性,极有可能在特定条件下行使瓜氨酸转运体的功能[10]。
|
| 图 1 部分短乳杆菌的arc基因簇 Figure 1 arc gene clusters of partial Lactobacillus brevis |
|
|
|
| 图 2 短乳杆菌2-34 arc基因簇分析 Figure 2 arc gene clusters of partial Lactobacillus brevis |
|
|
本研究主要利用Duet-1TM系列表达载体表达了乳酸菌ADI途径中瓜氨酸代谢相关基因,比较瓜氨酸分泌和吸收情况,进而确定短乳杆菌2-34中的瓜氨酸转运蛋白,为进一步解析瓜氨酸代谢与重吸收机制提供理论依据,为该菌株调控黄酒中氨基甲酸乙酯含量奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 培养基MRS液体培养基(g/L):蛋白胨10.0,酵母粉5.0,牛肉膏10.0,无水葡萄糖20.0,柠檬酸铵2.0,Tween-80 1 mL,乙酸钠5.0,K2HPO4·3H2O 2.0,MgSO4·7H2O 0.58,MnSO4·H2O 0.25,乙酸调pH 5.0,用于短乳杆菌2-34的培养。
1.1.2 主要试剂和仪器高保真酶PrimeSTAR MAX premix、限制性核酸内切酶(BamHⅠ、PstⅠ、Bgl Ⅱ、KpnⅠ)、抗生素[卡那霉素(Kan)、氨苄青霉素(Amp)]、氨基酸标准品(L-精氨酸,L-瓜氨酸)均购自TaKaRa公司;四氢呋喃、乙腈、甲醇等色谱纯试剂、衍生剂邻苯二甲醛(OPA)购自Sigma公司;质粒提取试剂盒,DNA纯化试剂盒购自OMEGA公司;Ezup细菌基因组提取试剂盒购自生工生物工程(上海)股份有限公司。
数码凝胶成像仪,江苏捷达科技发展有限公司;PCR仪,Eppendorf公司;摇床,上海苏坤实业有限公司。
1.1.3 引物设计与合成根据短乳杆菌2-34 arc基因簇中arcB、dcuC和ao Antiporter基因的核苷酸序列,设计了表 1中的扩增引物,所有引物均由天霖生物科技(上海)有限公司合成。
| 引物 Primers |
序列 Sequences (5′→3′) |
修饰 Modification |
| FdcuC | GGAAGATCTATGGCTAATGCTGAAGTTCA | Bgl II |
| RdcuC | CGGGGTACCTTAAACACCTGAAATTAATA | Kpn I |
| Fao | GGAAGATCTATGCAAGAACCTTCAGCCAAG | Bgl II |
| Rao | CGGGGTACCCTAGAGTATGGCCATAATAC | Kpn I |
| FarcB | GGAGGATCCATGACTAAGGATTTTCGGGA | BamH I |
| RarcB | CCAATGCATTGGTTCTGCAGTTAAGCTCGTGGAATGAATA | Pst I |
| 注:下划线所标注序列为限制性酶切位点序列,加粗序列为保护碱基. Note: The underlined sequences are restriction enzyme site sequences and the thickening sequences are protective bases. | ||
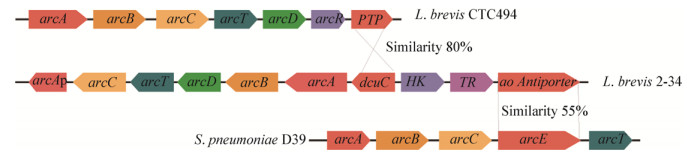
提取短乳杆菌2-34基因组,并以其为模板,所用引物序列如表 1所示,以PrimeSTAR酶进行PCR扩增,经琼脂糖凝胶电泳验证,切胶回收dcuC、ao Antiporter和arcB基因。根据短乳杆菌2-34 arcA及arcD基因的核苷酸序列,设计多顺反子arcDA,中间以RBS核糖体结合位点序列(5′-TAGGAAGGAGATATACATATG-3′)[11-12]连接,5′端和3′端分别添加EcoR I和Sal I酶切位点(由金维智生物公司合成生成)。
将arcDA、dcuC、ao Antiporter、arcB基因片段以及表达载体pRSFDuet-1和pETDuet-1按照图 3和图 4所示进行双酶切、连接并转化大肠杆菌DH5α[13],挑取相应抗生素平板上的阳性转化子,获得质粒pRSFDuet-arcDA、pRSFDuet-arcDAdcuC、pRSFDuet-arcDAao、pETDuet-dcuC、pETDuet-ao、pETDuet-arcBdcuC和pETDuet-arcBao,随后按表 2所示将上述质粒转化至大肠杆菌C43(DE3)中并对其进行命名,重组菌株保存在甘油管中。
|
| 图 3 pRSFDuet-arcDAdcuC和pRSFDuet-arcDAao载体构建示意图 Figure 3 Construction flow of pRSFDuet-arcDAdcuC and pRSFDuet-arcDAao |
|
|

|
| 图 4 pETDuet-arcBdcuC和pETDuet-arcBao载体构建示意图 Figure 4 Construction flow of pETDuet-arcBdcuC and pETDuet-arcBao |
|
|
| 菌株或质粒 Strains or plasmids |
特点 Property |
来源 Source |
| pRESFDuet-1 | Kanr | Presented by Professor Deng Yu |
| pETDuet-1 | Ampr | Presented by Professor Deng Yu |
| pRSFDuet-arcDA | Kanr, arcDA inserted into pRESFDuet-1 | This study |
| pRSFDuet-arcDAdcuC | Kanr, dcuC inserted into pRSFDuet-arcDA | |
| pRSFDuet-arcDAao | Kanr, ao Antiporter inserted into pRSFDuet-arcDA | |
| pETDuet-dcuC | Ampr, dcuC inserted into pETDuet-1 | |
| pETDuet-ao | Ampr, ao Antiporter inserted into pETDuet-1 | |
| pETDuet-arcBdcuC | Ampr, arcB inserted into pETDuet-dcuC | |
| pETDuet-arcBao | Ampr, arcB inserted into pETDuet-ao | |
| E. coli C43(DE3) | Expression host | Purchased from Wuhan Miaoling Biological Company |
| E. coli DH5α | Cloning host | Presented by Professor Fang Fang |
| L. brevis 2-34 | Kanr, Sper, Emr, Cmr | Isolated from fermentation of yellow rice wine |
| E. coli C1 | Kanr, pRSFDuet-arcDA transformed into C43 | This study |
| E. coli C2 | Kanr, pRSFDuet-arcDAdcuC transformed into C43 | |
| E. coli C3 | Kanr, pRSFDuet-arcDAao transformed into C43 | |
| E. coli C4 | Ampr; pETDuet-arcBdcuC transformed into C43 | |
| E. coli C5 | Ampr; pETDuet-arcBao transformed into C43 | |
| E. coli C6 | Kanr, Ampr; pRSFDuet-arcDA and pETDuet-dcuC transformed into C43 | |
| E. coli C7 | Kanr, Ampr; pRSFDuet-arcDA and pETDuet-ao transformed into C43 |
所有表达载体经PCR和测序验证,所用引物如表 3所示。
| 引物 Primers |
检测基因 Identified gene |
序列 Sequences (5′→3′) |
| Fa | arcA | ATGACAAGTCCGATTCACGT |
| Ra | arcA | GGTCTTCTCGAACTAATGGC |
| Fd | arcD | ATGGATGAAAATAAAGGCTT |
| Rd | arcD | CTAAATCTGGATAGCACCCA |
| FdcuC | dcuC | ATGGCTAATGCTGAAGTTCA |
| RdcuC | dcuC | AGTATCCCACCAAAGGTGAG |
| Fao | ao Antiporter | ATGCAAGAACCTTCAGCCAA |
| Rao | ao Antiporter | CTAGAGTATGGCCATAATACC |
将重组菌C1、C2、C3、C6和C7活化后,接种于含5 g/L精氨酸的LB培养基[13],37 ℃、220 r/min培养至OD600为0.8−1.0,加入诱导剂IPTG使其终浓度为0.1 mmol/L[14],30 ℃、150 r/min诱导24 h。或将重组菌先接种于不含精氨酸的LB培养基至OD600为0.8−1.0,加入IPTG至终浓度1 mmol/L[14-15],16 ℃、150 r/min诱导6 h后[15],收集菌体转入等量含有5 g/L精氨酸的LB培养基,30 ℃、200 r/min培养24 h。收集发酵液测定氨基酸含量。
将重组菌株C4和C5分别活化后,接种于含5 g/L瓜氨酸的LB培养基,37 ℃、220 r/min培养至OD600为0.8−1.0,加入诱导剂IPTG使其终浓度为0.1 mmol/L,30 ℃、150 r/min诱导24 h。或将重组菌株先接种于不含瓜氨酸的LB培养基至OD600为0.8−1.0,加入IPTG至终浓度1 mmol/L,16 ℃、150 r/min诱导6 h后,收集菌体转入等量含有5 g/L瓜氨酸的LB培养基,30 ℃、200 r/min培养24 h。收集发酵液测定氨基酸含量。
1.2.3 高效液相色谱检测发酵液中L-精氨酸/L-瓜氨酸的含量采用OPA柱前衍生HPLC法测定氨基酸[7],洗脱时流速为1 mL/min,柱温35 ℃,检测波长338 nm,色谱柱为ODS HYPERSIL C18柱(250 mm×4.6 mm),程序如表 4所示。发酵液经4 ℃、10 000 r/min离心10 min去除菌体后,收集上清,取适量与OPA衍生剂混合后进样测定,根据标准曲线计算氨基酸含量。
| 时间 Time (min) |
流动相A Mobile phase A (%) |
流动相B Mobile phase B (%) |
| 0.0 | 92 | 8 |
| 27.5 | 40 | 60 |
| 31.5 | 0 | 100 |
| 33.0 | 92 | 8 |
| 35.5 | 92 | 8 |
在相应的抗性平板上挑取阳性转化子,经过培养、提取质粒DNA及PCR验证,重组表达载体中的目的片段长度与参考序列完全一致,如图 5所示,分别为1.2 kb (arcA)、1.4 kb (arcD)、1.5 kb (dcuC)、1.5 kb (ao Antiporter),表明成功构建了含有重组表达载体pRSFDuet-arcDAdcuC、pRSFDuet- arcDAao、pETDuet-arcBao和pETDuet-arcBdcuC的菌株。

|
| 图 5 pRSFDuet-arcDAdcuC/pRSFDuet-arcDAao表达载体鉴定 Figure 5 Identification of vectors pRSFDuet-arcDAdcuC/pRSFDuet-arcDAao 注:M:Marker;A中1/2、3/4分别为pRSFDuet-arcDAdcuC/pRSFDuet-arcDAao中arcA (1 233 bp)和arcD (1 413 bp)基因;B中1、2分别为pRSFDuet-arcDAao/pRSFDuet-arcDAdcuC中ao Antiporter (1 515 bp)和dcuC (1 563 bp)基因;C中1/2、3/4分别为pETDuet-ao/pETDuet-dcuC中ao Antiporter (1 515 bp)和dcuC (1 563 bp)基因. Note: M: Marker; A: 1/2 and 3/4 represent arcA (1 233 bp) and arcD (1 413 bp) genes in pRSFDuet-arcDAdcuC/pRSFDuet-arcDAao respectively; B: 1/2 represent ao Antiporter (1 515 bp) and dcuC (1 563 bp) genes in pRSFDuet-arcDAao/pRSFDuet-arcDAdcuC respectively; C: 1/2, 3/4 represent ao Antiporter (1 515 bp) and dcuC (1 563 bp) genes in pETDuet-ao/pETDuet-dcuC respectively. |
|
|
按照1.2.2和1.2.3中的方法,对重组表达菌株C1、C2、C6进行培养及诱导表达后,分别对发酵液中的精氨酸和瓜氨酸含量进行测定。由图 6可知,不论是在诱导表达前加入精氨酸,还是在重组蛋白表达后加入精氨酸,重组菌株C1、C2和C6均能不同程度地利用精氨酸,并形成瓜氨酸,但发酵结束后,C2和C6发酵液中瓜氨酸含量较C1明显降低(分别减少了51.83%,47.74%;31.09%,58.65%)。
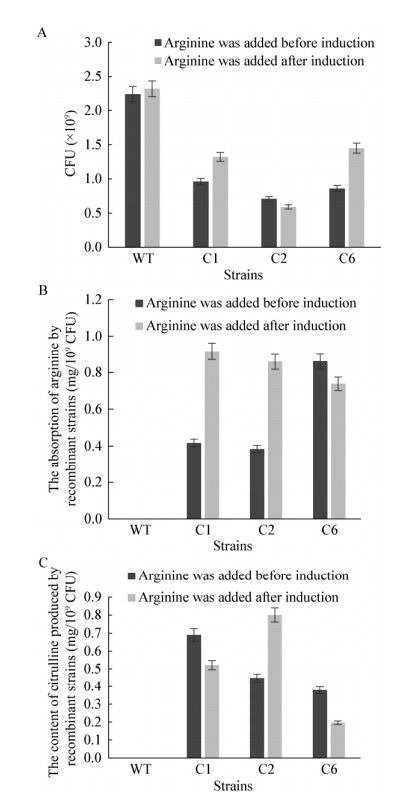
|
| 图 6 重组菌株C1、C2、C6生长及吸收精氨酸分泌瓜氨酸的情况 Figure 6 The growth of strains C1, C2, C6 and their utilization of arginine and secretion of citrulline |
|
|
在诱导前及诱导后添加精氨酸,含有pRSFDuet-arcDAdcuC的重组菌株C2在发酵结束后,菌体数量(0.709×109 CFU;0.965×109 CFU)明显低于C1 (0.958×109 CFU;1.32×109 CFU)和C6 (0.858×109 CFU;1.45×109 CFU),可见pRSFDuet- arcDAdcuC对E. coli C43(DE3)的生长有较大影响。
在诱导表达ArcD、ArcA和DcuC前加精氨酸,重组菌C6单位菌体吸收精氨酸的能力较C1和C2强,且发酵液中瓜氨酸的含量更低,说明C6具有较强的吸收瓜氨酸能力,即DcuC具有瓜氨酸重吸收功能。重组菌C2对于精氨酸的吸收利用较C1和C6差,其原因可能是进行多顺反子串联表达两个膜蛋白ArcD和DcuC时,基因间隔区长度较短,使得后期蛋白折叠时彼此受到干扰,蛋白折叠异常,最终导致两个蛋白活性降低,而当两个膜蛋白基因分别位于不同质粒中表达时,则不存在此问题。
在诱导表达ArcD、ArcA和DcuC后添加精氨酸,重组菌C2和C6单位菌体吸收精氨酸的能力均弱于C1,推测低温条件影响了重组菌共表达,导致折叠或定位膜蛋白DcuC和ArcD时两个蛋白彼此产生一定干扰,影响了其功能发挥。
2.3 AO antiporter对瓜氨酸的重吸收按照1.2.2和1.2.3中的方法,对重组表达菌株C1、C3、C7进行培养及诱导表达后,分别对发酵液中的精氨酸和瓜氨酸含量进行测定,结果如图 7所示。在诱导前及诱导后添加精氨酸,含有pRSFDuet-arcDAao的重组菌株C3在发酵结束后菌体数量(0.853×109 CFU;0.565×109 CFU)低于C1 (0.958×109 CFU;1.32×109 CFU)和C7 (1.42×109 CFU;1.71×109 CFU),可见pRSFDuet-arcDAao对E. coli C43(DE3)的生长有一定影响。

|
| 图 7 重组菌株C1、C3、C7生长及吸收精氨酸分泌瓜氨酸的情况 Figure 7 The growth of strains C1, C3, C7 and their utilization of arginine and secretion of citrulline |
|
|
如图 7B所示,在诱导表达ArcD、ArcA和AO antiporter前添加精氨酸,重组菌C3和C7单位菌体吸收精氨酸的能力均弱于C1,而在诱导表达ArcD、ArcA和AO antiporter后添加精氨酸,重组菌C3单位菌体吸收精氨酸的能力远优于C1和C7,虽然其发酵液中瓜氨酸含量相对较高,但因精氨酸分解成瓜氨酸为等摩尔的转化过程,因此发酵液中瓜氨酸含量实际低于所吸收精氨酸的转化量,说明有大量之前代谢分泌的胞外瓜氨酸被重新吸收回胞内,因此C3对瓜氨酸和精氨酸均有较强的吸收能力,即AO antiporter可能同时具有吸收精氨酸和瓜氨酸的功能。此外,与DcuC相反,低温诱导似乎更利于膜蛋白ArcD和AO antiporter的共表达和定位。
因含有的表达载体及携带外源基因的种类和数量的不同,导致不同重组菌株生长状况有一定差异性。与出发菌株E. coli C43(DE3)相比,重组菌经诱导表达后菌体数量均较少,推测异源膜蛋白的表达对细胞有一定的毒性。
在图 6C和图 7C中,在诱导前添加精氨酸的条件下,重组菌C6和C7发酵液中瓜氨酸总浓度高于C2和C3,但单位菌体瓜氨酸浓度均低于C2和C3,推测在该诱导条件下C6和C7对精氨酸有较大吸收量,吸收至胞内的精氨酸经ArcA分解为瓜氨酸并被大量分泌至胞外。虽然C6和C7对瓜氨酸有一定的重吸收能力,但是因代谢生成的瓜氨酸量较多导致发酵液中仍有大量的瓜氨酸存在,而C2和C3在该诱导表达过程中膜蛋白表达异常,精氨酸吸收量少,相应的转化成瓜氨酸的量较少。
2.4 DcuC和AO antiporter对瓜氨酸的吸收为进一步证明DcuC和AO antiporter对瓜氨酸的吸收功能,分别将其与降解瓜氨酸的ArcB联合重组表达,在两种诱导条件下,重组菌株C4和C5均可吸收并利用瓜氨酸,且含有DcuC重组蛋白的C4菌株对发酵液中瓜氨酸的吸收量更高,再次证明二者均具有瓜氨酸吸收功能,且DcuC对瓜氨酸的转运活性更高(图 8)。

|
| 图 8 重组菌株C4和C5生长及吸收瓜氨酸的情况 Figure 8 The growth of strains C4, C5 and their utilization of citrulline |
|
|
瓜氨酸是乳酸菌ADI途径的中间产物,也是食品发酵中有害物质EC (Ethyl carbamate)的重要前体物质。已有报道食品发酵过程中分离的部分乳酸菌具有重吸收瓜氨酸的功能,但对其吸收瓜氨酸的机制缺乏系统的研究[8-10]。目前有关瓜氨酸转运蛋白的研究仅有清酒乳杆菌的PTP基因[9],且仅通过基因敲除实验假设,对其功能、活性、结构、应用等方面的研究有待进一步开展。
本研究选择具有较强瓜氨酸吸收功能的短乳杆菌2-34,对其中两个可能的编码转运蛋白的基因在大肠杆菌C43(DE3)中进行异源表达,同时利用Duet-1TM系列表达载体,实现了ADI途径中瓜氨酸代谢相关蛋白的多顺反子串联表达及双质粒表达,通过高效液相色谱法测定重组菌株利用精氨酸、吸收瓜氨酸的情况。在诱导相关转运蛋白及代谢酶重组表达的同时或之后加入精氨酸,重组菌株均能吸收利用精氨酸并形成瓜氨酸,但含有重组转运蛋白DcuC和AO antiporter的重组菌发酵液中瓜氨酸含量显著降低。进一步通过直接添加瓜氨酸证实了两种转运蛋白对瓜氨酸的吸收功能。同时,我们也发现DcuC蛋白具有较强的瓜氨酸吸收功能,而AO antiporter对精氨酸和瓜氨酸均具有一定的转运能力,且其对瓜氨酸的转运活性低于DcuC蛋白,这与报道的D39中ArcE[10]对多种氨基酸的亲和力具有相似之处。本研究为探索乳酸菌ADI途径中瓜氨酸转运机制及利用提供了线索,也为进一步降低黄酒中EC前体物提供了理论依据。
致谢: 感谢蔡国林老师提供的改稿意见,感谢方芳教授和邓禹教授对研究所用菌株和质粒的惠赠。| [1] |
Xie GF. Brewing Technology of Yellow Rice Wine[M]. Beijing: China Light Industry Press, 2010: 18. (in Chinese) 谢广发. 黄酒酿造技术[M]. 北京: 中国轻工业出版社, 2010: 18. |
| [2] |
Wang RR, Li XM, Chen L, et al. Detection of biogenic amines produced by lactic acid bacteria isolated from the fermentation process of Chinese rice wine[J]. Food and Fermentation Industries, 2017, 43(1): 12-17. (in Chinese) 王然然, 李晓敏, 陈柳, 等. 黄酒发酵过程中乳酸菌的分离及对其产生物胺能力的评价[J]. 食品与发酵工业, 2017, 43(1): 12-17. |
| [3] |
Wu SJ, Wang HX. Research advancement of ethyl carbamate in fermented food[J]. Chemistry & Bioengineering, 2009, 26(9): 15-19. (in Chinese) 吴世嘉, 王洪新. 发酵食品中氨基甲酸乙酯的研究进展[J]. 化学与生物工程, 2009, 26(9): 15-19. |
| [4] |
Li XM, Wang PH, Wu DH, et al. Isolation, identification and characterization of citrulline-producing lactic acid bacteria from fermenting liquid of yellow rice wine[J]. Liquor-making Science & Technology, 2015(6): 11-15. (in Chinese) 李晓敏, 王霈虹, 吴殿辉, 等. 黄酒发酵液中产瓜氨酸乳酸菌的分离鉴定与评价[J]. 酿酒科技, 2015(6): 11-15. |
| [5] |
Wang PH. Study on ethyl carbamate during the production of Chinese rice wine[D]. Wuxi: Master's Thesis of Jiangnan University, 2014 (in Chinese) 王霈虹.黄酒生产过程中氨基甲酸乙酯的研究[D].无锡: 江南大学硕士学位论文, 2014 |
| [6] |
Yu W, Li XM, Lu J, et al. Citrulline production by lactic acid bacteria in Chinese rice wine[J]. Journal of the Institute of Brewing, 2018, 124(1): 85-90. DOI:10.1002/jib.475 |
| [7] |
Yu W. Study on citrulline accumulation by Lactic acid bacteria isolated from Chinese rice wine fermentation[D]. Wuxi: Master's Thesis of Jiangnan University, 2018 (in Chinese) 禹伟.分离自黄酒发酵液的乳酸菌积累和降低瓜氨酸的研究[D].无锡: 江南大学硕士学位论文, 2018 |
| [8] |
Vrancken G, Rimaux T, Weckx S, et al. Environmental pH determines citrulline and ornithine release through the arginine deiminase pathway in Lactobacillus fermentum IMDO 130101[J]. International Journal of Food Microbiology, 2009, 135(3): 216-222. DOI:10.1016/j.ijfoodmicro.2009.07.035 |
| [9] |
Rimaux T, Rivière A, Hebert EM, et al. A putative transport protein is involved in citrulline excretion and re-uptake during arginine deiminase pathway activity by Lactobacillus sakei[J]. Research in Microbiology, 2013, 164(3): 216-225. DOI:10.1016/j.resmic.2012.11.004 |
| [10] |
Noens EEE, Lolkema JS. Convergent evolution of the arginine deiminase pathway: the ArcD and ArcE arginine/ornithine exchangers[J]. MicrobiologyOpen, 2017, 6(1): e00412. DOI:10.1002/mbo3.412 |
| [11] |
Ma R, Xu H, Ding R, et al. The strategy of gene coexpression in Escherichia coli[J]. China Biotechnology, 2012, 32(4): 117-122. (in Chinese) 马蓉, 徐昊, 丁锐, 等. 大肠杆菌多基因共表达策略[J]. 中国生物工程杂志, 2012, 32(4): 117-122. |
| [12] |
Geng FT, Zhao XY, Gao S. The strategy of coexpression in Escherichia coli[J]. Letters in Biotechnology, 2007, 18(2): 339-341. (in Chinese) 耿风廷, 赵晓瑜, 高珊. 多基因在大肠杆菌中的共表达策略[J]. 生物技术通讯, 2007, 18(2): 339-341. DOI:10.3969/j.issn.1009-0002.2007.02.049 |
| [13] |
Zhu QD. Metabolic engineering of Escherichia coli for resveratrol production[D]. Wuxi: Master's Thesis of Jiangnan University, 2016 (in Chinese) 朱屹东.代谢工程改造大肠杆菌生产白藜芦醇[D].无锡: 江南大学硕士学位论文, 2016 |
| [14] |
Classen E, Groth G. Cloning, expression and purification of orthologous membrane proteins: a general protocol for preparation of the histidine sensor kinase ETR1 from different species[J]. Molecular Membrane Biology, 2012, 29(2): 26-35. |
| [15] |
Tian Y. The Construction of recombinant E. coli producing isobutanol[D]. Changsha: Master's Thesis of Central South University of Forestry and Technology, 2013 (in Chinese) 田宇.产异丁醇大肠杆菌工程菌的构建[D].长沙: 中南林业科技大学硕士学位论文, 2013 |
 2019, Vol. 46
2019, Vol. 46