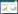扩展功能
文章信息
- 白滨, 文朝慧, 何苏琴, 甘延林
- BAI Bin, WEN Zhao-Hui, HE Su-Qin, GAN Yan-Lin
- 莴笋炭疽病病原鉴定
- Anthracnose of lettuce caused by Marssonina panattoniana in Gansu province
- 微生物学通报, 2019, 46(9): 2241-2248
- Microbiology China, 2019, 46(9): 2241-2248
- DOI: 10.13344/j.microbiol.china.190168
-
文章历史
- 收稿日期: 2019-03-06
- 接受日期: 2019-05-28
- 网络首发日期: 2019-06-13
2. 农业农村部农产品质量安全风险评估实验室(兰州) 甘肃 兰州 730070;
3. 甘肃出入境检验检疫局检验检疫综合技术中心 甘肃 兰州 730010;
4. 甘肃省农业科学院植物保护研究所 甘肃 兰州 730070;
5. 农业农村部天水作物有害生物科学观测实验站 甘肃 天水 741200;
6. 甘肃省永登县武胜驿镇政府 甘肃 永登 730317
2. Laboratory of Quality & Safety Risk Assessment for Agro-products (Lanzhou), Ministry of Agriculture and Rural Affairs, P. R. China, Lanzhou, Gansu 730070, China;
3. Comprehensive Technical Center of Gansu Entry-Exit Inspection and Quarantine Bureau, Lanzhou, Gansu 730010, China;
4. Institute of Plant Protection, Gansu Academy of Agricultural Sciences, Lanzhou, Gansu 730070, China;
5. Scientific Observing and Experimental Station of Crop Pests in Tianshui, Ministry of Agriculture and Rural Affairs, P. R. China, Tianshui, Gansu 741200, China;
6. Government of Wushengyi Town, Yongdeng County, Gansu Province, Yongdeng, Gansu 730317, China
莴苣炭疽病是一种世界性、重要的莴苣病害,依据病害的症状特点,又被称为穿孔病、环斑病和锈病等[1-2]。由Marssonina panattoniana (Berl.) Magnus引起的莴苣炭疽病最初由Berlese (1895年)报道发生于意大利[1, 3]。病害现已广泛分布于世界各地,包括非洲的利比亚和毛里求斯;亚洲的日本、黎巴嫩、菲律宾和土耳其;大洋洲的澳大利亚和新西兰;欧洲的奥地利、英国、保加利亚、法国、德国、希腊、匈牙利、意大利、荷兰、瑞典、瑞士、俄罗斯和南斯拉夫;北美洲的加拿大和美国[4]。病害的发病率通常很低,但在有利的气候条件下,可导致严重的损失,例如1983年春季在美国加州发生强降雨期间,及1985年夏季在英国发生强降雨期间[2]。近年来,由于气候变化,寒冷潮湿的天气在冬春季越来越普遍,炭疽病成为澳大利亚莴苣生产中的主要病害,每年可造成约1千万美元的损失[5]。
在我国,对该病害的研究报道极少,仅新疆的北疆地区有病害发生的报道,罹病莴苣生长瘦小纤弱,品质产量都受到不同程度的影响,重病田块莴苣死亡率可达80%以上[6-7]。
莴笋(Lactuca sativa var. angustata Irish ex Bremer),又称茎用莴苣,为菊科莴苣属一、二年生草本植物,茎粗或极粗,供食用与制备酱菜,叶作蔬菜用,全国各地均有栽培[8]。甘肃省永登县武胜驿镇属半干旱半湿润的二阴山区,区域内海拔2 300−2 900 m,年降雨量400−650 mm,年平均气温3.6−7.2 ℃,全年无霜期70−140 d,≥10 ℃的活动积温1 080 ℃[9]。莴笋为半耐寒、喜冷凉蔬菜,非常适宜在武胜驿镇种植。该镇从2013年开始进行莴笋的引种和试种,2015年起莴笋种植面积迅速扩大,到2018年武胜驿镇莴笋种植面积达1 000 hm2,仅石家滩、缸子沟、黑林3个村的种植面积就达667 hm2。种植莴笋的收益已成为当地农民重要的经济来源。
2018年7−8月,武胜驿镇种植的莴笋上发生了严重、疑似炭疽病的病害。莴笋叶片和茎受害,产生大量黄褐色至褐色病斑。叶片上的病斑水浸状,圆形或因受叶脉限制呈角状,(1−3) mm×(1−5) mm,后期病灶中心坏死脱落形成孔洞;中脉和茎上的病斑凹陷明显,病斑近圆形、长椭圆形或梭形,中脉上病斑的长度可达10 mm。约40%的地块发病,绝收面积达10%,海拔2 600−2 750 m的石家滩、缸子沟、黑林3个村为重病区。本研究旨在明确该病害的病原,为病害科学防治提供依据。
1 材料与方法 1.1 病害标样采集2018年8月16日,从甘肃省永登县武胜驿镇石家滩采集典型症状的莴笋病株20株,带回实验室,用于镜检和病原菌分离(图 1A-C)。

|
| 图 1 莴笋炭疽病症状 Figure 1 Symptoms of lettuce anthracnose 注:A−C:自然发病症状;D−G:莴笋离体叶片接种菌株Lett-11后的发病症状(10−20 ℃,20 d). Note: A−C: Symptoms in field; D−G: Symptoms of inoculating strain Lett-11 on detached lettuce leaves (10−20 ℃, 20 d). |
|
|
PDA (g/L):马铃薯200.0,葡萄糖20.0,琼脂粉12.0。PDB (g/L):马铃薯200.0,葡萄糖20.0。WA (水琼脂培养基) (g/L):琼脂粉12.0。
1.3 主要试剂和仪器Universal Genomic DNA Extraction Kit、PCR扩增引物、Taq DNA聚合酶、琼脂糖凝胶回收试剂盒,宝生物工程(大连)有限公司。HITACHI CT15RE高速离心机,日立公司;梯度PCR扩增仪,ABI公司。
1.4 病原菌镜检和分离用灭菌的解剖刀和接种针挑取少许病组织,置载玻片上,以蒸馏水为浮载剂,镜检病原菌分生孢子产生情况并测量其大小(≥30个数值)。
采用组织分离法,自叶片的独立病斑上取病健交界处组织(每个病斑取1块,大小约5 mm×5 mm),经75%乙醇表面消毒5 s,灭菌水冲洗4次,置PDA平板上20 ℃黑暗培养,及时挑取菌落尖端菌丝进行纯化,纯化后的菌株接种于PDA斜面保存。
1.5 致病性测定菌株Lett-11在PDA平板10 ℃培养14 d,取大小约3 mm×3 mm菌丝块接种于莴笋离体叶片上(叶片取自市售健康莴笋,品种不详;叶片经0.02%次氯酸钠消毒5 s,再用自来水冲洗干净),每叶片接种4枚菌丝块,以接种相同大小的无菌PDA培养基块为对照。每处理12个叶片,置于放有湿滤纸的直径20 cm培养皿内,10−20 ℃、自然散射光下保湿培养。24 h后,移去叶片上的接种菌丝块和无菌PDA培养基块,继续保湿培养。随时观察接种叶片的发病情况,20 d后调查发病率,并对发病叶片进行病原菌的重分离。
1.6 病原菌适宜生长温度测定及形态特征观察设置10、15、20、25和30 ℃ 5个温度。试验菌株在PDA平板上15 ℃黑暗培养15 d后,用灭菌刀切取大小约3 mm×3 mm的菌丝块,接种于PDA平板中央,置不同温度下恒温黑暗培养,重复5皿。培养14 d和20 d时用十字交叉法测量菌落直径。观察不同温度条件下菌落形态。
试验菌株在PDA平板上20 ℃和10 ℃培养7−14 d,观察、测量分生孢子梗、产孢细胞、分生孢子和微菌核的形态和大小,另外观察测量试验菌株在WA平板上20 ℃培养7 d的产孢细胞和分生孢子大小,每个目标的测量≥30个数值。依据病菌培养特征和显微形态特征进行种类鉴定。
1.7 病原菌分子生物学鉴定 1.7.1 DNA提取及测序取在PDB中20 ℃培养14 d的菌株Lett-11的菌丝,利用Universal Genomic DNA Extraction Kit按使用说明提取总DNA。选用真菌通用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TC CTCCGCTTATTGATATGC-3′)扩增其ITS基因[10]。PCR反应体系(25 μL):10×PCR reaction buffer 2.5 μL,dNTPs (2.5 mmol/L) 1 μL,引物ITS1/ITS4 (10 μmol/L)各0.5 μL,Taq DNA polymerase (5 U/μL) 0.3 μL,DNA模板2 μL,ddH2O 18.2 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 min,35个循环;72 ℃ 10 min,4 ℃保存。用1.0%琼脂糖凝胶电泳检测PCR产物,紫外灯下切取凝胶中的目的条带,利用琼脂糖凝胶回收试剂盒按使用说明回收纯化,测序工作委托金唯智生物科技有限公司完成。测序结果在NCBI数据库进行BLASTn分析,并提交GenBank获得接受号。
1.7.2 构建系统发育树基于试验菌株的rDNA-ITS区序列构建系统发育树:从GenBank核酸序列数据库中下载相关菌株的rDNA-ITS序列(表 1),以Diplocarpon mespil为外群,用ClustalX 1.83软件对目的序列进行比对(Alignment),比对后的序列用MEGA 6.0软件的NJ法构建系统发育树[11],进行1 000次Bootstrap检验计算系统树中节点的置信度。
| 种类 Species |
序列号 Accession No. |
菌株编号 Strain No. |
寄主 Host |
地理来源 Locality |
| Marssonina brunnea | KM246325.1 | BHHB1 | Populus tomentosa | China |
| Marssonina brunnea | KM246338.1 | ROHY8253a1 | Populus tomentosa | China |
| Marssonina coronariae | FJ606798.1 | wgl | − | − |
| Marssonina coronariae | EU329734.1 | ZXR-YL-Ye-2 | − | − |
| Marssonina panattoniana | MH854831.1 | CBS 163.25 | − | − |
| Marssonina rosae | KP099199.1 | CFCC6814 | Rosa chinensis | China |
| Marssonina rosae | FJ493249.1 | RM080715008 | Rosa chinensis | China |
| Diplocarpon mespili | EF600984.1 | KACC 42361 | Raphiolepis umbellata | South Korea |
| 注:−:不祥. Note: −: Unknown. | ||||
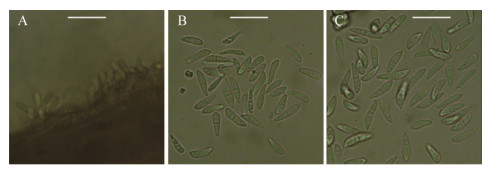
镜检发现叶片和茎上的病斑上产生大量分生孢子盘(分生孢子座)及无色、双细胞分生孢子(图 2)。分生孢子大小为(10.82−18.65) μm×(2.98−4.48) μm,平均(14.72±1.63) μm×(3.82±0.34) μm;长宽比2.79−5.00,平均3.88±0.52。
|
| 图 2 产生于自然发病叶片上的分生孢子盘和分生孢子 Figure 2 Microscopic morphology of acervuli and conidia borned on naturally diseased leaf 注:A:分生孢子盘;B−C:分生孢子;标尺:A−C=20 μm. Note: A: Acervuli; B−C: Conidia; Scale bar: A−C=20 μm. |
|
|
从15块病组织(取自15个独立的病斑)的3块上分离得到3株生长极缓慢、形态特征相似的目标真菌。选择其中的Lett-11为代表性菌株进行后续的研究工作。
2.2 致病性接种后7−10 d,接种叶片开始发病显症。接种后20 d,发病率达100%。接种莴笋离体叶片的发病症状与自然发病症状相似。对照未发病。发病叶片原接种菌的分出率达100% (图 1D-G)。
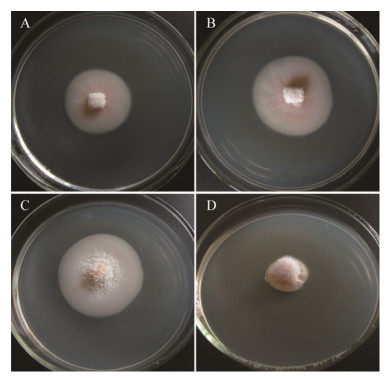
2.3 病原菌适宜生长温度及形态特征菌株Lett-11的适宜生长温度为15−20 ℃ (图 3),20 ℃培养14 d,菌落直径20.7−24.0 mm。在PDA平板上,菌落肉粉色(Flesh),气生菌丝白色稀疏(20 ℃),或几乎没有气生菌丝(10 ℃和15 ℃),菌落边缘整齐(图 4)。

|
| 图 3 温度对菌株Lett-11菌丝生长的影响 Figure 3 Effect of temperature on mycelial growth of strain Lett-11 注:PDA培养基,黑暗培养. Note: Potato dextrose agar in the dark. |
|
|
|
| 图 4 菌株Lett-11的菌落形态特征 Figure 4 Colony morphology of Marssonina panattoniana strain Lett-11 注:A−D:不同温度下培养20 d菌落形态(PDA培养基,培养皿内径72 mm). A:10 ℃;B:15 ℃;C:20 ℃;D:25 ℃. Note: A−D: Cultured 20 d at different temperatures (PDA medium, Petri dish inner diameter 72 mm). A: 10 ℃; B: 15 ℃; C: 20 ℃; D: 25 ℃. |
|
|
Let-11在PDA和WA平板上培养7 d,产生大量分生孢子。产孢细胞无色,圆柱状、安瓿瓶形至不规则形;支持产孢细胞的分生孢子梗可以形成也可以不形成,无色,稀疏分枝,分枝顶部生1−4个产孢细胞;分生孢子无色,梭形,稍弯曲,基部平截、钝圆或尖锐,多数具一个隔膜(偶见2−3个隔膜),2个细胞不等大,可萌生次生分生孢子。不同培养条件下产孢细胞和分生孢子大小差异较大;即使相同条件下,产孢细胞和分生孢子的大小和形状也有较大差异(表 2,图 5A-H)。微菌核近球形,淡色(肉粉色),55.0−75.0 μm (图 5I),仅在10 ℃培养14 d的PDA平板上观察到。
| 培养基 Medium |
培养条件 Culture condition |
产孢细胞大小 Size of conidiogenous cells (μm) |
分生孢子Conidia | |
| 大小Size (μm) | 长宽比Length/Width ratio | |||
| PDA | 7 d, 20 ℃ | (9.70−23.87)×(2.09−2.98) av. (15.97±3.58)×(2.51±0.37) | (10.44−19.40)×(2.61−4.48) av. (14.46±2.28)×(3.46±0.44) | 2.60−5.78 av. 4.25±0.86 |
| WA | 7 d, 20 ℃ | (4.48−17.90)×(2.24−4.10) av. (10.31±3.05)×(2.96±0.45) | (7.46−13.43)×(2.98−5.22) av. (10.48±1.63)×(3.77±0.80) | 1.43−4.05 av. 2.88±0.66 |
| PDA | 7 d, 10 ℃ | (11.19−19.40)×(1.12−2.98) av. (14.92±2.56)×(2.40±0.49) | (6.69−20.14)×(2.11−3.52) av. (13.24±1.83)×(2.94±0.34) | 2.26−6.81 av. 4.59±0.90 |

|
| 图 5 菌株Lett-11显微形态特征 Figure 5 Microscopic features of Marssonina panattoniana strain Lett-11 注:A−E:WA培养基,20 ℃培养7 d;A−C:分生孢子梗和产孢细胞;D,E:分生孢子;F,G:PDA培养基,20 ℃培养7 d,示分生孢子及其萌生的次生分生孢子;H,I:PDA培养基,10 ℃培养7−14 d;H:分生孢子;I:微菌核;标尺:A−H=20 μm,I=30 μm. Note: A−E: Cultured 7 d at 20 ℃, WA medium; A−C: Conidiophores and conidiogenous cells; D, E: Conidia; F, G: Cultured 7 d at 20 ℃, PDA medium, showed conidia and secondary conidia; H, I: Cultured 7−14 d at 10 ℃, PDA medium; H: Conidia; I: Microsclerotia; Scale bar: A−H=20 μm, I=30 μm. |
|
|
通过与文献[3-4]中描述的相关真菌的形态特征进行比对,并依据Mycobank中对Marssonina panattoniana的定义[12],将菌株Lett-11鉴定为莴苣盘二孢菌Marssonina panattoniana (Berlese) Magnus [Synonymy: Microdochium panattonianum (Berl.) B. Sutton, Galea & T.V. Price]。
2.4 病原菌的分子生物学鉴定BLASTn分析结果显示,Lett-11 (GenBank登录号MK252097)的rDNA-ITS序列与Marssonina panattoniana (GenBank登录号MH854831.1)序列相似性达99%。同源性比对结果与形态学鉴定结果一致。
试验菌株Lett-11在系统发育树中与Marssonina panattoniana菌株CBS 163.25聚为一支(图 6)。

|
| 图 6 试验菌株Lett-11基于rDNA-ITS序列构建的系统发育树 Figure 6 Phylogenetic trees based on rDNA-ITS sequences of tested strain Lett-11 注:分支上的数据表示Bootstrap检验的支持百分率,自展支持值(Bootstrap) > 50%的显示在各个进化分支节点上;以Diplocarpon mespil为外群,粗体显示为本研究的试验菌株;括号内为GenBank序列号及菌株编号;图中标尺代表位点的碱基替代率. Note: The confidence values over 50% from 1 000 replicate bootstrap samplings are shown at each node. Diplocarpon mespil is an outgroup, isolate in this research shows in bold. GenBank accession numbers and strain numbers are shown in the parentheses. Scale bar indicates the base substitution rate. |
|
|
经病原菌分离、科赫氏法则证病,及病原菌形态学和分子生物学鉴定,将甘肃省永登县武胜驿镇莴笋炭疽病的病原鉴定为莴苣盘二孢菌Mar. panattoniana (Berlese) Magnus。
Mar. panattoniana (=Mic. panattonianum)是寄主专化性较强的病菌,其寄主包括莴苣Lactuca sativa L.,野莴苣Lactuca serriola L.和Lactuca scariola L.,苦苣Cichorium endivia L.[4]。但从北海道的莴苣病叶中分离到的Mar. panattoniana仅对莴苣有致病性,对菊苣属Cichorium spp.和其他菊科植物无致病性[13]。除了影响田间的莴苣生长外,该菌也是莴苣采后病害的潜在病原[2]。
不同来源(不同菌株及不同基质上)的Mar. panattoniana (=Mic. panattonianum)的分生孢子大小上存在差异;在3−26 ℃和pH 4.0−5.2条件下分生孢子可萌发;分生孢子在没有游离水的情况下不会萌发;芽管在20 ℃和pH 5.2条件下生长最佳;15−20 ℃时菌落生长最优;在MEA (Malt extract agar)培养基上20 ℃培养,2−7 d内分生孢子的产量呈对数增长[3]。
Mar. panattoniana (=Mic. panattonianum)的分生孢子萌发后可直接穿透寄主表皮细胞,72 h内在叶片组织中广泛定殖,96 h后可形成坏死斑并产孢;在温度 > 5 ℃时,接种后随着叶片湿润期的增加,侵染水平增加;最佳侵染条件是叶片湿润期 > 8 h和15 ℃[14]。
Mar. panattoniana (=Mic. panattonianum)的分生孢子在土壤里的病残体中可存活18周,在干燥的病残体中可以存活78周[5, 15]。在美国加利福尼亚的萨利纳斯山谷,土壤中病残体上的微菌核的存活时间可长达4年[16];但在澳大利亚的罹病莴苣叶片上未检测到微菌核,微菌核仅在培养中产生[5, 17]。
在本研究中,病原真菌的分出率只有20%,究其原因主要是病原菌生长极慢,病组织容易被生长速度较快的交链孢菌和镰刀菌等干扰和覆盖。直接从病斑上挑取病菌的分生孢子进行培养可能更易获得病菌的纯培养物。本研究分离得到的病原菌的形态特征和生物学特性与国外已有报道[3]基本一致,在自然发病寄主组织上及不同培养条件下分生孢子大小差异较大,即使在相同条件下,分生孢子的大小和形状也有较大差异;病菌的适宜生长温度为15−20 ℃。病菌的寄主范围及在当地自然条件下的存活时间等尚待研究。甘肃省兰州市永登县武胜驿镇莴笋炭疽病的暴发流行,与该地区2018年7−8月的多降雨(7月份降水量51.1 mm,8月份降水量91.7 mm)造成的寒冷潮湿天气及莴笋大面积重茬种植密切相关。这是莴苣盘二孢菌Mar. panattoniana引起莴笋炭疽病在甘肃的首次报道。
鉴于莴笋炭疽病危害的严重性,应引起有关部门的高度重视,积极开展相关研究,制定防治对策。
| [1] |
Brandes EW. Anthracnose of lettuce caused by Marssonina panattoniana[J]. Journal of Agricultural Research, 1918, 13(5): 261-280. |
| [2] |
Moline HE, Pollack FG. Conidiogenesis of Marssonina panattoniana and its potential as a serious postharvest pathogen of lettuce[J]. Phytopathology, 1976, 66(5): 669-674. DOI:10.1094/Phyto-66-669 |
| [3] |
Galea VJ, Price TV, Sutton BC. Taxonomy and biology of the lettuce anthracnose fungus[J]. Transactions of the British Mycological Society, 1986, 86(4): 619-628. DOI:10.1016/S0007-1536(86)80065-1 |
| [4] |
Sutton BC, Holderness M. IMI descriptions of fungi and bacteria No. 1034 (Microdochium panattonianum)[J]. Mycopathologia, 1991, 114: 51-52. |
| [5] |
Rogers G, Kimpton T. Project VG10123 Developing a strategy to control Anthracnose in lettuce[EB/OL]. [2018-09-04]. http:// www.ahr.com.au/wp-content/uploads/2015/03/Developing-a-strategy-to-control-Anthracnose-in-lettuce.pdf
|
| [6] |
Jia JS, He HM, Sun XH. The shot-hole disease of lettuce was found in Xinjiang[J]. Plant Protection, 1991, 17(1): 50. (in Chinese) 贾菊生, 何海明, 孙秀华. 新疆发现莴苣穿孔病[J]. 植物保护, 1991, 17(1): 50. |
| [7] |
He HM. Occurrence and control of lettuce shot-hole disease[J]. Plant Protection Technology and Extension, 1997, 17(4): 26. (in Chinese) 何海明. 莴苣穿孔病的发生及防治[J]. 植保技术与推广, 1997, 17(4): 26. |
| [8] |
Lin R, Shi Z. Flora Reipublicae Popularis Sinicae, Volume 80(1)[M]. Beijing: Science Press, 1997: 233-235. (in Chinese) 林镕, 石铸. 中国植物志, 第80(1)卷[M]. 北京: 科学出版社, 1997: 233-235. |
| [9] |
Xu XJ, Wei GQ. Analysis and suggestion on production status of mini Chinese cabbage in Wushengyi Town[J]. Scientific & Technical Information of Gansu, 2015, 44(7): 125-126. (in Chinese) 徐学军, 魏桂琴. 武胜驿娃娃菜生产现状分析及建议[J]. 甘肃科技纵横, 2015, 44(7): 125-126. DOI:10.3969/j.issn.1672-6375.2015.07.046 |
| [10] |
White TJ, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[A]//Innis MA, Gelfand DH, Sninsky JJ, et al. PCR Protocols: A Guide to Methods and Applications[M]. San Diego, California: Academic Press, 1990: 315-322
|
| [11] |
Tamura K, Stecher G, Peterson D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013(20): 2725-2729. |
| [12] |
Marssonina panattoniana[EB/OL]. [2019-03-05]. http://www. mycobank.org/Biolomics.aspx?Table=Mycobank&MycoBankNr_=100649
|
| [13] |
Horita H, Yasuoka S, Ozawa S, et al. Anthracnose of lettuce caused by Microdochium panattonianum in Hokkaido[J]. Annual Report of the Society of Plant Protection of North Japan, 2001(52): 42-44. |
| [14] |
Galea VJ, Price TV. Infection of lettuce by Microdochium panattonianum[J]. Transactions of the British Mycological Society, 1988, 91(3): 419-425. DOI:10.1016/S0007-1536(88)80117-7 |
| [15] |
Galea VJ, Price TV. Survival of the lettuce anthracnose fungus (Microdochium panattonianum) in Victoria[J]. Plant Pathology, 1988, 37(1): 54-63. DOI:10.1111/j.1365-3059.1988.tb02195.x |
| [16] |
Patterson CL, Grogan RG. Role of microsclerotia as primary inoculum of Microdochium panattonianum, incitant of lettuce anthracnose[J]. Plant Disease, 1991, 75(2): 134-138. DOI:10.1094/PD-75-0134 |
| [17] |
Parman N, Price TV. Production of microsclerotia by Microdochium panattonianum[J]. Australasian Plant Pathology, 1991, 20(2): 41-46. DOI:10.1071/APP9910041 |
 2019, Vol. 46
2019, Vol. 46