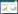扩展功能
文章信息
- 韩燕峰, 邵秋雨, 杨娟, 张延威, 陈万浩, 梁建东, 梁宗琦
- HAN Yan-Feng, SHAO Qiu-Yu, YANG Juan, ZHANG Yan-Wei, CHEN Wan-Hao, LIANG Jian-Dong, LIANG Zong-Qi
- 来自土壤的金孢属四个新记录种
- Four new soil-inhabiting Chrysosporium records
- 微生物学通报, 2019, 46(9): 2207-2213
- Microbiology China, 2019, 46(9): 2207-2213
- DOI: 10.13344/j.microbiol.china.180780
-
文章历史
- 收稿日期: 2018-10-10
- 接受日期: 2019-01-23
- 网络首发日期: 2019-02-19
2. 贵州师范学院生物科学学院 贵州 贵阳 550018;
3. 贵阳中医学院基础医学院 贵州 贵阳 550025
2. School of Biological Sciences, Guizhou Education University, Guiyang, Guizhou 550018, China;
3. School of Basic Medical Science, Guiyang College of Traditional Chinese Medicine, Guiyang, Guizhou 550025, China
金孢属(Chrysosporium)是Corda等于1833年以革质金孢C. corii为模式种所建立[1-3]。它的有性型分属于爪甲团囊菌目(Onygenales)和粪壳菌目(Sordariales)[4-5]。根据2018年10月Index Fungorum (http://www. indexfungorum.org/names/Names.asp)记载,金孢属迄今已报道了102个种名,经作者对文献研究和总结,除去同物异名和无效种,目前有70多种。国内对金孢属的研究最早是由梁宗琦先生于1991年报道了分离自冬虫夏草上的一个金孢新种,并将其命名为中国金孢。之后一些学者先后发表了一些新种和新记录种,目前共有22种(表 1)。为了摸清我国嗜角蛋白真菌资源的地理分布和了解其物种多样性,近年来作者团队在对我国嗜角蛋白真菌资源调查中,从鸟窝羽毛或利用鸡毛和头发进行钓饵富集的土壤和污泥样品等基质上,分离获得一批金孢菌株,经形态学特征和分子系统学发育分析,已报道一些新种如荆州金孢C. jingzhouense Y.W. Zhang, Y.F. Han & Z.Q. Liang和棒孢金孢C. clavisporum Y.W. Zhang, Y.F. Han & Z.Q. Liang[6],贵州金孢C. guizhouense Y.W. Zhang, Y.F. Han & Z.Q. Liang和湖北金孢C. hubeiense Y.W. Zhang, Y.F. Han & Z.Q. Liang[7],雷公山金孢C. leigongshanense Z. Li, G.P. Zeng & Y.F. Han[8],山西金孢C. shanxiense Y.W. Zhang, W.H. Chen, X. Zou, Y.F. Han & Z.Q. Liang[9],三亚金孢C. sanyaense Y.W. Zhang, Y.F. Han, J.D. Liang & Z.Q. Liang[10],青海金孢C. qinghaiense Y.F. Han, Y.R. WANG, J.D. Liang & Z.Q. Liang[11],侧生金孢Chrysosporium laterisporum Z. Li, Y.W. Zhang, W.H. Chen & Y.F. Han和卵形金孢Chrysosporium ovalisporum Z. Li, Y.W. Zhang, W.H. Chen & Y.F. Han (2019)[12]。现从我国甘肃、云南等地的土壤中,分离获得5个菌株,经形态特征和系统发育分析相结合研究,鉴定为节状金孢、乔治金孢、水生金孢和轮带金孢这4个种,为我国新记录种。
| 序号No. | 学名 Scientific names |
| 1 | 阿尔维亚金孢Chrysosporium alvearium F. Liu & L. Cai (2018) |
| 2 | 穴形节皮菌的金孢属无性型Chrysosporium anamorph of Arthroderma cuniculi (Dawson) C.A.N. van Oorschot (1980) |
| 3 | 具刺裸囊菌的金孢属无性型Chrysosporium anamorph of Gymnoascus exasperatus Z.F. Zhang, F. Liu & L. Cai (2017) |
| 4 | 棒孢金孢Chrysosporium clavisporum Y.W. Zhang, Y.F. Han & Z.Q. Liang (2017) |
| 5 | 法斯特金孢Chrysosporium fastidium Pitt T. Matsushima & H. Asahina (1958) |
| 6 | 贵州金孢Chrysosporium guizhouense Y.W. Zhang, Y.F. Han & Z.Q. Liang (2016) |
| 7 | 湖北金孢Chrysosporium hubeiense Y.W. Zhang, Y.F. Han & Z.Q. Liang (2016) |
| 8 | 印度金孢Chrysosporium indicum (H.S. Randhawa & R.S. Sandhu) Garg (1966) |
| 9 | 荆州金孢Chrysosporium jingzhouense Y.W. Zhang, Y.F. Han & Z.Q. Liang (2017) |
| 10 | 嗜毛金孢Chrysosporium keratinophilum D. Frey ex J.W. Carmich. (1962) |
| 11 | 侧生金孢Chrysosporium laterisporum Z. Li, Y.W. Zhang, W.H. Chen & Y.F. Han (2019) |
| 12 | 雷公山金孢Chrysosporium leigongshanenseZ. Li, G.P. Zeng & Y.F. Han (2017) |
| 13 | 临汾金孢Chrysosporium linfenense Z.Q. Liang, J.D. Liang & Y.F. Han (2009) |
| 14 | 裂叶金孢Chrysosporium lobatum Scharapov (1978) |
| 15 | 粪生金孢Chrysosporium merdarium var. merdarium (Ehrenb.) J.W. Carmich. (1962) |
| 16 | 卵形金孢Chrysosporium ovalisporum Z. LI, Y.W. Zhang, W.H. Chen & Y.F. Han (2019) |
| 17 | 毡状金孢Chrysosporium pannorum (Link) S. Hughes (1958) |
| 18 | 青海金孢Chrysosporium qinghaiense Y.F. Han, Y.R. WANG, J.D. Liang & Z.Q. Liang (2013) |
| 19 | 三亚金孢Chrysosporium sanyaense Y.W. Zhang, Y.F. Han, J.D. Liang & Z.Q. Liang (2013) |
| 20 | 山西金孢Chrysosporium shanxiense Y.W. Zhang, W.H. Chen, X. Zou, Y.F. Han & Z.Q. Liang (2016) |
| 21 | 中国金孢Chrysosporium sinense Z.Q. Liang (1991) |
| 22 | 热带金孢 Chrysosporium tropicum J.W. Carmich. (1962) |
DNA提取试剂盒、Master Mix,北京百泰克生物技术有限公司;光照显微镜,奥林巴斯(中国)有限公司;PCR仪,Bio-Rad公司;引物合成由擎科生物技术有限公司;PDA培养基,博威科技有限公司。
1.2 菌株的分离和描述本研究是从我国甘肃、云南采集的土壤样品。将鸡毛和头发段与土样混合,保湿培养1个月。挑取长有真菌的毛发进行直接分离,同时采用梯度稀释平板法对土壤中金孢菌株进行分离:称取2 g土壤样品,用无菌水稀释至10−1、10−2和10−3三个浓度梯度;每个浓度梯度取1 mL置于9 cm的已灭菌平板中,加入马丁氏培养基混合后,将平板置于25 ℃下培养3 d后,先用显微镜镜检,挑出5个目标菌株H5.11、H10.10、EB8803M、EB8801M和O1至PDA培养皿中,25 ℃下培养7 d或14 d,透明胶带制片进行形态学描述、显微拍照和手绘形态图。活菌经接种3−5个产孢的菌丝体块在已灭菌的30%甘油冻存管中存放于−80 ℃中。培养皿中的培养物在35 ℃烘箱中放置12 h,制作成干标本,保存于中国科学院微生物所菌物标本馆。
1.3 DNA提取及PCR扩增刮取新鲜产孢菌丝,经液氮研磨后,按照真菌DNA提取试剂盒的流程进行DNA的提取。参照Zhang等[6-7]的操作方法,采用通用引物ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)和ITS5 (5′-G GTGAGAGATTTCTGTGC-3′)对ITS1-5.8S-ITS2 rDNA进行PCR扩增。PCR反应体系:ITS4 (10 μmol/L) 1 μL,ITS5 (10 μmol/L) 1 μL,2×Master Mix 12.5 μL,模板(10 ng) 2 μL,无菌水补足25 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。将获得的PCR产物交北京诺赛公司进行测序,得到的序列经校正后提交GenBank (MH577291−MH577295)。
1.4 数据处理和系统发育树的构建经GenBank中BLAST比对后,下载与本研究序列相近的序列以及金孢属相关种的序列共44条,以合川戴氏霉(Taifanglania hechuanensis)为外群,经MAFFT V7.03b[13]进行序列比对及手工校正后,保存为FASTA格式。使用MrBayes 3.2进行贝叶斯推理法(Bayesian inference,BI)分析[14],经Model test 3.7[15]检验获得最佳替换模型为K80+G。,位点间差异比率采用分布比率差异(Gamma-distributed rate variation),其中部分为不变位点(A proportion of invariant sites),其余参数为默认值;采用Metropolis-coupled Markov Chain Monte Carlo (MCMCMC)法运算10 000 000代,每500代取样1次,从得到的样本中舍弃25 000个老化样本后总结得到一致树,用TreeView (Page 1996)查看。同时在软件MEGA 6.0中采用最大似然法(ML)经1 000次Bootstrap验证构建系统发育树[16]。
2 结果与分析 2.1 中国新记录种的形态描述(1)节状金孢 图 1

|
| 图 1 节状金孢(HMAS255374) Figure 1 Chrysosporium articulatum (HMAS255374) 注:A:间生孢子;B:产孢结构;C:链状孢子;D:分生孢子. Note: A: Intercalary conidia; B: Conidiogenous structures; C: Chain conidia; D: Conidia. Bars: A–D=20 μm. |
|
|
Chrysosporium articulatum Scharapov, Nov. sist. Niz. Rast. 15: 146, 1978.
在PDA培养基上25 ℃培养7 d,菌落直径71–72 mm,白色,稀疏絮状,边缘规则,隆起,背面淡黄色;菌丝分隔,光滑,透明至半透明,宽1.5 μm–2.3 μm;分生孢子单生或串生,光滑,透明,着生于菌丝上,单胞或双胞,长卵形,(5.8–15.0) μm× (2.5–5.5) μm,或棒状,(10.5–17.0) μm×(3.0–4.3) μm;有间生孢子,单生或链状,光滑,长卵形,(6.8–7.5) μm×(2.5–3.5) μm;厚垣孢子未见;基痕宽度小于1 μm。
研究菌株:H5.11 (HMAS255374,GenBank No. MH577291),2017年7月采自甘肃省玉门关市雅丹地质公园骆驼刺根际土样。菌种保存于贵州大学真菌资源研究所(GZAC),培养物干标本保存于中国科学院微生物所菌物标本馆HMAS255374。
分布:甘肃省,玉门关市。
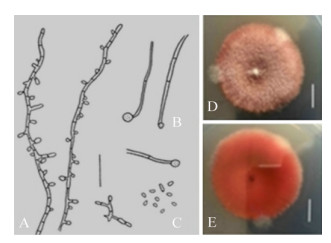
(2)乔治金孢 图 2
|
| 图 2 乔治金孢(HMAS255377) Figure 2 Chrysosporium georgiae (HMAS255377) 注:A:产孢结构;B:厚垣孢子;C:分生孢子;D−E:菌落在PDA培养基上的背面和正面. Note: A: Conidiogenous structures; B: Chlamydospores; C: Conidia; D−E: Colonies on PDA. Bars: A−D=20 μm; E−F=10 mm. |
|
|
Chrysosporium georgiae (Varsavsky & Ajello) Oorschot [as ‘georgii’], Stud. Mycol. 20: 31, 1980.
在PDA培养基上25 ℃培养14 d,菌落直径40–43 mm,绒毛状,中心微隆,边缘不规则,近圆形,背面棕红色。菌丝分隔,光滑,透明,宽0.8 μm–2.6 μm;无球拍状菌丝;分生孢子单生或2个串生,光滑,透明,直接着生于菌丝上或短柄上,棒状,(2.6–5.1) μm×(1.2–1.6) μm;或卵形,(2.2–3.5) μm× (0.9–2.5) μm;或不规则椭圆形,(1.8–3.8) μm× (1.5–2.6) μm;无间生孢子;厚垣孢子偶有,粗糙,(4.3–4.9) μm×(4.6–4.7) μm;基痕宽 < 1 μm。
研究菌株:H10.10 (HMAS255377,GenBank No. MH577292),2017年7月采自甘肃省玉门关市雅丹地质公园骆驼刺根际土样。菌种保存于贵州大学真菌资源研究所(GZAC),培养物干标本保存于中国科学院微生物所菌物标本馆HMAS255377。
分布:甘肃省,玉门关市。
(3)水生金孢 图 3

|
| 图 3 水生金孢(GZACEB8803M) Figure 3 Chrysosporium submersum (GZACEB8803M) 注:A:球拍状菌丝;B−C:产孢结构;D:在PDA培养基上的菌落特征. Note: A: Racquet hyphae; B−C: Conidiogenous structures; D: Colonies on PDA. Bars: A−C=10 μm; D=10 mm. |
|
|
Chrysosporium submersum P. Vidal & Guarro, in Vidal, Valmaseda, ángeles Vinuesa & Guarro, Stud. Mycol. 47: 200, 2002.
在PDA培养基上,14 d,25 ℃,菌落直径50–60 mm,浅黄色,中部粉质,边缘绒毛状,圆形,边缘规则;背面浅黄色;菌丝分隔,光滑,壁薄,分支,宽2.0 μm–3.5 μm;具球拍状菌丝。分生孢子起初透明,光滑,薄壁,成团后变为半透明至淡黄色或厚壁,有时具疣状突起;分生孢子顶生和侧生于短柄、侧枝或膨大的突出上,大多单生,有时成有2–4个孢子组成的短链,主要为棒状,有时梨形、卵圆或近球形,单胞或2–3胞,(4.5–30.0) μm× (2.5–4.5) μm,基痕约1.2 μm–2.5 μm;延长培养后出现间生孢子,柱状,一端膨大或桶状,(6–38) μm× (2–5) μm;厚垣孢子较少,透明,单生,球形至近球形或不规则,光滑,厚壁,5 μm–12 μm。
研究菌株:EB8803M (GenBank No. MH577293)和EB8801M (GenBank No. MH577294),2006年8月采集自云南省昆明市公园土样。研究菌株现保存于贵州大学真菌资源研究所(GZAC)。
分布:云南省,昆明市。
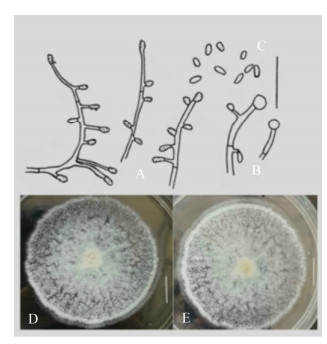
4)轮带金孢 图 4
|
| 图 4 轮带金孢(HMAS255385) Figure 4 Chrysosporium zonatum (HMAS255385) 注:A:产孢结构;B:厚垣孢子;C:分生孢子;D−E:菌落在PDA培养基上的正面和背面. Note: A: Conidiogenous structures; B: Chlamydospores; C: Conidia; D−E: Colonies (front and reverse) on PDA. Bars: A−D=20 μm; E−F=10 mm. |
|
|
Chrysosporium zonatum Al-Musallam & C.S. Tan, Persoonia, 14(1): 69, 1989.
在PDA培养基上,26 ℃培养14 d,菌落直径52–53 mm,白色,絮状,中心淡黄色,粉状,近边缘部有一圈白色轮纹,边缘整齐,半透明色。背面白色,中心淡黄色。菌丝分隔,光滑,透明,宽0.6 μm–1.6 μm,球拍状菌丝未见;分生孢子单生,表面粗糙或光滑,透明,着生于菌丝短柄上,梨形,(2.7–3.8) μm×(1.2–2.2) μm,倒卵形,(2.6–3.1) μm× (1.0–1.9) μm;间生孢子未见;厚垣孢子:4.2 μm–5.3 μm;基痕宽0.6 μm–1.3 μm。
研究菌株:O1 (HMAS255385,GenBank No. MH577295),2017年8月采自云南省腾冲土样。菌种保存于贵州大学真菌资源研究所(GZAC),培养物干标本保存于中国科学院微生物所菌物标本馆HMAS255385。
分布:云南省,腾冲。
2.2 系统发育分析用于构建系统树的数据矩阵包含45个菌株,其中40个菌株的序列来自GenBank,5个菌株的序列为本研究所提供。本研究分析得到的贝叶斯树与ML树拓扑结构相似(图 5)。

|
| 图 5 基于ITS-5.8S rDNA序列构建的金孢属系统发育树 Figure 5 Phylogenetic tree of Chrysosporium spp. constructed from ITS-5.8S rDNA sequences 注:节点上的统计数值分别为ML/Bayesian posterior所得数值;括号中文本为GenBank登录号;外群为合川戴氏霉;标尺表示进化距离. Note: Statistical support values (ML/Bayesian posterior probability) were shown at nodes; Text in brackets presented GenBank accession number; The tree was rooted by using Taifanglania hechuanensis as the out group; Scale label presented distance scale. |
|
|
系统发育树显示,全部金孢属菌株聚在不同分支。节状金孢MH577291 (菌株号H5.11)、乔治金孢MH577292 (菌株号H10.10)和轮带金孢MH577295 (菌株号O1)均以较高的支持率(≥99/0.99)与GenBank上对应种的序列聚在一起,支持了形态学研究结果。本研究两个水生金孢菌株MH577293/ MH577294 (菌株号分别为EB8803M/EB8801M)与GenBank上的该种两个序列以87/0.99的支持率聚为一个亚分支,且其形态特征与模式菌株描述基本一致。
因此分子系统发育研究和形态特征相结合的研究结果,支持了本研究5个菌株分别与其相应4个种的关系。
3 讨论与结论金孢属真菌是一类重要的嗜角蛋白资源,分布广泛,可从不同基质上分离获得[2],如土壤、污泥、动物皮肤等,也有学者在保存的蜂巢花粉中分离到该属真菌[17]。总体来说,这类资源易在富含角蛋白基质的环境中被发现。该属真菌具有强的环境适应能力,能产生丰富的代谢产物,如产生各种蛋白酶如角蛋白酶、纤维素酶和脂肪酶等,以及可产生抗生素类物质可抗癌、抗真菌和抗寄生虫等。因此,
该属真菌在医药、纺织、食品、饲料和日用化工等领域具有重要的开发应用前景[18]。本研究从甘肃和云南省采集的土壤中加入鸡毛和头发段通过富集钓饵法获得一批嗜角蛋白真菌资源,其中5个为金孢属菌株。分离获得的金孢菌株H5.11 (GenBank No. MH577291)在形态上与节状金孢模式菌株的形态特征非常相近[2],而且系统发育中二者以较高的支持率(ML/BI: 99/0.99)聚在一个亚分支(图 5)。H10.10菌株的形态特征与乔治金孢模式标本的形态非常吻合[2],培养基上均呈现红色,同时系统发育分析结果表明该菌株与模式菌株较好地聚在一个亚分支(图 5)。EB8803M (GenBank No. MH577293)和EB8801M (GenBank No. MH577294)两个菌株在形态特征上与水生金孢模式标本的描述非常吻合[19]。系统发育分析结果显示它们与模式菌株能较好地聚在一个亚分支(图 5)。本研究O1 (GenBank No. MH577295)菌株在形态特征上与轮带金孢模式标本的描述非常吻合[20]。系统发育分析结果显示它们与模式菌株能较好地聚在一个亚分支(图 5)。这4个种迄今未在中国报道记载,是我国的新记录种。该结果在了解我国真菌物种的多样性和地理分布方面有一定的价值。
致谢: 感谢中国科学院微生物研究所孙炳达老师和杨柳老师在菌株和干模保藏方面提供的帮助。| [1] |
Corda ACJ. Deutschlands Flora[M]. Abt. III. Die Pilze Deutschlands, 1833
|
| [2] |
van Oorschot CAN. A revision of Chrysosporium and allied genera[J]. Studies in Mycology, 1980, 20: 1-89. |
| [3] |
Han YF, Shen X, Liang JD, et al. Taxonomic advance and characteristics of the genus Chrysosporium[J]. Journal of Mountain Agriculture and Biology, 2017, 36(5): 1-5. (in Chinese) 韩燕峰, 沈鑫, 梁建东, 等. 金孢属的分类研究进展及其分类特征[J]. 山地农业生物学报, 2017, 36(5): 1-5. |
| [4] |
Kirk PM, Cannon PF, David JC, et al. Ainsworth & Bisby's Dictionary of the Fungi[M]. 9th ed. Wallingford: CAB International, 2001: 571-583.
|
| [5] |
Vidal P, de Los Angeles Vinuesa M, Sánchez-Puelles JM, et al. Phylogeny of the anamorphic genus Chrysosporium and related taxa based on rDNA internal transcribed spacer sequences[A]// Kushwaha RKS, Guarro J. Biology of Dermatophytes and Other Keratinophilic Fungi[M]. Bilbao, Spain: Revista Iberoamericana de Micologia, 2000, 17: 22-29
|
| [6] |
Zhang YW, Zeng GP, Zou X, et al. Two new keratinophilic fungal species[J]. Phytotaxa, 2017, 303(2): 173-180. DOI:10.11646/phytotaxa.303.2.7 |
| [7] |
Zhang YW, Chen WH, Zeng GP, et al. Two new Chrysosporium (Onygenaceae, Onygenales) from China[J]. Phytotaxa, 2016, 270(3): 210-216. DOI:10.11646/phytotaxa.270.3.5 |
| [8] |
Li Z, Zeng GP, Ren J, et al. Chrysosporium leigongshanense sp. nov. from Guizhou Province, China[J]. Mycosphere, 2017, 8(8): 1210-1216. DOI:10.5943/mycosphere/8/8/17 |
| [9] |
Zhang YW, Chen WH, Zou X, et al. A new Chrysosporium species from sparrow's nest in Shanxi Province[J]. Mycosystema, 2016, 35(11): 1337-1343. (in Chinese) 张延威, 陈万浩, 邹晓, 等. 来自山西鸟窝的金孢属一新种[J]. 菌物学报, 2016, 35(11): 1337-1343. |
| [10] |
Zhang YW, Han YF, Liang JD, et al. A new species of the genus Chrysosporium from the rhizosphere soil of palm[J]. Mycosystema, 2013, 32(4): 612-616. |
| [11] |
Han YF, Wang YR, Liang JD, et al. A new species of the genus Chrysosporium from the farmland soil of Qinghai Province[J]. Mycosystema, 2013, 32(4): 606-611. (in Chinese) 韩燕峰, 王玉荣, 梁建东, 等. 来自青海农田土壤的金孢属一新种[J]. 菌物学报, 2013, 32(4): 606-611. |
| [12] |
Li Z, Zhang YW, Chen WH, et al. Morphologica traits and molecular analysis for new Chrysosporium species from Fujian Province, China[J]. Phytotaxa, 400(5): 257-264
|
| [13] |
Katoh K, Standley DM. MAFFT multiple sequence alignment software version 7: improvements in performance and usability[J]. Molecular Biology and Evolution, 2013, 30(4): 772-780. DOI:10.1093/molbev/mst010 |
| [14] |
Ronquist F, Teslenko M, van Der Mark P, et al. MrBayes 3.2: efficient Bayesian phylogenetic inference and model choice across a large model space[J]. Systematic Biology, 2012, 61(3): 539-542. DOI:10.1093/sysbio/sys029 |
| [15] |
Posada D, Crandall KA. MODELTEST: testing the model of DNA substitution[J]. Bioinformatics, 1998, 14(9): 817-818. DOI:10.1093/bioinformatics/14.9.817 |
| [16] |
Tamura K, Stecher G, Peterson D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197 |
| [17] |
Zhao YZ, Zhang ZF, Cai L, et al. Four new filamentous fungal species from newly-collected and hive-stored bee pollen[J]. Mycosphere, 2018, 9(6): 1089-1116. DOI:10.5943/mycosphere/9/6/3 |
| [18] |
Liang JD, Han YF, Liang ZQ. A study and application progresses in a group of keratinophilic fungi-the genus Chrysosporium[J]. Journal of Fungal Research, 2007, 5(2): 113-118. (in Chinese) 梁建东, 韩燕峰, 梁宗琦. 一类嗜角蛋白真菌——金孢属的应用价值评介[J]. 菌物研究, 2007, 5(2): 113-118. DOI:10.3969/j.issn.1672-3538.2007.02.014 |
| [19] |
Vidal P, Valmaseda M, Vinuesa MÁ, et al. Two new species of Chrysosporium[J]. Stdudy in Mycology, 2002(47): 199-209. |
| [20] |
Al-Musallam A, Tan CS. Chrysosporium zonatum, a new keratinophilic fungus[J]. Persoonia, 1989, 14(1): 69-71. |
 2019, Vol. 46
2019, Vol. 46