扩展功能
文章信息
- 孙一好, 陆巧灵, 高雪, 尼玛扎西, 周敬明, 王蓥燕, 张小平, 辜运富
- SUN Yi-Hao, LU Qiao-Ling, GAO Xue, Nima Tashi, ZHOU Jing-Ming, WANG Ying-Yan, ZHANG Xiao-Ping, GU Yun-Fu
- 万顺铅锌矿区蜈蚣草内生细菌砷氧化基因(aoxB)的多样性分析
- Diversity of arsenic oxide gene (aoxB) in endophytic bacteria of Pteris vittata in a Pb-Zn mining area in Wanshun
- 微生物学通报, 2019, 46(9): 2175-2185
- Microbiology China, 2019, 46(9): 2175-2185
- DOI: 10.13344/j.microbiol.china.180700
-
文章历史
- 收稿日期: 2018-09-07
- 接受日期: 2019-01-25
- 网络首发日期: 2019-03-19
2. 西藏自治区农牧科学院农业资源与环境研究所 西藏 拉萨 850002;
3. 四川农业大学水稻研究所 四川 成都 611130
2. Institute of Agricultural Resources and Environment, Tibet Academy of Agricultural and Animal Husbandry Science, Lhasa, Tibet 850002, China;
3. Rice Institute, Sichuan Agriculture University, Chengdu, Sichuan 611130, China
砷(Arsenic,As)是广泛存在于自然环境中的有毒元素,是世界公认的一种致癌物。砷在土壤中的滞留时间为1−3千年,依靠自然化学循环过程很难净化砷污染土壤[1]。砷常见的形式可分为五价的砷酸盐[Arsenate,As(Ⅴ)]和三价的亚砷酸盐[Arsenite,As(Ⅲ)]两种。其中As(Ⅲ)的毒性比As(Ⅴ)强约100倍,且不带电荷,移动性强,危害性更大[2]。
目前,砷污染修复的主要方式有物理修复技术、化学修复技术和生物修复技术。物理修复主要包括换土法、玻璃化法以及电动修复法等,化学修复主要包括固化/稳定化法、土壤淋洗法等[3]。但传统的物理和化学方法虽从某种程度上缓和了砷污染,但存在局限性,产生的废渣难以处理、成本高,会带来二次污染等缺点[4]。近年来,兴起的生物修复技术利用生物体吸收、降解、转化土壤中的污染物,其具有投资少、效率高、环境友好、不破坏土壤结构等特点[5]。因此,对砷污染土壤进行生物修复成为目前环境修复领域的研究热点[6]。蜈蚣草(Pteris vittata)属凤尾蕨科孢子植物,具有很强的砷富集能力,生长快、分布广、适应性强,且价格低廉,相关植物修复技术已成功应用于土壤中砷的去除[7]。研究发现蜈蚣草在As含量达1 500 mg/kg的盆栽土壤上正常生长时,地上部累积的砷可达22.6 g/kg DW,所富集的砷占地上部生物量(干重)的2.3%[8]。其生物富集系数可达1 450,生物转移系数可达24[9]。
植物内生细菌指定殖在植物体内但不危害植物生长的细菌统称,其中根部的内生细菌数量远超过其他组织[10]。植物内生细菌应用于生物降解有许多有益之处,细菌的分解途径比植物分解途径更容易[11],此外内生细菌还能促进植物生长,提高植物的生物量,促进超富集植物吸收积累重金属[12]。研究发现从耐锌植物东南景天(Sedum alfredii Hance)植物根组织内分离得到的内生菌的抗性要高于土壤根际细菌[13]。从镍超富集植物香雪球(Alyssum serpyllifolium)植物根、茎、叶组织内部分离出的内生细菌对重金属镍的耐受性高达750−1 000 mg/kg,并具有分泌ACC脱氨酶、铁载体、植物激素以及溶磷等特征,从而显著地促进植物对重金属镍的提取和吸收[14]。
与砷的长期共存下,微生物已经进化出各种不同的砷转化机制。目前的研究发现,微生物中主要存在6种类型的砷抗性机制,包括:As(Ⅲ)氧化、细胞质As(Ⅴ)还原、呼吸性As(Ⅴ)还原、As(Ⅲ)甲基化、As(Ⅲ)氧化偶联光合作用和As(Ⅴ)代替磷来维持微生物的生长。砷氧化微生物可以将环境中的As(Ⅲ)氧化成As(Ⅴ),使其具有弱毒性并且易于被铁铝矿物吸附和固定,因此对环境中砷毒性的降解起着重要作用[15-16]。砷氧化酶基因aoxB编码微生物As(Ⅲ)氧化过程中的关键酶——砷氧化酶[17],最早的相关报道是从工业废水中分离得到的一株细菌Centibacterium arsenoxidans[18]。As(Ⅲ)的氧化过程发生在细胞周质,氧化电子传递路径为As(Ⅲ)传递2个电子到aoxB最后到呼吸链中的O2[19]。aoxB基因的表达是一个复杂的过程,其上游调控基因有编码组氨酸激酶的基因aoxS和感应调控子的基因aoxR,下游辅助基因有编码细胞色素C的基因aoxC和钼生物合成辅因子基因aoxD[20]。目前土壤微生物农杆菌(Agrobacterium tumefaciens)中的As(Ⅲ)氧化酶基因得到了深入的研究[21],但仍然缺乏关于内生细菌中该基因的知识。
植物内生细菌的生态功能与土壤环境之间存在着密切的联系[22]。微生物功能多样性的变化受土壤生态系统各干扰因子的影响,而微生物的功能多样与其功能基因有着密切的联系[23]。因此将功能基因作为一个新的切入点,了解蜈蚣草内生细菌的抗砷功能是很有必要的。本研究应用实时荧光定量PCR (Real-time quantitative PCR,qPCR)和限制性片段长度多态性(Restriction fragment length polymorphism,RFLP)技术,研究不同重金属胁迫下蜈蚣草根组织内生细菌砷氧化酶基因aoxB的表达量、多样性及土壤理化性质对其的影响。从功能基因角度探讨蜈蚣草内生细菌砷抗性机理,也为砷污染的防治工作和生物修复提供基础理论依据。
1 材料与方法 1.1 采样点简介及采样方法四川省汉源县万顺铅锌矿区(N29°23'17″− 29°23'58″,E102°38'02″−102°38'14″)位于四川省流沙河下游左岸,海拔800−1 200 m之间,年平均气温14.1−17.9 ℃,年平均降雨量486 mm。蜈蚣草在该矿区广泛分布。
根据采矿、冶炼、废渣排放等产生过程分5个区采集样品,每区重复采样3次。5个样区分别位于尾矿堆积区、弃渣场、矿口、选矿区和进山口,编号依次为WK1−3、QZ1−3、KK1−3、XK1−3和CK1−3。随机多株选择生长良好的蜈蚣草,挖取整株植株装入无菌密封塑料袋中,贴上标签,立即带回实验室,置于4 ℃保存。
1.2 主要试剂和仪器Sanprep柱式PCR产物纯化试剂盒、质粒小量抽提试剂盒、限制性内切酶、荧光染料SYBR Mix、Taq PCR Mix、大肠杆菌DH5α感受态,生工生物工程(上海)股份有限公司;pMDl9-T载体、T4连接酶,TIANGEN公司;其余常用化学试剂均为国产AR级,四川瑞进特科技有限公司。电感耦合等离子体光谱仪,Thermo Electron公司;电泳仪、UV凝胶成像仪、CFX Connect Real-Time System,Bio-Rad公司;微量核酸蛋白质分析仪,Nanodrop公司。
1.3 实验方法 1.3.1 蜈蚣草根组织重金属浓度分析植物根组织样品采用吸收光谱法测定Cu、Cd、Zn、Pb、As的有效量[24]。样品分析过程中采用国家标准参比物质(植物:GBW-08501)进行分析质量控制,结果见表 1。
| 采样区 Sampling site |
Cu (mg/kg) | Cd (mg/kg) | Zn (mg/kg) | Pb (mg/kg) | As (mg/kg) |
| KK | 65±5a | 37±3a | 974±65a | 587±22a | 221±12a |
| WK | 57±4a | 31±6ab | 1 035±34a | 499±23b | 198±23a |
| QZ | 42±4b | 24±3ab | 995±62a | 344±24c | 165±30a |
| XK | 33±7b | 19±5bc | 984±83a | 162±36d | 62±10b |
| CK | 11±2c | 8±1c | 157±35b | 93±6d | 81±10b |
| 注:表中的数据为均值±3个重复的标准误差;数据间的差异程度采用LSD法检验,同列数值后标注的不同字母表明两个区域样品统计学上的差异显著(p<0.05),相同字母表明两个区域样品无显著统计差异(p<0.05). Note: The data in the table are mean±3 standard deviations; The difference between the data is tested by the LSD method, and different letters in the same column indicate statistically significant differences (p<0.05), same letters in the same column indicate no significant statistical differences (p<0.05). |
|||||
蜈蚣草根组织总DNA的提取参照Tian等[25]的方法进行。首先将5 g蜈蚣草地下部根组织样品表面灭菌后,剪碎置于无菌研钵中,加液氮、磷酸缓冲液研磨,磨细后装入2 mL无菌EP管中,再加1.5 mL磷酸缓冲液配平。然后加10 μL蛋白酶K,放入37 ℃培养箱30 min,隔10 min摇一次。再加入200 μL 20%十二烷基硫酸钠(SDS),65 ℃水浴2 h,隔20 min摇一次。再用离心机以6 000 r/min离心10 min,将上清液转入新的离心管中。原管中重新加入500 μL提取液和25 μL 20% SDS,用无菌牙签混匀后,65 ℃水浴锅中水浴10 min,再用离心机以6 000 r/min离心10 min取上清液合并。上清液中加入0.5倍体积的50% PEG,4 ℃环境下静置过夜。4 ℃、6 000 r/min离心10 min取上清液合并。用1倍体积苯酚、氯仿、异戊醇抽提3次,抽提时使用的离心机设置为10 000 r/min,15 min。加入0.1倍体积3 mol/L的NaAc和0.6倍体积的异丙醇沉淀1 h,再用离心机以10 000 r/min离心25 min。加入预冷的70%乙醇5 μL进行洗涤,10 000 r/min离心25 min弃上清液。待乙醇完全挥发后,加入100 μL的1×TE溶解,经1%的琼脂糖凝胶电泳检测后置于−20 ℃保存备用。
1.3.3 蜈蚣草根组织内生细菌aoxB基因的检测和分析利用简并引物aoxBM1-2F与aoxBM2-1R按照Ouéméneur等[26]所述的方法,对蜈蚣草根组织总DNA进行aoxB的扩增,阳性片段大小约530 bp。PCR反应体系:10 μmol/L上、下游引物各0.1 μL,Template DNA (20 ng/μL) 1 μL,PCR Mix 12.5 μL,ddH2O 11.3 μL。PCR反应条件:95 ℃ 4 min;95 ℃ 45 s,52 ℃ 45 s,72 ℃ 70 s,35个循环;95 ℃ 45 s,46 ℃ 45 s,72 ℃ 5 min。相应的引物序列为:aoxBM1-2F (5′-CCACTTCTGCATCGTGGGNTGY GGNTA-3′),aoxBM2-1R (5′-GGAGTTGTAGGCGG GCCKRTTR TGDAT-3′)。产物于1.5%琼脂糖凝胶电泳检测后用SanPrep柱式PCR产物纯化试剂盒对PCR产物进行纯化,1.0%琼脂糖凝胶电泳和微量核酸蛋白质分析仪(NanoDrop)检验DNA质量并确定其浓度,−20 ℃保存。
1.3.4 aoxB基因定量分析按照顾卿等[27]的方法用实时荧光定量PCR仪对aoxB基因进行定量分析。各基因qPCR所需引物及程序按照1.3.3蜈蚣草根组织内生细菌aoxB基因PCR的方法。83 ℃下收集每个循环中荧光,以防止由于引物二聚体的存在所引起的误差。溶解曲线程序为65−98 ℃,每0.2 ℃读数,其间停留6 s。
1.3.5 蜈蚣草根组织内生细菌aoxB基因克隆将PCR纯化产物与pMDl9-T载体连接,转化于E. coli DH5α感受态细胞中,通过蓝白斑筛选阳性克隆,挑选出白色菌落,37 ℃、180 r/min培养过夜,用通用引物进行菌液PCR。菌液PCR引物为M13F (5′-GTAAAACGACGGCCAG-3′)和M13R (5′-CAGGAAACAGCTATGAC-3′)[28]。PCR反应体系:10 μmol/L上、下游引物各0.2 μL,菌液1 μL,PCR Mix 10 μL,ddH2O 8.6 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 1 min,57 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 5 min。菌液PCR之后,取5 μL PCR产物于1%琼脂糖凝胶进行电泳检测。
1.3.6 蜈蚣草根组织内生细菌aoxB基因RFLP酶切菌液PCR扩增产物用Msp Ⅰ限制性内切酶进行酶切,2.0%琼脂糖凝胶电泳分离,挑取特异性条带对应的克隆子进行测序。酶切试剂及体系参见Msp Ⅰ限制性内切酶使用说明书,酶切过程全程冰上操作。
1.3.7 数据处理与分析基础数据的处理利用Excel 2010进行,Duncan单因素方差分析、qPCR结果以及蜈蚣草根组织重金属含量间Pearson相关性分析用SPSS 17.0完成。按照Hill等[29]的方法计算Shannon多样性指数(H)、丰富度(S)和均匀度(Eh)等,并评价群落结构多样性。多样性指数计算公式为:
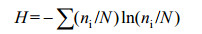
|
(1) |

|
(2) |
其中ni为单一条带的强度,N为所有条带的总强度,S为每一泳道总的条带数。
2 结果与分析 2.1 蜈蚣草根内生细菌aoxB基因检测根据Ct值和起始模板拷贝数的对数得标准曲线,获得Ct值y与拷贝数x之间的曲线方程为y=−4.452x+54.085,R2=0.983,扩增效率在90%−105%之间,符合qPCR的要求。取拷贝数的对数值作图(图 1)。每个样品(3个重复)拷贝数从高到低依次为选矿区>进山口>弃渣场>尾矿>矿口(图 1)。最高拷贝数是选矿区的1.93×107 copies/g,说明该采样点含aoxB基因的根组织内生细菌数量较高;最低拷贝数为矿口的8.27×105 copies/g,说明该采样点含aoxB基因的根组织内生细菌数量较低。

|
| 图 1 不同采样点蜈蚣草根组织内生细菌aoxB基因丰度特征 Figure 1 Abundance of aoxB genes in the endophytic bacteria of Pteris vittata root at different sampling points 注:表中的数据为各采样点均值;数据间的差异程度采用LSD法检验,误差线上不同字母表明两个区域样品在统计学上的差异显著(p<0.05),相同字母表明两个区域样品无显著统计差异(p<0.05). Note: The data in the figure are the mean of each sampling point. The difference between the data is LSD. Different letters on the error line indicate statistically significant differences (p < 0.05), same letters on the error line indicate no significant statistical differences (p < 0.05). |
|
|
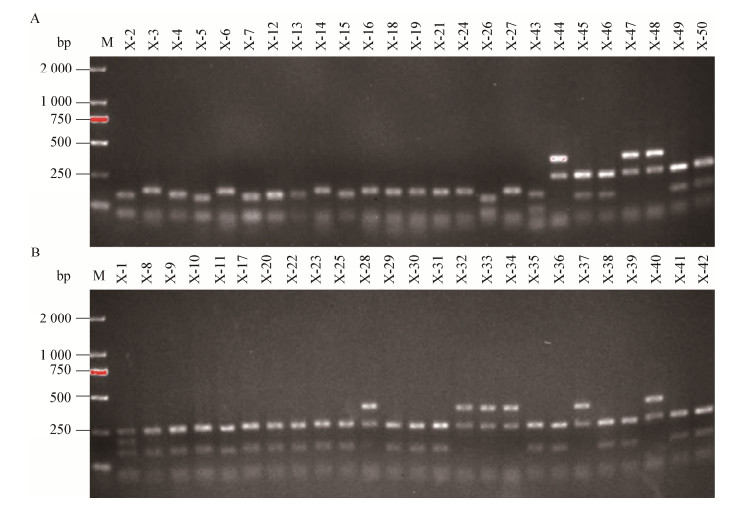
铅锌矿区蜈蚣草根组织内生细菌aoxB基因克隆子酶切图谱分析见图 2。5个采样点分别挑取10个阳性克隆子,进山口、选矿区、弃渣场、尾矿区和矿口分别标注为X-1-X-10、X-11-X-20、X-21-X-30、X-31-X-40、X-41-X-50,共有6条不同类型的谱型。挑不同类型图谱进行测序,构建系统发育树,并计算多样性指数等。
|
| 图 2 蜈蚣草根组织内生细菌aoxB基因克隆子Msp Ⅰ酶切图谱 Figure 2 endophytic bacteria of Pteris vittataroot by Msp Ⅰ |
|
|
通过分析系统发育树可知(图 3),本研究的样品序列全部隶属于变形菌门(Proteobacteria),说明蜈蚣草根组织中携aoxB基因的内生细菌较为单一。在aoxB基因比对分析中,所有本研究样品序列和NCBI中已知序列的相似性高达100%。系统发育树分为3个簇,簇1包含2个样品序列,全部属于α-变形菌(Alphaproteobacteria),包含根瘤菌属(Rhizobium Frank)和农杆菌(Agrobacterium);簇2包含3个样品序列,全部属于β-变形菌(Betaproteobacteria)的硫杆菌属(Thiobacillus);簇3只有1个样品序列,属于γ-变形菌(Gammaproteobacteria)的不动杆菌属(Acinetobacter)。结合酶切图谱分析,矿口与尾矿均有2种谱型,其中与X-8相同的占50%,与X-28相同的占50%,分别属于α-变形菌(Alphaproteobacteria)和β-变形菌(Betaproteobacteria);弃渣场有4种谱型,其中与X-8相同的占50%,为优势菌种,属于α-变形菌(Alphaproteobacteria);选矿区有3种谱型,其中与X-27相同的占40%,为优势菌种,属于β-变形菌(Betaproteobacteria);进山口有4种谱型,其中与X-26相同的占40%,为优势菌种,属于γ-变形菌(Gammaproteobacteria)。综上可得,该区域含有aoxB基因的内生细菌优势种为α-变形菌(Alphaproteobacteria)。

|
| 图 3 蜈蚣草根组织内生细菌aoxB基因系统发育树 Figure 3 Phylogenetic tree of the aoxB gene sequences of endophytic bacteria isolated from the Pteris vittata root 注:本研究的样品序列以粗体显示.节点的数字表示基于1 000重取样数据集的Bootstrap支持率(%);只有超过50%才显示出来.比例栏对应于每个核苷酸位置的0.02个替换. Note: Sequences from this study are in bold type. The number at the nodes indicate the level of bootstrap support (%) based on 1 000 resampled data sets; Only values above 50% are given. The scale bar corresponds to 0.02 substitutions per nucleotide position. |
|
|
不同位置采集的蜈蚣草根组织内生细菌aoxB基因多样性指数(H)、丰富度指数(S)以及均匀度指数(Eh)在一定程度上都存在差异(表 2)。对于分析结果,多样性指数和丰富度有高度一致性,皆表现为尾矿>矿口>弃渣区>进山口>选矿区。总体而言,多样性指数在0.81−1.10之间,丰富度指数在2.30−3.00之间,均匀度指数在0.993−0.999之间。其中尾矿区域蜈蚣草根组织内生细菌aoxB基因的多样性指数和丰富度均为最高,达到了1.10和3.00,而多样性指数和丰富度最低的是选矿区,分别为0.81和2.30。不同采样点蜈蚣草根组织内毛细菌aoxB基因的酶切谱型种类也存在差异,其中来自矿口有2种谱型,尾矿区2种谱型,弃渣场4种谱型,选矿区3种谱型,进山口4种谱型。
| 采样点 Sampling site |
多样性指数(H) Diversity index |
丰富度指数(S) Richness |
均匀度指数(Eh) Evenness |
酶切类型 RFLP type |
| KK | 1.09±0.00a | 3.00±0.00a | 0.993±0.00a | 2 |
| WK | 1.10±0.00a | 3.00±0.00a | 0.998±0.00b | 2 |
| QZ | 0.94±0.07ab | 2.60±0.16ab | 0.999±0.00b | 4 |
| XK | 0.81±0.06b | 2.30±0.15b | 0.999±0.00b | 3 |
| CK | 0.88±0.08b | 2.50±0.22b | 0.999±0.00b | 4 |
| 注:表中的数据为均值±10个重复的标准差;数据间的差异程度采用LSD法检验,同列数值后标注的不同字母代表在统计学上的差异显著(p<0.05),相同字母表明两个区域样品无显著统计差异(p<0.05). Note: The data in the table are mean±10 standard deviations; The difference between the data is tested by the LSD method, and the different letters in the same column indicate statistically significant differences (p<0.05), same letters on the error line indicate no significant statistical differences (p<0.05). |
||||
样品多样性指数和丰富度都与Cu、Cd、Pb、As呈正相关(表 3)。其中,多样性指数与Pb和As相关性较大,丰富度指数均未达到显著水平,且相关性指数均较低,说明丰富度受重金属含量影响较小。样品均匀度指数与Cu、Cd、Zn、Pb和As均呈负相关,但与Zn未达到显著水平。拷贝数与Cu、Cd、Pb、As呈显著负相关,与Zn呈负相关,但未达到显著水平,其中As与拷贝数相关系数最高。综上,As与多样性指数和拷贝数的相关系数最高,表明As含量对aoxB基因表达量及多样性影响较大。
| 指标 Index |
Cu | Cd | Zn | Pb | As |
| 多样性指数(H) Diversity index |
0.556* | 0.366 | 0.226 | 0.724** | 0.700** |
| 丰富度指数(S) Richness |
0.199 | 0.318 | 0.151 | 0.384 | 0.378 |
| 均匀度指数(Eh) Evenness |
−0.670** | −0.626* | −0.266 | −0.741** | −0.634* |
| 拷贝数 Copy number |
−0.679** | −0.616* | −0.370 | −0.853** | −0.934** |
| Note:**: P<0.01; *: P<0.05. | |||||
本研究将功能基因作为一个新的切入点,应用qPCR技术以及RFLP研究不同重金属胁迫下蜈蚣草根组织内生细菌aoxB基因的多样性,从功能基因角度探讨蜈蚣草内生细菌砷抗性机理以及植物体内重金属与细菌群落结构间的关系。本文中植物体内As含量非常高,最高达到244 mg/kg,但这还并不是蜈蚣草所能富集的最大砷含量。据韦朝阳等[30]报道,野外污染条件下,蜈蚣草地上部的最高砷含量可达1 540 mg/kg,根部最大砷含量可达900 mg/kg。正常植物在土壤中的砷含量一般不超过3 mg/kg,而本次实验中的蜈蚣草达到了普通植物的上百倍。砷并非植物生长的必需元素,而且砷过量时对植物的毒性极强,但蜈蚣草却能够吸收并忍耐如此高浓度的砷[31]。
就基因表达量而言,选矿区的拷贝数之所以高于其他采样点,是受该采样点的环境因子影响,aoxB基因表达水平提高使植物抗重金属毒害或者植物本身自我解毒作用有所提升[32]。而环境中的其他重金属可以诱导aoxB基因的表达,从而导致植株体内富集了更多的重金属离子,同理,这些基因的表达产物及其植物体内富集的重金属离子可反过来作用于植物体,导致其aoxB的表达水平下降。此外,植物激素也在植物应对环境中重金属的过程中起到了重要的信号调控作用[33]。铅锌矿区中含不同重金属,其作用可能使蜈蚣草根组织内生细菌aoxB基因的表达模式产生了不同[34]。
从蜈蚣草根组织内生细菌aoxB基因的多样性、丰富度及均匀度,与蜈蚣草根组织重金属含量的相关性分析可知,Pb和As与多样性指数的相关系数最高,可以表明Pb和As含量对aoxB基因多样性影响较大。王慧忠等[35]研究表明,一定重金属胁迫下,对相关功能基因的表达具有一定的积极影响。王年等[36]表明环境中的As可以诱导砷氧化基因的表达,但是在不同的菌株中其诱导表达的机制不尽相同。同时,Inskeep等[37]研究表明砷氧化基因广泛存在于含砷的土壤及水体中,且具有较高的多样性,这与本文的研究结论一致。
aoxB基因的多样性能够反映蜈蚣草根组织内生细菌的多样性,而基因多样性受环境等因素影响。结合系统发育树结果,含有aoxB基因的蜈蚣草根组织内生细菌中α-变形菌(Alphaproteobacteria)是优势菌群,其与硫杆菌属(Thiobacillus)相似性最高。肖菊芳[38]研究表明硫杆菌属对多种重金属有耐受作用且去除率较高。同时,这与之前对其他重金属矿区植物内生细菌的研究结果相似,如陈宝报道的铅锌矿区东南景天内生细菌群落中,变形菌为主要的优势菌种[39]。牛红榜等报道紫金泽兰根际土壤中α-变形菌(Alphaproteobacteria)为优势菌群[40]。从5个不同采样点菌群结构来看,矿口、尾矿、弃渣场、选矿区和进山口的主要种群为α-变形菌(Alphaproteobacteria)、β-变形菌(Betaproteobacteria)、α-变形菌(Alphaproteobacteria)、β-变形菌(Betaproteobacteria)和α-变形菌(Alphaproteobacteria),其种类分别由少变多。杨金水等[41]研究表明,重金属Pb含量与微生物的群落结构是具有极显著的相关性的。从此可以推测,铅锌矿区蜈蚣草根组织携aoxB基因的内生细菌菌群变化在一定程度上是受重金属的影响,但是并非简单的线性关系[42]。
4 结论采用qPCR以及RFLP技术对四川汉源万顺铅锌矿区蜈蚣草根组织内生细菌aoxB基因在重金属胁迫下的表达量及多样性进行分析,结果发现不同采样点蜈蚣草根组织内生细菌aoxB基因表达量及多样性都存在明显的差异。各采样点拷贝数值均与As呈显著负相关(p<0.05)。多样性指数和丰富度表现为尾矿>矿口>弃渣区>进山口>选矿区。主要的优势菌群属于α-变形菌(Alphaproteobacteria)。
| [1] |
Yang JH. Research advance in bioremediation of soil polluted by arsenic[J]. Acta Agriculturae Jiangxi, 2012, 24(3): 125-127, 134. (in Chinese) 杨金红. 砷污染土壤的生物修复研究进展[J]. 江西农业学报, 2012, 24(3): 125-127, 134. DOI:10.3969/j.issn.1001-8581.2012.03.039 |
| [2] |
Luo T, Sun JX, Xia K. A research review of arsenic pollution in soil[J]. Environment and development, 2017, 29(8): 11-12. (in Chinese) 罗婷, 孙健雄, 夏科. 土壤砷污染研究综述[J]. 环境与发展, 2017, 29(8): 11-12. |
| [3] |
Ren CQ, Zhang Y, Yang M. Research progress in soil arsenic pollution remediation technology[J]. Environmental Protection and Circular Economy, 2014, 34(6): 30-33. (in Chinese) 任春强, 张云, 杨明. 土壤砷污染修复技术研究进展[J]. 环境保护与循环经济, 2014, 34(6): 30-33. DOI:10.3969/j.issn.1674-1021.2014.06.008 |
| [4] |
Ran JW, Zhang X, Ning P, et al. Advances in soil remediation polluted by arsenic in different kinds of farmland[J]. Environmental Science Survey, 2017, 36(3): 80-86. (in Chinese) 冉继伟, 张旭, 宁平, 等. 不同耕地类型中砷污染修复方式研究进展[J]. 环境科学导刊, 2017, 36(3): 80-86. |
| [5] |
Huang YF, Chen GF, Xiong LM, et al. A review of soil heavy metal pollution status of cultivated land and analysis of phytoremediation application[J]. Journal of Anhui Agricultural Sciences, 2015, 43(26): 88-89. (in Chinese) 黄雁飞, 陈桂芬, 熊柳梅, 等. 耕地土壤重金属污染现状及植物修复的应用[J]. 安徽农业科学, 2015, 43(26): 88-89. DOI:10.3969/j.issn.0517-6611.2015.26.032 |
| [6] |
Shen HL, He ZY, Ma M. Advance of the mechanisms of arsenic hyperaccumulation in Pteris vittata L. and applications for arsenic-remediation[J]. Plant Physiology Journal, 2014, 50(5): 591-598. (in Chinese) 申红玲, 何振艳, 麻密. 蜈蚣草砷超富集机制及其在砷污染修复中的应用[J]. 植物生理学报, 2014, 50(5): 591-598. |
| [7] |
Liu WJ, Zhao FJ. A brief review of arsenic uptake and metabolism in plants[J]. Environmental Chemistry, 2011, 30(1): 56-62. (in Chinese) 刘文菊, 赵方杰. 植物砷吸收与代谢的研究进展[J]. 环境化学, 2011, 30(1): 56-62. |
| [8] |
Chen TB, Wei CY, Huang ZC, et al. Arsenic hyperaccumulator Pteris vittata L. and its arsenic accumulation[J]. Chinese Science Bulletin, 2002, 47(11): 902-905. (in Chinese) 陈同斌, 韦朝阳, 黄泽春, 等. 砷超富集植物蜈蚣草及其对砷的富集特征[J]. 科学通报, 2002, 47(3): 207-210. DOI:10.3321/j.issn:0023-074X.2002.03.011 |
| [9] |
Wang HJ, Ning P, Zhang ZB, et al. Pretreatment of arsenic gold ore by Pteris vittata L.[J]. Journal of Wuhan University of Technology, 2010, 32(8): 59-63. (in Chinese) 王海娟, 宁平, 张泽彪, 等. 含砷金矿的蜈蚣草除砷预处理初步研究[J]. 武汉理工大学学报, 2010, 32(8): 59-63. DOI:10.3963/j.issn.1671-4431.2010.08.016 |
| [10] |
Hallmann J, Morgenroth W, Paulmann C, et al. Time-resolved X-ray diffraction of the photochromic α-styrylpyrylium trifluoromethanesulfonate crystal films reveals ultrafast structural switching[J]. Journal of the American Chemical Society, 2009, 131(41): 15018-15025. DOI:10.1021/ja905484u |
| [11] |
Luo MY, Lu XJ, Liao XL. Research advances on application of endophytic bacteria[J]. Modern Agricultural Sciences and Technology, 2010(7): 11-12, 16. (in Chinese) 罗茗月, 路雪君, 廖晓兰. 植物内生细菌的应用研究进展[J]. 现代农业科技, 2010(7): 11-12, 16. DOI:10.3969/j.issn.1007-5739.2010.07.001 |
| [12] |
Liu LH, Liu SJ, Chen FM, et al. Effect of endophytic bacteria inoculation on cadmium uptake in Solanum nigrum L.[J]. Acta Scientiae Circumstantiae, 2013, 33(12): 3368-3375. (in Chinese) 刘莉华, 刘淑杰, 陈福明, 等. 接种内生细菌对龙葵吸收积累镉的影响[J]. 环境科学学报, 2013, 33(12): 3368-3375. |
| [13] |
Zhang XC. Isolation and identification of endophytes from Sedum alfredii and the mechanisms of their enhancement on heavy metal hyperaccumulation[D]. Hangzhou: Doctoral Dissertation of Zhejiang University, 2012 (in Chinese) 张新成.东南景天内生菌分离鉴定及其强化重金属超积累效应与机制[D].杭州: 浙江大学博士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10335-1013153486.htm |
| [14] |
Ma Y, Rajkumar M, Luo YM, et al. Inoculation of endophytic bacteria on host and non-host plants—Effects on plant growth and Ni uptake[J]. Journal of Hazardous Materials, 2011, 195: 230-237. DOI:10.1016/j.jhazmat.2011.08.034 |
| [15] |
Yang J, Zhu YG. Progress in study of mechanisms of microbial arsenic transformation in environment[J]. Asian Journal of Ecotoxicology, 2009, 4(6): 761-769. (in Chinese) 杨婧, 朱永官. 微生物砷代谢机制的研究进展[J]. 生态毒理学报, 2009, 4(6): 761-769. |
| [16] |
Wang GJ, Huang YY, Li J. Bacteria live on arsenic——analysis of microbial arsenic metabolism-A review[J]. Acta Microbiologica Sinica, 2011, 51(2): 154-160. (in Chinese) 王革娇, 黄银燕, 李洁. "吃"砒霜的细菌——解析微生物的砷代谢[J]. 微生物学报, 2011, 51(2): 154-160. |
| [17] |
Zhao K. Gene function and regulation of arsenite oxidase in arsenite-oxidizing bacteria-Acidovorax spp.[D]. Wuhan: Master's Thesis of Huazhong Agricultural University, 2010 (in Chinese) 赵凯.食酸菌属中三价砷氧化细菌As(Ⅲ)氧化酶基因和调控基因的功能研究[D].武汉: 华中农业大学硕士学位论文, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10504-1010010436.htm |
| [18] |
Weeger W, Lièvremont D, Perret M, et al. Oxidation of arsenite to arsenate by a bacterium isolated from an aquatic environment[J]. Biometals, 1999, 12(2): 141-149. DOI:10.1023/A:1009255012328 |
| [19] |
Cai L, Wang GJ. Advance on studies of arsenic-resistant microorganisms and molecular mechanisms[J]. Microbiology China, 2009, 36(8): 1253-1259. (in Chinese) 蔡林, 王革娇. 抗砷性微生物及其抗砷分子机制研究进展[J]. 微生物学通报, 2009, 36(8): 1253-1259. |
| [20] |
Wang GJ, Wang Q, Chen F, et al. Research progress of microbial arsenite oxidation regulation[J]. Journal of Microbiology, 2014, 34(5): 1-7. (in Chinese) 王革娇, 王倩, 陈芳, 等. 微生物砷氧化调控研究进展[J]. 微生物学杂志, 2014, 34(5): 1-7. DOI:10.3969/j.issn.1005-7021.2014.05.001 |
| [21] |
Han YH, Wang SS. Arsenic resistance mechanisms in microbes and their roles in arsenic geochemical cycling-A review[J]. Acta Microbiologica Sinica, 2016, 56(6): 901-910. (in Chinese) 韩永和, 王珊珊. 微生物耐砷机理及其在砷地球化学循环中的作用[J]. 微生物学报, 2016, 56(6): 901-910. |
| [22] |
Cao K, Wang XN, Sun YF, et al. Research progress on endophytic bacterial diversity and biocontrol of plant roots[J]. Agriculture & Technology, 2017, 37(17): 1-3, 5. (in Chinese) 曹焜, 王晓楠, 孙宇峰, 等. 植物根部内生细菌多样性及其生防作用研究进展[J]. 农业与技术, 2017, 37(17): 1-3, 5. |
| [23] |
Zhang J, Zhang HW, Li XY, et al. Soil microbial ecological process and microbial functional gene diversity[J]. Chinese Journal of Applied Ecology, 2006, 17(6): 1129-1132. (in Chinese) 张晶, 张惠文, 李新宇, 等. 土壤微生物生态过程与微生物功能基因多样性[J]. 应用生态学报, 2006, 17(6): 1129-1132. DOI:10.3321/j.issn:1001-9332.2006.06.034 |
| [24] |
Zheng YK, Ren D, Lu SE, et al. Diversity and community structure of endophytic actinomycetes of Pteris vittata in a Pb-Zn mining area[J]. Acta Scientiae Circumstantiae, 2014, 34(11): 2832-2838. (in Chinese) 郑有坤, 任丹, 卢圣鄂, 等. 铅锌矿区蜈蚣草内生放线菌的多样性及群落结构[J]. 环境科学学报, 2014, 34(11): 2832-2838. |
| [25] |
Tian XL, Cao LX, Tan HM, et al. Diversity of cultivated and uncultivated actinobacterial endophytes in the stems and roots of rice[J]. Microbial Ecology, 2007, 53(4): 700-707. DOI:10.1007/s00248-006-9163-4 |
| [26] |
Quéméneur M, Heinrich-Salmeron A, Muller D, et al. Diversity surveys and evolutionary relationships of aoxB genes in aerobic arsenite-oxidizing bacteria[J]. Applied and Environmental Microbiology, 2008, 74(14): 4567-4573. DOI:10.1128/AEM.02851-07 |
| [27] |
Gu Q, Xu YL, Wei W, et al. The establishment of the real-time PCR system for detecting soil bacteria abundance[J]. Soil and Crop, 2012, 1(2): 117-120. (in Chinese) 顾卿, 许艳丽, 魏巍, 等. 土壤细菌群落密度实时荧光定量PCR检测体系的建立[J]. 土壤与作物, 2012, 1(2): 117-120. |
| [28] |
Giloteaux L, Holmes DE, Williams KH, et al. Characterization and transcription of arsenic respiration and resistance genes during in situ uranium bioremediation[J]. The ISME Journal, 2013, 7(2): 370-383. DOI:10.1038/ismej.2012.109 |
| [29] |
Hill T, Motte F, Didelon P, et al. Filaments and ridges in vela C revealed by Herschel: from low-mass to high-mass star-forming sites[J]. Astronomy & Astrophysics, 2011, 533: A94. |
| [30] |
Wei CY, Zheng H, Sun X, et al. Characteristics of arsenic enrichment by plants of Pteris vittata different in source and their phytoremediation efficiency[J]. Soils, 2008, 40(3): 474-478. (in Chinese) 韦朝阳, 郑欢, 孙歆, 等. 不同来源蜈蚣草吸收富集砷的特征及植物修复效率的探讨[J]. 土壤, 2008, 40(3): 474-478. DOI:10.3321/j.issn:0253-9829.2008.03.026 |
| [31] |
Pan ZM, Deng TL. A review of researches on Pteris vittata phytoremediation of arsenic polluted soils[J]. Soils, 2007, 39(3): 341-346. (in Chinese) 潘志明, 邓天龙. 砷污染土壤的蜈蚣草修复研究进展[J]. 土壤, 2007, 39(3): 341-346. DOI:10.3321/j.issn:0253-9829.2007.03.003 |
| [32] |
Xu D. Cadmium-induced gene expression for heavy metal transport in barley[D]. Changchun: Master's Thesis of Northeast Normal University, 2009 (in Chinese) 许多.镉诱导大麦重金属转运基因的表达[D].长春: 东北师范大学硕士学位论文, 2009 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1465287 |
| [33] |
Robert-Seilaniantz A, Grant M, Jones JDG. Hormone crosstalk in plant disease and defense: more than just jasmonate-salicylate antagonism[J]. Annual Review of Phytopathology, 2011, 49(1): 317-343. DOI:10.1146/annurev-phyto-073009-114447 |
| [34] |
Diao S, Su XH, Ding CJ, et al. Cloning and expression analysis of PsCCH from Populus simonii under stresses of heavy metal[J]. Forest Research, 2015, 28(1): 32-36. (in Chinese) 刁姝, 苏晓华, 丁昌俊, 等. 小叶杨CCH基因的克隆及其在重金属胁迫下的表达模式[J]. 林业科学研究, 2015, 28(1): 32-36. |
| [35] |
Wang HZ, Li J. Effect of cadmium ion and Lead ion induced stress on anti-oxidative genes expression in perennial ryegrass cells[J]. Journal of Agro-Environment Science, 2008, 27(6): 2371-2376. (in Chinese) 王慧忠, 李鹃. 重金属镉、铅对多年生黑麦草细胞内几种抗氧化酶基因表达的影响[J]. 农业环境科学学报, 2008, 27(6): 2371-2376. DOI:10.3321/j.issn:1672-2043.2008.06.043 |
| [36] |
Wang N, Lu XL, Wu MXJ, et al. Progress in microbial oxidation of As(Ⅲ) and Sb(Ⅲ)[J]. Microbiology China, 2017, 44(3): 689-700. (in Chinese) 王年, 鲁小璐, 邬梦晓俊, 等. 微生物氧化As(Ⅲ)和Sb(Ⅲ)的研究进展[J]. 微生物学通报, 2017, 44(3): 689-700. |
| [37] |
Inskeep WP, Macur RE, Hamamura N, et al. Detection, diversity and expression of aerobic bacterial arsenite oxidase genes[J]. Environmental Microbiology, 2007, 9(4): 934-943. DOI:10.1111/j.1462-2920.2006.01215.x |
| [38] |
Xiao JF. Study on removal and its mechanism of heavy metals by Acidithiobacillus ferrooxidans in steel-picking sulfuric acid pickling waste liquor[D]. Tianjin: Master's Thesis of Tianjin University of Technology, 2014 (in Chinese) 肖菊芳.钢铁硫酸洗废液中嗜酸性氧化亚铁硫杆菌对重金属的去除及机理研究[D].天津: 天津理工大学硕士学位论文, 2014 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2533867 |
| [39] |
Chen B. The effects and mechanisms of endophytic bacteria promoting Zn/Cd phytoextraction by Sedum alfredii[D]. Hangzhou: Doctoral Dissertation of Zhejiang University, 2015 (in Chinese) 陈宝.内生细菌促进东南景天Zn/Cd的提取效应及其机制研究[D].杭州: 浙江大学博士学位论文, 2015 http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y2788108 |
| [40] |
Niu HB, Liu WX, Wan FH, et al. Screening, identification, and antagonism assessment of dominant bacteria in Ageratina adenophora Sprengel rhizosphere soil[J]. Chinese Journal of Applied Ecology, 2007, 18(12): 2795-2800. (in Chinese) 牛红榜, 刘万学, 万方浩, 等. 紫茎泽兰根际土壤中优势细菌的筛选鉴定及拮抗性能评价[J]. 应用生态学报, 2007, 18(12): 2795-2800. |
| [41] |
Yang JS, Yang Y, Sun LM, et al. Characterization of soil fungal community in response to heavy metal pollution in Lead-Zinc mining area[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2017, 53(2): 387-396. (in Chinese) 杨金水, 杨扬, 孙良明, 等. 铅锌矿区土壤真菌响应重金属污染的群落组成变化[J]. 北京大学学报:自然科学版, 2017, 53(2): 387-396. |
| [42] |
Xie XH, Fan FX, Yuan XW, et al. Impact on microbial diversity of heavy metal pollution in soils near Dexing copper mine tailings[J]. Microbiology China, 2012, 39(5): 624-637. (in Chinese) 谢学辉, 范凤霞, 袁学武, 等. 德兴铜矿尾矿重金属污染对土壤中微生物多样性的影响[J]. 微生物学通报, 2012, 39(5): 624-637. |
 2019, Vol. 46
2019, Vol. 46