扩展功能
文章信息
- 张峰峰, 周可, 谢凤行, 赵琼, 赵玉洁
- ZHANG Feng-Feng, ZHOU Ke, XIE Feng-Xing, ZHAO Qiong, ZHAO Yu-Jie
- Pseudomonas alcaliphila AD-28的脱氮性能及其关键酶活性
- Nitrogen removal characteristic and key enzymes activity of Pseudomonas alcaliphila AD-28
- 微生物学通报, 2019, 46(9): 2166-2174
- Microbiology China, 2019, 46(9): 2166-2174
- DOI: 10.13344/j.microbiol.china.180730
-
文章历史
- 收稿日期: 2018-09-20
- 接受日期: 2019-01-22
- 网络首发日期: 2019-02-28
近年来,由于人类活动产生的城市污水、工业废水、农田灌溉、养殖尾水等各种污染废水的排放,导致全国各大水系富营养化严重[1-2],从而导致蓝藻水华暴发、生物链破坏等一系列环境问题,影响了生态系统的稳定和人类健康发展[3]。其中氮污染已成为水体最主要污染源,如何解决水体中的氮素污染问题已成为解决当前水体污染问题的研究热点和难点[4]。异养硝化-好氧反硝化(Heterotrophic nitrification-aerobic denitrification)菌可利用有机碳源进行生长,同时将含氮化合物硝化生成羟胺、亚硝酸盐、硝酸盐等产物,再通过好氧反硝化作用直接将硝化产物转化为含氮气体,其同步去除有机物、氨氮和(亚)硝态氮的优点成为目前最有前景的生物脱氮方法之一[5]。然而目前发现的异养硝化-好氧反硝化细菌脱氮效率不高[6],且脱氮过程受到各种环境因子的抑制[7],相关研究多数还是集中在菌株的筛选和生物学特性上,对其脱氮机理及脱氮途径方面研究较少,特别是从酶学角度进行脱氮相关关键酶的提取和酶活性研究鲜有报道。
本研究从天津市西青区养殖池活性污泥中分离筛选出一株有较强脱氮性能的菌株,具有较强的异养硝化能力和好氧反硝化能力,命名为AD-28,通过生理生化鉴定和16S rRNA基因同源性分析,鉴定其为嗜碱假单胞菌Pseudomonas alcaliphila[8]。同时,本研究在实验室条件下采用单因素试验和正交试验优化超声波破碎法提取酶的条件,检测关键酶氨单加氧酶(AMO)、羟胺氧化还原酶(HAO)、亚硝酸盐还原酶(NIR)、硝酸盐还原酶(NAR)的酶活[9-10],为从酶学角度深入了解该菌株的脱氮性能提供参考,以期为该菌在养殖水体中的脱氮应用提供理论支持。
1 材料与方法 1.1 材料 1.1.1 菌株来源菌株AD-28分离自天津市西青区养殖池的活性污泥,经形态、生理生化和分子试验鉴定为嗜碱假单胞菌(Pseudomonas alcaliphila),保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC 8991。
1.1.2 培养基DM培养基(g/L):柠檬酸钠5.0,KH2PO4 1.0,MgSO4·7H2O 0.2,(NH4)2SO4 0.1或NaNO2 0.1或KNO3 0.18,蒸馏水1 L,pH 7.2。1×105 Pa灭菌30 min备用。
1.1.3 主要试剂和仪器蛋白质浓度定量试剂盒,上海杰美公司;羟胺,Sigma公司;Tris-HCl、K3[Fe(CN)6]、EDTA,上海阿拉丁生化科技股份有限公司。
冷冻离心机,Heraeus公司;总氮分析仪,哈希水质分析仪器(上海)有限公司;紫外分光光度计,岛津公司;超声波破碎仪,宁波新芝生物科技股份有限公司;精密电子天平,赛多利斯科学仪器(北京)有限公司。
1.2 方法 1.2.1 菌株的脱氮性能将1 mL处于对数生长期的菌株AD-28接种到装有100 mL灭菌培养基的250 mL锥形瓶中。30 ℃、150 r/min振荡培养,每4 h取样,测定菌密度(OD600),6 000 r/min离心10 min后测定上清液中的氨氮NH4+-N、亚硝酸盐氮NO2−-N、硝酸盐氮NO3−-N及总氮。结果取3个重复试验平均值。
1.2.2 超声波破碎将1 mL处于对数生长期的菌株AD-28接种到装有100 mL DM培养基的250 mL锥形瓶中,30 ℃、150 r/min振荡培养24 h。将菌液4 ℃、10 000 r/min离心20 min,弃上清收集菌体。用0.01 mol/L pH 7.4的磷酸盐缓冲液洗3次,重悬菌体于离心管中,用超声波细胞粉碎机破碎,工作条件按单因素和正交试验表(表 1)进行。超声波破碎后,将破碎液4 ℃、14 000 r/min离心20 min,上清即为粗酶液。由于蛋白质对紫外光具有吸收作用,其最大吸收光度在波长280 nm处,通过测定细胞破碎前后280 nm处的吸光度A280变化情况,可以间接了解菌体的破碎程度和细胞内蛋白质的溶出量,并以此表征细胞破碎后的粗酶含量[9],结果取3个重复试验平均值。
| 水平 Levels |
因素Factors | |||
| A菌液密度 OD600 |
B功率 Ultrasonic power (W) |
C工作与间歇时间 Work/Interval time (s/s) |
D总工作时间 Total work time (min) |
|
| 1 | 1.512 | 150 | 4/2 | 4 |
| 2 | 2.103 | 200 | 4/6 | 6 |
| 3 | 2.524 | 250 | 7/8 | 8 |
AMO酶活性测试方法[9]:通过测定NH4+-N的浓度来确定AMO的酶活性。在20 mL的反应体系中,包含4 mL的粗酶、10 mmol/L的Tris-HC1缓冲液(pH 8.0)、0.2 mmol/L的NADH,反应以加入NH4Cl时开始,在恒温摇床上以30 ℃、120 r/min的条件反应15 min,测定反应前后体系中NH4+-N的浓度。
HAO酶活性测试方法:测定的体系包括0.050 mmol/L Tris-HCl (pH 7.4)、0.001 mmol/L K3[Fe(CN)6]、0.004 mmol/L EDTA、1 mL粗酶液,加入羟胺开始反应,30 ℃孵育15 min,以加入灭活后的酶液作为对照,根据反应体系中羟胺的减少量测定HAO的活性[11]。
NIR、NAR酶活性测试方法:测定体系包括10 mmol/L磷酸盐缓冲溶液(pH 7.4)、0.2 mmol/L NADH、1 mL粗酶液,分别加入10 μmol/L亚硝酸钠、硝酸钠开始反应,30 ℃孵育15 min,根据反应前后亚硝酸钠、硝酸钠的减少量分别测定NIR、NAR的活性[12]。
蛋白浓度的测定用GENMED Bradford蛋白质浓度定量试剂盒。1个酶活单位(U)定义为每分钟催化1 μmol反应物所需的酶量。酶比活力(U/mg)定义为每毫克蛋白所具有的酶活力单位。
1.2.4 分析方法菌密度(OD600)采用可见分光光度计测定;氨氮采用纳氏试剂光度法[13];亚硝酸盐氮采用N-(1-萘基)-乙二胺光度法[13];硝酸盐氮采用紫外分光光度法[13];总氮采用碱性过硫酸钾消解紫外分光光度法[13];羟胺用8-羟基喹啉光度法[13];粗酶含量利用酶液的A280吸光度值表示。
1.3 数据分析试验结果用平均数±标准差(x±SD,n=3)表示,运用软件SPSS19.0,经One-way ANOVA分析,采用Duncan’s多重检验分析试验结果的差异显著性,P<0.05为差异显著。
2 结果与分析 2.1 菌株的脱氮性能如图 1所示,菌株AD-28生长的迟缓期较短,培养4 h后进入对数生长期,4−16 h时生长速度最快,16 h时基本进入稳定期,OD600可达1.971。培养8 h时能去除97.03%的NH4+-N,相应的硝化速率达到2.53 mg/(L·h);16 h时对亚硝酸盐氮去除率达到99.59%;24 h时3种含氮污染物的去除率均达到96%以上,培养基中总氮浓度随着菌株的生长也逐渐降低,总氮去除率达到96.99%。说明在3种氮源同时存在的情况下,AD-28先去除氨氮,再去除亚硝酸盐氮,最后去除硝酸盐氮,而培养基中的总氮也随着菌株的生长逐渐去除,说明AD-28具有较强的脱氮性能。
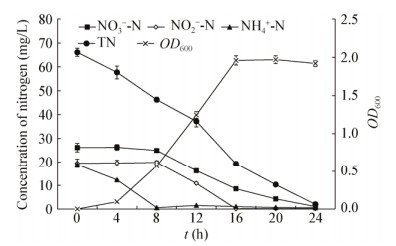
|
| 图 1 AD-28的生长及脱氮性能 Figure 1 The growth and nitrogen removal characteristic of strain AD-28 |
|
|
为了研究HAO、NIR和NAR的酶活性,需要进行关键酶的提取。超声波破碎法提取粗酶在实验室规模应用普遍,但由于超声对细菌有热效应、空化效应、机械效应,应首先考察影响粗酶溶出量的因素(主要有OD600、破碎功率、工作与间歇时间、总工作时间),并采用正交试验进行优化,确定超声波破碎的最佳工作条件。
由图 2可以看出,菌液OD600、超声波破碎功率、工作与间歇时间、总工作时间对粗酶液的蛋白质浓度(A280)影响较大。由图 2A可见,OD600增加,总的蛋白质含量增大,OD600为2.561时A280达到最大值,但OD600超过3.0后,菌液粘度相对升高,菌体接触空化气泡的机会减少,导致破碎效率降低,粗酶溶出量随之减少,A280值降低。A280随着超声波破碎功率的提高呈现先增加后减少的趋势,在破碎功率达到250 W时A280达到最大值,进一步提高功率则A280随之减小(图 2B),可能是由于超声波功率增大,细胞壁的网状结构容易被破碎为较小的碎片,但功率过大时溶出蛋白易断裂[9]。前人研究表明[10],不同的工作/间歇时间对粗酶的溶出也有较大的影响,如果工作时间太短则破碎不彻底,而工作时间太长则产生的热量不能及时扩散会导致蛋白质变性,如果间歇时间太短,空化效应产生的气泡能有足够时间爆炸。比较7个不同的工作/间歇时间处理,发现在4 s/2 s的处理条件下,A280显著高于其他处理(P<0.05) (图 2C)。总破碎时间越长,细菌破碎越完全,粗酶溶出量增加(图 2D),在处理8 min时A280显著高于其他短时处理(P<0.05),但是总工作时间太长则热效应增强,空化效应也会产生高温高压,导致部分蛋白变性[14],所以要合理选择总工作时间。

|
| 图 2 粗酶溶出量与OD600 (A)、超声波破碎功率(B)、工作与间歇时间(C)、总工作时间(D)的关系 Figure 2 Relationship between A280 and OD600 (A), ultrasonic power (B), work/interval time (C), total work time (D) 注:A:超声波破碎功率200 W,工作与间歇时间分别为4 s和6 s,总工作时间4 min;B:工作与间歇时间分别为4 s和6 s,OD600为2.5,总工作时间4 min;C:超声波破碎功率200 W,OD600为2.5,总工作时间4 min;D:超声波破碎功率200 W,工作与间歇时间分别为4 s和6 s,OD600为2.5. Note: A: Ultrasonic power 200 W, work/interval time 4 s/6 s, total work time 4 min; B: Work/Interval time 4 s/6 s, OD600=2.5, total work time 4 min; C: Ultrasonic power 200 W, OD600=2.5, total work time 4 min; D: Ultrasonic power 200 W, work/interval time 4 s/6 s, OD600=2.5. |
|
|
采用L9(34)正交试验,结合单因素试验结果,对粗酶提取条件进行优化。各因素所选参数如表 1所示,正交试验结果如表 2所示。由正交试验结果分析可知,各因素对粗酶溶出量影响的重要程度依次为A>B>D>C,即菌液密度对粗酶溶出量影响最大,然后是超声波破碎功率、总工作时间,工作/间歇时间影响最小。由正交结果T值分析可知,利于粗酶溶出的最佳工作参数组合为A3B2D3C1,即菌液密度2.524,超声波破碎功率200 W,总工作时间8 min,工作/间歇时间为4 s/2 s。
| 试验 Tests |
A菌液密度 OD600 |
B功率 Ultrasonic power |
C工作与间歇时间 Work/Interval time |
D总工作时间 Total work time |
A280 |
| 1 | 1 | 1 | 1 | 1 | 0.403 |
| 2 | 1 | 2 | 2 | 2 | 0.932 |
| 3 | 1 | 3 | 3 | 3 | 1.381 |
| 4 | 2 | 1 | 2 | 3 | 0.95 |
| 5 | 2 | 2 | 3 | 1 | 1.382 |
| 6 | 2 | 3 | 1 | 2 | 1.533 |
| 7 | 3 | 1 | 3 | 2 | 1.705 |
| 8 | 3 | 2 | 1 | 3 | 3.818 |
| 9 | 3 | 3 | 2 | 1 | 1.943 |
| T1 | 0.905 | 1.019 | 1.918 | 1.243 | |
| T2 | 1.288 | 2.044 | 1.275 | 1.39 | |
| T3 | 2.489 | 1.619 | 1.489 | 2.05 | |
| R | 1.584 | 1.025 | 0.643 | 0.807 |
根据正交试验得出的最佳超声波破碎条件对菌株AD-28菌液进行破碎获得酶液,检测关键酶AMO、HAO、NIR和NAR酶活,结果如表 3所示。菌株AD-28的AMO酶活力为0.112 U/mL,比活力为0.028 U/mg,高于已报道菌株Alcaligenes faecalisstrain NR[9];AD-28的HAO酶活力为0.012 U/mL,比活力为0.003 U/mg,高于已报道菌株Agrobacterium sp. LAD9、Achromobacter sp. GAD3、Comamonas sp. GAD4[15],但不及Alcaligenes faecalis NR[16]和Acinetobacter calcoaceticus HNR[17],而且远低于活性污泥的HAO酶活力0.339 U/mL[18];AD-28的NIR酶活力和比活力分别为0.043 U/mL和0.011 U/mg,优于Acinetobacter sp. Y1[10],但低于Providencia rettgeri YL[19] 0.041 U/mg的水平;AD-28的NAR酶活力和比活力分别为0.108 U/mL和0.027 U/mg,优于Acinetobacter sp. Y1[10]、Alcaligenes faecalis C16[11]、Klebsiella pneumoniae CF-S9[20]的比活力,与Providencia rettgeri YL[19]比活力相当。
| 酶 Enzyme |
酶活力 Enzyme activity (U/mL) |
比活力 Specific activity (U/mg) |
| AMO | 0.112±0.003 | 0.028±0.001 |
| HAO | 0.012±0.001 | 0.003±0.000 |
| NIR | 0.043±0.002 | 0.011±0.001 |
| NAR | 0.108±0.004 | 0.027±0.001 |
以上酶活性测试结果表明,在AD-28的脱氮过程中,AMO、HAO、NIR、NAR都有一定量的表达。其中AMO和NAR酶活较高,说明在3种氮源存在的情况下,菌株氨氮的催化去除作用较强,在后期硝酸盐去除过程中,NAR也表达较多,结合不同时期的不同含氮污染物的去除效果,初步推断AD-28对含氮污染物可能的去除顺序路径,NH4+-N在AMO作用下被氧化为羟胺,然后由HAO氧化为亚硝酸盐氮(NO2−-N),而后NO2−-N和NO3−-N在NIR、NAR等的催化作用下还原为含氮气体。
3 讨论与结论近年来对异养硝化-好氧反硝化菌的分离、筛选、鉴定的研究较多,主要分布在不动杆菌属(Acinetobacter sp.)[21]、气单胞菌属(Aeromonas sp.)[22]、粪产碱杆菌(Alcaligenes faecalis)[23-24]、Anoxybacillus contaminans[25]、节杆菌属(Arthrobacter sp.)[26]、芽孢杆菌属(Bacillus sp.)[27]、脱氮副球菌(Paracoccus denitrificans)[28]、假单胞菌属(Pseudomonas sp.)[29-30]、红球菌(Rhodococcus sp.)[31]、Zobellella taiwanensis[32]等近20个属中,而关于嗜碱假单胞菌Pseudomonas alcaliphila只有在废水重金属处理中应用及还原硝酸盐的报道[33-34],且未见去除氨氮和亚硝酸盐应用的报道,本研究筛选的Pseudomonas alcaliphila AD-28在3种氮源同时存在的条件下生长24 h,OD600可达1.970,对初始浓度为18.85 mg/L的氨氮、26.13 mg/L的硝酸盐氮、19.47 mg/L的亚硝酸盐氮、66.11 mg/L的总氮去除率均达到96%以上,脱氮效果良好。
对异养硝化-好氧反硝化菌的研究,除了对脱氮优良菌株筛选外,还主要集中在碳源、氮源、C/N、DO、pH值、温度等环境因素对菌株脱氮性能的影响方面[21, 23, 29-31],而针对异养硝化-好氧反硝化菌对氮污染物的代谢路径研究,成为该类菌株进行脱氮应用的关键。不同菌株表达的酶系不同,代谢途径差异较大,因此,系统研究异养硝化-好氧反硝化过程中酶的种类、活性和代谢产物的种类可推测菌株对氮污染物的代谢路径。
提取菌株粗酶液的方法主要有渗透压休克法[10, 18-19]、超声波破碎法[9-11, 18]、化学渗透处理法[18]等,刘泽英等[10]对菌株Acinetobacter sp. Y1提取HAO酶的方法进行了比较,发现超声波破碎法得到的粗酶液蛋白条带较多、含量高,渗透压休克法得到的粗酶液蛋白条带少、含量也较低;原因可能是超声波破碎会使细胞壁、细胞膜破裂,细胞内容物完全释放,而渗透压休克法使细菌的质壁分离,细菌外膜破裂,释放周质蛋白。因此,本研究提取酶液主要采用超声波破碎法。超声波破碎法中,菌液OD600、超声波破碎功率、工作与间歇时间、总工作时间等条件对粗酶液的蛋白质浓度影响较大,不同菌株的提取条件也不尽相同[9-10],本研究中AD-28粗酶提取的最佳工作条件为:OD600=2.524,超声波破碎功率200 W,总工作时间8 min,工作/间歇时间为4 s/2 s。
在异养硝化-好氧反硝化作用中可能涉及到的酶有氨单加氧酶(AMO)、羟胺氧化酶(HAO)、硝酸盐还原酶(NAR)、亚硝酸盐还原酶(NIR)、NO还原酶(NOR)和N2O还原酶(NOS)[5]。因菌株的不同,异养硝化-好氧反硝化菌不同类型酶是否表达以及表达活性存在较大的差别。AMO将氨氮氧化为羟胺;HAO将羟胺转化为NO2−-N;NAR一般有膜质硝酸盐还原酶(Membrane-bound nitrate reductase,NAR)和周质硝酸盐还原酶(Periplasmic nitrate reductase,NAP)两种类型,菌体生长的好/厌氧条件直接影响两种酶类型的活性,在缺氧条件下前者表达较多,在好氧条件下后者表达较多;NIR是反硝化途径中的关键酶,包括Cyt cd1型亚硝酸盐还原酶和Cu型亚硝酸盐还原酶两种,均可还原亚硝酸盐氮。Zhang等[35]研究发现Pseudomonas fluorescens wsw-1001 AMO和HAO的活性分别为0.28 U/mg和0.24 U/mg,Zhao等[16]测定了Alcaligenes faecalis NR的酶活,未发现NAR和NIR,而HAO的活性为0.063 U/mg,Zhao等[17]对Acinetobacter calcoaceticus HNR的酶活进行了测定,发现其中并不存在NAR和NIR,而HAO的活性为0.051 U/mg;Chen等[15]测定了Agrobacterium sp. LAD9、Achromobacter sp. GAD3、Comamonas sp. GAD4细胞周质中的NAP,其活性分别为0.094、0.22和0.754 U/mg;菌株Acinetobacter sp. Y1[10]的NIR活性仅有0.002 U/mg,而Providencia rettgeri YL[19]则高达0.041 U/mg的水平。本研究测定了AD-28用超声波破碎法得到的粗酶液中最主要的4种酶活,发现AMO、HAO、NIR、NAR的酶活力分别为0.112、0.012、0.043、0.108 U/mL,比活力分别为0.028、0.003、0.011、0.027 U/mg。其中AMO、NAR的比活力较高,优于或和已报道的菌株相当。
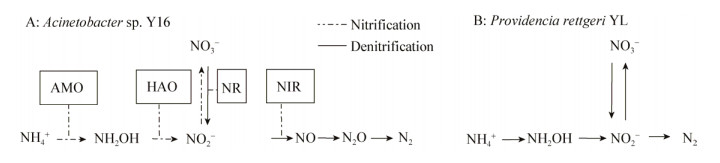
Huang等[36]通过酶活试验,提出了Acinetobacter sp. Y16的氮代谢路径(图 3A),这与Zhang等[37]对Bacillus methylotrophicus L7的研究结果相同;Taylor[38]对Providencia rettgeri YL的脱氮途径推测如图 3B所示。Li等[39]通过酶活试验和气体产物的分析,得出Pseudomonas stutzeri YG-24可能的脱氮途径为NH4+(→NH2OH)→NO2−→NO (N2O→N2)。本研究根据酶活测定结果,初步推断AD-28对含氮污染物可能的代谢路径,NH4+-N在AMO作用下被氧化为羟胺,然后由HAO氧化为亚硝酸盐氮(NO2−-N),而后NO2−-N和NO3−-N在NIR、NAR等酶的催化作用下还原为含氮气体。由于不同条件下的酶学特征有很大差异,下一步还需要通过对AD-28异养硝化-好氧反硝化的酶基因进行扩增、序列分析以及外源表达方面进行比较深入的研究,从而进一步确定其脱氮机理。
| [1] |
Wu QL, Ruan XH, Wu CM, et al. Analyses of sources and transformation of nitrogen as a contaminant in the river and lake water in the western region of the Taihu Lake basin[J]. Acta Scientiae Circumstantiae, 2015, 35(12): 3883-3889. (in Chinese) 吴庆乐, 阮晓红, 吴朝明, 等. 太湖西部河湖氮污染物来源及转化途径分析[J]. 环境科学学报, 2015, 35(12): 3883-3889. |
| [2] |
Li YM, Xian CF, Xu G, et al. Analysis of nitrogen pollutant emissions by urban sewage with initial nitrogen source apportionment: a case study of Haidian district in Beijing City[J]. Acta Scientiae Circumstantiae, 2017, 37(1): 146-153. (in Chinese) 李彦旻, 冼超凡, 徐刚, 等. 城市污水氮污染排放特征及来源探讨——以北京市海淀区为例[J]. 环境科学学报, 2017, 37(1): 146-153. |
| [3] |
Meng YY, Wang SR, Jiao LX, et al. Characteristics of nitrogen pollution and the potential mineralization in surface sediments of Dianchi lake[J]. Environmental Science, 2015, 36(2): 471-480. (in Chinese) 孟亚媛, 王圣瑞, 焦立新, 等. 滇池表层沉积物氮污染特征及其潜在矿化能力[J]. 环境科学, 2015, 36(2): 471-480. |
| [4] |
Zhang XY, Zhu F, Chen L, et al. Removal of ammonia nitrogen from wastewater using an aerobic cathode microbial fuel cell[J]. Bioresource Technology, 2013, 146: 161-168. DOI:10.1016/j.biortech.2013.07.024 |
| [5] |
Yang T, Yang Y, Liu YX. Research progress and challenges of heterotrophic nitrification-aerobic denitrification[J]. Microbiology China, 2017, 44(9): 2213-2222. (in Chinese) 杨婷, 杨娅, 刘玉香. 异养硝化-好氧反硝化的研究进展[J]. 微生物学通报, 2017, 44(9): 2213-2222. |
| [6] |
Zou YY, Zhang Y, Li MZ, et al. Isolation and identification of a heterotrophic nitrification-aerobic denitrification bacterium and its denitrification ability[J]. China Environmental Science, 2016, 36(3): 887-893. (in Chinese) 邹艳艳, 张宇, 李明智, 等. 一株异养硝化-好氧反硝化细菌的分离鉴定及脱氮活性研究[J]. 中国环境科学, 2016, 36(3): 887-893. DOI:10.3969/j.issn.1000-6923.2016.03.034 |
| [7] |
Sun QH, Yu DS, Zhang PY, et al. Isolation, identification and nitrogen removal characteristics of a heterotrophic nitrification-aerobic denitrification strain y3 isolated from marine environment[J]. Environmental Science, 2016, 37(3): 1089-1097. (in Chinese) 孙庆花, 于德爽, 张培玉, 等. 海洋菌株y3的分离鉴定及其异养硝化-好氧反硝化特性[J]. 环境科学, 2016, 37(3): 1089-1097. |
| [8] |
Zhang FF, Xie FX, Zhou K, et al. Pseudomonas alcaliphila AD-28 and application thereof to denitrification of water body: CN, 201410153835[P]. 2014-07-16 (in Chinese) 张峰峰, 谢凤行, 周可, 等.一株嗜碱假单胞菌AD-28及其在水体脱氮中的应用: 中国, 201410153835[P]. 2014-07-16 |
| [9] |
An Q, Zhao B, He YL. Heterotrophic nitrification capability and its enzyme activity of Alcaligenes faecalis strain NR[J]. Journal of Shanghai Jiaotong University, 2012, 46(5): 774-779. (in Chinese) 安强, 赵彬, 何义亮. 异养硝化菌Alcaligenes faecalis strain NR的硝化性能及其酶活性[J]. 上海交通大学学报, 2012, 46(5): 774-779. |
| [10] |
Liu ZY, Lyu YK, Liu YX, et al. Ammonia nitrogen removal characteristic and its key enzymes activity of Acinetobacter sp. Y1[J]. Microbiology China, 2016, 43(9): 1931-1938. (in Chinese) 刘泽英, 吕永康, 刘玉香, 等. Acinetobacter sp. Y1的氨氮去除性能及其关键酶活性[J]. 微生物学通报, 2016, 43(9): 1931-1938. |
| [11] |
Wang Y, Liu YX, An H, et al. Influence of metal ions on nitrogen removal and NO2--N accumulation by Alcaligenes faecalis C16[J]. Microbiology China, 2014, 41(11): 2254-2263. (in Chinese) 王瑶, 刘玉香, 安华, 等. 金属离子对粪产碱杆菌C16的脱氮和亚硝酸盐积累的影响[J]. 微生物学通报, 2014, 41(11): 2254-2263. |
| [12] |
Zhao B, He YL, Huang J, et al. Heterotrophic nitrogen removal by Providencia rettgeri strain YL[J]. Journal of Industrial Microbiology & Biotechnology, 2010, 37(6): 609-616. |
| [13] |
State Environmental Protection Administration, Editorial Board of Water and Exhausted Water Monitoring Analysis Method. Water and Exhausted Water Monitoring Analysis Method[M]. 4th ed. Beijing: China Environmental Science Press, 2002: 211-285. (in Chinese) 国家环境保护总局, 水和废水监测分析方法编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 211-285. |
| [14] |
Shi RL, Wang LP, Liu YP. Conditions of ultrasonic wave disruption for recombination E. coli of alginate lyase[J]. Hunan Agricultural Sciences, 2010(21): 98-101, 104. (in Chinese) 石荣莲, 汪立平, 刘玉佩. 重组褐藻胶裂解酶基因工程菌超声波破碎条件研究[J]. 湖南农业科学, 2010(21): 98-101, 104. DOI:10.3969/j.issn.1006-060X.2010.21.030 |
| [15] |
Chen Q, Ni JR. Heterotrophic nitrification-aerobic denitrification by novel isolated bacteria[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(9): 1305-1310. |
| [16] |
Zhao B, An Q, He YL, et al. N2O and N2 production during heterotrophic nitrification by Alcaligenes faecalis strain NR[J]. Bioresource Technology, 2012, 116: 379-385. DOI:10.1016/j.biortech.2012.03.113 |
| [17] |
Zhao B, He YL, Hughes J, et al. Heterotrophic nitrogen removal by a newly isolated Acinetobacter calcoaceticus HNR[J]. Bioresource Technology, 2010, 101(14): 5194-5200. DOI:10.1016/j.biortech.2010.02.043 |
| [18] |
He ZX, Wei YN, Liu JJ, et al. Optimization of crude hydroxylamine oxidoreductase extraction from activated sludge and its activity measurement[J]. Acta Scientiae Circumstantiae, 2015, 35(12): 3797-3804. (in Chinese) 何志仙, 魏旖旎, 刘婧晶, 等. 活性污泥羟氨氧化还原酶粗酶提取及活性测定方法的优化研究[J]. 环境科学学报, 2015, 35(12): 3797-3804. |
| [19] |
Chen Q, Ma T, Wang T. Separation and purification of hydroxylamine oxidase from Agrobacterium tumefaciens LAD9[J]. Biotechnology Bulletin, 2014(7): 69-73. (in Chinese) 陈倩, 马涛, 王婷. 异养硝化好氧反硝化菌株Agrobacterium tumefaciens LAD9羟胺氧化酶的分离纯化[J]. 生物技术通报, 2014(7): 69-73. |
| [20] |
Padhi SK, Tripathy S, Sen R, et al. Characterisation of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae CF-S9 strain for bioremediation of wastewater[J]. International Biodeterioration & Biodegradation, 2013, 78: 67-73. |
| [21] |
Huang TL, Zhang LN, Zhang HH, et al. Screening and nitrogen removal characteristics of a heterotrophic nitrification-aerobic denitrification strain[J]. Ecology and Environmental Sciences, 2015, 24(1): 113-120. (in Chinese) 黄廷林, 张丽娜, 张海涵, 等. 一株贫营养异养硝化-好氧反硝化菌的筛选及脱氮特性[J]. 生态环境学报, 2015, 24(1): 113-120. |
| [22] |
Chen MX, Wang H, Zhou HZ, et al. Screening and characteristics of heterotrophic nitrification-aerobic denitrification strain HN-02[J]. Chinese Journal of Applied & Environmental Biology, 2013, 19(4): 688-693. (in Chinese) 陈茂霞, 王欢, 周后珍, 等. 异养硝化-好氧反硝化菌HN-02的筛选及其特性[J]. 应用与环境生物学报, 2013, 19(4): 688-693. |
| [23] |
Fang HY, Wang Z, Li JH, et al. Denitriding characteristics of a heterotrophic nitrification-aerobic denitrification strain Alcaligenes faecalis No. 4[J]. Chinese Journal of Environmental Engineering, 2015, 9(2): 983-988. (in Chinese) 方海洋, 王智, 李建华, 等. 异养硝化-好氧反硝化菌粪产碱杆菌的脱氮特性[J]. 环境工程学报, 2015, 9(2): 983-988. |
| [24] |
Blagodatsky SA, Kesik M, Papen H, et al. Production of NO and N2O by the heterotrophic nitrifier Alcaligenes faecalis parafaecalis under varying conditions of oxygen saturation[J]. Geomicrobiology Journal, 2006, 23(3/4): 165-176. |
| [25] |
Chen J, Zheng J, Li Y, et al. Characteristics of a novel thermophilic heterotrophic bacterium, Anoxybacillus contaminans HA, for nitrification-aerobic denitrification[J]. Applied Microbiology and Biotechnology, 2015, 99(24): 10695-10702. DOI:10.1007/s00253-015-6870-0 |
| [26] |
Ho KL, Chung YC, Lin YH, et al. Biofiltration of trimethylamine, dimethylamine, and methylamine by immobilized Paracoccus sp. CP1[J]. Chemosphere, 2008, 72(2): 250-256. DOI:10.1016/j.chemosphere.2008.01.044 |
| [27] |
Deng B, Zheng JJ, Fu LQ, et al. Identification and characteristics of a high-efficient nitrification bacterium[J]. Chinese Journal of Environmental Engineering, 2013, 7(9): 3635-3641. (in Chinese) 邓斌, 郑佳佳, 傅罗琴, 等. 一株高效硝化菌的鉴定及其特性[J]. 环境工程学报, 2013, 7(9): 3635-3641. |
| [28] |
Moir JWB, Crossman LC, Spiro S, et al. The purification of ammonia monooxygenase from Paracoccus denitrficans[J]. FEBS Letters, 1996, 387(1): 71-74. DOI:10.1016/0014-5793(96)00463-2 |
| [29] |
Zhao D, Yu DS, Li J, et al. Isolation and identification of a bacterial strain ZD8 and its characteristics of heterotrophic nitrification and anoxic/oxic denitrification[J]. Acta Scientiae Circumstantiae, 2013, 33(11): 3007-3016. (in Chinese) 赵丹, 于德爽, 李津, 等. 菌株ZD8的分离鉴定及其异养硝化和缺氧/好氧反硝化特性研究[J]. 环境科, 2013, 33(11): 3007-3016. |
| [30] |
Zhou YQ, Xin X, Yao L, et al. Isolation and identification of a heterotrophic nitrification-aerobic denitrification bateria with high efficiency and its denitrification characteristics[J]. Chinese Journal of Environmental Engineering, 2013, 7(10): 4127-4132. (in Chinese) 周迎芹, 信欣, 姚力, 等. 一株高效异养硝化-好氧反硝化菌的分离鉴定及脱氮性能[J]. 环境工程学报, 2013, 7(10): 4127-4132. |
| [31] |
Chen PZ, Wang LG, Wang YC, et al. Screening and denitrification characteristics of a heterotrophic nitrification-aerobic denitrifier bacteria[J]. Environmental Science, 2009, 30(12): 3614-3618. (in Chinese) 陈昢圳, 王立刚, 王迎春, 等. 异养硝化⁃好氧反硝化菌的筛选及脱氮性能的实验研究[J]. 环境科学, 2009, 30(12): 3614-3618. DOI:10.3321/j.issn:0250-3301.2009.12.028 |
| [32] |
Lei Y, Wang YQ, Liu HJ, et al. A novel heterotrophic nitrifying and aerobic denitrifying bacterium, Zobellella taiwanensis DN-7, can remove high-strength ammonium[J]. Applied Microbiology and Biotechnology, 2016, 100(9): 4219-4229. DOI:10.1007/s00253-016-7290-5 |
| [33] |
Jiang HD, He XH, Zhang LX, et al. Reduction of selenite to elemental red selenium under aerobic condition by Pseudomonas alcaliphila MBR[J]. Acta Microbiologica Sinica, 2010, 50(10): 1347-1352. (in Chinese) 蒋华东, 何晓红, 张礼霞, 等. 一株假单胞菌(Pseudomonas alcaliphila MBR)好氧还原亚硒酸钠为红色单质硒[J]. 微生物学报, 2010, 50(10): 1347-1352. |
| [34] |
Li DP, He XH, Tao Y, et al. Pseudomonas and application thereof in biological reduction and biological adsorption: CN, 200810044958[P]. 2009-09-16 (in Chinese) 李大平, 何晓红, 陶勇, 等.一株假单胞菌及其在生物还原和生物吸附中的用途: 中国, CN200810044958[P]. 2009-09-16 |
| [35] |
Zhang SM, Sha CQ, Jiang W, et al. Ammonium removal at low temperature by a newly isolated heterotrophic nitrifying and aerobic denitrifying bacterium Pseudomonas fluorescens wsw-1001[J]. Environmental Technology, 2015, 36(19): 2488-2494. DOI:10.1080/09593330.2015.1035759 |
| [36] |
Huang XF, Li WG, Zhang DY, et al. Ammonium removal by a novel oligotrophic Acinetobacter sp. Y16 capable of heterotrophic nitrification-aerobic denitrification at low temperature[J]. Bioresource Technology, 2013, 146: 44-50. DOI:10.1016/j.biortech.2013.07.046 |
| [37] |
Zhang QL, Liu Y, Ai GM, et al. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7[J]. Bioresource Technology, 2012, 108: 35-44. DOI:10.1016/j.biortech.2011.12.139 |
| [38] |
Taylor S. Further study on the heterotrophic nitrification-aerobic denitrification ability of two MBR isolated bacteria-Providencia rettgeri YL and Alcaligenes faecalis NR[D]. Shanghai: Master's Thesis of Shanghai Jiao Tong University, 2009 (in Chinese) Taylor S.两株异养细菌Providencia rettgeri YL和Alcaligenes faecalis NR脱除能力的研究[D].上海: 上海交通大学硕士学位论文, 2009 http://cdmd.cnki.com.cn/Article/CDMD-10248-2010033692.htm |
| [39] |
Li CE, Yang JS, Wang X, et al. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a phosphate accumulating bacterium Pseudomonas stutzeri YG-24[J]. Bioresource Technology, 2015, 182: 18-25. DOI:10.1016/j.biortech.2015.01.100 |
 2019, Vol. 46
2019, Vol. 46