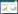扩展功能
文章信息
- 衷炜华, 朱笔通, 赵春贵, 张晓波, 徐慧芳, 杨素萍
- ZHONG Wei-Hua, ZHU Bi-Tong, ZHAO Chun-Gui, Zhang Xiao-Bo, Xu Hui-Fang, YANG Su-Ping
- 固氮红细菌(Rhodobacter azotoformans) YLK20去除无机氮的影响因素
- Factors affecting nitrogen removal from aquaculture wastewater by Rhodobacter azotoformans YLK20
- 微生物学通报, 2019, 46(9): 2146-2156
- Microbiology China, 2019, 46(9): 2146-2156
- DOI: 10.13344/j.microbiol.china.190291
-
文章历史
- 收稿日期: 2019-04-08
- 接受日期: 2019-06-10
- 网络首发日期: 2019-07-01
中国渔业生态环境状况公报(2017)数据显示,养殖水体中无机氮含量超标居众多污染物之首,不但制约了水产养殖业的发展,也带来了环境和健康等诸多问题。养殖水体中的大量有机物沉积在沉积物-水界面层,经微生物作用后该区域往往形成缺氧区或厌氧区,进而厌氧微生物的代谢产物向水体释放,这是导致水体富营养化及氨氮、亚硝氮等大量累积的主要原因[1-3],硝氮虽无毒,但会被微生物转化为对养殖对象毒副作用较大的氨氮和亚硝氮。因此,如何有效去除养殖水体中的无机三态氮,维持水体生态平衡,是保障水产养殖业健康发展的主要问题[3-4]。微生物修复技术已广泛应用于水产养殖业,在改善水质、控制污染物、调节水体微生物群落结构和疾病防治等方面发挥了重要作用[3, 5-6]。不同微生物类群其代谢特性和环境适应性有较大差异,复杂多变的养殖水体(光、氧、pH、碳和氮等)环境势必会影响微生物制剂的功效。针对性地选育适合水体沉积物-水界面生境(低溶氧和高有机氮化物)的高效除氮菌种,系统地了解其除氮特性与复杂环境适应性关系,对于微生物制剂的合理应用具有重要意义。
不产氧光合细菌(Anoxygenic phototrophic bacteria,APB)作为一类重要的微生物资源,在水产养殖业已被广泛研究和应用。目前研究和应用的APB菌种主要包括Rhodopseudomonas (Rp.) palustris、Rhodobacter (Rb.) sphaeroides、Rhodospirillum rubrum、Rubrivivax gelatinosa、Marichromatium (M.) gracile等[6]。关于APB对氨氮和亚硝氮去除特性及影响因素的研究表明,在适宜菌体生长的光、氧、盐度和有机碳等条件下,菌株对氨氮和亚硝氮均具有良好的去除能力,但不同菌株对环境的适应性以及对无机三态氮的去除能力有很大差异[6-7]。养殖水体中无机三态氮往往共存且相互转化,有机碳和有机氮种类繁多,势必会影响APB菌株的除氮能力,但在无机三态氮共存体系中研究有机碳和有机氮对APB菌株脱氮影响的报道较少,主要集中在M. gracile YL28和Rp. palustris CQV97这2个菌株[6-7]。这2个菌株都具有氨同化和反硝化脱氮机制,能以亚硝氮为唯一氮源生长,但其生长机制尚不明确。碳源不同,这2个菌株脱氮能力有很大差异,例如葡萄糖、乙酸钠和乙醇等有机碳可促进M. gracile YL28对无机氮的去除,但葡萄糖严重抑制Rp. palustris CQV97的氨氮去除,有机氮严重影响它们对水体氨氮的去除,甚至使水体氨氮升高[6-7],目前尚未见到在有机氮环境中高效去除无机三态氮菌株的报道。淡水种(如Rp. palustris)制剂已应用于海水养殖水体,但未见到盐度与菌株除氮能力关系的报道,这些淡水菌株能否在海水养殖水体环境中生长并除氮,还有待进一步考证。
针对目前APB除氮研究和应用中存在的问题,本文以Rb. azotoformans YLK20菌株为研究对象,在高浓度无机三态氮共存的体系和适宜条件(光照、温度和pH)下,系统地研究了8种有机碳(有机酸盐、糖类和醇类)、2种有机氮(尿素和胰蛋白胨)和盐度对该菌株生长及去除无机三态氮的影响,在淡水和海水实际养殖水体中考察了该菌株的除氮效果,并从基因组水平上初步分析了该菌株主要的碳代谢、氮代谢和耐盐特性,为针对性选育APB微生态制剂菌种以及制剂的合理应用提供指导。
1 材料与方法 1.1 菌株固氮红细菌(Rhodobacter azotoformans) YLK20由本实验室分离和鉴定,菌株保藏号为CGMCC7.312,基因组GenBank登录号为GCA_002844445.1,由上海美吉生物医药科技有限公司采用Illumina HiSeq高通量测序方法测定。
1.2 基因组获取与注释通过软件Velvet 1.2.1对测序原始数据进行基因组序列组装,将重新组装得到的基因组序列提交至NCBI的原核基因组注释数据库PGAP (Prokaryotic genome annotation pipeline, https://www.ncbi.nlm.nih.gov/genome/annotation_prok/release_notes/)进行注释。以Rhodobacter属名为关键词,通过NCBI获得Rhodobacter基因组数据,并提交至RAST (Rapid annotation using subsystem technology,http://rast.nmpdr.org/)数据库进行基因组重注释[8],通过Glimmer算法进行高质量的基因组重分析,以消除因原注释方法不同而产生的偏差。将RAST重注释分析结果结合KEGG (Kyoto encyclopedia of genes and genomes)数据库中的代谢途径注释和NCBI中的蛋白列表对各数据库未注释的序列进行核对补充,为了确认数据库注释基因或确认可疑基因的功能,将基因编码的蛋白序列提交至CDD (Conserved domain database),与验证功能的同源序列比对,进一步确定该基因的功能[9]。
1.3 主要试剂和仪器酵母浸出粉和胰蛋白胨,Oxford公司;亚硝酸钠、氯化铵、硝酸钾,国药集团化学试剂有限公司。紫外可见分光光度计,翱艺仪器有限公司;多参数水质测量仪,Oakton公司。
1.4 培养基和菌种悬液制备Ormerod培养基[10]中添加酵母浸出粉3.0 g/L、胰蛋白胨5.0 g/L和葡萄糖2.5 g/L,调节pH约7.0。菌悬液制备:在30 ± 2 ℃、2 500 lx条件下光照厌氧培养4 d,8 000 r/min条件下离心5 min收集菌体,无菌水洗涤菌体2次,制备得到OD660约为3.0的菌悬液。
1.5 无机三态氮测定体系无机三态氮共存体系:在无碳氮的Ormerod培养基中添加氯化铵、亚硝酸钠和硝酸钾,其终浓度(N元素)分别设计为52、156和354 mg/L,以实测值为准。
有机碳对无机三态氮去除的影响:在无机三态氮共存体系中,按乙酸钠(2.46 g/L)中碳原子含量计,添加8种不同有机碳,葡萄糖(1.98 g/L)、果糖(1.80 g/L)、蔗糖(1.71 g/L)、丙酮酸钠(1.92 g/L)、柠檬酸钠(2.94 g/L)、乳糖(1.80 g/L)、甘露醇(1.82 g/L)和乙醇(1.38 g/L)。
有机氮对无机三态氮去除的影响:在含有乙酸钠(2.46 g/L)的无机三态氮共存体系中,添加不同浓度的胰蛋白胨或尿素,对照(CK)未添加有机氮。
盐度对无机三态氮去除的影响:在含有乙酸钠(2.46 g/L)的无机三态氮共存体系中,添加不同浓度NaCl,对照(CK)未添加NaCl。
测定体系的容器为100 mL规格玻璃蓝盖瓶,总容积约为140 mL,装样量为80%,每瓶装液量约为110 mL,初始溶氧量(Dissolved oxygen,DO)约为0.32 mg/L,调整体系pH为7.0,菌种悬液接种量为3.0%,容器置于30 ± 2 ℃、2 500 lx光照静置培养,每个处理设置3个重复。处理过程中取样,测定生物量、氨氮、硝氮和亚硝氮含量。
1.6 实际养殖水体除氮体系从福建厦门集美区水产养殖试验场(N24°35′3.08″,E118°05′52.66″)和集美区养殖区(N24°34′3.83″,E118°06′8.81″)排水口分别采集对虾(海水养殖)和鳗鱼(淡水养殖)水样,低温静置12 h,分装到规格100 ml的玻璃蓝盖瓶中,每瓶装液量约为110 mL,菌种悬液接种量为3.0%,于32 ± 2 ℃、2 500 lx光照静置培养,培养过程中取样测定无机三态氮含量,以未接种菌为对照(CK),每处理设置3个重复。
1.7 生物量、pH和无机三态氮的测定菌体生物量采用比浊法测定:在光程为1 cm的比色杯中,于分光光度计上测定660 nm处光密度值(OD660)[11]。用pH计测定样品pH值。氨氮、亚硝氮和硝氮分别采用次溴酸钠氧化法(GB12763.4-91)、N-(1-萘基)乙二胺分光光度法(GB/T11889-1989)和紫外分光光度法(HJ/T346-2007)进行测定[11]。计量单位:mg/L或r (%),r表示残留率,无机氮的残留率(r)按照公式r (%)=Ct/C0×100计算,其中C0和Ct分别表示无机三态氮的初始浓度和测定时刻的浓度(mg/L)。无机三态氮的含量均以测定的氮素含量计算,重复测定3次。
2 结果与分析 2.1 生物信息学分析Rb. azotoformans YLK20基因组序列全长4 325 082 bp,(G+C)mol%含量为68.5%,编码5 182个基因,含10个16S-23S-5S核糖体rRNA和54个tRNA基因,包含4 483个CDS (Coding sequence),其中有995个大于1 kb。通过RAST的Subsystems子系统分析和FIGfams蛋白数据库比对完成直系同源蛋白分类,得到包括物质代谢、细胞生物学过程及信号传导、信息储存与处理以及未有明确功能的编码蛋白。如图 1所示,YLK20基因组有2 978个功能基因,参与氨基酸和衍生物(Amino acids and derivatives),碳水化合物(Carbohydrates),辅助因子(Cofactors)、维生素(vitamins)、辅基(prosthetic groups)和色素(pigments),脂肪酸(Fatty acids)、脂(lipids)和异戊二烯类(isoprenoids),呼吸作用(Respiration),蛋白质代谢(Protein metabolism),应激反应(Stress response)等功能蛋白所占总功能蛋白的比例较大,分别占14.84%、14.67%、9.2%、7.8%、6.7%、4.6%和4.2%。
|
| 图 1 Rb. azotoformans YLK20功能蛋白分类 Figure 1 The profile of functional proteins in Rb. azotoformans YLK20 |
|
|
氮代谢功能基因分析显示,YLK20拥有氨化、氨同化、固氮和反硝化4条途径。固氮基因簇包括nifBDEHKQTWXZ,关键基因为nifD (nt 17129-18610)、nifK (nt 15510-17030)和nifH (nt 18672-19547)。反硝化关键酶基因包括硝酸还原酶基因napADEF [(napA (nt 958-3444)、napD (nt 24347-25288)、napE (nt 25843-26025)和napF (nt 26033-26515)]、亚硝酸还原酶基因nirK (nt 26498-27565)、一氧化氮还原酶基因norBC (nt 64379-65698)和一氧化二氮还原酶基因nosZ (nt 65701-67598)。碳代谢相关基因丰富,主要涉及EMP (Embden meyerhof parnas)途径、HMP (Hexose monophosphate pathway)途径和TCA (Tricarboxylic acid cycle)循环。目前已报道的Rb. azotoformans归到淡水种分支,但YLK20基因组上含有多种耐盐相关基因,如nhaC (nt 8042-9532,与胞内Na+排出相关)、betB (nt 5540-6451,与甜菜碱转运相关)、gbsA (nt 36157-37608,与甜菜碱合成相关)和调节渗透压相关的水通道蛋白Z基因。耐盐基因比对分析显示[12-13],该菌株Na+外排基因(nhaC)与近缘海水种Rhodovulum sulfidophilum的Na+外排基因(nhaA)在进化关系上呈明显的两个分支,也未发现海水种中的MATE族MDR外排泵和钠/甘氨酸同向转运体glyP等基因。虽然YLK20与近缘海水种的耐盐相关基因不同,但具有丰富的耐盐相关基因,由此推测该菌株对盐具有良好的耐受性,进一步测定其耐盐程度。
2.2 有机碳对YLK20生长和无机三态氮去除的影响实际水体中可能存在多种类型的有机碳,为了理解该菌株对不同有机碳的适应性,考察了8种常见有机碳对YLK20除氮效果的影响。
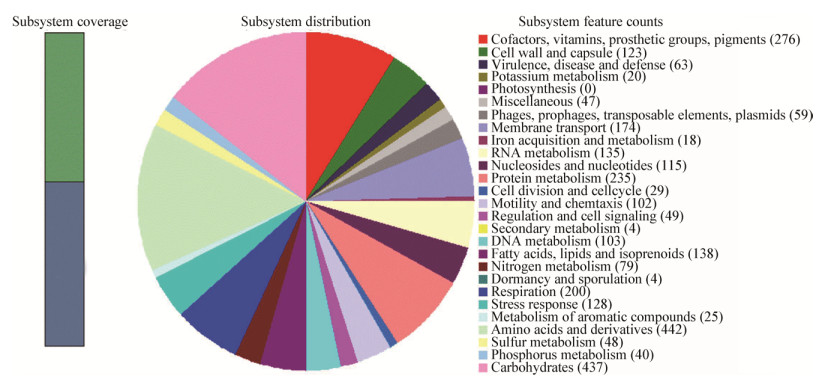
有机碳对菌体生长和pH影响结果如图 2A和2B所示。结果表明:在无机三态氮共存体系中,有机碳类型不同,菌体生长速率和最大生物量存在差异。总体上来看,培养体系中添加小分子有机酸(丙酮酸、乙酸和柠檬酸)盐、醇(甘露醇和乙醇)和蔗糖更有利于菌体生长,其中丙酮酸钠和乙酸钠是YLK20生长良好有机碳,其生物量(OD660)可达到1.776和1.551。在单糖(葡萄糖和果糖)体系中菌体生物量相对较低,其最大生物量(OD660)在0.751−0.832内。丙酮酸钠、乙酸钠、柠檬酸钠和甘露醇使培养体系pH升高,乙醇和蔗糖基本不影响体系pH,而单糖(葡萄糖和果糖)使体系pH降低。由于低pH对大多数APB生长具有抑制作用,这可能是该菌体在单糖体系中生长较差的原因。

|
| 图 2 有机碳对菌体生物量(A)、pH (B)、氨氮(C)、硝氮(D)和亚硝氮(E)去除过程的影响 Figure 2 Effects of organic carbons on biomass (A), pH (B), ammonia (C), nitrate (D) and nitrite (E) 注:▲:丙酮酸钠;△:乙酸钠;☆:甘露醇;★:乙醇;▽:柠檬酸钠;○:蔗糖;□:葡萄糖;■:果糖;●:乳糖.初始氮浓度(C,mg/L):氨氮:51.87;硝氮:353.66;亚硝氮:155.34. Note: ▲: sodium pyruvate; △: acetate; ☆: mannitol; ★: ethanol; ▽: sodium citrate; ○: sucrose; □: glucose; ■: fructose; ●: lactose. Initial concentration (C, mg/L): ammonia: 51.87; nitrate: 353.66; nitrite: 155.34. |
|
|
有机碳对菌体去除无机三态氮的影响结果如图 2C−2E所示。结果表明:有机碳种类不同,菌体去除无机三态氮的能力表现出差异。一般来说,对菌体生长有促进作用的碳源,也有利于无机三态氮的去除。丙酮酸钠和乙酸钠体系中,无机氮去除能力最高。在乙酸钠体系中,氨氮、硝氮和亚硝氮最大去除率分别达84.95%、89.90%和99.76% (6 d)。在单糖(葡萄糖和果糖)体系中,菌体生物量和除氮能力都较低,其中果糖去除能力最低,其对氨氮和硝氮去除率分别为21.36%和31.71%,对亚硝氮没有明显的去除作用。
2.3 有机氮对YLK20生长和无机三态氮去除的影响实际养殖体系中,饲料残留、动物排泄物及其微生物降解产物在水体中溶解沉降,会产生多种含氮有机物。由于尿素是养殖动物排泄终产物,蛋白胨是蛋白质的降解产物,本研究以尿素或胰蛋白胨作为含氮有机物代表,在无机三态氮共存体系中研究了菌体在复杂有机氮环境中的除氮能力。
在胰蛋白胨体系中处理7 d (图 3A),随着处理时间的延长,生物量和硝氮去除率升高并趋于稳定,随胰蛋白胨浓度(0−14.00 g/L)升高,生长速率和硝氮去除速率升高,低浓度(≤1.43 g/L)时氨氮和亚硝氮去除速率逐渐升高,其去除率分别达96%和98%以上。高浓度(1.43−14.00 g/L)下氨氮和亚硝氮暂时积累,但随着时间的延长氨氮和亚硝氮又逐渐去除,3 d时亚硝氮被有效去除,去除率达98%以上,浓度达7.00 g/L时,氨氮的去除率约为35%,浓度达14.00 g/L时,体系中氨氮不但不去除,甚至高于初始值,这可能是由于菌体的氨化作用大于菌体的消耗所致。由此可见,蛋白胨可促进硝氮的去除,虽然亚硝氮出现暂时性积累,也能被有效去除,低浓度(≤1.43 g/L)时促进菌体对氨氮的去除,浓度高达7.00 g/L时虽然对氨氮去除有抑制,但仍有明显的去除。
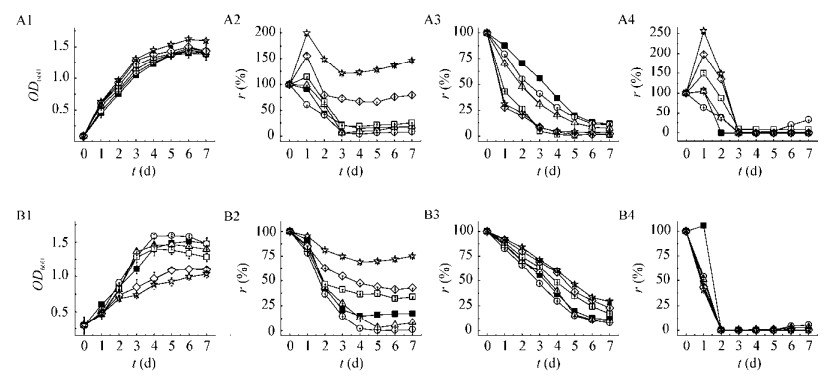
|
| 图 3 胰蛋白胨(A)和尿素(B)对菌体生物量(1)、氨氮(2)、硝氮(3)和亚硝氮(4)去除过程的影响 Figure 3 Effects of tryptone (A) or urea (B) on biomass (1), ammonia (2), nitrate (3) and nitrite (4) 注:初始无机氮浓度(C,mg/L):氨氮:52.32;硝氮:354.28;亚硝氮:156.26.胰蛋白胨或尿素(C,g/L):■:0;○:0.71;△:1.43;□; :3.21;◇:7.00;☆:14.00. Note: Initial concentration (C, mg/L): ammonia: 52.32; nitrate: 354.28; nitrite: 156.26. tryptone or urea (C, g/L): ■: 0; ○: 0.71; △: 1.43; □: 3.21; ◇: 7.00; ☆: 14.00. |
|
|
在尿素体系中处理7 d (图 3B),随处理时间延长,生物量和无机三态氮去除率逐渐升高并趋于稳定。随着尿素浓度升高,即使高达14.0 g/L时虽然对菌体生长、氨氮和硝氮去除具有抑制作用,但菌体也能良好地生长,生物量(OD660)接近1.0 (6 d)时也具有良好的去除氨氮和硝氮能力,去除率分别为28.1%和66.3%,但对亚硝氮去除能力未见抑制。在低浓度时,尿素对菌体生长、氨氮和硝氮去除表现出促进作用,尿素浓度为0.71 g/L时,体系中生物量(OD660)最大值可达1.597 (4 d),比对照组高12.7%,氨氮和硝氮的最大去除率分别为99.6% (5 d)和84.6% (5 d),分别比对照高17.8%和3.3%。由此可见,环境含有尿素时菌体能良好地生长,具有良好的氨氮、硝氮和亚硝氮去除能力,低浓度尿素更有利于菌体生长和无机三态氮去除。
2.4 盐度对YLK20生长和无机三态氮去除的影响海水入侵引发海水向陆地移动,导致淡水盐化,使淡水养殖的氮负荷增大[14],不但影响了淡水养殖业,也会影响微生物对水体的修复能力。
目前一些陆源淡水种微生物制剂已用于海水养殖体系水体修复,为进一步了解这些菌种在海水环境中的除氮规律,考察不同盐度对该菌株去除无机三态氮的影响。结果如图 4所示,随着盐度升高,菌体生物量(OD660)在1.392−2.513范围内,1%盐度时生物量(OD660)最大值可达到2.513,3.0%盐度时生物量不低于无盐对照,表明该菌株能够良好地耐盐,基本适应海水的盐度(3.0%)。随着盐度(≤3.0%)增加,氨氮去除能力有所增加,硝氮去除能力逐渐降低,3.0%盐度时硝氮去除率为68.86%,而亚硝氮去除率大幅度降低,从99.72%下降到6.71%,在盐度为1.5%时去除率下降至20.65%。由此可见,在高浓度无机三态氮共存体系中,该菌株能够在0−3.0%盐度环境中良好生长,具有良好的耐盐特性,在3.0%盐度环境中表现出良好的脱氨氮和硝氮能力,亚硝氮去除能力受到严重抑制。
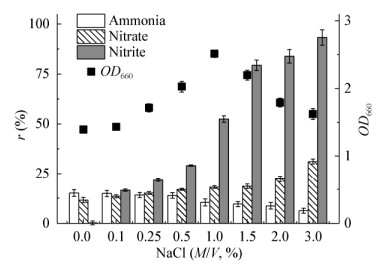
|
| 图 4 盐度对菌体生长和无机三态氮去除影响(5 d) Figure 4 Effect of salinity on cell growth and inorganic nitrogen removal on the 5th days 注:初始无机氮浓度(C,mg/L):氨氮:51.15;硝氮:352.78;亚硝氮:154.93. Note: Initial concentration (C, mg/L): ammonia: 51.15; nitrate: 352.78; nitrite: 154.93. |
|
|
通过异位方法来处理养殖污染水体,YLK20对养殖水体无机三态氮去除结果如图 5所示。对照水体中,由于土著微生物的作用,水体无机三态氮呈现不同变化,随时间延长,氨氮总体上呈降低趋势,硝氮没有明显的降低,亚硝氮出现暂时性上升的波动现象。相比于对照组,实验组海水对虾和淡水鳗鱼养殖水体中的氨氮、硝氮和亚硝氮均具有良好的去除效果,氨氮和硝氮在处理5 d后基本被完全去除,亚硝氮含量也明显降低。由此表明,该菌株与水体中土著微生物共同作用,能够良好地去除无机三态氮污染,改善水体水质。

|
| 图 5 YLK20对养殖水体中氨氮(A)、硝氮(B)和亚硝氮(C)去除过程的影响 Figure 5 Effect of YLK20 on ammonia (A), nitrate (B) and nitrite (C) removal process in rearing water 注:□,○:无菌对照组;■,●:实验组;□,■:对虾海水养殖水体;○,●:鳗鱼淡水养殖水体. Note: □, ○: CK; ■, ●: Experimental; □, ■: shrimp mariculture; ○, ●: eel freshwater aquaculture. |
|
|
环境中有毒氮化物(尤以游离态氨和亚硝氮危害严重)及富营养化,都可能对养殖环境产生很大影响[5]。养殖水体中无机三态氮尤其是氨氮和亚硝氮的去除受到人们普遍关注。高效除氮菌株的理化特性与环境适应性息息相关,因此,研究和认识菌株的理化特性不但是微生物制剂合理运用的前提,也能进一步发现和选育具有良好环境适应性的菌株。
目前影响微生物除氮效果的研究已有较多报道,结果显示,不同菌种其除氮能力存在较大差异,也与除氮评价体系(无机氮的种类和浓度)和影响因素相关。在单一无机氮体系中,Pseudomonas fluorescens L2对329 mg/L硝氮的去除率为100.0%,去除过程中亚硝氮暂时性积累[15];Rp. palustris R3对40 mg/L氨氮的去除率为80.0%[16];Halomonas titanicae X3对42.0 mg/L硝氮和亚硝氮的去除率分别为96.5%和99.1%[17];Rp. palustris wps菌株对亚硝氮(50 mg/L)的去除率不低于99%[18];M. gracile YL28对氨氮(9.64 mmol/L)、硝氮(22.90 mmol/L)和亚硝氮(13.50 mmol/L)的去除率均不低于99.0%[19];Rp. palustris CQV97对33.23、76.65和108.25 mg/L氨氮的去除率分别为99.0%、88.2%和84.1%,硝氮(45.37−215.40 mg/L)和亚硝氮(43.64−175.21 mg/L)的去除率均不低于99.0%[20]。由于亚硝氮不是APB的良好氮源且对细胞具有毒性,一些菌株往往在氨氮和亚硝氮共存体系中才有脱除亚硝氮能力,如在无机三态氮共存体系中,M. gracile YL28菌株对氨氮(260.05 mg/L)、亚硝氮(80.50 mg/L)和硝氮(100.06 mg/L)去除率分别为93.4%、100.0%和100.0%[19],Rp. palustris CQV97对氨氮(41.36 mg/L)、硝氮(42.38 mg/L)和亚硝氮(41.18 mg/L)去除率分别为75.5%、100.0%和100.0%[5]。与单一氮源体系相比,无机三态氮共存体系中氨氮去除率有所降低,硝氮和亚硝氮去除率未见降低,亚硝氮会出现暂时性积累。与文献相比,本研究测定体系中氨氮浓度在文献报道范围内,硝氮和亚硝氮浓度达到文献报道的最高水平,同时YLK20对氨氮、硝氮和亚硝氮具有高去除率。由此表明,该菌株具有去除高浓度无机三态氮能力,除氮过程中亚硝氮出现暂时性积累的现象与文献[6-7, 15]报道的规律一致。
有机碳对微生物除氮有较大影响。例如,与乙酸钠相比,葡萄糖可降低Rp. palustris P4和Rhodobacter sp. S菌株的亚硝氮去除能力,分别降低了60.4%和65.0%[21-22];在乙酸钠和乙醇体系中,Rp. palustris CQV97对氨氮和亚硝氮去除率不低于70.0%和98.0%,而在葡萄糖体系中基本上失去了氨氮和亚硝氮去除能力[5]。在无机三态氮共存体系中,葡萄糖、乙醇和乙酸钠对M. gracile YL28去除硝氮和亚硝氮影响较小,但乙醇明显抑制了氨氮的去除,去除率仍在60.0%以上[4]。与文献相比,单糖(葡萄糖和果糖)和蔗糖不利于YLK20对无机三态氮的去除,小分子有机酸和醇有利于无机三态氮的去除,其中丙酮酸和乙酸钠体系中脱氮能力最高。
养殖水体,尤其是沉积物-水界面层积累大量有机氮化合物,微生物代谢活跃,是水体氨氮和亚硝氮等有害物质的主要来源[3, 23]。研究表明,有机氮化物严重制约微生物的氨氮去除作用,水体氨氮不但不降低,反而呈现升高现象[6-7, 24]。如Bacillus megaterium X2在含有蛋白胨的体系中氨氮呈现积累,积累量达111.57%[24];在含有0.12 g/L蛋白胨或尿素水体中,Rp. palustris CQV97在对氨氮的去除过程中,水体氨氮含量反而升高[5];添加0.24 g/L尿素时M. gracile YL28对水体氨氮去除呈现不降反升的现象,而添加0.14 g/L蛋白胨导致氨氮在去除过程中暂时性出现积累,虽很快又被去除,但氨氮去除率被抑制了约50%[4]。本研究的特点是发现YLK20菌株在高浓度有机氮环境中能高效去除无机三态氮,当蛋白胨和尿素分别高达3.21 g/L和1.43 g/L时,YLK20对水体无机三态氮的去除仍未受到明显抑制。低浓度有机氮促进YLK20脱除无机三态氮的原因可能是:由于无机三态氮共存测定体系中氨氮限量,添加有机氮能促进菌体的生长和代谢,进而促进菌体脱氮;当有机氮浓度较高时,菌体通过氨化作用释放的氨大于其氨同化作用吸收的氨,体系中氨氮去除率降低,但不影响菌体对硝氮和亚硝氮的去除。微生物的氨化作用是导致水体氨氮升高的主要原因,由于目前测试的菌株很少,有机氮化物是否影响目前报道的其它APB菌株,影响程度如何尚不清楚,需要进一步评估。
文献研究表明,APB中的紫色非硫细菌类群主要通过固氮、氨化、氨同化和反硝化等4条氮代谢途径参与自然界氮循环过程。反硝化过程主要由4个关键酶催化完成,但大多数菌株并未同时拥有这4个关键酶的编码基因,因此不能完成无机氮的矿化(N2),所以导致N2O或NO等温室气体积累。有些菌株(如Rp. palustris HaA2)缺失反硝化的关键酶基因[25],从而失去了对硝氮和亚硝氮的去除作用。YLK20基因组同时具有这4条氮代谢途径的基因,并拥有反硝化过程的4个关键酶基因,具有将亚硝氮和硝氮转化为N2的潜能,避免温室气体的积累。除了固氮作用外,无机三态氮转化的实验数据与基因组其它3条氮代谢途径相吻合,其转化机制是:氨氮是通过氨同化途径去除的,硝氮和亚硝氮是通过反硝化途径去除的。该菌株拥有EMP途径、HMP途径和TCA循环的相关基因,与其利用小分子有机酸、醇和糖生长的数据吻合,但对不同有机碳的利用能力不同。Gendel等研究表明,非耐盐菌在高盐环境中反硝化能力会被抑制[26],本研究发现了YLK20能在0−3%盐度环境中良好生长,在淡水和海水体系中均具有高效除氮作用,与其基因组拥有丰富的耐盐和渗透压调节相关基因有关。但高盐度对亚硝氮去除具有严重抑制作用,这与文献[26]报道结果基本吻合。
综上所述,YLK20是一株高效去除无机三态氮的菌株,其显著的特点是能在高浓度有机氮化合物环境中高效去除无机三态氮,不但适用于淡水养殖水体,也适用于海水养殖水体。本研究为APB微生物制剂的合理应用提供了指导。
| [1] |
Yang P, Lai DYF, Jin BS, et al. Dynamics of dissolved nutrients in the aquaculture shrimp ponds of the Min River estuary, China: concentrations, fluxes and environmental loads[J]. Science of the Total Environment, 2017, 603-604: 256-267. DOI:10.1016/j.scitotenv.2017.06.074 |
| [2] |
Newaj-Fyzul A, Al-Harbi AH, Austin B. Review: developments in the use of probiotics for disease control in aquaculture[J]. Aquaculture, 2014, 431: 1-11. DOI:10.1016/j.aquaculture.2013.08.026 |
| [3] |
Zhang XB, Zhou GJ, Zhu BT, et al. Effect of light and oxygen on the removal of inorganic nitrogen by Marichromatium gracile YL28[J]. Microbiology China, 2019, 46(5): 997-1007. (in Chinese) 张晓波, 周广静, 朱笔通, 等. 光氧环境对紫色硫细菌YL28去除无机三态氮的影响[J]. 微生物学通报, 2019, 46(5): 997-1007. |
| [4] |
Chun SJ, Cui YS, Ahn CY, et al. Improving water quality using settleable microalga Ettlia sp. and the bacterial community in freshwater recirculating aquaculture system of Danio rerio[J]. Water Research, 2018, 135: 112-121. DOI:10.1016/j.watres.2018.02.007 |
| [5] |
Luo ZB, Hu SY, Chen DJ. The trends of aquacultural nitrogen budget and its environmental implications in China[J]. Scientific Reports, 2018, 8(1): 10877. DOI:10.1038/s41598-018-29214-y |
| [6] |
Jiang P, Zhao CG, Yang SP. Influences of low-molecular-weight organic carbon and nitrogen sources on growth and inorganic nitrogen removal by Marichromatium gracile strain YL28[J]. Oceanologia et Limnologia Sinica, 2014, 45(6): 1218-1224. (in Chinese) 蒋鹏, 赵春贵, 杨素萍. 小分子有机碳、氮源对海洋着色菌(Marichromatium gracile)生长和去除高浓度无机三态氮的影响[J]. 海洋与湖沼, 2014, 45(6): 1218-1224. |
| [7] |
Zhang XB, Zhu BT, Xiong H, et al. Simultaneous removal of inorganic nitrogen from aquaculture water by Rhodopseudomonas palustris CQV97[J]. Amino Acids & Biotic Resources, 2015, 37(4): 38-45. (in Chinese) 张晓波, 朱笔通, 熊慧, 等. 沼泽红假单胞菌(Rhodopseudomonas palustris)CQV97对无机三态氮共存水体中氮素的去除效率及其影响因素[J]. 氨基酸和生物资源, 2015, 37(4): 38-45. |
| [8] |
Shtratnikova VY, Belalov I, Kasianov AS, et al. The complete genome of the oil emulsifying strain Thalassolituus oleivorans K-188 from the Barents Sea[J]. Marine Genomics, 2018, 37: 18-20. DOI:10.1016/j.margen.2017.08.005 |
| [9] |
Marchler-Bauer A, Bo Y, Han LY, et al. CDD/SPARCLE: functional classification of proteins via subfamily domain architectures[J]. Nucleic Acids Research, 2016, 45(1): 200-203. |
| [10] |
Zhuo MQ, Zhao CG, Cheng QR, et al. Fingerprinting analysis of photopigments in purple bacteria[J]. Acta Microbiologica Sinica, 2012, 52(6): 760-768. (in Chinese) 卓民权, 赵春贵, 程茜茹, 等. 紫细菌光合色素指纹图谱的建立与色素分析[J]. 微生物学报, 2012, 52(6): 760-768. |
| [11] |
Zhou GJ, Zhang XB, Zhu BT, et al. Biofilm formation characteristics in marine purple sulfur bacterium Marichromatium gracile YL28 with high nitrite removal efficiency[J]. Microbiology China, 2018, 45(9): 1980-1988. 周广静, 张晓波, 朱笔通, 等. 高脱氮活性海洋着色菌YL28生物膜特性[J]. 微生物学通报, 2018, 45(9): 1980-1988. |
| [12] |
Heising S, Dilling W, Schnell S, et al. Complete assimilation of cysteine by a newly isolated non-sulfur purple bacterium resembling Rhodovulum sulfidophilum (Rhodobacter sulfidophilus)[J]. Archives of Microbiology, 1996, 165(6): 397-401. DOI:10.1007/s002030050343 |
| [13] |
Mykytczuk NCS, Foote SJ, Omelon CR, et al. Bacterial growth at -15 ℃; molecular insights from the permafrost bacterium Planococcus halocryophilus Or1[J]. The ISME Journal, 2013, 7(6): 1211-1226. DOI:10.1038/ismej.2013.8 |
| [14] |
Helton AM, Bernhardt ES, Fedders A. Biogeochemical regime shifts in coastal landscapes: the contrasting effects of saltwater incursion and agricultural pollution on greenhouse gas emissions from a freshwater wetland[J]. Biogeochemistry, 2014, 120(1/3): 133-147. |
| [15] |
Wei HF, Han BA, Wang TY, et al. Identification and characterization of a denitrifying bacterium Pseudomonas fluorescens[J]. Microbiology China, 2016, 43(8): 1679-1689. (in Chinese) 魏荷芬, 韩保安, 王田野, 等. 一株荧光假单胞杆菌的分离鉴定与反硝化特性[J]. 微生物学通报, 2016, 43(8): 1679-1689. |
| [16] |
Wen G, Wang B, Liu B, et al. Ammonia nitrogen removal efficiency from aquaculture water by Rhodopseudomonas palustris R-3[J]. Hunan Agricultural Sciences, 2017(6): 49-51. (in Chinese) 文刚, 汪彬, 刘标, 等. 沼泽红假单胞菌R-3去除水体中氨氮的特性研究[J]. 湖南农业科学, 2017(6): 49-51. |
| [17] |
Sun XM, Li QF, Zhang Y, et al. Phylogenetic analysis and nitrogen removal characteristics of a heterotrophic nitrifying-aerobic denitrifying bacteria strain from marine environment[J]. Acta Microbiologica Sinica, 2012, 52(6): 687-695. (in Chinese) 孙雪梅, 李秋芬, 张艳, 等. 一株海水异养硝化-好氧反硝化菌系统发育及脱氮特性[J]. 微生物学报, 2012, 52(6): 687-695. |
| [18] |
Chen H, Zhang DM, Wang LG, et al. Biological characteristics and phylogenetic analysis of a denitrifying photosynthetic bacterium[J]. Acta Microbiologica Sinica, 2011, 51(2): 249-255. (in Chinese) 陈慧, 张德民, 王龙刚, 等. 一株反硝化光合细菌的生物学特性及系统发育分析[J]. 微生物学报, 2011, 51(2): 249-255. |
| [19] |
Jiang P, Zhao CG, Jia YQ, et al. Inorganic nitrogen removal by a marine purple sulfur bacterium capable of growth on nitrite as sole nitrogen source[J]. Microbiology China, 2014, 41(5): 824-831. (in Chinese) 蒋鹏, 赵春贵, 贾雅琼, 等. 以亚硝氮为唯一氮源生长的海洋紫色硫细菌去除无机三态氮[J]. 微生物学通报, 2014, 41(5): 824-831. |
| [20] |
Zhao Y, Zhao CG, Chen Y, et al. Denitrifying characterizations from inorganic nitrogen-polluted wastewater by Rhodopseudomonas palustris CQV97[J]. Journal of Shanxi University (Natural Science Edition), 2012, 35(3): 557-562. (in Chinese) 赵玥, 赵春贵, 陈龑, 等. 沼泽红假单胞菌CQV97菌株对污染水体三氮去除特性研究[J]. 山西大学学报:自然科学版, 2012, 35(3): 557-562. |
| [21] |
Yu JA, Zhang CK, Chen F, et al. Denitration of photosynthetic bacteria P4 strain[J]. Journal of Shanghai Jiaotong University, 2000, 34(11): 1579-1582, 1597. (in Chinese) 俞吉安, 张承康, 陈峰, 等. 光合细菌P4株的反硝化作用[J]. 上海交通大学学报, 2000, 34(11): 1579-1582, 1597. DOI:10.3321/j.issn:1006-2467.2000.11.031 |
| [22] |
Liu SJ, Sun Y, Cen YH, et al. Biological control of nitrite in fish farming ponds by photosynthetic nonsulfur bacteria[J]. Environmental Science, 1995, 16(6): 21-23. (in Chinese) 刘双江, 孙燕, 岑运华, 等. 采用光合细菌控制水体中亚硝酸盐的研究[J]. 环境科学, 1995, 16(6): 21-23. DOI:10.3321/j.issn:0250-3301.1995.06.004 |
| [23] |
Han HJ, Lu XX, Burger DF, et al. Nitrogen dynamics at the sediment-water interface in a tropical reservoir[J]. Ecological Engineering, 2014, 73: 146-153. DOI:10.1016/j.ecoleng.2014.09.016 |
| [24] |
Hou Y, Sun JD, Xu JQ, et al. Degrading characters of ammonia nitrogen in aquatic water of Bacillus megaterium[J]. Journal of Shenyang Agricultural University, 2006, 37(4): 607-610. (in Chinese) 侯颖, 孙军德, 徐建强, 等. 巨大芽孢杆菌对养殖水体氨氮降解特性研究[J]. 沈阳农业大学学报, 2006, 37(4): 607-610. DOI:10.3969/j.issn.1000-1700.2006.04.014 |
| [25] |
Zhu BT, Zhang XB, Zhao CG, et al. Comparative genome analysis of marine purple sulfur bacterium Marichromatium gracile YL28 reveals the diverse nitrogen cycle mechanisms and habitat-specific traits[J]. Scientific Reports, 2018, 8(1): 17803. DOI:10.1038/s41598-018-36160-2 |
| [26] |
Gendel Y, Lahav O. A novel approach for ammonia removal from fresh-water recirculated aquaculture systems, comprising ion exchange and electrochemical regeneration[J]. Aquacultural Engineering, 2013, 52: 27-38. DOI:10.1016/j.aquaeng.2012.07.005 |
 2019, Vol. 46
2019, Vol. 46