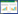扩展功能
文章信息
- 邱东茹, 高娜, 安卫星, 余佃贞, 夏明
- QIU Dong-Ru, GAO Na, AN Wei-Xing, YU Dian-Zhen, XIA Ming
- 活性污泥微生物胞外多聚物生物合成途径与菌胶团形成的调控机制
- Biosynthesis pathway of extracellular polymeric substance and regulatory mechanism underlying floc formation of activated sludge bacteria
- 微生物学通报, 2019, 46(8): 2080-2089
- Microbiology China, 2019, 46(8): 2080-2089
- DOI: 10.13344/j.microbiol.china.190331
-
文章历史
- 收稿日期: 2019-04-15
- 接受日期: 2019-06-05
- 网络首发日期: 2019-06-20
2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
18世纪源自英国的工业革命导致快速的工业化和城市化,城市生活污水和生产废水大量排放,造成严重的水体污染,霍乱和腹泻等水源性流行病频繁暴发,造成数以百万计的人口死亡。为防治水体污染,迫切需要高效的污水净化工艺。1914年3月,在受到美国学者Harry W. Clark和Stephen de M. Gage前期研究启发的曼彻斯特大学化学教授Gilbert Fowler的指导下,英国年轻学者William Lockett和Edward Ardern发明了活性污泥法(Activated sludge process),该法至今依然是全世界的主流污水净化工艺[1-3]。2014年“国际水协会”(International water association,简称IWA)等学术团体和水务业界分别在英国曼彻斯特市(工业革命和活性污泥法的诞生地)、美国马萨诸塞州(1912年Fowler教授观摩Clark和Gage在波士顿附近的劳伦斯试验站所进行的污水曝气试验,对活性污泥的诞生起了至关重要的启发作用)、德国埃森(欧洲大陆第一座活性污泥处理厂所在地)和中国香港举行活性污泥国际研讨会以资纪念。国内学术界也举行了形式多样的纪念活动。
近30年来,我国的工业化和城市化带来了严重的水污染问题,江河湖海水污染日趋严重,污染性缺水加剧,成为制约社会经济可持续发展的瓶颈。活性污泥法和生物膜(Biofilm)法是污水生化处理的两种主要方法。我国90%以上的城市生活污水处理厂和50%以上的工业废水处理厂采用活性污泥法。世界范围内活性污泥法也是处理城市生活污水和工业废水的主流二级生化处理技术。截至2019年2月底,全国市、县累计建成城市市政污水处理厂5 500余座,污水处理能力为2.04×108 m3/d;全世界有5万座城镇污水处理厂在运转。我国中央和地方财政投入污水处理厂建设的资金高达上万亿。活性污泥法的三要素是曝气(提高氧气供给加快微生物代谢与生长)、污泥通过重力作用实现泥水分离(无需过滤、沉淀下来污泥便于回用)和活性污泥回流(以维持曝气池微生物的浓度),污水净化速度大为提高。先前的污水曝气中因净化和硝化所需时间太长(4-6周)而不具有实用价值的瓶颈得以打破,这是活性污泥法最为关键的发明点。然而这一技术也有严重的缺点,容易发生活性污泥膨胀(Sludge bulking)、上浮(Rising sludge)和生物泡沫(Foaming)问题,严重影响水质净化效果[4-5]。传统活性污泥处理工艺的除磷脱氮效果不够好[6],能耗高,所产生的大量剩余活性污泥难以处理、费用高。活性污泥法成功之处在于污泥,其最为人诟病之处和令人头疼之处也在于污泥。我国城镇污水处理厂的剩余污泥已经成为令人“谈虎色变”的顽疾,污泥偷排屡禁不止,国内有专家甚至说活性污泥法只是一种污染转移罢了,只不过是将污染物从污水中转移到污泥中而已。每年我国所产生高达4 500多万t的巨量污泥大多未能得到妥善处置和有效利用,有可能造成二次污染。通过微生物的分解和转化,污水中约30%-50%的化学需氧量(Chemical oxygen demand,COD)、约30%-45%的氮、约90%的磷以生物质的形式转入污泥中。有鉴于此,如何合理有效地处置和开发利用污泥将是决定该技术能否存在又一个百年的关键所在[2]。鉴于全世界5万座城镇活性污泥污水处理厂在水污染控制中扮演的主要角色,即便微小的技术改进也能对水环境保护和水安全产生极大正面影响,因此有必要加强研究。我们参考大量国内外活性污泥相关文献,结合我们近年来的研究工作,梳理了活性污泥微生物胞外多聚物生物合成途径和菌胶团形成与调控机制的结果。
1 活性污泥宏基因组和胞外多聚物近年来通过高通量测序及宏基因组学分析揭示了活性污泥微生物的组成,已经发现700多个属,揭示了已为人类服务一个世纪的活性污泥“黑箱”(Black box)的内部成员组成。然而活性污泥和生物膜中的微生物群落和基质胞外多聚物的组成复杂多样,活性污泥微生物和胞外多聚物的应用基础研究工作难度很大,甚至无从下手。胞外多聚物(Extracellular polymeric substances,简称EPS,包括胞外多糖、蛋白质和核酸等生物大分子物质)是活性污泥菌胶团形成的物质基础和百年活性污泥法成功的关键。大量紧密包裹微生物细胞团的胞外多糖吸水性高,因此剩余活性污泥含水率在90%以上,造成污泥脱水和后续处置困难。
近年来,由于下一代测序技术的成熟,宏基因组学研究广泛开展,获得许多前所未知的新知识,包括特定环境中和特定过程(如污泥膨胀)中微生物群落的种类组成变化与动态过程,也获得一些目前还不能分离培养的细菌如活性污泥中的聚磷菌(Candidatus Accumulibacter phosphatis,简称CAP)和Eikelboom 0092型丝状菌(Candidatus Promineofilum breve)的基因组序列[7-8]。微丝菌基因组测序显示该菌具有硝酸还原酶(NapA)基因而没有亚硝酸还原酶基因[9],微丝菌可能还原硝酸根。香港大学张彤和清华大学文湘华等学者分别利用宏基因组学分析揭示活性污泥水处理系统的微生物多样性以及与活性污泥膨胀有关的细菌种类[10-12]。美国学者从田纳西州一座化工废水处理厂膨胀的活性污泥中分离一株陶厄氏菌(Thauera sp. TMZlT),分析鉴定了其胞外多糖的结构[13],认为这种多糖可能是造成污泥脱水困难的原因,之后又完成了该菌基因组测序工作[14]。此前荧光原位杂交(Fluorescence in situ hybridization,FISH)技术也曾用来揭示活性污泥系统中动胶菌的丰度[15]和丝状菌的种群动态[16]。活性污泥菌胶团最重要也是最丰富的组成成分主要是单个物种的微菌群(Single species microcolonies)及其特殊微环境。丝状菌通常可作为一种联结这些微型结构的骨架,而这些微型结构由种类特异性的胞外多聚物和其他知之甚少的大分子如腐殖质胶合在一起[17]。这些研究结果说明,基因组学和分子生物学手段是研究活性污泥微生物多样性和生理生态的利器,给活性污泥研究与技术开发带来新的机遇,可谓方兴未艾[2]。
动胶菌属(Zoogloea)是兼性好氧型革兰氏阴性杆菌,属于β变形菌纲红环菌目(Rhodocyclales)红环菌科(Rhodocyclaceae)。其属名来源于希腊语,意为“动物胶质”(Animal glue)或者“活胶质”(Living glue),最显著特征是可以产生由多糖等生物大分子组成的胶状胞外多聚物(Extracellular polymeric substance,简称EPS),可包裹细菌聚集形成菌胶团(Zoogloeal floc),是菌胶团形成所必需的“黏合剂”。EPS种类多样、结构复杂。活性污泥菌胶团可以吸附污水中的微粒和重金属离子[18-19]。菌胶团形成是动胶菌等细菌的特殊生理状态,可抵抗原生动物摄食和环境胁迫,提高生存几率、维持一定的生物量。正是形成菌胶团这一特性被无意中利用来培养活性污泥处理污水。曝气供氧可以强化动胶菌等活性污泥微生物的生长和代谢,提高其对污染物质吸收、转化和降解的能力[20]。活性污泥在沉淀池中可以通过重力作用自行沉降以实现污泥固体与经处理的清水的分离[21-22],回用的污泥可以维持曝气池中微生物合适的浓度(即适当的食物/微生物比例,F/M),提高水处理速度和效率,这就是活性污泥处理技术方法的基本原理[1, 5]。目前在动胶菌属中已描述5个种,包括枝状动胶菌(Zoogloea ramigera)、污泥动胶菌(Z. caeni)、喜树脂动胶菌(Z. resiniphila)、水稻动胶菌(Z. oryzae)和噬油动胶菌(Z. oleivorans)[23-24]。在活性污泥微生物菌群的研究过程中,Dias等通过涂布平板的分离方法从7个活性污泥样品中共分离得到300多个菌株,其中动胶菌属(Zoogloea)细菌在所有菌株中占有优势地位[25]。Rosselló-Mora等用荧光原位杂交技术对活性污泥中的微生物进行研究,结果发现有接近10%的细胞为生枝动胶菌(Zoogloea ramigera)[15]。我国研究者通过基于16S rRNA基因的焦磷酸高通量测序方法,发现动胶菌属是我国内地和香港以及新加坡、美国、加拿大污水处理厂污泥中的优势属之一,丰度占1.38%-11.1%[10-11]。可见,动胶菌属细菌在许多污水处理厂活性污泥中都占有优势地位,是活性污泥形成的关键细菌之一。最近对全球6大洲23国89城的269座城市污水处理厂所采集的1 200个污泥样品16S rRNA基因序列大规模分析,揭示了由28个分类群(OTU)组成的全球活性污泥核心群落与活性污泥的性能紧密相关。在属水平上动胶菌是最丰富的优势类群(平均丰度约为1.36%),与之前的研究结果相符。而鉴定出的种系型(Phylotype)则高达10亿个之多[26]。
近年来国内外对活性污泥EPS组成和特性的研究较多[21-22, 27-30],研究者尝试建立一些新型成分提取和分析方法[18, 31]。目前尚缺乏标准的EPS分析方法,不同学者的研究结果可比性差,这极有可能是由于活性污泥微生物种类和群落结构差异所致。我们已对从武汉江夏污水处理厂分离纯化的喜树脂动胶菌(Zoogloea resiniphila) MMB株的胞外多糖进行了初步分析,发现该菌胞外多糖中含有葡萄糖、半乳糖和甘露糖等单糖组分[32],我们将对其结构进行深入分析,可以从另一个角度揭示活性污泥EPS的组成和特性。
2 动胶菌基因组学和菌胶团形成的分子遗传学分析针对活性污泥膨胀、污泥减量与剩余污泥利用问题,我们开展了动胶菌基因组学和分子遗传学研究,完成了喜树脂动胶菌MMB株基因组草图测序和注释;与香港大学合作完成了从香港城市污水处理厂活性污泥中分离的另一株喜树脂动胶菌TS9株的基因组组装、注释及与近缘菌基因组的比较,揭示了与水处理相关的氮、磷代谢和芳香化合物降解途径;还成功构建转座子插入突变株库,筛选到多个与菌胶团形成相关的突变株,鉴定出一些与胞外多糖生物合成与组装及菌胶团形成相关基因,包括一个约40 kb的大型基因簇(图 1),并发现该基因簇中糖基转移酶基因组成上存在种间和种内差异,还发现其中两个编码天冬酰胺合成酶的旁系同源基因在菌胶团形成过程中具有重要功能,这2个基因突变或敲除后能够阻断或推迟菌胶团的形成;通过比较基因组学分析发现类似的基因簇也存在于其他重要的活性污泥细菌基因组或宏基因组(特别是聚磷菌CAP,该类细菌在强化生物除磷工艺中具有重要作用,但还未能加以分离培养)中,说明这些细菌也可以形成菌胶团,从而可通过特定工艺在活性污泥中加以富集而发挥作用[32]。
|
| 图 1 喜树脂动胶菌MMB株基因组中的胞外多糖合成基因簇[32] Figure 1 The large gene cluster for the biosynthesis of extracellular polysaccharides in Zoogloea resiniphila MMB strain[32] 注:黑色箭头所指的是筛选出菌胶团形成功能缺失的突变株中转座子插入破坏的基因.相似的基因簇也在许多其他活性污泥细菌基因组中编码并存在种间和种内差异.从基因簇可推测胞外多糖的合成是Wzy聚合酶依赖途径[33-34]. Note: The black arrows indicate the transposon-disrupted gene in the floc-formation deficient mutants. The similar gene cluster is encoded in the genome or metagenome of many other activated sludge bacteria and the interspecies and intraspecies difference are also found. The polysaccharide biosynthesis pathway is predicted to be Wzy polymerase dependent based on the gene cluster[33-34]. |
|
|
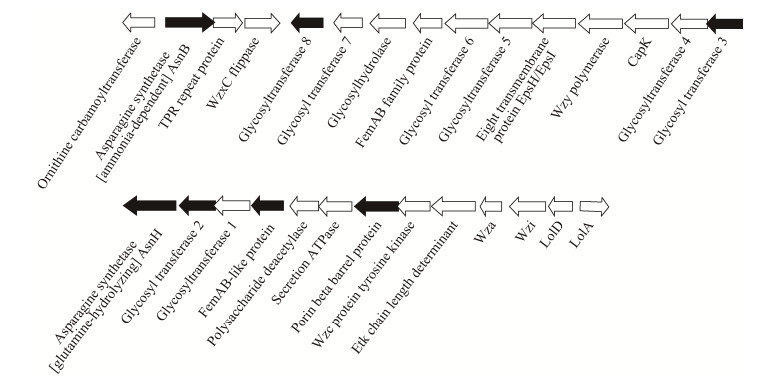
参与活性污泥细菌菌胶团形成的不只有胞外多糖,可能还有胞外蛋白质参与。20世纪90年代末期发现在革兰氏阳性菌(无细胞外膜)中,蛋白分选酶(Sortase)可将拥有C端LPXTG基序的表面蛋白和菌毛通过共价键锚定到细胞壁的肽聚糖分子上[35]。经过对大量细菌基因组的生物信息学分析,在革兰氏阴性细菌特别是与生物被膜(Biofilm)和底泥相关的细菌和蓝藻中也鉴别出类似的分选酶同源基因,这个分选酶基因(以前称之为epsH)和推测可能位于细胞表面的一类新型蛋白基因通常与胞外多糖合成基因簇在染色体上连锁,所鉴别的表面蛋白中通常具有C端的PEP (很多情况下是VPEP)基序,而且富含可以与糖基相连的丝氨酸、苏氨酸(O-linked)和天冬酰胺(N-linked)残基,因此将这种蛋白分选系统称为PEP-CTERM/Exosortase (Exo意指胞外多糖)系统[36]。从结构类比推测胞外多糖生物合成基因簇所编码的EpsH蛋白可能是所谓的外分选酶(Exosortase)。EpsH为8次穿膜的膜蛋白,可能像革兰氏阳性菌的分选酶一样具有转肽酶功能。PEP-CTERM基因的表达可能受到邻近的RpoN (或称σ54)依赖的双组分系统(Two component system) PrsK和PrsR的调节。此外,研究发现某些环境细菌中长链N-酰基氨基酸合成酶(酰基转移酶)基因也多与PEP-CTERM/Exosortase分选系统基因连锁,因此长链N-酰基氨基酸有可能是组氨酸激酶HrsK的活化信号,这类酰基转移酶被称为ExoAT[37]。我们最近鉴定出另外一个由7个基因组成参与菌胶团形成的基因簇,其中3个基因(糖基转移酶基因epsB2、脂蛋白基因prsT和尿苷二磷酸-N-乙酰-D-氨基葡萄糖胺脱氢酶基因ugd)插入失活或者敲除后基本检测不到胞外多糖,说明其参与胞外多糖的生物合成和分泌。敲除prsK或者prsR基因后,胞外多糖的合成依然存在,所合成的大量胞外多糖被分泌和溶解到培养基中,不能包裹细菌细胞群形成菌胶团。我们进一步的研究表明某些PEP-CTERM蛋白参与喜树脂动胶菌的菌胶团形成,其中两个基因pepA和pepE转录水平高,并且受到RpoN、PrsK和PrsR的调节[38]。在prsK或者prsR基因敲除突变株中过量表达pepA基因可以恢复菌胶团形成表型。这些初步结果说明这类新型蛋白质在菌胶团形成菌中具有重要的功能,这些蛋白的氨基端具有典型的分泌信号肽,而其羧基端具有保守的PEP-CTERM域,包括PEP (Pro-Glu-Pro,脯氨酸-谷氨酸-脯氨酸)基序。我们前期实验证实PEP-CTERM基因上游具有RpoN σ因子识别的-24 (GG)和-12 (GC)启动子基序,而胞外多糖合成相关基因和基因簇连锁的prsK (编码感受器组氨酸激酶PrsK,Sensor histidine kinase)和prsR (编码响应转录调节蛋白PrsR)基因产物参与调控PEP-CTERM基因如pepA和pepE的表达[38]。跨细胞内膜的组氨酸激酶PrsK接收未知信号后可能发生自磷酸化(PrsK-P)并将磷酸基团传递给反应调节蛋白PrsR。磷酸化后的PrsR被活化(PrsR-P)后聚合并结合到PEP-CTERM基因启动子(-24 GG/-12 GC)上游的增强子(Enhancer)上与RpoN σ因子发生相互作用,通过水解ATP启动RNA聚合酶全酶驱动的基因转录(图 2)。PEP-CTERM是富含天冬酰胺残基的特殊分泌型蛋白质,与胞外多糖可能通过共价结合(N-连锁的蛋白质糖基化)形成网状(或者蜂窝状)的EPS,包裹微生物细胞来介导菌胶团的形成[38]。
|
| 图 2 动胶菌及近缘活性污泥菌基因组和宏基因组中编码的PrsK-PrsR二组分信号转导系统及RpoN (σ54) σ因子可能共同调节PEP-CTERM基因pepA的表达[38] Figure 2 The transcription of PEP-CTERM genes are regulated by the RpoN-dependent two-component system PrsK-PrsR and the PEP-CTERM proteins undergo post-translational processing and sorting for EPS biosynthesis[38] |
|
|
比较基因组学分析揭示PEP-CTERM基因家族、epsB2-prsK-prsR-prsT和胞外多糖生物合成基因簇在陶厄氏菌(Thaurea)、亚硝化菌(如Nitrosomonas、Nitrosospira、Nitrosovibrio和Nitrosococcus等氨氧化菌)、固氮弧菌(Azoarcus)和聚磷菌(CandidatusAccumulibacter phosphatis)等活性污泥细菌的基因组中存在,说明这些微生物也是菌胶团形成菌。我们所鉴定的胞外多糖合成相关基因簇和PEP-CTERM蛋白及其表达调控基因prsK和prsR,在前文所提及的活性污泥细菌、最近富集、分离和纯化的硝化螺菌属(Nitrospira)的全程氨氧化细菌(Comammox,包括Nitrospira inopinata)和污泥动胶菌LCSB751基因组中存在[39-40],说明这些活性污泥细菌能够形成菌胶团,而且菌胶团形成机制相似。
4 其他细菌的胞外多糖和菌胶团形成机理最近我们对从西安北石桥污水处理厂活性污泥中分离到的一株黄色菌胶团形成菌解壳聚糖松江菌(Mitsuaria chitosanitabida) XHY-A6菌株进行了分子遗传学和基因组分析,发现了与菌胶团形成相关的一个大型基因簇,包括与胞外多糖生物合成和分泌相关的基因、epsB2-prsK-psrR-prsT基因以及一个编码PEP-CTERM蛋白A的基因[41]。此外,类似的基因簇和PEP-CTERM蛋白基因也存在于某些肠道微生物及其他微生物基因组中[36, 38]。菌胶团形成菌也可以造成一些环境问题。近年来我们还对湖北省浠水县南城自来水厂井水和末梢水中大量出现的棕黑色絮凝物问题进行研究。该自来水公司2005年以前采用傍河取水,由于需水量增加,2004-2006年改建水厂,取水工艺采用渗滤取水技术。2006年底南城水厂投产,水质优良,但2007年夏季开始,自来水中出现不明黑褐色物质,此类物质在取水井和供水网内大量存在,呈絮状分布,形成团状的“黑褐色絮状物”,部分管网出现“黄水”,严重影响水质。棕黑色絮状物的出现给市民用水造成困扰,成为必须解决的重大民生问题。来自武汉自来水公司和中国科学院水生生物研究所等单位的专家调查显示有可能是由于铁氧化细菌(Iron oxidizing bacteria),或称铁细菌(Iron bacteria)的大量繁殖所造成的,自来水厂根据专家建议采取了消毒和其他措施,但问题依然没有得到解决。
我国大多数自来水厂采取加氯方式进行消毒并利用水中余氯控制有害微生物的生长繁殖,然而自来水出厂后在输水管网系统中还可能受到微生物二次污染,许多细菌可大量繁殖在管壁形成细菌生物被膜(Bacterial biofilm)[42]。铁细菌就是其中可能导致水质问题的一类微生物,如北京自来水管中嘉氏铁柄杆菌(Gallionella)导致的红水[43]。铁细菌大量繁殖可造成输水管道腐蚀、堵塞,有时形成红水,使自来水带有金属臭气[44]。我们利用多种培养基对微生物进行分离培养,未能分离到典型的铁细菌,特别是经常在井水中造成棕黑色絮凝物的纤发菌(Leptothrix),而分离到一株亲缘关系较近的解叔丁醇水居菌(Aquincola tertiaricarbonis) RN12株。水居菌分类地位未定,属于β变形菌Rubrivivax-Roseateles-Leptothrix-Ideonella-Aquabacterium分支,这个细菌种类也是活性污泥微生物群落的28个核心分类群之一[26]。RN12株可以形成絮状沉淀,因此我们利用该菌来研究棕黑色絮状物形成的机理。俄克拉荷马大学环境基因组学研究所周集中教授协助进行基因组测序,我们进行分析和注释后发现该菌基因组与红长命菌(Rubrivivax)、纤发菌和Methylibium属细菌相近。采取与喜树脂动胶菌相似的方法大量筛选絮状物形成缺失的突变株,鉴定到一个大型胞外多糖合成基因簇与喜树脂动胶菌胞外多糖合成基因簇非常相似,但各拥有一些不同的基因,可能与胞外多糖的重复单位单糖组成和糖基的修饰相关[45]。我们还鉴定出一个调节菌胶团形成的调节基因rpoN1,编码一个σ54家族的σ因子(σ54)。利用遗传互补分析确定RpoN1是菌胶团形成的主要调控基因之一,但该基因插入突变株中所合成的大量胞外多糖被分泌和溶解到培养基中,不能包裹细菌细胞群形成菌胶团。分析发现RpoN1并不影响胞外多糖合成基因的转录,说明RpoN1所调控的基因在表达后通过某种机制使胞外多糖链紧密结合在细菌群体表面以形成菌胶团,而不是直接调控EPS的合成。RN12菌株具有rpoN1、rpoN2、rpoN3和rpoN4等4个旁系同源基因,但只有RpoN1能调控菌胶团的形成,并且调节该菌株的群集运动(Swarming motility)和生物被膜形成(Biofilm formation)[45]。由于拥有4个rpoN基因,rpoN1的敲除并没有造成像动胶菌rpoN敲除突变株那样的“微小菌落”表型,后者的生长状况受到抑制,也几乎检测不到胞外多糖[39]。无独有偶,该菌基因组拥有数十个编码PEP-CTERM蛋白质的基因。这些结果说明动胶菌和水居菌等β变形菌形成菌胶团(或称絮状物、生物絮团)的机理非常相似,对两者的研究可以相互补充和相互印证。
5 总结与展望我们的分子遗传学研究和比较基因组学分析表明活性污泥法是一个有效富集菌胶团形成菌的生物选择过程,陶厄氏菌(Thauera,在工业废水处理厂污泥中占优势)、硝化细菌(Nitrosomonnas、Nitrosospira、Nitrosovibrio和Nitrosococcus等)、全程氨氧化菌(Commamox,目前包括Nitrospira属的部分菌株)和尚未纯化培养的聚磷菌(Candidatus Accumulibacter phosphatis)等细菌拥有与动胶菌相似的胞外多糖合成基因簇和多个PEP-CTERM基因,也可能合成胞外多聚物并形成菌胶团,因而可通过污泥沉淀和回用而加以富集[32, 38, 45]。动胶菌等多种活性污泥菌胶团形成菌可能形成单种微菌落(Single species microcolonies),有的学者称为群簇(Cluster),通过胞外多聚物及其他大分子物质胶连成团并通微丝菌(Microthrix)等丝状菌形成的骨架(Backbone)贯穿聚集在一起,有机纤维物质、无机颗粒和附生细菌吸附到菌胶团表面;另一方面,假单胞菌和芽孢杆菌等浮游细菌则在二沉池中不能沉淀而随出水流失(图 3)。这些微生物过程需要进一步研究,为工艺革新打下基础。

|
| 图 3 根据比较基因组学和活性污泥菌胶团形成机制研究初步结果提出的活性污泥法原理示意图[32, 38, 45] Figure 3 Schematic diagram about activated sludge process based on microbial floc formation mechanism and comparative genomics analyses[32, 38, 45] Note: Floc-forming bacteria including Zoogloea, Thauera, Dechloromonas, Nitrosomonas, Mitsuria, Candidatus Accumulibacter and Nitrospira comammox bacteria could be enriched via repeated sludge settlement and recycling while planktonic cells are carried away along with effluents. |
|
|
回顾活性污泥的历史,实际上某些细菌能够形成菌胶团这一特点只是在20世纪初无意中被Ardern和Lockett利用来进行污水处理,微生物菌胶团形成的生理功能和进化上的意义可能远不只是抵抗原生动物摄食和吸水保湿而已,许多问题有待解答,需要进一步加以探讨。我们希望揭示动胶菌等活性污泥细菌胞外多聚物生物合成和菌胶团形成及其调节机制,以期为工程技术界人士在活性污泥工艺革新及相关污水处理技术的净化效率提升、工艺优化、污泥膨胀和生物泡沫的有效控制和新工艺及新型反应器设计提供参考,对污水和污泥中资源与能源(污水中蕴藏的能源是净化污水所需能源的4–10倍)的回收利用打下科学基础。
| [1] |
Zhang JF. Activated Sludge Process Control[M]. Beijing: China Electric Power Press, 2007: 235. (in Chinese) 张建丰. 活性污泥法工艺控制[M]. 北京: 中国电力出版社, 2007: 235. |
| [2] |
Sheik AR, Muller EEL, Wilmes PA. Hundred years of activated sludge: time for a rethink[J]. Frontiers in Microbiology, 2014, 5: 47. |
| [3] |
van Loosdrecht MCM, Brdjanovic D. Water treatment. Anticipating the next century of wastewater treatment[J]. Science, 2014, 344(6191): 1452-1453. DOI:10.1126/science.1255183 |
| [4] |
Jenkins D, Richard MG, Daigger GT. Manual on the Causes and Control of Activated Sludge Bulking, Foaming, and Other Solids Separation Problems 3rd ed[M]. Florida: CRC Press, 2003: 224.
|
| [5] |
Peng YZ, Guo JH. Mechanism Cause and Control of Activated Sludge Swelling[M]. Beijing: Science Press, 2012: 367. (in Chinese) 彭永臻, 郭建华. 活性污泥膨胀机理、成因及控制[M]. 北京: 科学出版社, 2012: 367. |
| [6] |
Ge SJ, Peng YZ, Qiu S, et al. Complete nitrogen removal from municipal wastewater via partial nitrification by appropriately alternating anoxic/aerobic conditions in a continuous plug-flow step feed process[J]. Water Research, 2014, 55: 95-105. DOI:10.1016/j.watres.2014.01.058 |
| [7] |
McIlroy JS, Kristiansen R, Albertsen M, et al. Metabolic model for the filamentous 'Candidatus Microthrix parvicella' based on genomic and metagenomic analyses[J]. The ISME Journal, 2013, 7(6): 1161-1172. DOI:10.1038/ismej.2013.6 |
| [8] |
McIlroy JS, Karst SM, Nierychlo M, et al. Genomic and in situ investigations of the novel uncultured Chloroflexi associated with 0092 morphotype filamentous bulking in activated sludge[J]. The ISME Journal, 2016, 10(9): 2223-2234. DOI:10.1038/ismej.2016.14 |
| [9] |
Muller EEL, Pinel N, Gillece JD, et al. Genome sequence of "Candidatus Microthrix parvicella" Bio17-1, a long-chain-fatty-acid-accumulating filamentous actinobacterium from a biological wastewater treatment plant[J]. Journal of Bacteriology, 2012, 194(23): 6670-6671. DOI:10.1128/JB.01765-12 |
| [10] |
Guo F, Zhang T. Profiling bulking and foaming bacteria in activated sludge by high throughput sequencing[J]. Water Research, 2012, 46(8): 2772-2782. DOI:10.1016/j.watres.2012.02.039 |
| [11] |
Wang XH, Hu M, Xia Y, et al. Pyrosequencing analysis of bacterial diversity in 14 wastewater treatment systems in China[J]. Applied and Environmental Microbiology, 2012, 78(19): 7042-7047. DOI:10.1128/AEM.01617-12 |
| [12] |
Ju F, Zhang T. Bacterial assembly and temporal dynamics in activated sludge of a full-scale municipal wastewater treatment plant[J]. The ISME Journal, 2015, 9(3): 683-695. DOI:10.1038/ismej.2014.162 |
| [13] |
Allen MS, Welch KT, Prebyl BS, et al. Analysis and glycosyl composition of the exopolysaccharide isolated from the floc-forming wastewater bacterium Thauera sp. MZ1T[J]. Environmental Microbiology, 2004, 6(8): 780-790. DOI:10.1111/j.1462-2920.2004.00615.x |
| [14] |
Jiang K, Sanseverino J, Chauhan A, et al. Complete genome sequence of Thauera aminoaromatica strain MZ1T[J]. Standards in Genomic Sciences, 2012, 6(3): 325-335. DOI:10.4056/sigs.2696029 |
| [15] |
Rosselló-Mora RA, Wagner M, Amann R, et al. The abundance of Zoogloea ramigera in sewage treatment plants[J]. Applied and Environmental Microbiology, 1995, 61(2): 702-707. |
| [16] |
Mielczarek AT, Kragelund C, Eriksen PS, et al. Population dynamics of filamentous bacteria in Danish wastewater treatment plants with nutrient removal[J]. Water Research, 2012, 46(12): 3781-3795. DOI:10.1016/j.watres.2012.04.009 |
| [17] |
Nielsen PH, Saunders AM, Hansen AA, et al. Microbial communities involved in enhanced biological phosphorus removal from wastewater - a model system in environmental biotechnology[J]. Current Opinion in Biotechnology, 2012, 23(3): 452-459. DOI:10.1016/j.copbio.2011.11.027 |
| [18] |
Shen R, Sheng GP, Yu HQ. Measurement of proteins in extracellular polymeric substances from activated sludge by a spectral probing stain method (MSASC)[J]. Acta Scientiae Circumstantiae, 2008, 28(1): 192-196. (in Chinese) 沈荣, 盛国平, 俞汉青. 活性污泥胞外聚合物中蛋白质的探针分析方法[J]. 环境科学学报, 2008, 28(1): 192-196. DOI:10.3321/j.issn:0253-2468.2008.01.030 |
| [19] |
Li WW, Yu HQ. Insight into the roles of microbial extracellular polymer substances in metal biosorption[J]. Bioresource Technology, 2014, 160: 15-23. DOI:10.1016/j.biortech.2013.11.074 |
| [20] |
Xu J, Sheng GP, Ma Y, et al. Roles of extracellular polymeric substances (EPS) in the migration and removal of sulfamethazine in activated sludge system[J]. Water Research, 2013, 47(14): 5298-5306. DOI:10.1016/j.watres.2013.06.009 |
| [21] |
Shin SH, Kang ST, Nam SY. Effect of carbohydrate and protein in the EPS on sludge settling characteristics[J]. Water Science and Technology, 2001, 43(6): 193-196. DOI:10.2166/wst.2001.0373 |
| [22] |
Zhou J, Long TR, Miao LL. Effect of extracellular polymeric substances (EPS) on sedimentation of activated sludge[J]. Acta Scientiae Circumstantiae, 2004, 24(4): 613-618. (in Chinese) 周健, 龙腾锐, 苗利利. 胞外聚合物EPS对活性污泥沉降性能的影响研究[J]. 环境科学学报, 2004, 24(4): 613-618. DOI:10.3321/j.issn:0253-2468.2004.04.009 |
| [23] |
Xie CH, Yokota A. Zoogloea oryzae sp. nov., a nitrogen-fixing bacterium isolated from rice paddy soil, and reclassification of the strain ATCC 19623 as Crabtreella saccharophila gen. nov., sp. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(3): 619-624. DOI:10.1099/ijs.0.63755-0 |
| [24] |
An WX, Gao N, Xia M, et al. Physiological characteristics and systematic classification of the Zoogloea species and their role in the activated sludge[J]. Chinese Journal of Applied and Environmental Biology, 2016, 22(6): 1167-1174. (in Chinese) 安卫星, 高娜, 夏明, 等. 动胶菌属系统分类、生理特征及其在活性污泥中的作用[J]. 应用与环境生物学报, 2016, 22(6): 1167-1174. |
| [25] |
Dias FF, Bhat JV. Microbial ecology of activated sludge Ⅰ. Dominant bacteria[J]. Applied and Environmental Microbiology, 1964, 12(5): 412-417. |
| [26] |
Wu LW, Ning DL, Zhang B, et al. Global diversity and biogeography of bacterial communities in wastewater treatment plants[J]. Nature Microbiology, 2019, 4(7): 1183-1195. DOI:10.1038/s41564-019-0426-5 |
| [27] |
Frolund B, Palmgren R, Keiding K, et al. Extraction of extracellular polymers from activated sludge using a cation exchange resin[J]. Water Research, 1996, 30(8): 1749-1758. DOI:10.1016/0043-1354(95)00323-1 |
| [28] |
Guo X, Wang X, Liu JX. Composition analysis of fractions of extracellular polymeric substances from an activated sludge culture and identification of dominant forces affecting microbial aggregation[J]. Scientific Reports, 2016, 6: 28391. DOI:10.1038/srep28391 |
| [29] |
Li JY, Zuo H, Luan ZK, et al. Effects of substrate conditions on compositions of extracellular polymeric substances in biofilms[J]. Environmental Chemistry, 2002, 21(6): 546-551. (in Chinese) 李久义, 左华, 栾兆坤, 等. 不同基质条件对生物膜细胞外聚合物组成和含量的影响[J]. 环境化学, 2002, 21(6): 546-551. DOI:10.3321/j.issn:0254-6108.2002.06.005 |
| [30] |
Cao XS, Long TR, Meng XZ, et al. Effects of Mn2+, Mo6+ and Zn2+ on the components change of extracellular polymeric substances in activated sludge[J]. Environmental Science, 2004, 25(4): 70-73. (in Chinese) 曹相生, 龙腾锐, 孟雪征, 等. Mn2+、Mo6+和Zn2+对活性污泥内胞外聚合物组分的影响[J]. 环境化学, 2004, 25(4): 70-73. |
| [31] |
Ni BJ, Fang F, Xie WM, et al. Characterization of extracellular polymeric substances produced by mixed microorganisms in activated sludge with gel-permeating chromatography, excitation-emission matrix fluorescence spectroscopy measurement and kinetic modeling[J]. Water Research, 2009, 43(5): 1350-1358. DOI:10.1016/j.watres.2008.12.004 |
| [32] |
An WX, Guo F, Song YL, et al. Comparative genomics analyses on EPS biosynthesis genes required for floc formation of Zoogloea resiniphila and other activated sludge bacteria[J]. Water Research, 2016, 102: 494-504. DOI:10.1016/j.watres.2016.06.058 |
| [33] |
Drummelsmith J, Whitfield C. Gene products required for surface expression of the capsular form of the group 1 K antigen in Escherichia coli (O9a: K30)[J]. Molecular Microbiology, 1999, 31(5): 1321-1332. DOI:10.1046/j.1365-2958.1999.01277.x |
| [34] |
Drummelsmith J, Whitfield C. Translocation of group 1 capsular polysaccharide to the surface of Escherichia coli requires a multimeric complex in the outer membrane[J]. The EMBO Journal, 2000, 19(1): 57-66. DOI:10.1093/emboj/19.1.57 |
| [35] |
Mazmanian SK, Liu G, Ton-That H, et al. Staphylococcus aureus sortase, an enzyme that anchors surface proteins to the cell wall[J]. Science, 1999, 285(5428): 760-763. DOI:10.1126/science.285.5428.760 |
| [36] |
Haft DH, Paulsen IT, Ward N, et al. Exopolysaccharide-associated protein sorting in environmental organisms: the PEP-CTERM/EpsH system. Application of a novel phylogenetic profiling heuristic[J]. BMC Biology, 2006, 4: 29. DOI:10.1186/1741-7007-4-29 |
| [37] |
Craig JW, Cherry MA, Brady SF. Long-chain N-acyl amino acid synthases are linked to the putative PEP-CTERM/exosortase protein-sorting system in Gram-negative bacteria[J]. Journal of Bacteriology, 2011, 193(20): 5707-5715. DOI:10.1128/JB.05426-11 |
| [38] |
Gao N, Xia M, Dai JC, et al. Both widespread PEP-CTERM proteins and exopolysaccharides are required for floc formation of Zoogloea resiniphila and other activated sludge bacteria[J]. Environmental Microbiology, 2018, 20(5): 1677-1692. DOI:10.1111/1462-2920.14080 |
| [39] |
Kits KD, Sedlacek CJ, Lebedeva EV, et al. Kinetic analysis of a complete nitrifier reveals an oligotrophic lifestyle[J]. Nature, 2017, 549(7671): 269-272. DOI:10.1038/nature23679 |
| [40] |
Muller EEL, Narayanasamy S, Zeimes M, et al. First draft genome sequence of a strain belonging to the Zoogloea genus and its gene expression in situ[J]. Standards in Genomic Sciences, 2017, 12: 64. DOI:10.1186/s40793-017-0274-y |
| [41] |
Wang J, Gao N, Liu SY, et al. Identification and analysis of a large gene cluster involved in floc formation of activated sludge bacterium Mitsuaria chitosanitabida[J]. Microbiology China, 2019, 46(8): 1946-1953. (in Chinese) 王晶, 高娜, 刘双元, 等. 活性污泥微生物解壳聚糖松江菌中菌胶团形成相关大型基因簇的鉴定和分析[J]. 微生物学通报, 2019, 46(8): 1946-1953. |
| [42] |
Schmeisser C, Stöckigt C, Raasch C, et al. Metagenome survey of biofilms in drinking-water networks[J]. Applied and Environmental Microbiology, 2003, 69(12): 7298-7309. DOI:10.1128/AEM.69.12.7298-7309.2003 |
| [43] |
Li D, Li Z, Yu JW, et al. Characterization of bacterial community structure in a drinking water distribution system during an occurrence of red water[J]. Applied and Environmental Microbiology, 2010, 76(21): 7171-7180. DOI:10.1128/AEM.00832-10 |
| [44] |
Emerson D, Fleming EJ, McBeth JM. Iron-oxidizing bacteria: an environmental and genomic perspective[J]. Annual Review of Microbiology, 2010, 64: 561-583. DOI:10.1146/annurev.micro.112408.134208 |
| [45] |
Yu DZ, Xia M, Zhang LP, et al. RpoN (σ54) is required for floc formation but not for extracellular polysaccharide biosynthesis in a floc-forming Aquincola tertiaricarbonis strain[J]. Applied and Environmental Microbiology, 2017, 83(14): e00709-17. DOI:10.1128/AEM.00709-17 |
 2019, Vol. 46
2019, Vol. 46