扩展功能
文章信息
- 姜谦, 张衍, 刘和
- JIANG Qian, ZHANG Yan ZHANG Yan, LIU He
- 导电碳颗粒促进污泥厌氧消化及微生物种间电子传递的研究进展
- A review on enhancement of sludge anaerobic digestion and microbial interspecies electron transfer induced by conductive carbon particles
- 微生物学通报, 2019, 46(8): 1998-2008
- Microbiology China, 2019, 46(8): 1998-2008
- DOI: 10.13344/j.microbiol.china.190323
-
文章历史
- 收稿日期: 2019-04-14
- 接受日期: 2019-06-05
- 网络首发日期: 2019-06-17
2. 江苏省厌氧生物技术重点实验室 江苏 无锡 214122
2. 2 Jiangsu Key Laboratory of Anaerobic Biotechnology, Wuxi, Jiangsu 214122, China
城市污泥是城市生活污水处理的主要副产物,其产量随着近年来污水处理量的增加而快速提升。研究显示,污水中30%−50%的有机物在处理过程中进入污泥,因此需要对污泥进行合理有效的处理处置,防止产生污染物的二次转移。厌氧消化处理能够实现污泥处理的减量化、稳定化和资源化,然而污泥厌氧消化处理工艺中仍存在不足,限制了其推广应用,具体包括:(1)有机质降解速度慢,转化效率低:污泥厌氧消化过程挥发性悬浮固体降解率通常仅为40%−65%[1];(2)厌氧消化过程稳定性差、启动时间长:厌氧微生物生长缓慢,消化过程中挥发性脂肪酸(Volatile fatty acids,VFAs)及氨氮等抑制性物质的积累容易造成消化体系稳定性差、启动和恢复速度慢;(3) CO2含量偏高影响沼气利用:污泥厌氧消化所产沼气中CO2含量可达15%−60%[2],CO2过高降低了沼气热值,影响其后续利用。污泥厌氧消化处理在我国的污泥处理过程中受到了挑战。
许多学者对污泥厌氧消化处理技术的强化和推广开展了针对性研究,我们先前的研究成果证明了在污泥厌氧消化过程中可通过强化同型产乙酸过程实现CO2的固定[3],进一步的研究发现添加硅灰石等矿物能够通过Ca2+、Mg2+溶出实现沼气中CO2的固定以及N、P等营养元素的回收,达到强化污泥厌氧消化效果的目的[4-5];与此同时,关于导电碳材料如活性炭、生物炭、炭布、炭纳米管、石墨、炭黑乃至石墨烯等能够在污泥等有机质厌氧消化中促进底物降解、提高消化过程稳定性以及提升消化产物(沼气和沼渣)质量等方面的研究受到了越来越广泛的关注[6-11],其中,研究发现导电碳颗粒的不同物理化学特性(如原料、制备工艺、添加量、粒径、比表面积等)在不同工况条件下对污泥厌氧消化过程的促进作用存在差异,也有少数研究甚至发现导电碳颗粒对于厌氧消化过程也可能存在抑制作用[12-13]。研究分析认为导电碳颗粒的吸附能力[14]及pH缓冲能力[15]都是可能的强化机理,但也有研究者认为由导电碳颗粒介导的微生物直接种间电子传递(Direct interspecies electron transfer,DIET)在促进污泥厌氧消化处理效果提升中发挥了重要作用[16-18]。导电碳颗粒介导的厌氧微生物种间互营关系的强化为提高污泥厌氧消化效果开辟了一条新的思路,并有望实现厌氧消化处理效能的全面提升,但其在污泥等复杂有机质厌氧消化体系中的促进作用及关键机理的研究还有待进一步跟进。
因此,本文以活性炭和生物炭作为典型导电碳颗粒,综述了其对污泥厌氧消化效果的影响;对导电碳颗粒促进厌氧消化效果提升的相关机理,如解除抑制作用、提升pH缓冲能力以及强化厌氧微生物种间互营关系进行了总结,重点对导电碳颗粒介导DIET强化种间互营关系这一关键强化机理进行阐述;最后对污泥厌氧消化体系中导电碳颗粒促进污泥厌氧消化的未来研究方向进行了展望。
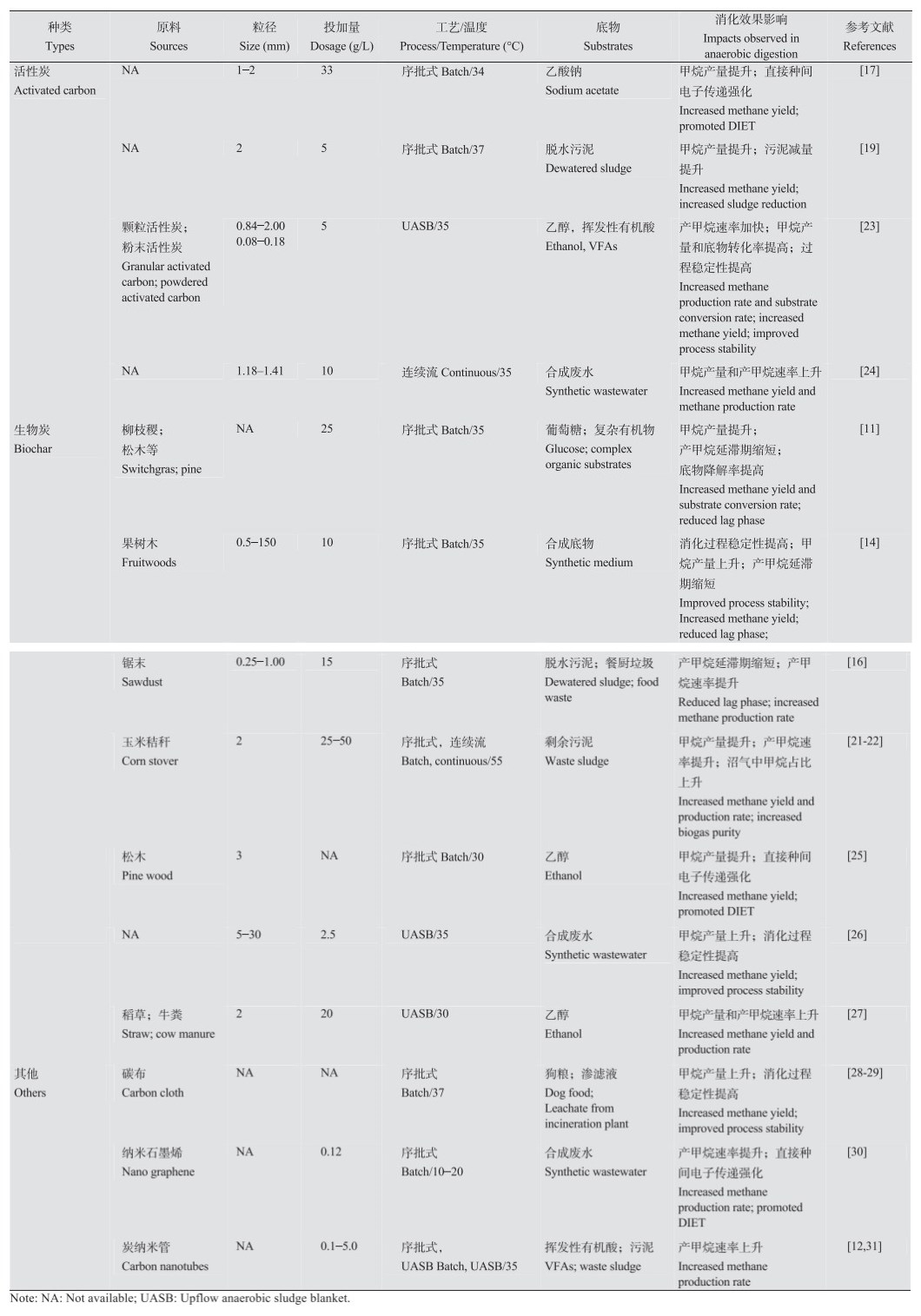
1 导电碳颗粒影响污泥厌氧消化及相关机理 1.1 导电碳颗粒对污泥厌氧消化的影响一方面,许多研究者报道了不同工况条件下导电碳颗粒添加对污泥厌氧消化的促进作用,如Wang等[15]发现在污泥和餐厨垃圾混合底物的厌氧消化体系中添加生物炭后会使其pH缓冲能力显著上升,并能够适应高有机负荷、高氢分压条件,促进甲烷产率的提高;Yang等[19]在序批式污泥厌氧消化系统中添加5.0 g/L的活性炭促使污泥降解率由39.1%提高至45.2%,甲烷产量也提高了17.4%;还有研究者认为生物炭的添加能够减缓厌氧消化过程中的氨抑制作用,促进产甲烷过程[20];此外,Shen等[21-22]发现分别在短期和长期连续流污泥厌氧消化系统中添加生物炭能够提高甲烷产量的同时原位去除CO2,最终可使沼气中甲烷含量提高到95%,显著提升了厌氧消化系统产能效果。表 1总结了不同工况条件下导电碳颗粒在厌氧消化体系中的促进作用,这些作用主要总结为缩短产甲烷延滞期、提高厌氧消化过程稳定性以及提高甲烷产率、产甲烷速率等方面,部分研究还发现有促进污泥减量[19],消化污泥脱水性能提高[32],重金属钝化[33-34],提升消化污泥土地利用效能(如提升营养元素含量、减少肥效流失等)[21-22, 35]。
|
另一方面,有研究者也发现导电碳颗粒对于有机质厌氧消化过程可能存在抑制作用,如Salvador等[12]发现碳纳米管的添加量在5 g/L时会对纯培养状态下的厌氧产甲烷过程形成抑制作用,但当添加量在0.5 g/L和1.0 g/L时则能够促进底物和微生物细胞间的传质速度,呈现出加速产甲烷过程的作用;有学者发现添加粒径为0.02 μm−0.35 μm的炭黑能够对厌氧消化产甲烷过程形成显著的抑制作用,产甲烷抑制率达到51.5%[13];而Li等[31]在污泥厌氧消化体系中添加浓度为1.0 g/L的碳纳米管材料却发现对甲烷产量并没有明显的影响,可能的原因在于污泥体系中微生物胞外聚合物(Extracellular polymeric substances,EPS)会使纳米材料形成团聚,阻止其与细胞间发生相互作用。可见导电碳颗粒的种类、粒径、添加量以及厌氧消化工况条件等都会对导电碳颗粒在厌氧消化过程中发挥作用形成影响,而粒径的影响似乎更加明显,如Lü等[14]就认为不同粒径的生物炭对厌氧消化产甲烷速率的影响不同,添加更小粒径生物炭的效果反而可能会变差。
不难看出导电碳颗粒对于厌氧消化过程的促进作用已经被大量的研究者在不同的底物体系(如葡萄糖、合成废水、剩余污泥以及餐厨垃圾等) (表 1)以及实际的厌氧消化工程体系[36]中证实,但不同特性(如原料、制备工艺、添加量、粒径、比表面积等)的导电碳颗粒在不同工况条件下对于有机质厌氧消化过程的影响可能会存在不同。因此,探究导电碳颗粒关键特性与其强化机理联系方面的研究也引起了众多学者的兴趣。
1.2 导电碳颗粒促进厌氧消化的机理目前,不同的研究者对于导电碳颗粒促进厌氧消化过程的机理存在多种解释,导电碳颗粒的吸附性能、pH缓冲能力以及强化厌氧微生物种间互营关系都可能是促进污泥厌氧消化效果提升的潜在作用机制。(1)导电碳颗粒具有较大的比表面积和较强的吸附性能,通过吸附固定或促进功能微生物富集等作用达到减缓或消除厌氧消化过程中抑制性物质(如NH3、NH4+-N、VFAs、酚类以及重金属等)对厌氧消化效果的影响[14, 26, 37];(2)导电碳颗粒能够通过金属离子溶出、离子交换以及表面官能团等机制提升厌氧消化体系pH缓冲能力[15-16, 21-22],维持消化过程pH稳定,我们先前的研究成果也证实了厌氧消化体系pH缓冲能力的提升[4-5]及pH条件调控[38]对于提高污泥厌氧消化效果具有促进作用,而这与碳材料的化学组成以及表面化学特性等有关;(3)许多研究者提出导电碳颗粒促进微生物种间电子传递进而强化厌氧微生物种间互营关系的功能是提升厌氧消化效果的重要因素,而与这一机制有关的材料特性主要包括材料的多孔结构、导电性、表面官能团以及氧化还原活性等[16-18];(4)导电碳颗粒吸附性能、化学组成、表面官能团以及氧化还原活性等特性也被报道与沼气中CO2去除[21-22]以及沼渣的土地利用性能提高[21-22, 35]等有关。图 1总结了导电碳颗粒促进有机质厌氧消化效果提升的相关机理以及与之相关的关键特性。

|
| 图 1 导电碳颗粒关键特性与厌氧消化过程促进作用间的相互联系 Figure 1 Relationships between characteristics and the enhancement of anaerobic digestion by conductive carbon particles |
|
|
电子传递在微生物的代谢繁殖和物质转化中发挥着关键作用,而在传统的污泥厌氧消化过程中,产酸菌和产甲烷菌之间的种间电子互营关系被认为主要是通过H2或其他可溶性小分子物质(如甲酸盐等)为媒介进行的,是一种间接的种间电子传递方式(Mediated interspecies electron transfer,MIET)。然而,H2及甲酸在厌氧环境中以扩散形式进行传递,速度缓慢且传质过程中易发生逸散等造成电子损失,降低电子传递效率[39];此外,受厌氧消化体系中氢分压影响较大,底物有机负荷波动等条件很容易造成VFAs的过度积累,抑制产甲烷菌活性,进而阻碍产酸菌和产甲烷菌种间电子互营关系,最终导致厌氧消化产甲烷体系的崩溃[40]。因此,产酸产甲烷过程中不同厌氧微生物种间电子互营关系的建立则被认为是有机质厌氧消化过程的关键限速阶段[41-42]。
相比于MIET的无序扩散,直接种间电子传递DIET能够以具备电子传递能力的微生物细胞结构(如细胞色素蛋白、导电菌毛e-pili)[43-44]以及具备电子传递能力的外源物质(如导电碳颗粒等)[45]为媒介完成电子的快速和定向传递,同时需要更少的生物酶促反应参与,被认为是一种更为高效的种间电子传递方式[43];并且当导电碳颗粒介导的DIET存在时,微生物细胞还能够节约用于形成导电菌毛以及细胞色素蛋白等电子传递载体的这部分能量,促进厌氧微生物间更为高效地建立种间互营关系,进而促进底物快速转化产甲烷,避免高氢分压以及VFAs的累积引起的消化体系波动,提升消化体系的适应能力和稳定性,促进厌氧消化效果的提升[16-18, 24]。不难看出,添加导电碳颗粒介导DIET互营关系的建立可以解释污泥厌氧消化效果的提升,也被认为是现阶段解决污泥厌氧消化所存在问题的一条有效途径[26, 36, 42]。
2 导电碳颗粒强化种间电子传递促进厌氧消化效果提升 2.1 厌氧消化过程中DIET强化产甲烷的发现及验证Summers等[43]于2010年首次报道了地杆菌Geobacter metallireducens和Geobacter sulfurreducens共培养体系中存在的DIET现象,并确认了DIET能够实现微生物种间更为高效的电子传递,进而促进了互营微生物共同生长。紧接着,不同环境体系中存在的其他DIET互营微生物组合也陆续被报道[45-48],目前已经证实的DIET互营微生物组合见表 2。其中,Liu等[45]及Rotaru等[46]在先前研究的基础上证实了地杆菌和污泥厌氧消化过程中常见的产甲烷菌(如Methanosaeta、Methanosarcina等)之间也能够通过DIET建立电子互营关系产甲烷,而更为重要的是Chen等[25]和Liu等[45]进一步的研究发现添加导电碳颗粒(活性炭和生物炭)能够促进厌氧微生物DIET互营关系的建立,这不仅进一步丰富和拓展了厌氧微生物种间电子传递的途径,颠覆了研究者对于传统厌氧消化产甲烷过程的认识,也为强化污泥厌氧消化处理及提升厌氧消化系统产能效果提供了一条全新的思路。
| 已证实的互营微生物组合(电子供体菌-电子受体菌) Defined electron co-cultures (donor-acceptor) |
底物 Substrates |
参考文献 References |
| Geobacter metallireducens-Geobacter sulfurreducens | Ethanol | [43] |
| Geobacter metallireducens-Methanosarcina barkeri | Ethanol | [45-46] |
| Geobacter metallireducens-Methanosaeta harundinacea | Ethanol | [46] |
| Geobacter sulfurreducens-Prossthecohloris aestaurii | Ethanol/CO2 | [47] |
| ANME-1 archaea-SRB Hotseep-1 | CH4/S | [48] |
通过添加导电碳颗粒促进DIET产甲烷已经在共培养体系中得到验证,但这一机制在复杂底物体系(如污泥厌氧消化)中却尚未明确,为此,导电碳颗粒被投加到不同工况的厌氧消化体系中探究复杂底物厌氧消化过程中DIET互营关系对厌氧消化的促进作用。
2.1.1 以模式微生物(地杆菌-产甲烷菌)为基础的厌氧消化DIET互营关系验证Zhao等[18]在UASB体系中利用外加电场实现了富集模式地杆菌(Geobacter)和产甲烷菌(Methanosaeta),并通过产甲烷途径筛选对比的方法确定了该厌氧体系中DIET产甲烷的贡献占比超过50%,这也是首次在复杂体系中对DIET产甲烷的明确论证;接着Zhao等[26]利用碳布、生物炭和石墨等为介质在UASB反应体系中同样论证了DIET在促进产甲烷以及提升反应体系稳定性方面的作用;类似地,Zhang等[17]和Lee等[24]也同样在连续流厌氧消化体系中验证了由活性炭介导的地杆菌和产甲烷菌之间的DIET互营关系及其对厌氧消化产甲烷的促进作用。随着研究的推进,Zhao等[42]以两相厌氧消化工艺为基础,提出了一种基于构建DIET互营关系的厌氧消化系统效能提升策略:即通过前置产酸相促进复杂有机物的分解和转化为小分子底物如醇类、VFAs等,促进地杆菌等产电微生物的富集,进而促进产甲烷相中地杆菌与产甲烷菌构建DIET互营关系,维持反应体系稳定,最终达到促进产甲烷的目的,而这一策略也得到了其他研究者的认可[49];Zhang等[50]更是提出了一种直接在厌氧消化体系中投加Geobacter sulfurreducens PCA菌剂促进体系中DIET互营产甲烷的强化策略。
2.1.2 以其他微生物为基础的厌氧消化DIET互营关系探索通过地杆菌属构建DIET互营关系固然是一条很好的路径,但也可能成为其在污泥厌氧消化体系中推广应用的限制,因为地杆菌在污泥中丰度很低,甚至无法检出[51];即使人为地富集后对整个微生物体系的影响也尚不明确。因此,也有一些研究者尝试在复杂厌氧消化体系中拓展其他DIET互营微生物方面的研究。通过添加导电碳颗粒能够实现在复杂厌氧消化体系达到促进产甲烷的效果,并通过16S rRNA基因测序和基因组学分析等手段推断,不同工况条件下可能存在其他厌氧微生物具备与产甲烷菌通过DIET构建种间互营关系的能力,表 3总结了复杂有机质厌氧消化体系中可能存在DIET互营关系的微生物组合。
| 可能的DIET互营微生物组合(电子供体菌-电子受体菌) Proposed electron co-cultures (donor-acceptor) |
底物 Substrates |
验证方法 Identification technique |
参考文献 References |
| Anaerolineaceae-Methanosaeta | Waste sludge; food waste | 16S rRNA gene sequencing | [16] |
| Sporanaerobacter-Methanosarcina | Dog food | 16S rRNA gene sequencing | [28] |
| Bacteroides, Streptococcus, Syntrophomonas-Methanosarcina, Methanospirillum |
Leachate | 16S rRNA gene sequencing | [29] |
| Caloramator sp.-Methanosaeta, Methanosarcina | Synthetic substrates | 16S rRNA gene sequencing | [52] |
| Syntrophomonas-Methanosaeta | Waste sludge | 16S rRNA gene sequencing | [53] |
| Trichococcus spp.-Methanosaeta | Whey | DGGE/qPCR | [54] |
可以看出,虽然在共培养体系中证实DIET的发生机制及其对厌氧消化产甲烷过程促进作用已接近10年,但在复杂有机质(如城市污泥)厌氧消化体系中厌氧微生物DIET互营关系促进厌氧消化效果提升的研究还存在争议。赵智强[51]认为如果未能在体系中证实地杆菌的存在而推测DIET是该体系中微生物种间互营代谢的主要机制可能不妥,因此有研究者主张通过预先富集[42]或者直接投加[50]模式微生物(如地杆菌)的方式构建厌氧微生物DIET互营关系促进复杂有机质厌氧消化效果提升。不可避免地是,由于模式微生物(如地杆菌)在复杂有机质(如剩余污泥、餐厨垃圾等)中丰度很低[51],甚至可能无法检出,人为富集后目标微生物在整个厌氧消化体系可能也不足以起主导作用,这在一定程度上限制了构建DIET互营机制强化复杂有机质厌氧消化效果的研究和推广。污泥等复杂有机质厌氧消化过程中微生物DIET互营关系对厌氧消化效果的影响以及DIET验证方法体系仍需要进一步跟进。
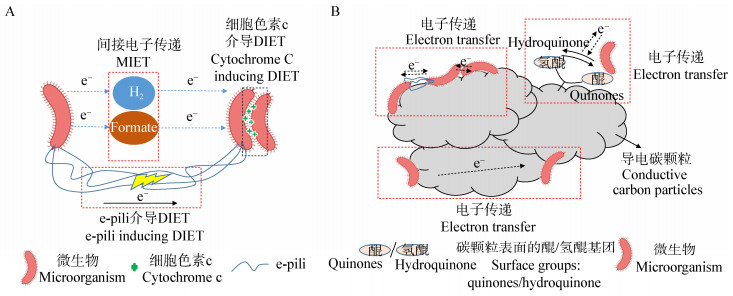
2.2 导电碳颗粒构建厌氧消化种间电子传递的多重联系导电碳颗粒能够介导厌氧微生物DIET互营关系与其自身材料特性密切相关,目前认为导电碳颗粒与DIET互营关系有关的材料特性主要包括比表面积、多孔结构、材料导电性以及表面官能团(如醌类基团)等,其中与电子传递能力有关的特性(导电性、表面官能团等)被认为可能与促进厌氧微生物种间电子互营关系有关而受到了广泛关注[16-18]。多孔导电碳颗粒一方面发挥自身的导电性为相距较远的微生物传递电子发生DIET,并且通过颗粒表面的氧化还原基团辅助间接电子传递;另一方面通过表面多孔结构吸附固定微生物,促进形成稳定的微生物团簇乃至生物膜结构,增强微生物群落内的接触和联系[55],间接促进DIET的发生,最终有利于构建微生物间电子传递途径的多重联系。厌氧消化过程中导电碳颗粒介导的微生物种间多重联系见图 2。
|
| 图 2 厌氧消化过程中导电碳颗粒介导的微生物种间多重联系 Figure 2 Multiple connections that induced by conductive carbon particles during anaerobic digestion 注:A:微生物种间电子传递机制;B:导电碳颗粒介导的电子传递机制. Note: A: Microbial interspecies electron transfer; B: Microbial interspecies electron transfer mediated by conductive carbon particles. |
|
|
需要指出的是在污泥厌氧消化过程中,导电碳颗粒与DIET互营关系对应的关键物理化学特性还存在诸多争议,相关研究距证实导电碳颗粒关键特性与强化DIET功能之间的对应关系还有一定距离:
(1) 材料导电性驱动DIET。出于材料导电性方面的考虑,活性炭被应用于促进种间电子传递进而提升厌氧消化效果[45];Chen等[25]发现生物炭也能够起到同样效果,而其所用的生物炭导电性要比活性炭差1 000倍;更具说服力的是Yuan等[27]的报道,他们研究发现制备的3种生物炭在导电性方面相差不大,但是在对厌氧消化体系产甲烷方面的影响却差别明显。由以上研究可以推断,导电碳颗粒的导电性与DIET促进效果之间的联系还存在争议,或者并非是主要影响因素。
(2) 表面官能团驱动种间电子传递。导电碳颗粒表面氧化还原基团,如醌/氢醌类物质被认为存在于导电碳颗粒表面并且与促进种间电子传递密切相关,但是Liu等[45]的研究却发现醌基团并不能够驱动G. metallireducens和Methanosarcina barkeri通过电子互营关系还原CO2产甲烷,其原因主要为醌/氢醌对氧化还原电势(−184 mV)要高于CO2/CH4对氧化还原电势(−240 mV);同样Tian等[30]通过在厌氧消化体系中设置不同浓度的醌类物质并未发现其与促进厌氧消化产甲烷之间有任何联系。
(3) 材料结构特性驱动DIET。一些研究认为导电碳颗粒具有表面多孔结构,能够通过吸附和固定形成生物膜拉近细胞间空间距离进而有利于强化DIET,促进种间互营关系的建立,但Chen等[25]和Liu等[45]的研究均发现厌氧微生物细胞在导电碳颗粒材料表面呈分散状态排布,并不是聚集成团簇或形成紧密生物膜等结构。添加导体碳颗粒对于厌氧微生物细胞状态的影响目前尚不明确,如Xu等[23]和Luo等[37]都认为较小粒径的导电碳颗粒有利于细胞吸附固定进而提升厌氧消化效能,但同时Li等[31]却认为纳米碳材料会受细胞外聚合物等影响发生团聚而对其发挥作用产生干扰,更小粒径的材料(如纳米材料)反而会对厌氧消化过程存在抑制作用[12]。
3 研究展望导电碳颗粒在不同工况条件下对于厌氧消化体系的影响不同,但众多研究确认了导电碳颗粒对厌氧消化具有促进作用,并且主要集中于提高过程稳定性以及提高甲烷产率和产甲烷速率两个方面,部分研究也报道了导电碳颗粒对于沼气质量和沼渣土地利用性能的提高具有促进作用。
吸附性能和pH缓冲能力都可能是导电碳颗粒促进污泥厌氧消化效果提升的作用机制,但更为重要的是导电碳颗粒促进微生物种间电子传递进而强化厌氧微生物种间互营关系的功能。相比于传统认为的以H2/甲酸等为介质的MIET互营关系,导电碳颗粒能够介导厌氧微生物构建DIET互营关系,更有利于构建种间互营关系,实现厌氧消化过程稳定性、底物转化及产甲烷水平的同步提升,促进厌氧消化体系整体效能的提高,因此,通过添加活性炭、生物炭等为代表的导电碳颗粒可能是解决污泥厌氧消化现存问题的一条有效途径,但相关机理研究仍需要进一步推进,特别是与厌氧消化过程中微生物种间电子传递有关机理的研究,我们认为可以从以下3个方面展开:
(1) DIET促进复杂有机质厌氧消化体系微生物种间互营关系的研究仍需进一步深入。不同于纯培养体系,复杂有机质(如城市污泥)的厌氧消化过程中代谢网络体系庞杂,基于DIET的互营关系对整个厌氧消化体系的促进作用可能并非占主导作用,这也提示解析导电碳颗粒促进厌氧消化还需要考虑除DIET外的其他机理,如环境氧化还原电势变化等;此外,结合先前关于底物组成影响污泥厌氧消化产物的论证[56],我们认为探究导电碳颗粒对于污泥厌氧消化过程中不同底物利用效率以及不同产甲烷代谢途径的影响,对于解析导电碳颗粒强化污泥厌氧消化关键机理十分必要;
(2) 导电碳颗粒关键特性,特别是与污泥厌氧消化过程中DIET互营关系的建立有关的特性(如电子传递能力等)需要进一步拓展研究。材料导电性可能并非主要原因,但表面官能团种类及特性方面目前知之甚少。如除醌类基团外,导电碳颗粒表面还存在大量其他含氮、含氧及含硫官能团,这些官能团在复杂有机质厌氧消化电子传递过程中发挥的作用及相关机理值得进一步探索;
(3) 复杂有机物厌氧消化体系中DIET途径与其他途径如MIET间的相互联系目前所知不多。导电碳颗粒促进生物膜或聚集体的形成对于MIET和DIET的促进效果无法区分,这是因为生物膜或细胞聚集体的形成可能加强了DIET互营关系,也有可能通过这种细胞聚集结构减少了H2/甲酸等的逸散流失,提高了传质效率,其中最终机理的研究可能还需要结合底物利用、微生物细胞赋存状态以及不同产甲烷途径效率等方面进行综合分析。
| [1] |
Zhen GY, Lu XQ, Kato H, et al. Overview of pretreatment strategies for enhancing sewage sludge disintegration and subsequent anaerobic digestion: current advances, full-scale application and future perspectives[J]. Renewable and Sustainable Energy Reviews, 2017, 69: 559-577. DOI:10.1016/j.rser.2016.11.187 |
| [2] |
Carballa M, Regueiro L, Lema JM. Microbial management of anaerobic digestion: exploiting the microbiome-functionality nexus[J]. Current Opinion in Biotechnology, 2015, 33: 103-111. DOI:10.1016/j.copbio.2015.01.008 |
| [3] |
Liu H, Shi JS, Zhan XM, et al. Selective acetate production with CO2 sequestration through acetogen-enriched sludge inoculums in anaerobic digestion[J]. Biochemical Engineering Journal, 2017, 121: 163-170. DOI:10.1016/j.bej.2017.02.008 |
| [4] |
Liu H, Gong LL, Zhang Y, et al. Silicate mediated simultaneous in-situ CO2 sequestration and nutrients removal in anaerobic digestion[J]. Bioresource Technology, 2019, 282: 125-132. DOI:10.1016/j.biortech.2019.03.004 |
| [5] |
Zhang Y, Zhang LH, Liu H, et al. Carbon dioxide sequestration and methane production promotion by wollastonite in sludge anaerobic digestion[J]. Bioresource Technology, 2019, 272: 194-201. DOI:10.1016/j.biortech.2018.10.004 |
| [6] |
Romero-Güiza MS, Vila J, Mata-Alvarez J, et al. The role of additives on anaerobic digestion: a review[J]. Renewable and Sustainable Energy Reviews, 2016, 58: 1486-1499. DOI:10.1016/j.rser.2015.12.094 |
| [7] |
Feng QJ, Lin YQ. Integrated processes of anaerobic digestion and pyrolysis for higher bioenergy recovery from lignocellulosic biomass: a brief review[J]. Renewable and Sustainable Energy Reviews, 2017, 77: 1272-1287. DOI:10.1016/j.rser.2017.03.022 |
| [8] |
Zhang JS, Zhao WQ, Zhang HW, et al. Recent achievements in enhancing anaerobic digestion with carbon-based functional materials[J]. Bioresource Technology, 2018, 266: 555-567. DOI:10.1016/j.biortech.2018.07.076 |
| [9] |
Masebinu SO, Akinlabi ET, Muzenda E, et al. A review of biochar properties and their roles in mitigating challenges with anaerobic digestion[J]. Renewable and Sustainable Energy Reviews, 2019, 103: 291-307. DOI:10.1016/j.rser.2018.12.048 |
| [10] |
Luz FC, Cordiner S, Manni A, et al. Biochar characteristics and early applications in anaerobic digestion-a review[J]. Journal of Environmental Chemical Engineering, 2018, 6(2): 2892-2909. |
| [11] |
Shanmugam SR, Adhikari S, Nam H, et al. Effect of bio-char on methane generation from glucose and aqueous phase of algae liquefaction using mixed anaerobic cultures[J]. Biomass and Bioenergy, 2018, 108: 479-486. DOI:10.1016/j.biombioe.2017.10.034 |
| [12] |
Salvador AF, Martins G, Melle-Franco M, et al. Carbon nanotubes accelerate methane production in pure cultures of methanogens and in a syntrophic coculture[J]. Environmental Microbiology, 2017, 19(7): 2727-2739. DOI:10.1111/1462-2920.13774 |
| [13] |
Martins G, Salvador AF, Pereira L, et al. Methane production and conductive materials: a critical review[J]. Environmental Science & Technology, 2018, 52(18): 10241-10253. |
| [14] |
Lü F, Luo CH, Shao LM, et al. Biochar alleviates combined stress of ammonium and acids by firstly enriching Methanosaeta and then Methanosarcina[J]. Water Research, 2016, 90: 34-43. DOI:10.1016/j.watres.2015.12.029 |
| [15] |
Wang D, Ai J, Shen F, et al. Improving anaerobic digestion of easy-acidification substrates by promoting buffering capacity using biochar derived from vermicompost[J]. Bioresource Technology, 2017, 227: 286-296. DOI:10.1016/j.biortech.2016.12.060 |
| [16] |
Wang GJ, Li Q, Gao X, et al. Synergetic promotion of syntrophic methane production from anaerobic digestion of complex organic wastes by biochar: performance and associated mechanisms[J]. Bioresource Technology, 2018, 250: 812-820. DOI:10.1016/j.biortech.2017.12.004 |
| [17] |
Zhang S, Chang JL, Lin C, et al. Enhancement of methanogenesis via direct interspecies electron transfer between Geobacteraceae and Methanosaetaceae conducted by granular activated carbon[J]. Bioresource Technology, 2017, 245: 132-137. DOI:10.1016/j.biortech.2017.08.111 |
| [18] |
Zhao ZQ, Zhang YB, Wang LY, et al. Potential for direct interspecies electron transfer in an electric-anaerobic system to increase methane production from sludge digestion[J]. Scientific Reports, 2015, 5: 11094. DOI:10.1038/srep11094 |
| [19] |
Yang YF, Zhang YB, Li ZY, et al. Adding granular activated carbon into anaerobic sludge digestion to promote methane production and sludge decomposition[J]. Journal of Cleaner Production, 2017, 149: 1101-1108. DOI:10.1016/j.jclepro.2017.02.156 |
| [20] |
Sharma P, Melkania U. Biochar-enhanced hydrogen production from organic fraction of municipal solid waste using co-culture of Enterobacter aerogenes and E. coli[J]. International Journal of Hydrogen Energy, 2017, 42(30): 18865-18874. DOI:10.1016/j.ijhydene.2017.06.171 |
| [21] |
Shen YW, Linville JL, Urgun-Demirtas M, et al. Producing pipeline-quality biomethane via anaerobic digestion of sludge amended with corn stover biochar with in-situ CO2 removal[J]. Applied Energy, 2015, 158: 300-309. DOI:10.1016/j.apenergy.2015.08.016 |
| [22] |
Shen YW, Forrester S, Koval J, et al. Yearlong semi-continuous operation of thermophilic two-stage anaerobic digesters amended with biochar for enhanced biomethane production[J]. Journal of Cleaner Production, 2017, 167: 863-874. DOI:10.1016/j.jclepro.2017.05.135 |
| [23] |
Xu SY, He CQ, Luo LW, et al. Comparing activated carbon of different particle sizes on enhancing methane generation in upflow anaerobic digester[J]. Bioresource Technology, 2015, 196: 606-612. DOI:10.1016/j.biortech.2015.08.018 |
| [24] |
Lee JY, Lee SH, Park HD. Enrichment of specific electro-active microorganisms and enhancement of methane production by adding granular activated carbon in anaerobic reactors[J]. Bioresource Technology, 2016, 205: 205-212. DOI:10.1016/j.biortech.2016.01.054 |
| [25] |
Chen SS, Rotaru AE, Shrestha PM, et al. Promoting interspecies electron transfer with biochar[J]. Scientific Reports, 2014, 4: 5019. |
| [26] |
Zhao ZQ, Zhang YB, Woodard TL, et al. Enhancing syntrophic metabolism in up-flow anaerobic sludge blanket reactors with conductive carbon materials[J]. Bioresource Technology, 2015, 191: 140-145. DOI:10.1016/j.biortech.2015.05.007 |
| [27] |
Yuan HY, Ding LJ, Zama EF, et al. Biochar modulates methanogenesis through electron syntrophy of microorganisms with ethanol as a substrate[J]. Environmental Science & Technology, 2018, 52(21): 12198-12207. |
| [28] |
Dang Y, Holmes DE, Zhao ZQ, et al. Enhancing anaerobic digestion of complex organic waste with carbon-based conductive materials[J]. Bioresource Technology, 2016, 220: 516-522. DOI:10.1016/j.biortech.2016.08.114 |
| [29] |
Lei YQ, Sun DZ, Dang Y, et al. Stimulation of methanogenesis in anaerobic digesters treating leachate from a municipal solid waste incineration plant with carbon cloth[J]. Bioresource Technology, 2016, 222: 270-276. DOI:10.1016/j.biortech.2016.10.007 |
| [30] |
Tian T, Qiao S, Li X, et al. Nano-graphene induced positive effects on methanogenesis in anaerobic digestion[J]. Bioresource Technology, 2017, 224: 41-47. DOI:10.1016/j.biortech.2016.10.058 |
| [31] |
Li LL, Tong ZH, Fang CY, et al. Response of anaerobic granular sludge to single-wall carbon nanotube exposure[J]. Water Research, 2015, 70: 1-8. DOI:10.1016/j.watres.2014.11.042 |
| [32] |
Wang N, Zhang WJ, Cao BD, et al. Advanced anaerobic digested sludge dewaterability enhancement using sludge based activated carbon (SBAC) in combination with organic polymers[J]. Chemical Engineering Journal, 2018, 350: 660-672. DOI:10.1016/j.cej.2018.06.026 |
| [33] |
Li JH, Zhang M, Ye ZY, et al. Effect of manganese oxide-modified biochar addition on methane production and heavy metal speciation during the anaerobic digestion of sewage sludge[J]. Journal of Environmental Sciences, 2019, 76: 267-277. DOI:10.1016/j.jes.2018.05.009 |
| [34] |
Ho SH, Chen YD, Yang ZK, et al. High-efficiency removal of lead from wastewater by biochar derived from anaerobic digestion sludge[J]. Bioresource Technology, 2017, 246: 142-149. DOI:10.1016/j.biortech.2017.08.025 |
| [35] |
Fagbohungbe MO, Herbert BMJ, Hurst L, et al. The challenges of anaerobic digestion and the role of biochar in optimizing anaerobic digestion[J]. Waste Management, 2017, 61: 236-249. DOI:10.1016/j.wasman.2016.11.028 |
| [36] |
Sánchez-Sánchez C, González-González A, Cuadros-Salcedo F, et al. Using low-cost porous materials to increase biogas production: a case study in Extremadura (Spain)[J]. Journal of Cleaner Production, 2018, 198: 1165-1172. DOI:10.1016/j.jclepro.2018.07.079 |
| [37] |
Luo CH, Lü F, Shao LM, et al. Application of eco-compatible biochar in anaerobic digestion to relieve acid stress and promote the selective colonization of functional microbes[J]. Water Research, 2015, 68: 710-718. DOI:10.1016/j.watres.2014.10.052 |
| [38] |
Ma HJ, Chen XC, Liu H, et al. Improved volatile fatty acids anaerobic production from waste activated sludge by pH regulation: Alkaline or neutral pH?[J]. Waste Management, 2016, 48: 397-403. DOI:10.1016/j.wasman.2015.11.029 |
| [39] |
Rotaru AE, Shrestha PM, Liu FH, et al. Direct interspecies electron transfer between Geobacter metallireducens and Methanosarcina barkeri[J]. Applied and Environmental Microbiology, 2014, 80(15): 4599-4605. DOI:10.1128/AEM.00895-14 |
| [40] |
Wang T, Zhang D, Dai LL, et al. Magnetite triggering enhanced direct interspecies electron transfer: a scavenger for the blockage of electron transfer in anaerobic digestion of high-solids sewage sludge[J]. Environmental Science & Technology, 2018, 52(12): 7160-7169. |
| [41] |
Martínez EJ, Rosas JG, Sotres A, et al. Codigestion of sludge and citrus peel wastes: evaluating the effect of biochar addition on microbial communities[J]. Biochemical Engineering Journal, 2018, 137: 314-325. DOI:10.1016/j.bej.2018.06.010 |
| [42] |
Zhao ZQ, Li Y, He JY, et al. Establishing direct interspecies electron transfer during laboratory-scale anaerobic digestion of waste activated sludge via biological ethanol-type fermentation pretreatment[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(10): 13066-13077. |
| [43] |
Summers ZM, Fogarty HE, Leang C, et al. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria[J]. Science, 2010, 330(6009): 1413-1415. DOI:10.1126/science.1196526 |
| [44] |
Huang LY, Liu X, Zhou SG. Direct interspecies electron transfer of microbes: mechanism and application[J]. Acta Pedologica Sinica, 2018, 55(6): 1313-1324. (in Chinese) 黄玲艳, 刘星, 周顺桂. 微生物直接种间电子传递:机制及应用[J]. 土壤学报, 2018, 55(6): 1313-1324. |
| [45] |
Liu FH, Rotaru AE, Shrestha PM, et al. Promoting direct interspecies electron transfer with activated carbon[J]. Energy & Environmental Science, 2012, 5(10): 8982-8989. |
| [46] |
Rotaru AE, Shrestha PM, Liu FH, et al. A new model for electron flow during anaerobic digestion: direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane[J]. Energy & Environmental Science, 2014, 7(1): 408-415. |
| [47] |
Ha PT, Lindemann SR, Shi L, et al. Syntrophic anaerobic photosynthesis via direct interspecies electron transfer[J]. Nature Communications, 2017, 8: 13924. DOI:10.1038/ncomms13924 |
| [48] |
Wegener G, Krukenberg V, Riedel D, et al. Intercellular wiring enables electron transfer between methanotrophic archaea and bacteria[J]. Nature, 2015, 526(7574): 587-590. DOI:10.1038/nature15733 |
| [49] |
Park JH, Kang HJ, Park KH, et al. Direct interspecies electron transfer via conductive materials: a perspective for anaerobic digestion applications[J]. Bioresource Technology, 2018, 254: 300-311. DOI:10.1016/j.biortech.2018.01.095 |
| [50] |
Zhang S, Chang JL, Liu W, et al. A novel bioaugmentation strategy to accelerate methanogenesis via adding Geobacter sulfurreducens PCA in anaerobic digestion system[J]. Science of the Total Environment, 2018, 642: 322-326. DOI:10.1016/j.scitotenv.2018.06.043 |
| [51] |
Zhao ZQ. Establishment and enhancement of direct interspecies electron transfer between syntrophic microorganisms during anaerobic methanogenesis[D]. Dalian: Doctoral Dissertation of Dalian University of Technology, 2017 (in Chinese) 赵智强.厌氧甲烷化中互养微生物种间直接电子传递的构建与强化[D].大连: 大连理工大学博士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10141-1017245416.htm |
| [52] |
Yan WW, Shen N, Xiao YY, et al. The role of conductive materials in the start-up period of thermophilic anaerobic system[J]. Bioresource Technology, 2017, 239: 336-344. DOI:10.1016/j.biortech.2017.05.046 |
| [53] |
Zhao ZS, Li Y, Yu QL, et al. Ferroferric oxide triggered possible direct interspecies electron transfer between Syntrophomonas and Methanosaeta to enhance waste activated sludge anaerobic digestion[J]. Bioresource Technology, 2018, 250: 79-85. DOI:10.1016/j.biortech.2017.11.003 |
| [54] |
Baek G, Kim J, Cho K, et al. The biostimulation of anaerobic digestion with (semi)conductive ferric oxides: their potential for enhanced biomethanation[J]. Applied Microbiology and Biotechnology, 2015, 99(23): 10355-10366. DOI:10.1007/s00253-015-6900-y |
| [55] |
Li C, Lesnik KL, Liu H. Stay connected: electrical conductivity of microbial aggregates[J]. Biotechnology Advances, 2017, 35(6): 669-680. DOI:10.1016/j.biotechadv.2017.07.010 |
| [56] |
Ma HJ, Liu H, Zhang LH, et al. Novel insight into the relationship between organic substrate composition and volatile fatty acids distribution in acidogenic co-fermentation[J]. Biotechnology for Biofuels, 2017, 10: 137. DOI:10.1186/s13068-017-0821-1 |
 2019, Vol. 46
2019, Vol. 46