扩展功能
文章信息
- 闫潇, 刘兴宇, 张明江, 崔兴兰, 钟娟, 胡学武
- YAN Xiao, LIU Xing-Yu, ZHANG Ming-Jiang, CUI Xing-Lan, ZHONG Juan, HU Xue-Wu
- 分离自活性污泥的硫酸盐还原菌用于铅锌冶炼渣重金属污染修复
- Remediation of heavy metal pollution by sulfate reducing bacteria (SRB) isolated from activated sludge in lead-zinc smelter slag
- 微生物学通报, 2019, 46(8): 1907-1916
- Microbiology China, 2019, 46(8): 1907-1916
- DOI: 10.13344/j.microbiol.china.190283
-
文章历史
- 收稿日期: 2019-04-04
- 接受日期: 2019-06-10
- 网络首发日期: 2019-06-12
目前,我国受锌、铅、镉等重金属污染严重,这些重金属污染40%以上来源于有色金属矿山采选冶行业,其中铅锌冶炼渣长期无组织的堆存和不达标排放造成周边环境污染尤为显著[1]。该冶炼渣中的重金属不仅有扩散广、毒性大、处理难等特点,而且还破坏内源微生物群落结构,迁移到周边土壤造成其衍生出来的食品安全问题更是直接危害着人类的健康[2-3]。因此,对铅锌冶炼渣场的修复和治理已成为了当今亟待解决的问题。目前冶炼渣的处理方法很多[4-7],多数采用添加还原剂的化学处理技术,即利用石灰、铁系盐、EDTA等还原剂与重金属反应产生氢氧化物等形式沉淀下来[8-9],然而好氧中和过程产生的高铁氢氧化物会包裹石灰石,导致进一步的中和反应被终止,该法不仅运行成本高,而且产生的重金属污泥容易再次溶解,造成二次污染。微生物还原技术应用于重金属污染修复是近年来研究的热点,利用一些功能微生物具有吸附或转化重金属结合态的能力,使其从溶解态转化为稳定态,弱化重金属毒性、迁移性并限制生物可利用性,从而降低环境污染的风险[10]。微生物修复法具有经济高效、绿色环保且微生物自身具有种类繁多、数量庞大、比表面积大等优点,所以利用一些真菌、细菌、放线菌等修复冶炼渣场具有很大的潜力[11-14]。
目前用于重金属污染修复的微生物种类很多,包括Bacillus sp.[15]、Pseudomonas aeruginosa[16-17]、Sulfate-reducing bacteria (Desulfovibrio、Desulfomicrobium、Desulfobacter、Desulfosarcina、Desulfotomaculum)[18-19]、Streptomyces griseus[20]、Rahnella sp.[21]等,其中本文所采用的硫酸盐还原菌(Sulfate reducing bacteria,SRB)是一类从活性污泥中分离的具有还原重金属能力的细菌,研究表明该类菌在厌氧条件下具有固化冶炼渣中的铅锌等重金属的能力;Nancucheo等利用寡营养嗜酸铁还原菌(Acidiphilium strain SJH)及硫酸盐还原菌(Sulfate reducing bacteria,SRB)开展了实验室规模生物修复含铜锌尾矿废石的研究,结果表明接种上述细菌后,修复组比对照组电位低、pH值高,可降低尾矿废石中铜、锌等离子溶出,然而利用硫酸盐还原菌作为功能微生物修复冶炼渣场固化材料的报道还比较有限[22]。
本文以铅锌冶炼废渣为试验材料,通过接种本实验室前期分离自活性污泥的硫酸盐还原菌进行修复试验,在不同修复时段取样,分别测定冶炼废渣pH、氧化还原电位(Oxidation-reduction potential,ORP)、微生物菌群结构和关键重金属离子化学形态及浓度变化,探究硫酸盐还原菌(SRB)对铅锌冶炼渣中重金属离子修复效果。
1 材料与方法 1.1 材料 1.1.1 供试菌株及培养基供试菌株来自本实验室(生物冶金国家工程实验室)从活性污泥中分离的一类具有硫酸盐还原能力的细菌,统称为硫酸盐还原菌(SRB)。
复壮培养基(g/L):葡萄糖3.0,酵母浸提物5.0,蛋白胨6.0,氯化钠6.0。
修复培养基(g/L):葡萄糖1.8,蛋白胨2.0,磷酸氢二钾0.8,磷酸二氢钾0.6,氯化钠1.0,硫酸镁0.6,pH调至8.0。
1.1.2 供试渣样铅锌冶炼渣样采自广西某铅锌冶炼渣场。样品为黄褐色固体,pH 4.2,ORP 317 mV,含水率25.3%,将铅锌冶炼渣原样消解后利用电感耦合等离子发射光谱仪测得主要元素结果见表 1。通过对渣样中元素分析得出,原渣里面主要含有Zn、S、Ca、Fe及Pb元素。
| 元素 Element |
铅锌冶炼渣 Lead-zinc smelter slag (mg/kg) |
| Fe | 14.4 |
| Pb | 18.0 |
| Zn | 426.0 |
| Cd | 1.2 |
| Cr | 1.5 |
| Sn | 1.3 |
| S | 16.7 |
| Ca | 2.7 |
| Mn | 0.3 |
葡萄糖、蛋白胨、磷酸氢二钾,博恩创奇生化试剂公司。pH计,Thermo Fisher公司;电感耦合等离子发射光谱仪,安捷伦科技有限公司;偏光显微镜,上海五久自动化设备公司;高通量测序,生工生物工程(上海)股份有限公司。
1.2 方法 1.2.1 供试渣样的矿物组成检测铅锌冶炼渣样的矿物组成通过X射线衍射(X-ray diffraction,XRD)分析。矿物组成分析在国标(北京)检验认证有限公司进行,所用仪器型号为Rigaku-SmartLab衍射仪。测试条件:辐射源为CuKα (λ=0.154 18 nm),步宽为0.02,扫描范围10°-90°,扫描速度8°/min,电压45 kV,电流200 mA,测试在常温下进行。
矿物含量根据“绝热法”(K值法)原理进行计算。如果一个系统中存在N个相,其中X相的质量分数为:

|
其中,A可以是被选定的样品中的任一相。i=A……N,表示样品中有N个相;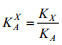
在无菌操作台将冻干保藏的菌粉取出转移至装有5 mL复壮液体培养基的试管中摇匀,取1 mL菌液转接到装有100 mL培养液的锥形瓶中,30 ℃条件下厌氧培养5 d。采用紫外可见分光光度计在波长为600 nm处测定其OD600值,当OD600值为0.8时再次转接到新鲜培养液中,如此转接3-5次备用,每次转接前用硫酸铅(PbSO4)试纸检测是否有硫化氢生成,并在显微镜下观察微生物状态。
1.2.3 构建硫酸盐还原菌修复体系将自然风干后的铅锌冶炼渣调配均匀,分别取150 g加入6个500 mL的锥形瓶中,按照修复培养基配方各制备900 mL液体培养基,分别平均添加到锥形瓶中,然后各取15 mL复壮后的硫酸盐还原菌菌液在4 500 r/min下离心3.5 min,弃去上清液后将菌泥分别接种到3个锥形瓶中设置为修复组,另设3个未接菌的设置为对照组,30 ℃且CO2稳定在5%的条件下厌氧培养。
1.2.4 冶炼渣的酸碱性及氧化还原电位测定在第10、20、30、40、50和60天分别取对照组和修复组的溶液,采用pH计和高电阻直流电位差计测定液体的pH值和ORP值。每次测定前需使用标准液进行校正。
1.2.5 冶炼渣中重金属固化的研究固化作用是通过微生物自身代谢活动改变冶炼渣中重金属结合态,转化为毒性低、迁移性小、生物可利用性低的稳定态。其中以修复过程中样品重金属离子稳定态的增加量来衡量修复效果。硫酸盐还原菌固化冶炼渣中重金属的能力,既与微生物菌群丰度有关,又与修复时间有关。具体操作:在第10、20、30、40和50天分别对修复组和对照组取样,用紫外可见分光光度计在波长为600 nm处测定其OD600值。另外,各取10 mL菌液经0.45 μm的滤膜过滤,然后将滤液转移到含有5%稀硝酸的容量瓶中,摇匀后静置2 h,最后通过电感耦合等离子发射光谱仪(Inductively coupled plasma optical emission spectrometer,ICP-OES)测定各种重金属离子浓度[23-24]。每次取样后,修复组添加同等体积的培养基,对照组添加同等体积的去离子水。
1.2.6 冶炼渣中不同形态的重金属提取及测定分别取原渣样修复30 d和60 d样品自然风干,研磨至200目,各准确称取2 g (精确到0.000 1 g)样品,编号装入带盖50 mL聚丙烯离心管中,按照修改后的Tessier法进行分步提取操作。具体操作如下:
(1) 水溶态。加入16 mL去离子水,自然pH条件下,25 ℃连续振荡30 min,8 800 r/min离心13 min,取上清液用0.45 μm滤膜过滤至25 mL容量瓶中待测。去离子水洗涤残余物,离心弃去上清液。
(2) 可交换态。加入16 mL 1 mol/L的MgCl2溶液,调节pH 7.0,25 ℃下连续振荡1.5 h,8 800 r/min离心13 min,取上清液用0.45 μm滤膜过滤,加入5%的硝酸定容至25 mL容量瓶中待测。去离子水洗涤残余物,离心弃去上清液。
(3) 碳酸盐结合态。第2步的残渣加16 mL 1 mol/L NaAc溶液调至pH 5.0,25 ℃下连续振荡6 h,8 800 r/min离心13 min,取上清液用0.45 μm滤膜过滤,加入5%的硝酸于25 mL容量瓶定容后待测。去离子水洗涤残余物,离心弃去上清液。
(4) 铁锰氧化物结合态。第3步的残渣加16 mL 0.04 mol/L NH2OH·HCl的25% HAc溶液,在97 ℃水浴锅中恒温间断振荡5 h,静置水浴30 min、振荡30 min交替进行。8 800 r/min离心13 min,取上清液用0.45 μm滤膜过滤,加入5%的硝酸于25 mL容量瓶定容后待测。去离子水洗涤残余物,离心弃去上清液。
(5) 有机结合态和硫化物结合态。向上一步的残渣加5 mL 0.01 mol/L HNO3和8 mL 30% H2O2,用HNO3调节至pH 2.0,水浴加热到87 ℃,间断振荡2 h,加入5 mL H2O2调节至pH 2.0,继续间断振荡2 h后冷却到26 ℃,再加入5 mL 3.2 mol/L NH4Ac的20% HNO3溶液,连续振荡30 min,8 800 r/min离心13 min,取上清液用0.45 μm滤膜过滤,加入5%的硝酸于25 mL容量瓶定容后待测。去离子水洗涤残余物,离心弃去上清液。
(6) 残渣态。在200 ℃分别加入HCl、HNO3、HClO4消煮。残留态消解的步骤与全量提取法的步骤相同,即:将上一步剩下的残渣转移至200 mL的烧杯中,加入15 mL HCl消煮10 min后加入5 mL HNO3,消煮30 min后加入5 mL HClO4,消煮2 h后降低温度为160 ℃继续消煮30 min。最后将溶液过滤后转移至100 mL的容量瓶中定容,用ICP-OES测定所需重金属离子浓度。
1.2.7 微生物群落结构的检测采集不同修复时段(原渣样,修复30 d和60 d)的样品于塑料袋中,4 ℃密封送往生工生物工程(上海)股份有限公司进行高通量测序[25-26]。
用原核生物16S rRNA基因V3–V4区的通用引物开展高通量扩增子测序分析,用HiSeq 2500平台结合PE 250进行测序,群落组成与多样性用QIIME、Mothur、UPARSE软件分析,跟踪修复过程中的微生物种群结构改变。研究不同样品微生物的多样性、丰度、种群结构和空间分布的差异[27]。
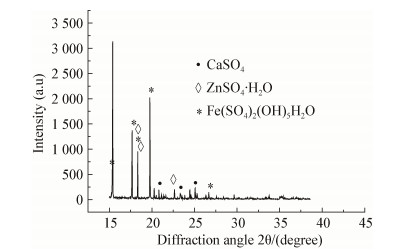
2 结果与分析 2.1 矿物组成分析由图 1可见,铅锌冶炼渣中主要成分为硫酸盐类物质,其中包括硫酸钙(CaSO4)、硫酸锌(ZnSO4)和硫酸铁类物质[Fe(SO4)2(OH)5H2O]等。
|
| 图 1 铅锌冶炼X射线衍射图谱 Figure 1 X-ray diffraction (XRD) patterns of lead-zinc smelter slag |
|
|
(1) 样品修复过程中的pH值
为避免样品溶解后自身pH可能对微生物修复过程产生影响,跟踪测定该过程中铅锌冶炼渣上清液在1 mol/L KCl溶液中的pH变化。铅锌冶炼渣的初始pH值为4.35。经不同时段取样检测pH的变化如图 2所示,对照组和修复组pH变化显著,在整个过程中对照组pH (4.0-5.0)变化不明显,仍然处于酸性环境;而修复组pH的变化为先升高后平缓逐渐调节至中性(pH 7.0左右),铅锌冶炼渣的酸性环境得到改善。

|
| 图 2 铅锌冶炼渣修复过程中pH值的变化 Figure 2 Changes of pH at different remediation time |
|
|
(2) 样品修复过程中的ORP值
跟踪测定修复过程中铅锌冶炼渣的氧化还原电位(ORP)的变化由图 3可见,对照组ORP变化不显著且均高于300 mV,处于氧化态电位,而修复组的电位存在降低的趋势,修复20 d后电位下降至负值(还原态),且20-40 d电位下降显著,最低电位达到-243 mV (40 d),40-50 d电位虽然仍处于负值但有上升趋势,这可能与修复后期微生物的营养消耗有关。

|
| 图 3 铅锌冶炼渣修复过程中ORP的变化 Figure 3 Changes of ORP at different remediation time |
|
|
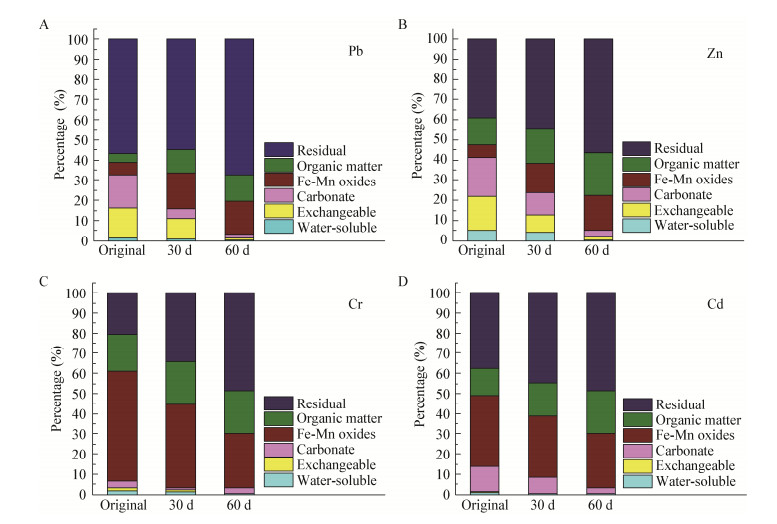
渣样中铅、锌的化学形态主要以铁锰氧化态、有机结合态和残渣态为主,碳酸盐态含量不多,且生物可直接利用的可溶态含量相对较低,但该部分仍然有被动植物富集的风险。分别取原渣样、修复30 d和60 d的渣样检测重金属形态分布结果如图 4所示。结果表明,原渣样中铅、锌、铬和镉主要以残渣态、有机结合态和铁锰结合态为主,分别占总量的67.50%、59.91%、76.21%和93.13%;碳酸盐态含量随修复进程逐渐降低,但原渣中仍有少量重金属以化学性质活泼、环境活性高的水溶及可交换态存在,可见该渣样仍然有污染环境的风险。在硫酸盐还原菌修复的过程中,铅、锌、铬和镉4种金属的稳定态含量不断提高,且60 d比30 d重金属固化效果更为显著。对于重金属铅,水溶态和可交换态的总量由原来的32.52%降低至3.30%,稳定态增加至96.71%;锌各化学形态的变化与铅有相似的趋势,其中水溶态和碳酸盐结合态含量变化较为显著,水溶态含量仅为0.22%,碳酸盐结合态也由19.41%降至3.12%,减小了该类物质在酸性条件下再次复溶且形成二次污染的风险;原渣样中的铬93.12%属于稳定态(残渣态、有机结合态和铁锰结合态),经过60 d的修复稳定态增加至98%以上,降低了渣样中铬离子迁移转化的风险;渣样中镉的化学形态变化与铬相似,几乎全部聚集为稳定态,少量的碳酸盐结合态也在修复过程中由12.52%降至3.12%。在采用硫酸盐还原菌修复铅锌冶炼渣的过程中,各重金属离子稳定态增加、游离态减少,固化效果显著,降低了铅锌冶炼渣污染环境风险,同时还为类似污染场地的修复提供了实验基础。
|
| 图 4 修复过程中各重金属化学形态变化 Figure 4 Chemical fractions of heavy metals at different remediation time Note: A: Pb; B: Zn; C: Cr; D: Cd. |
|
|
经过硫酸盐还原菌修复铅锌冶炼渣中各重金属浓度变化如图 5所示,在实验过程中对照组溶液中铅、锌、铬和镉4种重金属浓度变化不明显,而修复组中各重金属含量变化较为显著,采集不同时段液体检测重金属离子浓度及生物量的变化可知,随修复时间增加重金属离子浓度逐渐降低且微生物经过短暂的延迟期后迅速增殖,该结果与修复过程中各重金属化学形态变化较为一致(稳定态含量增加)。对于铅而言,硫酸盐还原菌修复前10天铅的固化效果不够明显,该结果可能与硫酸盐还原菌对环境的适应性相关,随着硫酸盐还原菌的活性增强,溶液中铅浓度降低显著,50 d后渣样中铅浓度仅为2.59 mg/L,固化率达到69.35%,且溶液中锌、铬和镉的浓度变化与铅一致,固化率分别为83.11% (由283.79 mg/L降低至47.91 mg/L)、77.16% (由0.22 mg/L降低至0.05 mg/L)和89.75% (由0.96 mg/L降低至0.09 mg/L)且生物量由0.11增加至0.79 (OD600)。总之,与对照组相比,接种硫酸盐还原菌的修复组重金属固化效果显著。因此,硫酸盐还原菌可作为这些重金属固定化的优良材料,用于修复类似污染场地,降低重金属的生物有效性及提升固化、稳定化的效果。

|
| 图 5 修复过程中各重金属浓度的变化 Figure 5 The concentrations of heavy metals at different remediation time Note: A: Pb; B: Zn; C: Cr; D: Cd. |
|
|
铅锌冶炼渣在修复过程中的微生物群落结构演替如图 6所示。结果表明,原冶炼渣样中以Bacillus、Exiguobacterium、Hydrotalea和Acidithiobacillus为主要菌群,其中Acidithiobacillus属于冶炼渣场常见的微生物,可以加速重金属离子的溶出。与原渣样相比,经过30 d和60 d的修复后,微生物群落结构发生了演替且微生物丰度增强显著,多样性明显增大,样品中Bacillus、Exiguobacterium和Acidithiobacillus含量均有降低,分别由17.65%、28.74%和7.50%减少至10.16%、0.55%和3.25%,而样品中Desulfovibrio的相对丰度从32.22%增加至63.72%,成为冶炼渣修复过程中的优势菌群;而且与原渣样相比,修复系统中微生物的浓度显著增加,由0.15增加至0.67 (OD600),其中修复30-60 d过程中微生物浓度增加平缓。结合修复实验结果可知,多数土著微生物仍然在修复组存活,与硫酸盐还原菌有机共存。该过程可在冶炼渣表面构建健康的底层微生物生态系统,这一系统可在现有的条件下自我平衡、自我生长,通过分泌胞外聚合物粘附于冶炼渣表面生长,实现固化重金属,改善生态环境,促进植物根系发展等多种修复功能。
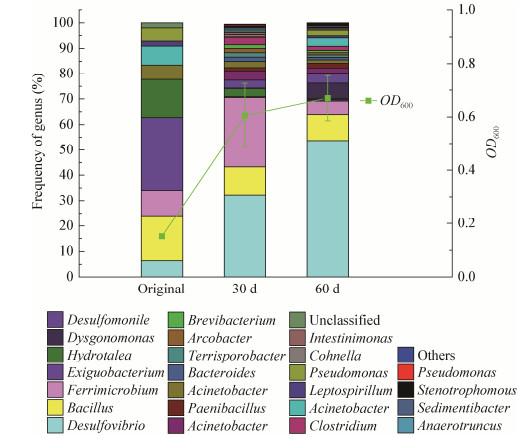
|
| 图 6 铅锌冶炼渣修复过程中微生物群落结构变化 Figure 6 Microbial community structure at different remediation time |
|
|
硫酸盐还原菌能够固化铅锌冶炼渣中的重金属,具有很好的工业应用前景,研究其对重金属修复的可行性具有非常重要的意义。Thavamani等发现从污泥中分离的硫酸盐还原菌在厌氧环境中修复重金属尾矿效果显著[28];Joo等将脱硫菌(Desulfovibrio desulfuicans)应用到含有镉、镍和铬多种重金属环境中的修复实验结果表明,其去除率分别可达到99.90%,98.31%和74.20%,并生成重金属硫化物沉淀[29]。通过对铅锌冶炼渣化学成分和矿物组成分析可知,该渣样主要成分为硫酸盐类物质,其中包括硫酸钙(CaSO4)、硫酸锌(ZnSO4)和硫酸铁类物质[Fe(SO4)2(OH)5H2O]等;该结果与冶炼过程中所选的药剂和渣样前期添加还原剂处理有关(硫化物及铁系盐),但由于受环境中各因子及土著氧化菌的影响,往往会造成重金属的再次“返溶”。为了实现持久稳定地固化冶炼渣中的重金属,本研究接种硫酸盐还原菌于铅锌冶炼渣中,在修复过程中,系统中环境电位降低、pH升高且各重金属化学形态及浓度发生变化,各重金属稳定态含量增加,可交换态含量减少,所以系统溶液中各离子浓度降低。冶炼渣中硫酸盐还原过程主要是硫酸盐还原菌通过传递电子给系统中的硫酸根产生S2-,S2-具有还原性,其与冶炼渣中重金属结合生成金属硫化物沉淀[30-31]是一个耗酸的过程,从而引起pH的升高,环境电位降低。尾矿堆和冶炼渣场中存在多种微生物[32-35],包括氧化菌(Acidithiobacillus ferrooxidans、Leptospirillum ferrooxidans、Leptospirillum ferriphilum)和还原菌(SRB、Pseudochrobactrum saccharolyticum、Stenotrophomonas sp.)等[36-38],其中在嗜酸氧化菌的作用下会源源不断地溶出重金属,形成恶性循化。在重金属浸出或修复过程中随时间的增加微生物群落结构变化显著[39-41]。本实验取不同修复时段样品对微生物群落结构变化进行分析,所测样品的Desulfovibrio含量从32.22%增加至63.72%,成为冶炼渣修复过程中的优势菌,且原渣样中主要菌群(Bacillus、Exiguobacterium和Acidithiobacillus)含量逐渐减少,该过程硫酸盐还原菌成为主要菌群,将铅锌冶炼渣中恶性循环变为良性循环。综上所述,硫酸盐还原菌可用作重金属污染修复的固化药剂。
| [1] |
Park JH, Bolan N, Megharaj M, et al. Isolation of phosphate solubilizing bacteria and their potential for lead immobilization in soil[J]. Journal of Hazardous Materials, 2011, 185(2/3): 829-836. |
| [2] |
Han GQ, Wang B, Xu WH, et al. Effects of heavy metal compound contamination of Cd, Zn, Cu and Pb on soil biological activity[J]. Chinese Journal of Eco-Agriculture, 2012, 20(9): 1236-1242. (in Chinese) 韩桂琪, 王彬, 徐卫红, 等. 重金属Cd、Zn、Cu和Pb复合污染对土壤生物活性的影响[J]. 中国生态农业学报, 2012, 20(9): 1236-1242. |
| [3] |
Li MJ, Wang CL, Li RC, et al. Microorganism remediation of Hg, Pb and Cr contaminated soil[J]. Chinese Journal of Environmental Engineering, 2013, 7(4): 1568-1572. (in Chinese) 李梦杰, 王翠玲, 李荣春, 等. 汞、铅、铬污染土壤的微生物修复[J]. 环境工程学报, 2013, 7(4): 1568-1572. |
| [4] |
Wang YY, Li FF, Song J, et al. Stabilization of Cd-, Pb-, Cu- and Zn-contaminated calcareous agricultural soil using red mud: a field experiment[J]. Environmental Geochemistry and Health, 2018, 40(5): 2143-2153. DOI:10.1007/s10653-018-0089-9 |
| [5] |
Bolan N, Kunhikrishnan A, Thangarajan R, et al. Remediation of heavy metal(loid)s contaminated soils-to mobilize or to immobilize?[J]. Journal of Hazardous Materials, 2014, 266: 141-166. DOI:10.1016/j.jhazmat.2013.12.018 |
| [6] |
Lim MW, Lau EV, Poh PE. A comprehensive guide of remediation technologies for oil contaminated soil — Present works and future directions[J]. Marine Pollution Bulletin, 2016, 109(1): 14-45. DOI:10.1016/j.marpolbul.2016.04.023 |
| [7] |
Hrynkiewicz K, Baum C. Application of microorganisms in bioremediation of environment from heavy metals[A]//Malik A, Grohmann E, Akhtar R. Environmental Deterioration and Human Health[M]. Dordrecht: Springer, 2014: 215-227
|
| [8] |
Pociecha M, Lestan D. Novel EDTA and process water recycling method after soil washing of multi-metal contaminated soil[J]. Journal of Hazardous Materials, 2012, 201-202: 273-279. DOI:10.1016/j.jhazmat.2011.11.092 |
| [9] |
Li YY, Liang JL, He X, et al. Kinetics and mechanisms of amorphous FeS2 induced Cr(Ⅵ) reduction[J]. Journal of Hazardous Materials, 2016, 320: 216-225. DOI:10.1016/j.jhazmat.2016.08.010 |
| [10] |
Cason ED, Williams PJ, Ojo E, et al. Hexavalent chromium bioreduction and chemical precipitation of sulphate as a treatment of site-specific fly ash leachates[J]. World Journal of Microbiology and Biotechnology, 2017, 33(5): 88. DOI:10.1007/s11274-017-2243-4 |
| [11] |
Braud AM, Hubert M, Gaudin P, et al. A quick rhizobacterial selection tests for the remediation of copper contaminated soils[J]. Journal of Applied Microbiology, 2015, 119(2): 435-445. DOI:10.1111/jam.2015.119.issue-2 |
| [12] |
El Aafi N, Brhada F, Dary M, et al. Rhizostabilization of metals in soils using Lupinus luteus inoculated with the metal resistant Rhizobacterium serratia sp. MSMC541[J]. International Journal of Phytoremediation, 2012, 14(3): 261-274. DOI:10.1080/15226514.2011.604693 |
| [13] |
Banerjee G, Pandey S, Ray AK, et al. Bioremediation of heavy metals by a novel bacterial strain Enterobacter cloacae and its antioxidant enzyme activity, flocculant production, and protein expression in presence of lead, cadmium, and nickel[J]. Water, Air, & Soil Pollution, 2015, 226(4): 91. |
| [14] |
Liu M, Zheng R, Bai SL, et al. Advances of species diversity of arbuscular mycorrhizal fungi[J]. Microbiology China, 2016, 43(8): 1836-1843. (in Chinese) 刘敏, 峥嵘, 白淑兰, 等. 丛枝菌根真菌物种多样性研究进展[J]. 微生物学通报, 2016, 43(8): 1836-1843. |
| [15] |
Shi FY, Zhu YB. Application of statistically-based experimental designs in medium optimization for spore production of Bacillus subtilis from distillery effluent[J]. Biocontrol, 2007, 52(6): 845-853. DOI:10.1007/s10526-006-9055-z |
| [16] |
Kang CX, Wu PX, Li YW, et al. Estimates of heavy metal tolerance and chromium(Ⅵ) reducing ability of Pseudomonas aeruginosa CCTCC AB93066: chromium(Ⅵ) toxicity and environmental parameters optimization[J]. World Journal of Microbiology and Biotechnology, 2014, 30(10): 2733-2746. DOI:10.1007/s11274-014-1697-x |
| [17] |
Zhao J, Chen MM, Hu HB, et al. Construction of Pseudomonas sp. GP72 rpeB mutant and its regulation on PCA and 2-OH-PHZ biosynthesis[J]. Microbiology China, 2015, 42(1): 3-8. (in Chinese) 赵嘉, 陈明敏, 胡洪波, 等. 假单胞菌GP72 rpeB突变株的构建及其对吩嗪类抗生素合成的调控[J]. 微生物学通报, 2015, 42(1): 3-8. |
| [18] |
Senko JM, Zhang GX, McDonough JT, et al. Metal reduction at low pH by a Desulfosporosinus species: implications for the biological treatment of acidic mine drainage[J]. Geomicrobiology Journal, 2009, 26(2): 71-82. DOI:10.1080/01490450802660193 |
| [19] |
Cabrera G, Pérez R, Gómez JM, et al. Toxic effects of dissolved heavy metals on Desulfovibrio vulgaris and Desulfovibrio sp. strains[J]. Journal of Hazardous Materials, 2006, 135(1/3): 40-46. |
| [20] |
Aparicio J, Solá MZS, Benimeli CS, et al. Versatility of Streptomyces sp. M7 to bioremediate soils co-contaminated with Cr(Ⅵ) and lindane[J]. Ecotoxicology and Environmental Safety, 2015, 116: 34-39. DOI:10.1016/j.ecoenv.2015.02.036 |
| [21] |
Govarthanan M, Mythili R, Selvankumar T, et al. Isolation and characterization of a biosurfactant-producing heavy metal resistant Rahnella sp. RM isolated from chromium-contaminated soil[J]. Biotechnology and Bioprocess Engineering, 2017, 22(2): 186-194. DOI:10.1007/s12257-016-0652-0 |
| [22] |
Guo YR, Liu YS. Experiment on dissolution of Pd and Zn in heavy metals contaminated agricultural soil by functional microorganisms[J]. Chinese Journal of Environmental Engineering, 2014, 8(3): 1191-1196. (in Chinese) 郭彦蓉, 刘阳生. 功能微生物对污染农田土壤中铅锌的溶出实验[J]. 环境工程学报, 2014, 8(3): 1191-1196. |
| [23] |
Chen HY, Fan T, Zhang Z, et al. Effects of four plants on soil microbial biomass and soil enzyme activity in heavy metal combined polluted soil[J]. Environmental Protection, 2018, 46(1): 65-69. (in Chinese) 陈海燕, 樊霆, 张泽, 等. 不同植物修复重金属复合污染土壤对土壤中微生物数量与酶活性的影响[J]. 环境保护, 2018, 46(1): 65-69. DOI:10.3969/j.issn.1006-4362.2018.01.013 |
| [24] |
Fang X, Tian DL, Wu LH, et al. Effects on soil microorganisms and enzyme activity of re-vegetation in the slag wasteland of Xiangtan manganese mine[J]. Journal of Soil and Water Conservation, 2009, 23(4): 221-226. (in Chinese) 方晰, 田大伦, 武丽花, 等. 植被修复对锰矿渣废弃地土壤微生物数量与酶活性的影响[J]. 水土保持学报, 2009, 23(4): 221-226. |
| [25] |
Xing JJ, Lei Q, Qiu ZM, et al. Microbial community structure and diversity in waterlogged wood and lacquer named F446 by Illumina MiSeq technology[J]. Microbiology China, 2018, 45(8): 1685-1692. (in Chinese) 幸晶晶, 雷琼, 邱祖明, 等. 应用高通量技术分析F446饱水木漆器中微生物群落结构多样性[J]. 微生物学通报, 2018, 45(8): 1685-1692. |
| [26] |
Qi YY, Wu ML, Zhu CC, et al. Microbial community structure shift during bioremediation of petroleum contaminated soil using High Throughput Sequencing[J]. Environmental Science, 2019, 40(2): 869-875. (in Chinese) 祁燕云, 吴蔓莉, 祝长成, 等. 基于高通量测序分析的生物修复石油污染土壤菌群结构变化[J]. 环境科学, 2019, 40(2): 869-875. |
| [27] |
Song SF, Yang F, Gao XF, et al. Effects of sewage treatment on microbial community structure of surface water in Xiantao wetland[J]. Microbiology China, 2019, 46(3): 512-521. (in Chinese) 宋淑芬, 杨帆, 高绣纺, 等. 湿地法处理生活污水对仙桃湿地地表水微生物群落结构的影响[J]. 微生物学通报, 2019, 46(3): 512-521. |
| [28] |
Thavamani P, Samkumar RA, Satheesh V, et al. Microbes from mined sites: harnessing their potential for reclamation of derelict mine sites[J]. Environmental Pollution, 2017, 230: 495-505. DOI:10.1016/j.envpol.2017.06.056 |
| [29] |
Joo JO, Choi JH, Kim IH, et al. Effective bioremediation of cadmium (Ⅱ), nickel (Ⅱ), and chromium (Ⅵ) in a marine environment by using Desulfovibrio desulfuricans[J]. Biotechnology and Bioprocess Engineering, 2015, 20(5): 937-941. DOI:10.1007/s12257-015-0287-6 |
| [30] |
Jong T, Parry DL. Adsorption of Pb(Ⅱ), Cu(Ⅱ), Cd(Ⅱ), Zn(Ⅱ), Ni(Ⅱ), Fe(Ⅱ), and As(Ⅴ) on bacterially produced metal sulfides[J]. Journal of Colloid and Interface Science, 2004, 275(1): 61-71. DOI:10.1016/j.jcis.2004.01.046 |
| [31] |
Alazard D, Joseph M, Battaglia-Brunet F, et al. Desulfosporosinus acidiphilus sp. nov.: a moderately acidophilic sulfate-reducing bacterium isolated from acid mining drainage sediments[J]. Extremophiles, 2010, 14(3): 305-312. DOI:10.1007/s00792-010-0309-4 |
| [32] |
Liu XY, Chen BW, Chen JH, et al. Biogeographical distribution of acidophiles and their effects around the Zijinshan heap bioleaching plant[J]. Chemistry and Ecology, 2016, 32(5): 419-431. DOI:10.1080/02757540.2016.1150456 |
| [33] |
Brierley CL, Brierley JA. Progress in bioleaching: Part B: applications of microbial processes by the minerals industries[J]. Applied Microbiology and Biotechnology, 2013, 97(17): 7543-7552. DOI:10.1007/s00253-013-5095-3 |
| [34] |
Sun M, Xiao TF, Ning ZP, et al. Microbial community analysis in rice paddy soils irrigated by acid mine drainage contaminated water[J]. Applied Microbiology and Biotechnology, 2015, 99(6): 2911-2922. DOI:10.1007/s00253-014-6194-5 |
| [35] |
Xia LX, Dai SL, Yin C, et al. Comparison of bioleaching behaviors of different compositional sphalerite using Leptospirillum ferriphilum, Acidithiobacillus ferrooxidans and Acidithiobacillus caldus[J]. Journal of Industrial Microbiology & Biotechnology, 2009, 36(6): 845-851. |
| [36] |
Abdollahi H, Noaparast M, Shafaei SZ, et al. Silver-catalyzed bioleaching of copper, molybdenum and rhenium from a chalcopyrite-molybdenite concentrate[J]. International Biodeterioration & Biodegradation, 2015, 104: 194-200. |
| [37] |
Wang N, Lu XL, Wu MXJ, et al. Progress in microbial oxidation of As(Ⅲ) and Sb(Ⅲ)[J]. Microbiology China, 2017, 44(3): 689-700. (in Chinese) 王年, 鲁小璐, 邬梦晓俊, 等. 微生物氧化As(Ⅲ)和Sb(Ⅲ)的研究进展[J]. 微生物学通报, 2017, 44(3): 689-700. |
| [38] |
Chen BW, Wu B, Liu XY, et al. Effect of CO2 and N2 on microbial community changes during column bioleaching of low-grade high pyrite-bearing chalcocite ore[J]. Journal of Central South University, 2015, 22(12): 4528-4535. DOI:10.1007/s11771-015-3002-z |
| [39] |
Zhang MJ, Chen BW, Wang N, et al. Effects of heap-bioleaching plant on microbial community of the nearby river[J]. International Biodeterioration & Biodegradation, 2018, 128: 36-40. |
| [40] |
Ahemad M, Kibret M. Recent trends in microbial biosorption of heavy metals: a review[J]. Biochemistry & Molecular Biology, 2013, 1(1): 19-26. |
| [41] |
Shahi A, Aydin S, Ince B, et al. Reconstruction of bacterial community structure and variation for enhanced petroleum hydrocarbons degradation through biostimulation of oil contaminated soil[J]. Chemical Engineering Journal, 2016, 306: 60-66. DOI:10.1016/j.cej.2016.07.016 |
 2019, Vol. 46
2019, Vol. 46