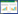扩展功能
文章信息
- 张晓红, 姜博, 张文武, 陈立明, 郭泓利
- ZHANG Xiao-Hong, JIANG Bo, ZHANG Wen-Wu, CHEN Li-Ming, GUO Hong-Li
- 京津冀区域市政污水厂活性污泥种群结构的多样性及差异
- Microbial community diversity of activated sludge from municipal wastewater treatment plants in Beijing-Tianjin-Hebei region
- 微生物学通报, 2019, 46(8): 1896-1906
- Microbiology China, 2019, 46(8): 1896-1906
- DOI: 10.13344/j.microbiol.china.190366
-
文章历史
- 收稿日期: 2019-04-25
- 接受日期: 2019-07-05
- 网络首发日期: 2019-07-22
2. 北京北控污水净化及回用有限公司 北京 102200;
3. 北京大学环境科学与工程学院 北京 100871
2. Beijing Beikong Sewage Purification and Reuse Co. Ltd., Beijing 102200, China;
3. College of Environmental Sciences and Engineering, Peking University, Beijing 100871, China
活性污泥法是最重要的污水处理工艺之一,在世界范围内已被广泛地应用于处理市政污水和工业废水。而高度多样化微生物群落(超过700属)形成的以菌胶团为骨架的活性污泥,是有效保证污水处理效果的关键[1-2]。活性污泥是微生物群体及它们所依附的有机物质和无机物质的总称,具有由多种细菌组成并通过胞外聚合物和离子桥作用形成的絮状结构,其中细菌是活性污泥组成和净化功能的核心[3]。研究活性污泥中细菌的群落结构组成及多样性,并分析相应菌群的主要功能,对更好地发挥细菌的净化作用、保持污水处理过程的稳定和提高污水的处理效率具有重要的指导作用。
活性污泥中的大多数微生物无法通过传统的培养技术进行准确可靠的分离鉴定[4],而随着16S rRNA基因测序技术的逐步完善和成本降低,使得获取复杂环境条件下的细菌群落结构信息成为可能[5]。近年来,454焦磷酸、Illumina等高通量测序因具有分析结果准确、快速、灵敏度高等特点,已在土壤、污泥、沉积物等复杂环境样品的检测分析中取得了很好的应用效果[6-8]。因此,采用高通量测序研究污水厂活性污泥细菌群落结构不失为一个良好的技术选择。Seib等采用Illumina MiSeq高通量测序的方法,发现不同进水温度、不同进水微生物菌群以及不同反应器结构都会对厌氧膜生物反应器内污泥群落结构产生影响[9]。Metch等利用高通量测序技术对污泥DNA以及RNA反转录后的cDNA样本进行分析,发现经过18 d的饥饿期,硝化细菌Nitrospira成为污泥中的优势硝化菌种,其DNA和cDNA相对丰度的比例保持稳定,对饥饿有着很好的耐受性[10]。Yang等对污水厂正常活性污泥和膨胀活性污泥进行了Illumina高通量测序分析,发现污泥膨胀会影响细菌与噬菌体之间相对丰度的平衡,并使细菌与噬菌体菌群生物多样性降低[11]。
京津冀地区是国家发展战略中最为重要的区域之一。由于京津冀地区长期高强度的开发利用水资源,导致该区域出现了严重的水资源短缺和水环境污染的双重困境[12-13]。2005年以来,京津冀地区城镇污水处理设施建设得到很大的提升,部分缓解了市政污水对水环境的污染[13]。由此我们以京津冀地区污水厂的活性污泥为研究对象,考察其群落组成并进行功能解析,以期明确影响污水处理过程稳定性和处理效率的关键因素。
本研究采用Illumina MiSeq高通量测序对京津冀区域5个污水厂的活性污泥中细菌群落结构组成进行详细的测定解析,同时对不同工艺运行参数下的活性污泥之间的优势物种进行比较分析,从而有利于进一步挖掘功能微生物的重要作用。另外,随着近年来国家环保部门对污水厂出水总氮监控的日趋严格,如何提高脱氮工艺中反硝化过程的运行效率和稳定性已成为污水厂亟待解决的问题。本研究采用实时定量PCR技术,通过对5个污水厂的活性污泥中反硝化过程关键功能基因nirS和nirK丰度进行定量分析[14-15],揭示了不同污水厂污泥中反硝化菌的差异。本研究的结果为提高污水处理系统的稳定运行及实际效能提供了一定的理论依据与技术支持。
1 材料与方法 1.1 主要试剂和仪器DNA提取试剂盒,MP Biomedicals公司;琼脂糖,Sigma公司。NanoDrop 2000紫外分光光度计,Thermo Fisher Scientific公司;PCR仪,Applied Biosystems公司。16S rRNA基因扩增引物由美吉生物医药科技有限公司合成。
1.2 样品采集及水质测定活性污泥样品采集时间为2017年11月中旬,取自5个污水厂的缺氧段,每个污水厂取3个平行样。混合液经过30 min静置并离心(4 ℃、8 000 r/min、5 min)后保存在-20 ℃。选取的5个污水厂地处京津冀区域,各污水厂的进水水质特性、工艺类型、出水浓度见表 1。5个污水厂进水水质存在较为明显的差异:Shahe (SH)厂来水中生活污水占比约95%,有机质含量丰富,COD (Chemical oxygen demand)、BOD5 (5-Day biochemical oxygen demand)、总氮(Total nitrogen,TN)和氨氮浓度均为5个水厂中最高;Daoxianghu (DXH)厂来水主要为生活污水,但由于管道存在地下水渗漏的现象,导致各项指标偏低;Nangong (NG)厂来水中生活污水占比约为80%,剩下20%主要为皮毛加工厂、屠宰厂产生废水;Hejian (HJ)厂来水中超过45%为车间冲洗水和冷却水、空调水及其他工业废水,各项来水指标浓度均为5个水厂中最低;Hengshui (HS)厂位于工业园区其来水约80%为工业废水,园区内企业多为龙头企业,污水处理站预处理运行状况较好,排放的废水各项指标均达标,因此各项来水指标浓度也非常低。
| 水厂名称 Sewage plant |
工艺 Craft |
COD (mg/L) | BOD5 (mg/L) | TN (mg/L) | NH4+-N (mg/L) | TP (mg/L) | 水温 Tempera-ture (℃) |
|||||||||
| Influent | Effluent | Influent | Effluent | Influent | Effluent | Influent | Effluent | Influent | Effluent | |||||||
| Daoxianghu (DXH) | Anoxic-Oxic (AO) | 173.80 | 17.40 | 84.10 | 1.70 | 36.10 | 17.75 | 30.10 | 0.29 | 3.30 | 0.19 | 14.0 | ||||
| Shahe (SH) | Anaerobic- Anoxic-Oxic (A2O) | 345.80 | 27.10 | 217.30 | 7.00 | 49.40 | 14.00 | 39.70 | 0.30 | 6.20 | 0.34 | 14.6 | ||||
| Nangong (NG) | Anoxic- Anaerobic- Oxic (A2O) | 255.20 | 24.50 | 74.00 | 5.70 | 32.80 | 17.60 | 24.00 | 0.80 | 6.46 | 3.17 | 19.7 | ||||
| Hengshui (HS) | A2O | 100.64 | 19.09 | 32.00 | 6.67 | 29.67 | 15.15 | 2.96 | 2.82 | 2.15 | 0.36 | 20.0 | ||||
| Hejian (HJ) | A2O | 94.70 | 34.00 | 28.00 | 7.00 | 21.35 | 17.71 | 7.95 | 1.64 | 0.24 | 0.06 | 16.9 | ||||
采用DNA提取试剂盒对每个保存的样品取0.2 mL污泥进行DNA提取,具体操作按试剂盒的试验步骤进行。对于提取的DNA,采用NanoDrop 2000对DNA浓度和纯度进行检测,采用1%琼脂糖凝胶电泳对DNA完整性进行检测。
1.4 PCR扩增及Illumina测序质检合格的DNA样品采用引物对515F (5′-G TGCCAGCMGCCGCGG-3′)和907R (5′-CCGTCA ATTCMTTTRAGTTT-3′)进行16S rRNA基因V4可变区的高通量测序(Illumina MiSeq 2000)。测序获得的原始序列数据经过质控过滤后得到高质量序列,之后采用USEARCH进行OTU (Operational taxonomic units)聚类分析并通过RDP classifier贝叶斯算法在97%相似水平对OTU进行物种分类学注释(80%置信度)。基于OTU数据,对反映微生物群落丰度和多样性的参数进行了计算,包括丰富度指数(Chao/ACE指数)、覆盖率指数(Good’s coverage)和多样性指数(Shannon指数)。本研究所有样品的原始序列已上传至NCBI,数据项目编号(BioSample accession)为SRP154042。
1.5 实时定量PCR对5个污水厂活性污泥DNA中的nirS、nirK基因进行实时定量PCR (Real-time quantitative PCR,qPCR)分析。PCR反应体系(20 μL):DNA模板2 μL,正、反向引物(10 pmol/L)各2 μL,2×Power qPCR PreMix 10 μL,50×Rox Reference Dye 0.4 μL,双蒸馏水3.6 μL。本次实验所采用的qPCR反应引物和扩增测序如表 2所示。
| 基因名 Gene symbol |
引物名称 Primers name |
引物序列 Primers sequences (5′→3′) |
扩增反应程序 qPCR processes |
| nirS | NirS-cd3aF | GTSAACGTSAAGGARACSGG | 94 ℃ 2 min; 6 cycles of 94 ℃ 30 s, 57 ℃ 30 s (-1 ℃/cycle), 72 ℃ 45 s; 30 cycles of 94 ℃ 30 s, 52 ℃ 30 s, 72 ℃ 45 s |
| NirS-R3cd | GASTTCGGRTGSGTCTTGA | ||
| nirK | NirK-F1aCu | ATCATGGTSCTGCCGCG | 95℃ 3 min; 6 cycles of 95℃ 30 s, 63℃ 30 s (-1 ℃/cycle), 72 ℃ 30 s; 32 cycles of 95 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 30 s |
| NirK-R3Cu | GCCTCGATCAGRTTGTGGTT |
经过对原始序列进行质控过滤处理后,5组污泥样品的有效序列数为32 290-69 083 (表 3)。为保证后续各样品的分析均在同一测序深度上进行,对5组污泥样品进行了抽平处理,即将各样品的有效序列数标准化至最小的32 290。在97%相似水平上,5组样品的OTU数、Good’s coverage指数、Shannon指数和ACE指数的计算结果见表 3。可以看出,各样品的Coverage指数值较高,均在0.98以上,说明样品中绝大部分的细菌种属都被检测出来,测序结果能够较准确地反映样品的生物特性。5组污泥样品中的OTU数为1 006-1 965,与此前活性污泥的研究结果相似[16]。通过比较不同厂污泥的OTU数可以发现:HS厂污泥的微生物多样性最高,其次是SH厂、NG厂和DXH厂污泥,而HJ厂污泥的微生物多样性最低。各样品的Shannon指数和ACE指数也展示出与OTU数非常相似的规律。HJ厂的来水多为车间冲洗水和冷却水、空调水,部分为工业废水,进水COD仅为94.7 mg/L,TN浓度为21.35 mg/L,营养物质匮乏和C/N失衡可能是导致其污泥中微生物多样性较低的主要原因[17]。
| Samples | Reads number | OTU | Shannon index | ACE index | Coverage |
| DXH1 | 46 387 | 1 617 | 5.93 | 1 885 | 0.986 8 |
| DXH2 | 48 306 | 1 600 | 5.96 | 1 902 | 0.985 1 |
| DXH3 | 45 849 | 1 485 | 5.81 | 1 757 | 0.984 5 |
| SH1 | 62 970 | 1 292 | 5.54 | 1 514 | 0.989 7 |
| SH2 | 57 529 | 1 323 | 5.54 | 1 643 | 0.987 1 |
| SH3 | 58 184 | 1 262 | 5.49 | 1 528 | 0.988 3 |
| NG1 | 44 387 | 1 319 | 5.72 | 1 544 | 0.988 5 |
| NG2 | 63 653 | 1 413 | 5.73 | 1 627 | 0.991 7 |
| NG3 | 49 432 | 1 352 | 5.78 | 1 588 | 0.988 6 |
| HS1 | 69 083 | 1 965 | 5.88 | 2 206 | 0.993 0 |
| HS2 | 43 505 | 1 791 | 5.90 | 2 137 | 0.986 4 |
| HS3 | 66 475 | 1 912 | 5.97 | 2 079 | 0.994 3 |
| HJ1 | 32 290 | 1 006 | 4.98 | 1 329 | 0.985 3 |
| HJ2 | 34 397 | 1 034 | 5.08 | 1 263 | 0.988 6 |
| HJ3 | 34 638 | 1 019 | 4.97 | 1 297 | 0.986 6 |
为了深入了解不同样品间群落结构的相似性和差异性,采用层序聚类HeatMap对5个污水厂活性污泥样品进行Average聚类分析,结果如图 1所示。可以看出,各污水厂的3个平行样品均被聚类为一簇,表明本次研究平行性较好。同时,还可以看出,DXH和SH厂污泥样品中的微生物群落结构相似,被聚类为一簇。推测原因是DXH和SH厂均位于北京地区,且污水厂来水均主要为生活污水,因此污水特性也相似。HJ和HS厂污泥的微生物群落结构与其他3个污水厂污泥差异性较大。推测是由于这两个污水厂的来水为企业生产废水(占50%),与生活污水水质特性相差较大所致。NG厂来水为80%生活污水及20%工业废水,因此其污泥的微生物群落结构与DXH和SH厂较相似,但也存在差异。
|
| 图 1 属水平群落结构聚类分析(仅展示总丰度前40的属) Figure 1 Hierarchical cluster analysis of microbial communities from each activated sludge (Showing top 40 genera) 注:越偏红色表示相对丰度越高,越偏绿色表示相对丰度越低. Note: The closer to red, the higher of their relative abundance, whereas the closer to green, the lower of their relative abundance. |
|
|
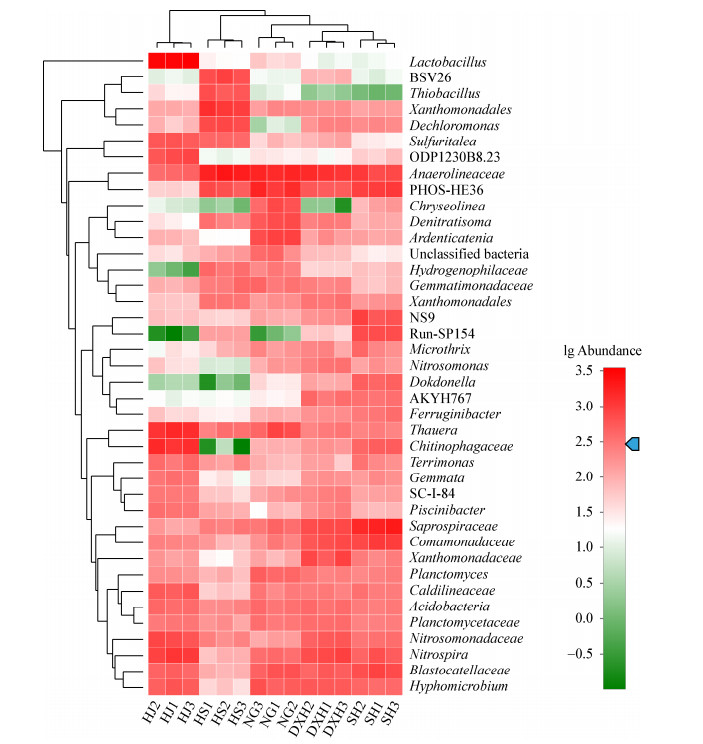
为了进一步研究5个污水厂污泥的微生物群落结构差异的机制,采用Distance-based- redundancy analysis (db-RDA)方法对菌群与环境因子之间的关系进行了分析,如图 2所示。结果表明,环境因子对群落结构的总解释度为93.2%,各厂污泥的3个平行样本均各自聚为一类,群落结构差异明显。温度、总氮、总磷和氨氮是影响污泥群落结构的最主要因素,且具有显著性(P < 0.05)。HS厂污泥的群落结构受温度的影响最大;SH、DXH、NG厂污泥的群落结构受总氮、总磷和氨氮的影响,其中,SH厂污泥受氨氮的影响最大。HJ厂污泥最为特殊,4个环境因子均未对其群落结构产生影响,其主要原因可能为其它环境因子的作用,如重金属离子、抗生素等。COD和BOD5对5个污水厂污泥微生物群落结构的影响不具显著性差异(P > 0.05),因此未在图中展示。
|
| 图 2 各活性污泥样品微生物群落RDA分析 Figure 2 RDA analysis of different sludge samples |
|
|
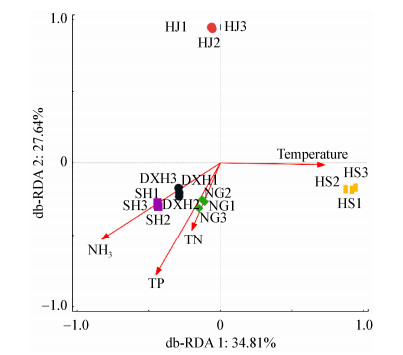
Venn图可用于统计多个样品中所共有和独有的OTU数目,不同的颜色代表不同的样本,可以比较直观的表现污泥样品的OTU数目组成相似性及重叠情况。在本次研究的5组污泥样品中,共检测到了3 258个OTU,从图 3可以看出5种污泥共有的OTU为478个。HS厂污泥中检测到的OTU最多,为2 099个,其中有667个OTU是HS厂污泥中独有的。推测是由于其上游来水为企业生产废水,水质组成更加复杂、与常规生活废水水质特性差别较大所致。DXH厂污泥中检测到的OTU数其次,为1 889个,其中有84个是DXH厂污泥中独有的。
|
| 图 3 基于OTU的5组污泥微生物群落Venn图 Figure 3 Venn diagram of microbial communities from different sludge samples based on OTU |
|
|
为了更好地了解不同污水厂活性污泥中菌群结构的特征,利用RDP Classifier对各样品的有效序列进行了从门到属的物种注释。在门水平上,5组污泥样品共检测到了53个门。从图 4可以看出,变形菌门(Proteobacteria)是所有样品中丰度最高的菌门,占比为34.1%-47.4%。另外3个主要菌门是拟杆菌门(Bacteroidetes)、绿弯菌门(Chlorolfexi)、厚壁菌门(Firmicutes),占比分别为10.0%-22.7%、7.0%-16.2%、1.7%-20.9%。以上4个菌门的细菌合计占比为64.8%-78.7%。其他丰度(所有样品均值)大于1%的菌门还有酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、Ignavibacteriae、放线菌门(Actinobacteria)、硝化螺旋菌门(Nitrospirae)、芽单胞菌门(Gemmatimonadetes)。
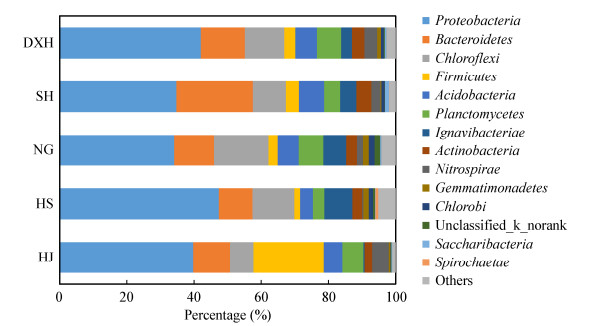
|
| 图 4 各污水厂活性污泥样品在门分类水平上的细菌群落组成 Figure 4 Taxonomic classification of bacterial sequencing at level of phylum |
|
|
表 4为主要优势菌门的丰度排序,可以看出各厂污泥样品在门分类水平上的菌群丰度存在一定的差异。对于DXH和SH,其污泥中拟杆菌占比较其他3个污水厂污泥高,是丰度仅次于变形菌门的第二优势菌。马思佳等[18]的研究表明在以乙酸钠为碳源时,会促进污泥中拟杆菌门含量的上升。DXH和HS厂为确保出水TN达标,投加了乙酸钠作为补充碳源。因此,可以推测乙酸钠的投加是导致DXH和HS厂污泥中拟杆菌门细菌含量较高的原因之一。此外,厚壁菌门在HJ厂污泥中的占比为20.9%,要远高于其他4个污水厂的1.7%-3.8%,成为HJ厂污泥中丰富度仅次于Proteobacteria的菌门。进一步分析表明HJ厂污泥中厚壁菌门细菌主要为乳杆菌属(Lactobacillus)细菌和盐厌氧菌目(Halanaerobiales)细菌,占比分别为15.42%和3.47%。这表明乳杆菌属细菌丰度的大幅度增加是导致HJ厂污泥中厚壁菌门远高于其他4个污水厂的主要原因。
| 污水厂名称 Sewage plant |
优势菌门丰度排序 Order of dominate bacteria at phylum level |
| DXH | Mycetozoan > Bacteroidetes > Chloroflexi > Planctomycetes > Acidobacteria |
| SH | Mycetozoan > Bacteroidetes > Chloroflexi > Acidobacteria > Ignavibacteriae |
| NG | Mycetozoan > Chloroflexi > Bacteroidetes > Planctomycetes > Ignavibacteriae |
| HS | Mycetozoan > Chloroflexi > Bacteroidetes > Ignavibacteriae > Acidobacteria |
| HJ | Mycetozoan > Firmicutes > Bacteroidetes > Chloroflexi > Planctomycetes |
为了更加深入探究5组污水厂污泥中的物种组成,在属或科水平上进行了物种分类和丰度分析,并对高丰度菌属(每种属或科的丰度至少在一个样品中不小于1%)的主要功能进行了注释,结果见表 5。从表 5中可以看出,各厂污泥中的优势菌属大多数为具有脱氮除磷功能的微生物,主要包括厌氧绳菌科(Anaerolineaceae)、乳杆菌属(Lactobacillus)、腐螺旋菌科(Saprospiraceae)、陶厄氏菌属(Thauera)、硝化螺菌属(Nitrospira)、黄色单胞菌目(Xanthomonadales)。另外,还有一部分是功能有待明确的菌属。
| Genera | Key functions | DXH (%) | SH (%) | NG (%) | HS (%) | HJ (%) |
| f_Anaerolineaceae | Denitrification, Methanogenesis | 6.13 | 4.14 | 7.47 | 9.39 | 1.95 |
| f_PHOS-HE36 | - | 2.56 | 4.77 | 6.49 | 3.12 | 0.22 |
| Lactobacillus | Hydrolytic acidification | 0.07 | 0.07 | 0.23 | 0.10 | 15.42 |
| f_Saprospiraceae | Denitrification, Anaerobic digestion | 3.60 | 8.40 | 1.76 | 1.32 | 0.61 |
| Thauera | Denitrification | 1.33 | 1.15 | 3.27 | 1.50 | 6.63 |
| Nitrospira | Nitration | 3.85 | 2.63 | 1.80 | 0.40 | 4.94 |
| o_Xanthomonadales | Heterotrophic denitrification/Biodegradable aliphatic polyester | 2.46 | 1.47 | 1.72 | 6.99 | 0.78 |
| f_Blastocatellaceae_Subgroup_4_ | Hydrogen sulfide oxidation | 2.38 | 3.72 | 2.83 | 0.44 | 2.17 |
| f_Comamonadaceae | Produce zoogloea | 3.29 | 4.55 | 1.12 | 0.48 | 1.09 |
| Hyphomicrobium | Denitrification | 2.66 | 1.92 | 2.65 | 0.22 | 2.58 |
| f_Chitinophagaceae | Denitrification | 0.77 | 2.30 | 0.44 | 0.01 | 6.48 |
| f_Nitrosomonadaceae | Nitrosation/Conversion of organic nitrogen to nitrate | 2.56 | 1.64 | 0.61 | 1.08 | 3.48 |
| c_Acidobacteria | - | 1.78 | 1.31 | 1.69 | 1.00 | 1.89 |
| f_Caldilineaceae | - | 1.27 | 1.41 | 1.27 | 0.27 | 2.63 |
| f_Planctomycetaceae | - | 1.79 | 1.21 | 1.51 | 0.75 | 1.44 |
| Denitratisoma | Denitrification | 1.28 | 0.48 | 3.25 | 1.30 | 0.13 |
| f_Xanthomonadaceae | Denitrification | 3.58 | 1.19 | 0.49 | 0.16 | 0.69 |
| Dechloromonas | Denitrifying phosphorus removal | 1.05 | 0.98 | 0.03 | 3.65 | 0.36 |
| c_Ardenticatenia | Denitrification, Iron reduction | 0.74 | 0.57 | 4.07 | 0.09 | 0.39 |
| Planctomyces | - | 1.25 | 1.15 | 2.14 | 0.40 | 0.85 |
| Sulfuritalea | Denitrification | 0.51 | 0.13 | 0.30 | 2.00 | 2.82 |
| f_NS9_marine_group | - | 0.90 | 3.44 | 0.51 | 0.22 | 0.31 |
| 注:-:该菌属目前尚未有明确功能注释. Note: -: No clear functional annotation for these genera. | ||||||
在DXH、NG和HS厂污泥中,丰度最高的菌属均为厌氧绳菌科(Anaerolineaceae),占比分别为6.13%、7.47%和9.39%。Anaerolineaceae作为绿弯菌门的代表菌科,有研究表明其在中温和高温的UASB反应器中广泛分布[19]。它不仅具有反硝化的功能,同时还有降解碳水化合物和其他细胞材料(如氨基酸)的作用[20]。可以推测,Anaerolineaceae是DXH、NG和HS污水厂COD和TN去除最主要的贡献者之一。
SH厂污泥中腐螺旋菌科(Saprospiraceae)是丰度最高的菌种,占比为8.40%。张朝升等[21]的研究表明,Saprospiraceae是以亚硝酸盐为电子受体的反硝化除磷系统中的优势菌种。所谓反硝化除磷即在缺氧条件下,以硝酸盐或亚硝酸盐为电子受体来进行除磷,能够减少同时脱氮除磷所需要的碳源量。而影响反硝化除磷的关键因素之一是污泥停留时间。徐伟锋等[22]的研究表明,延长泥龄,反硝化除磷对A2O系统除磷所起的作用增大,且较长污泥停留时间(12 d和15 d)条件下去除单位氮和磷所需的外碳源较8 d时要低。SH厂在实际运行时污泥停留时间较长,通常为15-18 d,这为反硝化除磷菌的生长提供了有力条件。因此,可以推测在SH厂的缺氧区中很可能存在反硝化除磷现象。
在HJ厂污泥中,乳杆菌属(Lactobacillus)是丰度最高的菌属,占比为15.42%,远大于其他4个污水厂的污泥(0.07%-0.23%)。乳杆菌属是一类化能异养菌,耐酸性,能发酵分解糖代谢,终产物中50%以上是乳酸[23],在污泥处理中有广泛的应用。Picard等[24]利用驯化培养的嗜酸乳杆菌降解生活污水中总悬浮固体,同时对COD和BOD5都有很好的降解效果。Oh等[25]通过向厌氧发酵罐接种乳杆菌属强化初沉污泥水解酸化,溶解性有机物(Soluble chemical oxygen demand,SCOD)增加59%以上,同时产生了醋酸、乳酸、丙酸、丁酸和戊酸等多种有机酸。因此,Lactobacillus细菌有强化污泥水解酸化,起到强化污泥减量的作用。由于河间厂进水中有机物浓度很低,而污泥水解的过程能够产生大量SCOD与挥发性脂肪酸(Volatile fatty acid,VFA),这些物质可以为生物反硝化脱氮、除磷提供优质碳源,有利于TN和TP的去除。但另一方面,污泥过度水解将会导致泥质比较松散、絮凝效果变差,影响工艺的稳定运行。同时,HJ厂污泥中脱氮微生物Thauera丰度远高于其他污水厂,占比为6.63%。Thauera属是β-Proteobacteria纲下的一类革兰氏阴性细菌,大多为杆状且具有反硝化能力,是一类广泛存在于各种类型废水处理装置中并具有多种芳香族污染物降解能力的重要功能类群,该菌能降解大部分的主要有机物,如苯酚、甲基苯酚和吲哚等[26]。
2.4 脱氮细菌丰度5个污水厂污泥中硝化细菌的占比见表 6。从表 6中可以看出,硝化过程中起重要作用的氨氧化菌为亚硝化单胞菌科菌(Nitrosomonadaceae),所占比例为1.12%-4.00%,丰度最高和最低的污泥分别来自DXH和HS厂。硝化过程中起重要作用的亚硝酸盐氧化菌为Nitrospira,所占比例为0.40%-4.94%,丰度最高和最低的污泥分别来自HJ和HS厂。此外,亚硝酸盐氧化菌Nitrobacter也被检测到,所占比例仅为0.16%-1.88%,丰度最高和最低的污泥分别来自HJ和HS厂。5个污水厂中,HS厂污泥中硝化细菌丰度最低,仅为1.62%,远低于其他4个污水厂。从表 1可以看出HS厂进水氨氮浓度非常低,仅为2.96 mg/L,与出水氨氮浓度2.82 mg/L相比基本没有氨氮的去除。HS厂生化系统中硝化反应过程微弱,这与其污泥中硝化细菌丰度很低相符。
| Nitrobacteria | Genera | DXH (%) | SH (%) | NG (%) | HS (%) | HJ (%) |
| Ammonia oxidizing bacteria | Nitrosomonas | 4.00 | 2.35 | 1.27 | 1.12 | 3.69 |
| Nitrite oxidizing bacteria | Nitrobacter | 0.37 | 0.23 | 0.20 | 0.10 | 1.88 |
| Nitrospira | 3.85 | 2.63 | 1.80 | 0.40 | 4.94 |
为了对不同污水厂污泥中反硝化菌的含量进行比较,我们对污泥中反硝化功能基因进行qPCR绝对定量分析。参与反硝化过程的4种还原酶分别为:硝酸还原酶、亚硝酸还原酶、NO还原酶和N2O还原酶。亚硝酸盐还原酶(Nitrite reductase,Nir)是反硝化作用有别于其他硝酸盐代谢的标志性反应,它催化亚硝酸盐转化为氧化氮的过程。该反应是反硝化过程中最重要的限速步骤,亚硝酸盐还原酶(Nir)是催化此反应的限速酶,因此Nir基因也常被作为反硝化菌的分子标记[27]。Nir分布于细胞膜外周质中,有2种类型:一种是Cu型亚硝酸盐还原酶,由nirK基因编码;另一种是Cyt cd1型亚硝酸盐还原酶,由nirS编码[28]。本研究对5污水厂污泥中的nirK和nirS基因进了qPCR绝对定量分析,结果如表 7所示。从表 7中可以看出,5个污水厂污泥样品中HJ厂污泥中的nirK和nirS基因合计拷贝数最多,为2.74E+06 copies/μL DNA,表明其中反硝化菌丰度最高;HS厂污泥中的nirK和nirS基因合计拷贝数最少,仅为6.32E+04 copies/μL DNA,表明其中反硝化菌丰度最低。同时我们还发现,除了HJ厂污泥中nirK基因拷贝数大于nirS基因,其他4个污水厂污泥中均是nirS基因拷贝数大于nirK基因。这表明本次研究的京津冀区域污水厂污泥中nirS是比nirK分布更加广泛的亚硝酸盐还原酶编码基因。
| Gene symbol | DXH | SH | NG | HS | HJ |
| nirK | 1.71E+05 | 8.63E+05 | 2.71E+05 | 1.81E+04 | 2.25E+06 |
| nirS | 2.91E+05 | 1.21E+06 | 6.45E+05 | 4.51E+04 | 4.85E+05 |
| nirK+nirS | 4.62E+05 | 2.07E+06 | 9.16E+05 | 6.32E+04 | 2.74E+06 |
| nirS/nirK | 1.70 | 1.40 | 2.38 | 2.49 | 0.22 |
(1) 5个污水厂的活性污泥中,HS厂的微生物多样性最高且检测到独有OTU最多,其次是SH、NG和DXH厂,而HJ厂的微生物多样性最低。
(2) HS厂活性污泥中的种群结构受温度的影响最大,SH、DXH、NG厂的种群结构受总氮、总磷和氨氮的共同影响,且氨氮对SH厂活性污泥影响最大。HJ厂污泥最为特殊,温度、总氮、总磷和氨氮均未对其群落结构产生影响。
(3) DXH、NG和HS厂活性污泥中的优势菌均为Anaerolineaceae,而SH厂和HJ厂的优势菌则分别为Saprospiraceae与Lactobacillus。
(4) 5个污水厂活性污泥中反硝化菌丰度最高的为HJ厂而丰度最低的为HS厂,且本次研究的污水厂污泥中nirS是比nirK分布更加广泛的亚硝酸盐还原酶编码基因。
| [1] |
Xia Y, Wen XH, Zhang B, et al. Diversity and assembly patterns of activated sludge microbial communities: a review[J]. Biotechnology Advances, 2018, 36(4): 1038-1047. DOI:10.1016/j.biotechadv.2018.03.005 |
| [2] |
Ju F, Guo F, Ye L, et al. Metagenomic analysis on seasonal microbial variations of activated sludge from a full-scale wastewater treatment plant over 4 years[J]. Environmental Microbiology Reports, 2014, 6(1): 80-89. DOI:10.1111/1758-2229.12110 |
| [3] |
Ge H, Batstone DJ, Mouiche M, et al. Nutrient removal and energy recovery from high-rate activated sludge processes - impact of sludge age[J]. Bioresource Technology, 2017, 245: 1155-1161. DOI:10.1016/j.biortech.2017.08.115 |
| [4] |
Zhang YY, Kuroda M, Arai S, et al. Biological treatment of selenate-containing saline wastewater by activated sludge under oxygen-limiting conditions[J]. Water Research, 2019, 154: 327-335. DOI:10.1016/j.watres.2019.01.059 |
| [5] |
Wang CX, Liu CJ, Zheng LX, et al. Study on denitrifying bacteria in anaerobic ammonium-oxidation coupled with denitrification system[J]. China Water & Wastewater, 2015, 31(13): 19-22. (in Chinese) 王春香, 刘常敬, 郑林雪, 等. 厌氧氨氧化耦合脱氮系统中反硝化微生物研究[J]. 中国给水排水, 2015, 31(13): 19-22. |
| [6] |
Gonzalez-Silva BM, Rønning AJ, Andreassen IK, et al. Changes in the microbial community of an anammox consortium during adaptation to marine conditions revealed by 454 pyrosequencing[J]. Applied Microbiology and Biotechnology, 2017, 101(12): 5149-5162. DOI:10.1007/s00253-017-8160-5 |
| [7] |
Yin XW, Tian W, Ding Y, et al. Composition and predictive functional analysis of bacterial communities in surface sediments of the Danjiangkou Reservoir[J]. Journal of Lake Sciences, 2018, 30(4): 1052-1063. (in Chinese) 阴星望, 田伟, 丁一, 等. 丹江口库区表层沉积物细菌多样性及功能预测分析[J]. 湖泊科学, 2018, 30(4): 1052-1063. |
| [8] |
Dai YT, Yan ZJ, Xie JH, et al. Soil bacteria diversity in Rhizosphere under two types of vegetation restoration based on high throughput sequencing[J]. Acta Pedologica Sinica, 2017, 54(3): 735-748. (in Chinese) 戴雅婷, 闫志坚, 解继红, 等. 基于高通量测序的两种植被恢复类型根际土壤细菌多样性研究[J]. 土壤学报, 2017, 54(3): 735-748. |
| [9] |
Seib MD, Berg KJ, Zitomer DH. Influent wastewater microbiota and temperature influence anaerobic membrane bioreactor microbial community[J]. Bioresource Technology, 2016, 216: 446-452. DOI:10.1016/j.biortech.2016.05.098 |
| [10] |
Metch JW, Wang H, Ma YJ, et al. Insights gained into activated sludge nitrification through structural and functional profiling of microbial community response to starvation stress[J]. Environmental Science: Water Research & Technology, 2019, 5(5): 884-896. |
| [11] |
Yang QX, Zhao HL, Du BB. Bacteria and bacteriophage communities in bulking and non-bulking activated sludge in full-scale municipal wastewater treatment systems[J]. Biochemical Engineering Journal, 2017, 119: 101-111. DOI:10.1016/j.bej.2016.12.017 |
| [12] |
Zhao Y, Xu YX, Bu XG, et al. Assessment of nitrogen reduction potentials by improved sanitation in Beijing-Tianjin-Hebei region[J]. Environmental Pollution and Control, 2019, 41(5): 615-620. (in Chinese) 赵越, 续衍雪, 卜晓鸽, 等. 京津冀地区基础卫生处理设施提升产生的氮素入水削减评估[J]. 环境污染与防治, 2019, 41(5): 615-620. |
| [13] |
Du CY, Yu JJ. Issues on the sustainable development of Beijing-Tianjin-Hebei region based on the limited water resources[J]. South-to-North Water Transfers and Water Science & Technology, 2018, 16(4): 17-25. (in Chinese) 杜朝阳, 于静洁. 京津冀地区适水发展问题与战略对策[J]. 南水北调与水利科技, 2018, 16(4): 17-25. |
| [14] |
Zhang HH, Feng J, Chen SN, et al. Geographical patterns of nirS gene abundance and nirS-type denitrifying bacterial community associated with activated sludge from different wastewater treatment plants[J]. Microbial Ecology, 2019, 77(2): 304-316. DOI:10.1007/s00248-018-1236-7 |
| [15] |
Zehr JP, Kudela RM. Nitrogen cycle of the open ocean: from genes to ecosystems[J]. Annual Review of Marine Science, 2011, 3: 197-225. DOI:10.1146/annurev-marine-120709-142819 |
| [16] |
Gao CC, Zheng XC, You J, et al. Structure characteristics of activated sludge microbial communities in nitrogen and phosphorus removal system of municipal wastewater[J]. China Water & Wastewater, 2015, 31(23): 37-42. (in Chinese) 高晨晨, 郑兴灿, 游佳, 等. 城市污水脱氮除磷系统的活性污泥菌群结构特征[J]. 中国给水排水, 2015, 31(23): 37-42. |
| [17] |
Zhang SH, Huang ZJ, Lu SJ, et al. Nutrients removal and bacterial community structure for low C/N municipal wastewater using a modified anaerobic/anoxic/oxic (mA2/O) process in North China[J]. Bioresource Technology, 2017, 243: 975-985. DOI:10.1016/j.biortech.2017.07.048 |
| [18] |
Ma SJ, Gu ZJ, Ding LL, et al. Effects of carbon sources on cell membrane properties and microbial community of activated sludge[J]. Microbiology China, 2017, 44(3): 561-573. (in Chinese) 马思佳, 顾卓江, 丁丽丽, 等. 碳源对活性污泥微生物细胞膜特性和群落结构影响[J]. 微生物学通报, 2017, 44(3): 561-573. |
| [19] |
Yamada T, Sekiguchi Y, Imachi H, et al. Diversity, localization, and physiological properties of filamentous microbes belonging to Chloroflexi subphylum I in mesophilic and thermophilic methanogenic sludge granules[J]. Applied and Environmental Microbiology, 2005, 71(11): 7493-7503. DOI:10.1128/AEM.71.11.7493-7503.2005 |
| [20] |
Li LL. Nitrogen removal pathways and microbial diversity in a Hybrid Constructed Wetland[D]. Chongqing: Master's Thesis of Chongqing University, 2015 (in Chinese) 李玲丽.复合人工湿地脱氮途径及微生物多样性研究[D].重庆: 重庆大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10611-1015970002.htm |
| [21] |
Zhang CS, Zhang KF, Tang JH, et al. Study on microbial community structure during the cultivated process for short-cut denitrifying dephosphatation[J]. Water & Wastewater Engineering, 2013, 39(1): 138-141. (in Chinese) 张朝升, 张可方, 唐家桓, 等. 短程反硝化除磷工艺培养过程的群落结构分析[J]. 给水排水, 2013, 39(1): 138-141. DOI:10.3969/j.issn.1002-8471.2013.01.033 |
| [22] |
Xu WF, Chen YG, Zhang F, et al. Effect of SRT on denitrifying phosphorus removal in A/A/O process[J]. Environmental Science, 2007, 28(8): 1693-1696. (in Chinese) 徐伟锋, 陈银广, 张芳, 等. 污泥龄对A/A/O工艺反硝化除磷的影响[J]. 环境科学, 2007, 28(8): 1693-1696. DOI:10.3321/j.issn:0250-3301.2007.08.008 |
| [23] |
Zhang YX, Vadlani PV. Lactic acid production from biomass-derived sugars via co-fermentation of Lactobacillus brevis and Lactobacillus plantarum[J]. Journal of Bioscience and Bioengineering, 2015, 119(6): 694-699. DOI:10.1016/j.jbiosc.2014.10.027 |
| [24] |
Picard C, Fischer A. Contribution of high-throughput DNA sequencing to the study of primary immunodeficiencies[J]. European Journal of Immunology, 2014, 44(10): 2854-2861. DOI:10.1002/eji.201444669 |
| [25] |
Oh MH, Lee SM, Hong SH, et al. Monitoring of Lactobacillus sp. inoculated in the reactor to evaluate the solubilization efficiency of primary sludge[J]. International Biodeterioration & Biodegradation, 2013, 85: 603-607. |
| [26] |
Zheng LX, Li J, Hu JW, et al. Analysis of denitrifying bacteria community composition in simultaneous nitrification and denitrification systems[J]. China Environmental Science, 2015, 35(1): 116-121. (in Chinese) 郑林雪, 李军, 胡家玮, 等. 同步硝化反硝化系统中反硝化细菌多样性研究[J]. 中国环境科学, 2015, 35(1): 116-121. |
| [27] |
Rösch C, Mergel A, Bothe H. Biodiversity of denitrifying and dinitrogen-fixing bacteria in an acid forest soil[J]. Applied and Environmental Microbiology, 2002, 68(8): 3818-3829. DOI:10.1128/AEM.68.8.3818-3829.2002 |
| [28] |
Guo LY, Shi F, Yang LY, et al. Advances in functional genes and molecular ecology in denitrifiers[J]. Microbiology China, 2011, 38(4): 583-590. (in Chinese) 郭丽芸, 时飞, 杨柳燕, 等. 反硝化菌功能基因及其分子生态学研究进展[J]. 微生物学通报, 2011, 38(4): 583-590. |
 2019, Vol. 46
2019, Vol. 46