扩展功能
文章信息
- 王晓丽, 孙蕾, 刘文军, 商营利
- WANG Xiao-Li, SUN Lei, LIU Wen-Jun, SHANG Ying-Li
- 非洲猪瘟病毒编码蛋白功能研究进展
- Advances in the functions of African swine fever virus-encoded proteins
- 微生物学通报, 2019, 46(7): 1827-1836
- Microbiology China, 2019, 46(7): 1827-1836
- DOI: 10.13344/j.microbiol.china.190023
-
文章历史
- 收稿日期: 2019-01-06
- 接受日期: 2019-04-28
- 网络首发日期: 2019-05-14
2. 中国科学院病原微生物与免疫学重点实验室 中国科学院微生物研究所 北京 100101
2. CAS Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染猪引起的一种急性、热性、高度接触性传染病,病程短,发病率和死亡率高。ASF于1921年首发于非洲肯尼亚并蔓延至非洲多个地区;1957年传到欧洲的葡萄牙;1971年由西欧传入南美洲的古巴,随后南美洲国家陆续暴发疫情;2007年传入欧亚接壤的高加索地区,2017年传播至俄罗斯远东地区[1]。2018年8月,我国在辽宁省沈阳市发现首例非洲猪瘟病例[2],随后迅速蔓延至全国23个省份,给养猪业造成严重的经济损失[1-2]。ASFV是非洲猪瘟病毒科非洲猪瘟病毒属的唯一成员,也是目前已知的唯一的DNA虫媒病毒。ASFV的基因组约170-193 kb,含有150-167个开放阅读框(Open reading frames,ORFs),编码150-200种蛋白质,其中约50多种是病毒的结构蛋白。同时ASFV基因组还编码DNA复制、基因转录和RNA修饰酶类,以及调节宿主细胞功能和参与病毒免疫逃逸的相关蛋白[3-5]。然而,目前仍有约一半以上的ASFV基因编码的蛋白功能尚不清楚。本文就ASFV主要结构蛋白、非结构蛋白以及参与免疫逃逸等相关蛋白功能的最新研究进展进行综述。
1 ASFV主要结构蛋白 1.1 囊膜蛋白ASFV病毒粒子为二十面体结构,直径约200 nm,是由核壳蛋白包裹的病毒基因组DNA、病毒内囊膜、病毒衣壳和外囊膜组成的。囊膜蛋白是构成病毒颗粒的主要结构蛋白,也是重要的表面抗原,与宿主细胞嗜性、致病性与免疫原性密切相关。已知功能的ASFV囊膜蛋白主要有CD2v、p54、p12、p30、p17和p22等[6]。
CD2v是ASFV外膜蛋白中唯一特征性病毒蛋白[6],由ORF EP402R基因编码,也称为pEP402R,蛋白大小约45.3 kD。该蛋白类似于T淋巴细胞表面粘附受体CD2,是由信号肽、跨膜区和两个免疫球蛋白样结构域组装而成的糖蛋白。由于猪红细胞表面具有CD2配体,因此ASFV能够非常容易地吸附到红细胞上。从病毒基因组中删除EP402R基因并不影响病毒感染猪引起的死亡率,但能够延迟病毒血症的发生和病毒向组织的传播,ASFV感染细胞所致的红细胞吸附现象基本消失,表明CD2v介导红细胞吸附有助于病毒在宿主体内的扩散[7]。另外,CD2v胞质结构域一个显著特征是存在数目可变的富含脯氨酸重复序列,且不同分离株之间长度不同。已有研究发现,在ASFV感染的细胞中,该重复序列能够与肌动蛋白衔接蛋白SH3P7相互作用,共定位于核周病毒工厂周围区域,参与细胞囊泡转运和信号转导等[8]。目前对于此串联重复序列变异的生物学意义尚不十分清楚,有研究发现EP402R基因的串联重复序列数量在不同毒株之间差异显著,提示这种遗传差异性可以作为一种新的遗传标记[9],用于分析来自不同地区的ASFV毒株和建立基于CD2v蛋白胞外区的毒株的血清群分类,从而跟踪病毒传播[10]。CD2v具有良好的免疫原性,可以用于ASFV亚单位疫苗研发的抗原蛋白[11]。研究表明,人工缺失CD2v的BA71ΔCD2株能产生针对亲本病毒和异源病毒的交叉免疫保护,且能产生特异性CD8+T淋巴细胞,进一步证实了CD2v具有抑制淋巴细胞增殖的功能,为研制具有交叉免疫保护效果的疫苗提供了新的思路[12]。
p54是ASFV表达的早期膜蛋白,由ORF E183L基因编码,蛋白大小约19.9 kD。p54蛋白含跨膜结构域,定位于内质网衍生的内膜前体,在病毒吸附易感细胞和入侵过程中发挥重要作用[13-15]。研究发现,ASFV结构蛋白p54过表达可以促进细胞凋亡。深入研究表明p54能与胞质动力蛋白轻链LC8特异性相互作用,实现病毒在胞质内的转运。p54与LC8相互作用的结构域含有一个13个氨基酸残基序列,该序列与促凋亡蛋白Bim具有一定的相似性。当ASFV感染后,p54-LC8复合物能够利用该序列结合抗凋亡蛋白Bcl-2,进而消除Bcl-2对细胞凋亡的抑制作用,导致Caspase-9、Caspase-3活化,介导细胞凋亡[16]。这是ASFV编码蛋白中首次被证实能诱导细胞凋亡的蛋白。另外,有研究表明p54具有免疫原性,能够刺激机体产生针对该蛋白的抗体[17-18],可能是理想的ASFV亚单位疫苗抗原。
p12是ASFV感染晚期表达的膜蛋白,由ORF O61R基因编码,蛋白大小为6.7 kD,位于病毒内囊膜[19]。纯化的p12能抑制ASFV与易感细胞特异性结合,表明p12和ASFV病毒颗粒都识别Vero细胞中的相同受体,p12介导ASFV病毒颗粒与易感细胞的附着,但其作为附着蛋白的作用机制仍有待进一步研究[15]。另外,利用HEK293细胞表达p12蛋白,纯化后免疫猪能产生针对p12的特异性抗体,表明p12具有一定的免疫原性[11]。
p30是ASFV表达的早期膜蛋白,由ORF CP204L基因编码,蛋白大小为23.6 kD,通常在感染后2-4 h产生,在整个感染期间持续表达,与病毒入侵宿主细胞有关[20],p30是ASFV重要的结构蛋白。目前p30被广泛用于ASFV血清学检测,基于重组蛋白p30的ELISA及免疫印迹法可以准确检测ASFV抗体,具有极高的特异性和灵敏性[21-22]。基于p30的DNA疫苗能够刺激机体产生体液免疫和细胞免疫,表明p30是重要的抗原蛋白,可用于ASF疫苗研制[17, 23]。
p17是ASFV表达的晚期膜蛋白,由ORF D117L基因编码,蛋白大小为13.1 kD,位于病毒内膜的跨膜蛋白[6]。与早期膜蛋白p54一样,p17是病毒前体膜形成二十面体过程中所必需的中间体,而且对于病毒活力至关重要[7]。当p17表达受抑制时,pp220和pp62的蛋白水解加工被阻断,pp220和pp62不能被切割成成熟的病毒蛋白,不能组装到含DNA的类核核芯壳中,导致病毒组装成核芯缺陷的二十面体颗粒[24]。
除以上主要蛋白以外,还有许多病毒蛋白包括p22 (pKP117R)、pE248R、pE199L以及pH108R等均位于病毒内囊膜上,其中pE248R和pE199L与病毒的入侵有关[6]。
1.2 衣壳蛋白病毒衣壳能保护病毒核酸免受环境中核酸酶或其他理化因素破坏,同时参与病毒的感染过程且具有良好的免疫原性,诱发机体的体液免疫和细胞免疫,这些免疫应答不仅有免疫防御作用,而且可引起免疫病理损伤,与病毒本身的致病性有关。ASFV编码的衣壳蛋白目前已知的有p72、p49 (pB438L)和p14.5 (pE120R)。
p72产生于病毒感染晚期,由ORF B646L基因编码,蛋白大小为73.2 kD。p72作为ASFV的重要抗原蛋白,是病毒二十面体的主要成分,对于病毒衣壳的形成至关重要[19]。在病毒组装过程中,p72从细胞质转移到内质网衍生内膜面上,当细胞质处于还原态内环境时,p72与特定病毒伴侣分子CAP80相互作用并进行折叠。伴随着病毒的成熟,p72抗氧化能力增强[15],这可能为病毒从细胞中释放做准备。p72蛋白序列高度保守,并具有良好的抗原性。除可利用p72的单克隆抗体对病毒进行血清学检测外[25],利用反向遗传操作构建表达ASFV p72的重组新城疫病毒(rNDV-p72)免疫小鼠后,能够产生较高滴度的p72特异性IgG抗体,还引发T细胞增殖和IFN-γ、IL-4等细胞因子的分泌[26]。
p49也称为pB438L,由ORF B438L基因编码,该蛋白没有疏水区,可能通过与病毒内膜上的蛋白相互作用结合到病毒的内膜上,表现为完整的膜蛋白。当缺乏p49时病毒所形成的病毒颗粒虽具有管状结构,但二十面体对称性丧失,通过免疫电镜对完整的病毒体或病毒颗粒进行观察,发现p49位于衣壳顶点附近,表明该蛋白在构建或稳定病毒颗粒的二十面体顶点过程中起重要作用[6]。
p14.5也称为pE120R,表达于ASFV感染晚期,由ORF E120R基因编码,蛋白分子位于病毒工厂中。p14.5与p72共同组成病毒颗粒的衣壳,在ASFV扩散时发挥重要作用。在病毒感染期间,p14.5的N-末端丙氨酸残基会被乙酰化,可能与ASFV生命周期有关[7, 27]。
1.3 核壳蛋白ASFV核衣壳形成于病毒的内膜下方,随后病毒DNA和核蛋白被包装并浓缩形成类核。在已知的110个ASFV高度保守的ORFs中,ORF CP2475L和CP530R分别编码多聚蛋白前体pp220和pp62,它们可以被蛋白酶水解切割成成熟的病毒蛋白,共同组装到含DNA的类核的核芯壳中[6-7]。
多聚蛋白pp220是一个N-豆蔻酰化的前体多肽,其肉豆蔻酰基部分可以起到膜锚定信号的作用,可以将发育中的核芯壳结合到病毒内部囊膜上,可作为内部核质体和核外层之间的蛋白质支架,促发空壳体的装配,因此pp220是核芯组装的必需成分[23]。pp220在SUMO1样蛋白酶水解加工后产生主要结构蛋白包括p150、p37、p34、p14及最近鉴定的p5等[6]。pp62是病毒DNA复制的晚期表达蛋白,在病毒复制、病毒颗粒核芯的正确组装和成熟过程中发挥重要作用,抑制pp62表达则会导致出现大部分空的病毒粒子[28]。pp62可以被S273R蛋白酶水解切割成成熟的病毒体蛋白p35、p15及最近鉴定的p8,其中p5和p8均为ASFV病毒颗粒的结构组分,它们随其他多聚蛋白成熟产物共同被包装到核芯中[6]。多聚蛋白的加工过程与病毒组装同时发生,pp220和pp62的加工依赖于主要衣壳蛋白p72的表达,而pp62的加工则需要pp220前体的表达,表明两种多聚蛋白前体彼此相互作用有利于形成核壳样病毒结构域[29]。
1.4 DNA结合蛋白ASFV病毒基因组被蛋白包裹形成病毒的类核。免疫电镜显示两种DNA结合蛋白p10 (pK78R)和pA104R均位于成熟的病毒粒子的类核中,可能在病毒类核的组装过程发挥作用[6]。其中pA104R是一个类组蛋白的蛋白,可能参与病毒的转录、DNA复制及基因组包装等过程[30]。
2 ASFV编码的复制酶和修饰酶除主要结构蛋白外,ASFV病毒颗粒内还含有多种转录因子和修饰酶类。目前认为,约20%的ASFV基因组用来编码参与其mRNA转录和修饰的酶及因子,这种转录机制使ASFV相对于宿主细胞具有显著的独立性,可以使病毒自身的基因在准确时间和位置表达。目前已知的可能参与ASFV mRNA合成的RNA聚合酶亚基主要有pNP1450L (RP1)、pEP1242L (RP2)、pH359L (RP3)、pD205R (RP5)、pC147L (RP6)和pD339L (RP7)等。此外,还有mRNA修饰酶如加帽酶pNP868R、甲基转移酶pEP424R和多聚腺苷聚合酶pC475L等。另外,转录因子pG1340L和解旋酶pD1133L,以及含解旋酶结构域的pB962L和pQ706L也可能参与病毒转录的起始和终止[6]。ASFV病毒颗粒中还含有碱基切除修复系统,包括Ⅱ类脱嘌呤/脱嘧啶核酸内切酶pE296R、DNA连接酶pNP419L和DNA X型聚合酶pO174L等。这些酶类可以纠正宿主巨噬细胞强氧化环境中诱导的DNA损伤,以确保病毒基因组的完整性[31-32]。病毒dUTP酶pE165R确保基因组复制高度保真的酶,可以在低dUTP浓度下减少脱氧尿苷错误掺入到病毒DNA的几率。除此之外,DNA B型聚合酶pG1207R、DNA引物酶pC962R和DNA Ⅱ型拓扑异构酶p1192R等均与病毒DNA复制有关[6]。
3 ASFV非结构蛋白及免疫逃逸相关蛋白ASFV主要通过网格蛋白介导的内吞作用或巨胞饮作用感染猪单核-巨噬细胞等免疫细胞[33]。为了适应宿主细胞,ASFV编码蛋白通过多种方式抑制宿主细胞的免疫系统和抗病毒系统,调控细胞的转录,抑制宿主细胞的蛋白质合成,调节细胞凋亡,从而为病毒自身在感染宿主细胞内的繁殖及扩散创造最有利的条件[34-35]。
ASFV编码的多个多基因家族蛋白,包括MGF100、MGF110、MGF300、MGF360和MGF505/530等,其中MGF360和MGF505/530决定了ASFV的细胞嗜性,与病毒在巨噬细胞内的复制密切相关,是ASFV的毒力决定因素[36-37]。另外,MGF360和MGF505/530还参与抑制宿主干扰素(Interferons,IFN)的产生和调控促炎性细胞因子表达,并通过延长感染细胞的存活时间来提高病毒在宿主细胞内的增殖效率和数量[38]。如MGF360家族成员pA276R通过抑制干扰素调节因子IRF3的磷酸化来抑制Poly(I:C)刺激的IFN-β的产生,而对核转录因子NF-κB的活化和IFN诱导的JAK-STAT信号通路没有影响。同样地,MGF505家族成员pA528R能抑制Poly(I:C)诱导的IRF3和NF-κB的活性来抑制IFN表达。与pA276R不同,pA528R能明显抑制IFN-β和IFN-γ诱导ISRE或GAS的启动子活性,表明pA528R也能抑制IFN诱导的JAK-STAT信号通路[39]。MGF110家族成员pDP148R为ASFV表达的早期蛋白,该蛋白免疫猪后能诱导针对同源病毒的攻毒保护,推测pDP148R可能在病毒逃逸宿主防御中发挥作用[40-41]。
除多基因家族蛋白外,ASFV编码的其他蛋白也能抑制I型IFN产生而进行免疫逃逸。最新的研究表明,ASFV中国株pDP96R可以通过抑制TBK1和IKK β活化而抑制cGAS/STING介导的I型干扰素表达和NF-κB活化,表明pDP96R是ASFV的一个重要免疫抑制蛋白[42]。pI329L是由ORF I329L基因编码的序列相对保守、高度糖基化的I型跨膜蛋白,是病毒感染晚期表达的蛋白,主要分布于感染细胞的细胞膜及病毒囊膜表面[43]。pI329L为Toll样受体(Toll-like receptors,TLRs)蛋白家族同源蛋白,其胞外区结构域富含亮氨酸的重复序列,是蛋白质之间相互作用的重要基序。研究发现,pI329L可以抑制TLR下游的重要接头蛋白TRIF的活性,进而阻断IRF3和NF-κB的活化以及下游基因的转录,从而拮抗TLR3介导的信号通路活化和抑制IFN产生[39, 43]。
病毒感染后过早的细胞凋亡不利于病毒自身的繁殖与扩散,因而ASFV会编码一些蛋白抑制宿主细胞过早凋亡,如pA224L、pA179L、pEP153R等。在病毒感染早期,pA238L对NF-κB信号通路产生抑制作用,而随着感染进程的推进,ASFV感染细胞晚期表达的凋亡抑制蛋白pA224L能够激活NF-κB信号通路,通过抑制细胞凋亡促进ASFV感染细胞的存活[16]。pA179L是基因序列高度保守的Bcl-2家族成员,在病毒感染的早期和晚期均有表达,主要定位于线粒体或内质网,能通过与Beclin-1相互作用调节细胞自噬,并抑制自噬体的形成[44]。另外,pA179L在多种细胞中表达后或与促凋亡蛋白家族的蛋白相互作用后均能抑制细胞凋亡[16, 45]。pEP153R又称为C型凝集素蛋白,在病毒感染的早期和晚期均有表达,是一个多功能蛋白,能够抑制细胞凋亡,降低细胞MHC-I表达,且参与ASFV感染细胞后的血细胞吸附过程。在Vero或Cos细胞中,pEP153R能作用于转录因子p53并将其积聚到细胞核中,从而使其活性被部分抑制,最终抑制病毒感染诱导的细胞凋亡[16, 46]。另外,pEP153R还能介导特异性血清学反应并诱导同源毒株免疫保护[10],提示pEP153R是重要的保护性抗原。最近鉴定的pEP153R的T淋巴细胞表位为开发pEP153R亚单位疫苗奠定了基础[47]。
除以上蛋白外,ASFV基因组还编码一些其他蛋白可能参与调节宿主细胞功能及病毒免疫逃逸。如ASFV表达A238L能够抑制宿主细胞核转录因子NF-kB和NFAT的活化[39],从而调节宿主基因表达;而ASFV pDP71L则能促进翻译起始因子eIF2a磷酸化,使细胞不能关闭蛋白合成,从而促进病毒在细胞内的大量复制[16, 48]。
4 总结及展望ASFV复制主要在巨噬细胞内进行,是一个高度受调控的过程。早期感染阶段,ASFV通过巨胞饮、网格蛋白小窝或粘附于红细胞进入巨噬细胞后,通过微管被导向细胞核周围,随后进入细胞核启动病毒复制,开始表达早期基因并在核周边形成病毒工厂,最终进行高效病毒复制。在病毒感染晚期,病毒DNA、膜组分和结构蛋白以及某些宿主蛋白被波形蛋白和线粒体包裹,同时病毒RNA也被招募至病毒工厂,最后包装完整的病毒子沿微管被运送至细胞膜并通过出芽释放到细胞外[49]。ASFV的基因组编码多种结构和非结构蛋白,其中构成病毒的结构蛋白分布在病毒粒子的不同结构区域(图 1)。病毒编码的结构和非结构蛋白在病毒感染周期的各个阶段中发挥不同的作用,并参与调控宿主免疫系统和病毒的免疫逃逸,为病毒自身的增殖及扩散创造条件(表 1)。近年来,随着对ASFV编码蛋白鉴定和蛋白功能的深入研究,人们对ASFV与宿主相互作用机制有了更清晰的认识。但ASFV基因组结构庞大,编码蛋白中已知功能的数量相对较少,深入研究ASFV编码蛋白的功能将有助于全面了解ASFV致病机理。最近Alejo等对ASFV细胞适应株(BA71V株)的病毒颗粒进行的蛋白质组学分析检测到了68种病毒组成蛋白,其中有20多种未知功能新鉴定病毒蛋白[6]。
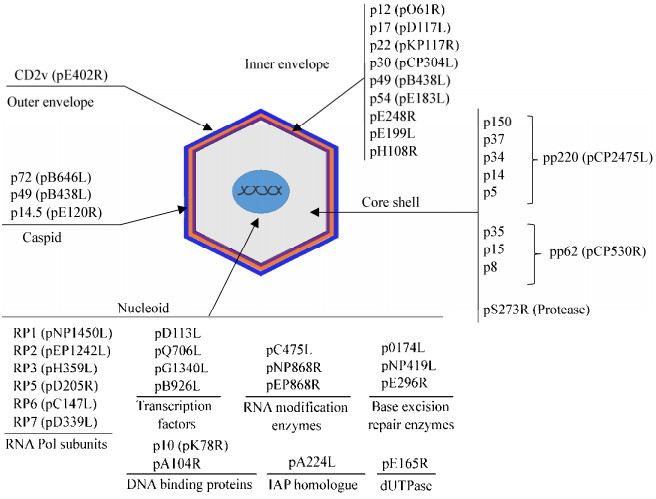
|
| 图 1 非洲猪瘟病毒编码结构蛋白分布示意图 Figure 1 Distribution of ASFV-encoded proteins 注:ASFV病毒粒子从内至外由类核、核壳、内囊膜、衣壳和外囊膜5个结构组成,病毒编码蛋白分布在病毒结构的不同区域. Note: Five structure domains of ASFV particle including nucleoid, core shell, inner envelope, capsid and outer envelope are shown as above and the subviral localization of viral proteins were marked in the five structure domains. |
|
|
| 病毒蛋白 Viral protein |
开放阅读框 Open reading frame |
描述及功能 Description and function |
| CD2v | EP402R | 类CD2蛋白,主要外膜蛋白和重要抗原蛋白,介导病毒吸附[8],病毒血清型鉴定标志蛋白[9-10] Similar to host CD2, major outer membrane protein and antigen protein, required for viral particles to bind to red blood cells[8], genetic marker for identification of different ASFV strains[9-10] |
| p54 | E183L | 跨膜蛋白,招募病毒囊膜前提蛋白至病毒工厂,与动力蛋白轻链相互作用,参与病毒侵入[15],诱导细胞凋亡[16] Transmembrane protein, recruits envelope precursors to the viral factory, interacts with light chain of dynein, contributes to virus entry[15] and induces apoptosis[16] |
| p12 | O61R | 有免疫原性[11],促进病毒粘附至宿主细胞[15] Antigen protein[11], participates in virus adhesion to host cells[15] |
| p30 (p32) | CP204L | 主要的内膜蛋白,重要抗原蛋白,参与病毒侵入[15, 20] Major inner membrane protein and key antigen protein, contributes to virus entry[15, 20] |
| p17 | D117L | 促进病毒的十二面体颗粒形成[7, 24] Requirement for precursor membranes to form viral icosahedral particles[7, 24] |
| p72 | B646L | 主要衣壳蛋白,免疫原性好,参与病毒侵入[15] Major capsid protein with good immunogenicity, contributes to virus entry[15] |
| p14.5 | E120R | 与病毒生命周期有关[7],参与病毒迁移扩散[27] Related to viral life cycle[7] and required for virus migration to plasma membrane[27] |
| p49 | B438L | 促进形成和稳定病毒颗粒十二面体顶点[6] Requirement for formation of vertices in viral icosahedral capsid and stabilizes the vertices[6] |
| pp220 | CP2475L | p150、p37、p34、p14和p5前体蛋白,促进病毒核芯包装[6] Polyprotein precursor of p150, p37, p34, p14, and p5, requirement for packaging of nucleoprotein core[6] |
| pp62 | CP530R | p35、p15和p8前体蛋白[6],校正病毒类核蛋白芯的组装和成熟[28] Polyprotein precursor of p35, p15 and p8[6],corrects assembling and maturation of the nucleoprotein core of the viral particles[28] |
| p10 | K78R | DNA结合蛋白,参与病毒基因组包装[6] DNA binding protein, participates in virus packaging[6] |
| pA104R | A104R | DNA结合蛋白,参与病毒转录、DNA复制及基因组包装[30] DNA binding protein, participates in viral transcription, DNA replication and genome packaging[30] |
| pA276R | MGF360 | 抑制IRF3磷酸化和IFN产生[39] Inhibits phosphorylation of IRF3 and IFN-β production[39] |
| pA528R | MGF505 | 抑制IFN产生和JAK-STAT信号通路活化[42] Inhibits IFN induction and suppresses activation of JAK-STAT signaling pathway[42] |
| pDP148R | DP148R | 与病毒毒力有关[41] Related to virulence of the virus[41] |
| pDP96R | DP96R | 抑制I型IFN表达和NF-κB活化[42] Suppression of type I IFN expression and NF-κB signaling[42] |
| pI329L | I329L | TLR3同源类似物,抑制TLR3诱导的IFN产生[39, 43] TLR3 homologue, inhibits the induction of IFNs[39, 43] |
| pA224L | A224L | 抑制早期感染阶段宿主细胞凋亡[16] Inhibits apoptosis in the early stages of infection[16] |
| PA179L | A179L | 抑制细胞凋亡和自噬[16, 44-45] Inhibits apoptosis and autophagy of infected cells[16, 44-45] |
| pEP153R | EP153R | C型凝集素蛋白,下调MHC-I表达,抑制细胞凋亡,参与吸附血细胞过程[16, 24] C-type lectin protein, decreases expression of MHC-I, inhibits apoptosis and participates in binding red blood cells[16, 24] |
| pA238L | A238L | 抑制核转录因子NFAT和NFCκB活化[39, 50] Inhibits activation of NFAT or NFCκB[39, 50] |
| pDP71L | DP71L | 促进细胞蛋白合成,抑制宿主细胞凋亡[16, 48] Promotes cellular protein synthesis, inhibits apoptosis of host cells[16, 48] |
ASFV的复制主要在巨噬细胞内完成。为了完成复制,ASFV可能通过多种机制来拮抗宿主抗病毒免疫反应,进而实现免疫逃逸。但天然免疫信号活化是一个复杂的多层级调控过程,包括转录及转录后调控、翻译及翻译后修饰及染色体表观修饰等,以及受到其他细胞信号调控[51-52],ASFV编码蛋白是否参与这些多层次的调控有待于进一步研究。除巨噬细胞之外,ASFV也感染树突状细胞(Dendritic cell,DC)[53],但ASFV感染如何影响DC功能尚不清楚。浆样树突状细胞(Plasmacytoid DC,pDC)是宿主响应病毒感染而分泌I型IFNs的主要细胞[54-55],ASFV编码蛋白是否影响pDC中IFNs产生尚无报道。总之,目前对ASFV的研究仍存在巨大的未知领域,特别是病毒的免疫逃逸机制。深入研究ASFV编码蛋白与宿主细胞的相互作用机制,将有助于阐明ASFV的免疫逃逸机制,为研发ASF疫苗提供理论基础。
迄今为止,国际上尚未开发出针对ASF的有效疫苗。研究表明,绝大部分ASF灭活疫苗无保护作用,即使添加新型免疫佐剂后也不能提高灭活疫苗的保护力,这可能与ASFV复杂的免疫逃逸机制和ASFV的成熟方式有关[56-57]。ASFV编码的结构蛋白如CD2v、p72、p54、p30等均具有良好的抗原性。虽然重组p54和p72蛋白免疫能诱导中和抗体产生,但对致死剂量的ASFV感染仅有部分保护作用。同样地,重组CD2v蛋白或表达p54-p30融合蛋白的DNA疫苗仅有30%-50%的免疫保护作用[23, 58-59]。以上研究表明核酸疫苗和亚单位疫苗虽然均能激活宿主体液和细胞免疫应答,但单纯依靠一种或几种蛋白质很难达到免疫预防效果。最新的研究发现,联合应用22种ASFV抗原的DNA疫苗和重组痘病毒疫苗免疫后能够显著降低病毒在血液和淋巴组织中的病毒量,提示多种保护性抗原协同免疫可以提高疫苗的免疫保护水平[59]。与以上结果相似,利用痘病毒、腺病毒、伪狂犬病毒等病毒载体表达ASFV保护性抗原,再通过“鸡尾酒”式混合免疫后,虽然还不能提供完全保护,但能够诱导机体产生强烈体液免疫和细胞免疫反应[60]。另外,通过删除ASFV的毒力基因(如TK、UK、9GL和CD2v)或者免疫逃逸相关基因等构建基因缺失疫苗也是当前ASF疫苗研究的热点[12, 36, 61-63]。已有的研究表明,大部分基因缺失疫苗针对亲本毒株的攻击具有同源保护作用[41-43, 62-63],部分也具有一定的异源保护作用[64]。因此,ASFV基因缺失疫苗免疫保护效果相对较为理想,可能是短期内最有希望研制成功的疫苗。但由于ASF为法定的一类动物传染病,需要高度重视ASFV基因缺失疫苗的生物安全性。考虑到生物安全因素,构建ASFV复制必需基因缺失的突变病毒[31, 65],获得复制缺陷型疫苗可能是未来ASF疫苗研发的重要方向。
| [1] |
Wang T, Sun Y, Luo YZ, et al. Prevention, control and vaccine development of African swine fever: challenges and countermeasures[J]. Chinese Journal of Biotechnology, 2018, 34(12): 1931-1942. (in Chinese) 王涛, 孙元, 罗玉子, 等. 非洲猪瘟防控及疫苗研发:挑战与对策[J]. 生物工程学报, 2018, 34(12): 1931-1942. |
| [2] |
Ge SQ, Li JM, Fan XX, et al. Molecular characterization of African swine fever virus, China, 2018[J]. Emerging Infectious Diseases, 2018, 24(11): 2131-2133. DOI:10.3201/eid2411.181274 |
| [3] |
Reis AL, Netherton C, Dixon LK. Unraveling the armor of a killer: evasion of host defenses by African swine fever virus[J]. Journal of Virology, 2017, 91(6): e02338-16. |
| [4] |
Wang XX, Chen Q, Chen HJ, et al. Research progress on immune evasion proteins of African swine fever virus[J]. Chinese Journal of Virology, 2018, 34(6): 929-935. (in Chinese) 王西西, 陈青, 陈鸿军, 等. 非洲猪瘟病毒免疫逃逸相关蛋白研究进展[J]. 病毒学报, 2018, 34(6): 929-935. |
| [5] |
Galindo I, Alonso C. African swine fever virus: a review[J]. Viruses, 2017, 9(5): E103. DOI:10.3390/v9050103 |
| [6] |
Alejo A, Matamoros T, Guerra M, et al. A proteomic atlas of the African swine fever virus particle[J]. Journal of Virology, 2018, 92(23): e01293-18. |
| [7] |
Jia N, Ou YW, Pejsak Z, et al. Roles of African swine fever virus structural proteins in viral infection[J]. Journal of Veterinary Research, 2017, 61(2): 135-143. DOI:10.1515/jvetres-2017-0017 |
| [8] |
Goatley LC, Dixon LK. Processing and localization of the African swine fever virus CD2v transmembrane protein[J]. Journal of Virology, 2011, 85(7): 3294-3305. DOI:10.1128/JVI.01994-10 |
| [9] |
Sanna G, Giudici SD, Bacciu D, et al. Improved strategy for molecular characterization of African swine fever viruses from Sardinia, based on analysis of p30, CD2v and I73R/I329L variable regions[J]. Transboundary and Emerging Diseases, 2017, 64(4): 1280-1286. DOI:10.1111/tbed.2017.64.issue-4 |
| [10] |
Burmakina G, Malogolovkin A, Tulman ER, et al. African swine fever virus serotype-specific proteins are significant protective antigens for African swine fever[J]. Journal of General Virology, 2016, 97(7): 1670-1675. DOI:10.1099/jgv.0.000490 |
| [11] |
Lopera-Madrid J, Osorio JE, He YQ, et al. Safety and immunogenicity of mammalian cell derived and Modified Vaccinia Ankara vectored African swine fever subunit antigens in swine[J]. Veterinary Immunology and Immunopathology, 2017, 185: 20-33. DOI:10.1016/j.vetimm.2017.01.004 |
| [12] |
Monteagudo PL, Lacasta A, López E, et al. BA71ΔCD2: A new recombinant live attenuated African swine fever virus with cross-protective capabilities[J]. Journal of Virology, 2017, 91(21): e01058-17. |
| [13] |
García-Mayoral MF, Rodríguez-Crespo I, Bruix M. Structural models of DYNLL1 with interacting partners: African swine fever virus protein p54 and postsynaptic scaffolding protein gephyrin[J]. FEBS Letters, 2011, 585(1): 53-57. DOI:10.1016/j.febslet.2010.11.027 |
| [14] |
Sánchez EG, Quintas A, Nogal M, et al. African swine fever virus controls the host transcription and cellular machinery of protein synthesis[J]. Virus Research, 2013, 173(1): 58-75. DOI:10.1016/j.virusres.2012.10.025 |
| [15] |
Sánchez EG, Pérez-Núñez D, Revilla Y. Mechanisms of entry and endosomal pathway of African swine fever virus[J]. Vaccines (Basel), 2017, 5(4): 42. |
| [16] |
Dixon LK, Sánchez-Cordón P, Galindo I, et al. Investigations of pro- and anti-apoptotic factors affecting African swine fever virus replication and pathogenesis[J]. Viruses, 2017, 9(9): 241. DOI:10.3390/v9090241 |
| [17] |
Lacasta A, Ballester M, Monteagudo PL, et al. Expression library immunization can confer protection against lethal challenge with African swine fever virus[J]. Journal of Virology, 2014, 88(22): 13322-13332. DOI:10.1128/JVI.01893-14 |
| [18] |
Argilaguet JM, Pérez-Martín E, López S, et al. BacMam immunization partially protects pigs against sublethal challenge with African swine fever virus[J]. Antiviral Research, 2013, 98(1): 61-65. DOI:10.1016/j.antiviral.2013.02.005 |
| [19] |
Salas ML, Andrés G. African swine fever virus morphogenesis[J]. Virus Research, 2013, 173(1): 29-41. DOI:10.1016/j.virusres.2012.09.016 |
| [20] |
Lithgow P, Takamatsu H, Werling D, et al. Correlation of cell surface marker expression with African swine fever virus infection[J]. Veterinary Microbiology, 2014, 168(2/4): 413-419. |
| [21] |
Cubillos C, Gómez-Sebastian S, Moreno N, et al. African swine fever virus serodiagnosis: a general review with a focus on the analyses of African serum samples[J]. Virus Research, 2013, 173(1): 159-167. DOI:10.1016/j.virusres.2012.10.021 |
| [22] |
Kazakova AS, Imatdinov IR, Dubrovskaya OA, et al. Recombinant protein p30 for serological diagnosis of African swine fever by immunoblotting assay[J]. Transboundary and Emerging Diseases, 2017, 64(5): 1479-1492. DOI:10.1111/tbed.2017.64.issue-5 |
| [23] |
Argilaguet JM, Pérez-Martín E, Nofrarías M, et al. DNA vaccination partially protects against African swine fever virus lethal challenge in the absence of antibodies[J]. PLoS One, 2012, 7(9): e40942. DOI:10.1371/journal.pone.0040942 |
| [24] |
Suárez C, Gutiérrez-Berzal J, Andrés G, et al. African swine fever virus protein p17 is essential for the progression of viral membrane precursors toward icosahedral intermediates[J]. Journal of Virology, 2010, 84(15): 7484-7499. DOI:10.1128/JVI.00600-10 |
| [25] |
Heimerman ME, Murgia MV, Wu P, et al. Linear epitopes in African swine fever virus p72 recognized by monoclonal antibodies prepared against baculovirus-expressed antigen[J]. Journal of Veterinary Diagnostic Investigation, 2018, 30(3): 406-412. DOI:10.1177/1040638717753966 |
| [26] |
Chen XX, Yang JF, Ji YH, et al. Recombinant Newcastle disease virus expressing African swine fever virus protein 72 is safe and immunogenic in mice[J]. Virologica Sinica, 2016, 31(2): 150-159. DOI:10.1007/s12250-015-3692-2 |
| [27] |
Andrés G, García-Escudero R, Viñuela E, et al. African swine fever virus structural protein pE120R is essential for virus transport from assembly sites to plasma membrane but not for infectivity[J]. Journal of Virology, 2001, 75(15): 6758-6768. DOI:10.1128/JVI.75.15.6758-6768.2001 |
| [28] |
Suárez C, Salas ML, Rodríguez JM. African swine fever virus polyprotein pp62 is essential for viral core development[J]. Journal of Virology, 2010, 84(1): 176-187. DOI:10.1128/JVI.01858-09 |
| [29] |
Andrés G, Alejo A, Salas J, et al. African swine fever virus polyproteins pp220 and pp62 assemble into the core shell[J]. Journal of Virology, 2002, 76(24): 12473-12482. DOI:10.1128/JVI.76.24.12473-12482.2002 |
| [30] |
Frouco G, Freitas FB, Coelho J, et al. DNA-binding properties of African swine fever virus pA104R, a histone-like protein involved in viral replication and transcription[J]. Journal of Virology, 2017, 91(12): e02498-16. |
| [31] |
Redrejo-Rodríguez M, Salas ML. Repair of base damage and genome maintenance in the nucleo-cytoplasmic large DNA viruses[J]. Virus Research, 2014, 179: 12-25. DOI:10.1016/j.virusres.2013.10.017 |
| [32] |
Redrejo-Rodríguez M, Rodríguez JM, Suárez C, et al. Involvement of the reparative DNA polymerase pol X of African swine fever virus in the maintenance of viral genome stability in vivo[J]. Journal of Virology, 2013, 87(17): 9780-9787. DOI:10.1128/JVI.01173-13 |
| [33] |
Andrés G. African swine fever virus gets undressed: new insights on the entry pathway[J]. Journal of Virology, 2017, 91(4): e01906-16. |
| [34] |
Portugal R, Leitão A, Martins C. Modulation of type I interferon signaling by African swine fever virus (ASFV) of different virulence L60 and NHV in macrophage host cells[J]. Veterinary Microbiology, 2018, 216: 132-141. DOI:10.1016/j.vetmic.2018.02.008 |
| [35] |
Hoffmann HH, Schneider WM, Rice CM. Interferons and viruses: an evolutionary arms race of molecular interactions[J]. Trends in Immunology, 2015, 36(3): 124-138. DOI:10.1016/j.it.2015.01.004 |
| [36] |
O'Donnell V, Holinka LG, Sanford B, et al. African swine fever virus Georgia isolate harboring deletions of 9GL and MGF360/505 genes is highly attenuated in swine but does not confer protection against parental virus challenge[J]. Virus Research, 2016, 221: 8-14. DOI:10.1016/j.virusres.2016.05.014 |
| [37] |
O'Donnell V, Holinka LG, Gladue DP, et al. African swine fever virus Georgia isolate harboring deletions of MGF360 and MGF505 genes is attenuated in swine and confers protection against challenge with virulent parental virus[J]. Journal of Virology, 2015, 89(11): 6048-6056. DOI:10.1128/JVI.00554-15 |
| [38] |
Golding JP, Goatley L, Goodbourn S, et al. Sensitivity of African swine fever virus to type I interferon is linked to genes within multigene families 360 and 505[J]. Virology, 2016, 493: 154-161. DOI:10.1016/j.virol.2016.03.019 |
| [39] |
Correia S, Ventura S, Parkhouse RM. Identification and utility of innate immune system evasion mechanisms of ASFV[J]. Virus Research, 2013, 173(1): 87-100. DOI:10.1016/j.virusres.2012.10.013 |
| [40] |
Keẞler C, Forth JH, Keil GM, et al. The intracellular proteome of African swine fever virus[J]. Scientific Reports, 2018, 8(1): 14714. DOI:10.1038/s41598-018-32985-z |
| [41] |
Reis AL, Goatley LC, Jabbar T, et al. Deletion of the African swine fever virus gene DP148R does not reduce virus replication in culture but reduces virus virulence in pigs and induces high levels of protection against challenge[J]. Journal of Virology, 2017, 91(24): e01428-17. |
| [42] |
Wang XX, Wu J, Wu YT, et al. Inhibition of cGAS-STING-TBK1 signaling pathway by DP96R of ASFV China 2018/1[J]. Biochemical and Biophysical Research Communications, 2018, 506(3): 437-443. DOI:10.1016/j.bbrc.2018.10.103 |
| [43] |
de Oliveira VL, Almeida SCP, Soares HR, et al. A novel TLR3 inhibitor encoded by African swine fever virus (ASFV)[J]. Archives of Virology, 2011, 156(4): 597-609. DOI:10.1007/s00705-010-0894-7 |
| [44] |
Hernaez B, Cabezas M, Muñoz-Moreno R, et al. A179L, a new viral Bcl2 homolog targeting Beclin 1 autophagy related protein[J]. Current Molecular Medicine, 2013, 13(2): 305-316. DOI:10.2174/156652413804810736 |
| [45] |
Banjara S, Caria S, Dixon LK, et al. Structural insight into African swine fever virus A179L-mediated inhibition of apoptosis[J]. Journal of Virology, 2017, 91(6): e02228-16. |
| [46] |
Hurtado C, Maria JB, Granja AG, et al. The African swine fever virus lectin EP153R modulates the surface membrane expression of MHC class I antigens[J]. Archives of Virology, 2011, 156(2): 219-234. DOI:10.1007/s00705-010-0846-2 |
| [47] |
Burmakina G, Malogolovkin A, Tulman ER, et al. Identification of T-cell epitopes in African swine fever virus CD2v and C-type lectin proteins[J]. Journal of General Virology, 2019, 100(2): 259-265. DOI:10.1099/jgv.0.001195 |
| [48] |
Barber C, Netherton C, Goatley L, et al. Identification of residues within the African swine fever virus DP71L protein required for dephosphorylation of translation initiation factor eIF2α and inhibiting activation of pro-apoptotic CHOP[J]. Virology, 2017, 504: 107-113. DOI:10.1016/j.virol.2017.02.002 |
| [49] |
Netherton CL, Wileman T. African swine fever virus organelle rearrangements[J]. Virus Research, 2013, 173(1): 76-86. DOI:10.1016/j.virusres.2012.12.014 |
| [50] |
Hu XY, Chakravarty SD, Ivashkiv LB. Regulation of interferon and Toll-like receptor signaling during macrophage activation by opposing feedforward and feedback inhibition mechanisms[J]. Immunological Reviews, 2010, 226(1): 41-56. |
| [51] |
Shang YL, Coppo M, He T, et al. The transcriptional repressor Hes1 attenuates inflammation by regulating transcription elongation[J]. Nature Immunology, 2016, 17(8): 930-937. DOI:10.1038/ni.3486 |
| [52] |
Shang YL, Smith S, Hu XY. Role of Notch signaling in regulating innate immunity and inflammation in health and disease[J]. Protein & Cell, 2016, 7(3): 159-174. |
| [53] |
Franzoni G, Graham SP, Sanna G, et al. Interaction of porcine monocyte-derived dendritic cells with African swine fever viruses of diverse virulence[J]. Veterinary Microbiology, 2018, 216: 190-197. DOI:10.1016/j.vetmic.2018.02.021 |
| [54] |
Swiecki M, Colonna M. The multifaceted biology of plasmacytoid dendritic cells[J]. Nature Reviews Immunology, 2015, 15(8): 471-485. DOI:10.1038/nri3865 |
| [55] |
Liu F, Liu CX, Hu XY, et al. MicroRNA-21: a positive regulator for optimal production of type Ⅰ and type Ⅲ interferon by plasmacytoid dendritic cells[J]. Frontiers in Immunology, 2017, 8: 947. DOI:10.3389/fimmu.2017.00947 |
| [56] |
Blome S, Gabriel C, Beer M. Modern adjuvants do not enhance the efficacy of an inactivated African swine fever virus vaccine preparation[J]. Vaccine, 2014, 32(31): 3879-3882. DOI:10.1016/j.vaccine.2014.05.051 |
| [57] |
Arisa M, de la Torre Ana, Dixon L, et al. Approaches and perspectives for development of African swine fever virus vaccines[J]. Vaccines (Basel), 2017, 5(4): 35. DOI:10.3390/vaccines5040035 |
| [58] |
Argilaguet JM, Pérez-Martín E, Gallardo C, et al. Enhancing DNA immunization by targeting ASFV antigens to SLA-Ⅱ bearing cells[J]. Vaccine, 2011, 29(33): 5379-5385. DOI:10.1016/j.vaccine.2011.05.084 |
| [59] |
Jancovich JK, Chapman D, Hansen DT, et al. Immunization of pigs by DNA prime and recombinant vaccinia virus boost to identify and rank African swine fever virus immunogenic and protective proteins[J]. Journal of Virology, 2018, 92(8): e02219-17. |
| [60] |
Lokhandwala S, Waghela SD, Bray J, et al. Adenovirus-vectored novel African swine fever virus antigens elicit robust immune responses in swine[J]. PLoS One, 2017, 12(5): e0177007. DOI:10.1371/journal.pone.0177007 |
| [61] |
O'Donnell V, Holinka LG, Krug PW, et al. African swine fever virus Georgia 2007 with a deletion of virulence-associated gene 9GL (B119L), when administered at low doses, leads to virus attenuation in swine and induces an effective protection against homologous challenge[J]. Journal of Virology, 2015, 89(16): 8556-8566. DOI:10.1128/JVI.00969-15 |
| [62] |
O'Donnell V, Risatti GR, Holinka LG, et al. Simultaneous deletion of the 9GL and UK genes from the African swine fever virus Georgia 2007 isolate offers increased safety and protection against homologous challenge[J]. Journal of Virology, 2016, 91(1): e01760-16. |
| [63] |
Sánchez-Cordón PJ, Jabbar T, Berrezaie M, et al. Evaluation of protection induced by immunisation of domestic pigs with deletion mutant African swine fever virus BeninΔMGF by different doses and routes[J]. Vaccine, 2018, 36(5): 707-715. DOI:10.1016/j.vaccine.2017.12.030 |
| [64] |
Gallardo C, Sánchez EG, Pérez-Núñez D, et al. African swine fever virus (ASFV) protection mediated by NH/P68 and NH/P68 recombinant live-attenuated viruses[J]. Vaccine, 2018, 36(19): 2694-2704. DOI:10.1016/j.vaccine.2018.03.040 |
| [65] |
Coelho J, Martins C, Ferreira F, et al. African swine fever virus ORF P1192R codes for a functional type Ⅱ DNA topoisomerase[J]. Virology, 2015, 474: 82-93. DOI:10.1016/j.virol.2014.10.034 |
 2019, Vol. 46
2019, Vol. 46




