扩展功能
文章信息
- 毛黎娟, 葛洋, 周文武, 祝增荣, 章初龙
- MAO Li-Juan, GE Yang, ZHOU Wen-Wu, ZHU Zeng-Rong, ZHANG Chu-Long
- 基于硅胶管吸附萃取的热脱附-气相色谱-质谱联用法测定真菌的挥发性有机化合物
- Determination of fungal volatile organic compounds by thermal desorption-gas chromatography-mass spectrometry analysis based on silicone tube sorptive extraction
- 微生物学通报, 2019, 46(7): 1748-1758
- Microbiology China, 2019, 46(7): 1748-1758
- DOI: 10.13344/j.microbiol.china.190166
-
文章历史
- 收稿日期: 2019-03-04
- 接受日期: 2019-05-13
- 网络首发日期: 2019-05-20
2. 浙江大学农生环测试中心 浙江 杭州 310058
2. Analysis Center of Agrobiology and Environmental Science, Zhejiang University, Hangzhou, Zhejiang 310058, China
挥发性有机化合物(Volatile organic compounds,VOCs)是指低分子量、低沸点、易挥发的有机化合物,已报道的由真菌和细菌产生的VOCs有800多种,包括醇类、醛类、酮类、萜烯类、烯烃类、烷烃类和酯类等,它们是多种代谢途径的中间产物和终产物[1-2]。VOCs赋予微生物特殊的气味,如蘑菇风味由一系列含有8个碳的挥发性物质组成,包括1-辛醇、3-辛醇、3-辛酮、1-辛烯-3-醇、2-辛烯-1-醇和1-辛烯-3-酮等[3]。另外,VOCs可作为微生物与微生物、微生物与动植物交流的化学信号,如木霉产生的6-戊基-2H-吡喃-2-酮(6-Pentyl-2H-Pyran-2-one,6-PP)不仅可以抑制立枯丝核菌(Rhizoctonia solani)、灰葡萄孢(Botrytis cinerea)等植物病原真菌的生长[4],还可促进植物生长和诱导植物抗病性[5]。
微生物产生VOCs受到基因型以及培养环境的影响,为了了解不同微生物产生的VOCs及其生理和生态功能,首先进行VOCs样品制备,然后通过气相色谱-质谱(Gas chromatography-mass spectrometry,GC-MS)进行检测。VOCs样品制备大致可分为溶剂法和顶空法[2]。用有机溶剂可以从生物样品(如真菌菌丝体或培养液)中萃取得到更多的VOCs,但这种样品制备方法不仅费时费力,而且溶剂提取物往往含有非挥发性物质以及溶剂或实验室设备中的杂质[6]。因此,VOCs样品制备方法逐渐向直接从生物样品的顶空收集气相挥发物的无溶剂萃取方法转变[7],其中以固相微萃取(Solid phase microextraction,SPME)为代表的被动顶空采样法被广泛应用于微生物培养物的VOCs测定[8-14]。被动顶空采样法大多采用由聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)或PDMS与其它吸附材料如二乙烯基苯(Divinylbenzene,DVB)等制成的混合物作为吸附剂直接从生物样品的顶空吸附VOCs[2]。硅胶管(Silicone tube)是用PDMS制造的,用一次性使用的硅胶管进行VOCs的被动顶空采样是一种价格低廉、灵活可靠的替代方案。与使用PDMS的SPME法相比,硅胶管吸附萃取法(Silicone tube sorptive extraction,STSE)的吸附容量高,允许对LogKow > 5的分析物进行极限萃取,对LogKow < 4的分析物回收率更高,因此STSE适用于广泛极性范围内分析物的吸取萃取[15]。STSE操作简单,用硅胶管对分析物进行吸附萃取时,首先将一定尺寸和容量的硅胶管切割成相同长度的短硅胶管,以确保每次使用相同的体积,然后将硅胶管在氮气流中加热清洗或用溶剂进行清洗。萃取时,将硅胶管放入需要萃取的气相或水相样品中,萃取时间取决于样品、硅胶管容量以及分析物。萃取后,将硅胶管置于石英样品管中,用热脱附-气相色谱-质谱(Thermal desorption-gas chromatography-mass spectrometry,TD-GC-MS)联用仪进行解吸附并进行检测[15]。
基于STSE的TD-GC-MS技术常应用于空气、水、牛奶等样品中有机化合物的检测[15],Kallenbach等率先将这一技术应用于田间条件下植物VOCs的分析[16],目前这一技术还未应用于真菌培养物VOCs的测定。木霉是一种典型的产生VOCs的真菌,用溶剂法萃取了木霉菌株FA1132的VOCs,GC-MS分析发现278个可挥发性组分,包括由二甲基烯丙基二磷酸(Dimethyl allyldiphospate,DMAPP)与异戊烯基二磷酸(Isopentenyl diphosphate,IPP)通过香叶基二磷酸(Geranyl diphosphate,Geranyl-PP)和法尼基二磷酸(Farnesyl diphosphate,Farnesyl-PP)结合而成单萜和倍半萜,由脂肪酸分解而成的烷烃、烯烃、甲基酮、C8初级醇和6-PP[17]。本文以木霉菌为研究对象,建立了一种简单可靠、基于STSE的TD-GC-MS分析测定真菌培养物VOCs的高通量分析技术,可用于真菌VOCs的分析测定。
1 材料与方法 1.1 主要材料硅胶管(内径1.0 mm,外径1.8 mm,壁厚0.4 mm),Carl Roth公司;Tenax-TA吸附管,Superlab公司;TD100-xr自动热脱附仪,Markes International公司;Trace 1300 GC/ISQ 7000MSD气相色谱仪-质谱仪,Thermo Scientific公司。
1.2 硅胶管、Tenax-TA吸附管和空石英样品管预处理用管线切割器将硅胶管切割成1 cm长的硅胶管,然后在乙腈:甲醇溶液(4:1,体积比)中浸泡3 h以上或过夜,在通风柜中晾干,于真空电热恒温干燥箱中100 mL/min N2流下210 ℃老化3 h,冷却到室温后分装到棕色玻璃瓶中,充氩气保存备用。
将Tenax-TA吸附管和空石英样品管置于老化仪中,在60 mL/min N2流下335 ℃老化30 min备用。
1.3 对照品溶液配制选择21种代表性的VOCs,包括酯、酮、醇、醛、烯等作为对照品(表 1)。分别精密移取对照品适量,用乙醇作为稀释液进行稀释,并配制成浓度分别为0.1、0.2、0.5、1.0、2.0、5.0、10.0 µg/mL系列对照品溶液。
| 对照品序号 Serial number of reference substances |
保留时间 Retention time (min) |
化合物 Compound |
CAS号 CAS number |
分子式 Molecular formula |
分子量 Molecular weight |
特征质量离子 Characteristic mass ion |
| 1 | 6.34 | 乙酸丁酯 Butyl acetate |
123-86-4 | C6H12O2 | 116 | 43 |
| 2 | 7.54 | (E)-2-己烯醛 Trans-2-hexenal |
6728-26-3 | C6H10O | 98 | 41 |
| 3 | 8.47 | 2-甲基丁基乙酸酯 2-Methylbutyl acetate |
624-41-9 | C7H14O2 | 130 | 43 |
| 4 | 8.78 | 庚酮 2-Heptanone |
110-43-0 | C7H14O | 114 | 43 |
| 5 | 9.25 | 庚醇 2-Heptanol |
543-49-7 | C7H16O | 116 | 45 |
| 6 | 10.22 | (1R)-(+)-α-蒎烯 (1R)-(+)-α-Pinene |
80-56-8 | C10H16 | 136 | 93 |
| 7 | 11.17 | 苯甲醛 Benzaldehyde |
100-52-7 | C7H6O | 106 | 77 |
| 8 | 11.95 | 1-辛烯-3-醇 1-Octen-3-ol |
3391-86-4 | C8H16O | 128 | 57 |
| 9 | 12.10 | 3-辛酮 3-Octanone |
106-68-3 | C8H16O | 128 | 43 |
| 10 | 12.79 | 乙酸顺式-3-己烯酯 (Z)-3-Hexen-1-ol acetate |
3681-71-8 | C8H14O2 | 142 | 43 |
| 11 | 13.05 | 乙酸己酯 Acetic acid hexyl ester |
142-92-7 | C8H16O2 | 144 | 43 |
| 12 | 13.54 | D-柠檬烯 D-Limonene |
5989-27-5 | C10H16 | 136 | 68 |
| 13 | 15.43 | 萜品油烯 Terpinolene |
586-62-9 | C10H16 | 136 | 93 |
| 14 | 15.45 | 3-壬酮 3-Nonanone |
925-78-0 | C9H18O | 142 | 43 |
| 15 | 15.93 | 芳樟醇 Linalool |
78-70-6 | C10H18O | 154 | 71 |
| 16 | 16.20 | 1-辛烯-3-醇乙酸酯 1-Octen-3-yl-acetate |
2442-10-6 | C10H18O2 | 170 | 43 |
| 17 | 19.62 | β-环柠檬醛 β-Cyclocitral |
432-25-7 | C10H16O | 152 | 41 |
| 18 | 21.82 | 2-十一酮 2-Undecanone |
112-12-9 | C11H22O | 170 | 58 |
| 19 | 25.31 | α-柏木烯 α-Cedrene |
469-61-4 | C15H24 | 204 | 119 |
| 20 | 25.40 | β-石竹烯 β-Caryophyllene |
87-44-5 | C15H24 | 204 | 93 |
| 21 | 25.52 | β-柏木烯 β-Cedrene |
546-28-1 | C15H24 | 204 | 161 |
对照品溶液以进样量1.0 µL直接注入Tenax-TA吸附管,通过C-SLR通入吹扫气去除溶剂。Tenax-TA吸附管放入热脱附仪自动进样盘,用自动热脱附仪-气相色谱仪-质谱仪进行TD-GC-MS分析。
色谱条件:石英毛细管柱TG-5SILMS (5%苯甲基硅氧烷:0.25 mm×30 m,0.25 μm);载气为氦气,柱流量为1.0 mL/min;热脱附条件:传输线温度205 ℃;预解析1 min;一级解析200 ℃,8 min;二级解析预吹扫1 min,低温−10 ℃,高温230 ℃,5 min。色谱柱初始温度30 ℃,保持3 min,以5 ℃/min升温速率升至210 ℃;不分流。
质谱条件:EI电离源,电离电压70 eV,离子源温度300 ℃;质谱范围20−450 amu。通过NIST17数据库比较鉴定挥发性物质。对照组检测到的色谱峰将在处理组获得的峰中扣除。
1.5 专属性测定在直径6 cm的玻璃平皿中加PDA培养基,将其打开盖子放在另一套空的直径9 cm的玻璃平皿中,备用。取无菌滤纸片置于6 cm玻璃平皿的PDA培养基上,滴加5 µg/mL对照品溶液10 µL (0.05 µg)于滤纸片上,然后取一根老化好的1 cm长硅胶管置于9 cm玻璃平皿中,用封口膜将9 cm玻璃平皿密封,24 ℃静置24 h后,将硅胶管取出,置于老化好的空石英样品管中,进行TD-GC-MS分析,每个处理3个重复。
1.6 菌株样品的重复性测定选择木霉菌株T552进行方法的重复性测定。将待测菌株在PDA培养基中活化培养,取直径0.5 cm菌丝块接种在6 cm玻璃平皿的PDA培养基上,24 ℃培养7 d后,打开盖子放在另一套空的9 cm玻璃平皿中,取一根老化好的1 cm长硅胶管置于9 cm玻璃平皿中,用封口膜将9 cm玻璃平皿密封,24 ℃静置24 h后,将硅胶管取出,置于老化好的空石英样品管中,进行TD-GC-MS分析。以不接种的空白PDA培养基为对照,每个处理3个重复。
1.7 菌株样品VOCs的筛选选择6株木霉T746、T1730、T1807、T1954、T2366和T3273,按1.6方法进行VOCs筛选。
2 结果与分析 2.1 标准曲线对照品溶液经TD-GC-MS分析,以峰面积为纵坐标、溶液浓度为横坐标绘制标准曲线,得线性回归方程,结果见表 2。除了保留时间相近的第13、14号对照品(萜品油烯、3-壬酮)以外,其它对照品分离良好。进一步通过特征离子,以提取离子模式鉴定萜品油烯和3-壬酮。TD-GC-MS分析结果表明,全扫描条件下供试的VOCs在1.0−10.0 μg/mL范围内线性关系良好;提取离子条件下供试的VOCs在0.1−10.0 μg/mL范围内线性关系良好。
| 对照品序号 Serial number of reference substances |
全扫描模式 SCAN mode |
提取离子模式 Extract ion mode |
||||
| 线性回归方程 Linear equation |
相关系数平方 Correlation coefficient (r2) |
提取离子 Extract ion |
线性回归方程 Linear equation |
相关系数平方 Correlation coefficient (r2) |
||
| 1 | y=186 739x−25 427 | 0.998 7 | 43 | y=75 334x+19 818 | 0.998 9 | |
| 2 | y=125 986x−77 153 | 0.997 7 | 69 | y=10 726x−608 | 0.999 1 | |
| 3 | y=223 092x−72 159 | 0.998 0 | 43 | y=84 956x−7 506 | 0.998 7 | |
| 4 | y=215 377x−56 173 | 0.998 2 | 58 | y=48 984x−418 | 0.998 0 | |
| 5 | y=212 907x−17 732 | 0.998 4 | 45 | y=94 882x−30 474 | 0.998 7 | |
| 6 | y=265 422x−161 418 | 0.998 0 | 93 | y=62 121x−8 304 | 0.998 1 | |
| 7 | y=190 445x+61 867 | 0.999 0 | 77 | y=48 622x+41 188 | 0.998 4 | |
| 8 | y=169 616x−109 884 | 0.998 2 | 57 | y=60 663x−16 625 | 0.994 0 | |
| 9 | y=182 780x+21 959 | 0.999 1 | 43 | y=42 247x+277 | 0.997 3 | |
| 10 | y=215 679x−145 374 | 0.998 3 | 43 | y=65 277x−13 074 | 0.995 6 | |
| 11 | y=227 007x−82 097 | 0.999 1 | 43 | y=75 149x−13 668 | 0.995 4 | |
| 12 | y=298 598x−170 | 0.998 5 | 68 | y=43 504x+5 540 | 0.997 1 | |
| 13 | y=447 562x+15 149 | 0.988 9 | 93 | y=32 716x−9 291 | 0.991 0 | |
| 14 | y=447 562x+15 149 | 0.988 9 | 57 | y=44 533x−10 775 | 0.991 0 | |
| 15 | y=265 430x−276 807 | 0.998 0 | 71 | y=34 581x−13 006 | 0.994 9 | |
| 16 | y=268 300x−89 438 | 0.995 3 | 43 | y=81 608x−14 557 | 0.995 6 | |
| 17 | y=285 337x−21 247 | 0.998 8 | 41 | y=13 670x−2 418 | 0.998 0 | |
| 18 | y=288 741x−284 916 | 0.996 7 | 58 | y=66 575x−17 478 | 0.985 0 | |
| 19 | y=374 453x−67 085 | 0.998 4 | 119 | y=63 851x−5 393 | 0.997 5 | |
| 20 | y=252 703x−41 252 | 0.998 4 | 93 | y=16 425x−3 284 | 0.994 9 | |
| 21 | y=336 268x+9 125 | 0.998 5 | 161 | y=29 414x−6 498 | 0.991 7 | |
用硅胶管吸附滴加于PDA培养基上滤纸片的对照品,TD-GC-MS分析表明,对照品分离良好(图 1)。由此可见,PDA培养基平皿中的供试VOCs可以通过硅胶管吸附采样,PDA培养基平皿中的其它物质不干扰VOCs的测定。因此该方法专属性良好,可用于微生物PDA培养过程中产生的VOCs测定。
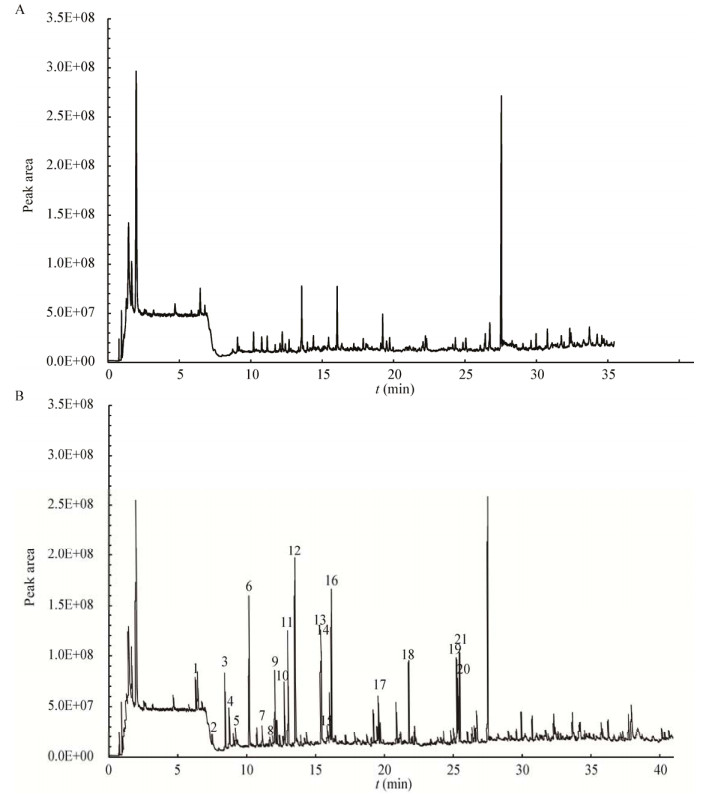
|
| 图 1 硅胶管吸附萃取的热脱附-气相色谱-质谱测定PDA平皿中挥发性有机化合物的总离子流图 Figure 1 The total ion chromatorgraphy of VOCs in PDA petri dish determined by thermal desorption-gas chromatography-mass spectrometry analysis based on silicone tube sorptive extraction 注:A:PDA培养基对照;B:PDA培养基滴加对照品溶液.色谱峰旁标注数字1−21表示对照品序号. Note: A: PDA control; B: The reference substances dropped into the PDA medium. The numbers 1−21 beside the chromatographic peaks indicates the serial number of reference substances. |
|
|
木霉菌T552在PDA培养基中培养,产生的VOCs通过硅胶管吸附进行TD-GC-MS分析,通过NIST17数据库比较鉴定出T552产生的5种VOCs,并对具有重要生物活性的VOCs组分6-PP通过标样进行了确认。重复性测定发现5种VOCs的相对标准偏差均小于10% (表 3),可见基于STSE的TD-GC-MS分析测定真菌培养物VOCs的重复性良好。
| 保留时间 Retention time (min) |
提取离子 Extraction ion |
峰面积 Peak area* |
可能的化合物 Possible compound |
CAS号 CAS number |
分子式 Molecular formula |
分子量 Molecular weight |
||||
| Ⅰ | Ⅱ | Ⅲ | 平均 Average |
相对标准偏差 Relative standard deviation (RSD, %) |
||||||
| 2.26 | 43 | 280 829 | 240 416 | 254 313 | 258 519 | 7.94 | 2-甲基-1-丙醇 2-Methyl-1-propanol |
78-83-1 | C4H10O | 74 |
| 14.86 | 43 | 13 920 | 15 493 | 13 697 | 14 370 | 6.81 | 6-甲基-3, 4-二氢-2h-吡喃 6-Methyl-3, 4-dihydro-2h-pyran |
16015-11-5 | C6H10O | 98 |
| 26.37 | 95 | 8 260 435 | 7 101 053 | 7 960 435 | 7 773 974 | 7.74 | 6-戊基-2h-吡喃-2-酮 6-Pentyl-2h-pyran-2-one |
27593-23-3 | C10H14O2 | 166 |
| 27.22 | 119 | 126 974 | 119 273 | 111 505 | 119 251 | 6.49 | Trans-sesquisabinene hydrate | 145512-84-1 | C15H26O | 222 |
| 31.30 | 43 | 246 844 | 237 866 | 231 348 | 238 686 | 3.26 | 5, 6, 6-三甲基-十一-3, 4-二烯-2, 10-二酮 5, 6, 6-Trimethyl-undeca-3, 4-diene-2, 10-dione |
90165-10-9 | C14H22O2 | 222 |
| 注:*:扣除PDA对照中的相应化合物,并去除信噪比小于3的小峰. Note: *: The corresponding compounds existed in PDA controls were deleted. Minor peaks with signal-to-noise ratio < 3 were cutoff. |
||||||||||
在上述试验条件下,供试木霉菌在PDA培养基中培养,产生的VOCs通过硅胶管吸附进行TD-GC-MS分析,通过NIST17数据库比较鉴定出这6株木霉产生包括酸、醇、酯、烯等共37种VOCs (表 4),其中对1-辛烯-3-醇、3-辛酮、β-石竹烯、β-柏木烯、苯乙醇(Phenylethyl alcohol)等5种重要VOCs组分通过标样进行了确认。从表 4可见,T1954产生苯乙醇,T2366产生相对含量最高的1-辛烯-3-醇和3-辛酮,T3273产生β-石竹烯,T1807产生β-柏木烯。
| 保留时间 Retention time (min) |
提取离子 Extraction ion |
峰面积 Peak area* |
可能的化合物 Possible compound |
CAS号 CAS number |
分子式 Molecular formula |
分子量 Molecular weight |
|||||
| T746 | T1730 | T1807 | T1954 | T2366 | T3273 | ||||||
| 2.26 | 43 | 348 839 | ND | 1 066 182 | 644 360 | 717 035 | ND | 2-甲基-1-丙醇 2-Methyl-1-propanol |
78-83-1 | C4H10O | 74 |
| 3.01 | 45 | 750 722 | 170 200 | 318 179 | 273 716 | 148 932 | ND | 3-甲基-2-丁醇 3-Methyl-2-butanol |
598-75-4 | C5H12O | 88 |
| 3.31 | 71 | 63 384 | 1 216 193 | 39 783 | ND | ND | ND | 3-戊烯-2-醇 3-Penten-2-ol |
1569-50-2 | C5H10O | 86 |
| 4.13 | 55 | ND | ND | ND | 1 583 745 | ND | ND | 3-甲基-1-丁醇 3-Methyl-1-butanol |
123-51-3 | C5H12O | 88 |
| 4.23 | 41 | ND | ND | ND | 573 046 | ND | ND | 2-甲基-1-丁醇 2-Methyl-1-butanol |
137-32-6 | C5H12O | 88 |
| 5.22 | 43 | 41 010 | ND | ND | ND | 349 839 | ND | 乙酰丙酮 Acetylacetone |
123-54-6 | C5H8O2 | 100 |
| 7.44 | 56 | ND | ND | ND | 147 193 | ND | ND | 甲基-1-戊醇 3-Methyl-1-pentanol |
589-35-5 | C6H14O | 102 |
| 10.40 | 55 | ND | ND | 104 062 | 60 913 | 261 147 | ND | 3-庚烯-2-酮 (z)-3-Hepten-2-one |
69668-88-8 | C7H12O | 112 |
| 11.36 | 43 | ND | ND | ND | ND | 957 727 | ND | 5-甲基-2-庚酮 5-Methyl-2-heptanone |
18217-12-4 | C8H16O | 128 |
| 11.54 | 74 | 129 716 | ND | 81 489 | 38 219 | 227 791 | ND | 庚酸甲酯 Heptanoic acid, methyl ester |
106-73-0 | C8H16O2 | 144 |
| 12.01 | 57 | 11 280 092 | ND | 4 623 258 | 13 600 194 | 32 582 202 | ND | 1-辛烯-3-醇 1-Octen-3-ol |
3391-86-4 | C8H16O | 128 |
| 12.08 | 43 | 1 868 007 | 388 053 | 541 616 | 5 403 438 | 6 751 624 | ND | 3-辛酮 3-Octanone |
106-68-3 | C8H16O | 128 |
| 12.60 | 59 | ND | ND | ND | 3 696 384 | 13 261 744 | ND | 3-辛醇 3-Octanol |
589-98-0 | C8H18O | 130 |
| 13.91 | 55 | ND | ND | ND | ND | 634 515 | ND | 辛烯-2-酮 3-Octen-2-one |
1669-44-9 | C8H14O | 126 |
| 14.90 | 57 | 7 728 972 | 798 126 | 1 269 149 | 18 051 525 | ND | ND | 反式-2-辛烯-1-醇 (e)-2-Octen-1-ol |
18409-17-1 | C8H16O | 128 |
| 14.86 | 43 | 3 340 686 | ND | 3 405 029 | 1 744 657 | 2 049 391 | ND | 6-甲基-3, 4-二氢-2h-吡喃 6-Methyl-3, 4-dihydro-2h-pyran |
16015-11-5 | C6H10O | 98 |
| 16.30 | 91 | ND | ND | ND | 5 837 448 | ND | ND | 苯乙醇 Phenylethyl alcohol |
60-12-8 | C8H10O | 122 |
| 18.85 | 95 | ND | ND | ND | ND | 1 671 311 | ND | 壬-3, 5-二烯-2-酮 Nona-3, 5-dien-2-one |
80387-31-1 | C9H14O | 138 |
| 18.96 | 81 | 785 838 | ND | 317 111 | 228 641 | ND | ND | Unknown | |||
| 19.97 | 93 | 183 494 | ND | 316 485 | 36 812 | 401 915 | 17 193 | Unknown | |||
| 23.57 | 123 | ND | ND | ND | 401 943 | ND | ND | Unknown | |||
| 25.39 | 161 | ND | ND | 391 853 | ND | ND | ND | Unknown | |||
| 25.42 | 93 | ND | ND | ND | ND | ND | 2 962 495 | β-石竹烯 Caryophyllene |
87-44-5 | C15H24 | 204 |
| 25.56 | 161 | ND | ND | 701 769 | ND | ND | ND | β-柏木烯 β-Cedren |
546-28-1 | C15H24 | 204 |
| 26.21 | 105 | ND | ND | ND | ND | ND | 2 331 045 | (-)-alpha-荜澄茄油烯 (-)-α-Cubebene |
17699-14-8 | C15H24 | 204 |
| 26.55 | 161 | ND | ND | ND | ND | ND | 3 966 951 | 顺-衣兰油-4(15), 5-二烯 cis-Muurola-4(15), 5-diene |
157477-72-0 | C15H24 | 204 |
| 27.30 | 105 | ND | ND | ND | ND | ND | 7 128 019 | β-瑟林烯 (+)-b-Selinene |
17066-67-0 | C15H24 | 204 |
| 27.36 | 161 | ND | ND | ND | ND | ND | 4 596 488 | γ-衣兰油烯 γ-Muurolene |
30021-74-0 | C15H24 | 204 |
| 27.50 | 93 | ND | ND | ND | ND | ND | 8 079 038 | (+)-g-古芸烯 (+)-g-Gurjunene |
22567-17-5 | C15H24 | 204 |
| 27.90 | 161 | 1 053 213 | 1 440 534 | ND | 1 030 895 | 487 833 | 1 762 178 | (-)-g-荜澄茄烯 (-)-g-Cadinene |
39029-41-9 | C15H24 | 204 |
| 28.16 | 161 | ND | ND | ND | ND | ND | 99 137 520 | d-荜澄茄烯 d-Cadinene |
483-76-1 | C15H24 | 204 |
| 28.42 | 119 | ND | ND | ND | ND | ND | 1 914 631 | 1, 2, 3, 4, 4a, 7-六氢-1, 6-二甲基-4-(1-甲基乙基)-萘 1, 2, 3, 4, 4a, 7-Hexahydro-1, 6-dimethy4-(1-methylethyl)-naphthalene |
16728-99-7 | C15H24 | 204 |
| 31.15 | 95 | ND | ND | ND | ND | ND | 15 357 637 | α-杜松醇 α-Cadinol |
481-34-5 | C15H26O | 222 |
| 31.44 | 95 | ND | ND | ND | ND | ND | 17 436 324 | (1s, 4s, 4ar, 8as)-1, 2, 3, 4, 4a, 7, 8, 8a-八氢-1, 6-二甲基-4-(1-甲基乙基)-1-萘酚 (1s, 4s, 4ar, 8as)-1, 2, 3, 4, 4a, 7, 8, 8a-Octahydro-1, 6-dimethyl-4-(1-methylethyl)-1-naphthalenol |
19912-62-0 | C15H26O | 222 |
| 33.83 | 73 | ND | 1 950 636 | 2 295 735 | ND | 510 207 | ND | 十四酸 Tetradecanoic acid |
544-63-8 | C14H28O2 | 228 |
| 37.28 | 74 | ND | ND | ND | 1 384 858 | ND | ND | 十六酸甲酯 Hexadecanoic acid, methyl ester |
112-39-0 | C17H34O2 | 270 |
| 38.17 | 73 | ND | 5 945 795 | 7 517 911 | ND | 8 105 | ND | 十六酸 n-Hexadecanoic acid |
1957-10-3 | C16H32O2 | 256 |
| 注:*:扣除PDA对照中的相应化合物,并去除信噪比小于3的小峰;ND:未检出. Note: *: The corresponding compounds existed in PDA controls were deleted. Minor peaks with signal-to-noise ratio < 3 were cutoff; ND: Not detected. |
|||||||||||
GC-MS联用分析因高分辨率、高灵敏度已被广泛应用于复杂组分(尤其是VOCs)的分离鉴定。微生物培养物VOCs的分析测定需要高通量的VOCs样品制备技术与GC-MS分析仪器配合才可以在短时间内处理更多样品,实现高通量分析。SPME是一种广泛应用于VOCs的被动顶空采样技术,这种技术采用安装在SPME针头的具有不同涂层的萃取头萃取VOCs进行采样。但是用SPME进行微生物培养物的VOCs样品制备存在以下缺点:(1)由于SPME萃取装置价格较贵,而采用SPME萃取装置完成一个样品VOCs的萃取约耗时1 h,因此采用SPME不能同时对大量培养物进行VOCs的样品制备;(2)由于SPME萃取头表面涂覆的吸附材料量少,因此萃取头吸附容量较小,且重复使用后吸附萃取VOCs的效果下降。与SPME相比,用STSE对培养物进行VOCs样品制备可以克服以上缺点:(1)由于硅胶管价格低廉,采用STSE只需将切割成1 cm长的硅胶管分别置于培养基平皿内即可实现同时对大量培养物进行VOCs的样品制备,因此便于大量培养物的高通量分析;(2)硅胶管吸附容量大,即使样品中VOCs浓度较高(即TD-GC-MS检测获得的色谱峰较高较宽),在培养基平皿中简单增加硅胶管吸附即可,避免了SPME萃取头吸附容量小的问题,而且硅胶管一次性使用,不存在重复使用导致VOCs吸附萃取效果下降的问题。本试验选择了21种包括酯、酮、醇、醛、烯的代表性VOCs化合物作为对照品,1根1 cm长的硅胶管吸附0.05 µg对照品/平皿,测定VOCs的分离度良好,可见培养基平皿中硅胶管吸附VOCs的TD-GC-MS检测方法灵敏度高、专属性强,能较准确地测定培养基平皿中的不同种类的VOCs。
木霉可以产生多样化的VOCs组分,包括饱和烃、环己烷、环戊烷、脂肪酸、醇类、酯类、含硫化合物以及简单的吡喃和苯衍生物等,如吡喃酮衍生物就有10多种[2]。Siddiquee等用不同极性溶剂从木霉菌FA1132液体培养物中提取制备样品,用不同极性毛细管柱进行GC-MS分析,发现278个可挥发性组分[17],但溶剂法提取不适合对大量样品进行快速检测分析,也不能用于微生物培养过程的动态分析。用本试验建立的硅胶管吸附培养基平皿中VOCs的TD-GC-MS检测方法对木霉产生的VOCs进行了测定,成功检测出两大类VOCs组分,包括重要的挥发性芳香成分,如具有蘑菇风味的3-辛醇、3-辛酮、1-辛烯-3-醇、2-辛烯-1-醇、3-辛烯-2-酮等八碳挥发性物质,具有特有的杏仁气味、玫瑰花香、芸香香气的苯甲醛、苯乙醇、2-十一烷酮,以及具有重要生物活性的6-戊基-2H-吡喃-2-酮、β-石竹烯等VOCs成分。本文建立的基于STSE的TD-GC-MS分析测定真菌培养物VOCs的高通量分析技术简单可靠,可用于真菌VOCs的分析测定,将为VOCs产生菌筛选和VOCs影响因子研究、VOCs产生菌与其它微生物、动植物互作提供一种高通量的分析手段。
| [1] |
Korpi A, Järnberg J, Pasanen AL. Microbial volatile organic compounds[J]. Critical Reviews in Toxicology, 2009, 39(2): 139-193. DOI:10.1080/10408440802291497 |
| [2] |
Zeilinger S, Schuhmacher R. Volatile organic metabolites of Trichoderma spp.: biosynthesis, biology and analytics[A]//Mukherjee PK, Horwitz BA, Singh US, et al. Trichoderma: Biology and Application[M]. Wallingford: CABI, 2013: 110-127
|
| [3] |
Maga JA. Mushroom flavor[J]. Journal of Agricultural and Food Chemistry, 1981, 29(1): 1-4. DOI:10.1021/jf00103a001 |
| [4] |
Dennis C, Webster J. Transactions of the British Mycological Society[M]. 1971: 41-48, IN4.
|
| [5] |
Kottb M, Gigolashvili T, Großkinsky DK, et al. Trichoderma volatiles effecting Arabidopsis: from inhibition to protection against phytopathogenic fungi[J]. Frontiers in Microbiology, 2015, 6: 995. |
| [6] |
Rowan DD. Volatile metabolites[J]. Metabolites, 2011, 1(1): 41-63. DOI:10.3390/metabo1010041 |
| [7] |
Rubiolo P, Sgorbini B, Liberto E, et al. Analysis of the plant volatile fraction[A]//Herrmann A. The Chemistry and Biology of Volatiles[M]. Chichester: John Wiley & Sons Ltd., 2010: 49-93
|
| [8] |
Zhang WW, Guo ZY, Zhao XD, et al. Effect and identification of volatile compounds from Trichoderma against Fusarium oxysporum[J]. Chinese Journal of Tropical Crops, 2017, 38(4): 704-715. (in Chinese) 张雯雯, 国振宇, 赵晓迪, 等. 木霉菌株挥发性物质拮抗尖孢镰刀菌的效果及其鉴定[J]. 热带作物学报, 2017, 38(4): 704-715. DOI:10.3969/j.issn.1000-2561.2017.04.019 |
| [9] |
Mao LJ, Chen JJ, Xia CY, et al. Identification and characterization of new Muscodor endophytes from gramineous plants in Xishuangbanna, China[J]. MicrobiologyOpen, 2019, 8(4): e00666. DOI:10.1002/mbo3.2019.8.issue-4 |
| [10] |
Song YL, Hu P, Zhao SY, et al. Distinction of fermented Cordyceps products from different strains and analysis of their volatile components by HS-SPME/GC-MS combined with chemometrics analysis[J]. Chinese Journal of Pharmaceutical Analysis, 2018, 38(1): 67-78. (in Chinese) 宋玉玲, 胡坪, 赵诗怡, 等. HS-SPME/GC-MS结合化学计量学鉴别不同菌种发酵虫草产品及挥发性成分分析[J]. 药物分析杂志, 2018, 38(1): 67-78. |
| [11] |
Zhang ZC, Zhang Y, Li JM, et al. The aroma components analysis of two Ceratocystis strains[J]. Natural Product Research and Development, 2018, 30(11): 1939-1942, 1956. (in Chinese) 张志超, 张彧, 李建梅, 等. 两株长喙壳属真菌挥发性香气成分分析[J]. 天然产物研究与开发, 2018, 30(11): 1939-1942, 1956. |
| [12] |
Xu MK, Yin JW, Tan SY, et al. Isolation of endophytic fungi of Dendrobium officinale and analysis of their volatile constituent[J]. Biotic Resources, 2017, 39(1): 53-57. (in Chinese) 徐梦珂, 印嘉闻, 谈思源, 等. 铁皮石斛内生真菌的分离及其挥发性成分分析[J]. 生物资源, 2017, 39(1): 53-57. |
| [13] |
Chen YP, Yang Y, Shi T, et al. Identification and fungistasis of volatile compounds produced by endophytic fungi HND5[J]. Chinese Journal of Tropical Crops, 2017, 38(4): 689-694. (in Chinese) 陈奕鹏, 杨扬, 时涛, 等. 内生真菌HND5挥发性物质组分分析及其抑菌作用测定[J]. 热带作物学报, 2017, 38(4): 689-694. DOI:10.3969/j.issn.1000-2561.2017.04.016 |
| [14] |
Dai HY, Liu MZ, Lv ZC. Identification of paclitaxel-producing wild-type entophyte fungus J11 and its mutant strain J11-8 by HS-SPME-GC-MS[J]. Journal of Huizhou University, 2016, 36(6): 45-49. (in Chinese) 戴黄益, 刘明志, 吕镇城. 顶空固相微萃取-气相色谱-质谱联用法鉴别产紫杉醇的内生菌株J11和诱变菌株J11-8[J]. 惠州学院学报:自然科学版, 2016, 36(6): 45-49. |
| [15] |
van Pinxteren M, Paschke A, Popp P. Silicone rod and silicone tube sorptive extraction[J]. Journal of Chromatography A, 2010, 1217(16): 2589-2598. DOI:10.1016/j.chroma.2009.11.025 |
| [16] |
Kallenbach M, Oh Y, Eilers EJ, et al. A robust, simple, high-throughput technique for time-resolved plant volatile analysis in field experiments[J]. The Plant Journal, 2014, 78(6): 1060-1072. DOI:10.1111/tpj.12523 |
| [17] |
Siddiquee S, Cheong BE, Taslima K, et al. Separation and identification of volatile compounds from liquid cultures of Trichoderma harzianum by GC-MS using three different capillary columns[J]. Journal of Chromatographic Science, 2012, 50(4): 358-367. DOI:10.1093/chromsci/bms012 |
 2019, Vol. 46
2019, Vol. 46




