扩展功能
文章信息
- 朱倩, 程迅, 杜秀秀, 周国英, 邓云霞, 黄志伟
- ZHU Qian, CHENG Xun, DU Xiu-Xiu, ZHOU Guo-Ying, DENG Yun-Xia, HUANG Zhi-Wei
- 极长链脂肪酸的合成缺陷对酵母细胞膜的稳定性和多烯类药物敏感性的影响
- Effects of synthetic defects of very long-chain fatty acids on cell membrane stability and sensitivity of polyenes in yeast
- 微生物学通报, 2019, 46(7): 1645-1653
- Microbiology China, 2019, 46(7): 1645-1653
- DOI: 10.13344/j.microbiol.china.180631
-
文章历史
- 收稿日期: 2018-08-14
- 接受日期: 2018-11-08
- 网络首发日期: 2018-12-13
2. 中国科学院西北高原生物研究所 青海 西宁 810008
2. Northwest Institute of Plateau Biology, Chinese Academy of Sciences, Xining, Qinghai 810008, China
链长为16−18个碳原子的脂肪酸类物质在大多数动植物组织中占总脂肪酸的90%以上,然而细胞内许多生物学过程依赖由20或更多个碳原子组成的脂肪酸,其通常被称为极长链脂肪酸(Very long-chain fatty acids,VLCFA)[1]。VLCFA生物合成、调控及其生物学功能并不完全清楚。脂肪酸延长酶家族参与脂肪酸代谢具有真核生物的高度保守性,酿酒酵母是研究VLCFA代谢极好的生物模型[2]。酵母脂肪酸延长酶ELO家族包括ELO1、ELO2和ELO3,elo1是C14和C16之间的微粒体脂肪酸链延伸所需的基因[3],另外两个ELO家族基因elo2和elo3负责将长链脂肪酸延长到VLCFA,并参与细胞多项生命活动和功能的调节,在真核生物中有很高的保守性。
VLCFA在酵母中有重要作用,这可能是因为它们作为鞘脂和GPI-锚定的组分而拥有特殊的结构功能[4]。鞘脂是细胞膜的重要组成成分,同时还是重要的信号分子,与调控细胞生长、分化和死亡相关的信号传导途径有关[5]。近期,在核膜的提取物中发现含有C26脂肪酸的磷脂酰肌醇种类,暗示VLCFA修饰的脂质在建立核孔复合物的膜曲率中起结构作用[6]。elo2的突变体因对丁苯吗啉(一种影响固醇代谢的药物)具有抗性而被鉴定出来[7]。elo2和gns1的双突变体胞内1, 3-β-葡聚糖合酶活性显著降低。elo2或elo3突变后能够抑制编码v-SNARE (可溶性NSF吸附蛋白受体)的snc1和snc2同时敲除引起的热温敏感表型和转化酶分泌的减少[8]。另外,elo3与erg6缺失具有联合致死表型[9]。这些研究结果证明了脂肪酸延长对于囊泡运输的重要性,以及与固醇代谢的密切联系。
多烯类药物能选择性地与真菌细胞膜的固醇部分结合,在细胞膜上形成孔道,从而增加细胞膜的通透性,造成细胞内小分子外漏,致使细胞死亡[10]。但多烯类药物对细胞膜不含固醇的细菌无作用。两性霉素B (Amphotericin B,AmB)、制霉菌素(Nystatin,Ny)是被广泛应用的两种多烯类药物。AmB通过与细胞膜上麦角固醇结合,使膜的通透性增高,阳离子外漏,从而杀死细胞。Ny抗真菌的作用机理与AmB相似。咪唑类药物硝酸益康唑(Econazole nitrate,Eco)是一种广谱抗真菌药,对皮肤癣菌、酵母菌和霉菌均有疗效。Eco作用于细胞膜,改变其通透性,阻止营养摄取,从而导致细胞死亡。但VLCFA的合成缺陷对以上抑菌药物的敏感性并不清楚。
本文通过对比脂肪酸延长酶缺陷酵母对不同多烯类化合物的响应,分析VLCFA合成障碍对细胞膜稳定性、膜脂麦角固醇含量及胞内钠钾离子平衡等的影响,探讨脂肪酸延长酶在酵母细胞模型中参与抵抗多烯类药物胁迫等方面的调控功能。
1 材料与方法 1.1 实验材料 1.1.1 菌株和培养基实验所用酿酒酵母Saccharomyces cerevisiae BY4741 (WT,MATa his3Δ1 leu2Δ0 met15Δ0 ura3Δ0)、elo1Δ (BY4741 elo1ΔKanMX)、elo2Δ (BY4741 elo2ΔKanMX)和elo3Δ (BY4741 elo3ΔKanMX)均由本实验室[2]提供。
酵母选择性营养缺陷培养基(SC-Ura培养基),从完全合成SC培养基[11]中去除尿嘧啶;YPD培养基[12];在YPD或SC中分别加入适量的不饱和脂肪酸OLA或AmB、Ny、Eco、NaCl配制成相应胁迫的培养基。
1.1.2 主要试剂和仪器AmB、Ny、OLA和Eco均购于生工生物工程(上海)股份有限公司;NaCl购于上海凌峰化学试剂有限公司。紫外可见分光光度计购于上海尤尼柯仪器有限公司;凝胶成像系统购于上海天能科技有限公司;电感耦合等离子体原子发射光谱(ICP-AES)仪购于LEEMAN CHINA公司。
1.2 实验方法 1.2.1 AmB对脂肪酸延长酶缺陷酵母生长抑制的分析将不同基因型酵母(BY4741、elo1Δ、elo2Δ和elo3Δ)细胞转接到新配制的YPD培养基上进行活化。取已复苏的不同基因型酵母细胞约1×107个/mL (OD600约为0.5),10倍比进行梯度稀释后(稀释4−5个梯度),每个浓度梯度取5 μL稀释后的菌液,滴在含有0.1、0.5、1.0 μg/mL AmB的YPD培养基平板上,30 ℃培养3−4 d,以不含AmB的培养基作为对照,利用凝胶成像系统进行拍照观察。
1.2.2 Ny、Eco对脂肪酸延长酶缺陷酵母生长抑制的分析依据AmB对脂肪酸延长酶缺陷酵母生长抑制的分析方法,将新复苏的不同基因型酵母(BY4741、elo1Δ、elo2Δ和elo3Δ)细胞梯度稀释后滴在含2.5、10 μg/mL Ny和0.1、0.2 μg/mL Eco的YPD培养基平板上,30 ℃培养3−4 d,以不含Ny、Eco的培养基作为对照,利用凝胶成像系统进行拍照观察。
1.2.3 OLA胁迫下酵母麦角固醇的含量测定麦角固醇的提取及检测[13]:将培养好的酵母细胞5 000 r/min离心10 min收集菌体,得到的菌体重悬于无菌双蒸水中洗涤2次,称菌体的湿重;加入3 mL 25%的KOH乙醇溶液(25 g KOH溶于35 mL水中,用无水乙醇补足至100 mL),涡旋混匀1 min;将细胞悬液置于85 ℃水浴孵育1 h;冷却至室温后加入1 mL无菌双蒸水和3 mL正庚烷,涡旋充分混合3 min;将正庚烷层转移到新的离心管中,用无水乙醇适当稀释后,于分光光度计下测定281.5 nm和230 nm处的吸光度值。
样品中麦角固醇含量计算公式:
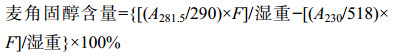
|
其中F是在无水乙醇中的稀释倍数,290和518分别是晶体麦角固醇和24(28)DHE的E值(cm−1)。
1.2.4 AmB与OLA的联合抑菌效应分析依据AmB对脂肪酸延长酶缺陷酵母生长抑制的分析方法,将新复苏不同基因型酵母(BY4741、elo1Δ、elo2Δ和elo3Δ)细胞梯度稀释后滴在含0.1、0.5 mmol/L OLA或0.2 μg/mL AmB与0、0.1、0.5 mmol/L OLA联用的YPD培养基平板上,30 ℃培养3−4 d,以不含OLA和AmB的YPD培养基作为对照,利用凝胶成像系统进行拍照观察。
1.2.5 盐离子NaCl对VLCFA合成缺陷细胞的影响将新复苏不同基因型酵母(BY4741、elo1Δ、elo2Δ和elo3Δ)细胞梯度稀释后,取5 μL稀释后的菌液,滴在含0.5、1.0、1.5 mol/L NaCl的YPD培养基平板上,30 ℃培养3−4 d,利用凝胶成像系统进行拍照观察。
1.2.6 酵母细胞的金属含量检测将实验酵母菌株(BY4741、elo1Δ、elo2Δ和elo3Δ)分别接种于YPD培养基中进行复苏,30 ℃、160 r/min培养过夜后转接到含新鲜培养基的培养瓶中,调整OD600为0.1,继续培养,当菌体密度达到OD600为0.5时,加0.0、0.2或0.3 μg/ml AmB进行处理。培养16 h后,将全部菌液8 000 r/min离心2 min后去上清,收集菌体,用PBS溶液洗3遍;将菌体置于恒温干燥箱中,50−60 ℃过夜烘干;用研钵将上述烘干的菌体研磨成粉末,称取相同质量的菌体(10−15 mg)装入2 mL EP管中;向EP管中加入600 μl的6 mol/L硝酸(5 mL 65%硝酸稀释于7 mL去离子水中);放入沸水浴中加热2 h进行裂解硝化,12 000 r/min离心10 min;上清用去离子水适当稀释后使用ICP-AES测定离子浓度。
1.2.7 数据统计分析文中实验数据重复3−5次,结果表示为平均值±标准差。野生型和突变体之间以及各基因型不同处理之间的比较,使用t检验和单因素方差分析(ANOVA)进行分析检验,以P < 0.05代表差异显著。
2 结果与分析 2.1 VLCFA合成缺陷菌株对AmB敏感性的检测细胞脂肪酸延长酶缺陷菌株对不同浓度AmB的敏感性检测结果如图 1所示。elo2Δ和elo3Δ对AmB呈现浓度相关的敏感性,而elo1Δ则对AmB不敏感。其中ELO1负责C14到C16之间的微粒体脂肪酸链的延伸,ELO2和ELO3负责将长链脂肪酸延长成VLCFA,实验结果显示VLCFA的合成在细胞对抗多烯类药物胁迫中起到重要作用。
|
| 图 1 VLCFA合成缺陷菌株对AmB的敏感性 Figure 1 The sensitivity of VLCFA synthetic-deficient strains to AmB 注:野生型酵母菌株BY4741和脂肪酸延长酶缺陷菌株elo1Δ、elo2Δ和elo3Δ通过10倍梯度稀释后,滴在含有0.0、0.1、0.5、1.0 μg/mL AmB培养基上. Note: The wild-type strain and fatty acid elongase-deficient strains elo1Δ, elo2Δ and elo3Δ were serially diluted (10-fold) and spotted on plates containing 0.0, 0.1, 0.5 or 1.0 μg/mL AmB. |
|
|
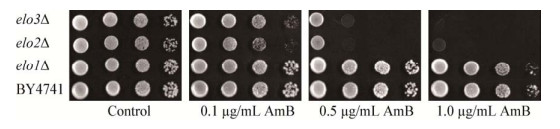
多烯类和咪唑类化合物主要通过直接或间接影响细胞质膜的功能而发挥抑菌活性,为了进一步分析细胞极长链脂肪酸的合成缺陷对菌株细胞膜稳定性的影响,将BY4741和elo1Δ、elo2Δ、elo3Δ通过10倍比梯度稀释后,滴在不同浓度的Ny和Eco的平板上。结果如图 2所示,elo2Δ和elo3Δ突变株对这两种抗生素同样表现出敏感性,进一步证实VLCFA合成对细胞膜的稳定性和以质膜为靶标抗生素的耐受性有重要作用。
|
| 图 2 VLCFA合成缺陷菌株对Ny和Eco的敏感性 Figure 2 The sensitivity of VLCFA synthetic-deficient strains to Ny and Eco 注:野生型酵母细胞BY4741、脂肪酸延长酶缺陷菌株elo1Δ、elo2Δ和elo3Δ通过10倍比梯度稀释后,滴在含有0.0、2.5、10.0 μg/mL Ny及0.1、0.2 μg/mL Eco的平板上. Note:The wild-type strain and fatty acid elongase-deficient strains elo1Δ, elo2Δ and elo3Δ were serially diluted (10-fold) and spotted on plates containing 0.0, 2.5, 10.0 μg/mL Ny or 0.1, 0.2 μg/mL Eco. |
|
|
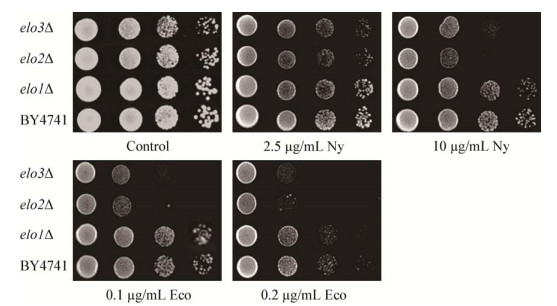
膜脂的组成决定了质膜的流动性和稳定性,非饱和脂肪酸的增加能促进膜的流动性[14]。非饱和脂肪酸OLA胁迫下对不同基因型酵母(BY4741,elo1Δ,elo2Δ和elo3Δ)生长的影响以及OLA胁迫下对AmB的响应分析如图 3所示。elo2Δ和elo3Δ突变菌株随着OLA浓度的增加,对AmB的敏感性增强;在低浓度的AmB培养基中同时加入不同浓度的OLA,也增加了elo2Δ和elo3Δ突变株的敏感性。这一结果表明OLA增加了VLCFA合成缺陷株对AmB的敏感性。
|
| 图 3 OLA对VLCFA合成缺陷株AmB敏感性的影响 Figure 3 The effect of OLA on the sensitivity of VLCFA synthetic-deficient strains to AmB 注:野生型酵母、脂肪酸延长酶缺陷菌株elo1Δ、elo2Δ和elo3Δ通过10倍比梯度稀释后,滴在含0.0、0.1、0.5 mmol/L OLA或0.2 μg/mL AmB与0.0、0.1、0.5 mmol/L OLA联用的平板上. Note: The wild-type strain and fatty acid elongase-deficient strains elo1Δ, elo2Δ and elo3Δ were serially diluted (10-fold) and spotted on plates containing 0.0, 0.1, 0.5 mmol/L OLA or 0.2 μg/mL AmB in combination with 0.0, 0.1, 0.5 mmol/L OLA. |
|
|
麦角甾醇是酵母细胞膜的一个重要组成部分,对维护质膜稳定性具有重要作用,是与动植物细胞的重要区别之一[15]。麦角甾醇的合成与脂肪酸的代谢途径有许多交叉,但脂肪酸延长酶缺陷是否影响麦角甾醇的合成并不清楚。本文结果显示脂肪酸延长酶,特别是极长链脂肪酸延长酶ELO2和ELO3缺陷造成麦角固醇的含量显著降低(不同酵母细胞的麦角固醇含量如图 4所示)。油酸处理后,野生型菌株中麦角固醇的含量显著下降,可能是细胞OLA含量急剧升高而其它成分相对下降引起的。

|
| 图 4 脂肪酸延长酶缺陷菌株在OLA处理与未处理下麦角固醇的含量测定 Figure 4 Determination of ergosterol content in OLA-treated and untreated strains 注:A:麦角固醇在紫外可见分光光度计下的扫描光谱图;B:野生型菌株和脂肪酸延长酶缺陷菌株在OLA处理与未处理下麦角固醇的含量. *:P < 0.05 vs.未处理的细胞;#:P < 0.05 vs.野生型细胞;##:P < 0.01 vs.野生型细胞. Note: A: Scanning spectra of ergosterol under UV-Vis spectrophotometer; B: Wild-type strains and fatty acid elongase deficient strains were detected for ergosterol content with or without OLA treatment. *: P < 0.05 vs. untreated cells respectively; #: P < 0.05 vs. wild-type strain; ##: P < 0.01 vs. wild-type strain. |
|
|
钠钾离子的平衡对于维持渗透压和细胞正常生理过程有重要意义,细胞对钠离子胁迫的敏感程度也反映了质膜的稳定性。用不同浓度的NaCl处理野生型酵母和不同脂肪酸延长酶缺陷菌株,结果如图 5所示。3种脂肪酸延长酶ELO1、ELO2和ELO3缺陷在0.5 mol/L钠盐胁迫下都具敏感表型,VLCFA合成缺陷elo2Δ和elo3Δ菌株对钠盐胁迫更敏感,反映了长链脂肪酸的合成,特别是VLCFA合成对维护细胞的离子平衡和质膜稳定性具有重要意义。
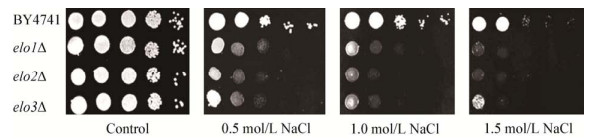
|
| 图 5 VLCFA合成缺陷菌株对AmB的敏感性 Figure 5 The sensitivity of VLCFA synthetic-deficient strains to NaCl 注:野生型酵母细胞、脂肪酸延长酶缺陷菌株elo1Δ、elo2Δ和elo3Δ通过10倍比梯度稀释后,滴在含0.0、0.5、1.0、1.5 mol/L NaCl平板上. Note: The wild-type strain and fatty acid elongase-deficient strains elo1Δ, elo2Δ and elo3Δ were serially diluted (10-fold) and spotted on plates containing 0.0, 0.5, 1.0 or 1.5 mol/L NaCl. |
|
|
钠钾离子平衡也是指示细胞膜稳定性和完整性的一个重要指标。利用ICP-ACE测量了经不同浓度AmB药物处理后不同基因型酵母细胞内钠离子和钾离子的水平,以研究VLCFA对维护细胞离子平衡的重要性。实验结果如图 6所示,野生型和突变菌株中钠的水平随AmB浓度增加而升高(图 6A),钾的水平随AmB浓度增加而降低(图 6B)。当AmB浓度达到0.3 μg/mL时,3种突变菌株Na+、K+水平的变化较野生型菌株更加明显,AmB对VLCFA合成缺陷菌株中Na+、K+水平较野生型菌株影响更大。数据表明多烯类药物AmB通过破坏细胞的离子平衡发挥抑菌活性,而长链脂肪酸的合成,特别是VLCFA合成对抵抗AmB胁迫、维护细胞膜的完整性、维持离子平衡有重要生物学意义。

|
| 图 6 AmB对VLCFA合成缺陷菌株钠钾离子水平的影响 Figure 6 Impacts of AmB on the content of sodium and potassium ion of VLCFA synthetic-deficient strains 注:A:0.0、0.2、0.3 μg/mL AmB处理之后,通过ICP-AES检测野生型菌株、elo1Δ、elo2Δ和elo3Δ突变菌株细胞内Na+含量; B:0.0、0.3、0.5 μg/mL AmB处理之后,通过ICP-AES检测上述菌株细胞内K+含量. Note: A: after the treatment with 0.0, 0.2 or 0.3 μg/mL AmB, the Na+ content was detected by ICP-AES in wild-type (BY4741), elo1Δ, elo2Δ and elo3Δ mutant cells; B: after the treatment with 0.0, 0.3 or 0.5 μg/mL AmB, the K+ content of the above samples was detected by ICP-AES. |
|
|
多烯类抗真菌药物,如AmB、Ny等是一类针对真菌的抗微生物多烯化合物,同时具有疏水性和亲水性。通常认为多烯类能选择性地与细胞膜的麦角固醇结合,在细胞膜上形成孔道,改变细胞膜的通透性,导致细胞内许多小分子物质如钾离子泄漏,破坏细胞的渗透平衡,最终导致细胞死亡而发挥作用[16-17]。临床上应用最广泛的多烯类药物是AmB。它也有一些副作用,比如肾脏的毒副作用,可能是由于麦角固醇和哺乳动物细胞膜中胆固醇之间的结构相似性[18]。唑类抗真菌药通过靶向由白色念珠菌erg11编码的羊毛甾醇14α去甲基化酶,从而抑制麦角固醇合成,导致真菌死亡,在许多真菌中,它们通过促进扩散进入真菌细胞[19],并通过吡咯环中的氮原子起作用,后者与位于ERG11活性位点的血红素中的铁原子结合[20]。这导致了羊毛甾醇14α去甲基化酶无法氧化激活,阻断麦角固醇的合成,致使毒性甾醇的积累[21]。这几种抗生素都是通过改变细胞膜的通透性,使细胞内含物外漏,从而起到杀菌的作用[16]。elo2Δ和elo3Δ突变株对AmB极其敏感,而野生型菌株和elo1Δ突变株对AmB不敏感(图 1)。同时对于其它多烯类药物如Ny和唑类药物Eco (图 2),elo2Δ和elo3Δ突变株均表现出明显的敏感性。表明VLCFA的合成水平与真菌对多烯类药物的敏感性有密切的关系,原因可能有两个方面:一方面细胞膜的流动性与膜脂组成有关,膜脂VLCFA含量越高越稳定[14],而VLCFA的合成缺陷造成细胞膜膜脂VLCFA比例相对降低[2],膜的流动性提高,稳定性降低;另一方面,脂肪酸延长酶缺陷膜脂麦角固醇合成受到影响,尤其VLCFA延长酶缺陷elo2Δ和elo3Δ的麦角固醇含量与对照相比显著减少(图 4B),与以往研究VLCFA延长酶与膜脂麦角固醇和磷脂的代谢密切相关[2, 22]是一致的。总之,脂肪酸延长酶,尤其是VLCFA延长酶ELO2和ELO3在维持细胞膜稳定性中起到重要作用。
脂肪酸延长酶,尤其是VLCFA延长酶缺陷elo2Δ和elo3Δ对OLA敏感,当OLA与AmB共同处理酵母细胞时,油酸加重了elo2Δ和elo3Δ对AmB的敏感程度(图 3)。饱和脂肪酸与不饱和脂肪酸对酵母的影响与对动物或各种细胞株的作用是不同的。前期我们用棕榈酸和OLA处理野生型和脂肪酸延长酶缺陷的酵母细胞,发现棕榈酸对野生型和突变株的生长均没有明显影响,而突变株对不饱和脂肪酸极为敏感[23],造成这种差异的原因可能与细胞内脂肪酸的去饱和能力有关。在人的动脉内皮细胞高表达脂肪酸去饱和酶SCD1能够补救棕榈酸引起的细胞死亡[24],而酵母中脂肪酸去饱和酶OLE1缺失后会对外源饱和脂肪酸敏感,而不饱和脂肪酸的添加能够改善细胞生长状况[25]。Lockshon等对OLA敏感菌株的筛选,发现一些过氧化物酶体的蛋白具有OLA高度敏感的表型,可能是由于不能氧化过多游离脂肪酸,导致膜磷脂脂肪酸组成失衡[26]。OLA加重了VLCFA延长酶缺陷菌株AmB的敏感性,一方面可能是elo2Δ和elo3Δ影响细胞饱和脂肪酸与不饱和脂肪酸的比例来影响细胞对OLA的敏感水平;另一方面,膜脂不饱和脂肪酸的含量影响膜的流动性[27],OLA处理提高了不饱和脂肪酸的比例,相对降低了麦角固醇含量,细胞膜的不稳定性提高,加重了elo2Δ和elo3Δ缺陷菌株AmB的敏感程度。
钠钾离子平衡是维护细胞正常生理的必要条件,也是检测细胞膜稳定性和完整性的重要参数[28]。脂肪酸延长酶的缺陷导致其对Na+非常敏感(图 5),这可能是由于它们改变了细胞VLCFA的分布和比例,细胞膜不稳定性提高,打破了细胞内钠钾离子的平衡,抑制细胞生长[2]。盐胁迫会引起酵母细胞生理代谢紊乱,致使生长受到明显抑制,抑制程度取决于胁迫的强度和酵母细胞的耐盐能力。据此可以推测脂肪酸延长酶在酵母抵抗盐胁迫方面起着保持钠钾离子平衡的作用。Quist等在拟南芥中对ELO样蛋白HOS3的研究支持本文的研究结果,渗透响应株HOS3的根系在钠盐胁迫下较正常根系生长稍快,并且hos3能回补elo2、elo3缺陷株的功能[29]。钠离子与钾离子的竞争性作用使钠钾水平呈明显的负相关,用AmB处理的不同细胞中,缺陷菌株中钠钾离子水平的变化比野生型菌株更明显(图 6),这可能是由于脂肪酸延长酶的缺陷提高了细胞膜的通透性,使钠钾离子平衡容易被破坏,用AmB处理进一步损伤了细胞膜的完整性,破坏了离子平衡,所以缺陷菌株中离子的变化波动更大。以上结果证明了细胞VLCFA延长酶参与维持细胞膜稳定性的重要作用,是潜在抗真菌治疗的靶点。
| [1] |
Tvrdik P, Westerberg R, Silve S, et al. Role of a new mammalian gene family in the biosynthesis of very long chain fatty acids and sphingolipids[J]. Journal of Cell Biology, 2000, 149(3): 707-718. DOI:10.1083/jcb.149.3.707 |
| [2] |
Wang Q, Du XX, Ma K, et al. A critical role for very long-chain fatty acid elongases in oleic acid-mediated Saccharomyces cerevisiae cytotoxicity[J]. Microbiological Research, 2018, 207: 1-7. DOI:10.1016/j.micres.2017.11.001 |
| [3] |
Toke DA, Martin CE. Isolation and characterization of a gene affecting fatty acid elongation in Saccharomyces cerevisiae[J]. Journal of Biological Chemistry, 1996, 271: 18413-18422. DOI:10.1074/jbc.271.31.18413 |
| [4] |
Tehlivets O, Scheuringer K, Kohlwein SD. Fatty acid synthesis and elongation in yeast[J]. Biochimica Et Biophysica Acta, 2007, 1771(3): 255-270. DOI:10.1016/j.bbalip.2006.07.004 |
| [5] |
Ohanian J, Ohanian V. Sphingolipids in mammalian cell signalling[J]. Cellular & Molecular Life Science, 2001, 58(14): 2053-2068. |
| [6] |
Schneiter R, Brügger B, Amann CM, et al. Identification and biophysical characterization of a very-long-chain-fatty-acid-substituted phosphatidylinositol in yeast subcellular membranes[J]. Biochemical Journal, 2004, 381(3): 941-949. |
| [7] |
Lorenz RT, Parks LW. Physiological effects of fenpropimorph on wild-type Saccharomyces cerevisiae and fenpropimorph-resistant mutants[J]. Antimicrobial Agents & Chemotherapy, 1991, 35(8): 1532-1537. |
| [8] |
David D, Sundarababu S, Gerst JE. Involvement of long chain fatty acid elongation in the trafficking of secretory vesicles in yeast[J]. Journal of Cell Biology, 1998, 143(5): 1167-1182. DOI:10.1083/jcb.143.5.1167 |
| [9] |
Eisenkolb M, Zenzmaier C, Leitner E, et al. A specific structural requirement for ergosterol in long-chain fatty acid synthesis mutants important for maintaining raft domains in yeast[J]. Molecular Biology of the Cell, 2002, 13(12): 4414-4428. DOI:10.1091/mbc.e02-02-0116 |
| [10] |
Jiang ZL, Lin JQ. New progress in research on polyene antifungal drugs[J]. China Pharmaceuticals, 2006, 15(7): 62-63. (in Chinese) 蒋正立, 林建群. 多烯类抗真菌药物的研究新进展[J]. 中国药业, 2006, 15(7): 62-63. DOI:10.3969/j.issn.1006-4931.2006.07.053 |
| [11] |
Kaiser C, Michaelis S, Mitchell A. Methods in Yeast Genetics: A Cold Spring Harbor Laboratory Course Manual[M]. New York: Cold Spring Harbor Laboratory Press, 1994: 232.
|
| [12] |
Kurat CF, Natter K, Petschnigg J, et al. Obese yeast: triglyceride lipolysis is functionally conserved from mammals to yeast[J]. Journal of Biological Chemistry, 2006, 281(1): 491-500. DOI:10.1074/jbc.M508414200 |
| [13] |
Arthington-Skaggs BA, Jradi H, Desai T, et al. Quantitation of ergosterol content: novel method for determination of fluconazole susceptibility of Candida albicans[J]. Journal of Clinical Microbiology, 1999, 37(10): 3332-3337. |
| [14] |
Wang XY. Effect of salt stress and aluminum stress on the composition and content of membrane lipids in rice[D]. Beijing: Master's Thesis of University of Chinese Academy of Sciences, 2016 (in Chinese) 王鑫月.盐胁迫和铝胁迫对水稻膜脂组分和含量的影响[D].北京: 中国科学院大学硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-80129-1016758117.htm |
| [15] |
Shreaz S, Shiekh RA, Raja V, et al. Impaired ergosterol biosynthesis mediated fungicidal activity of Co(Ⅱ) complex with ligand derived from cinnamaldehyde[J]. Chemico-Biological Interactions, 2016, 247: 64-74. DOI:10.1016/j.cbi.2016.01.015 |
| [16] |
Gruszecki WI, Gagoś M, Hereć M, et al. Organization of antibiotic amphotericin B in model lipid membranes. A mini review[J]. Cellular & Molecular Biology Letters, 2003, 8: 161-170. |
| [17] |
Ostrosky-Zeichner L, Casadevall A, Galgiani JN, et al. An insight into the antifungal pipeline: selected new molecules and beyond[J]. Nature Reviews Drug Discovery, 2010, 9(9): 719-727. DOI:10.1038/nrd3074 |
| [18] |
Fanos V, Cataldi L. Amphotericin B-induced nephrotoxicity: a review[J]. Journal of Chemotherapy, 2000, 12(6): 463-470. DOI:10.1179/joc.2000.12.6.463 |
| [19] |
Mansfield BE, Oltean HN, Oliver BG, et al. Azole drugs are imported by facilitated diffusion in Candida albicans and other pathogenic fungi[J]. PLoS Pathogens, 2010, 6(9): e1001126. DOI:10.1371/journal.ppat.1001126 |
| [20] |
White TC, Marr KA, Bowden RA. Clinical, cellular, and molecular factors that contribute to antifungal drug resistance[J]. Clinical Microbiology Reviews, 1998, 11(2): 382-402. DOI:10.1128/CMR.11.2.382 |
| [21] |
Lupetti A, Danesi R, Campa M, et al. Molecular basis of resistance to azole antifungals[J]. Trends in Molecular Medicine, 2002, 8(2): 76-81. DOI:10.1016/S1471-4914(02)02280-3 |
| [22] |
Hama K, Fujiwara Y, Morita M, et al. Profiling and imaging of phospholipids in brains of Abcd1-deficient mice[J]. Lipids, 2018, 53(1): 85-102. |
| [23] |
Cheng X, Du XX, Wang HD, et al. Study on the response of fatty acid elongase defects to lipid metabolism and oleic acid stress in Saccharomyces cerevisiae[J]. Chinese Journal of Cell Biology, 2018, 40(9): 1494-1503. (in Chinese) 程迅, 杜秀秀, 王寒冬, 等. 脂肪酸延长酶缺陷对酵母细胞脂质代谢及油酸胁迫响应的影响[J]. 中国细胞生物学报, 2018, 40(9): 1494-1503. |
| [24] |
Peter A, Weigert C, Staiger H, et al. Induction of stearoyl-CoA desaturase protects human arterial endothelial cells against lipotoxicity[J]. American Journal of Physiology-Endocrinology and Metabolism, 2008, 295(2): E339-E349. DOI:10.1152/ajpendo.00022.2008 |
| [25] |
Nguyen LN, Nosanchuk JD. Lipid droplet formation protects against gluco/lipotoxicity in Candida parapsilosis: an essential role of fatty acid desaturase Ole1[J]. Cell Cycle, 2011, 10(18): 3159-3167. DOI:10.4161/cc.10.18.16932 |
| [26] |
Lockshon D, Surface LE, Kerr EO, et al. The sensitivity of yeast mutants to oleic acid implicates the peroxisome and other processes in membrane function[J]. Genetics, 2007, 175(1): 77-91. |
| [27] |
Zhai ZH, Wang XZ, Ding MX. Cell Biology[M]. 4th ed. Beijing: Higher Education Press, 2011: 62. (in Chinese) 翟中和, 王喜忠, 丁明孝. 细胞生物学[M]. 4版. 北京: 高等教育出版社, 2011: 62. |
| [28] |
Sun TH, Zhao CX, Jin FX. Effect of several kinds of inorganic ions on yeasts metabolism and mechanisms of acid producing in fermentation[J]. Journal of Dalian Institute of Light Industry, 2002, 21(1): 29-32. (in Chinese) 孙廷宏, 赵长新, 金凤燮. 几种无机离子对啤酒酵母生理代谢的影响及发酵过程的产酸机制[J]. 大连轻工业学院学报, 2002, 21(1): 29-32. DOI:10.3969/j.issn.1674-1404.2002.01.010 |
| [29] |
Quist TM, Sokolchik I, Shi HZ, et al. HOS3, an ELO-like gene, inhibits effects of ABA and implicates a S-1-P/ceramide control system for abiotic stress responses in Arabidopsis thaliana[J]. Molecular Plant, 2009, 2(1): 138-151. DOI:10.1093/mp/ssn085 |
 2019, Vol. 46
2019, Vol. 46




