扩展功能
文章信息
- 徐志周, 王明元, 杜锦鹏, 刘建福, 欧树文, 秦紫艺, 杨可然
- XU Zhi-Zhou, WANG Ming-Yuan, DU Jin-Peng, LIU Jian-Fu, OU Shu-Wen, QIN Zi-Yi, YANG Ke-Ran
- 一株香蕉枯萎病拮抗菌HQB-1的分离鉴定及其发酵条件优化
- Isolation, identification and fermentation optimization of an antagonistic bacterial strain HQB-1 against banana wilt disease
- 微生物学通报, 2019, 46(7): 1611-1618
- Microbiology China, 2019, 46(7): 1611-1618
- DOI: 10.13344/j.microbiol.china.180980
-
文章历史
- 收稿日期: 2018-12-02
- 接受日期: 2019-03-15
- 网络首发日期: 2019-04-19
香蕉枯萎病是由尖孢镰刀菌古巴专化型(Fusarium oxysporum f. sp. cubense,Foc)引起的一种真菌毁灭性土传病害,在世界范围内普遍发生,尤以Foc 4号生理小种入侵危害最为严重,致使香蕉产量大幅减少[1-3]。目前防治香蕉枯萎病的方法主要有化学防治、抗病育种、农业防控措施及生物防治等[4-5],其中生防菌防治因其来源广泛、生长繁殖快、环境友好、持续高效等优点近年来逐渐成为研究热点。已有许多研究获得有效防控枯萎病发生的生防菌,包括放线菌、芽孢杆菌、青霉菌和伯克霍尔德菌等[6-9]。但是,随着菌种保藏时间的延长或菌种的多次转接传代,菌种本身所具有的优良遗传性状可能得到延续,也可能发生变异退化,因此需要不断筛选补充新的优良拮抗菌株[10]。
已有研究表明,在不同植物根际分离得到多种有益微生物,这些微生物在促进植物生长、抑制病害发生、调节根际微生态结构等各个方面得到广泛的应用[11]。因此,从香蕉生态系统中分离筛选对香蕉枯萎病菌具有拮抗作用的生防菌,并进一步利用拮抗菌开展对香蕉枯萎病的生物防治是一种较为理想的控制植物病害的方法。此外,为了能够将生防菌更好地应用到田间农业生产上,发酵培养基和培养条件的筛选和优化必不可少。郝林华等通过单因素及正交试验方法优化了枯草芽孢杆菌的发酵条件,极大地提高了菌体数量[12],洪鹏等通过优化芽孢杆菌HF-01发酵培养基成分和培养条件,显著提高了菌株的抑菌活性,降低了柑桔绿霉病的发病率[13]。本研究从香蕉根际土壤中筛选分离得到一株对香蕉枯萎病有显著抑制作用的HQB-1,通过形态学特征、生理生化指标检测及16S rRNA基因序列分析将其初步鉴定为Burkholderia stagnalis,并结合单因素试验及正交设计探究不同培养环境对HQB-1菌株生长量及抑菌效率的影响。
1 材料与方法 1.1 供试材料供试病原菌:香蕉枯萎病致病菌(Fusarium oxysporum f. sp. Cubense Tropical Race 4,Foc 4)由广东省农业科学院果树研究所提供,华侨大学园艺植物生物学课题组保存。
供试土壤:福建省漳州市香蕉园根际土壤。
供试培养基:PDA培养基(g/L):马铃薯200.0,葡萄糖20.0,琼脂18.0,pH自然;NA培养基(g/L):牛肉膏3.0,蛋白胨10.0,NaCl 5.0,琼脂15.0,pH自然;NB培养基(g/L):牛肉膏3.0,蛋白胨10.0,NaCl 5.0,pH 7.0–7.2。上述培养基灭菌条件均为0.1 MPa,20 min。
主要试剂和仪器:细菌基因组DNA小量纯化试剂盒、Premix Taq (TaKaRa Taq Version 2.0)试剂盒,宝生物工程(大连)有限公司;葡萄糖、牛肉膏、氯化钠等试剂,国药集团化学制剂有限公司。基因扩增仪,东胜创新生物科技有限公司;立式振荡培养箱,上海旻泉仪器有限公司;紫外可见分光光度计,上海美谱达仪器有限公司。
1.2 拮抗菌的分离与筛选 1.2.1 菌株的分离将采集后的土样室内自然晾干后破碎,过100目筛。称取10 g过筛土样,加无菌水1 L,25 ℃、180 r/min振荡30 min,依次稀释浓度至10-3、10-4、10-5、10-6、10-7、10-8 g/L,充分混匀。分别取1 mL稀释液加入冷却至50 ℃左右的PDA培养基中,轻轻摇匀,在28 ℃下培养3-5 d,挑取不同类型的菌落在新的平板上划线纯化培养。
1.2.2 拮抗菌初筛用打孔器(直径6 mm)在已活化的香蕉枯萎病菌平板打孔,取一菌块接种于新的PDA平板中央,28 ℃下恒温培养1 d,将分离得到的菌落纯培养物均匀点种于病原菌块四周,28 ℃恒温培养5 d后,挑选有抑制病原菌生长效果的菌落划线接入试管斜面,编号记录。
1.2.3 拮抗菌复筛采用平板对峙法测定拮抗菌抑菌效率。用打孔器(直径为6 mm)在已活化的病原菌平板打孔,取一菌块置于新的PDA平板中央。在距离菌块中央四周1.5 cm处分别打4块相同直径的琼脂孔,取各待测菌28 ℃、180 r/min发酵24 h种子液50 μL,轻轻滴加在琼脂孔中,以相同条件下无菌发酵液为对照,各设3个重复。待对照平板菌丝长满整个培养皿后,观察待测菌对病原菌生长的抑制情况。将抑制效果最好的拮抗菌命名为HQB-1,与20%甘油混合后置于-20 ℃下保存。
抑菌率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.3 拮抗菌的鉴定 1.3.1 形态结构和生理生化特性测定HQB-1菌体形态特征和生理生化特性测定参照文献[13-15]进行。
1.3.2 16S rRNA基因鉴定HQB-1菌株在NB培养基30 ℃、180 r/min振荡培养至对数生长期,10 000 r/min离心5 min收集菌体。使用试剂盒提取菌体基因组DNA,PCR体系及条件参照俞鲁等[10]的方法,选择通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACCCTT-3′)进行PCR扩增,PCR产物经纯化后测序。将测序结果与GenBank数据库中的已有序列进行比对,通过MEGA 7.0软件进行序列分析,并采用Neighbor-Joining法构建系统发育树[16],Bootstrap自检值设为1 000,确定该菌株的分类地位。
1.4 HQB-1菌株发酵条件优化 1.4.1 单因素试验法筛选最适培养条件以NB培养基为对照,采用单因素试验法分别研究不同碳源(葡萄糖,蔗糖,可溶性淀粉,甘露醇,牛肉膏)、不同氮源(蛋白胨,酵母浸粉,氯化铵,硫酸铵,硝酸铵,尿素)、不同无机盐(氯化钠,氯化钙,硫酸锌,硫酸铜,硫酸镁)、不同培养时间(12-96 h)、不同接种量(0.25%-8%)、不同温度(24-39 ℃)、不同转速(120-220 r/min)、不同pH (5.0-9.0)下对HQB-1菌株生长量(OD600)和抑菌率的影响。
1.4.2 正交试验设计确定最佳组合根据单因素试验结果,从中选择对拮抗菌HQB-1菌体浓度及抑菌活性影响较为显著的因子(碳源、氮源、温度和pH),使用正交设计助手Ⅱ软件,选择L9(34)正交表,设计4因素3水平的正交试验,以进一步确定影响HQB-1发酵过程中菌株有效活菌数及抑菌活性的最佳组合。
1.5 数据处理使用Microsoft Excel 2007和SPSS 19.0统计软件进行数据处理与分析。
2 结果与分析 2.1 拮抗菌的分离与筛选经过分离和筛选,得到对香蕉枯萎病菌有明显拮抗作用的菌株共11株,通过挑取单菌落多次划线纯化后,其中细菌HQB-1菌株抑菌率最高,抑菌效果如图 1所示。HQB-1菌株在NB培养基30 ℃、180 r/min条件下培养24 h,其OD600值为1.251,抑菌率为9.18%。
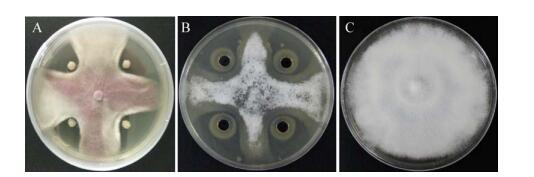
|
| 图 1 HQB-1菌株的拮抗效果 Figure 1 Antagonistic effect of strain HQB-1 注:A:点种拮抗效果;B:发酵液拮抗效果;C:对照. Note: A: Antagonistic effect of plate confrontation; B: Antagonistic effect of fermentation broth; C: Control. |
|
|
HQB-1菌株在NA平板上30 ℃培养24 h后,可形成直径1 mm-2 mm菌落,菌落呈圆形、白色、表面光滑、有扫描光泽、边缘整齐、不透明,不产生荧光(图 2A)。在扫描电子显微镜下,细菌形态呈直杆状,菌体大小为(1.2-2.5) μm×(0.5-1.0) μm (图 1B)。

|
| 图 2 HQB-1菌株形态特征 Figure 2 Features of strain HQB-1 注:A:NA平板上单菌落形态;B:扫描电子显微镜下菌体形态. Note: A: Single colony morphology on NA; B: Morphology of strain HQB-1 using scanning electron microscopy. |
|
|
HQB-1菌株生理生化指标:革兰氏阴性菌,H2O2酶、甲基红、明胶液化、丙酮胺酸脱氨等反应呈阳性,V-P、肌酸、淀粉水解、脲酶、硫化氢等试验检测呈阴性,可利用葡萄糖、蔗糖、甘露醇等多种碳源,在5% NaCl环境下不能生长。
2.2.2 分子鉴定测序结果显示,HQB-1菌株的16S rRNA基因PCR扩增产物大小为1 471 bp,序列提交至GenBank中获得登录号为MK612762,在数据库中进行BLAST比对,结果显示HQB-1菌株16S rRNA基因序列与Burkholderia stagnalis相似性高达99.65%。利用MEGA 7.0软件分析其系统发育进化关系,结果显示HQB-1菌株与Burkholderia stagnalis聚在同一系统分支且支持率为89% (图 3)。

|
| 图 3 基于16S rRNA基因序列的系统发育进化树 Figure 3 Phylogenetic tree of strain HQB-1 based on 16S rRNA gene sequence analysis 注:分支上的数字表示构建系统进化树时1 000次计算形成该节点的百分比;括号内数值为GenBank登录号;标尺0.001代表 0.2%的16S rRNA基因序列的进化差异. Note: The bootstrap values (%) presented at the branches were calculated from 1 000 replications; Numbers in parentheses are GenBank accession numbers; The scale bar 0.001 represents 2 nucleotide substitutions per 1 000 nucleotides. |
|
|
单因素试验结果显示不同培养基组分及培养环境对HQB-1菌株生长量及抑菌率均有不同程度的影响(图 4)。对比OD600值和抑菌率可知HQB-1菌株的最适培养基为:碳源选择牛肉膏,氮源选择酵母浸粉,无机盐选择氯化钠。最佳培养条件为:培养时间24 h,接种量1% (体积比),温度33 ℃,转速200 r/min,pH 7.0。由图 4可知,HQB-1菌株培养时间和接种量对菌体量影响不大,48 h后缓慢进入衰退期,但同时抑菌率都明显下降;HQB-1菌株在24-33 ℃都能正常生长,菌体量和抑菌率随温度升高而增大,但在39 ℃下致死;转速对菌株生长和抑菌率影响差异不大,最佳转速为200 r/min,OD600可达1.692,抑菌率为19.25%;HQB-1菌株适合在中性(pH 7.0)环境下培养,过酸过碱都会使菌株生长受到抑制甚至致死。
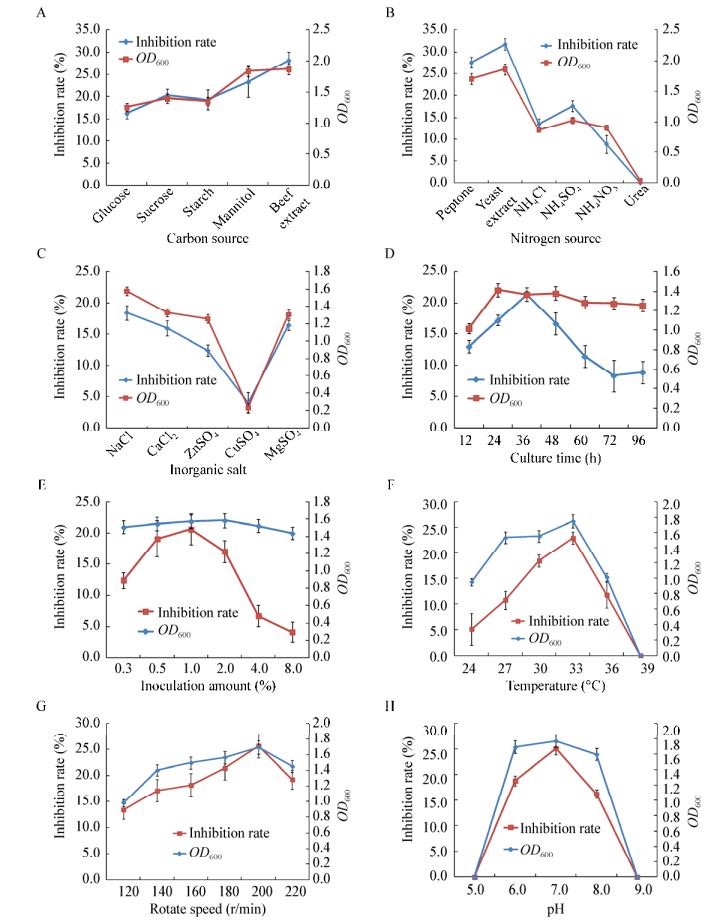
|
| 图 4 不同培养条件对HQB-1菌株生长量及抑菌率的影响 Figure 4 Effects of different culture conditions on growth and inhibition rate of HQB-1 注:A:不同碳源;B:不同氮源;C:不同无机盐;D:不同培养时间;E:不同接种量;F:不同温度;G:不同转速;H:不同pH. Note: A: Different carbon source; B: Different nitrogen source; C: Different inorganic salt; D: Different culture time; E: Different inoculation amount; F: Different temperature; G: Different rotate speed; H: Different pH. |
|
|
根据上述单因素试验结果,各因素对HQB-1菌株生物量及抑菌率都有影响,但影响较为显著的因子主要有碳源(A)、氮源(B)、培养温度(C)和pH (D)。采用L9(34)正交表,设计4因素3水平的正交试验,以进一步确定影响HQB-1菌株发酵各因子的最佳配比(表 1)。
| 编号 Number |
因素Factors | 抑菌率 Inhibition rate (%) |
|||
| 碳源浓度 Carbon source concentration (g/L) |
氮源浓度 Nitrogen concentration (g/L) |
培养温度 Temperature (℃) |
pH | ||
| A | B | C | D | ||
| 1 | 1 (2.5) | 1 (2.5) | 1 (27) | 1 (6.0) | 6.16 |
| 2 | 1 (2.5) | 2 (5) | 2 (30) | 2 (7.0) | 10.43 |
| 3 | 1 (2.5) | 3 (10) | 3 (33) | 3 (8.0) | 5.69 |
| 4 | 2 (5) | 1 (2.5) | 2 (30) | 3 (8.0) | 7.11 |
| 5 | 2 (5) | 2 (5) | 3 (33) | 1 (6.0) | 8.53 |
| 6 | 2 (5) | 3 (10) | 1 (27) | 2 (7.0) | 34.60 |
| 7 | 3 (10) | 1 (2.5) | 3 (33) | 2 (7.0) | 4.74 |
| 8 | 3 (10) | 2 (5) | 1 (27) | 3 (8.0) | 15.17 |
| 9 | 3 (10) | 3 (10) | 2 (30) | 1 (6.0) | 13.74 |
| K1 | 22.27 | 18.01 | 55.92 | 28.44 | ∑M=106.17 |
| K2 | 50.24 | 34.12 | 31.28 | 49.76 | |
| K3 | 33.65 | 54.03 | 18.96 | 27.96 | |
| R | 27.96 | 36.02 | 36.97 | 21.80 | |
R值(极差)的大小顺序(RC > RB > RA > RD)表明,影响菌株HQB-1发酵液抑菌活性的因子强度由强到弱依次为培养温度、氮源浓度、碳源浓度和pH。K值反映了每个因素在3个不同水平中抑菌能力的差异。从4个因素各自的K1、K2、K3中选择最大值,可以获得每个因素的最优水平;每个因素的最优水平组合在一起即为4因素的最优组合。因此,结合K值,适合HQB-1菌株发酵的最优组合为碳源浓度(5.0 g/L)、氮源浓度(10.0 g/L)、培养温度(27 ℃)、pH为7.0。
3 讨论与结论伯克霍尔德菌(Burkholderia)属于革兰氏阴性细菌,广泛存在于土壤、植物根际、水等多种生态环境。Burkholderia cepacia complex (Bcc)是其中重要的代表类群,目前已有研究表明其在生物固氮、生物修复、促进植物生长以及植物病害生物防治等方面显示了应用潜力,具有重要的经济和生态价值[17]。一些优势菌株已作为生物农药投入到植物病害的防治中,如在美国注册的有“Blue Circle”、“Type Wisconsin”、“Deny”和“Intercepty’等[18],但在我国关于Bcc作生防菌的研究却鲜有报道。本研究从香蕉根际土壤中分离筛选到一株具有优良防效的拮抗菌HQB-1,并通过形态学特征、生理生化指标检测及16S rRNA基因序列分析将其初步鉴定为Burkholderia stagnalis。
众多研究表明,优化生防菌培养液组分及培养条件可以提高菌体的生长量[12, 19-20]、抗菌活性物质的产量及生防效果[21-22]。本研究将HQB-1的生长量及抑菌效率作为主要考量指标,从培养基成分及培养环境对菌株发酵条件进行优化。从单因素试验的结果可以看出,碳源、氮源、温度、pH等因素对HQB-1菌株生长和抑菌效率影响较大,而发酵时间和接种量对菌体生物量和抑菌率的影响并不一致,其原因可能为不同环境下HQB-1菌株产生抑菌物质的能力有差异,菌体生长量高不代表抑菌效率高,因此,探究最佳的发酵条件对后续研究及推广应用至关重要。
正交试验设计是研究多因素、多水平的一种科学的试验设计方法,可研究其间的交互作用。Zhang等通过正交试验设计确定了哈茨木霉TS1的最佳培养条件,在该条件下哈茨木霉的孢子量较优化前提高了1.46倍[23],Liu等采用响应面法对培养基中Mg2+、Fe2+和Zn2+ 3种金属离子的浓度进行优化,显著提高了拮抗酵母Candida diversa的生物量及生防效率[24]。根据单因素试验结果,本研究选取了对HQB-1菌株生长量及抑菌率影响较大的因素设计了4因素3水平的正交试验。试验结果表明,采用优化条件培养HQB-1菌株,有效活菌数量明显增加,OD600由优化前的1.251提高至1.881;抑菌率较优化前明显提高,由优化前的9.18%提高至34.60%,提高了约2.31倍,这也为下一步抑菌活性物质的分离鉴定以及田间实际应用提供了理论参考。
| [1] |
Hwang SC, Ko WH. Cavendish banana cultivars resistant to Fusarium wilt acquired through somaclonal variation in Taiwan[J]. Plant Disease, 2004, 88(6): 580-588. DOI:10.1094/PDIS.2004.88.6.580 |
| [2] |
Ploetz RC. Fusarium wilt of banana is caused by several pathogens referred to as Fusarium oxysporum f. sp. cubense[J]. Phytopathology, 2006, 96(6): 653-656. DOI:10.1094/PHYTO-96-0653 |
| [3] |
Wang ZZ. Advances in research on banana wilt and its control[J]. Plant Quarantine, 2006, 20(3): 198-200. (in Chinese) 王振中. 香蕉枯萎病及其防治研究进展[J]. 植物检疫, 2006, 20(3): 198-200. DOI:10.3969/j.issn.1005-2755.2006.03.038 |
| [4] |
Di Pietro A, Huertas-González MD, Gutierrez-Corona JF, et al. Molecular characterization of a subtilase from the vascular wilt fungus Fusarium oxysporum[J]. Molecular Plant-Microbe Interactions, 2001, 14(5): 653-662. DOI:10.1094/MPMI.2001.14.5.653 |
| [5] |
Huang JF, Zhang FB, Pang YW, et al. Inhibition of banana Fusarium wilt by two biocontrol agents[J]. Microbiology China, 2017, 44(4): 835-844. (in Chinese) 黄建凤, 张发宝, 逄玉万, 等. 两株香蕉枯萎病拮抗细菌的筛选及抑菌机理[J]. 微生物学通报, 2017, 44(4): 835-844. |
| [6] |
Zhang N, Wu K, He X, et al. A new bioorganic fertilizer can effectively control banana wilt by strong colonization with Bacillus subtilis N11[J]. Plant and Soil, 2011, 344(1/2): 87-97. |
| [7] |
Jung BK, Hong SJ, Park GS, et al. Isolation of Burkholderia cepacia JBK9 with plant growth-promoting activity while producing pyrrolnitrin antagonistic to plant fungal diseases[J]. Applied Biological Chemistry, 2018, 61(2): 173-180. |
| [8] |
Waweru B, Turoop L, Kahangi E, et al. Non-pathogenic Fusarium oxysporum endophytes provide field control of nematodes, improving yield of banana (Musa sp.)[J]. Biological Control, 2014, 74: 82-88. DOI:10.1016/j.biocontrol.2014.04.002 |
| [9] |
Zhang XF, Xiang L, Wang YF, et al. Identification of Penicillium oxalicum A1 strain and antagonistic effects on four species of Fusarium pathogen of apple[J]. Acta Horticulturae Sinica, 2016, 43(5): 841-852. (in Chinese) 张先富, 相立, 王艳芳, 等. 草酸青霉A1菌株的鉴定及对苹果4种镰孢病菌的拮抗作用[J]. 园艺学报, 2016, 43(5): 841-852. |
| [10] |
Yu L, Ling N, Zhang N, et al. Isolation, identification and biocontrol effect of antagonistic bacteria against Fusarium oxysporum f. sp. cubense[J]. Journal of Nanjing Agricultural University, 2012, 35(4): 81-86. (in Chinese) 俞鲁, 凌宁, 张楠, 等. 香蕉枯萎病拮抗菌的筛选鉴定及其生防效果[J]. 南京农业大学学报, 2012, 35(4): 81-86. |
| [11] |
Lugtenberg B, Kamilova F. Plant-growth-promoting rhizobacteria[J]. Annual Review of Microbiology, 2009, 63(1): 541-556. DOI:10.1146/annurev.micro.62.081307.162918 |
| [12] |
Hao LH, Sun PX, Jiang ZB, et al. Liquid fermentation conditions of Bacillus subtilis[J]. Journal of Shanghai Jiaotong University (Agricultural Science), 2006, 24(4): 380-385. (in Chinese) 郝林华, 孙丕喜, 姜振波, 等. 枯草芽孢杆菌(Bacillus subtilis)液体发酵条件[J]. 上海交通大学学报:农业科学版, 2006, 24(4): 380-385. |
| [13] |
Hong P, An GD, Hu MY, et al. Optimizing fermentation condition for Bacillus amyloliquefaciens HF-01[J]. Chinese Journal of Biological Control, 2013, 29(4): 569-578. (in Chinese) 洪鹏, 安国栋, 胡美英, 等. 解淀粉芽孢杆菌HF-01发酵条件优化[J]. 中国生物防治学报, 2013, 29(4): 569-578. |
| [14] |
Dong XZ, Cai MY. Common Bacterial System Identification Manual[M]. Beijing: Science Press, 2001: 166-171. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 166-171. |
| [15] |
Zhao B, He SJ. Microbiology Experiment[M]. Beijing: Science Press, 2002: 26-120. (in Chinese) 赵斌, 何绍江. 微生物学实验[M]. 北京: 科学出版社, 2002: 26-120. |
| [16] |
Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J]. Molecular Biology and Evolution, 1987, 4(4): 406-425. |
| [17] |
Sijam K, Dikin A. Biochemical and physiological characterization of Burkholderia cepacia as biological control agent[J]. International Journal of Agriculture & Biology, 2005, 7(3): 385-388. |
| [18] |
Ren JH, Li H, Liu H, et al. Influence of Burkholderia pyrrocinia JK-SH007 on the microbial population and functional diversity of microbial communities in the rhizosphere soil of poplar[J]. Scientia Silvae Sinicae, 2016, 52(5): 126-133. (in Chinese) 任嘉红, 李浩, 刘辉, 等. 吡咯伯克霍尔德氏菌JK-SH007对杨树根际微生物数量及功能多样性的影响[J]. 林业科学, 2016, 52(5): 126-133. |
| [19] |
Li H, Ren JH, Ye JR. Optimization of biocontrol agent Burkholderia pyrrocinia strain JK-SH007 fermentation by response surface methodology[J]. Chinese Journal of Biotechnology, 2013, 29(2): 243-246. (in Chinese) 李浩, 任嘉红, 叶建仁. 响应面法优化生防菌吡咯伯克霍尔德氏菌JK-SH007的发酵工艺[J]. 生物工程学报, 2013, 29(2): 243-246. |
| [20] |
Jiang Y, Huang LL, Chen CQ, et al. Screen, identification and optimized fermentation condition of an actinomycete strain against pathogenic fungus Fulvia fulva[J]. Acta Microbiologica Sinica, 2007, 47(4): 622-627. (in Chinese) 姜云, 黄丽丽, 陈长卿, 等. 一株拮抗番茄叶霉病菌的放线菌筛选、鉴定及发酵条件研究[J]. 微生物学报, 2007, 47(4): 622-627. DOI:10.3321/j.issn:0001-6209.2007.04.011 |
| [21] |
Han YZ, Deng Z, Zhang B, et al. Optimization of fermentation conditions for production of antifungal peptides by Bacillus amyloliquefaciens H15 and comparison of extraction methods for antifugal peptides[J]. Food Science, 2015, 36(15): 135-141. (in Chinese) 韩玉竹, 邓钊, 张宝, 等. 解淀粉芽孢杆菌H15产抗菌肽的发酵条件优化和提取方法比较研究[J]. 食品科学, 2015, 36(15): 135-141. DOI:10.7506/spkx1002-6630-201515025 |
| [22] |
Liu JL, Xue YR, Liu CH. Optimization of shake flask-fermentation conditions for Iturin A production by endophytic Bacillus amyloliquefaciens CC09[J]. Microbiology China, 2014, 41(1): 75-82. (in Chinese) 刘京兰, 薛雅蓉, 刘常宏. 内生解淀粉芽孢杆菌CC09产Iturin A摇瓶发酵条件优化[J]. 微生物学通报, 2014, 41(1): 75-82. |
| [23] |
Zhang JD, Yang Q. Optimization of solid-state fermentation conditions for Trichoderma harzianum using an orthogonal test[J]. Genetics and Molecular Research, 2015, 14(1): 1771-1781. DOI:10.4238/2015.March.13.4 |
| [24] |
Liu J, Li GK, Sui Y. Optimization of culture medium enhances viable biomass production and biocontrol efficacy of the antagonistic yeast, Candida diversa[J]. Frontiers in Microbiology, 2017, 8: 2021. DOI:10.3389/fmicb.2017.02021 |
 2019, Vol. 46
2019, Vol. 46




