扩展功能
文章信息
- 兰鸿珠, 胡文革, 杨扬, 何园, 高岩
- LAN Hong-Zhu, HU Wen-Ge, YANG Yang, HE Yuan, GAO Yan
- 艾比湖湿地盐节木土壤固氮微生物群落结构和丰度的环境异质性特点
- Environmental heterogeneity of the nitrogen-fixing microbial community structure and abundance in the soil surrounding Halocnemum strobilaceum in Ebinur Lake wetland
- 微生物学通报, 2019, 46(7): 1597-1610
- Microbiology China, 2019, 46(7): 1597-1610
- DOI: 10.13344/j.microbiol.china.180131
-
文章历史
- 收稿日期: 2018-02-13
- 接受日期: 2018-05-11
- 网络首发日期: 2018-06-06
氮在生命体内发挥着极大作用,氮是植物生长的必要养分之一且需要量大。固氮作用是指在固氮酶的作用下,氮气被生态环境中的固氮微生物还原成含氮化合物,从而促进各类生物生长,生物固氮产生的含氮化合物约占固氮总量的70%,是最重要的固氮途径[1]。
土壤中天然存在许多固氮微生物,对土壤固氮微生物特性的研究借助分子生物技术能更全面了解。编码固氮酶铁蛋白组分的结构基因nifH是固氮细菌最为保守的功能基因,常用来证明固氮菌的存在[2-5],同时也用以揭示固氮菌群落结构与环境的关系[6]。
目前,据研究显示在不同生境中的nifH基因和固氮微生物的群落结构都存在一定差异[7]。
新疆艾比湖湿地国家自然保护区作为国内最典型的温带干旱区湿地荒漠生态系统[8],对于富集生物多样性、平衡生态环境等方面有重要意义[9]。非豆科植物盐节木(Halocnermum strobilaceum)的耐盐能力使其在荒漠化严重的艾比湖湿地中也能生长较好[10]。目前,关于艾比湖湿地固氮菌的相关研究报道很少[11],关于植物根际与非根际群落区土壤固氮微生物群落结构和丰度的相关研究尚未见相关报道。环境和植物种类是影响根际细菌数量和多样性的2个关键因素[12],采用构建克隆文库和q-PCR的方法,并利用冗余分析法(Redundant analysis,RDA)探究土壤理化性质与固氮微生物群落结构及丰度的相关性,目的在于揭示微生物群落对国内极端干旱区脆弱敏感的艾比湖湿地生态系统循环过程中的作用,为改善荒漠化的艾比湖湿地环境提供理论依据。
1 材料与方法 1.1 样地介绍艾比湖湿地位于新疆博尔塔拉蒙古自治州,自然保护区的范围为44°30′-45°09′N、82°36′-83°50′E,保护区总面积为2 670.85 km2,是我国西部重要的湿地保护区;艾比湖湿地是准噶尔盆地的最低点,是水盐汇集的中心;处在阿拉山口大风通道下,为典型大陆性气候,干燥少雨而多风,四季分明。平均降水量为105.17 mm,水蒸发量为1 315 mm[13],其蒸发量远远大于降水量。由于艾比湖湿地的生态功能和地理环境独特,因此其复杂多样的生境和资源需要通过研究去保护和可持续开采。
1.2 主要试剂和仪器Power Soil DNA Isolation Kit,北京Mo Bio有限公司;pMD19-T载体、HhaⅠ和Hae Ⅲ限制性内切酶,TaKaRa有限公司;SYBR Green Real-Time PCR Master Mix,康为世纪公司。PCR仪,Barloworld Scientific公司。
1.3 样品的采集、处理与保存选取艾比湖湿地盐节木群落区根际和非根际土壤进行采样。盐节木群落区根际和非根际土壤的采样点信息见表 1,在该采样区内随机设置10 m×10 m的样方,每个样方设置5个采样点,每个采样点选取盐节木植株紧附在根系表面的根际土壤(H)。在盐节木植株附近的非根际土壤区,取表层5 cm–20 cm的土壤作为相对的非根际土壤(HN)。将土壤样品混匀过筛后:(1)测定土壤的含水量;(2)测定土壤生物地球化学性质[8];(3)提取土壤总DNA[8]。
| 项目 Items |
信息 Informations |
| 植被类型Vegetation types | 盐节木Halocnemum strobilaceum |
| 土壤类型Soil types | 沙壤土Sandy loam soil |
| 经度Longitude (E) | 82°48′ |
| 纬度Latitude (N) | 44°50′ |
| 海拔Elevation (m) | 186 |
测定了12项物理化学因子指标,有机质(Organic matter,OM)、全氮(Total nitrogen,TN)、电导率(Electric conductivity,EC)、含水量(Soil moisture,SM)、土壤pH、速效氮(Available nitrogen,AN)、硝态氮(NO3--N)、铵态氮(NH4+-N)、全磷(Total phosphorus,TP)、速效磷(Available phosphorus,AP)、全钾(Tota kalium,TK)和速效钾(Available potassium,AK),分析测定采用土壤常规分析方法[14],每个样地样本进行3次重复测定。
1.5 土壤总DNA的提取和固氮nifH的扩增采用PowerSoil DNA Isolation Kit提取艾比湖湿地土壤环境样品总DNA。固氮菌nifH基因的扩增引物参照文献[15],序列为:
nifH-F:5′-AAAGG(C/T)GG(A/T)ATCGG(C/T) AA(A/G)TCCACCAC-3′;
nifH-R:5′-TTGTT(G/C)GC(G/C)GC(A/G)TACAT (G/C)GCCATCAT-3′。
该引物可以从土壤总DNA中扩增到大约460 bp的目的基因片段。PCR反应体系(25 μL):MgCl2 (25 mmol/L) 3 μL,dNTPs (10 mmol/L) 0.5 μL,10×PCR buffer 2.5 μL,上、下游引物(10 μmol/L)各1 μL,Taq DNA聚合酶(5 U/μL) 0.2 μL,补足ddH2O至25 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,60.7 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。经1%琼脂糖电泳,割胶,然后用琼脂糖凝胶DNA回收试剂盒回收PCR扩增产物。
1.6 固氮基因(nifH)克隆文库的构建将nifH目的片段与pMD19-T载体连接48 h后,转入大肠杆菌DH5α感受态细胞进行蓝白斑筛选,挑取白斑克隆子[8]。将每个样品所有的白色单克隆子利用原引物进行阳性克隆鉴定。用HhaⅠ和Hae Ⅲ 2种限制性内切酶对阳性克隆的PCR扩增产物进行酶切分型[8],每个酶切类型随机挑取若干代表菌株送华大基因公司测序。
1.7 荧光定量PCR (q-PCR)固氮菌 nifH基因定量PCR以艾比湖湿地土壤的总DNA为模板,nifH-F和nifH-R为引物,采用实时荧光定量PCR (q-PCR)法测定湿地土壤固氮菌nifH基因拷贝数。
1.7.1 绝对定量标准品的制备选取用nifH-F和nifH-R引物PCR扩增鉴定的阳性克隆,提取质粒供q-PCR反应的标准曲线使用。质粒的浓度用Thermo NanoDrop 2000检测,nifH基因的拷贝数通过质粒的浓度进行计算[16]。按10倍比梯度稀释,以10-1-10-5浓度梯度的标准质粒为模板进行荧光定量PCR扩增,设置蒸馏水为阴性对照。
1.7.2 DNA的定量nifH基因的丰度采用SYBR GreenⅠ方法测定[8]。以nifH-F和nifH-R为引物,在LightCycler 480上对nifH基因进行荧光定量PCR扩增,每个样品3个重复,每组实验设置3个阴性对照,以基线(背景)荧光信号标准差的10倍作为阈值,扩增效率 > 80%,溶解曲线为单一峰[8]。
1.8 数据处理与分析利用DOTUR软件以3%的差异度划分为一个独立操作单元(Operational taxonomic unit,OTU),将代表序列经BLAST比对,使用MEGA 6.0软件以邻接(Neighbor-Joining)法构建系统发育树。测定的序列已提交至GenBank,盐节木根际nifH的登录号为MG923896-923909,非根际nifH的登录号为MG923849-923895。q-PCR反应数据采用罗氏LightCycler 480软件进行处理;利用DOTUR软件计算Chao1指数、Simpson指数、ACE指数和Shannon指数,文库覆盖度C=1-n1/N,其中,N为所分析的克隆总数,n1为仅有一个克隆的操作分类单位数;采用Origin软件绘制Rarefaction曲线。利用Canoco 4.5对固氮菌群落结构和丰度与环境的关联进行冗余分析(RDA)。
2 结果与分析 2.1 艾比湖湿地盐节木根际土壤与非根际土壤的理化性质由表 2可知,盐节木根际与非根际土壤均为pH 8.0以上的碱性土壤;除含水量和pH外,盐节木根际土壤其他理化因子的值均高于非根际土壤;其中两种土壤中的NO3--N和NH4+-N差距最显著。表明在夏季植物生长进行营养物质交换时会导致盐节木根际土壤氮肥水平显著高于非根际土壤;同时盐节木根际与非根际土壤的含水量较低,这可能与湿地逐渐荒漠化、气候环境恶劣及过度开垦农田有关,使艾比湖湿地的含水量逐渐下降,因而低于正常湿地水平。
| 理化因子 Physical and chemical properties |
土壤类型Soil types | |
| 根际H | 非根际HN | |
| pH | 8.53 | 9.46 |
| 含水量SM (%) | 2.97 | 5.56 |
| 有机质OM (g/kg) | 5.77 | 5.13 |
| 电导率EC (mS/cm) | 9.18 | 5.01 |
| 总氮TN (g/kg) | 0.62 | 0.55 |
| 速效氮AN (mg/kg) | 28.83 | 23.51 |
| 总磷TP (g/kg) | 0.76 | 0.51 |
| 速效磷AP (mg/kg) | 26.39 | 20.51 |
| 总钾TK (g/kg) | 7.37 | 6.59 |
| 速效钾AK (mg/kg) | 284.65 | 269.27 |
| 硝态氮NO3--N (mg/kg) | 3.11 | 0.92 |
| 铵态氮NH4+-N (mg/kg) | 7.33 | 5.25 |
通过文库覆盖度、Shannon指数、ACE指数、Chao1指数和丰富度来评估nifH基因文库的多样性。由表 3可知,盐节木非根际土壤 nifH基因文库的Shannon指数、ACE指数、Chao1指数、丰富度均高于根际土壤,盐节木根际土壤(H)和非根际土壤(HN)的文库覆盖度分别达到89.47%和73.83%。结合图 1可知,所得固氮微生物种群信息较好地代表了真实环境中固氮微生物的多样性。
| 测定项目Measuring items | 土壤类型Soil types | |
| 根际H | 非根际HN | |
| 克隆数Number of clone | 299 | 295 |
| 序列数Sequence number | 91 | 105 |
| 丰富度Rechness | 14 | 47 |
| Shannon指数Shannon index | 1.82 | 3.56 |
| ACE指数ACE index | 41.84 | 102.78 |
| Simpson指数Simpson index | 0.23 | 0.02 |
| Chao1指数Chao1 index | 61.00 | 91.00 |
| 覆盖度Coverage (%) | 89.47 | 73.83 |

|
| 图 1 盐节木根际和非根际土壤nifH基因文库的稀疏曲线 Figure 1 Rarefaction curves of nifH clone library in rhizosphere and non-rhizosphere of Halocnemum strobilaceum |
|
|
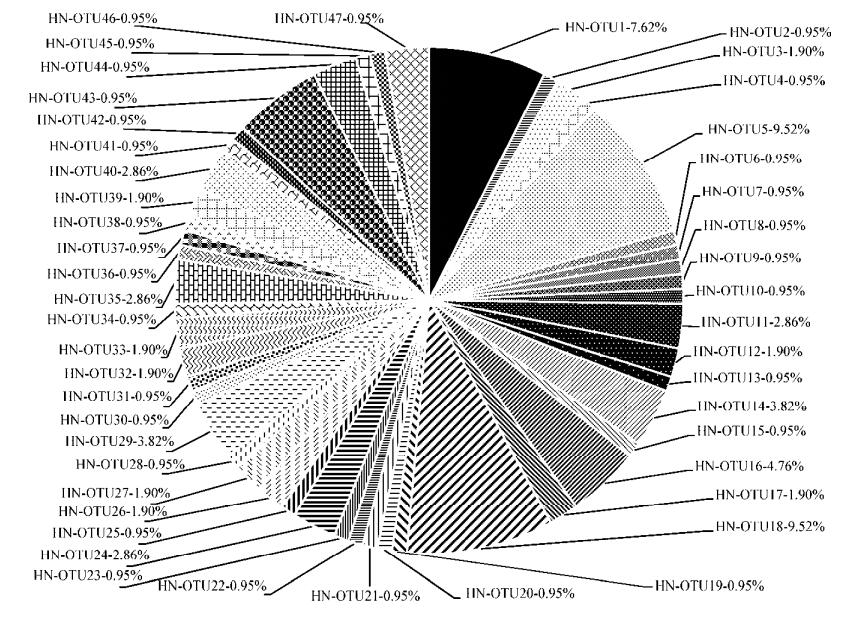
盐节木根际和盐节木非根际土壤固氮菌nifH克隆文库划分的OTU见图 2、3。由图 2可知,盐节木根际土壤固氮菌nifH克隆文库共划分为14个OTU,其中OTU1占盐节木根际文库序列的40.66%;OTU13占盐节木根际文库序列的25.26%;OTU12占盐节木根际文库序列的15.38%;为盐节木根际土壤中nifH克隆文库的优势菌群,文库中其他OTU所占比例相对较少(1.11%-4.40%)。由图 3可知,盐节木非根际土壤固氮菌nifH克隆文库共划分为47个OTU,其中OTU5占整个文库序列的9.52%;OTU18占整个文库序列的9.52%、OTU1占整个文库序列的7.62%;为nifH基因的较优势菌群。文库中其他OTU所占比例相对较少为0.95%-4.76%。对比盐节木根际和盐节木非根际土壤固氮菌群落结构发现,盐节木根际土壤优势固氮菌的OTU与该文库中其他OTU相比占比相差较大,而盐节木非根际土壤优势固氮菌OTU与该文库中其他OTU相比占比相对均匀。

|
| 图 2 根际固氮菌克隆文库群落组成图 Figure 2 The community structure of nitrogen-fixing bacteria in rhizosphere soil |
|
|
|
| 图 3 非根际固氮菌克隆文库群落组成图 Figure 3 The community structure of nitrogen-fixing bacteria in non-rhizosphere soil |
|
|
盐节木根际土壤固氮菌系统发育树见图 4。所有序列共划分为6个簇,ClusterⅠ中OTU5、OTU6、OTU8与日本明治大学在芒属植物虫草的根际以及中国甘肃农业大学在海拔高的草地中提取的菌株相似性为80%-83%,从属于固氮菌属(Azotobacter);ClusterⅡ中OTU7和俄罗斯微生物研究所在一种新型的碱性紫硫细菌内得到的序列相似性为79%,从属于外硫红螺菌(Ectothiorhodospira);ClusterⅢ中OTU9、OTU10与在美国苏打湖内提取的地杆菌(Geoalkalibacter)可以分为一种,相似性为79%、81%;ClusterⅣ中OTU1、OTU2和美国威斯康辛大学从田菁草内、德国马尔堡陆地微生物研究所在嗜甲烷细菌得到的序列与固氮根瘤菌(Azorhizobium)可以分为一种,相似性为85%、86%;ClusterⅤ中OTU3、OTU4与俄国微生物学研究所在水藓泥炭沼泽得到的序列相似性为84%、87%,从属于固氮螺菌属(Azospirillum);ClusterⅥ中OTU11-14和美国北卡罗来纳大学海洋科学研究所在潮间带微生物席内得到序列归为脱硫弧菌属(Desulfomicrobium)的相似性为80%-83%。

|
| 图 4 盐节木根际土壤nifH克隆文库系统发育树 Figure 4 Phylogenetic tree of nifH clone library in rhizosphere soil of Halocnemum strobilaceum 注:系统发育树通过Phylip-3.68软件采用邻接法构建,所有的参考序列均来自于GenBank,分支上的数值表示经1 000次计算后的置信度值,文库中的根际序列用H标注. Note: Phylogenetic tree was constructed using the Neighbor-Joining method through the program Phylip-3.68. Reference sequence was chosen from GenBank database. Numbers at branching points refer to bootstrap values after 1 000 times calculation. H represent rhizosphere nifH clone sequences in the library. |
|
|
盐节木非根际土壤固氮菌系统发育树见图 5。所有序列可以分为6个簇,ClusterⅠ中OTU18-23、OTU26、OTU31-33和高雄海洋科技大学在被石油污染的土壤内提取出来的固氮菌、德国普朗克微生物研究所、中国台湾农业与自然资源学院直接提交的已知菌株序列相似性为78%-82%,从属于固氮弧菌属(Azoarcus);ClusterⅡ中根际OTU 27、OTU34和日本明治大学在芒属植物虫草的根际以及中国甘肃农业大学在海拔高的草地中提取的菌株相似性为80%、83%,从属于固氮菌属(Azotobacter);ClusterⅢ中OTU24-25、OTU28-30和俄罗斯微生物研究所在一种新型的碱性紫硫细菌得到的序列相似性为82%-86%,从属于外硫红螺菌属(Ectothiorhodospira);ClusterⅣ中OTU17和中国台湾农业及自然资源学院直接提交的已知菌株 Skermanella aerolata序列相似性为96%,OTU14-16和日本大坂大学在沼泽红假单胞菌、巴西农业研究公司在甘蔗中生菌、中国西北大学在大豆根瘤中提取的菌株相似性为86%-88%,从属于慢生根瘤菌属(Bradyrhizobium);ClusterⅤ中OTU1-13、OTU46-47、OTU35和日本大坂大学国际生物中心直接提交的、中国森林生态研究所在西藏三江源高原地区获得的、美国洛斯阿拉莫斯国家大学生物科学部从在研究氮肥施用量对土壤的影响时获得的固氮菌序列、中国清华大学化学工程学系在中原油田内得到的序列可以分成一种,属于太阳杆菌属(Heliobacterium modesticaldum),相似性为76%-88%;ClusterⅥ中OTU36-45和美国北卡罗来纳大学海洋科学研究所在潮间带微生物席中得到的序列可以归属为脱硫弧菌属(Desulfomicrobium),相似性为76%-82%。

|
| 图 5 盐节木非根际土壤nifH克隆文库系统发育树 Figure 5 Phylogenetic tree of nifH clone library in non-rhizosphere soil of Halocnemum strobilaceum 注:系统发育树通过Phylip-3.68软件采用邻位法构建,所有的参考序列均来自于GenBank,分支上的数值表示经1 000次计算后的置信度值,文库中的非根际序列用HN标注. Note: Phylogenetic tree was constructed using the Neighbor-Joining method through the program Phylip-3.68. Reference sequence was chosen from GenBank database. Numbers at branching points refer to bootstrap values after 1 000 times calculation. HN represent non-rhizosphere nifH clone sequences in the library. |
|
|
盐节木根际土壤nifH序列的优势种属是脱硫弧菌属(Desulfovibrio)及固氮根瘤菌属(Azorhizobium);非根际土壤nifH序列的优势种属是太阳杆菌属(Heliobacterium modesticaldum)、脱硫弧菌属(Desulfovibrio)、固氮弧菌属(Azoarcus)[33]。
2.3 盐节木根际和非根际土壤固氮菌nifH的丰度利用实时荧光定量PCR (q-PCR)技术对盐节木根际与非根际土壤中的nifH进行定量分析,盐节木根际土壤中nifH拷贝数为4.08×104 copies/g、盐节木非根际土壤中nifH拷贝数为5.52×103 copies/g (图 6)。由此可见,盐节木根际土壤中固氮菌nifH的丰度与盐节木非根际土壤中固氮菌nifH的丰度相比较高。

|
| 图 6 盐节木根际和非根际土壤中nifH的基因数量 Figure 6 Abundance of nifH in the rhizosphere and non-rhizosphere of Halocnemum strobilaceum |
|
|
对盐节木根际和非根际土壤固氮菌的群落结构、丰度与盐节木土壤环境因子的相关性进行RDA法分析,如图 7所示,盐节木根际土壤(H)的PC1横轴解释了总变异的99%,PC2纵轴解释了总变异的1%。NO3--N、AN与根际nifH的优势类群ClusterⅣ、ClusterⅥ和丰度呈显著的正相关,而pH与其均呈现显著的负相关。在盐节木非根际土壤(HN)中PC1横轴解释了总变异的93%,PC2纵轴解释了总变异的7%。结果显示,TP、AN、TN、TK、NO3--N均与非根际nifH优势类群ClusterⅠ、ClusterⅤ、ClusterⅥ和丰度呈显著的正相关。

|
| 图 7 土壤理化因子与根际(A)、非根际(B)土壤固氮菌类群之间的冗余分析 Figure 7 The analysis of RDA among physicochemical properties and group, abundance of nitrogen-fixing bacteria in rhizosphere (A) and non-rhizosphere (B) soil 注:实心原点代表不同的固氮菌类群,黑色箭头表示不同的理化因子. Note: Black cycles are the different nitrogen-fixing, black arrows are hysicochemical properties, H, HN represent rhizosphere and non-rhizosphere soil of Halocnemum strobilaceum in Ebinur Lake wetland. |
|
|
固氮酶nifH基因是固氮酶中最保守的基因,常用于了解固氮微生物的物种和分布,除少数如rDNA有几个拷贝外,原核生物基因绝大多数都是单拷贝[17],所以用荧光定量PCR对氮循环功能基因拷贝数的定量,也可反映出氮循环微生物的数量,基因拷贝数越高则对应的微生物数量越大,相应的作用也越强[18]。本文通过构建基因克隆文库和实时荧光定量PCR (q-PCR)的方法,系统地反映出在盐节木群落区不同土壤环境固氮菌的分布情况。由表 3可知固氮菌功能基因nifH在盐节木根际土壤中的多样性小于非根际土壤。
盐节木根际土壤中优势种属固氮根瘤菌属(Azorhizobium)与美国威斯康辛大学从豆科植物得到的为同一种,是一种严格好氧并在微好氧条件下也能固氮的固氮菌属,其菌株能在田菁(Sesbania rostrata)的根和茎上生瘤,而且能以硝酸盐、氨和氨基酸作氮源,广泛分布于土壤中。
盐节木非根际土壤中优势种属有太阳杆菌属(Heliobacterium modesticaldum)和固氮弧菌属。太阳杆菌属是一种革兰氏阳性的固氮光养菌,它可以通过光合异养或化学营养的方式生长,但不通过光合作用生长;固氮弧菌属(Azoarcus)是一种严格的需氧代谢型和微需氧固氮的固氮菌属,在含有机酸的盐渍土壤中生长较好。脱硫弧菌属(Desulfovibrio)是盐节木根际和非根际土壤所共有的主要优势种属,属于化能有机营养型或混合营养型,细胞内含c型或b型细胞色素,通过呼吸的方式获取能量,脱硫弧菌属主要存在于淡水、淡咸水或海水下的污泥及沉积物中。湿地上游的农业生产、生活废物及工业产生的废水、废渣、废料大量注入艾比湖,引起脱硫弧菌属的大量发现。
影响土壤固氮微生物群落结构以及多样性的因素包括植被[19]、土地利用、养分[20]、温度和pH[21-22]等,其中植被可以提供土壤微生物生存繁殖所必需的有机营养物和能量,对土壤微生物的长期生存环境有重大的影响[23]。盐节木是最耐盐的肉质小半灌木,根系具有特别耐盐的特性,因此更适宜在碱性环境下生存,植物根系可以分泌为微生物提供足够能源的物质,主要包括糖、有机酸、胞外酶等物质[24],这可能是导致在盐节木群落区根际土壤中nifH基因丰度高于非根际土壤的原因。相关研究显示凋落物的分解会对植物非根际微生物的数量和种类产生影响,主要为非根际土壤中的营养物质和元素的循环利用等诸多方面[25]。而盐节木群落区的非根际土壤中有多种动植物残体、动物粪便及盐节木植物凋落物等;且非根际土壤中的固氮微生物营养方式多为异养,可以分解利用土壤中的凋落物等,因此与根际土壤中的nifH基因多样性相比,非根际土壤nifH基因的多样性较为丰富。在根际和非根际土壤中的nifH序列比对中,与已知序列的相似性在75%-89%,我们推测盐节木根际和非根际土壤中可能蕴含着丰富的未知固氮菌资源。
3.2 固氮微生物群落结构多样性和丰度在盐节木根际和非根际中的环境异质性特点土壤理化结果显示,盐节木区的含水量显著低于2016年平均水平,pH值则高于2016年平均水平。盐节木根际土壤与非根际土壤中的营养成分存在一定差异,例如盐节木根际土壤的pH值显著低于非根际土壤,而其他理化因子的含量均高于非根际土壤。这可能与盐节木植物养分的吸收、根系分泌物释放及根际微生物代谢活动等多过程同时发生有关[26]。由此推断,pH值的差异会影响到nifH基因的种类多样性。生态环境中多数微生物的最适生长pH值为6.5-7.5,过碱的环境会阻碍多数微生物的生长,只有那些耐碱性的微生物才能在此环境下生长。本研究中盐节木群落区根际和非根际土壤都为偏碱性土壤(pH > 8.0),说明2个样地的固氮菌皆为耐碱性固氮微生物。研究中盐节木根际土壤基因文库OTU共16个,非根际土壤基因文库的OTU有49个,说明在碱性更大的非根际土壤中会有更多种类的耐碱性固氮微生物生长。对比盐节木根际土壤和非根际土壤的群落结构发现,根际土壤优势固氮菌的OTU与该文库中其他OTU相比占比相差较大,范围在1.11%-40.66%;而非根际优势固氮菌的OTU与文库中其他OTU相比占比相对均匀,范围在0.95%-9.52%,相差较小。分析原因可能是pH对其产生影响,例如在根际土壤中OTU1 (40.66%)隶属固氮根瘤菌属,据大多数研究报道固氮根瘤菌pH值在7.5-9.0生长情况较好,符合本文根际土壤中固氮根瘤菌的生长环境。说明pH值对根际土壤OTU分布影响较大,而对非根际土壤中OTU的分布影响较小。
对比土壤中NH4+-N和NO3--N的含量,根际土壤明显高于非根际土壤,表明盐节木根际土壤的微环境在氮肥力水平上要优于非根际土壤。根际丰富的有机质矿化后将为微生物提供各种不同的代谢底物,也会刺激各种微生物的生长[27]。由相关性分析得出,NO3--N和NH4+-N与根际土壤的丰度显著正相关,这也是根际土壤丰度大于非根际土壤的原因。
本研究根际土壤中,优势类群ClusterⅣ中固氮根瘤菌属(Azorhizobium)与NO3--N和AN等成显著正相关,且AN > NO3--N > TK > AK > NH4+-N > TN > TP。据相关研究显示在种植红花的稻田土壤中施用氮肥、钾肥、磷肥会显著促进固氮根瘤菌的生长[28]。也说明了氮肥、钾肥、磷肥会促进该属菌的生长。
在非根际土壤中优势类群ClusterⅠ中,固氮弧菌属(Azoarcus)属于严格的需氧代谢型,能在微需氧的情况下进行固氮,在含有机酸的盐渍土壤中生长较好[29]。据研究表明,固氮弧菌属最适生长温度范围在35-40 ℃,最适pH值为7.0,最适盐度范围为0.5%-166%[30],而艾比湖湿地夏季高温和土壤高盐度生长环境也符合固氮弧菌属生长所需。在本研究中,通过RDA冗余分析得知NO3--N与固氮弧菌属呈显著的正相关,说明NO3--N会促进固氮弧菌属的生长,研究中还发现AN、TP、TK、TN同样也会促进固氮弧菌属的生长。在优势类群ClusterⅤ中,太阳杆菌属(Heliobacterium modesticaldum)是一种嗜热型光合细菌,能够在极端环境下生存,最适生长环境的pH为6.0-7.0,温度为52 ℃。研究证明了Heliobacterium modesticaldum在光合作用和化学营养生长过程中都有固氮作用,同时是一种固氮能力强的细菌,可能与水稻等植物共生组合在一起[31]。对比从青藏高原三江源自然保护区得到的序列(AY601051.1),该序列与TN、TK、TP均成正相关,与pH成负相关[32],这也与本研究得到的结论相似。而本研究中pH值对优势类群无影响,同时证明太阳杆菌属(Heliobacterium modesticaldum)在碱性环境下也可以生存,并且TN、TK、TP、NO3--N、AN也会显著影响太阳杆菌属(Heliobacterium modesticaldum)的生长。
根际和非根际土壤共有的优势类群脱硫弧菌属(Desulfovibrio)能进行反硫化作用,它在厌氧条件下将硫酸盐还原为H2S。H2S能够与重金属离子发生沉淀反应,且沉淀物不易溶解。此方法能与多种重金属种类反应且价格低廉,对环境也不会造成二次污染。因此脱硫弧菌属的大量发现对维护艾比湖湿地环境具有极大的意义。据报道外加氮源的含量会增加脱硫弧菌的转化效率[33],本研究中NO3--N、AN、TN、NH4+-N的含量与脱硫弧菌属的生长均成正相关,也说明了氮会促进脱硫弧菌的生长。
4 结论(1) 艾比湖湿地优势植物群落盐节木根际土壤的根际nifH序列优势种属主要为固氮根瘤菌属(Azorhizobium)和脱硫弧菌属(Desulfovibrio),非根际土壤的根际nifH序列优势种属主要是固氮弧菌属(Azoarcus)、太阳杆菌属(Heliobacterium modesticaldum)和脱硫弧菌属(Desulfovibrio)。
(2) 艾比湖湿地盐节木的非根际土壤群落多样性高于根际土壤,根际土壤中固氮菌nifH的丰度则高于非根际土壤。
(3) 艾比湖湿地盐节木根际和非根际土壤的优势固氮微生物固氮根瘤菌属(Azorhizobium)、太阳杆菌属(Heliobacterium modesticaldum)、固氮弧菌属(Azoarcus)、脱硫弧菌属(Desulfovibrio)的nifH群落结构和丰度与NO3--N、AN、TN、TP等环境因子显著相关。
| [1] |
Zhang QL, Lin M, Ping SZ. Biological nitrogen fixation and its application in sustainable agriculture[J]. Biotechnology Bulletin, 2008(2): 1-4. (in Chinese) 张秋磊, 林敏, 平淑珍. 生物固氮及在可持续农业中的应用[J]. 生物技术通报, 2008(2): 1-4. |
| [2] |
Terakado-Tonooka J, Ohwaki Y, Yamakawa H, et al. Expressed nifH genes of endophytic bacteria detected in field-grown sweet potatoes (Ipomoea batatas L.)[J]. Microbes and Environments, 2008, 23(1): 89-93. DOI:10.1264/jsme2.23.89 |
| [3] |
Tan ZY, Peng GX, Xu PZ, et al. Diversity and high nitrogenase activity of endophytic diazotrophs from Oryza rufipogon[J]. Chinese Science Bulletin, 2009, 54(13): 1885-1893. (in Chinese) 谭志远, 彭桂香, 徐培智, 等. 普通野生稻(Oryza rufipogon)内生固氮菌多样性及高固氮酶活性[J]. 科学通报, 2009, 54(13): 1885-1893. |
| [4] |
Wendu RL, Li G, Yang DL, et al. nifH gene diversity and community structure of soil nitrogen-fixing bacteria in Hulunbeier grassland, Inner Mongolia[J]. Chinese Journal of Ecology, 2011, 30(4): 790-797. (in Chinese) 文都日乐, 李刚, 杨殿林, 等. 呼伦贝尔草原土壤固氮微生物nifH基因多样性与群落结构[J]. 生态学杂志, 2011, 30(4): 790-797. |
| [5] |
Mirza BC, Potisap C, Nüsslein K, et al. Response of free-living nitrogen-fixing microorganisms to land use change in the Amazon rainforest[J]. Applied and Environmental Microbiology, 2014, 80(1): 281-288. DOI:10.1128/AEM.02362-13 |
| [6] |
Kang WL, Tai XS, Li SW, et al. Research on the number of nitrogen-fixing microorganism and community structure of nitrogen-fixing (nifH) genes in the alkali soils of alpine steppe in the Qilian Mountains[J]. Journal of Glaciology and Geocryology, 2013, 35(1): 208-216. (in Chinese) 康文龙, 台喜生, 李师翁, 等. 祁连山高寒草原碱性土壤固氮微生物数量及固氮基因(nifH)群落结构研究[J]. 冰川冻土, 2013, 35(1): 208-216. |
| [7] |
Zehr JP, Jenkins BD, Short SM, et al. Nitrogenase gene diversity and microbial community structure: a cross-system comparison[J]. Environmental Microbiology, 2003, 5(7): 539-554. DOI:10.1046/j.1462-2920.2003.00451.x |
| [8] |
He Y, Hu WG, Ma DC, et al. Diversity and abundance of ammonia-oxidizing microorganisms in relation to soil environment in rhizosphere soil of Halocnemum strobilaceum in Ebinur Lake wetland[J]. Acta Scientiae Circumstantiae, 2017, 37(5): 1967-1975. (in Chinese) 何园, 胡文革, 马得草, 等. 艾比湖湿地盐节木根际土壤氨氧化微生物多样性和丰度及其与环境因子的相关性分析[J]. 环境科学学报, 2017, 37(5): 1967-1975. |
| [9] |
Leng ZX, Ge LM, Nurbey, et al. The evaluation on Aiby lake wetland and its restoration[J]. Journal of XinJiang Normal University (Natural Science Edition), 2006, 25(2): 64-67. (in Chinese) 冷中笑, 格丽玛, 努尔巴依, 等. 新疆艾比湖湿地评价及生态恢复对策的研究[J]. 新疆师范大学学报:自然科学版, 2006, 25(2): 64-67. |
| [10] |
Qu XX, Huang ZY, Baskin JM, et al. Effect of temperature, light and salinity on seed germination and radicle growth of the geographically widespread halophyte shrub Halocnemum strobilaceum[J]. Annals of Botany, 2008, 101(2): 293-299. |
| [11] |
Yang D, Hu WG, Chen DW, et al. Correlation analysis between nitrogen-fixing bacteria number and organic matter, microbial biomass C, N in different soil depth and seasons of Ebinur Lake wetland[J]. Southwest China Journal of Agricultural Sciences, 2013, 26(6): 2417-2421. (in Chinese) 杨迪, 胡文革, 陈登稳, 等. 艾比湖湿地固氮菌数量与有机碳、微生物生物量C、N在时空分布上的相关性研究[J]. 西南农业学报, 2013, 26(6): 2417-2421. |
| [12] |
Garbeva P, van Elsas JD, van Veen JA. Rhizosphere microbial community and its response to plant species and soil history[J]. Plant and Soil, 2008, 302(1/2): 19-32. |
| [13] |
Xie H, Yu ET, Kong QY, et al. Study on the halophytes in Aibi Lake wetland nature reserve[J]. Journal of Arid Land Resources and Environment, 2009, 23(3): 176-180. (in Chinese) 谢辉, 于恩涛, 孔琼英, 等. 艾比湖湿地盐生植物区系研究[J]. 干旱区资源与环境, 2009, 23(3): 176-180. |
| [14] |
Lu RK. Methods of Soil and Agro-Chemical Analysis[M]. Beijing: China Agricultural Science and Technology Press, 2000. (in Chinese) 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. |
| [15] |
Rösch C, Mergel A, Bothe H. Biodiversity of denitrifying and dinitrogen-fixing bacteria in an acid forest soil[J]. Applied and Environmental Microbiology, 2002, 68(8): 3818-3829. DOI:10.1128/AEM.68.8.3818-3829.2002 |
| [16] |
Okano Y, Hristova KR, Leutenegger CM, et al. Application of real-time PCR to study effects of ammonium on population size of ammonia-oxidizing bacteria in soil[J]. Applied and Environmental Microbiology, 2004, 70(2): 1008-1016. DOI:10.1128/AEM.70.2.1008-1016.2004 |
| [17] |
Dick LK, Field KG. Rapid estimation of numbers of fecal Bacteroidetes by use of a quantitative PCR assay for 16S rRNA genes[J]. Applied and Environmental Microbiology, 2004, 70(9): 5695-5697. DOI:10.1128/AEM.70.9.5695-5697.2004 |
| [18] |
Shu T. Study on the community structure and abundance of functional bacteria involved in nitrogen cycling of the rhizosphere in emergent plants[D]. Wuhan: Master's Thesis of Central China Normal University, 2015 (in Chinese) 舒潼.挺水植物根际细菌群落结构及氮循环相关功能细菌丰度研究[D].武汉: 华中师范大学硕士学位论文, 2015 |
| [19] |
Zhang YG, Wang HM, Li DQ, et al. The community and structure of nitrogen-fixing microorganism in Sanjiangyuan Natural Reserve[J]. Acta Microbiologica Sinica, 2005, 45(3): 420-425. (in Chinese) 张于光, 王慧敏, 李迪强, 等. 三江源地区不同植被土壤固氮微生物的群落结构研究[J]. 微生物学报, 2005, 45(3): 420-425. DOI:10.3321/j.issn:0001-6209.2005.03.022 |
| [20] |
Li G, Wang LJ, Li YJ, et al. Effects of different vegetation restoration patterns on the diversity of soil nitrogen-fixing microbes in Hulunbeier sandy land, Inner Mongolia of North China[J]. Chinese Journal of Applied Ecology, 2013, 24(6): 1639-1646. (in Chinese) 李刚, 王丽娟, 李玉洁, 等. 呼伦贝尔沙地不同植被恢复模式对土壤固氮微生物多样性的影响[J]. 应用生态学报, 2013, 24(6): 1639-1646. |
| [21] |
Yang QB. The effect of pH and combined nitrogen factors on alfalfa bunching and nitrogen fixation[D]. Harbin: Master's Thesis of Northeast Agricultural University, 2007 (in Chinese) 杨琼博. pH值和化合态氮对紫花苜蓿结瘤和固氮效果的影响[D].哈尔滨: 东北农业大学硕士学位论文, 2007 |
| [22] |
Xing YX. Isolation and identification of endophytic nitrogen fixation in sugarcane and growth characteristics[D]. Nanning: Master's Thesis of Guangxi University, 2006 (in Chinese) 邢永秀.甘蔗内生固氮细菌的分离、鉴定和生长特性[D].南宁: 广西大学硕士学位论文, 2006 |
| [23] |
Shen QL, He DH, Xu QF, et al. Variation of nifH gene diversity of soil nitrogen-fixing bacteria in Moso bamboo (Phyllostachys pubescens) plantation converted from broadleaf forest[J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(3): 687-696. (in Chinese) 沈秋兰, 何冬华, 徐秋芳, 等. 阔叶林改种毛竹(Phyllostachys pubescens)后土壤固氮细菌nifH基因多样性的变化[J]. 植物营养与肥料学报, 2016, 22(3): 687-696. |
| [24] |
Zhang F, Shen J, Li L, et al. An overview of rhizosphere processes related with plant nutrition in major cropping systems in China[J]. Plant and Soil, 2004, 260(1/2): 89-99. DOI:10.1023/B:PLSO.0000030192.15621.20 |
| [25] |
Zhao H, Zhao MQ, Cheng YY, et al. Change of different soil types on microorganisms and enzyme activity of the rhizosphere and non-rhizosphere of Nanyang tobacco growing area in Henan province[J]. Chinese Journal of Soil Science, 2010, 41(5): 1057-1563. (in Chinese) 赵辉, 赵铭钦, 程玉渊, 等. 河南南阳烟区不同类型土壤的根际和非根际微生物及酶活性变化[J]. 土壤通报, 2010, 41(5): 1057-1563. |
| [26] |
Neumann G, Romheld V. Root-induced changes in the availability of nutrients in the rhizosphere[J]. ChemInform, 2003, 34(4): 617-649. |
| [27] |
Chen XP, Zhu YG, Xia Y, et al. Ammonia-oxidizing archaea: important players in paddy rhizosphere soil?[J]. Environmental Microbiology, 2008, 10(8): 1978-1987. DOI:10.1111/emi.2008.10.issue-8 |
| [28] |
Liu YB, Wang RF. Effect of NPK on clover nitrogen-fixing rhizobia growth and soil fertility after plantation[J]. Chinese Agricultural Science Bulletin, 2015, 31(36): 220-225. (in Chinese) 刘亚柏, 王润芳. 氮磷钾对红花草固氮根瘤菌生长及种植后土壤肥力的影响[J]. 中国农学通报, 2015, 31(36): 220-225. DOI:10.11924/j.issn.1000-6850.casb15090098 |
| [29] |
Xu TS. Research advance in endophytic diazotroph[J]. Journal of Anhui Agricultural Sciences, 2008, 36(12): 4828-4830. (in Chinese) 许褆森. 内生固氮菌研究进展[J]. 安徽农业科学, 2008, 36(12): 4828-4830. DOI:10.3969/j.issn.0517-6611.2008.12.012 |
| [30] |
Chen MH, Sheu SY, James EK, et al. Azoarcus olearius sp. nov., a nitrogen-fixing bacterium isolated from oil-contaminated soil[J]. International Journal of Systematic Evolutionary Microbiology, 2013, 63: 3755-3761. DOI:10.1099/ijs.0.050609-0 |
| [31] |
Tang KH, Yue H, Blankenship RE. Energy metabolism of Heliobacterium modesticaldum during phototrophic and chemotrophic growth[J]. BMC Microbiology, 2010, 10: 150. DOI:10.1186/1471-2180-10-150 |
| [32] |
Zhang YG, Li DQ, Wang HM, et al. Molecular diversity of nitrogen-fixing bacteria from the Tibetan Plateau, China[J]. FEMS Microbiology Letters, 2006, 260(2): 134-142. DOI:10.1111/fml.2006.260.issue-2 |
| [33] |
Xie BK, Zhang Y, Wang XW, et al. Performance and Influencing factors of dissimilatory nitrate reduction to ammonium process by the strain Desulfovibrio sp. CMX[J]. Environmental Science, 2016, 37(10): 3955-3962. (in Chinese) 谢柄柯, 张玉, 王晓伟, 等. 菌株Desulfovibrio sp. CMX的DNRA性能和影响因素[J]. 环境科学, 2016, 37(10): 3955-3962. |
 2019, Vol. 46
2019, Vol. 46




